ZYTIGA 500 mg film kaplı tablet (60 film kaplı tablet) Farmakolojik Özellikler
{ Abirateron }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Endokrin tedavisi, diğer hormon antagonistleri ve ilişkili ajanlar
ATC kodu: L02BX03
Etki mekanizması
Abirateron asetat (ZYTIGA) in vivo olarak bir androjen biyosentez inhibitörü olan abiraterona dönüşür. Spesifik olarak abirateron 17α-hidroksilaz/C17,20-liyaz (CYP17) enzimini seçici olarak inhibe eder. Bu enzim testiküler, adrenal ve prostatik tümör dokularında eksprese olur ve androjenin biyosentezi için gereklidir. CYP17, sırasıyla 17α-hidroksilasyon ve C17,20 bağının kırılmasıyla pregnenolon ve progesteronun testesteron prekürsörleri olan DHEA ve androstenediona dönüşümünü katalize eder. CYP17 inhibisyonu aynı zamanda adrenaller tarafından mineralokortikoid üretiminde artışa da yol açar (bkz. Bölüm 4.4).
Androjene duyarlı prostat karsinomu, androjen düzeylerini azaltan tedaviye yanıt verir. LHRH agonistleri ya da orşiektomi gibi androjen azaltıcı tedaviler, testislerdeki androjen üretimini azaltmalarına rağmen, adrenaller ya da tümördeki androjen üretimini etkilemezler. LHRH agonistleri (ya da orşiektomi) ile birlikte ZYTIGA tedavisi uygulandığında serum testesteron düzeyleri (ticari testlerle ölçüldüğünde) saptanamayan düzeylere düşer.
Farmakodinamik etkiler
ZYTIGA, serum testesteron ve diğer androjen seviyelerini, tek başına LHRH agonistleri ya da orşiektomi ile elde edilen seviyelerin altına düşürür. Bu, androjen biyosentezi için gerekli olan CYP17 enziminin selektif olarak inhibe edilmesinin bir sonucudur. Prostat spesifik antijen (PSA) prostat kanserli hastalarda bir biyogösterge olarak kullanılır. Daha önce taksanlarla yapılan kemoterapiden fayda görmeyen hastalarda gerçekleştirilen bir Faz 3 klinik çalışmada, abirateron asetat ile tedavi edilen hastaların % 38'inde başlangıç PSA değerlerine göre en az % 50 azalma sağlanabilmişken, bu azalma oranı plasebo ile tedavi edilenlerin % 10'unda sağlanabilmiştir.
Klinik etkililik ve güvenlilik
ZYTIGA'nın etkililik metastatik hormona duyarlı prostat kanseri (mHDPK) ve metastatik kastrasyona dirençli prostat kanseri (mKDPK)'li hastalarda gerçekleştirilen plasebo kontrollü çok merkezli randomize üç Faz 3 çalışmasında (Çalışma 3011, 302 ve 301) gösterilmiştir. Çalışma 3011'e, yüksek riskli prognostik faktörlere sahip yeni tanı almış (randomizasyonun 3 ayı içerisinde) mHDPK'li hastalar dahil edilmiştir. Yüksek riskli prognoz aşağıdaki 3 risk faktöründen en az 2'sine sahip olmak olarak tanımlanmıştır: (1) Gleason skorunın ≥8 olması; (2) kemik taramasında 3 veya daha fazla lezyon olması; (3) ölçülebilir visseral (lenf nodu hastalığı hariç) metastaz olması. Aktif tedavi kolunda, standart tedavi olan ADT'ye (LHRH agonisti veya orşiektomi) ilave olarak, ZYTIGA günde 1000 mg dozunda, günde tek doz 5 mg düşük doz prednizon ile kombine olarak uygulandı. Kontrol kolundaki hastalara ZYTIGA ve prednizon yerine ADT ve plasebo verildi Çalışma 301'e daha önceden dosetaksel almış hastalar, çalışma 302'ye ise daha önce dosetaksel kullanmamış hastalar dahil edilmişir. Hastalar bir LHRH agonisti kullanıyorlardı ya da daha önce orşiektomi olmuşlardı. Aktif tedavi kolunda, ZYTIGA, günde iki defa 5 mg düşük doz prednizon veya prednizolonla kombine olarak günde 1.000 mg dozunda uygulanmıştır. Kontrol hastaları plasebo ve günde iki defa 5 mg düşük doz prednizon veya prednizolon almıştır.
Serum PSA konsantrasyonlarındaki değişiklikler bağımsız olarak her zaman klinik faydayı göstermeyebilir. Bu nedenle, tüm çalışmalarda hastaların her bir çalışma için aşağıda belirtildiği şekilde tedavi kesilme kriterlerini karşılamalarına kadar tedaviye devam etmeleri önerilir.
Spironolakton androjen reseptörüne bağlandığından ve PSA seviyelerini artırabileceğinden, tüm
çalışmalarda spironolakton kullanımına izin verilmedi.
Çalışma 3011 (yeni tanı almış yüksek riskli mHDPK hastaları)
Çalışma 3011'e (n=1199) dahil edilen hastaların medyan yaşı 67 idi. ZYTIGA ile tedavi edilen hastaların 832'si (% 69,4) beyaz ırka mensup, 246'sı (% 20,5) sarı ırktan, 25'i (% 2,1) Siyahi veya Afro Amerikan, 80'i (% 6,7) diğer, 13'ü (% 1,1) bilinmiyen/raporlanmamış ve 3'ü (% 0,3) Amerikan yerlisi veya Alaska yerlisi ırklara mensuptu. Hastaların % 97'si için ECOG performans statüsü 0 veya 1 idi. Bilinen beyin metastazı, kontrol altına alınamayan hipertansiyonu, anlamlı kalp hastalığı olan veya NYHA Sınıf II-IV kalp yetmezliği olan hastalar çalışmaya alınmamıştır. Metastatik hastalıktan kaynaklanan semptomların tedavisi için 3 aya kadar ADT veya 1kür palyatif radyasyon veya operasyon tedavisi alan hastalar haricinde daha önce farmakoterapi, radyasyon terapisi veya metastatik prostat kanseri operasyonu geçirerek tedavi edilen hastalar çalışmaya alınmamıştır. Ortak primer etkililik sonlanım noktaları genel sağkalım (OS) ve radyografik progresyonsuz sağkalım (rPFS) idi. Kısa Ağrı Envanteri Kısa Form (BPI-SF) ile ölçülen medyan başlangıç ağrı skoru hem tedavi kolunda hem de Plasebo gruplarında 2,0 idi. Ortak primer sonlanım noktaları ölçümlerine ilave olarak; iskeletle ilişkili olaya (SRE) kadar olan süre, prostat kanseri için müteakip tedaviye kadar geçen süre, kemoterapi başlangıcına kadar geçen süre, ağrı progresyonuna kadar geçen süre ve PSA progresyonuna kadar geçen süre kullanılarak tedavi faydası da değerlendirildi. Tedavi hastalık progresyonuna, onamın geri çekilmesine, kabul edilemez toksisiteye veya ölüme kadar devam etti.
Radyografik progresyonsuz sağkalım, randomizasyondan radyografik progresyonun görülmesine veya herhangi bir nedene bağlı ölüme kadar geçen süre olarak tanımlandı. Radyografik progresyon, kemik taramasıyla progresyonu (modifiye PCWG2'ye göre) veya BT veya MRG ile yumuşak doku lezyonlarındaki progresyonu (RECIST 1.1'e göre) kapsıyordu.
Tedavi grupları arasında rPFS bakımından anlamlı bir farklılık gözlendi (bkz. Tablo 1 ve Şekil 1).
Tablo 1: Radyografik Progresyonsuz Sağkalım - Katmanlı Analiz; Intent-to-treat Popülasyonu (çalışma PCR3011) | ||
| AA-P | Plasebo |
Randomize hastalar | 597 | 602 |
Olay | 239 (% 40,0) | 354 (% 58,8) |
Sansürlendi | 358 (% 60,0) | 248 (% 41,2) |
Olaya Kadar Geçen Süre (ay) |
|
|
Medyan (% 95 GA) | 33,02 (29,57, NE) |
14,78 (14,69, 18,27) |
Aralık | (0,0+, 41.0+) | (0,0+, 40,6+) |
p değeri | < 0,0001 |
|
Risk oranı (% 95 GA) | 0,466 (0,394, 0,550) |
|
Not: += sansürlenmiş gözlem, NE=Değerlendirilebilir değil. rPFS olayını tanımlamada radyografik progresyon ve ölüm dikkate alınmıştır. AA-P= abirateron asetat ve prednizolon alan hastalar.
![]()
Şekil 1: Radyografik Progresyonsuz Sağkalıma ilişkin Kaplan-Meier Grafiği; Intent-to-treat
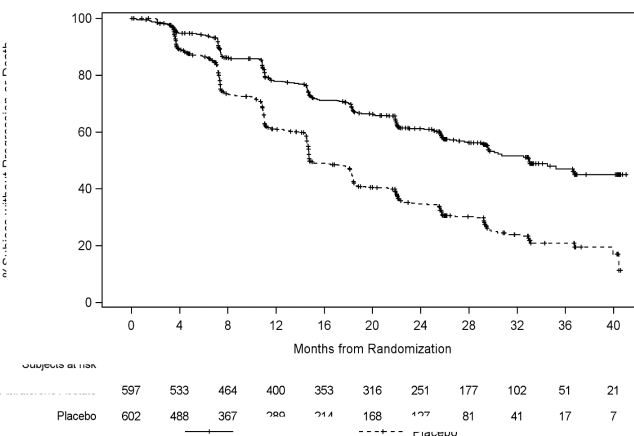
Popülasyonu (Çalışma PCR3011)
Riskteki denekler Abirateron asetatat
Plasebo
Progresyon veya ölüm olmaksızın % gönüllüler
Randomizasyondan sonraki zaman, ay
Abirateron asetatat Plasebo
Plasebo artı ADT ile karşılaştırıldığında ölüm riskinde % 34 azalma ile OS'de AA-P artı ADT lehine istatistiksel olarak anlamlı bir iyileşme gözlemlendi (HR=0,66; % 95 CI: 0,56, 0,78; p<0,0001, (bkz. Tablo 2 ve Şekil 2).
Tablo 2: PCR3011 çalışmasında ZYTIGA veya Plasebo ile Tedavi Edilen Hastaların Genel Sağkalımı (Intent-to-treat Analiz) | ||
Genel Sağkalım | ZYTIGA ve Prednizon (N=597) |
Plasebo (N=602) |
Ölüm (%) | 275 (% 46) | 343 (% 57) |
Medyan sağkalım (aylar) | 53,3 | 36,5 |
(% 95 CI) | 48,2, NE | 33,5, 40,0 |
Risk oranı (% 95 CI) | 0,66 (0,56, 0,78) | |
NE= Değerlendirilebilir değil
Risk oranı tabakalandırılmış orantısal riskler modelinden hesaplanmıştır. Risk oranı ï¼1 ZYTIGA ve prednizon lehine
![]()
Şekil 2: Genel Sağkalıma ilişkin Kaplan-Meier Grafiği; Intent-to-treat Popülasyon
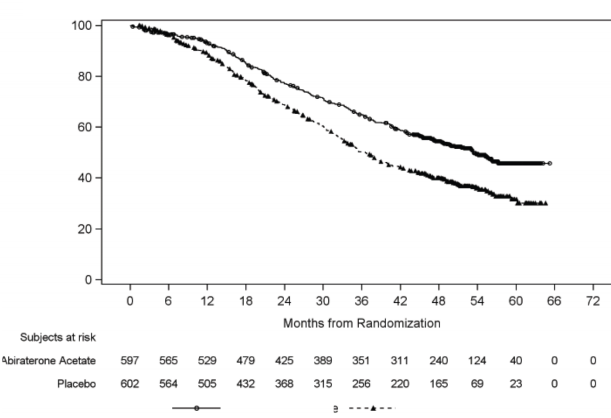
Riskteki gönüllüler Abirateron asetatat
Plasebo
Abirateron asetatat
Plasebo
Randomizasyondan sonraki zaman, ay
Ölüm olmaksızın % sağkalan gönüllüler
Analizi (çalışma PCR3011)
![]()
Plasebo
Alt grup analizleri tutarlı olarak ZYTIGA tedavisi lehine sonuçlanmaktadır. Önceden belirlenmiş alt gruplarda AA-P'nin rPFS ve OS üzerindeki tedavi etkisi, fayda gözlenmesi yönünde hiçbir eğilimin görülmediği ECOG skoru 2 olan alt grup hariç, genel çalışma popülasyonunda daha üstün ve tutarlı olmuştur, ancak örneklem büyüklüğünün küçük olması (n=40) anlamlı bir sonuç çıkarılmasını kısıtlamaktadır.
Genel sağkalım ve rPFS'de gözlenen artışlara ilave olarak, prospektif olarak tanımlanan tüm sekonder sonlanım noktaları için plasebo karşısında ZYTIGA lehine faydalar gösterilmiştir.
Çalışma 302 (daha önce kemoterapi almamış hastalar)
Bu çalışmaya asemptomatik veya hafif düzeyde semptomatik olan ve henüz klinik olarak kemoterapi endikasyonu bulunmayan kemoterapi almamış hastalar dahil edilmiştir. Kısa Ağrı Envanteri - Kısa Formunun (BPI-SF) âson 24 saat içindeki en kötü ağrıâ maddesinin skorunun 0- 1 olması asemptomatik, puanın 2-3 olması ise hafif semptomatik olarak değerlendirildi.
Çalışma 302'de (n = 1088) yer alan hastaların medyan yaşı ZYTIGA ile birlikte prednizon veya prednizolon alan hastalar için 71, plasebo ile birlikte prednizon veya prednizolon alan hastalar için 70 idi. ZYTIGA ile tedavi edilen hastaların ırklarına göre dağılımı şöyleydi: 520 (% 95,4) beyaz ırktan 15 (% 2,8) siyah ırk, 4 (% 0,7) sarı ırktan ve 6 (% 1,1) diğer. Doğu Ortak Onkoloji Grubu (ECOG) performans statüsü, her iki koldaki hastaların % 76'sı için 0 ve % 24'ü için 1 idi. Hastaların % 50'si yalnızca kemik metastazlarına, % 31'i kemik ve yumuşak doku veya lenf nodu
metastazlarına ve % 19'u yalnızca yumuşak doku veya lenf nodu metastazlarına sahipti. Visseral metastazı olan hastalar çalışmaya alınmamamıştır. Ortak birincil etkililik sonlanım noktaları genel sağkalım ve radyografik progresyonsuz sağkalım (rPFS) idi. Ortak primer sonlanım noktaları ölçümlerine ilave olarak; kanser ağrısı için opiat kullanımına kadar geçen süre, sitotoksik kemoterapi başlangıcına kadar geçen süre, ECOG performans skorunda ≥ 1 puanlık kötüleşmeye kadar geçen süre ve Prostat Kanseri Çalışma Grubu 2 (PCWG2) kriterlerine göre PSA progresyonuna kadar geçen süre kullanılarak tedavi faydası da değerlendirildi. Bariz klinik progresyon durumunda çalışma tedavilerine son verildi. Araştırmacı kararıyla, doğrulanmış radyografik progresyon süresinde de tedavi kesilebilecekti.
Radyografik progresyonsuz sağkalım (rPFS) PCWG2 kriterlerinde (kemik lezyonları için) tanımlanan seri görüntüleme çalışmalarına ve değiştirilen Solid Tümörlerde Yanıt Değerlendirme Kriterleri'nin (RECIST) kullanımı ile (yumuşak doku lezyonları için) değerlendirildi. rPFS analizinde, radyografik progresyon değerlendirmesi merkezi inceleme ile yapılmıştır.
Planlı rPFS analizi 401 olayı kapsamış, ZYTIGA ile tedavi edilen hastaların 150'si (% 28) ve plasebo ile tedavi edilen hastaların 251'i (% 46) ya radyografik progresyon göstermiş ya da ölmüştür. Tedavi grupları arasında rPFS bakımından anlamlı bir farklılık gözlendi (bkz. Tablo 3 ve Şekil 3).
Tablo 3: Çalışma 302: ZYTIGA veya plasebo ile birlikte prednizolon ve LHRH agonistleri ya da öncesinde orşiektomi olan hastalardaki radyolografik progresyonsuz sağkalım | ||
| ZYTIGA (N = 546) | Plasebo (N = 542) |
Radyografik Progresyonsuz Sağkalım (rPFS) |
|
|
Progresyon veya ölüm | 150 (% 28) | 251 (% 46) |
Medyan rPFS (ay) (% 95 GA) | Ulaşılmadı (11,66; NE) | 8,3 (8,12; 8,54) |
p-değeri* | < 0,0001 | |
Risk oranı** (% 95 GA) | 0,425 (0,347; 0,522) | |
NE = Değerlendirilebilir değil
* p-değeri, başlangıçtaki ECOG skoruna (0 veya 1) göre tabakalandırılmış bir log-rank testinden hesaplanmıştır.
** Risk oranı < 1 ZYTIGA lehine
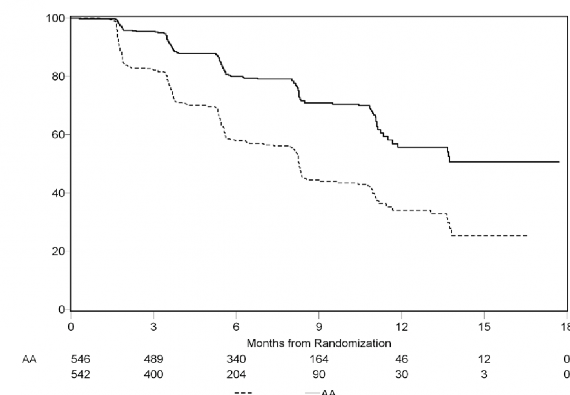
Randomizasyondan sonraki zaman, ay
Plasebo
Plasebo
Progresyon veya ölüm olmaksızın % gönüllüler
Şekil 3: ZYTIGA veya plasebo ile birlikte prednizolon ve LHRH agonistleri ya da öncesinde orşiektomi olan hastalardaki radyografik progresyonsuz sağkalımın Kaplan Meier grafiği
Ancak, Genel Sağkalıma (OS) ilişkin ikinci ara analiz tarihine kadar hasta verisi toplanmaya devam edilmiştir. Araştırmacının rPFS üzerinde bir takip duyarlılık analizi olarak yaptığı radyografik inceleme Tablo 4 ve Şekil 4'te sunulmuştur.
271'i (% 50) abirateron asetat grubundan, 336'sı (% 62) plasebo grubundan olmak üzere toplam altı yüz yedi (607) hasta radyografik progresyon göstermiş veya ölmüştür. Abirateron asetat ile tedavi, plaseboya kıyasla radyografik progresyon veya ölüm riskini % 47'ye kadar azaltmıştır (HR = 0,530; % 95 CI: [0,451; 0,623], p < 0,0001). Medyan rPFS, abirateron asetat grubunda 16,5 ay, plasebo grubunda ise 8,3 ay olmuştur.
Tablo 4: Çalışma 302: ZYTIGA veya plasebo ile birlikte prednizolon ve LHRH agonistleri ya da öncesinde orşiektomi olmuş hastalardaki radyografik progresyonsuz sağkalım (İkinci ara analizindeki OS - Araştırıcı İncelemesi) | ||
| ZYTIGA (N = 546) | Plasebo (N = 542) |
Radyografik Progresyonsuz Sağkalım (rPFS) |
|
|
Progresyon veya ölüm | 271 (% 50) | 336 (% 62) |
Medyan rPFS (ay) (% 95 GA) | 16,5 (13,80; 16,79) | 8,3 (8,05; 9,43) |
p-değeri* | < 0,0001 | |
Risk oranı** (% 95 GA) | 0,530 (0,451; 0.623) |
* p-değeri, başlangıçtaki ECOG skoruna (0 veya 1) göre tabakalandırılmış bir log-rank testinden türetilmiştir. ** Risk oranı < 1 ZYTIGA lehine | |
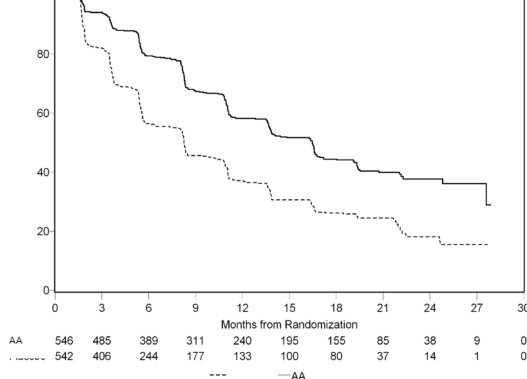
Randomizasyondan sonraki zaman, ay
Plasebo
Plasebo
Progresyon veya ölüm olmaksızın % gönüllüler
Şekil 4: ZYTIGA veya plasebo ile birlikte prednizolon ve LHRH agonistleri ya da öncesinde orşiektomi olmuş hastalardaki radyografik progresyonsuz sağkalımın Kaplan Meier grafiği (İkinci ara analizindeki OS - Araştırıcı İncelemesi)
333 ölüm gözlendikten sonra, OS için planlı bir ara analiz (IA) yapıldı. Gözlenen klinik faydanın büyüklüğü dikkate alınarak çalışmanın körlüğü kaldırıldı ve plasebo grubundaki hastalara ZYTIGA ile tedavi olmaları teklif edildi. ZYTIGA ölüm riskini % 25 azaltarak plaseboya kıyasla daha uzun bir genel sağkalım sağladı (HR = 0,752; % 95 CI: [0,606; 0,934], p = 0,0097), ancak OS olgunlaşmamıştı ve ara sonuçlar istatistiksel anlamlılık için önceden belirlenmiş durdurma sınırını karşılamıyordu (bkz. Tablo 4). Bu ara analiz sonrasında, sağkalım takibine devam edildi. OS için planlanan nihai analiz 741 ölüm gözlendikten sonra yapıldı (medyan takip süresi 49 ay). ZYTIGA ile tedavi edilen hastaların % 65'inin (354/546), plasebo ile tedavi edilen hastaların ise
% 71'inin (387/542) öldüğü saptandı. Ölüm riskinde % 19,4'lük bir azalma ile, OS bakımından ZYTIGA ile tedavi edilen grup lehine istatistiksel olarak anlamlı bir fayda (HR = 0,806; % 95 CI: [0,697; 0,931], p = 0,0033) ve 4,4 aylık medyan OS artışı sağlanmıştır (ZYTIGA 34,7 ay, plasebo 30,3 ay) (bkz. Tablo 5 ve Şekil 5). Bu iyileşme, plasebo kolundaki hastaların % 44'ü müteakip tedavi olarak ZYTIGA almış olmalarına rağmen gösterilmiştir.
Tablo 5: Çalışma 302: ZYTIGA veya plasebo ile birlikte prednizolon ve LHRH agonistleri ya da öncesinde orşiektomi olmuş hastalardaki genel sağkalım | ||
| ZYTIGA (N = 546) | Plasebo (N = 542) |
Ara sağkalım analizi |
|
|
Ölümler (%) | 147 (% 27) | 186 (% 34) |
Medyan sağkalım (ay) (% 95 GA) | Ulaşılmadı (NE; NE) | 27.2 (25,95; NE) |
p-değeri* | 0,0097 | |
Risk oranı** (% 95 GA) | 0,752 (0,606; 0,934) | |
Nihai sağkalım analizi |
| |
Ölüm Vakaları | 354 (% 65) | 387 (% 71) |
Medyan genel sağkalım (ay, % 95 GA)] | 34,7 (32,7; 36,8) | 30,3 (28,7; 33,3) |
p-değeri* | 0,0033 | |
Risk oranı** (% 95 GA) | 0,806 (0,697; 0,931) | |
NE = Değerlendirilebilir değil
* p-değeri, başlangıçtaki ECOG skoruna (0 veya 1) göre tabakalandırılmış bir log-rank testinden türetilmiştir.
** Risk oranı < 1 ZYTIGA lehine
Şekil 5: ZYTIGA veya plasebo ile birlikte prednizolon ve LHRH agonistleri ya da
öncesinde orşiektomi olmuş hastalardaki genel sağkalımın Kaplan Meier grafiği
Randomizasyondan sonraki zaman, ay
Plasebo
Plasebo
Ölüm olmaksızın % gönüllüler
- nihai analiz
Genel sağkalım ve rPFS'de gözlenen artışlara ilave olarak, tüm sekonder sonlanım noktaları için
plasebo tedavisi karşısında ZYTIGA için aşağıdaki faydalar gösterilmiştir:
PCWG2 kriterlerine göre PSA progresyonuna kadar geçen süre: PSA progresyonuna kadar geçen medyan süre ZYTIGA alan hastalar için 11,1 ay, plasebo alan hastalar için ise 5,6 ay olmuştur (HR = 0,488; % 95 CI: [0,420; 0,568], p < 0,0001). PSA progresyonuna kadar geçen süre ZYTIGA tedavisi ile yaklaşık iki katına çıkmıştır (HR = 0,488). Doğrulanmış PSA yanıtına sahip olan hastaların oranı ZYTIGA grubunda, plasebo grubuna oranla daha fazla olmuştur (% 24 karşısında % 62, p=0,0001). Yumuşak doku hastalığı ölçülebilir olan hastalarda, ZYTIGA ile anlamlı düzeyde artmış tam ve kısmi yanıt oranları görülmüştür.
Kanser ağrısı için opiat kullanımına kadar geçen süre: Nihai analiz sırasında, prostat kanseri ağrısı için opiat kullanımına kadar geçen medyan süre ZYTIGA alan hastalar için 33,4 ay, plasebo alan hastalar için 23,4 ay olmuştur; (HR = 0,721; % 95 CI: [0,614; 0,846], p < 0,0001).
Sitotoksik kemoterapi başlangıcına kadar geçen süre: Sitotoksik kemoterapi başlangıcına kadar geçen medyan süre ZYTIGA alan hastalar için 25,2 ay, plasebo alan hastalar için 16,8 ay olmuştur (HR = 0,580; % 95 CI: [0,487; 0,691], p < 0,0001).
ECOG performans skorunda ≥ 1 puan gerilemeye kadar geçen süre: ECOG performans skorunda
≥ 1 puan gerilemeye kadar geçen medyan süre ZYTIGA alan hastalar için 12,3 ay, plasebo alan hastalar için 10,9 ay olmuştur (HR = 0,821; % 95 CI: [0,714; 0,943], p = 0,0053).
Aşağıdaki çalışma sonlanım noktaları ZYTIGA tedavisi lehine istatistiksel olarak anlamlı bir
avantaj göstermiştir:
Objektif yanıt: Objektif yanıt, RECIST kriterlerine göre ölçülebilir hastalığa sahip olup tam veya kısmi yanıt elde eden hastaların oranı olarak tanımlanmıştır (hedef lezyon olarak değerlendirilebilmesi için başlangıçtaki lenf nodu büyüklüğünün ≥ 2 cm olması gerekmiştir). Başlangıçta ölçülebilir hastalığı olup objektif yanıt elde eden hastaların oranı ZYTIGA grubunda
% 36, plasebo grubunda ise % 16 olmuştur (p < 0,0001).
Ağrı: ZYTIGA tedavisi, plasebo ile karşılaştırıldığında, ortalama ağrı şiddeti progresyonu riskini anlamlı şekilde % 18'e kadar azaltmıştır (p = 0,0490). Progresyona kadar geçen medyan süre ZYTIGA grubunda 26,7 ay, plasebo grubunda ise 18,4 ay olmuştur.
FACT-P (Toplam Skor) kötüleşmesine kadar geçen süre: ZYTIGA tedavisi, plasebo ile karşılaştırıldığında, FACT-P (Toplam Skor) anketindeki kötüleşme riskini anlamlı şekilde % 22'ye kadar azaltmıştır (p = 0,0028). FACT-P (Toplam Skor) kötüleşmesine kadar geçen medyan süre ZYTIGA grubunda 12,7 ay, plasebo grubunda ise 8,3 ay olmuştur.
Çalışma 301 (daha önce kemoterapi almış olan hastalar)
Çalışma 301'e daha önceden dosetaksel kullanmış olan hastalar dahil edilmiştir. Bu kemoterapiden kaynaklanan toksisite tedavinin kesilmesine neden olmuş olabileceği için, hastaların dosetaksel tedavisi sırasında hastalık ilerlemesi göstermiş olması gerekmemiştir. Hastalar protokole tanımlanan radyografik ilerleme ve semptomatik ya da klinik ilerleme ile birlikte PSA ilerlemesi oluncaya kadar (hastanın başlangıç/en düşük düzeyine göre doğrulanmış % 25 artış) hastalar çalışma tedavilerine devam etmiştir. Daha önceden prostat kanseri için ketokonazol tedavisi gören hastalar bu çalışmaya alınmamıştır. Primer etkililik sonlanım noktası genel sağkalım olmuştur.
Çalışmaya alınan hastaların medyan yaşı 69 idi (aralık 39 - 95). ZYTIGA ile tedavi edilen hastaların ırklarına göre dağılımı şöyleydi: 737'si (% 93,2) beyaz ırktan, 28'i (% 3,5) siyah ırktan, 11'i (% 1,4) sarı ırktan ve geri kalan 14'ü (% 1,8) ise diğer ırklardandı. Çalışmaya alınan hastaların yüzde on birinin ECOG performans skoru 2 idi; % 70'i için PSA ilerlemesi olsun ya da olmasın, hastalık ilerlemesine dair radyografik kanıtlar mevcuttu; % 70'i daha önce bir sitotoksik kemoterapi, % 30'u ise iki sitotoksik kemoterapi almıştı. ZYTIGA ile tedavi edilen hastaların % 11'inde karaciğer metastazı vardı.
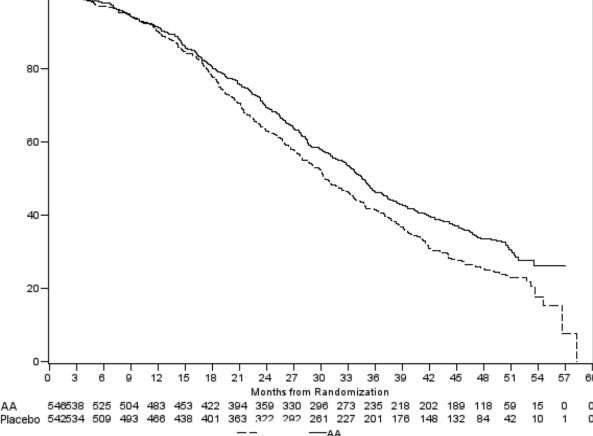
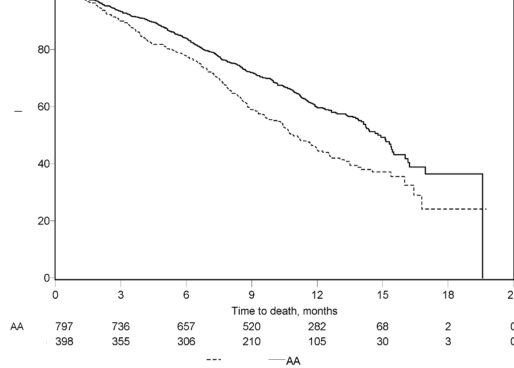
552 ölüm gözlendikten sonra yapılan planlı bir analizde, ZYTIGA ile tedavi edilen hastaların % 42'sinin (333/797), plasebo ile tedavi edilen hastaların ise % 55'inin (398 hastanın 219'u) öldüğü saptandı. ZYTIGA ile tedavi edilen hastaların medyan genel sağkalımda istatistiksel olarak anlamlı bir artış görüldü (bkz. Tablo 6).
Tablo 6: ZYTIGA veya plasebo ile birlikte prednizolon ve LHRH agonistleri ya da öncesinde orşiektomi olmuş hastalardaki genel sağkalım | ||
| ZYTIGA | Plasebo |
| (N=797) | (N=398) |
Primer Sağkalım Analizi |
|
|
Ölümler (%) | 333 (% 42) | 219 (% 55) |
Medyan genel sağkalım (ay) | 14,8 (14,1; 15,4) | 10,9 (10,2; 12,0) |
(% 95 GA) |
|
|
p-değeri | < 0,0001 | |
Risk oranı (% 95 GA) | 0,646 (0,543; 0,768) | |
Güncel Sağkalım Analizi |
|
|
Ölümler (%) | 501 (% 63) | 274 (% 69) |
Medyan genel sağkalım (ay) | 15,8 (14,8; 17,0) | 11,2 (10,4; 13,1) |
(% 95 GA) |
|
|
Risk oranı (% 95 GA) | 0,740 (0,638; 0,859) | |
Tedavinin başlangıçtaki ilk birkaç ayından sonra tüm değerlendirme zaman noktalarında, plasebo ile tedavi edilenlerin oranıyla karşılaştırıldığında, daha yüksek oranda ZYTIGA ile tedavi edilen hasta hayatta kalmıştır (bkz. Şekil 6).
Şekil 6: ZYTIGA veya plasebo ile birlikte prednizolon ve LHRH agonistleri ya da
öncesinde orşiektomi olmuş hastalardaki Kaplan Meier sağkalım grafiği
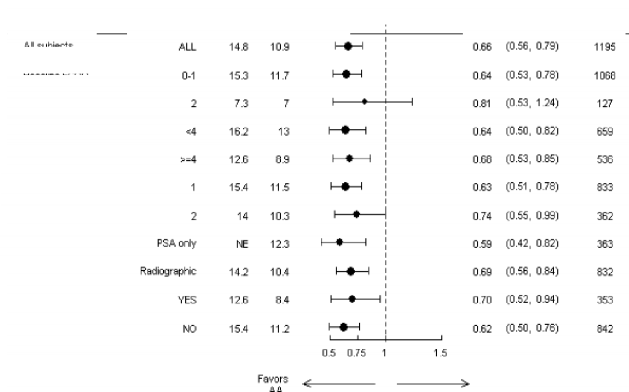
Altgrup sağkalım analizleri ZYTIGA tedavisi için tutarlı bir sağkalım faydası gösterdi (bkz. Şekil
7).
Değişken
Alt Grup
HR %95 GA
N
Tüm gönüllüler
Başlangıç ECOG
Başlangıç BPI
Daha önceki kemo
rejimlerinin sayısı
Progresyon türü
Girişte viskeral hastalık
Plasebo Lehine
Radyografi
Sadece PSA
AA Lehine
Şekil 7: Alt gruplara göre genel sağkalım: risk oranı ve % 95'lik güven aralığı
AA=ZYTIGA; BPI=Kısa ağrı envanteri; GA=Güven aralığı; ECOG=doğu kooperatif onkoloji grubu (eastern cooperative oncology grup) performans skoru; HR=Tehlike oranı; NE=Değerlendirilebilir değil
Genel sağkalımda gözlenen artışa ek olarak, tüm ikincil çalışma sonlanım noktaları ZYTIGA lehine idi ve aşağıda gösterildiği şekilde bu farklılıklar birden fazla test için ayarlandıktan sonra istatistiksel olarak anlamlı idi:
ZYTIGA alan hastalarda, plasebo alan hastalara göre anlamlı düzeylerde daha yüksek toplam PSA yanıt oranı (başlangıç değerinden ≥% 50 azalma olarak tanımlanmış) elde edildi, ZYTIGA ile % 38 iken, plaseboyla % 10, p < 0,0001.
ZYTIGA ile tedavi edilen hastalarda, PSA ilerlemesine kadar olan medyan süre 10,2 ay iken, bu süre plasebo ile tedavi edilen hastalarda 6,6 ay idi (HR=0,580; % 95 CI: [0,462; 0,728], p < 0,0001).
ZYTIGA ile tedavi edilen hastalarda medyan radyografik progresyonsuz sağkalım 5,6 ay iken, bu süre plasebo alan hastalarda 3,6 ay idi (HR=0,673; % 95 CI: [0,585; 0,776], p < 0,0001).
Ağrı
Ağrısında hafifleme olan hastaların oranı ZYTIGA grubunda, plasebo grubuna oranla istatistiksel olarak anlamlı derecede daha fazlaydı (% 44'e karşı % 27, p=0,0002). Bir hastada dört hafta arayla yapılan iki ardışık değerlendirmede 24 saatlik bir sürede analjezik kullanım skorunda herhangi bir artış olmaksızın BPI-SF en kötü ağrı yoğunluğu skorunda başlangıca göre en az % 30 azalma sağlanması ağrı hafiflemesi yanıtı olarak tanımlandı. Ağrı palyasyonu için yalnızca başlangıç ağrı skoru ≥ 4 olan hastalar ve en az bir başlangıç-sonrası ağrı skoru analiz edildi (N=512).
ZYTIGA ile tedavi edilen hastalarda, plasebo ile tedavi edilenlere oranla daha düşük oranda ağrı
ilerlemesi görüldü: 6. ayda abirateron asetat tedavisi alanların % 22'sine karşılık plasebo alanların
% 28'i, 12. ayda abirateron asetat tedavisi alanların % 30'una karşılık plasebo alanların % 38'i ve
18. ayda abirateron asetat tedavisi alanların % 35'ine karşılık plasebo alanların % 46'sında ağrıda ilerleme vardı. Ağrının hafiflemesi yanıtı, iki ardışık değerlendirmede son 24 saatlik bir sürede analjezik kullanım skorunda herhangi bir azalma olmaksızın BPI-SF en kötü ağrı yoğunluğu skorunda başlangıca göre % 30 veya daha fazla bir artış ya da iki ardışık değerlendirmede analjezik kullanım skorunda % 30 veya daha fazla bir artış olarak tanımlandı. 25. persentilde ağrı ilerlemesine kadar geçen süre ZYTIGA grubunda 7,4 ay iken, plasebo grubunda 4,7 ay idi.
İskelet sistemiyle ilişkili olaylar
5.2. Farmakokinetik özellikler
Genel özellikler
Abirateron asetat uygulamasından sonra, abirateronun farmakokinetiği sağlıklı gönüllülerde, ilerlemiş metastatik prostat kanserli hastalarda ve kanser hastası olmayan karaciğer veya böbrek yetmezliği olan gönüllülerde çalışılmıştır. Abirateron asetat in vivo olarak hızla bir androjen biyosentez inhibitörü olan abiraterona dönüşür (bkz. Bölüm 5.1).
Emilim:
Abirateron asetat açlık durumunda oral yoldan uygulandıktan sonra, yaklaşık 2 saatte maksimum
plazma abirateron konsantrasyonlarına ulaşılır.
Abirateron asetatın yemekle birlikte alınması, yemeğin yağ içeriğine bağlı olarak, açlık durumunda uygulanmasına oranla 10 kata kadar (EAA açısından) ve 17 kata kadar (Caçısından) daha fazla ortalama sistemik abirateron maruziyetine yol açar. Yemeklerin içerik ve bileşimindeki normal farklılıklar göz önüne alındığında, ZYTIGA'nın yemeklerle birlikte alınması oldukça değişken maruziyetine yol açma olasılığına sahiptir. Bu nedenle, ZYTIGA yemekle birlikte alınmamalıdır. ZYTIGA tabletleri günde bir kez tek doz olarak aç karna alınmalıdır. ZYTIGA, yemek yedikten en az iki saat sonra alınmalıdır ya da ZYTIGA aldıktan sonra en az 1 saat yemek yenmemelidir. Tabletler bütün olarak suyla yutulmalıdır (bkz. Bölüm 4.2).
Dağılım:
İnsan plazmasında C-abirateronun proteine bağlanma oranı % 99,8'dir. Görünür dağılım hacmi yaklaşık 5.63 litre olup, abirateronun periferik dokulara yoğun bir şekilde dağıldığını gösterir.
Biyotransformasyon:
Eliminasyon:
Sağlıklı gönüllülerden elde edilen verilere göre, plazmadaki abirateronun ortalama yarılanma ömrü yaklaşık 15 saattir. 1.000 mg C-abirateron asetatın oral yoldan alınmasından sonra radyoaktif dozun yaklaşık % 88'i feçeste ve yaklaşık % 5'i idrarda görülür. Feçeste bulunan majör bileşikler değişmemiş abirateron asetat ve abiraterondur (sırasıyla uygulanan dozun yaklaşık % 55 ve % 22'si).
Hastalardaki karakteristik özellikler
Karaciğer yetmezliği:
Abirateron asetatın farmakokinetiği hafif ya da orta şiddette karaciğer yetmezliği olan hastalar (sırasıyla Child-Pugh Sınıf A ve B) ile ve sağlıklı kontrollerde çalışılmıştır. 1.000 mg'lık tek bir oral doz sonrası abiraterona sistemik maruziyet hafif ve orta şiddette daha önceden karaciğer yetmezliği olan hastalarda sırasıyla yaklaşık % 11 ve % 260 oranında artmaktadır. Abirateronun ortalama yarılanma ömrü hafif karaciğer yetmezliği olan hastalarda yaklaşık 18 saate ve orta şiddette karaciğer yetmezliği olan hastalarda yaklaşık 19 saate uzamaktadır.
Bir başka çalışmada, abirateronun farmakokinetiği daha önceden ciddi karaciğer yetmezliği (Child-Pugh Sınıf C) olan (n=8) ve normal hepatik fonksiyona sahip 8 sağlıklı birey üzerinde incelenmiştir. Abirateronun sistemik etkisi (EAA) yaklaşık % 600 oranında yükselmiş ve serbest ilacın fraksiyonu şiddetli karaciğer yetmezliği olanlarda normal hepatik fonksiyonu olanlara göre
% 80 artmıştır.
Daha önceden hafif karaciğer yetmezliği olan hastalarda doz ayarlamasına gerek yoktur. Abirateron asetat kullanımı faydanın olası riskten açıkça ağır bastığı, orta şiddette karaciğer yetmezliğine sahip hastalarda dikkatle değerlendirilmelidir (bkz. Bölüm 4.2 ve 4.4). Abirateron asetat ağır karaciğer yetmezliği olan hastalarda kullanılmamalıdır (bkz. Bölüm 4.2, 4.3 ve 4.4).
ZYTIGA tedavi sırasında hepatotoksisite gelişen hastalarda, tedavinin durdurulması ve doz
ayarlaması gerekebilir (bkz. Bölüm 4.2 ve 4.4).
Böbrek yetmezliği:
Stabil bir hemodiyaliz programında olan son dönem böbrek yetmezliği olan hastalar ile normal böbrek fonksiyonları olan eşlenmiş kontrol hastalarında abirateron asetatın farmakokinetiği karşılaştırılmıştır. Diyaliz programında olan son dönem böbrek yetmezliği olan hastalarda
1.000 mg'lık tek bir oral doz sonrası abiraterona sistemik maruziyet artmamıştır. Ağır böbrek yetmezliği dahil, böbrek yetmezliği olan hastalarda ZYTIGA uygulanması sırasında dozu azaltmaya gerek yoktur (bkz. Bölüm 4.2). Ancak prostat kanseri ve ağır böbrek yetmezliği olan hastalarla ilgili klinik deneyim bulunmamaktadır. Bu tür hastalarda dikkatli olunması tavsiye edilir.
5.3. Klinik öncesi güvenlilik verileri
Tüm hayvan toksisite çalışmalarında, dolaşımdaki testesteron düzeyleri anlamlı derecelerde azalmıştır. Sonuç olarak üreme organlarıyla adrenal, hipofiz ve meme bezlerinin organ ağırlıklarında azalma ile morfolojik ve/veya histopatolojik değişiklikler gözlenmiştir. Tüm değişiklikler tamamen ya da kısmen geri döndürülebilirlik göstermiştir. Üreme organları ve androjene duyarlı organlardaki değişiklikler abirateronun farmakolojisiyle uyumludur. Tedaviyle ilişkili tüm hormonal değişiklikler eski haline dönmüştür veya 4 haftalık bir toparlanma dönemi sonunda geri düzeldiği gösterilmiştir.
Hem erkek hem de dişi sıçanlarda yapılan fertilite çalışmalarında, abirateron asetat fertiliteyi azaltmış, fakat abirateron asetat kesildikten sonra 4 ila 16 haftada fertilite tam olarak eski haline dönmüştür.
Sıçanlarda yapılan bir gelişim toksisitesi çalışmasında, abirateron asetat azalmış fetüs ağırlığı ve sağkalım da dahil olmak üzere gebeliği etkilemiştir. Abirateron asetat teratojenik olmasa da, dış genital organlarda etkiler görülmüştür.
Sıçanlarda yürütülen bu fertilite ve gelişim toksisitesi çalışmalarında, tüm etkiler abirateronun
farmakolojik aktivitesine bağlı olmuştur.
Tüm hayvan toksikoloji çalışmalarında görülen üreme organlarındaki değişiklikler dışında, klasik güvenlilik farmakolojisi, tekrarlayan doz toksisitesi, genotoksisite ve karsinojenik potansiyel çalışmalarına dayanan klinik dışı veriler insanlar için özel bir tehlikeyi göstermemiştir. Transjenik farelerde (Tg.rasH2) yapılan 6 aylık bir çalışmada abirateron asetat karsinojenik bulunmamıştır. Sıçanlarda yapılan 24 aylık bir karsinojenisite çalışmasında, abirateron asetat testislerde
interstisyel hücre neoplazmalarının insidansını arttırmıştır. Bu bulgu abirateronun farmakolojik aksiyonuna bağlı ve sıçanlara özgü olarak değerlendirilmiştir. Abirateron asetat dişi sıçanlarda karsinojenik bulunmamıştır.
Çevresel Risk Değerlendirmesi:
Abirateron etkin maddesi, akuatik ortam (özellikle balıklar) için çevresel bir risk göstermektedir.
Tablet çekirdeği
Mikrokristalin selüloz (silikatlaşmış)
Kroskarmelloz sodyum Hipromelloz 2910 (15 mPa.S) Laktoz monohidrat (sığır kaynaklı) Magnezyum stearat
Kolloidal anhidröz silika Sodyum lauril sülfat
Film kaplama
Siyah demir oksit (E172) Kırmızısı demir oksit (E172) Makrogol 3350
Polivinil alkol Talk
Titanyum dioksit
 Rahim Boyu ( Serviks ) Kanseri
Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden
sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir.
Rahim Boyu ( Serviks ) Kanseri
Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden
sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir. |
 En Yaygın Alerji Türleri
Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir.
En Yaygın Alerji Türleri
Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir. |
İLAÇ GENEL BİLGİLERİ
Johnson & Jonhson Sıhhi Malzeme San. ve Tic.Ltd.Şti.
| Satış Fiyatı | 18860.53 TL [ 10 May 2024 ] |
| Önceki Satış Fiyatı | 18860.53 TL [ 3 May 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699593095450 |
| Etkin Madde | Abirateron |
| ATC Kodu | L02BX03 |
| Birim Miktar | 500 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 60 |
| Antineoplastik ve İmmünomodülatör Ajanlar > Hormon Antagonistleri > Abirateron |
| Yerli ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Kalp Krizi Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
 |
İnme İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına yol açar. |
 |
Şizofrenlik Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler hakkında bilgi verecektir. |