ZYTIGA 250 mg 120 tablet Farmakolojik Özellikler
{ Abirateron }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Endokrin tedavisi, diğer hormon antagonistleri ve ilişkili ajanlar ATC kodu: L02BX03
Etki mekanizması
Abirateron asetat (ZYTIGA) in vivo olarak bir androjen biyosentez inhibitörü olan abiraterona dönüşür. Spesifik olarak abirateron 17α-hidroksilaz/C17,20-liyaz (CYP17) enzimini seçici olarak inhibe eder. Bu enzim testiküler, adrenal ve prostatik tümör dokularında eksprese olur ve androjenin biyosentezi için gereklidir. CYP17 enzimi, sırasıyla 17α-hidroksilasyon ve C17,20 bağının kırılmasıyla pregnenolon ve progesteronun testesteron prekürsörleri olan DHEA ve androstenediona dönüşümünü katalize eder. CYP17 inhibisyonu aynı zamanda adrenaller tarafından mineralokortikoid üretiminde artışa da yol açar (bkz. Bölüm 4.4).
Androjene duyarlı prostat karsinomu, androjen düzeylerini azaltan tedaviye yanıt verir. LHRH analogları ya da orşiektomi gibi androjen azaltıcı tedaviler, testislerdeki androjen üretimini azaltmalarına rağmen, adrenaller ya da tümör dokusundaki androjen üretimini etkilemezler. LHRH analogları (ya da orşiektomi) ile birlikte ZYTIGA tedavisi uygulandığında serum testesteron düzeyleri (ticari testlerle ölçüldüğünde) saptanabilir düzeylerin altına düşer.
Farmakodinamik etkiler
ZYTIGA, serum testesteron ve diğer androjen seviyelerini, tek başına LHRH analogları ya da orşiektomi ile elde edilen seviyelerin altına düşürür. Bu, androjen biyosentezi için gerekli olan CYP17 enziminin selektif olarak inhibe edilmesinin bir sonucudur. Prostat spesifik antijen (PSA) prostat kanserli hastalarda bir biyogösterge olarak kullanılır. Daha önce taksanlarla yapılan kemoterapiden fayda görmeyen hastalarda gerçekleştirilen bir Faz 3 klinik çalışmada, ZYTIGA ile tedavi edilen hastaların % 38'inde başlangıç PSA değerlerine göre en az % 50 azalma sağlanabilmişken, bu azalma oranı plasebo ile tedavi edilenlerin ancak % 10'unda sağlanabilmiştir.
Klinik etkililik ve güvenlilik
ZYTIGA'nın etkililiği metastatik hormona duyarlı prostat kanseri (mHDPK) ve metastatik kastrasyona dirençli prostat kanseri (mKDPK) olan hastalarda gerçekleştirilen plasebo kontrollü çok merkezli randomize üç Faz 3 çalışmayla (çalışma 3011, 302 ve 301) gösterilmiştir. Çalışma 3011'e, yüksek riskli prognostik faktörlere sahip yeni tanı almış (randomizasyondan önceki 3 ay içerisinde) mHDPK'li hastalar dahil edilmiştir. Yüksek riskli prognoz aşağıdaki 3 risk faktöründen en az 2'sine sahip olmak olarak tanımlanmıştır: (1) Gleason skorunun ≥8 olması; (2) kemik taramasında 3 veya daha fazla lezyon olması; (3) ölçülebilir visseral (lenf nodu hastalığı hariç) metastaz olması. Aktif tedavi kolunda, standart tedavi olan ADT'ye (LHRH analoğu veya orşiektomi) ilave olarak, ZYTIGA günde 1.000 mg dozunda, günde tek doz 5 mg düşük doz prednizon ile kombine olarak uygulandı. Kontrol kolundaki hastalara ZYTIGA ve prednizon
yerine ADT ve plasebo verildi. Çalışma 301'e daha önceden dosetaksel kullanmış hastalar, çalışma 302'ye ise daha önce dosetaksel kullanmamış hastalar dahil edilmiştir. Hastalar bir LHRH analoğu kullanıyorlardı ya da daha önce orşiektomi olmuşlardı. Aktif tedavi uygulanan kolda, ZYTIGA, günde iki defa 5 mg düşük doz prednizon ya da prednizolonla kombine olarak günde 1.000 mg dozunda kullanılmıştır. Kontrol grubundaysa plaseboya ek olarak günde iki defa 5 mg düşük doz prednizon ya da prednizolon uygulanmıştır.
Serum PSA konsantrasyonlarındaki değişiklikler bağımsız olarak her zaman klinik faydayı göstermeyebilir. Bu nedenle, tüm çalışmalarda hastaların aşağıda verilen tedavi kesilme kriterlerini karşılamalarına kadar tedaviye devam etmeleri önerilir.
Spironolakton androjen reseptörüne bağlandığı ve PSA düzeylerini artırabileceği için, tüm çalışmalarda spironolakton kullanımına izin verilmemiştir.
Çalışma 3011 (yeni tanı almış yüksek riskli mHDPK hastaları)
Çalışma 3011'e (n=1.199) dahil edilen hastaların medyan yaşı 67 idi. ZYTIGA ile tedavi edilen hastaların 832'si (% 69,4) beyaz ırka mensup, 246'sı (% 20,5) Asyalı, 25'i (% 2,1) Siyahi veya Afro Amerikan, 80'i (% 6,7) diğer, 13'ü (% 1,1) bilinmeyen/raporlanmamış ve 3'ü (% 0,3) Amerikan yerlisi veya Alaska yerlisi idi. Hastaların % 97'si için ECOG performans durumu 0 veya 1 idi. Bilinen beyin metastazı, kontrol altına alınamayan hipertansiyonu, önemli kalp hastalığı olan veya NYHA Sınıf II-IV kalp yetmezliği olan hastalar çalışmaya alınmamıştır. Metastatik hastalıktan kaynaklanan semptomların tedavisi için 3 aya kadar ADT veya 1 kür palyatif radyasyon veya operasyon tedavisi alan hastalar haricinde daha önce farmakoterapi, radyasyon terapisi veya metastatik prostat kanseri operasyonu geçirerek tedavi edilen hastalar çalışmaya alınmamıştır. Ortak birincil etkililik sonlanım noktaları, genel sağkalım (OS) ve radyografik progresyonsuz sağkalım (rPFS) idi. Kısa Ağrı Envanteri Kısa Form (BPI-SF) ile ölçülen medyan başlangıç ağrı skoru hem tedavi kolunda, hem de plasebo gruplarında 2,0 idi. Ortak birincil sonlanım noktaları ölçümlerine ilave olarak; iskeletle ilişkili olaya (SRE) kadar geçen süre, prostat tedavisi için sonraki tedaviye kadar geçen süre, kemoterapi başlangıcına kadar geçen süre, ağrı progresyonuna kadar geçen süre ve PSA progresyonuna kadar geçen süre kullanılarak tedavi faydası da değerlendirildi. Tedavi, hastalık progresyonuna, onamın geri çekilmesine, kabul edilemez toksisite veya ölüme kadar devam etti.
Radyografik progresyonsuz sağkalım, randomizasyondan radyografik progresyon görülmesine veya herhangi bir nedene bağlı ölüme kadar geçen süre olarak tanımlandı. Radyografik progresyon, kemik taramasıyla progresyonu (modifiye PCWG2'ye göre) veya BT veya MRG ile yumuşak doku lezyonlarındaki progresyonu (RECIST 1.1'e göre) kapsıyordu.
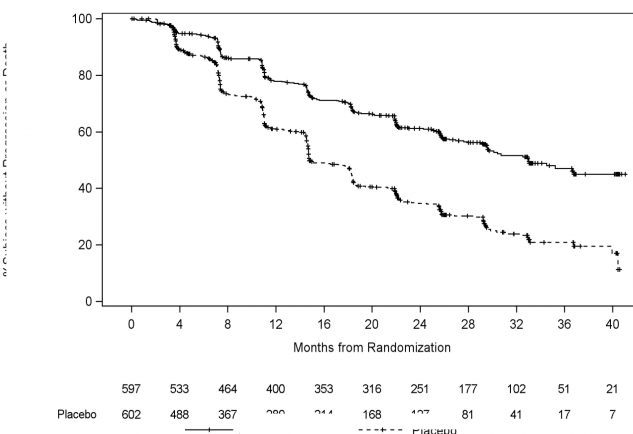
Tedavi grupları arasında rPFS bakımından anlamlı bir farklılık gözlendi (bkz. Tablo 1 ve Şekil 1).
Tablo 1: Radyografik Progresyonsuz Sağkalım - Katmanlı Analiz; Intent-to-treat Popülasyonu (çalışma PCR3011) | ||
| AA-P | Plasebo |
Randomize hastalar | 597 | 602 |
Olay | 239 (% 40,0) | 354 (% 58,8) |
Sansürlendi | 358 (% 60,0) | 248 (% 41,2) |
Olaya Kadar Geçen Süre (ay) |
|
|
Medyan (% 95 GA) | 33,02 (29,57, NE) | 14,78 (14,69, 18,27) |
Aralık | (0,0+, 41,0+) | (0,0+, 40,6+) |
p değeri | < 0,0001 |
|
Tehlike oranı (% 95 GA) | 0,466 (0,394, 0,550) |
|
Not: += Sansürlenmiş gözlem, NE=Hesaplanmadı. rPFS olayını tanımlamada radyografik progresyon ve ölüm dikkate alınmıştır. AA-P= Abirateron asetat ve prednizolon alan hastalar.
Progresyon veya ölüm olmaksızın % gönüllüler
Şekil 1: Radyografik Progresyonsuz Sağkalıma ilişkin Kaplan-Meier Grafiği; Intent-to- treat Popülasyonu (çalışma PCR3011) |
Risk altındaki Randomizasyondan sonraki zaman, ay gönüllüler Abirateron asetat Plasebo Abirateron asetat Plasebo |
OS bakımından Plasebo artı ADT (TO=0,66; % 95 GA: 0,56, 0,78; p<0,0001) ile karşılaştırıldığında, ölüm riskinde % 34'lük bir azalma ile AA-P artı ADT lehine istatistiksel olarak anlamlı bir iyileşme gözlenmiştir (bkz. Tablo 2 ve Şekil 2).
Tablo 2: PCR3011 çalışmasında ZYTIGA veya Plasebo ile Tedavi Edilen Hastaların Genel Sağkalımı (Intent-to-treat Analiz) | ||
Genel Sağkalım | ZYTIGA ve Prednizon (N=597) | Plasebo (N=602) |
Ölüm (%) | 275 (% 46) | 343 (% 57) |
Medyan sağkalım (aylar) | 53,3 | 36,5 |
(% 95 GA) | 48,2, NE | 33,5, 40,0 |
Tehlike oranı (% 95 GA) | 0,66 (0,56, 0,78) | |
NE= Hesaplanmadı
Tehlike oranı tabakalandırılmış orantısal riskler modelinden hesaplanmıştır. Tehlike oranı ï¼1 ZYTIGA ve prednizon lehine
![]()
Şekil 2: Genel Sağkalıma ilişkin Kaplan-Meier Grafiği; Intent-to-treat Popülasyon
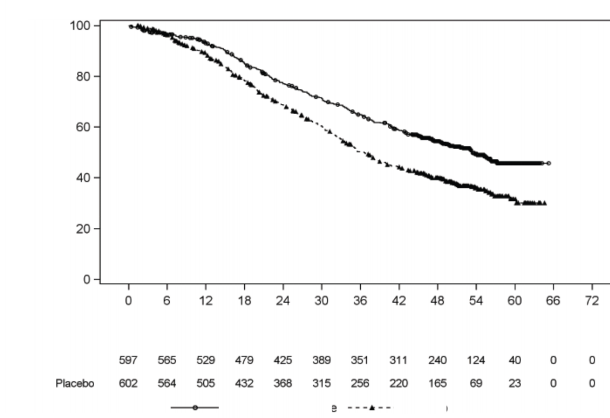
Analizi (çalışma PCR3011)
Ölüm olmaksızın % sağkalan gönüllüler
Risk altındaki gönüllüler Abirateron asetat
Plasebo
Randomizasyondan sonraki zaman, ay
Abirateron asetat Plasebo
Alt grup analizleri ZYTIGA ile tedaviyi sürekli olarak desteklemektedir. Önceden belirlenmiş alt gruplarda AA-P'nin rPFS ve OS üzerindeki tedavi etkisi genel çalışma popülasyonunda daha üstün ve tutarlı olurken, ECOG skoru 2 olan alt grupta lehde bir yarar gözlenmemiştir, ancak örneklem büyüklüğünün küçük olması (n=40) anlamlı bir sonuç çıkarılmasını kısıtlamıştır.
Genel sağkalım ve rPFS'de gözlenen artışlara ilave olarak, prospektif olarak tanımlanan tüm ikincil sonlanım noktaları için plasebo karşısında ZYTIGA lehine faydalar gösterilmiştir.
Çalışma 302 (daha önce kemoterapi almamış hastalar)
Bu çalışmaya asemptomatik veya hafif düzeyde semptomatik olan ve henüz kemoterapi endikasyonu bulunmayan kemoterapi almamış hastalar dahil edilmiştir. Kısa Ağrı Envanteri - Kısa Formunun (BPI-SF) âson 24 saat içindeki en kötü ağrıâ maddesinin puanının 0-1 olması asemptomatik, puanın 2-3 olması ise hafif semptomatik olarak değerlendirilmiştir.
Çalışma 302'de (n = 1.088) yer alan hastaların medyan yaşı ZYTIGA ile birlikte prednizon veya prednizolon alan hastalar için 71, plasebo ile birlikte prednizolon alan hastalar için 70 idi. ZYTIGA ile tedavi edilen hastaların ırklarına göre dağılımı şöyleydi: 520 (% 95,4) beyaz ırk, 15 (% 2,8) siyah ırk, 4 (% 0,7) sarı ırk ve 6 (% 1,1) diğer ırklar. Doğu Ortak Onkoloji Grubu (ECOG) performans durumu, her iki koldaki hastaların % 76'sı için 0 ve % 24'ü için 1 idi. Hastaların % 50'sinde yalnızca kemik metastazları, % 31'inde kemik ve yumuşak doku veya lenf nodu metastazları ve % 19'unda yalnızca yumuşak doku veya lenf nodu metastazları meydana gelmiştir. Visseral metastazı olan hastalar çalışmaya alınmamıştır. Ortak birincil etkinlik sonlanım noktaları, genel sağkalım ve radyografik progresyonsuz sağkalım (rPFS) idi. Ortak birincil sonlanım noktaları ölçümlerine ilave olarak; kanser ağrısı için opiat kullanımına kadar geçen süre, sitotoksik kemoterapi başlangıcına kadar geçen süre, ECOG performans durumunda
⥠1 puanlık kötüleşmeye kadar geçen süre ve Prostat Kanseri Çalışma Grubu 2 (PCWG2) kriterlerine göre PSA progresyonuna kadar geçen süre kullanılarak tedavi faydası da değerlendirilmiştir. Bariz klinik progresyon durumunda çalışma tedavilerine son verilmiştir. Araştırmacı kararıyla, doğrulanmış radyografik progresyon ile de tedavi kesilebilecekti.
Radyografik progresyonsuz sağkalım (rPFS) PCWG2 kriterlerinde (kemik lezyonları için) tanımlanan seri görüntüleme çalışmalarına ve Solid Tümörlerde Yanıt Değerlendirme Kriterleri'ne (RECIST) göre (yumuşak doku lezyonları için) değerlendirildi. rPFS analizinde, radyografik progresyon değerlendirmesi merkezi inceleme ile yapılmıştır.
Planlı rPFS analizi 401 olayı kapsamış, ZYTIGA ile tedavi edilen hastaların 150'sinde (% 28) ve plasebo ile tedavi edilen hastaların 251'inde (% 46) ya radyografik progresyon bulgusu görülmüş ya da hastalar ölmüştür. Tedavi grupları arasında rPFS bakımından anlamlı bir farklılık gözlenmiştir(bkz. Tablo 3 ve Şekil 3).
Tablo 3: Çalışma 302: ZYTIGA veya plasebo ile birlikte prednizolon ve LHRH analogları ya da öncesinde orşiektomi olan hastalardaki radyolografik progresyonsuz sağkalım | ||
| ZYTIGA (N = 546) | Plasebo (N = 542) |
Radyografik Progresyonsuz Sağkalım (rPFS) |
|
|
Progresyon veya ölüm | 150 (% 28) | 251 (% 46) |
Medyan rPFS (ay) (% 95 GA) | Ulaşılmadı (11,66; NE) | 8,3 (8,12; 8,54) |
p-değeri* | < 0,0001 | |
Tehlike oranı** (% 95 GA) | 0,425 (0,347; 0,522) | |
NE = Hesaplanmadı
* p-değeri, başlangıçtaki ECOG skoruna (0 veya 1) göre tabakalandırılmış bir log-rank testinden hesaplanmıştır.
** Tehlike oranı < 1 ZYTIGA lehine
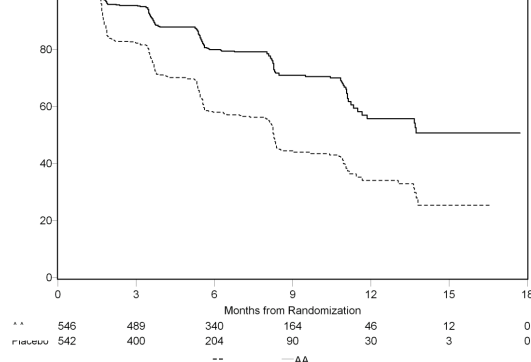
Randomizasyondan sonraki zaman, ay
Plasebo
Plasebo
Progresyon veya ölüm olmaksızın gönüllülerin
%' si
Şekil 3: Kaplan Meier grafiğinde ZYTIGA veya plasebo ile birlikte prednizolon ve LHRH analogları ya da öncesinde orşiektomi olan hastalardaki radyografik progresyonsuz sağkalım
Ancak, Genel Sağkalıma (OS) ilişkin ikinci ara analiz tarihine kadar hasta verisi toplanmaya devam edilmiştir. Araştırmacının rPFS üzerinde bir takip duyarlılık analizi olarak yaptığı radyografik inceleme Tablo 4 ve Şekil 4'te sunulmuştur.
271'i (% 50) abirateron asetat grubundan, 336'sı (% 62) plasebo grubundan olmak üzere toplam 607 hasta radyografik progresyon göstermiş veya ölmüştür. Abirateron asetat ile tedavi, plaseboya kıyasla radyografik progresyon riskini % 47'ye kadar azaltmıştır (TO = 0,530; % 95 GA: [0,451; 0,623], p < 0,0001). Medyan rPFS, abirateron asetat grubunda 16,5 ay, plasebo grubunda ise 8,3 ay olmuştur.
Tablo 4: Çalışma 302: ZYTIGA veya plasebo ile birlikte prednizolon ve LHRH analogları ya da öncesinde orşiektomi olmuş hastalardaki radyografik progresyonsuz sağkalım (İkinci ara analizdeki OS - Araştırıcı İncelemesi) | ||
| ZYTIGA (N = 546) | Plasebo (N = 542) |
Radyografik Progresyonsuz Sağkalım (rPFS) |
|
|
Progresyon veya ölüm | 271 (% 50) | 336 (% 62) |
Medyan rPFS (ay) (% 95 GA) | 16,5 (13,80; 16,79) | 8,3 (8,05; 9,43) |
p-değeri* | < 0,0001 | |
Tehlike oranı** (% 95 GA) | 0,530 (0,451; 0,623) | |
![]()
* p-değeri, başlangıçtaki ECOG skoruna (0 veya 1) göre tabakalandırılmış bir log-rank testinden hesaplanmıştır.
**Tehlike oranı < 1 ZYTIGA lehine
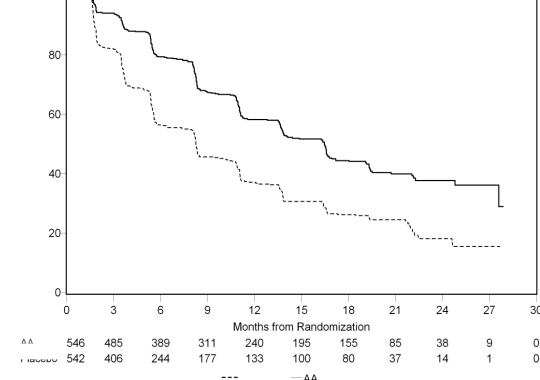
Randomizasyondan sonraki zaman, ay
Plasebo
Plasebo
Progresyon veya ölüm olmaksızın gönüllülerin
%' si
Şekil 4: Kaplan Meier grafiğinde ZYTIGA veya plasebo ile birlikte prednizolon ve LHRH analogları ya da öncesinde orşiektomi olmuş hastalardaki radyografik progresyonsuz sağkalım (İkinci ara analizdeki OS - Araştırıcı İncelemesi)
333 ölüm gözlendikten sonra, OS için planlı bir ara analiz (IA) yapıldı. Gözlenen klinik faydanın büyüklüğü dikkate alınarak çalışmanın körlüğü kaldırıldı ve plasebo grubundaki hastalara ZYTIGA ile tedavi olmaları teklif edildi. ZYTIGA ölüm riskini % 25 azaltarak plaseboya kıyasla daha uzun bir genel sağkalım sağladı (TO = 0,752; % 95 GA: [0,606; 0,934], p = 0,0097), ancak OS yeterli düzeye erişmemişti ve ara analiz sonuçları istatistiksel anlamlılık için önceden belirlenmiş sonlandırma sınırını karşılamıyordu (bkz. Tablo 3). Bu ara analiz sonrasında, sağkalım takibine devam edildi.
OS için planlanan nihai analiz 741 ölüm gözlendikten sonra yapıldı (medyan takip süresi 49 ay). ZYTIGA ile tedavi edilen hastaların % 65'inin (354/546), plasebo ile tedavi edilen hastaların ise
% 71'inin (387/542) öldüğü saptandı. Ölüm riskinde % 19,4'lük bir azalma ile, OS bakımından ZYTIGA ile tedavi edilen grup lehine istatistiksel olarak anlamlı bir fayda (TO = 0,806; % 95 GA: [0,697; 0,931], p = 0,0033) ve 4,4 aylık medyan OS artışı sağlanmıştır (ZYTIGA 34,7 ay, plasebo 30,3 ay) (bkz. Tablo 5 ve Şekil 5). Bu iyileşme, plasebo kolundaki hastaların % 44'ü müteakip tedavi olarak ZYTIGA almış olmalarına rağmen gösterilmiştir.
Tablo 5: Çalışma 302: ZYTIGA veya plasebo ile birlikte prednizolon ve LHRH analogları ya da öncesinde orşiektomi olmuş hastalardaki genel sağkalım | ||
| ZYTIGA (N = 546) | Plasebo (N = 542) |
Ara sağkalım analizi |
|
|
Ölüm vakaları (%) | 147 (% 27) | 186 (% 34) |
Ortalama sağkalım (ay) (% 95 GA) | Ulaşılmadı (NE; NE) | 27.2 (25,95; NE) |
p-değeri* | 0,0097 | |
Tehlike oranı** (% 95 GA) | 0,752 (0,606; 0,934) | |
Nihai sağkalım analizi |
| |
Ölüm Vakaları | 354 (% 65) | 387 (% 71) |
Medyan genel sağkalım (ay, % 95 GA)] | 34,7 (32,7; 36,8) | 30,3 (28,7; 33,3) |
p-değeri* | 0,0033 | |
Tehlike oranı** (% 95 GA) | 0,806 (0,697; 0,931) | |
NE = Hesaplanmadı
* p-değeri, başlangıçtaki ECOG skoruna (0 veya 1) göre tabakalandırılmış bir log-rank testinden hesaplanmıştır.
** Tehlikeoranı < 1 ZYTIGA lehine
Randomizasyondan sonraki zaman, ay
Plasebo
Plasebo
Ölüm olmaksızın gönüllü %' si
Şekil 5: Kaplan Meier grafiğinde ZYTIGA veya plasebo ile birlikte prednizolon ve LHRH analogları ya da öncesinde orşiektomi olmuş hastalardaki genel sağkalım - nihai analiz
Genel sağkalım ve rPFS'de gözlenen artışlara ilave olarak, tüm sekonder sonlanım noktaları için plasebo karşısında ZYTIGA lehine aşağıdaki faydalar gösterilmiştir:
PCWG2 kriterlerine göre PSA progresyonuna kadar geçen süre: PSA progresyonuna kadar geçen medyan süre ZYTIGA alan hastalar için 11,1 ay, plasebo alan hastalar için ise 5,6 ay olmuştur (TO = 0,488; % 95 GA: [0,420; 0,568], p < 0,0001). PSA progresyonuna kadar geçen süre ZYTIGA tedavisi ile yaklaşık iki katına çıkmıştır (TO = 0,488). PSA yanıtı belgelenmiş olan hastaların oranı ZYTIGA grubunda, plasebo grubuna oranla daha fazla olmuştur (% 24 karşısında % 62, p=0,0001). Yumuşak doku hastalığı ölçülebilir olan hastalarda, ZYTIGA ile anlamlı düzeyde artmış tam ve kısmı yanıt oranları görülmüştür.
Kanser ağrısı için opiat kullanımına kadar geçen süre: Nihai analiz sırasında, prostat kanseri ağrısı için opiat kullanımına kadar geçen medyan süre ZYTIGA alan hastalar için 33,4 ay, plasebo alan hastalar için 23,4 ay olmuştur; (TO = 0,721; % 95 GA: [0,614; 0,846], p < 0,0001).
Sitotoksik kemoterapi başlangıcına kadar geçen süre: Sitotoksik kemoterapi başlangıcına kadar geçen medyan süre ZYTIGA alan hastalar için 25,2 ay, plasebo alan hastalar için 16,8 ay olmuştur (TO = 0,580; % 95 GA: [0,487; 0,691], p < 0,0001).
ECOG performans skorunda ⥠1 puan gerilemeye kadar geçen süre: ECOG performans skorunda
⥠1 puan gerilemeye kadar geçen medyan süre ZYTIGA alan hastalar için 12,3 ay, plasebo alan hastalar için 10,9 ay olmuştur (TO = 0,821; % 95 GA: [0,714; 0,943], p = 0,0053).
Aşağıdaki çalışma sonlanım noktaları ZYTIGA tedavisi lehine istatistiksel olarak anlamlı bir üstünlük göstermiştir:
Objektif yanıt: Objektif yanıt, RECIST kriterlerine göre ölçülebilir hastalığı olup tam veya kısmi yanıt elde eden hastaların oranı olarak tanımlanmıştır (hedef lezyon olarak değerlendirilebilmesi için başlangıçtaki lenf nodu büyüklüğü ⥠2 cm olması gereklidir). Başlangıçta ölçülebilir hastalığı olup objektif yanıt elde eden hastaların oranı ZYTIGA grubunda % 36, plasebo grubunda ise % 16 olmuştur (p < 0,0001).
Ağrı: ZYTIGA tedavisi, plasebo ile karşılaştırıldığında, ortalama ağrı şiddeti progresyonunu anlamlı şekilde % 18'e kadar azaltmıştır (p = 0,0490). Progresyona kadar geçen medyan süre ZYTIGA grubunda 26,7 ay, plasebo grubunda ise 18,4 ay olmuştur.
FACT-P (Toplam Skor) anketinde kötüleşmeye kadar geçen süre: ZYTIGA tedavisi, plasebo ile karşılaştırıldığında, FACT-P (Toplam Skor) anketindeki kötüleşme riskini anlamlı şekilde % 22'ye kadar azaltmıştır (p = 0,0028). FACT-P (Toplam Skor) anketinde kötüleşmeye kadar geçen süre ZYTIGA grubunda 12,7 ay, plasebo grubunda ise 8,3 ay olmuştur.
Çalışma 301 (daha önce kemoterapi almış olan hastalar)
Çalışma 301'e daha önceden dosetaksel kullanmış olan hastalar dahil edilmiştir. Bu kemoterapiden kaynaklanan toksisite tedavinin kesilmesine neden olmuş olabileceği için, hastaların dosetaksel tedavisi sırasında hastalık ilerlemesi göstermiş olması gerekmemiştir. Hastalar, protokole tanımlanan radyografik ilerleme ve semptomatik ya da klinik ilerleme ile birlikte PSA ilerlemesi oluncaya kadar (hastanın başlangıç/en düşük düzeyine göre doğrulanmış
% 25 artış) çalışma tedavilerine devam etmiştir. Daha önceden prostat kanseri için ketokonazol tedavisi gören hastalar bu çalışmaya alınmamıştır. Birincil etkililik sonlanım noktası genel sağkalım olmuştur.
Çalışmaya alınan hastaların medyan yaşı 69 idi (yaş aralığı 39 - 95 yaş). ZYTIGA ile tedavi edilen hastaların ırklarına göre dağılımı şöyleydi: 737'si (% 93,2) beyaz ırktan, 28'i (% 3,5) siyah ırktan, 11'i (% 1,4) sarı ırktan ve geri kalan 14'ü (% 1,8) ise diğer ırklardandı. Çalışmaya alınan hastaların % 11'inin ECOG performans skoru 2 idi; % 70'i için PSA ilerlemesi olsun ya da olmasın, hastalık ilerlemesine dair radyografik kanıtlar mevcuttu; % 70'i daha önce bir sitotoksik kemoterapi, % 30'u ise iki sitotoksik kemoterapi almıştı. ZYTIGA ile tedavi edilen hastaların % 11'inde karaciğer metastazı vardı.
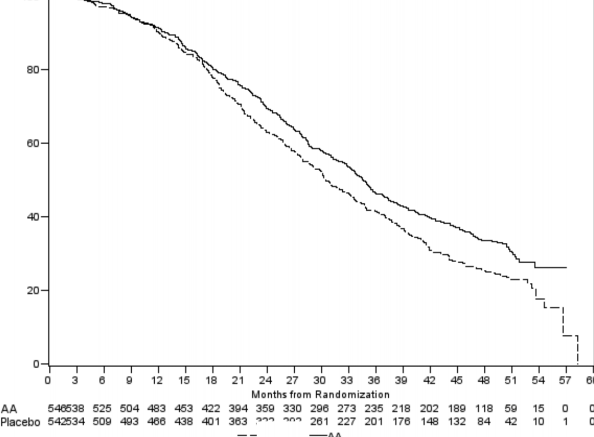
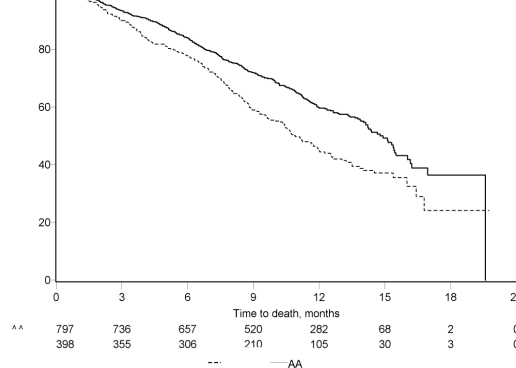
552 ölüm gözlendikten sonra yapılan planlı bir analizde, ZYTIGA ile tedavi edilen hastaların % 42'sinin (797 hastanın 333'ü), plasebo ile tedavi edilen hastaların ise % 55'inin (398 hastanın 219'u) öldüğü saptandı. ZYTIGA ile tedavi edilen hastaların medyan genel sağkalımda istatistiksel olarak anlamlı bir artış görüldü (bkz. Tablo 6).
Tablo 6: ZYTIGA veya plasebo ile birlikte prednizolon ve LHRH analogları ya da öncesinde orşiektomi olmuş hastalardaki genel sağkalım |
| ||
| ZYTIGA | Plasebo | |
| (N=797) | (N=398) | |
Birincil Sağkalım Analizi |
|
| |
Ölümler (%) | 333 (% 42) | 219 (% 55) | |
Medyan genel sağkalım (ay) (% 95 GA) | 14,8 (14,1; 15,4) | 10,9 (10,2; 12) | |
p-değeri | < 0,0001 | ||
Tehlike oranı (% 95 GA) | 0,646 (0,543; 0,768) | ||
Güncel Sağkalım Analizi |
|
| |
Ölümler (%) | 501 (% 63) | 274 (% 69) | |
Medyan genel sağkalım (ay) (% 95 GA) | 15,8 (14,8; 17) | 11,2 (10,4; 13,1) | |
Tehlike oranı (% 95 GA) | 0,740 (0,638; 0,859) | ||
< 1 ZYTIGA lehine
Tedavinin başlangıçtaki ilk birkaç ayından sonra her değerlendirme noktasında, plasebo ile tedavi edilip hayatta kalan hastaların oranıyla karşılaştırıldığında, ZYTIGA ile tedavi edilen hastaların daha yüksek sağkalım oranına sahip olduğu belirlenmiştir (bkz. Şekil 6).
Şekil 6: Kaplan Meier grafiğinde ZYTIGA veya plasebo ile birlikte prednizolon ve LHRH analogları ya da öncesinde orşiektomi olmuş hastalardaki genel sağkalım
Altgrup sağkalım analizleri ZYTIGA tedavisi için tutarlı bir sağkalım faydası gösterdi (bkz. Şekil 7).
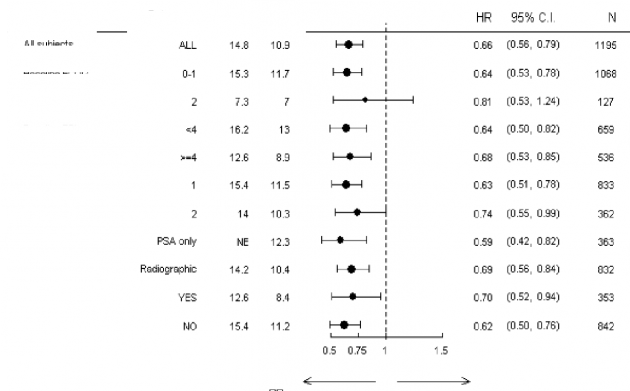
Değişken
Alt Grup
Tüm gönüllüler
Başlangıç ECOG
Başlangıç BPI
Daha önceki kemo rejimlerinin sayısı
Progresyon türü
Başlangıçta iç organlarla ilgili hastalık
AA Lehine
Plasebo Lehine
Sadece PSA
Radyografi
TO % 95 GA N
Şekil 7: Alt gruplara göre genel sağkalım: Tehlike oranı ve % 95'lik güven aralığı
AA= ZYTIGA; BPI= Kısa ağrı envanteri; GA= Güven aralığı; ECOG= doğu kooperatif onkoloji grubu (eastern cooperative oncology grup) performans skoru; TO= Tehlike oranı; NE= Hesaplanmadı
Genel sağkalımda gözlenen artışa ek olarak, tüm ikincil sonlanım noktaları ZYTIGA lehine idi ve aşağıda gösterildiği şekilde bu farklılıklar birden fazla test için ayarlandığında istatistiksel olarak anlamlı idi:
ZYTIGA alan hastalarda, plasebo alanlara göre istatistiksel olarak anlamlı düzeylerde daha yüksek PSA yanıt oranı (başlangıç değerinden â¥% 50 olarak tanımlanmış) elde edildi, ZYTIGA ile % 38 iken, plaseboyla % 10, p < 0,0001.
ZYTIGA ile tedavi edilen hastalarda, PSA ilerlemesine kadar olan medyan süre 10,2 ay iken, bu süre plasebo ile tedavi edilen hastalarda 6,6 ay idi (TO=0,580; % 95 GA: [0,462; 0,728], p < 0,0001).
ZYTIGA ile tedavi edilen hastalarda medyan radyografik progresyonsuz sağkalım 5,6 ay iken, bu süre plasebo ile tedavi edilen hastalarda 3,6 ay idi (TO=0,673; % 95 GA: [0,585; 0,776], p < 0,0001).
Ağrı
Ağrısında hafifleme olan hastaların oranı ZYTIGA grubunda, plasebo grubuna oranla istatistiksel olarak anlamlı derecede daha fazlaydı (% 44'e karşı % 27, p=0,0002). Bir hastada dört hafta arayla yapılan iki ardışık değerlendirmede, 24 saatlik bir sürede analjezik kullanım skorunda herhangi bir artış olmaksızın BPI-SF en kötü ağrı yoğunluğu skorunda başlangıca göre en az % 30 azalma sağlanması, ağrının hafiflemesi yanıtı olarak tanımlandı. Ağrı palyasyonu için yalnızca başlangıç ağrı puanı ⥠4 olan hastalar değerlendirildi ve en az bir başlangıç-sonrası ağrı skoru analiz edildi (N= 512).
ZYTIGA ile tedavi edilen hastalarda, plasebo ile tedavi edilenlere oranla daha düşük oranda ağrı artışı görüldü: 6. ayda ZYTIGA tedavisi alanların % 22'sine karşılık plasebo alanların % 28'i,
12. ayda ZYTIGA tedavisi alanların % 30'una karşılık plasebo alanların % 38'i ve 18. ayda ZYTIGA tedavisi alanların % 35'ine karşılık plasebo alanların % 46'sında ağrıda artış vardı. Ağrı artışı boyunca, iki ardışık değerlendirmede son 24 saatlik bir sürede analjezik kullanım skorunda herhangi bir azalma olmaksızın BPI-SF en kötü ağrı yoğunluğu skorunda başlangıca göre en az % 30 veya daha fazla bir artış ya da iki ardışık değerlendirmede analjezik kullanım skorunda % 30 veya daha fazla bir artış olarak tanımlandı. 25. persentilde ağrı ilerlemesine kadar geçen süre ZYTIGA grubunda 7,4 ay iken, plasebo grubunda 4,7 ay idi.
İskelet sistemiyle ilişkili olaylar
5.2. Farmakokinetik özellikler
Genel özelliklerAbirateron asetat uygulamasından sonra, abirateron farmakokinetiği sağlıklı gönüllülerde, ilerlemiş metastatik prostat kanserli hastalarda ve kanser hastası olmayan karaciğer veya böbrek yetmezliği olan gönüllülerde çalışılmıştır. Abirateron asetat in vivo olarak hızla bir androjen biyosentez inhibitörü olan abiraterona dönüşür (bkz. Bölüm 5.1).
Emilim:
Abirateron asetat açlık durumunda oral yoldan uygulandıktan sonra, en yüksek abirateron konsantrasyonlarına yaklaşık 2 saatte ulaşılır.
Abirateron asetatın yemekle birlikte alınması, yemeğin yağ içeriğine bağlı olarak, aç karına alınmasına oranla 10 kata kadar (EAA açısından) ve 17 kata kadar (Caçısından) daha fazla ortalama sistemik abirateron maruziyetine yol açar. Yemeklerin içerik ve bileşimindeki normal farklılıklar göz önüne alındığında, ZYTIGA'nın yemeklerle birlikte alınması oldukça değişken maruziyetler ile sonuçlanma potansiyeline sahiptir. Bu nedenle, ZYTIGA yemeklerle birlikte alınmamalıdır. ZYTIGA tabletler aç karnına günde bir kez tek doz olarak alınmalıdır. ZYTIGA, yemekten en az iki saat sonra alınmalıdır ve ZYTIGA alındıktan sonra en az bir saat yemek yenmemelidir.Tabletler bütün olarak suyla yutulmalıdır (bkz. Bölüm 4.2).
Dağılım:
İnsan plazmasında C-abirateronun proteine bağlanma oranı % 99,8'dir. Görünür dağılım hacmi yaklaşık 5.630 litre olup, abirateronun periferik dokulara yoğun bir şekilde dağıldığını gösterir.
Biyotransformasyon:
Eliminasyon:
Sağlıklı gönüllülerden elde edilen verilere göre, plazmadaki abirateronun yarılanma süresi yaklaşık 15 saattir. 1.000 mg C-abirateron asetatın oral yoldan alınmasından sonra radyoaktif dozun yaklaşık % 88'i feçeste ve yaklaşık % 5'i idrarda belirlenmiştir. Feçeste bulunan ana bileşikler değişmemiş abirateron asetat ve abiraterondur (sırasıyla uygulanan dozun yaklaşık % 55 ve % 22'si).
Hastalardaki karekteristik özellikler
Karaciğer yetmezliği olan hastalar:
Abirateron asetatın farmakokinetiği, hafif ya da orta şiddette karaciğer yetmezliği olan hastalar (sırasıyla Child-Pugh Sınıf A ve B) ile sağlıklı kontrollerde çalışılmıştır. 1.000 mg'lık tek bir oral doz sonrası abiraterona sistemik maruziyet, hafif ve orta şiddette karaciğer yetmezliği olan hastalarda sırasıyla % 11 ve % 260 oranında artmıştır. Abirateronun ortalama yarılanma ömrü
hafif karaciğer yetmezliği olan hastalarda yaklaşık 18 saate ve orta şiddette karaciğer yetmezliği olan hastalarda ortalama 19 saate uzamaktadır.
Bir başka çalışmada, abirateronun farmakokinetiği daha önceden ciddi karaciğer yetmezliği (Child-Pugh Sınıf C) olan (n= 8) ve normal hepatik fonksiyonu olan 8 sağlıklı birey üzerinde incelenmiştir. Abirateronenin sistemik etkisi (EAA), yaklaşık % 600 oranında artış göstermiş ve serbest ilacın etkisi şiddetli karaciğer bozukluğu olanlarda normal karaciğer fonksiyonu olanlara göre % 80 oranında artmıştır.
Daha önceden hafif karaciğer yetmezliği olan hastalarda doz ayarlamasına gerek yoktur. ZYTIGA kullanımı faydanın olası riskten açıkça ağır bastığı, orta şiddette karaciğer yetmezliği olan hastalarda dikkatle değerlendirilmelidir (bkz. Bölüm 4.2 ve 4.4). ZYTIGA ağır karaciğer yetmezliği olan hastalarda kullanılmamalıdır (bkz. Bölüm 4.2, 4.3 ve 4.4).
ZYTIGA tedavisi sırasında hepatotoksisite gelişen hastalarda, tedavinin durdurulması ve doz ayarlaması gerekebilir (bkz. Bölüm 4.2 ve 4.4).
Böbrek yetmezliği olan hastalar:
Stabil bir hemodiyaliz programında olan son dönem böbrek yetmezliği olan hastalar ile böbrek fonksiyonları normal olan eşlenmiş kontrol hastalarında ZYTIGA farmakokinetiği karşılaştırılmıştır. Diyaliz programında olan son dönem böbrek yetmezliği olan hastalarda
1.000 mg'lık tek bir oral doz sonrası abiraterona sistemik maruziyette artış olmamıştır. Ağır böbrek yetmezliği dahil, böbrek yetmezliği olan hastalarda ZYTIGA uygulanması sırasında dozu azaltmaya gerek yoktur (bkz. Bölüm 4.2). Ancak prostat kanseri ve ağır böbrek yetmezliği olan hastalarla ilgili klinik deneyim bulunmamaktadır. Bu tür hastalarda dikkatli olunması tavsiye edilir.
5.3. Klinik öncesi güvenlilik verileri
Tüm hayvan toksisite çalışmalarında, dolaşımdaki testesteron düzeyleri anlamlı derecelerde azalmıştır. Buna bağlı olarak üreme organlarıyla adrenal, hipofiz ve meme bezlerinin ağırlıklarında azalma ile morfolojik ve/veya histopatolojik değişiklikler gözlenmiştir. Tüm değişiklikler tamamen ya da kısmen geri döndürülebilir nitelikteydi. Üreme organları ve androjene duyarlı organlardaki değişiklikler abirateronun farmakolojisiyle uyumludur. Tedaviyle ilişkili tüm hormonal değişiklikler eski haline dönmüştür veya 4 haftalık bir toparlanma dönemi sonunda düzeldiği gösterilmiştir.
Erkek ve dişi sıçanlarda yapılan fertilite çalışmalarında, abirateron asetat fertiliteyi azaltmış, fakat abirateron asetat kesildikten sonra 4 ila 16 haftada fertilite tamamen eski haline dönmüştür.
Sıçanlarda yapılan bir gelişim toksisitesi çalışmasında, abirateron asetat azalmış fetüs ağırlığında azalma ve sağkalım da dahil olmak üzere gebeliği etkilemiştir. Abirateron asetat teratojenik olmasa da, dış genital organlarda etkiler görülmüştür.
Sıçanlarda yürütülen bu fertilite ve gelişim toksisitesi çalışmalarında, tüm etkiler abirateronun farmakolojik aktivitesine bağlı olmuştur.
Tüm hayvan toksikoloji çalışmalarında görülen üreme organlarındaki değişiklikler dışında, klasik güvenlilik farmakolojisi, tekrarlayan doz toksisitesi, genotoksisite ve karsinojenik potansiyel çalışmalarından elde edilen klinik dışı veriler insanlar için özel bir tehlikeyi
göstermemiştir. Transjenik farelerde (Tg.rasH2) yapılan 6 aylık bir çalışmada abirateron asetat karsinojenik bulunmamıştır. Sıçanlarda yapılan 24 aylık bir karsinojenite çalışmasında, abirateron asetat testislerde interstisyel hücre neoplazmalarının insidansını arttırmıştır. Bu bulgu abirateronun farmakolojik etkisine bağlı ve sıçanlara özgü olarak değerlendirilmiştir. Abirateron asetat dişi sıçanlarda karsinojenik değildir.
Çevresel Risk Değerlendirmesi
Abirateron etkin maddesi, sucul ortam (özellikle balıklar) için çevresel bir risk oluşturur.
Mikrokristalin selüloz Kroskarmelloz sodyum
Laktoz monohidrat (sığır kaynaklı) Magnezyum stearat
Povidon (K29/K32) Kolloidal anhidröz silika Sodyum lauril sülfat
 Deri Kanseri
Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör.
Deri Kanseri
Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör. |
 Diyabet Hastalığı
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır.
Diyabet Hastalığı
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |
İLAÇ GENEL BİLGİLERİ
Johnson & Jonhson Sıhhi Malzeme San. ve Tic.Ltd.Şti.
| Geri Ödeme Kodu | A14606 |
| Satış Fiyatı | 18860.53 TL [ 10 May 2024 ] |
| Önceki Satış Fiyatı | 18860.53 TL [ 3 May 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699593015304 |
| Etkin Madde | Abirateron |
| ATC Kodu | L02BX03 |
| Birim Miktar | 250 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 120 |
| Antineoplastik ve İmmünomodülatör Ajanlar > Hormon Antagonistleri > Abirateron |
| İthal ( ref. ülke : Fransa ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Dış Gebelik Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur. |
 |
Tiroid Kanseri En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur. |
 |
Kolon, Rektum yada Bağırsak Kanseri Bağırsak kanseri kolon veya rektumda (arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir şekilde tedavi edilir. |