COTELLIC 20 mg 63 film kaplı tablet Farmakolojik Özellikler
{ Kobimetinib }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ajanlar, protein kinaz inhibitörleri ATC kodu: L01EE02
Etki mekanizması:
COTELLIC, mitojen-aktive hücre dışı sinyal-regüle kinaz (MEK) 1 ve MEK 2'yi hedefleyerek ve sonucunda hücre dışı sinyal-regüle kinaz (ERK) 1 ve ERK 2'nin fosforilasyonunu inhibe ederek mitojen-aktive protein kinaz (MAPK) yolağını bloke eden, geri-dönüşümlü, selektif, allosterik, oral bir inhibitördür. Böylece kobimetinib, MEK1/2
sinyal ağını inhibe etmek suretiyle, MAPK yolağı tarafından tetiklenen hücre proliferasyonunu bloke eder.
Klinik öncesi modellerde, kobimetinib ve vemurafenib kombinasyonunun melanoma hücrelerindeki mutasyona uğramış BRAF V600 proteinleri ve MEK proteinlerini eşzamanlı olarak hedeflemesiyle, iki ürünü içeren bu kombinasyonun MEK1/2 aracılığıyla MAPK yolağının reaktivasyonunu inhibe ettiği ve bunun da, intraselüler sinyal iletiminin daha güçlü bir şekilde inhibisyonuna ve tümör hücresi proliferasyonunun azalmasına yol açtığı gösterilmiştir.
Klinik etkililik ve güvenlilik:
Santral sinir sistemi metastazı olan hastalarda veya non-kutanöz malign melanom hastalarında vemurafenib ile kombinasyon şeklindeki COTELLIC'in güvenliliği ve etkililiği hakkında veri mevcut değildir.
Çalışma GO28141 (coBRIM):
GO28141 çalışması, BRAF V600 mutasyonu pozitif, cerrahi yöntemle çıkarılamayan lokal olarak ilerlemiş (evre IIIc) ya da metastatik melanomu (evre IV) olan önceden tedavi edilmemiş hastalarda vemurafenib ile kombinasyon halinde uygulanan COTELLIC'in sağladığı güvenlilik ve etkililiğin vemurafenib artı plasebo ile karşılaştırmalı olarak değerlendirildiği çok merkezli, randomize, çift-kör, plasebo kontrollü bir Faz III çalışmadır.
Çalışma GO28141'e sadece ECOG performans durumu 0 ve 1 olan hastalar kaydedilmiştir. ECOG performans durumu 2 veya daha yüksek olan hastalar, çalışma dışında bırakılmıştır.
Cobas® 4800 BRAF V600 mutasyon testi kullanılarak BRAF V600 mutasyonunun doğrulanmasını takiben, cerrahi yöntemle çıkarılamayan lokal olarak ilerlemiş ya da metastatik melanomu olan önceden tedavi edilmemiş 495 hasta, aşağıdaki tedaviler uygulanmak üzere randomize olarak gruplara ayrılmıştır:
Yirmi sekiz günlük her bir tedavi siklusunun 1.-21. günleri arasında günde bir kez plasebo ve 1.-28. günleri arasında günde iki kez 960 mg vemurafenib veya
Yirmi sekiz günlük her bir tedavi siklusunun 1.-21. günleri arasında günde bir kez 60 mg COTELLIC ve 1.-28. günleri arasında günde iki kez 960 mg vemurafenib
Araştırmacı (INV) tarafından değerlendirilen progresyonsuz sağkalım (PS) birincil sonlanım noktasını oluşturmuştur. İkincil sonlanım noktaları; genel sağkalım (GS), objektif yanıt oranı, araştırmacı tarafından değerlendirilmiş yanıt süresi (YS) ve bağımsız bir inceleme kuruluşu (IRF) tarafından değerlendirilen PS'yi içermiştir.
Önemli başlangıç özellikleri aşağıdakileri içermiştir: hastaların %58'ini erkekler oluşturmuştur, medyan yaş 55'tir (sınır aralığı 23-88 yaş), %60'ında evre M1c metastatik melanom saptanmış ve LDH düzeyi yükselmiş olan hasta oranı, COTELLIC artı vemurafenib grubunda %46,3, plasebo artı vemurafenib grubunda ise %43 olarak belirlenmiştir.
GO28141 çalışmasında 65-74 yaş aralığında 89 hasta (%18,1), 75-84 yaş aralığında 38 hasta
(%7,7) ve 85 yaş ile üstü 5 hasta (%1) yer almıştır. Etkililik sonuçları Tablo 4'te özetlenmektedir.
Tablo 4 GO28141 (coBRIM) çalışmasının etkililik sonuçları
| COTELLIC + vemurafenib N=247 | Plasebo + vemurafenib N=248 |
Birincil Sonlanım Noktası
| ||
Progresyonsuz Sağkalım (PS) | ||
Medyan ( ay) %95 GA | 12,3 (9,5, 13,4) | 7,2 (5,6, 7,5) |
Tehlike oranı (%95 GA) | 0,58 (0,46; 0,72) | |
Önemli İkincil Sonlanım Noktaları
| ||
Genel Sağkalım (GS) | ||
Medyan ( ay) %95 GA | 22,3 (20,3, NE) | 17,4 (15, 19,8) |
Tehlike oranı (%95 GA) | 0,70 (%95 GA: 0,55, 0,9) (p değeri 0.005) | |
Objektif Yanıt Oranı (OYO) | 172 (69,6%) | 124 (50%) |
Objektif yanıt oranı için %95 GA | (63,5%, 75,3%) | (43,6%, 56,4%) |
OYO'daki fark (%95 GA) | 19,6 (11, 28,3) | |
En İyi Genel Yanıt |
|
|
Tam Yanıt | 39 (15,8%) | 26 (10,5%) |
Kısmi Yanıt | 133 (53,8%) | 98 (39,5%) |
Stabil hastalık | 44 (17,8%) | 92 (37,1%) |
Yanıt süresi |
|
|
Medyan yanıt süresi (ay) Medyan için %95 GA | 13 (11,1, 16,6) | 9,2 (7,5, 12,8) |
NE= değerlendirilebilir değildir.
GO28141 çalışması için primer analiz, 09 Mayıs 2014 veri alımı durdurulma tarihiyle yürütülmüştür. COTELLIC artı vemurafenib verilen hastalar, plasebo artı vemurafenib verilen hastalarla karşılaştırıldığında, primer sonlanım noktası, araştırıcı tarafından değerlendirilmiş PS'de anlamlı gelişme gözlemlenmiştir (HR 0,51 (0,39; 0,68); p-değeri < 0,0001). Araştırıcı tarafından değerlendirilmiş PS medyan tahmini, COTELLIC artı vemurafenib grubu için 9,9 ay ve plasebo artı vemurafenib grubu için 6,2 ay olmuştur. PS'nin bağımsız incelemesi için medyan tahmini, COTELLIC artı vemurafenib grubu için 11,3 ay ve plasebo artı vemurafenib grubu için 6 ay olmuştur (HR 0,60 (0,45; 0,79); p-değeri = 0,0003).
Objektif yanıt oranı (OYO), COTELLIC artı vemurafenib grubunda %67,6; plasebo artı vemurafenib grubunda %44,8 olmuştur. OYO'daki fark %22,9 olmuştur (p-değeri<0,0001).
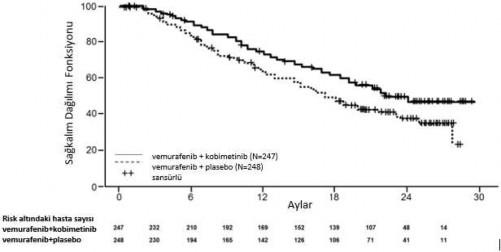
GO28141 çalışmasının final analizi, veri alımı sonlandırılma tarihi 28 Ağustos 2015 olacak şekilde tamamlanmıştır. COTELLIC artı vemurafenib grubundaki hastalarda GS'de, plasebo artı vemurafenib grubundaki hastalara kıyasla önemli ölçüde iyileşme gözlenmiştir (bkz. Şekil 1). COTELLIC artı vemurafenib grubu için 1 yıllık (%75) ve 2 yıllık (%48) GS beklentileri plasebo artı vemurafenib grubundaki hastalardan daha yüksektir (sırasıyla %64 ve %38).
Şekil 1: Final Genel Sağkalıma Ait Kaplan-Meier Eğrileri â Tedavi Edilmesi Amaçlanan Popülasyon (veri alımının durdurulduğu tarih: 28 Ağustos 2015)
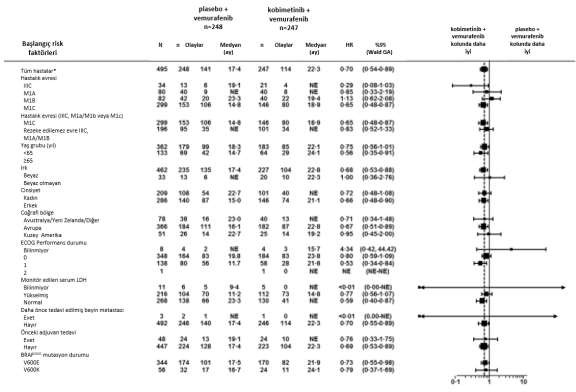
Şekil 2: Progresyonsuz Sağkalım Alt-Grup Analizlerinin Tehlike Oranlarına Ait Forest Plot â Tedavi Edilmesi Amaçlanan Popülasyon (veri alımının durdurulduğu tarih: 28 Ağustos 2015)
Genel sağlık durumu / sağlıkla ilişkili yaşam kalitesi, EORTC QLQ-C30 anketi kullanılarak, hasta bildirimi yoluyla ölçülmüştür. Tüm işlev alanlarına ait skorlar ve semptomların çoğunda (iştah kaybı, konstipasyon, bulantı ve kusma, dispne, ağrı, yorgunluk) klinik olarak anlamlı bir değişiklik (tüm skorlarda başlangıca göre ≤ 10 puan değişiklik) olmadığı ve iki tedavi grubu arasında başlangıçtan ortalama değişikliğin benzer olduğu gösterilmiştir.
Çalışma NO25395 (BRIM7):
COTELLIC'in etkililiği, Faz Ib araştırma olan NO25395'de değerlendirilmiştir; NO25395 araştırması, COTELLIC'in BRAF V600 mutasyonu pozitif (Cobas® 4800 BRAF V600 Mutasyon Testi ile saptanmıştır) cerrahi yöntemle çıkarılamayan ya da metastatik melanomu olan hastalarda vemurafenib tedavisine ek olarak kullanıldığında sağladığı güvenlilik, tolerabilite, farmakokinetik ve etkililiği değerlendirmek üzere tasarlanmıştır.
Bu çalışmada COTELLIC ve vemurafenib ile 129 hasta tedavi edilmiştir: daha önce BRAF inhibitörü tedavisi (BRAFi) uygulanmamış olan 63 hasta ve daha önce uygulanan vemurafenib tedavisi sırasında progresyon görülen 66 hasta. Daha önce BRAFi kullanmamış ileri melanomu olan 63 hastadan 20'sine, çoğunluğu (%80) immunoterapi olmak üzere, daha önce sistemik tedavi uygulanmıştır.
NO25395 araştırmasının daha önce BRAFi kullanmamış popülasyonundan elde edilen sonuçların, genel olarak GO28141 araştırmasının sonuçlarıyla tutarlı olduğu belirlenmiştir. Daha önce BRAFi kullanmamış hastalarda (n=63), %87 şeklindeki bir objektif yanıt oranı elde edilmiş ve bu oran, hastaların %16'sında elde edilen tam yanıtı da içermiştir. Medyan yanıt süresi 14,3 ay olarak belirlenmiştir. Daha önce BRAFi kullanmamış olan hastalar için medyan PS 13,8 ay ve medyan takip süresi 20,6 ay olmuştur.
Vemurafenib tedavisi sırasında progresyon görülen hastalarda (n=66), objektif yanıt oranı
%15 olarak saptanmıştır. Medyan yanıt süresi 6,8 ay olarak belirlenmiştir. Vemurafenib tedavisi sırasında progresyon görülen hastalar için medyan PS, 8,1 aylık medyan takip süresi ile 2,8 ay olmuştur.
BRAF inhibitörü ile tedavi edilmemiş hastalarda, medyan genel sağkalım 28,5 ay (%95 GA 23,3-34,6) olmuştur. BRAF inhibitörü tedavisi sırasında progresyon görülen hastalarda, medyan genel sağkalım 8,4 ay (%95 GA 6,7-11,1) olmuştur.
Pediyatrik popülasyon:
COTELLIC'in güvenlilik, etkililik ve farmakokinetiğini değerlendirmek için pediyatrik hastalarda (< 18 yaş, n=55) bir faz I/II, çok merkezli, açık etiketli, doz artırma çalışması yapılmıştır. Çalışma, standart tedavinin etkisiz veya tolere edilemez olduğu kanıtlanmış veya hiçbir iyileştirici standart bakım tedavi seçeneğinin bulunmadığı, bilinen veya potansiyel RAS/RAF/MEK/ERK yolu aktivasyonlu solid tümörleri olan pediyatrik hastaları içermiştir. Hastalar, her 28 günlük döngünün 1-21. günlerinde, günde bir kez 60 mg'a kadar COTELLIC ile tedavi edilmiştir. Genel yanıt oranı, yalnızca 2 kısmi yanıtla (%3,6) düşük olmuştur.
5.2. Farmakokinetik özellikler
Emilim:
Kanser hastalarında 60 mg oral doz uygulamasını takiben, kobimetinibin medyan 2,4 saatlik bir Tile orta dereceli bir absorpsiyon hızı olduğu gösterilmiştir. Ortalama sabit durum Cve EAA, sırasıyla 273 ng/mL ve 4340 ng.saat/mL olarak saptanmıştır. Sabit durumda ortalama birikim oranı yaklaşık 2,4 kat artmıştır. Kobimetinibin, ~3,5 mg ila 100 mg doz aralığında doğrusal bir farmakokinetiği vardır.
Kobimetinibin mutlak biyoyararlanımı, sağlıklı gönüllülerde %45,9 (%90 GA: %39,7,
%53,1) olarak belirlenmiştir. Sağlıklı gönüllülerde bir insan kütle dengesi araştırması yapılmış ve kobimetinibin yaygın olarak metabolize edildiği ve feçes yoluyla atıldığı gösterilmiştir. Emilen fraksiyonun ~%88 olduğu belirlenmiştir ve bu da yüksek bir emilim düzeyi ve ilk geçiş metabolizmasını göstermektedir.
Sağlıklı gönüllülerde tokluk durumunda (yağ içeriği yüksek bir öğün) uygulandığında, kobimetinibin farmakokinetiği açlık durumuna kıyasla değişiklik göstermemektedir. Farmakokinetiğinin besinlerden etkilenmemesi nedeniyle, kobimetinib besinlerle birlikte ya da öğün dışı zamanlarda kullanılabilmektedir.
Dağılım:
Kobimetinib, in vitro olarak insan plazma proteinlerine %94,8 oranında bağlanmaktadır. İnsan kırmızı kan hücrelerine ağırlıklı bir bağlanma gözlenmemiştir (kan/plazma oranı 0,93).
2 mg'lık bir IV doz uygulanan sağlıklı gönüllülerde dağılım hacmi 1050 L olarak saptanmıştır. Popülasyon farmakokinetiği analizi temel alındığında, kanser hastalarındaki görünen dağılım hacmi 806 L olarak belirlenmiştir.
Kobimetinib, P-gp in vitro substratıdır. Kan beyin bariyerindeki taşınması bilinmemektedir. Biyotransformasyon:
CYP3A ile oksidasyon ve UGT2B7 ile glukuronidasyonun, kobimetinib metabolizmasının başlıca yolakları olduğu görülmektedir. Kobimetinib, plazmada ağırlıklı olan kısımdır. Plazmada, insana spesifik metabolitler ya da dolaşımdaki toplam radyoaktivitenin %10'undan daha yüksek oranda oksidatif metabolitler gözlenmemiştir. Feçes ve idrarda saptanan değişmemiş formdaki tıbbi ürün, uygulanan dozun sırasıyla %6,6 ve %1,6'sını oluşturmuştur ve bu da, kobimetinibin primer olarak metabolize edildiğini ve böbrek yoluyla atılımının çok düşük olduğunu göstermektedir. İn vitro veriler, kobimetinibin OAT1, OAT3 veya OCT2 inhibitörü olmadığını göstermektedir.
Eliminasyon:
Kobimetinib ve metabolitleri sağlıklı denekler üzerinde kütle balans araştırması ile karakterize edilmiştir. Ortalama olarak dozun % 94'ü, 17 gün içerisinde geri alınır. Kobimetinibin metabolizasyonu ve eliminasyonu ağırlıklı olarak feçeste gerçekleşir.
2 mg'lık kobimetinib dozunun IV yolla uygulanmasını takiben ortalama plazma klerensi 10,7 L/saat olarak saptanmıştır. Kanser hastalarında 60 mg'lık oral dozu takiben ortalama görünen klerens 13.8 L/saat olmuştur. Kobimetinib dozunun oral yolla uygulanmasını takiben ortalama eliminasyon yarılanma ömrünün 43,6 saat (sınır aralığı: 23,1 - 69,6 saat) olduğu belirlenmiştir. Bu nedenle, kobimetinibin sistemik dolaşımdan tamamen temizlenmesi, tedavinin durdurulmasını takiben 2 hafta alabilmektedir.
Doğrusallık/ doğrusal olmayan durum:
Kobimetinibin, ~3,5 mg ila 100 mg doz aralığında doğrusal bir farmakokinetiği vardır.
Özel popülasyonlara ilişkin ek bilgiler:
Popülasyon farmakokinetiği analizine göre, cinsiyet, ırk, etnik köken, başlangıçtaki ECOG değeri, hafif ve orta dereceli böbrek fonksiyon bozukluğu, kobimetinibin farmakokinetiğini etkilememiştir. Başlangıçtaki yaş ve başlangıçtaki vücut ağırlığının, sırasıyla kobimetinib klerensi ve dağılım hacmi için istatistiksel olarak anlamlı ortak değişkenleri olduğu belirlenmiştir. Bununla birlikte duyarlılık analizi, bu ortak değişkenlerden hiçbirinin sabit durum maruziyeti üzerinde klinik olarak anlamlı bir etkisi olmadığını düşündürmektedir.
Cinsiyet:
210 kadın ve 277 erkeğin dahil edildiği bir popülasyon farmakokinetiği analizi temel alındığında, cinsiyet, kobimetinib maruziyeti üzerinde etki göstermemektedir.
Geriyatrik popülasyon:
65 yaş ve üstü 133 hastanın dahil edildiği bir popülasyon farmakokinetiği analizi temel alındığında, yaş, kobimetinib maruziyeti üzerinde etki göstermemektedir.
Böbrek yetmezliği:
5.3. Klinik öncesi güvenlilik verileri
ve insanlardaki kütle dengesi araştırması temel alındığında, kobimetinib ağırlıklı olarak metabolize edilmektedir ve böbrek yoluyla atılımı minimal düzeydedir. Böbrek fonksiyon bozukluğu olan hastalarda resmi farmakokinetik araştırması yapılmamıştır.
Hafif böbrek fonksiyon bozukluğu (kreatinin klerensi - KRKL 60 ila < 90 mL/dakika) olan 151 hasta, orta dereceli böbrek fonksiyon bozukluğu (KRKL 30 ila < 60 mL/dakika) olan 48 hasta ve böbrek fonksiyonu normal (KRKL ≥ 90 mL/dakika) olan 286 hastadan elde edilen verilerin kullanıldığı bir popülasyon farmakokinetik analizinin sonuçları, KRKL'nin kobimetinib maruziyeti üzerinde anlamlı bir etkisi olmadığını göstermiştir.
Popülasyon farmakokinetik analizine göre, hafif-orta dereceli böbrek fonksiyon bozukluğu kobimetinib maruziyetini etkilememektedir. Ciddi böbrek fonksiyon bozukluğu olan hastalarda COTELLIC kullanımına ilişkin sınırlı veri bulunmaktadır.
Karaciğer yetmezliği:
Kobimetinibin farmakokinetiği hafif derecede karaciğer bozukluğu (Child Pugh A) olan 6, orta derecede karaciğer bozukluğu (Child Pugh B) olan 6, şiddetli karaciğer bozukluğu (Child Pugh C) olan 6 ve 10 sağlıklı denekte incelenmiştir. Tek doz uygulamadan sonraki sistemik total kobimetinib maruziyeti, hafif ve orta derecede karaciğer bozukluğu olan deneklerde sağlıklı denekler ile benzerdir. Şiddetli karaciğer bozukluğu olan deneklerde total kobimetinib maruziyeti (sağlıklı deneklere kıyasla EAAgeometrik ortalama oran 0,69), klinik olarak anlamlı olmayan derecede daha düşüktür. Hafif ve orta derecede karaciğer bozukluğu olan deneklerdeki bağlanmamış kobimetinib maruziyetleri, normal karaciğer fonksiyonu olan deneklerdekine benzerdir. Şiddetli karaciğer bozukluğu olan deneklerdeki bağlanmamış kobimetinib maruziyeti, normal karaciğer fonksiyonu olan deneklerdekinden yaklaşık 2 kat daha fazladır (bkz. Bölüm 4.2)
Pediyatrik popülasyon
Tablet ve süspansiyon formülasyonları için kanserli pediyatrik hastalarda maksimum tolere edilen doz (MTD) sırasıyla 0,8 mg/kg/gün ve 1 mg/kg/gün olarak bildirilmiştir. Pediyatrik hastalarda 1 mg/kg/gün (süspansiyon formülasyonu) olarak beyan edilen MTD'de geometrik ortalama (%CV) kararlı durum maruziyetleri C,142 ng/mL (%79,5) ve EAA,1862 ng.s /mL (%87) olmuştur. Bu, günde bir kez 60 mg'lık bir dozda yetişkinlere göre yaklaşık
%50 daha düşüktür.
5.3. Klinik öncesi güvenlilik verileri
ve insanlardaki kütle dengesi araştırması temel alındığında, kobimetinib ağırlıklı olarak metabolize edilmektedir ve böbrek yoluyla atılımı minimal düzeydedir. Böbrek fonksiyon bozukluğu olan hastalarda resmi farmakokinetik araştırması yapılmamıştır.Kobimetinib ile karsinojenite çalışmaları yapılmamıştır. Kobimetinib ile yapılan standart genotoksisite araştırmalarının tümü negatif sonuç vermiştir.
Hayvanlarda kobimetinib ile özel fertilite araştırmaları yapılmamıştır. Toksikoloji çalışmalarında, üreme dokularında dejeneratif değişiklikler gözlenmiş ve bu değişiklikler, sıçanlarda korpus luteumlar ve seminal vezikül, epididim ve vajinal epitel hücrelerinin ve köpeklerde epididim epitel hücrelerinin apoptoz/nekrozundaki artışı içermiştir. Bu bulguların klinik önemi bilinmemektedir.
Kobimetinib önerilen dozda gebe sıçanlara uygulandığında, sistemik maruziyet insanlardakine benzer olmuş ve embriyoletaliteye ve fetüste büyük damar ve kafatası malformasyonlarına neden olmuştur.
Kobimetinibin vemurafenib ile kombine kullanıldığındaki kardiyovasküler güvenliliği in vivo değerlendirilmemiştir. İn vitro olarak, kobimetinib, 60 mg dozdaki pik plazma konsantrasyonlarından (C; bağlı olmayan C= 14 ng/mL [0,03 mcM]) yaklaşık 18 kat daha yüksek konsantrasyonlarında, orta dereceli bir hERG iyon kanalı inhibisyonu (IK= 0,5 mcM [266 ng/mL]) oluşturmuştur.
Sıçanlar ve köpeklerde yapılan toksisite araştırmalarında, klinik olarak etkili düzeylerin altındaki plazma maruziyetlerinde, kemik iliği, gastrointestinal sistem, deri, timus, adrenal bez, karaciğer, dalak, lenf düğümü, böbrek, kalp, over ve vajinada genellikle geri dönüşlü olan dejeneratif değişiklikler ortaya çıktığı belirlenmiştir. Doz sınırlayıcı toksisiteler,
sıçanlarda deri ülserasyonları, yüzey eksüdatları ve akantozu, köpeklerde ise kronik aktif enflamasyon ve değişen derecelerde gastroenteropatiyle bağlantılı özofagus dejenerasyonunu içermiştir.
Yavru sıçanlarda yapılan bir tekrarlanan doz toksisitesi araştırmasında, sistemik kobimetinib maruziyetleri erişkin sıçanlara benzer düzeyde olduğunda, doğum sonrası 10. gündeki sistemik kobimetinib maruziyetlerinin, erişkin sıçanlara benzer düzeyde olduğu doğum sonrası 38. güne kıyasla 2-11 kat daha yüksek olduğu saptanmıştır. Yavru sıçanlarda kobimetinib uygulaması, erişkinlerde yapılan pivotal toksisite araştırmalarında gözlenenlere benzer değişikliklere yol açmıştır - bunlar, timus ve karaciğerdeki geri dönüşlü dejeneratif değişiklikleri; dalak ve tiroid/paratiroid ağırlıklarının azalmasını; fosfor, bilirubin ve kırmızı kan hücre kütlesi artışlarını ve trigliserid düzeylerindeki düşüşü içermektedir. Yavru hayvanlarda ölüm oranı (3 mg/kg) dozajında gerçekleşmiştir, ki bu doz yetişkin hayvanlarda ölüme sebebiyet vermemiştir.
 İnme
İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama
ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına
yol açar.
İnme
İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama
ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına
yol açar. |
 Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir.
Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir. |
İLAÇ GENEL BİLGİLERİ
Roche Müstahzarları Sanayi A.Ş.
| Geri Ödeme Kodu | A16056 |
| Satış Fiyatı | 82273.11 TL [ 10 May 2024 ] |
| Önceki Satış Fiyatı | 82273.11 TL [ 3 May 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699505092645 |
| Etkin Madde | Kobimetinib |
| ATC Kodu | L01EE02 |
| Birim Miktar | 20 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 63 |
| Antineoplastik ve İmmünomodülatör Ajanlar |
| İthal ( ref. ülke : Isvicre ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Lösemi Kan Kanseri Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür. |
 |
Depresyonu Anlamak Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur? |
 |
Yüksek Tansiyon Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon atardamarlarınızdaki kanın basıncıdır. |