XELJANZ XR 11 mg uzatılmış salımlı film kaplı tablet(28 tablet) Klinik Özellikler
{ Tofacitinib }
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Romatoid artrit
XELJANZ XR, erişkinlerde orta veya şiddetli aktif romatoid artritte (RA) bir veya daha fazla TNF blokeri kullanımına yetersiz cevap olması veya intolerans olması durumunda endikedir.
XELJANZ XR diğer JAK inhibitörleri, biyolojik DMARD'lar, azatioprin ve siklosporin gibi potent immünsüpresiflerle birlikte kullanılması uygun değildir.
Psöriatik artrit
XELJANZ XR erişkinlerde aktif psöriatik artrit (PsA) tedavisinde bir veya daha fazla TNF blokeri kullanımına yetersiz cevap olması veya intolerans olması durumunda endikedir.
XELJANZ XR, diğer JAK inhibitörleri, biyolojik DMARD'lar, azatioprin ve siklosporin gibi potent immünsüpresiflerle birlikte kullanılması uygun değildir.
Ankilozan spondilit
XELJANZ XR, erişkinlerde ankilozan spondilit (AS) tedavisinde bir veya daha fazla TNF blokeri kullanımına yetersiz cevap olması veya intolerans olması durumunda endikedir.
XELJANZ XR biyolojik anti-romatizmal ilaçlarla (DMARD) veya azatiyopirin ve siklosporin gibi potent immünsüpresiflerle birlikte kullanılması uygun değildir.
4.2. Pozoloji ve uygulama şekli
Kullanım ile ilgili önemli talimatlar
11 mg uzatılmış salımlı film kaplı tablet ile 5 mg film kaplı tablet arasındaki geçiş hekim tarafından yapılmalıdır.
Mutlak lenfosit sayısı <500 hücre/ mm'ün altında, mutlak nötrofil sayısı (ANC)
<1000 hücre/ mm altında ve hemoglobin seviyeleri 9 g/dL'nin altında olan
hastalarda tofasitinib ile tedaviye başlanmamalıdır.
Lenfopeni, nötropeni ve aneminin kontrol altına alınmasında doz kesilmesi önerilir (bkz. bölüm 4.4 ve 4.8).
Ciddi enfeksiyon gelişen hastalarda enfeksiyon kontrol altına alınana kadar
tofasitinib kullanımı kesilmelidir (bkz. bölüm 4.4).
XELJANZ XR, yemeklerle birlikte veya tek başına alınmalıdır (bkz. bölüm 5.1).
XELJANZ XR bütün olarak yutulmalıdır. Ezilmemeli, parçalanmamalı ya da
çiğnenmemelidir.
XELJANZ XR tedavisi, XELJANZ XR'ın endike olduğu durumların teşhis ve tedavisinde deneyimli uzman hekimler tarafından başlatılmalı ve izlenmelidir.
Romatoid artrit, psöriatik artrit ve ankilozan spondilit
Aşağıdaki tablo 1 XELJANZ XR'in RA, PsA ve AS endikasyonlarında yetişkin hastalardaki günlük doz önerisini ve CYP2C19 ve/veya CYP3A4 inhibitörü alan hastalarda, orta veya şiddetli böbrek yetmezliği olan hastalarda (hemodiyalize giren şiddetli yetmezlik hastalarını da içerir ama bunlarla sınırlı değildir) veya orta şiddette karaciğer yetmezliği olan hastalarda ve lenfopeni, nötropeni ve anemi durumlarındaki doz önerilerini göstermektedir.
Yetişkin hastalarda tavsiye edilen doz, günde bir kez uygulanan 11 mg uzatılmış salımlı film kaplı tablettir. Bu doz aşılmamalıdır.
Tablo 1: RA, PsAve AS hastalarında XELJANZ XR için doz önerileri
| XELJANZ XR uzatılmış salımlı film kaplı tablet |
Yetişkin hastalar | Günde bir kez 11 mg |
inhibitörü(leri) ile beraber güçlü CYP2C19 inhibitörü (örn flukonazol) kullanan hastalar (bkz ilaç etkileşimleri) | RA ve PsA endikasyonu için doz günde bir kez 5 mg film kaplı tablete düşürülmelidir AS endikasyonu için doz her iki günde bir 11 mg uzatılmış salımlı tablet olarak devam edilmelidir. |
(bkz. özel popülasyonlar ile ilgili ek bilgiler) olan hastalar (bkz. özel popülasyonlar ile ilgili ek bilgiler) | RA ve PsA endikasyonu için doz günde bir kez 5 mg film kaplı tablete düşürülmelidir. AS endikasyonu için doz her iki günde bir 11 mg uzatılmış salımlı tablet olarak devam edilmelidir. |
| Hemodiyalize giren hastalarda doz diyaliz uygulamasından sonra aynı gün verilmelidir. Eğer diyaliz prosedüründen önce doz alındı ise diyaliz sonrası ek doz önerilmez. |
Tekrarlanan testlerle lenfosit sayısının <500 hücre/ mm'ün altında olduğu doğrulanan hastalar | Tedavi kesilir. |
ANC değeri 500-1000 hücre/mm olan hastalar | Tedavi kesilir. ANC>1,000 hücre/mm olduğunda günde tek doz 11 mg ile devam edilir. |
ANC<500 hücre/mm olan hastalar | Tedavi kesilir. |
Hemoglobin <8,0 g/dL veya 2 g/dL'den fazla düşüş | Hemoglobin değerleri normalleşene kadar uygulamaya ara verilir. |
Güçlü CYP3A4 inhibitörü (örn. ketokonazol) veya
Orta derecede CYP3A4
Orta veya şiddetli böbrek yetmezliği
Orta derecede karaciğer yetmezliği
XELJANZ XR'ın şiddetli karaciğer yetmezliğinde kullanımı önerilmez.
11 mg uzatılmış salımlı film kaplı tablet ile 5 mg film kaplı tablet arasındaki geçiş
Günde 2 kez 5 mg tablet kullanan hastalar 5 mg dozlarını aldıkları günü takip eden günde, günde 1 kez XELJANZ XR 11 mg uzatılmış salımlı tablet kullanmaya başlayabilirler.
Uygulama şekli:
XELJANZ XR, oral yoldan yemeklerle birlikte veya tek başına alınabilir.
XELJANZ XR 11 mg uzatılmış salımlı film kaplı tablet, dozun doğru miktarda alındığından emin olunabilmesi için bütün olarak yutulmalıdır. Ezilmemeli, parçalanmamalı ya da çiğnenmemelidir.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek yetmezliği:
Orta ve şiddetli yetmezlik
XELJANZ ile tedavi gören orta veya şiddetli böbrek yetmezliği hastaları normal böbrek fonksiyonu (bkz. bölüm 5.1) olan XELJANZ hastaları ile karşılaştırıldığında daha yüksek tofasitinib kan konsantrasyonuna sahiptir. Bu nedenle orta veya şiddetli böbrek yetmezliği olan hastalarda (hemodiyalize giren şiddetli yetmezlik hastalarını da içerir ama bunlarla sınırlı değildir) XELJANZ XR'ın dozunun ayarlanması önerilmektedir (bkz. pozoloji/uygulama sıklığı ve süresi-tablo 1).
Hafif yetmezlik
Hafif böbrek yetmezliği olan hastalarda doz ayarlması gerekli değildir.
Karaciğer yetmezliği:
Şiddetli yetmezlik
XELJANZ XR şiddetli karaciğer yetmezliği hastalarında çalışılmamıştır. Bu nedenle XELJANZ XR'ın şiddetli karaciğer yetmezliği hastalarında kullanımı önerilmez.
Orta şiddette yetmezlik
XELJANZ ile tedavi gören orta karaciğer yetmezliği hastaları normal karaciğer fonksiyonu (bkz. bölüm 5.1) olan XELJANZ hastaları ile karşılaştırıldığında daha yüksek tofasitinib kan konsantrasyonuna sahiptir. Yüksek kan konsantasyonu bazı yan etkilerin görülme riskini arttırabilir. Bu nedenle orta şiddette karaciğer yetmezliği olan hastalarda XELJANZ XR'ın dozunun ayarlanması önerilmektedir (bkz. Pozoloji/uygulama sıklığı ve süresi-tablo 1).
Hafif yetmezlik
Hafif karaciğer yetmezliği olan hastalarda doz ayarlması gerekli değildir.
Hepatit B veya C serolojisi
Hepatit B virüs veya hepatit C virüs serolojik tanısı pozitif olan hastalarda XELJANZ XR'ın güvenliliği veya etkililiği çalışılmamıştır.
Pediyatrik popülasyon:
Tofasitinibin pediyatrik hastalarda güvenliliği ve etkililiği belirlenmemiştir.
Geriyatrik popülasyon:
RA çalışmalarına katılan 3315 hastadan 505 RA hastası 65 yaş ve üzeri olup bunun 71 tanesi 75 yaş ve üzeridir. Tofasitinib ile tedavi edilen hastalarda ciddi enfeksiyonların görülme sıklığı 65 yaş ve üzeri hastalarda 65 yaş ve altındakilere kıyasla daha yüksektir.
Genel olarak yaşlı hastalarda enfeksiyon insidansındaki yükseklik nedeniyle bu yaş
grubunu tedavi ederken dikkatli olunmalıdır (bkz. bölüm 4.4).
Diyabetik hastalar:
Genel olarak yaşlı ve diyabeti olan popülasyonda enfeksiyon sıklığı daha yüksek olduğundan, bu gruptaki hastaların tedavisi sırasında dikkatli olunmalıdır.
4.3. Kontrendikasyonlar
Aktif tüberküloz (TB), sepsis veya fırsatçı enfeksiyonlar gibi ciddi enfeksiyonlarda (bkz. bölüm 4.4).
Ciddi karaciğer yetmezliğinde (bkz. bölüm 4.2).
Hamilelik ve emzirme döneminde (bkz. bölüm 4.6).
4.4. Özel kullanım uyarıları ve önlemleri
65 yaş ve üzeri hastalarda kullanım
65 yaş ve üzeri hastalardaki artmış ciddi enfeksiyon, miyokardiyal enfarktüs, malignite ve tüm nedenlere bağlı mortalite riski nedeniyle bu grup hastada tofasitinib başka uygun tedavi alternatifi yoksa kullanılmalıdır (daha fazla detay için bölüm 4.4 ve 5.1 başlıklarına bakınız).
Mortalite
En az bir ek kardiyovasküler (KV) risk faktörü görülen, 50 yaşında veya daha büyük romatoid artrit (RA) hastalarıyla yapılan geniş, randomize, pazarlama sonrası güvenlilik çalışmasında, tümör nekroz faktörü (TNF) inhibitörlerine kıyasla günde 2 kez 5 mg tofasitinib veya günde 2 kez 10 mg tofasitinib ile tedavi edilen hastalarda ani kardiyovasküler ölümler dahil olmak üzere tüm nedenlere bağlı ölüm oranı daha yüksektir. Tüm nedenlere bağlı ölümlerin insidans oranı 100 hasta yılı başına günde 2 kez 5 mg tofasitinib kullanımında 0,88; günde 2 kez 10 mg tofasitinib kullanımında 1,23 ve TNF blokerlerinin kullanımında ise 0,69'dur. Tofasitinib kullanımına başlamadan veya tedaviye devam etmeden önce hastalar risk yarar açısından bireysel olarak değerlendirilmelidir.
RA, PsA veya AS tedavisinde günde 2 kez 10 mg tofasitinib kullanımı önerilmez (bkz. bölüm 4.2).
Diğer ilaçlarla kombine kullanım
Tofasitinibin TNF antagonistleri, interlökin (IL)-1R antagonistleri, IL-6R antagonistleri, anti-CD20 monoklonal antikorları, IL-17 antagonistleri, IL-12/IL-23 antagonistleri, anti- integrinler, selektif kostimulan modülatörler ve azatiopirin, 6-merkaptopürin, siklosporin ve takrolimus gibi güçlü immunsüpresan tedavilerle beraber kullanılması denenmemiştir ve yüksek immunsüpresyon ve artmış enfeksiyon riski nedeniyle önerilmemektedir.
Romatoid artrit klinik çalışmalarında, tofasitinibin MTX kombinasyonu ile görülen advers olayların insidansı tofasitinib monoterapisine kıyasla daha yüksektir.
Tofasitinibin fosfodiesteraz 4 inhibitörleri ile kombinasyon halinde kullanımı klinik olarak çalışılmamıştır.
Tromboz
İnflamatuvar koşulları tedavi etmek için tofasitinib ve diğer Janus kinaz (JAK) inhibitörleri ile tedavi edilen hastalarda bazılarının ölümle sonuçlandığı pulmoner emboli (PE), derin damar trombozu (DVT) ve arteriyel trombozun da dahil olduğu ciddi tromboz olayları görülmüştür. Bu olayların birçoğu ciddi olup bazıları ölümle sonuçlanmıştır.
50 yaş ve üstü ve en az bir ek kardiyovasküler risk faktörüne sahip RA'lı hastalarda yapılan ruhsatlandırma sonrası güvenlilik çalışması 1'de, TNF inhibitörü alan hastalara kıyasla günde 2 kez 5 mg ve günde 2 kez 10 mg tofasitinib kullananlarda tromboz olaylarının insidansında artış gözlenmiştir (bölüm 4.8 ve 5.1'e bakınız). DVT insidans oranı 100 hasta yılı başına günde 2 kez 5 mg tofasitinib kullanımında 0,22; günde 2 kez 10 mg tofasitinib kullanımında 0,28 ve TNF blokerlerinin kullanımında ise 0,16'dır. PE insidans oranı 100 hasta yılı başına günde 2 kez 5 mg tofasitinib kullanımında 0,18; günde 2 kez 10 mg tofasitinib kullanımında 0,49 ve TNF blokerlerinin kullanımında ise 0,05'dir.
RA, PsA ve AS tedavisinde günde 2 kez 10 mg tofasitinib kullanımı önerilmez (bkz. bölüm 4.2).
Çalışma sonrası gözlemsel analizde bilinen tromboz risk faktörleri olan hastalarda tekrar trombozun ortaya çıkması tofasitinib alan hastalarda 12. ay D-dimer seviyesi ≥2Ã ULN olanlarda D-dimer seviyesi <2ÃULN olanlara göre daha yüksek çıkmıştır, bu risk TNF inhibitörleri ile tedavi edilen hastalarda belirgin değildir. Az sayıdaki tromboz olayları ve sınırlı D-Dimer testi yapılmış olması (yalnızca başlangıçta, 12. ayda ve çalışma bitiminde değerlendirilmiştir) nedeniyle sınırlı yorum yapılabilmektedir. Çalışma boyunca tromboz gelişmeyen hastalarda, 12. ayda tüm tedavi kollarında ortalama D-dimer seviyesi başlangıç seviyesine göre anlamlı ölçüde azalmıştır. Ancak hastaların yaklaşık %30'unda 12. ayda D-dimer seviyesi ≥2Ã ULN olmasına karşın tromboz olayları gözlenmemiştir. Bu durum bu çalışmadaki D-dimer testinin duyarlılığının sınırlı olduğunu göstermektedir.
Tromboz için bilinen risk faktörleri olan RA'lı hastalar için yaklaşık 12 aylık tedaviden sonra D-dimer seviyesinin test edilmesi düşünülmelidir.
D-dimer test seviyesi ≥2Ã ULN ise tofasitinib ile tedaviye devam etme kararından önce klinik yararların risklerden fazla olduğu doğrulanmalıdır.
MACE veya malignite risk faktörleri olan hastalarda (bkz. bölüm 4.4 âMajor advers kardiyovasküler olaylarâ ve âMalignite ve lenfoproliferatif hastalıkâ) tofasitinib yalnızca uygun tedavi alternatifleri yok ise kullanılmalıdır.
MACE veya malignite risk faktörleri dışındaki tromboz risk faktörlerine sahip hastalarda tofasitinib dikkatli kullanılmalıdır. MACE veya malignite risk faktörleri dışındaki tromboz risk faktörleri; daha önceden geçirilmiş tromboz, major bir ameliyat geçirecek olması, immobilizasyon, kombine hormonal kontraseptifler veya hormon replasman tedavisi kullanımı, kalıtımsal koagülasyon bozukluğu içerir Hastaların tofasitinib tedavisi boyunca tromboz risk faktörlerinde değişim için periyodik olarak tekrar değerlendirilmesi önerilir.
Doza veya endikasyona bakılmaksızın tromboz belirti ve bulguları olan hastalar hemen değerlendirilmeli ve tromboz belirtileri olan hastalarda tofasitinibe devam edilmemelidir.
Tofasitinib tromboz riski artmış olan hastalarda kullanılmamalıdır. Retinal venöz tromboz
Retinal venöz tromboz (RVT) tofasitinib ile tedavi edilen hastalarda raporlanmıştır (bkz. bölüm 4.8). RVT'yi işaret eden herhangi bir durumu tecrübe eden hastalara derhal medikal yardım almaları tavsiye edilmelidir.
Ciddi enfeksiyonlar
Tofasitinib tedavisi alan hastalarda bakteriyel, mikobakteriyel, invazif fungal, viral ya da diğer fırsatçı patojenlere bağlı ciddi ve bazen fatal enfeksiyonlar bildirilmiştir (bkz. bölüm 4.8). Tofasitinib ile bildirilen en yaygın ciddi enfeksiyonlar arasında, pnömoni, selülit, herpes zoster, idrar yolu enfeksiyonu, divertikülit ve apandisittir. Fırsatçı enfeksiyonlar arasından tüberküloz ve diğer mikobakteriyel enfeksiyonlar, kriptokok, histoplasmoz, özofageal kandidiyaz, pnömosistoz, multidermatomal herpes zoster, sitomegalovirüs, BK virüsü enfeksiyonları ve listeriyoz tofasitinib kullanımı ile bildirilmiştir. Bazı hastalar, lokalize yerine yayılmış enfeksiyon göstermiştir ve genellikle metotreksat veya kortikosteroid gibi immünomodülatör ajanlar ile birlikte kullanmışlardır.
Fırsatçı enfeksiyon riski Asya coğrafi bölgelerinde daha yüksektir. Kortikosteroid alan romatoid artrit hastaları enfeksiyona yatkın olabilir.
Tofasitinib, lokal enfeksiyonlar da dahil olmak üzere aktif enfeksiyonu olan hastalarda kullanımından kaçınılmalıdır.
Aşağıdaki durumlarda tofasitinibe başlamadan önce tedavinin hastalar açısından faydaları ve riskleri göz önünde bulundurulmalıdır.
Kronik veya tekrarlayıcı enfeksiyonları olan hastalar,
Tüberküloza maruz kalmış hastalar,
Ciddi ya da fırsatçı enfeksiyon geçmişi olan hastalar,
Endemik tüberküloz veya endemik mikoz bulunan yerlerde yaşamış ya da buralara seyahat etmiş olan hastalar,
Enfeksiyona yatkınlığa neden olabilecek altta yatan koşulları bulunan hastalar
Tofasitinib ile tedavi sırasında ya da tedaviden sonra hastalar enfeksiyon belirtileri ve semptomları açısından yakından izlenmelidir. Hastada ciddi bir enfeksiyon, fırsatçı enfeksiyon ya da sepsis ortaya çıkması halinde ilaca ara verilmelidir. Tofasitinib tedavisi sırasında yeni bir enfeksiyon görülen bir hastaya, immünitesi zayıflamış bir hasta için gerekli, tanısal testler derhal ve eksiksiz olarak yapılmalı, uygun antimikrobiyal tedavi başlamalı ve hasta yakından izlenmelidir.
Genel olarak yaşlı ve diyabeti olan popülasyonda enfeksiyon sıklığı daha yüksek olduğundan, bu gruptaki hastaların tedavisi sırasında dikkatli olunmalıdır (bkz. bölüm 4.8). 65 yaş ve üzerindeki hastalarda tofasitinib sadece başka uygun tedavi alternatifleri yok ise kullanılmalıdır (bkz. bölüm 5.1).
Lenfopeni derecesindeki artış ile enfeksiyon riski daha yüksek olabilir ve hastalardaki enfeksiyon riskini değerlendirirken lenfosit sayısına dikkat edilmelidir. Tedavinin durdurulması ve lenfopeni kriterlerinin gözlenmesi bölüm 4.2'de tartışılmıştır.
Tüberküloz
Aşağıdaki durumlarda tofasitinibe başlamadan önce tedavinin hastalar açısından faydaları ve riskleri göz önünde bulundurulmalıdır.
Tüberküloza maruz kalmış hastalar,
Endemik tüberküloz bulunan yerlerde yaşamış ya da buralara seyahat etmiş olan
hastalar.
Tofasitinib tedavisinden önce ve tedavi süresince periyodik olarak hastalar latent ya da aktif enfeksiyon açısından uygun kılavuzlara göre değerlendirilmeli ve tetkik edilmelidir.
Yeterli tedavi almış olduğu doğrulanamayan, TB testi negatif latent ya da aktif TB geçmişi olan hastalarda veya testi negatif olduğu halde TB enfeksiyonu açısından risk faktörleri bulunan hastalar için tofasitinib tedavisinden önce anti-tüberküloz tedavi gerekliliği değerlendirilmelidir. TB tedavisinde deneyimli bir uzman tarafından yapılan konsültasyon ile hastaların anti-tüberküloz tedavisi için uygunluk kararının verilmesi önerilmektedir.
Tedaviye başlamadan önce latent TB enfeksiyonu testi negatif çıkan hastalar da dahil olmak üzere hastalar TB belirtileri ve semptomlarının gelişimi açısından yakından izlenmelidir.
Latent TB enfeksiyonu olan hastalar tofasitinib uygulaması öncesi standart bir antimikobakteriyel ajan ile tedavi edilmelidir.
Viral reaktivasyon
Tofasitinib ile yapılan klinik çalışmalarda herpes virüs reaktivasyonu (örneğin herpes zoster) dahil olmak üzere viral reaktivasyon gözlenmiştir (bkz.bölüm 4.8).
Pazarlama sonrası araştırmalarda tofasitinib ile tedavi gören hastalarda hepatit B reaktivasyonu bildirilmiştir. Tofasitinibin kronik viral hepatit reaktivasyonu üzerindeki etkisi bilinmemektedir. Tarama sırasında Hepatit B ya da C için pozitif sonuç veren hastalar, klinik çalışmalardan çıkarılmıştır. Tofasitinib ile tedaviye başlanmadan önce klinik kılavuzlar doğrultusunda viral hepatit için tarama yapılmalıdır.
Tofasitinib ile tedavi edilen aşağıdaki hasta gruplarında herpes zoster insidansında artış görülmüştür.
Japon ve Koreli hastalar
ALC 1,000 hücre/mm'den az olan hastalarda (bkz. bölüm 4.2),
Daha önceden 2 veya daha fazla biyolojik DMARD alan uzun süreli RA hastalarında,
Günde 2 kere 10 mg kullanan hastalarda
Major advers kardiyovasküler olaylar
50 yaş ve üstü ve en az bir ek kardiyovasküler risk faktörüne sahip RA'lı hastalarda yapılan güvenlilik çalışması 1'de, TNF inhibitörü alan hastalara kıyasla günde 2 kez 5 mg ve günde
2 kez 10 mg tofasitinib kullananlarda kardiyovasküler ölüm, ölümcül olmayan miyokardiyal enfarktüs (MI) ve ölümcül olmayan inme olarak tanımlanan majör advers kardiyovasküler olayların (MACE) oranında artış olmuştur. MACE insidans oranı 100 hasta yılı başına günde 2 kez 5 mg tofasitinib kullanımında 0,91; günde 2 kez 10 mg tofasitinib kullanımında 1,11 ve TNF blokerlerinin kullanımında ise 0,79'dur. Ölümcül veya ölümcül olmayan miyokardiyal enfarktüs insidans oranı 100 hasta yılı başına günde 2 kez 5 mg tofasitinib kullanımında 0,36; günde 2 kez 10 mg tofasitinib kullanımında 0,39 ve TNF blokerlerinin kullanımında ise 0,20'dir. Geçmişte ya da halen sigara içen hastalar ek risk altındadır.
65 yaş ve üzerinde halen veya geçmişte uzun süredir sigara içen hastalarda ve aterosklerotik kardiyovasküler hastalık öyküsü veya diğer kardiyovasküler risk faktörleri olan hastalarda tofasitinib yalnızca uygun tedavi alternatifi yok ise kullanılmalıdır (bkz bölüm 5.1).
RA veya PsA tedavisinde günde 2 kez 10 mg tofasitinib kullanımı önerilmez (bkz. bölüm 4.2).
Maligniteler ve lenfoproliferatif hastalık
Tofasitinib kişinin malignitelere karşı savunma mekanizmasını etkileyebilir.
Tofasitinib ile yapılan klinik çalışmalarda lenfomalar ve katı tümörler dahil olmak üzere maligniteler gözlenmiştir (bkz. bölüm 4.8).
RA güvenlilik çalışması 1'de TNF inhibitörü alan hastalara kıyasla günde 2 kez 5 mg veya günde 2 kez 10 mg tofasitinib ile tedavi edilen hastalarda daha yüksek oranda malignite (özellikle NMSC) oranı gözlenmiştir. Malignitelerin insidans oranı 100 hasta yılı başına günde 2 kez 5 mg tofasitinib kullanımında 1,13; günde 2 kez 10 mg tofasitinib kullanımında 1,13 ve TNF blokerlerinin kullanımında ise 0,77'dir. Geçmişte ya da halen sigara içen hastalar ek risk altındadır.
RA güvenlilik çalışması 1'de tüm malignitelerin bir alt kümesi olan lenfomalar ve akciğer kanserleri TNF inhibitörü alan hastalara kıyasla günde 2 kez 5 mg veya günde 2 kez 10 mg tofasitinib ile tedavi edilen hastalarda daha yüksek oranda görülmüştür. Lenfomaların insidans oranı 100 hasta yılı başına günde 2 kez 5 mg tofasitinib kullanımında 0,07; günde 2 kez 10 mg tofasitinib kullanımında 0,11 ve TNF blokerlerinin kullanımında ise 0,02'dir. Geçmişte ya da halen sigara içen hastalar arasında akciğer kanserlerinin insidans oranı 100 hasta yılı başına günde 2 kez 5 mg tofasitinib kullanımında 0,48; günde 2 kez 10 mg tofasitinib kullanımında 0,59 ve TNF blokerlerinin kullanımında ise 0,27'dir.
Tofasitinib kullanımına başlamadan veya tedaviye devam etmeden önce özellikle bilinen malignitesi olan (başarılı bir şekilde tedavi edilen NMSC dışında), tedavi sırasında malignite geliştiren ve geçmişte uzun süre içmiş ya da halen sigara içen hastalar risk yarar açısından bireysel olarak değerlendirilmelidir. RA veya PsA tedavisinde günde 2 kez 10 mg tofasitinib kullanımı önerilmez (bkz. bölüm 4.2).
De novo böbrek nakli hastalarında yapılan kontrollü doz-aralıklandırma çalışmalarında (Faz 2B), tümü basiliksimab, yüksek doz kortikosteroidler ve mikofenolik asit ürünleri ile indüksiyon tedavisi alan 218 tofasitinib hastasının (%2,3) 5 tanesinde Epstein Barr Virüsü ile ilişkili nakil sonrası lenfoproliferatif bozukluk gözlemlenirken 111 siklosporin hastasının hiçbirinde bu bozukluk gözlenmemiştir.
Tofasitinib ile tedavi edilen hastalarda akciğer kanseri, meme kanseri, melanom, prostat kanseri ve pankreas kanseri dahil fakat bunlarla sınırlı olmamak üzere klinik çalışmalarda ve pazarlama sonrası araştırmalarda diğer maligniteler gözlenmiştir.
Melanom dışı cilt kanseri
Tüm hastalar için ama özellikle cilt kanseri için artmış risk taşıyan hastalar için periyodik cilt muayenesi önerilmektedir (bkz. bölüm 4.8).
İnterstisyel akciğer hastalığı
Kronik akciğer hastalığı hikayesi olan hastalarda veya interstisyel akciğer hastalığı geliştirmiş hastalarda enfeksiyona daha yatkın olmaları nedeniyle dikkatli olunması önerilir. RA klinik çalışmalarında ve pazarlama sonrasında tofasitinib kullanan hastalarda interstisyel akciğer hastalığı (bazıları ölüm ile sonuçlanmıştır) raporlanmıştır. Janus kinaz (JAK) inhibisyonunun bu olaylardaki rolü bilinmemektedir. Asyalı RA hastalarının interstisyel akciğer hastalığı açısından daha yüksek risk altında olduğu bilindiğinden bu hastaların tedavisinde dikkatli olunmalıdır.
Gastrointestinal perforasyon
Tofasitinib ile yürütülen klinik çalışmalarda gastrointestinal perforasyon olguları rapor edilmiştir ancak bu olaylarda JAK inhibisyonunun rolü bilinmemektedir.
Gastrointestinal perforasyon riski artmış olan (örneğin divertikülit geçmişi, eş zamanlı kortikosteroid ve/veya non steroidal antiinflamatuvar ilaç kullanımı) hastalarda tofasitinib dikkatli bir şekilde kullanılmalıdır. Yeni başlayan abdominal belirti ve bulgular ile hastaneye başvuran hastalar, gastrointestinal perforasyonunun erken tanısı için derhal değerlendirilmelidir (bkz. bölüm 4.8).
Kırıklar
Tofasitinib alan hastalarda kırık gelişimi gözlenmiştir.
Tofasitinib ileri yaşta hastalar, kadın hastalar ve kortikosteroid kullanan hastalar gibi bilinen kırık risk faktörleri olan hastalarda doz ve endikasyondan bağımsız dikkatli kullanılmalıdır.
Karaciğer enzimlerinde artış
Tofasitinib ile tedavi plasebo ile karşılaştırıldığında karaciğer enzimlerinde yükselme insidansında artış ile ilişkilendirilmiştir. Bu anormalliklerin çoğu öncesinde DMARD (öncelikle metotreksat) tedavisi olan çalışmalarda meydana gelmiştir.
Yüksek alanin aminotransferaz (ALT) veya aspartat aminotransferaz (AST) seviyeleri olan hastalarda tofasitinib tedavisi özellikle MTX gibi potansiyel hepatotoksik ilaçlarla birlikte başlatılması düşünülüyorsa dikkatli olunmalıdır.
Potansiyel ilaca bağlı karaciğer hasarı olgularını belirleyebilmek için karaciğer testleri rutin olarak takip edilmeli ve karaciğer enzimlerindeki yükselmenin sebepleri hızlıca araştırılmalıdır. Eğer ilaca bağlı karaciğer hasarından şüphelenilirse, bu teşhis ortadan kalkana kadar tofasitinib tedavisine ara verilmelidir.
Hipersensitivite
Tofasitinib kullanan hastalarda ilaca aşırı duyarlılığın işareti olabilen anjiyoödem ve ürtiker gibi reaksiyonlar gözlenmiştir. Bazı olaylar ciddidir. Ciddi hipersensitivite reaksiyonunun görülmesi durumunda potansiyel neden veya reaksiyona neyin sebep olduğu değerlendirilirken tofasitinib tedavisi derhal kesilmelidir (bkz. bölüm 4.8).
Laboratuvar anomalileri Lenfosit anomalileri
Tofasitinib tedavisi plasebo ile karşılaştırıldığında lenfopeni insidansında artış ile ilişkilendirilmiştir. 750 hücre/mm'ün altındaki lenfosit sayıları ciddi enfeksiyon insidansında artış ile ilişkilendirilmiştir. Lenfosit satısı 750 hücre/mm'ün altında olan hastalarda tofasitinib tedavisine başlanması veya devam edilmesi önerilmez.
Lenfosit seviyesi başlangıçta ve ardından her 3 ayda bir izlenmelidir. Lensofit sayısı baz alınarak önerilen düzenlemeler için bölüm 4.2'ye bakınız.
Nötropeni
Tofasitinib tedavisi, plasebo ile karşılaştırıldığında artmış nötropeni (<2,000 hücre/mm) insidansı ile ilişkilendirilmiştir. ANC'si 1.000 hücre/mm'ün altında olan hastalarda tofasitinib tedavisine başlanması önerilmez.
Tedavi başlangıcında, 4-8 hafta sonra ve ardından her 3 ayda bir ANC izlenmelidir. ANC baz alınarak önerilen düzenlemeler için bölüm 4.2'ye bakınız.
Anemi
Tofasitinib tedavisi, hemoglobin seviyelerinde düşüşler ile ilişkilendirilmiştir. Hemoglobin değeri düşük olan hastalarda (<9 g/dL) hastalarda tofasitinib tedavisinden kaçınılmalıdır.
Hemoglobin seviyesi; başlangıçta, tedavi başlangıcından 4-8 hafta sonra ve ardından her 3 ayda bir izlenmelidir. Hemoglobin seviyesi baz alınarak önerilen düzenlemeler için bölüm
4.2'ye bakınız.
Lipid değerlerinde artış
Tofasitinib tedavisi; total kolesterol, düşük yoğunluklu lipoprotein (LDL) kolesterol ve yüksek yoğunluklu lipoprotein (HDL) kolesterol gibi lipid parametrelerindeki artışlar ile ilişkilendirilmiştir. Maksimum etkiler genellikle 6 hafta içinde gözlenmiştir. Tofaistinib tedavisinin başlamasından 8 hafta sonra lipid parametrelerinin değerlendirilmesi yapılmalıdır.
Hastalar, hiperlipidemi tedavisine yönelik klinik kılavuzlara (uluslararası kolesterol eğitim programı (NCEP)) göre tedavi edilmelidir.
Tofasitinib tedavisi ile ilişkili olan toplam kolesterol ve LDL kolesterol seviyelerindeki artış statin tedavisi ile tofasitinib öncesi seviyelere düşürülebilir.
Diyabet tedavisi gören hastalarda hipoglisemi
Diyabet tedavisi gören hastalarda tofasitinib başlanmasını takiben hipoglisemi raporlanmıştır. Hipogliseminin görülmesi durumunda anti-diyabetik ilaçlarda doz ayarlaması gerekebilir.
Aşılamalar
Tofasitinib tedavisine başlamadan önce mevcut bağışıklama kılavuzlarına uygun olarak bağışıklamaları güncelleyiniz.
Canlı aşıların, tofasitinib ile birlikte uygulanmasından kaçınınız. Tofasitinib tedavisinden önce canlı aşı uygulama kararı verilirken, hastada var olan immünosüpresyon dikkate alınmalıdır.
Profilaktik zoster aşısı aşılama kılavuzlarına göre değerlendirilmelidir. Daha önce iki veya daha fazla biyolojik DMARD almış, uzun süreli RA'lı hastalara özellikle dikkat edilmelidir.
Canlı zoster aşısı yapılıyorsa; sadece su çiçeği öyküsü olan veya varicella zoster virüsü (VZV) için seropozitif olan hastalara uygulanmalıdır. Su çiçeği geçmişi şüpheli veya güvenilir değilse, VZV'ye karşı antikorların test edilmesi önerilir. Canlı aşılarla aşılama, tofasitinib başlangıcından en az 2 hafta, tercihen 4 hafta önce veya immünomodülatör tıbbi ürünlerle ilgili güncel aşılama kılavuzlarına uygun olarak yapılmalıdır. Tofasitinib alan hastalara canlı aşılar yoluyla enfeksiyonun sekonder bulaşmasına ilişkin herhangi bir veri mevcut değildir.
Deforme olmayan uzatılmış salım formülasyonu ile gastrointestinal obstrüksiyon riski Hali hazırda ciddi gastrointestinal daralma (patalojik yada iatrojenik) problemi olan hastalarda tofasitinib uzatılmış salımlı film kaplı tablet uygularken dikkatli olunmalıdır. Bozulmayan bir uzatılmış salım formülasyonu kullanan diğer ilaçların yutulması ile bağlantılı olarak bilinen darlıklara sahip hastalarda obstrüktif semptomlar nadir olarak bildirilmiştir.
Bu tıbbi ürün, her tablette sorbitol (E420) içerir. Nadir kalıtımsal fruktoz intolerans problemi olan hastaların bu ilacı kullanmamaları gerekir. Sorbitol (veya fruktoz) içeren ürünler ile diyetle sorbitol (veya fruktoz) alımının birlikte uygulanmasının ilave etkisi dikkate alınmalıdır.
Oral kullanılan ürünlerdeki sorbitol miktarı beraber kullanıldığı diğer oral ilaçların biyoyararlanımını etkileyebilir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Diğer ilaçların tofasitinibin farmakokinetiğini (PK) etkileme potansiyelleri
Tofasitinib, CYP3A4 ile metabolize edildiğinden, CYP3A4'ü inhibe eden ya da indükleyen ilaçlar ile etkileşimi olabilir. Tofasitinib maruziyeti, potent CYP3A4 inhibitörleri (ketokonazol) ya da orta derecede CYP3A4 ve potent CYP2C19 (örn. flukonazol) inhibisyonuna sebep olan bir veya birkaç ilacın beraber kullanılması ile artar (bkz. bölüm 4.2).
Tofasitinib maruziyeti potent CYP indükleyicileri (örn. rifampin) ile birlikte uygulandığında azalmaktadır. Tek başına CYP2C19 ya da P-glikoprotein inhibitörlerinin tofasitinib farmakokinetiğini belirgin bir şekilde değiştirmesi beklenmez.
Ketokonazol (güçlü bir CYP3A4 inhibitörü), flukonazol (orta derecede bir CYP3A4 ve potent CYP2C19 inhibitörü), takrolimus (hafif CYP3A4 inhibitörü) ve siklosporin (orta derecede bir CYP3A4 inhibitörü) ile birlikte kullanımı tofasitinib EAA'sını arttırırken
rifampisin (potent CYP indükleyicisi) tofasitinib EAA'sını düşürmektedir. Tofasitinibin potent CYP indükleyicileri (örn. rifampisin) ile birlikte kullanılması klinik cevap alınamamasına veya klinik cevabın azalmasına sebep olabilir (bkz. şekil 1). Tofasitinibin potent CYP3A4 indükleyicileri ile birlikte kullanılması önerilmemektedir. Ketokonazol ve flukonazol ile birlikte kullanılması tofasitinibin Cdeğerini arttırırken takrolimus, siklosporin ve rifampisin ile birlikte kullanılması tofasitinibin Cdeğerini azaltmaktadır.
RA hastalarında MTX ile eşzamanlı olarak uygulamanın (haftada bir kez 15-25 mg MTX), tofasitinib farmakokinetiği üzerinde bir etkisi olmamıştır (bkz. şekil 1).
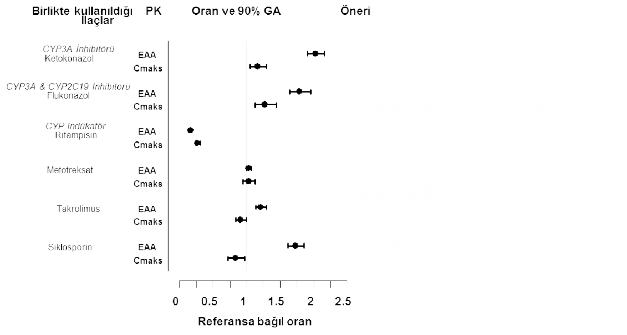
Tofasitinib dozu düşürülmelidir Tofasitinib dozu düşürülmelidir
Etkililiği düşürebilir.
Doz ayarlamasına gerek yoktur.
Tofasitinibin takrolimus ile birlikte kullanımından kaçınılmalıdır.
Tofasitinibin siklosporin ile birlikte kullanımından kaçınılmalıdır.
Şekil 1. Diğer ilaçların tofasitinib farmakokinetiği (PK) üzerine etkisi
Not: Referans gruba tofasitinib tek başına uygulanmıştır.
Tofasitinibin diğer ilaçların PK'larını etkileme potansiyeli
Sağlıklı kadın gönüllülerde tofasitinibin birlikte uygulandığı oral kontraseptiflerin
levonorgestrel ve etinil estradiol farmakokinetiği üzerinde bir etkisi olmamıştır.
RA hastalarında tofasitinibin haftada bir kez 15-25 mg MTX ile birlikte uygulanması, MTX EAA ve Cdeğerlerini sırasıyla %10 ve %13 oranında düşürmüştür. MTX maruziyetindeki düşüş miktarı, bireysel MTX dozunda ayarlama yapılmasını gerektirmemektedir.
Özel popülasyonlara ilişkin ek bilgiler Pediyatrik popülasyon:
Etkileşim çalışmaları sadece yetişkinlerde gerçekleştirilmiştir.
4.6. Gebelik ve laktasyon
Gebelik kategorisi : C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon) Çocuk doğurma potansiyeli bulunan kadınlara tofasitinib tedavisi sırasında ve son dozdan 4 hafta sonrasına kadar etkili doğum kontrol yöntemleri kullanmaları önerilmelidir.
Gebelik dönemi
Tofasitinibin gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Tofasitinibin sıçanlarda ve tavşanlarda teratojenik olduğu ve doğumu ve peri/postnatal gelişimi etkilediği gösterilmiştir (bkz. bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.
Önlem olarak tofasitinib gebelik döneminde kontrendikedir (bkz. bölüm 4.3). Risk özeti
Hamile kadınlarda XELJANZ XR kullanımına dair mevcut veriler, ilaç ile ilişkili majör doğum defektleri, düşük veya advers maternal ya da fetal sonuç riskinin belirlenmesi için yeterli değildir. Hamilelik sırasında romatoid artrit ve ülseratif kolit ile ilişkili anne ve fetüsü etkileyen riskler söz konusudur (bkz. klinik endişeler). Hayvan üreme çalışmalarında tofasitinib, maksimum önerilen doz olan günde 2 kez 10 mg dozunun sırasıyla 73 ve 6,3 katı maruziyet düzeyi durumunda, organogenez dönemindeki hamile sıçanlar ve tavşanlarda, fetosidal ve teratojenik etkilere sebep olmuştur. Ayrıca sıçanlarda gerçekleştirilen peri- ve post-natal bir çalışmada tofasitinib, önerilen günlük 2 kez 5 mg dozun yaklaşık 73 kat ve maksimum önerilen doz olan günde 2 kez 10 mg dozun yaklaşık 36 kat üzerindeki maruziyet düzeylerinde, canlı yavru boyutunda, postnatal sağkalımda ve yavru vücut ağırlıklarında düşüşe sebep olmuştur (bkz. veriler).
İlacın endike olduğu popülasyonlardaki tahmini majör doğum defekti ya da düşük riski bilinmemektedir. Tüm gebelikler altta yatan bir doğum kusuru ya da kaybı riski veya diğer advers sonuçlara ait riskler taşımaktaydır. Genel ABD popülasyonunda klinik olarak tanınmış olan gebeliklerde majör doğum defektleri ve düşükler için risk düzeyi sırasıyla
%2-4 ve %15-20 düzeyindedir.
Klinik endişeler
Hastalık ile ilişkili maternal ve/veya embriyo/fetal risk
Yayımlanmış olan veriler, romatoid artrit ya da ülseratif kolit hastası kadınlarda hastalık aktivitesindeki artışın advers gebelik sonuçlarının gelişimi ile ilişkili olduğuna işaret etmektedir. Advers gebelik sonuçları arasında preterm doğum (gestasyonun 37. haftasından
önce), düşük doğum ağırlıklı (< 2500 g) ve doğumdaki gestasyonel yaşa kıyasla küçük infantlar yer almaktadır.
Veriler
Hayvan verileri
Hamile sıçanlara organogenez sırasında tofasitinib uygulanan sıçan embriyofetal gelişim çalışmasında tofasitinibin, günlük önerilen doz olan günde 2 kez 5 mg'ın yaklaşık 146 kat üzerindeki ve maksimum önerilen doz olan günde 2 kez 10 mg'ın (sıçanlarda 100 mg/kg/gün oral dozlardaki EAA bazında) yaklaşık 73 kat üzerindeki maruziyet düzeylerinde teratojenik olduğu gösterilmiştir.
Teratojenik etkiler arasında, sırasıyla anasarka ve membranöz ventriküler septal defektler olmak üzere eksternal ve yumuşak doku malformasyonları; ve iskelet malformasyonları veya varyasyonları yer almaktadır (servikal ark eksikliği; bükülmüş femur, fibula, humerus, radius, skapula, tibia ve ulna; sternokizi; kaburga eksikliği; deforme femur; dallanmış kaburga, kaynaşmış kaburga; kaynaşmış sternebra; ve hemisentrik torasik merkez). Buna ek olarak, canlı fetüs sayısında azalma ile sonuçlanan, erken ve geç rezorpsiyonlar ile karakterize implantasyon sonrası kayıplarda bir artış gözlenmiştir. Ortalama fetal vücut ağırlığı düşmüştür. Sıçanlarda tofasitinibin, günlük önerilen doz olan günde 2 kez 5 mg'ın yaklaşık 58 kat üzerindeki ve maksimum önerilen doz olan günde 2 kez 10 mg'ın (hamile sıçanlarda 30 mg/kg/gün oral dozlardaki EAA bazında) yaklaşık 29 kat üzerindeki maruziyet düzeylerinde herhangi bir gelişimsel toksisite gözlemlenmemiştir.
Hamile tavşanlara organogenez sırasında tofasitinib uygulanan tavşan embriyofetal gelişim çalışmasında tofasitinibin, günlük önerilen doz olan günde 2 kez 5 mg'ın yaklaşık 13 kat üzerindeki ve maksimum önerilen doz olan günde 2 kez 10 mg'ın (tavşanlarda 30 mg/kg/gün oral dozlardaki EAA bazında) yaklaşık 6,3 kat üzerindeki maruziyet düzeylerinde maternal toksisiste belirtisi olmaksızın teratojenik olduğu gösterilmiştir. Teratojenik etkiler arasında; torakogastroşizis, omfalosel, membranöz ventriküler septal defektler ve kranial / iskelet malformasyonları (mikrostomi, mikroftalmi), orta hat ve kuyruk defektleri yer almaktadır. Buna ek olarak, geç rezorpsiyonlar ile ilişkili olarak implantasyon sonrası kayıplarda bir artış gözlenmiştir. Tavşanlarda tofasitinibin, günlük önerilen doz olan günde 2 kez 5 mg'ın yaklaşık 3 kat üzerindeki ve maksimum önerilen doz olan günde 2 kez 10 mg'ın (hamile tavşanlarda 10 mg/kg/gün oral dozlardaki EAA bazında) yaklaşık 1,5 kat üzerindeki maruziyet düzeylerinde herhangi bir gelişimsel toksisite gözlemlenmemiştir.
Hamile sıçanlarda gerçekleştirilen peri- ve post-natal bir gelişim çalışmasında 6. gestasyon gününden laktasyonun 20. gününe kadar tofasitinib, önerilen günde 2 kez 5 mg dozun yaklaşık 73 kat ve maksimum önerilen doz olan günde 2 kez 10 mg dozun (sıçanlarda 50 mg/kg/gün oral dozlarda EAA bazında) yaklaşık 36 kat üzerindeki maruziyet düzeylerinde, canlı yavru boyutunda, postnatal sağkalımda ve yavru vücut ağırlıklarında düşüşe sebep olmuştur. Sıçanlarda önerilen günde 2 kez 5 mg dozun yaklaşık 17 katı ve maksimum önerilen doz olan günde 2 kez 10 mg dozun (sıçanlarda 10 mg/kg/gün oral dozlardaki EAA bazında). yaklaşık 8,3 katı maruziyet düzeylerinde canlı F2 jenerasyon fetüslerin üretilmesinde ve F1 jenerasyon sıçanların davranışsal ve öğrenme
değerlendirmelerinde, seksüel olgunlaşmasında ya da çiftleşme yetenekleri üzerinde herhangi bir etki saptanmamıştır.
Laktasyon dönemi
Risk özeti
Tofasitinibin insan sütüne geçip geçmediği, emzirilen infant üzerindeki etkileri ya da süt üretimi üzerindeki etkilerine dair herhangi bir veri bulunmamaktadır. Tofasitinib emzirmekte olan sıçanların sütüne geçmiştir (bkz. veriler). Emzirme durumunda çocuk için risk dışlanamaz. Önlem olarak tofasitinib emzirme döneminde kontrendikedir (bkz. bölüm 4.3).
Üreme yeteneği/Fertilite
İnsan doğurganlığı üzerindeki potansiyel etkiye ilişkin resmi çalışmalar yapılmamıştır. Tofasitinib, sıçanlarda dişi fertilitesini bozmuş ancak erkek fertilitesini etkilememiştir (bkz. bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
Tofasitinibin araç ve makine kullanma yeteneği üzerine etkisi yoktur veya ihmal edilebilir düzeydedir.
4.8. İstenmeyen etkiler
Güvenlilik profili özeti Romatoid artritEn yaygın görülen ciddi advers reaksiyonlar, ciddi enfeksiyonlar olmuştur (bkz. bölüm 4.4). Tüm maruziyet popülasyonunda uzun dönem güvenlilik verilerine göre tofasitinib kullanımı ile en yaygın bildirilen ciddi enfeksiyonlar pnömoni (%1,7), herpes zoster (%0,6), idrar yolu enfeksiyonları (%0,4), selülit (%0,4), divertikülit (%0,3) ve apandisittir (%0,2). Fırsatçı enfeksiyonlar arasından TB ve diğer mikobakteriyel enfeksiyonlar, kriptokok, histoplasmoz, özofageal kandidiyaz, multidermatomal herpes zoster, sitomegalovirüs, BK virüsü enfeksiyonları ve listeriyoz tofasitinib kullanımı ile bildirilmiştir. Bazı hastalar, lokalize yerine yayılmış enfeksiyon bulguları ile başvurmuştur. Klinik çalışmalarda bildirilmeyen diğer ciddi enfeksiyonlar da ortaya çıkabilir (örn. koksidiyoidomikoz).
Çift kör, plasebo veya MTX kontrollü klinik çalışmaların ilk 3 ayında en yaygın rapor edilen advers reaksiyonlar; baş ağrısı (%3,9), üst solunum yolu enfeksiyonları (%3,8), viral üst solunum yolu enfeksiyonları (%3,3), diyare (%2,9), mide bulantısı (%2,7) ve hipertansiyon (%2,2) olmuştur.
Çift-kör, plasebo veya MTX kontrollü çalışmaların ilk 3 ayında herhangi bir advers reaksiyona bağlı olarak tedaviyi bırakma oranı tofasitinib alan hastalar için %3,8'dir. Kontrollü klinik çalışmaların ilk 3 ayında tedavinin bırakılması ile sonuçlanan en yaygın enfeksiyonlar; herpes zoster (%0,19) ve pnömonidir (%0,15).
Psöriatik artrit
Genel olarak, tofasitinib ile tedavi edilen aktif PsA hastalarında gözlenen güvenlilik profili
tofasitinib ile tedavi edilen RA hastalarında gözlenen güvenlilik profili ile uyumludur.
Ankilozan spondilit
Genel olarak, XELJANZ XR ile tedavi edilen AS hastalarında gözlenen güvenlilik profili XELJANZ ile tedavi edilen RA ve PsA hastalarında gözlenen güvenlilik profili ile uyumludur.
RA, PsA ve AS hastalarında yapılan klinik çalışmalara göre advers ilaç reaksiyonları, sistem/organ sınıfı ve aşağıda belirtilen sisteme göre belirlenmiş sıklık kategorisine göre sınıflandırılmıştır; çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila <1/100); seyrek (≥1/10.000 ila <1/1.000); çok seyrek (< 1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Her sıklık grubunda, istenmeyen etkiler azalan ciddiyet sırasına göre yer almaktadır.
Enfeksiyonlar ve enfestasyonlar
Yaygın : | Pnömoni, influenza, herpes zoster, idrar yolu enfeksiyonu, sinüzit, bronşit, nazofarenjit, farenjit |
Yaygın olmayan : | Tüberküloz, divertikülit, piyelonefrit, selülit, herpes simpleks, viral gastroenterit, viral enfeksiyon |
Seyrek : | Sepsis, ürosepsis, dissemine tüberküloz, bakteriyemi, Pnömosistis jiroveci pnömonisi, pnömokokal pnömoni, bakteriyel pnömoni, sitomegalovirüs enfeksiyonu, bakteriyel artrit |
Çok seyrek | Merkezi sinir sistemi tüberkülozu, kriptokokal menenjit, nekrotizan fasit, ensefalit, stafilokokal bakteremi Mikobakteriyum avium kompleks enfeksiyonu, atipik mikobakteriyel enfeksiyon |

Yaygın olmayan : Akciğer kanseri, melanom dışı cilt kanseri Seyrek : Lenfoma
(Kist ve polipler de dahil olmak üzere) iyi huylu ve kötü huylu neoplazmalar
Kan ve lenf sistemi hastalıkları
Yaygın : | Lenfopeni, anemi |
Yaygın olmayan : | Lökopeni, nötropeni |
Bağışıklık sistemi hastalıkları
Bilinmiyor : | İlaca aşırı duyarlılık*, anjiyoödem*, ürtiker* |
Metabolizma ve beslenme hastalıkları
Yaygın olmayan : Dislipidemi, hiperlipidemi, dehidratasyon
Psikiyatrik hastalıklar
Yaygın olmayan : İnsomnia
Sinir sistemi hastalıkları Yaygın : Baş ağrısı Yaygın olmayan : Parestezi
Kardiyak hastalıklar
Yaygın olmayan : Miyokardiyal enfarktüs
Vasküler hastalıklar
Yaygın : Hipertansiyon
Yaygın olmayan : Venöz tromboemboli**
Solunum, göğüs bozuklukları ve mediastinal hastalıklar
Yaygın : Öksürük
Yaygın olmayan : Dispne, sinüs konjesyonu
Gastrointestinal hastalıklar
Yaygın : Abdominal ağrı, kusma, diyare, bulantı, gastrit, dispepsi
Hepato-biliyer hastalıklar
Yaygın olmayan : Hepatik steatoz, hepatik enzim artışı, transaminaz artışı, gama
-glutamiltransferaz artışı,
Seyrek : Anormal karaciğer test sonuçları
Deri ve deri altı doku hastalıkları Yaygın : Döküntü Yaygın olmayan : Eritem, pruritus
Kas-iskelet bozukluklar, bağ doku ve kemik hastalıkları
Yaygın : Artralji
Yaygın olmayan : Eklem şişliği, tendinit
Seyrek : Muskuloskeletal ağrı
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Yaygın : Periferik ödem Yaygın olmayan : Pireksi, yorgunluk
Araştırmalar
Yaygın : Kan kreatin fosfokinaz düzeyi artışı
Yaygın olmayan : Kan kreatinin artışı, kan kolesterol düzeyi artışı, düşük yoğunluklu
lipoprotein artışı, kilo artışı
Yaralanma ve zehirlenme
Yaygın olmayan : Ligamentte burkulma, kas gerilmesi
* Spontan raporlanan veri
** Venöz tromboemboli PE, DVT ve Retinal Venöz Tromboz'u içerir.
Seçilmiş yan etkilerin açıklanması Venöz tromboemboli
Romatoid artrit
En az bir ek kardiyovasküler (KV) risk faktörü görülen, 50 yaşında veya daha büyük romatoid artrit hastalarıyla yapılan geniş (N=4.362), randomize, onay sonrası güvenlilik çalışmasında, TNF inhibitörlerine kıyasla tofasitinib ile tedavi edilen hastalarda doza bağımlı olarak artan insidansta VTE gözlenmiştir (bkz. bölüm 5.3). Bu olayların çoğu ciddidir ve bazıları ölümle sonuçlanmıştır. Günde iki kez 5 mg tofasitinib, günde iki kez 10 mg tofasitinib ve TNF inhibitörleri için PE insidans oranları (%95 GA) her 100 hasta- yıl için sırasıyla 0,17 (0,08-0,33), 0,50 (0,32-0,74) ve 0,06 (0,01-0,17)'dur. TNF
inhibitörleri ile karşılaştırıldığında PE risk oranı (HR), günde iki kez 5 mg tofatinib ve günde iki kez 10 mg tofasitinib için sırasıyla 2,93 (0,79-10,83) ve 8,26 (2,49-27,43)'dur (bkz. bölüm 5.1). Tofasitinib ile tedavi edilen ve PE görülen hastaların çoğunluğunda (%97) VTE risk faktörü bulunmaktadır.
Ankilozan spondilit
Birleştirilmiş faz 2 ve faz 3 randomize kontrollü klinik çalışmalarda 48 hafta kadar
tofasitinib alan 420 hastada (233 hasta-yıl gözlem) VTE görülmemiştir.
Genel enfeksiyonlar
Romatoid artrit
0-3 ay boyunca, kontrollü Faz 3 klinik çalışmalarında, günde iki kez 5 mg (toplam 616 hasta) ve günde iki kez 10 mg (toplam 642 hasta) tofasitinib monoterapi gruplarındaki enfeksiyon oranları sırasıyla %16,2 (100 hasta) ve %17,9 (115 hasta) iken, plasebo grubunda (toplam 122 hasta) bu oran %18,9 (23 hasta) olmuştur. DMARD kombinasyon tedavisi içeren kontrollü Faz 3 klinik çalışmalarında, günde iki kez 5 mg (toplam 973 hasta) ve günde iki kez 10 mg (toplam 969 hasta) tofasitinib artı DMARD gruplarındaki ilk 3 aydaki enfeksiyon oranları, sırasıyla %21,3 (207 hasta) ve %21,8 (211 hasta) iken plasebo artı DMARD grubunda (toplam 559 hasta) bu oran %18,4 (103 hasta) olmuştur.
En yaygın rapor edilen enfeksiyonlar, üst solunum yolu enfeksiyonu ve nazofarenjit olmuştur (sırasıyla %3,7 ve %3,2).
Uzun süreli tüm güvenlilik maruziyet popülasyonunda (toplam 4,867 hasta) tofasitinib ile
genel enfeksiyon oranı, 100 hasta yılı başına 46,1 olay olmuştur (günde iki kez 5 mg ve 10
mg için sırasıyla 43,8 ve 47,2 hasta). Monoterapi alan hastalar için (toplam 1,750) oran 100 hasta yılı başına günde iki kez 5 mg ve 10 mg için sırasıyla 48,9 ve 41,9 olaydır. DMARD'lar ile kombinasyon tedavisi alan hastalar için (toplam 3,117), enfeksiyon oranları 100 hasta yılı başına günde iki kez 5 mg ve 10 mg için sırasıyla 41,0 ve 50,3 olay olarak gerçekleşmiştir.
Ankilozan spondilit
Birleştirilmiş faz 2 ve faz 3 randomize kontrollü klinik çalışmalarda, 16 haftaya kadar ki placebo kontrollü çalışma periyodunda günde 2 kere 5 mg tofasitinib grubunda (185 hasta) enfeksiyonların görüme sıklığı % 27,6 iken placebo grubunda (187 hasta) bu oran %23'dür. Birleştirilmiş faz 2 ve faz 3 randomize kontrollü klinik çalışmalarda 48 haftaya kadar günde iki kez tofasitinib 5 mg alan 316 hastada enfeksiyon görülme oranı % 35,1'dir.
Ciddi enfeksiyonlar
Romatoid artrit
6 ay ve 24 ay süreli 2 kontrollü klinik çalışmada, günde iki kez 5 mg tofasitinib monoterapisi grubunda gözlenen ciddi enfeksiyon oranı, 100 hasta yılı başına 1,7 olaydır. Aynı oran; günde iki kez 10 mg tofasitinib monoterapisi grubunda, 100 hasta yılı başına 1,6 olay iken, plasebo grubunda 100 hasta yılı başına 0 olay olarak gerçekleşmiştir. MTX grubunda ise bu oran 100 hasta yılı başına 1,9 olay olmuştur.
6, 12 veya 24 ay süreli çalışmalarda, günde iki kez 5 mg ve 10 mg tofasitinib artı DMARD gruplarındaki ciddi enfeksiyon oranları 100 hasta yılı başına sırasıyla 3,6 ve 3,4 olay iken, plasebo ile birlikte DMARD uygulanan grupta 100 hasta yılı başına 1,7 olay olarak gerçekleşmiştir.
İlaca maruz kalan tüm popülasyonlardaki uzun dönem güvenlilik verilerinde, ciddi enfeksiyonların genel oranları günde iki kez 5 mg ve günde iki kez 10 mg tofasitinib tedavisi alan gruplar için 100 hasta yılı başına sırasıyla 2,4 ve 3,0 olay olmuştur. En yaygın görülen ciddi enfeksiyonlar arasında, pnömoni, herpes zoster, idrar yolu enfeksiyonu, selülit, gastroenterit ve divertikülit yer almıştır. Fırsatçı enfeksiyonlar da bildirilmiştir (bkz. bölüm 4.4).
En az bir ek kardiyovasküler (KV) risk faktörü görülen, 50 yaşında veya daha büyük romatoid artrit hastalarıyla yapılan geniş (N=4.362), randomize, onay sonrası güvenlilik çalışmasında, TNF inhibitörlerine kıyasla tofasitinib ile tedavi edilen hastalarda doza bağımlı olarak artan insidansta ciddi enfeksiyonlar gözlenmiştir (bkz. bölüm 4.4).
Günde iki kez 5 mg tofasitinib, günde iki kez 10 mg tofasitinib ve TNF inhibitörleri için ciddi enfeksiyon insidans oranları (%95 GA) her 100 hasta-yıl için sırasıyla 2,86 (2,41-
3,37), 3,64 (3,11-4,23) ve 2,44 (2,02-2,92)'dur. TNF inhibitörleri ile karşılaştırıldığında ciddi enfeksiyonların risk oranı (HR), günde iki kez 10 mg tofatinib ve günde iki kez 5 mg tofasitinib için sırasıyla 1,17 (0,92-1,50) ve 1,48 (1,17-1,87)'dur.
Ankilozan spondilit
Birleştirilmiş faz 2 ve faz 3 randomize kontrollü klinik çalışmalarda 48 haftaya kadar günde 2 kere tofasitinib 5 mg alan 316 hastada sadece 1 tane ciddi enfeksiyon görülmüştür (aseptik menenjit). Bu sayı oranlandığında 100 hasta yılı başına 0,43 olay denk gelmektedir.
Yaşlı hastalarda ciddi enfeksiyonlar
Çalışma I ila VI'ya dahil edilmiş olan 4,271 RA hastasının 608'i 65 yaş ve üzerinde, bu hastaların da 85'i 75 ve üzeri yaştadır. Tofasitinib ile tedavi edilen 65 yaş ve üzeri hastalarda gözlenen ciddi enfeksiyon sıklığı, 65 yaş altı hastalarda görülenden daha yüksek olmuştur (sırasıyla 100 hasta yılı başına 4,8 olaya karşı 100 hasta yılı başına 2,4 olay).
En az bir ek kardiyovasküler (KV) risk faktörü görülen, 50 yaşında veya daha büyük romatoid artrit hastalarıyla yapılan geniş (N=4.362), randomize, onay sonrası güvenlilik çalışmasında, TNF inhibitörlerine ve günde iki kere 5 mg tofasitinib kullanımına kıyasla günde iki kere 10 mg tofasitinib ile tedavi edilen 65 yaş ve üstü hastalarda ciddi enfeksiyonlarda artış gözlenmiştir (bkz. bölüm 4.4).
Günde iki kez 5 mg tofasitinib, günde iki kez 10 mg tofasitinib ve TNF inhibitörleri için 65 yaş ve üstü hastalarda ciddi enfeksiyon insidans oranları (%95 GA) her 100 hasta-yıl için sırasıyla 4,03 (3,02-5,27), 5,85 (4,64-7,30) ve 3,73 (2,81-4,85)'dur.
TNF inhibitörleri ile karşılaştırıldığında 65 yaş ve üstü hastalarda ciddi enfeksiyonların risk oranı (HR), günde iki kez 5 mg tofatinib ve günde iki kez 10 mg tofasitinib için sırasıyla 1,08 (0,74-1,58) ve 1,55 (1,10-2,19)'dur.
Girişimsel olmayan onay sonrası güvenlilik çalışmasından kaynaklanan ciddi enfeksiyonlar
Bir kayıttan (US Corrona) RA hastalarında tofasitinibi değerlendiren onay sonrası girişimsel olmayan bir güvenlik çalışmasından elde edilen veriler, günde bir kez uygulanan 11 mg tofasitinib için günde iki kez uygulanan 5 mg tofasitinibe kıyasla sayısal olarak daha yüksek ciddi enfeksiyon insidansı gözlemlendiğini göstermiştir.
Tedavinin başlangıcından 12 ay sonra her bir formülasyonun uygunluğundan elde edilen ham insidans oranları (%95 GA) (örneğin yaş ve cinsiyete göre ayarlanmamış) günde bir kez 11 mg tofasitinib ve günde iki kez 5 mg tofasitinib gruplarında sırasıyla 100 hasta yılı başına 3,45 (1,93, 5,69) ve 2,78 (1,74, 4,21) ve 36. ayda 4,71 (3,08, 6,91) ve 2,79 (2,01,
3,77) olaydır. Günde iki kez 5 mg tofasitinibe kıyasla günde 1 kez 11 mg tofasitinib için ayarlanmamış risk oranı 12. ayda 1,30 (%95GA:0,67, 2,50) ve 36. ayda 1,93 (%95GA: 1,15, 3,24)'tür. Veriler, nispeten büyük güven aralıkları ve sınırlı takip süresi ile gözlemlenen olaylara sahip az sayıda hastaya dayanmaktadır.
Viral reaktivasyon
Tofasitinib ile tedavi edilen Japon ve Koreli hastalarda veya daha önce iki veya daha fazla biyolojik DMARD almış olan uzun süreli RA hastalarında, ALC değeri 1,000 hücre/mm'ten az olan hastalarda ve günde iki kere 10 mg doz alan hastalarda herpes zoster riski daha yüksek olabilir (bkz. bölüm 4.4).
En az bir ek kardiyovasküler (KV) risk faktörü görülen, 50 yaşında veya daha büyük romatoid artrit hastalarıyla yapılan geniş (N=4.362), randomize, onay sonrası güvenlilik çalışmasında, TNF inhibitörlerine ve tofasitinib ile tedavi edilen hastalarda herpes zoster olaylarında artış gözlenmiştir (bkz. bölüm 4.4). Günde iki kez 5 mg tofasitinib, günde iki kez 10 mg tofasitinib ve TNF inhibitörleri için herpes zoster insidans oranları (%95 GA) her 100 hasta-yıl için sırasıyla 3,75 (3,22-4,34), 3,94 (3,38-4,57) ve 1,18 (0,90-1,52)'dur.
Laboratuvar testleri Lenfositler
Kontrollü RA klinik çalışmalarında, günde iki kez hem 5 mg hem de 10 mg tofasitinib gruplarında yer alan hastaların %0,3'ünde ALC değerleri 500 hücre/mm seviyesinin altına düşmüş ve %1,9 hastada ise ALC değeri 500-750 hücre/mm arasında çıkmıştır.
Uzun dönem RA güvenlilik popülasyonunda, günde iki kez hem 5 mg hem de 10 mg tofasitinib gruplarında yer alan hastaların %1,3'ünde ALC değerleri 500 hücre/mm seviyesinin altına düşmüş ve %8,4 hastada ise ALC değeri 500-750 hücre/mm arasında çıkmıştır.
ALC değerinin 750 hücre/mm'ün altına inmesi, ciddi enfeksiyonların artışı ile ilişkili bulunmuştur (bkz. bölüm 4.4).
Nötrofiller
Kontrollü RA klinik çalışmalarda, günde iki kez hem 5 mg hem de 10 mg tofasitinib gruplarında yer alan hastaların %0,08'inde ANC değerleri, 1,000 hücre/mm seviyesinin altına düşmüştür. Herhangi bir tedavi grubunda ANC değeri 500 hücre/mm değerinin altına düşmemiştir. Nötropeni ve ciddi enfeksiyonların oluşumu arasında net bir ilişki izlenmemiştir.
Uzun dönem RA güvenlilik popülasyonunda, ANC'deki doğrulanmış düşüş insidansı, kontrollü klinik çalışmalarda görülenle tutarlı bir şekilde seyretmiştir (bkz. bölüm 4.4).
Trombositler
Faz 3 kontrollü klinik çalışmalarda kayıt adına uygun olmak için (RA, PsA, AS) hastaların trombosit düzeyleri ≥100,000 hücre/mm olmalıdır. Bu nedenle, tofasitinib ile tedaviye başlamadan önce trombosit düzeyleri <100,000 hücre/mm olan hastalar için herhangi bir bilgi mevcut değildir.
Karaciğer enzimi testleri
RA hastalarında, karaciğer enzimlerinde normalin üst limitinin (ULN) üç katından daha fazla artış (3xULN) nadiren gözlenmiştir. Karaciğer enzimi artışı görülen bu hastalarda, eşlik eden DMARD dozunun azaltılması, tofasitinib tedavisine ara verilmesi ya da tofasitinib dozunun azaltılması gibi tedavi modifikasyonları, karaciğer enzimi seviyelerinin düşüşü ya da normal hale gelmesi ile sonuçlanmıştır.
RA Faz 3 monoterapi çalışmasının kontrollü bölümünde (0-3 ay) (Çalışma I, bkz. bölüm 5.1), plasebo, tofasitinib günde iki kez 5 mg ve günde iki kez 10 mg alan hastaların sırasıyla
%1,65, %0,41 ve %0'ında >3xULN ALT artışı gözlenmiştir. Bu çalışmada, plasebo,
tofasitinib günde iki kez 5 mg ve günde iki kez 10 mg alan hastaların sırasıyla %1,65,
%0,41 ve %0'ında >3x ULN AST artışı gözlenmiştir.
RA Faz 3 monoterapi çalışmasında (0-24 ay) (VI no.lu çalışma, (bkz. bölüm 5.1), MTX, tofasitinib günde iki kez 5 mg ve 10 mg alan hastaların sırasıyla %7,1, %3,0 ve %3,0'ünde
>3xULN ALT artışı gözlenmiştir. Bu çalışmada, MTX, tofasitinib günde iki kez 5 mg ve günde iki kez 10 mg alan hastaların sırasıyla %3,3, %1,6 ve %1,5'inde >3xULN AST artışı gözlenmiştir.
Eş zamanlı DMARD alan hastaların dahil edildiği RA Faz 3 çalışmalarının kontrollü bölümünde (0-3 ay) (Çalışma II-V, bkz. bölüm 5.1) plasebo, tofasitinib günde iki kez 5 mg ve günde iki kez 10 mg alan hastaların sırasıyla %0,9, %1,24 ve %1,14'ünde >3xULN ALT artışı gözlenmiştir. Bu çalışmalarda plasebo, tofasitinib günde iki kez 5 mg ve günde iki kez 10 mg alan hastaların sırasıyla %0,72, %0,5 ve %0,31'inde >3x ULN AST artışı gözlenmiştir.
Monoterapi ile yapılan uzun dönem RA uzatma çalışmalarında, tofasitinib günde iki kez 5 mg ve günde iki kez 10 mg alan hastaların sırasıyla %1,1 ve %1,4'ünde >3xULN ALT artışı gözlenmiştir. Tofasitinib günde iki kez 5 mg ve günde iki kez 10 mg gruplarının her ikisinde de <%1,0 oranında >3xULN AST artışı gözlenmiştir.
Eş zamanlı DMARD alan hastaların dahil edildiği uzun dönem RA uzatma çalışmalarında,
tofasitinib günde iki kez 5 mg ve günde iki kez 10 mg alan hastaların sırasıyla %1,8 ve
%1,6'sında >3xULN ALT artışı gözlenmiştir. Tofasitinib günde iki kez 5 mg ve günde iki kez 10 mg gruplarının ikisinde de <%1,0 oranında >3xULN AST artışı gözlenmiştir.
En az bir ek kardiyovasküler (KV) risk faktörü görülen, 50 yaşında veya daha büyük romatoid artrit hastalarıyla yapılan geniş (N=4.362), randomize, onay sonrası güvenlilik çalışmasında, ≥3xULN ALT yükselişi günde iki kez tofasitinib 5 mg, günde iki kez tofasitinib 10 mg ve TNF inhibitörleri alan hastalarda sırasıyla %6,01, %6,54 ve %3,77 hastada görülmüştür. ≥3xULN AST yükselişi günde iki kez tofasitinib 5 mg, günde iki kez tofasitinib 10 mg ve TNF inhibitörleri alan hastalarda sırasıyla %3,21, %4,57 ve %2,38 hastada görülmüştür.
Lipidler
Lipid parametrelerindeki artışlar (toplam kolesterol, LDL kolesterol, HDL kolesterol, trigliseritler) ilk olarak kontrollü çift-kör RA klinik çalışmalarında tofasitinib başlanmasından sonraki birinci ayda değerlendirilmiştir. Bu zaman noktasında gözlenen artışlar ardından stabil seyretmiştir.
Kontrollü RA klinik çalışmalarında çalışmanın başlangıcından sonuna kadar (6-24 ay) olan süredeki lipid parametrelerinde ortaya çıkan değişiklikler aşağıda özetlenmiştir:
Ortalama LDL kolesterol değeri 12.ayda tofasitinib günde iki kez 5 mg kolunda %15 ve tofasitinib günde iki kez 10 mg kolunda %20 ve 24. ayda tofasitinib günde iki kez 5 mg kolunda %16 ve tofasitinib günde iki kez 10 mg kolunda %19 artmıştır.
Ortalama HDL kolesterol değeri 12.ayda tofasitinib günde iki kez 5 mg kolunda %17 ve tofasitinib günde iki kez 10 mg kolunda %18 ve 24. ayda tofasitinib günde iki kez 5 mg kolunda %19 ve tofasitinib günde iki kez 10 mg kolunda %20 artmıştır.
Tofasitinib tedavisinin bırakılmasını takiben lipid seviyeleri başlangıç düzeyine dönmüştür.
Tofasitinib ile tedavi edilen hastalarda ortalama LDL/HDL kolesterol oranları ve Apolipoprotein B (ApoB)/ApoAoranları esasen değişmemiştir.
Kontrollü bir RA klinik çalışmasında, LDL kolesterol ve Apo B seviyelerindeki artışlar, statin tedavisi ile tedavi öncesi seviyelere düşmüştür.
Uzun dönem RA güvenlilik popülasyonunda, lipid parametrelerdeki artışlar, kontrollü klinik çalışmalarda gözlenenler ile tutarlı bir şekilde seyretmiştir.
En az bir ek kardiyovasküler (KV) risk faktörü görülen, 50 yaşında veya daha büyük romatoid artrit hastalarıyla yapılan geniş (N=4.362), randomize, onay sonrası güvenlilik çalışmasında 24 ay boyunca lipid parametrelerinde değişiklikler aşağıda özetlenmiştir.
Ortalama LDL kolesterol değerinde artış 12.ayda tofasitinib günde iki kez 5 mg
tofasitinib, günde iki kez 10 mg tofasitinib ve TNF inhibitöründe sırasıyla %13,80,
%17,04 ve %5,50 hastada görülmüştür. 24. ayda artış sırasıyla %12,71, %18,14 ve
%3,64 oranındadır.
Ortalama HDL kolesterol değerinde artış 12.ayda tofasitinib günde iki kez 5 mg
tofasitinib, günde iki kez 10 mg tofasitinib ve TNF inhibitöründe sırasıyla %11,71,
%13,63 ve %2,82 hastada görülmüştür. 24. ayda artış sırasıyla %11,58, %13,54 ve
%1,42 oranındadır.
Miyokardiyal enfarktüsü
Romatoid artrit
50 yaş ve üstü ve en az bir ek kardiyovasküler risk faktörüne sahip RA'lı hastalarda yapılan geniş (N=4,362) randomize ruhsat onayı sonrası güvenlilik çalışmasında, günde iki kez 5
mg tofasitinib, günde iki kez 10 mg tofasitinib ve TNF inhibitörleri için ölümcül olmayan miyokardiyal enfarktüs insidans oranları (%95 GA) her 100 hasta yılı başına sırasıyla 0,37 (0,22, 0,57), 0,33 (0,19, 0,53) ve 0,16 (0,07, 0,31) olaylı hastadır. TNF inhibitörlerine kıyasla tofasitinib ile tedavi edilen hastalarda az sayıda ölümcül miyokardiyal enfarktüsü benzer oranlarda raporlanmıştır (bkz. bölüm 4.4 ve 5.1). Bu çalışma, en az 1500 hastanın 3 yıl boyunca takip edilmesini gerektirmiştir.
NMSC harici maligniteler
Romatoid artrit
50 yaş ve üstü ve en az bir ek kardiyovasküler risk faktörüne sahip RA'lı hastalarda yapılan geniş (N=4,362) randomize ruhsat onayı sonrası güvenlilik çalışmasında, günde iki kez 5 mg tofasitinib, günde iki kez 10 mg tofasitinib ve TNF inhibitörleri için akciğer kanseri insidans oranları (%95 GA) her 100 hasta yılı başına sırasıyla 0,23 (0,12, 0,40), 0,32 (0,18,
0,51) ve 0,13 (0,05, 0,26) olaylı hastadır (bkz. bölüm 4.4 ve 5.1). Bu çalışma, en az 1500 hastanın 3 yıl boyunca takip edilmesini gerektirmiştir.
Günde iki kez 5 mg tofasitinib, günde iki kez 10 mg tofasitinib ve TNF inhibitörleri için lenfoma insidans oranları (%95 GA) her 100 hasta yılı için sırasıyla 0,07 (0,02, 0,18), 0,11
(0,04, 0,24) ve 0,02 (0,00, 0,10) olaylı hastadır (bkz. bölüm 4.4 ve 5.1).
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TUFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35
99)
4.9. Doz aşımı ve tedavisi
XELJANZ XR ile doz aşımı durumunda kullanılabilecek olan spesifik bir antidot bulunmamaktadır. Doz aşımı durumunda hastanın advers reaksiyonlara ilişkin belirti ve bulgular bakımından izlenmesi önerilir.
Sağlıklı gönüllülerde 100 mg'lık tek bir doza kadar olan farmakokinetik veriler, uygulanan dozun %95'inden fazlasının 24 saat içinde elimine edilmesinin beklendiğini göstermektedir.
 Yüksek Tansiyon
Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon
atardamarlarınızdaki kanın basıncıdır.
Yüksek Tansiyon
Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon
atardamarlarınızdaki kanın basıncıdır. |
 Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir.
Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir. |
İLAÇ GENEL BİLGİLERİ
Pfizer İlaçları Ltd.Şti.
| Satış Fiyatı | 11723.11 TL [ 3 May 2024 ] |
| Önceki Satış Fiyatı | 11723.11 TL [ 26 Apr 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8681308031044 |
| Etkin Madde | Tofacitinib |
| ATC Kodu | L04AA29 |
| Birim Miktar | 11 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 28 |
| Antineoplastik ve İmmünomodülatör Ajanlar > İmmünsupresif Ajanlar |
| Yerli ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Artrit Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında artrit tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
 |
Lösemi Kan Kanseri Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür. |
 |
Artrit Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında artrit tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |