VALAMOR 200 mg film kaplı tablet (63 tablet) Farmakolojik Özellikler
{ Ribosiklib }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grubu: Antineoplastik ajanlar, protein kinaz inhibitörleri, sikline bağımlı kinaz (CDK) inhibitörleri
ATC kodu: L01EF02
Etki mekanizması:
Ribosiklib seçici sikline bağımlı kinaz (CDK) 4 ve 6 inhibitörü olup, biyokimyasal analizlerde sırasıyla 0,01 (4,3 ng/ml) ve 0,039 µM'lik (16,9 ng/ml) %50 inhibisyon (IC) değerleri ile sonuçlanır. Bu kinazlar D-sikline bağlanma ile birlikte aktive olurlar ve hücre döngüsü progresyonu ve hücresel proliferasyona yol alan sinyal yolaklarında önemli bir rol oynarlar.
Siklin D-CDK4/6 kompleksi hücre döngüsü progresyonunu, retinoblastoma proteininin (pRb) fosforilasyonu yoluyla regüle eder.
İn vitro ortamda ribosiklib pRb fosforilasyonunu azaltarak hücre döngüsünün G1 fazında durmaya ve meme kanseri hücre dizilerinde hücre proliferasyonunda azalmaya yol açmıştır. İn vivo ortamda tek ajan ribosiklib ile tedavi, iyi tolere edilen dozlarda pRb fosforilasyonunun inhibisyonu ile korelasyon gösteren tümör regresyonuna yol açmıştır.
Hastadan elde edilmiş östrojen reseptör-pozitif meme kanseri ksenogreft modelinin kullanıldığı in vivo çalışmalarda, ribosiklib ve antiöstrojen ajanları (örn. letrozol) kombinasyonu, ajanların tek başına uygulandığı durumla karşılaştırıldığında, kalıcı tümör regresyonu ve doz uygulaması bırakıldıktan sonra yeni tümör büyümesinde gecikme ile birlikte daha iyi bir tümör büyümesi inhibisyonu sağlamıştır. Ek olarak, ZR751 ER+ insan meme kanseri ksenogreftlerini taşıyan ve bağışıklık yetmezliği bulunan farelerde fulvestrant ile kombinasyon halindeki ribosiklibin in vivo anti-tümör aktivitesi değerlendirilmiştir ve fulvestrant ile kombinasyon, tam tümör büyümesi inhibisyonu ile sonuçlanmıştır.
Bilinen ER durumuna sahip meme kanseri hücre hatları paneli test edildiğinde, ribosiklibin ER- olanlara kıyasla ER+ meme kanseri hücre hatlarında daha etkili olduğu gösterilmiştir. Şimdiye kadar test edilen klinik öncesi modellerde, ribosiklib aktivitesi için intakt pRb gerekmiştir.
Kardiyak elektrofizyoloji:
İleri evre kanseri olan hastalarda ribosiklibin QTc aralığı üzerindeki etkisini değerlendirmek için tek dozdan sonra ve kararlı durumda seri, üçlü EKG'ler kaydedilmiştir. Bir farmakokinetik- farmakodinamik analiz, 50-1200 mg aralığında dozlarla ribosiklib ile tedavi edilen 997 hastayı içermiştir. Bu analiz, ribosiklibin QTc aralığında konsantrasyona bağımlı artışlara neden olduğunu düşündürmüştür. NSAI veya fulvestrant ile kombinasyon halindeki 600 mg ribosiklib için başlangıça göre tahmini ortalama QTcF değişimi, tamoksifen ile kombinasyon halinde 34,7 milisaniye (%90 GA: 31,64, 37,78) ile karşılaştırıldığında, sırasıyla kararlı durumdaki geometrik ortalamada C'ta sırasıyla 22 milisaniye (%90 GA: 20,56, 23,44) ve 23,7
milisaniye (%90 GA: 22,31, 25,08) olmuştur (bkz. Bölüm 4.4). Klinik etkililik ve güvenlilik:
Çalışma CLEE011A2301 (MONALEESA-2)
Hormon reseptörü pozitif, HER2 negatif ileri evre meme kanseri olan, ileri evre hastalık için daha önce bir tedavi almamış postmenopozal kadınlarda tek başına letrozole kıyasla ribosiklibin letrozol ile kombine tedavisi randomize, çift kör, plasebo kontrollü, çok merkezli bir faz III klinik çalışmada değerlendirilmiştir.
Toplam 668 hasta, karaciğer ve/veya akciğer metastazlarının varlığına (Var [n=292 (44%)]) kıyasla Yok [n=376 (56%)]) göre stratifiye edilerek 1:1 oranında ribosiklib 600 mg ve letrozol (n=334) veya plasebo ve letrozol (n=334) almak üzere randomize edilmiştir. Demografik özellikler ve başlangıç hastalık karakteristikleri çalışma kolları arasında dengeli ve karşılaştırılabilir nitelikte olmuştur. Ribosiklib, 28 gün süreyle günde bir kez 2,5 mg letrozol ile kombinasyon halinde oral yolla günde bir kez 600 mg dozunda arka arkaya 21 gün verilmiş, ardından 7 gün tedavisiz ara bırakılmıştır. Çalışma süresince veya hastalık progresyonundan sonra hastaların plasebodan ribosiklibe geçiş yapmalarına izin verilmemiştir.
Bu çalışmaya alınan hastaların medyan yaşı 62'dir (aralık 23 - 91). Hastaların %44,2'si 65 yaşın üzerindedir ve bu hastalarında 69'u 75 yaşın üzerindedir. Dahil edilen hastalar beyaz (%82,2), Asyalı (%7,6) ve siyahtır (%2,5). Tüm hastaların ECOG performans durumu 0 veya 1'dir. Ribosiklib kolunda, hastaların %46,6'sı çalışmaya girmeden önce neoadjuvan veya adjuvan
koşullarda kemoterapi görmüştür ve %51,3'ü neoadjuvan veya adjuvan koşullarda anti- hormonal tedavi almıştır. Hastaların %34,1'i de novo hastadır. Hastaların %22'sinde sadece kemiği tutan hastalık ve %58,8'inde visseral hastalık vardır. Daha önce anastrozol veya letrozol ile (neo)adjuvan tedavi görmüş hastalar çalışma randomizasyonundan en az 12 ay önce bu tedaviyi tamamlamış olmalıdır.
Birincil analiz
Çalışma için birincil sonlanım noktası tüm popülasyonda (tüm randomize hastalar) araştırıcı değerlendirmesi temelinde Solid Tümörlerde Yanıt Değerlendirme Kriterleri (RECIST v1.1) kullanılarak hedeflenen progresyonsuz sağkalım (PFS) olaylarının %80'i gözlendikten sonra yürütülmüş planlanan ara analizde karşılanmış ve körlenmiş bağımsız merkezi radyolojik değerlendirme ile doğrulanmıştır.
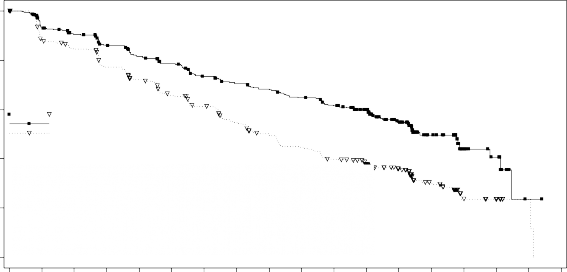
Tam analiz setinde etkililik sonuçları, plasebo artı letrozol alan hastalara kıyasla, ribosiklib artı letrozol kombinasyonu ile tedavi edilen hastalar için klinik olarak anlamlı tedavi etkisi ile PFS'de istatistiksel olarak anlamlı düzelme göstermiştir (tehlike oranı [HR] = 0,556, %95 GA: 0,429, 0,720, tek yönlü stratifiye edilmiş log sıra testi p değeri 0,00000329).
Global sağlık durumu/QoL verileri ribosiklib artı letrozol kolu ve plasebo artı letrozol kolu arasında ilgili bir fark olmadığını göstermiştir.
Tablo 8 ve 9'da etkililik verilerine ilişkin daha olgun bir güncelleme (02 Ocak 2017 veri kesme) sunulmaktadır.
Medyan PFS ribosiklib artı letrozol ile tedavi edilen hastalar için 25,3 ay (%95 GA: 23, 30,3) iken, plasebo artı letrozol alan hastalar için 16 (%95 GA: 13,4, 18,2) aydır. Ribosiklib artı letrozol alan hastaların %54,7'sinin, plasebo artı letrozol alan hastaların ise %35,9'unun 24. ayda progresyonsuz olduğu öngörüldü.
Tablo 8 MONALEESA-2 - Araştırmacının radyolojik değerlendirmesine dayalı etkililik sonuçları (PFS) (02 Ocak 2017 veri kesme)
| Güncellenen analiz | |
| Ribosiklib artı letrozol N=334 | Plasebo artı letrozol N=334 |
Progresyonsuz sağkalım | ||
Medyan PFS [ay] (%95 GA) | 25,3 (23 â 30,3) | 16 (13,4 â 18,2) |
Tehlike oranı (%95 GA) | 0,568 (0,457 - 0,704) | |
p değeri | 9,63x10 | |
GA=güven aralığı; N=hasta sayısı; PFS = Progresyonsuz sağkalım | ||
Şekil 1 MONALEESA-2 - Araştırmacının değerlendirmesine dayalı PFS'nin Kaplan- Meier grafiği (02 Ocak 2017 veri kesme)
|
|
|
|
|
|
|
|
|
|
|
|
| |||||
Önceden belirlenmiş alt grup PFS analizleri serisi prognostik faktörler ve başlangıç özellikleri temelinde tedavi etkisinin tutarlılığını araştırmak üzere yürütülmüştür. Yaş, ırk, önceki adjuvan veya neo adjuvan kemoterapi veya hormonal tedaviler, karaciğer ve/veya akciğer tutulumu ve sadece kemiğe metastaz yapan hastalığı içeren tüm bireysel hasta alt gruplarında hastalık progresyonu veya ölüm riskinde ribosiklib artı letrozol kolu lehine bir azalma gözlenmiştir. Bu, karaciğer ve/veya akciğer metastazları olan hastalar için (HR 0,561 [%95 GA: 0,424, 0,743], medyan progresyonsuz sağkalım [mPFS] ribosiklib artı letrozol için 24,8 ay ve tek başına letrozol için 13,4 ay) ya da karaciğer ve/veya akciğer metastazları olmayan hastalar için (HR 0,597 [%95 GA: 0,426, 0,837], mPFS 27,6 aya karşılık 18,2 ay) belirgindir.
Genel yanıt ve klinik fayda oranları için güncellenmiş bulgular Tablo 9'da gösterilmektedir.
Tablo 9 MONALEESA-2 - Araştırmacı değerlendirmesine dayalı etkililik sonuçları (ORR, CBR) (02 Ocak 2017 veri kesme)
Analiz | Ribosiklib artı letrozol (%, %95 GA) | Plasebo artı letrozol (%, %95 GA) | p değeri |
Tam analiz seti | N=334 | N=334 |
|
Genel yanıt oranı | 42,5 (37,2; 47,8) | 28,7 (23,9; 33,6) | 9,18 Ã 10 |
Klinik fayda oranı | 79,9 (75,6; 84,2) | 73,1 (68,3; 77,8) | 0,018 |
Ölçülebilir hastalığı olan hastalar | N=257 | N=245 |
|
Genel yanıt oranı | 54,5 (48,4; 60,6) | 38,8 (32,7;44,9) | 2,54 Ã 10 |
Klinik fayda oranı | 80,2 (75,3; 85) | 71,8 (66,2; 77,5) | 0,018 |
Nihai genel sağkalım analizi
Genel çalışma popülasyonunda bu nihai genel sağkalım analizinden bulgular Tablo 10 ve Şekil 2'de sunulmaktadır.
Tablo 10 MONALEESA-2- Etkililik bulguları (OS) (10 Haziran 2021 veri kesme)
Genel sağkalım, genel çalışma popülasyonu | Ribosiklib artı letrozol N=334 | Plasebo artı letrozol N=334 |
Olay sayısı â n [%] | 181 (54,2) | 219 (65,6) |
Medyan OS [ay] (%95 GA) | 63,9 (52,4; 71) | 51,4 (47,2; 59,7) |
Tehlike oranı (%95 GA) | 0,765 (0,628; 0,932) | |
p-değeri | 0,004 | |
OS olaysız oran, (%) (%95 GA) |
| |
24 ay | 86,6 (82,3; 89,9) | 85 (80,5; 88,4) |
60 ay | 52,3 (46,5; 57,7) | 43,9 (38,3; 49,4) |
72 ay | 44,2 (38,5; 49,8) | 32 (26,8; 37,3) |
GA = güven aralığı IRT'ye göre akciğer ve/veya karaciğer metastazları durumuna göre yürütülen sınıflandırma | ||
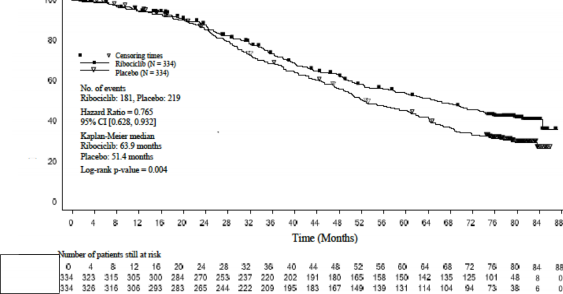
Şekil 2 MONALEESA-2- Genel popülasyonda OS'nin Kaplan-Meier grafiği (10 Haziran 2021 veri kesme)
Log-sıra testi ve Cox PH modeli IRT'ye göre karaciğer ve/veya akciğer metastazları durumuna göre sınıflandırılır.
Tek taraflı P-değeri sınıflandırılmış log-sıra testinden elde edilir.
Çalışma CLEE011E2301 (MONALEESA-7)
Ribosiklib, randomize çift kör, plasebo kontrollü, çok merkezli bir faz III klinik çalışmada, hormon reseptörü pozitif, HER2-negatif ilerlemiş meme kanseri olan premenopozal ve perimenopozal kadınların tedavisinde, NSAI veya tamoksifen artı goserelin ile kombinasyon halinde, bir NSAI veya tamoksifen artı goserelin ile kombinasyon halinde plasebo karşısında değerlendirilmiştir. MONALEESA-7'deki hastalar ilerlemiş meme kanseri için önceden endokrin tedavisi görmemişlerdir.
Toplam 672 hasta, karaciğer ve/veya akciğer metastazlarının varlığına (Var [n=344 (%51,2)] karşısında Yok [n=328 (%48,8)]), ilerlemiş hastalık için önceki kemoterapi (Var [n=120 (%17,9)] karşısında Yok [n=552 (%82,1)]) ve endokrin kombinasyon partneri (NSAI ve goserelin [n=493 (%73,4)] karşısında tamoksifen ve goserelin [n=179 (%26,6)]) göre katmanlandırılarak 1:1 oranında ya ribosiklib 600 mg artı NSAI/tamoksifen artı goserelin (n=335) ya da plasebo artı NSAI/tamoksifen artı goserelin (n=337) almak üzere randomize edilmiştir. Demografik özellikler ve çalışma başlangıcı hastalık karakteristikleri çalışma kolları arasında dengeli ve birbirine yakın olmuştur. Ribosiklib, 28 gün süreyle günde bir kez oral yolla NSAI (letrozol 2,5 mg veya anastrozol 1 mg) veya tamoksifen (20 mg) ve 28 günde bir subkutan yolla goserelin (3,6 mg) ile kombinasyon halinde, hastalık progresyonuna veya kabul edilemez toksisiteye kadar oral yolla günde bir kez 600 mg dozunda arka arkaya 21 gün verilmiş, ardından 7 gün tedavisiz ara bırakılmıştır. Çalışma sırasında veya hastalık progresyonundan sonra hastaların plasebodan ribosiklibe geçiş yapmalarına izin verilmemiştir. Endokrin kombinasyon partnerlerinin değiştirilmesine de izin verilmemiştir.
Bu çalışmaya kaydedilen hastaların medyan yaşı 44 yıldır (aralık: 25 ila 58) ve hastaların
%27,7'si 40 yaşın altındadır. Dahil edilen hastaların çoğu Beyaz (%57,7), Asyalı (%29,5) veya Siyahtır (%2,8) ve neredeyse tüm hastaların (%99) başlangıç ECOG performans durumu 0 veya 1'dir. Çalışmaya giriş öncesinde bu 672 hastanın %14'ü önceden metastatik hastalık için
kemoterapi görmüş, %32,6'sı adjuvan ve %18'i neoadjuvan koşullarda kemoterapi almış, ve
%39,6'sı adjuvan ve %0,7'si neoadjuvan koşullarda endokrin tedavisi almıştır. Çalışma E2301'de hastaların %40,2'sinde de novo metastatik hastalık, %23,7'sinde sadece kemiği tutan hastalık ve %56,7'sinde visseral hastalık söz konusudur.
Çalışma, tam analiz setinde (randomize edilen tüm hastalar) araştırmacı değerlendirmesine dayanan ve RECIST v1.1 kriterleri kullanılarak 318 progresyonsuz sağkalım (PFS) olayından sonra gerçekleştirilen birincil analizde birincil sonlanım noktasına ulaşmıştır. Birincil etkililik sonuçları, körlenmiş bağımsız merkezi radyolojik değerlendirmeye dayalı PFS sonuçlarıyla desteklenmiştir. Birincil PFS analizi tarihinde medyan takip süresi 19,2 ay olmuştur.
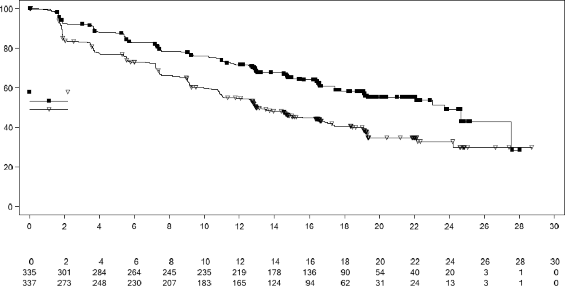
Genel çalışma popülasyonunda etkililik sonuçları, plasebo artı NSAI/tamoksifen artı goserelin kullanan hastalar ile karşılaştırıldığında ribosiklib artı NSAI/tamoksifen artı goserelin kullanan hastalarda, klinik olarak anlamlı bir tedavi etkisiyle birlikte PFS'de istatistiksel olarak anlamlı bir düzelme göstermiştir (Tehlike Oranı: 0,553, %95 GA: 0,441, 0,694, tek yanlı katmanlandırılmış log sıra testi p değeri 9,83x10). Medyan PFS, ribosiklib artı NSAI/tamoksifen artı goserelin ile tedavi edilen hastalarda 23,8 ay (%95 GA: 19,2, NE) ve plasebo artı NSAI/tamoksifen artı goserelin verilen hastalarda 13 ay (%95 GA: 11, 16,4) olmuştur.
PFS için dağılımı, Şekil 3'te, PFS için Kaplan-Meier eğrisinde özetlenmektedir.
Şekil 3 MONALEESA-7 â Genel popülasyonda PFS'nin araştırmacı değerlendirmesine dayalı Kaplan-Meier grafiği
Randomize edilen hastaların yaklaşık %40'ından rastgele seçilmiş bir alt grubun körlenmiş bağımsız merkezi radyolojik değerlendirmesine dayalı PFS sonuçları, araştırmacı değerlendirmesine dayalı birincil etkililik sonuçlarını destekler nitelikte olmuştur (Tehlike Oranı: 0,427; %95 GA: 0,288, 0,633).
Birincil PFS analizi tarihinde genel sağkalım verileri hazır olmayıp 89 (%13) ölüm (Tehlike Oranı: 0,916 [%95 GA: 0,601, 1,396]) söz konusu olmuştur.
RECIST v1.1'e göre araştırmacı değerlendirmesine dayalı genel yanıt oranı (ORR) ribosiklib kolunda (%40,9; %95 GA: 35,6, 46,2), plasebo kolundan daha yüksek bulunmuştur (%29,7;
%95 GA: 24,8, 34,6, p=0,00098). Gözlenen klinik fayda oranı (CBR), plasebo kolu (%69,7;
%95 GA: 64,8:74,6, p=0,002) ile karşılaştırıldığında ribosiklib kolunda (%79,1; %95 GA:
74,8:83,5) daha yüksektir.
NSAI artı goserelin ile kombinasyon halinde ribosiklib veya plasebo alan 495 hastanın önceden tanımlanmış alt grup analizinde, medyan PFS ribosiklib artı NSAI alt grubunda 27,5 ay (%95 GA: 19,1, NE) ve plasebo artı NSAI alt grubunda 13,8 ay (%95 GA: 12,6, 17,4) bulunmuştur
[Tehlike Oranı: 0,569; %95 GA: 0,436, 0,743]. Etkililik sonuçları Tablo 11'de özetlenmekte ve PFS için Kaplan-Meier eğrileri Şekil 4'te verilmektedir.
Tablo 11 MONALEESA-7 â NSAI alan hastalarda etkililik sonuçları (PFS)
| Ribosiklib + NSAI + goserelin N=248 | Plasebo + NSAI + goserelin N=247 |
Progresyonsuz sağkalım |
|
|
Medyan PFS [ay] (%95 GA) | 27,5 (19,1; NE) | 13,8 (12,6 â 17,4) |
Tehlike oranı (%95 GA) | 0,569 (0,436; 0,743) | |
GA=güven aralığı; N=hasta sayısı; NE = Hesaplanabilir değil. | ||
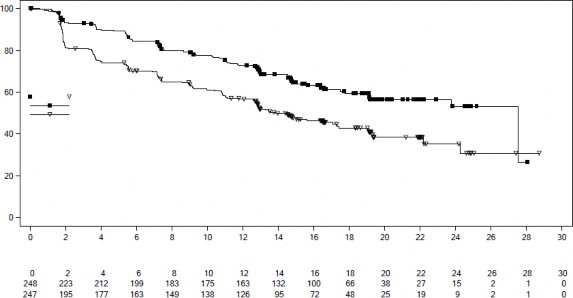
Şekil 4 MONALEESA-7 â NSAI alan hastalarda PFS'nin araştırmacı değerlendirmesine dayalı Kaplan-Meier grafiği
Genel yanıt oranı (ORR) etkililik sonuçları ve RECIST v1.1'e dayalı araştırmacı değerlendirmesine göre klinik fayda oranı (CBR) Tablo 12'de verilmektedir.
Tablo 12 MONALEESA-7 â NSAI alan hastalarda araştırmacı değerlendirmesine dayalı etkililik sonuçları (ORR, CBR)
Analiz | Ribosiklib artı NSAI artı goserelin (%, %95 GA) | Plasebo artı NSAI artı goserelin (%, %95 GA) |
Tam analiz seti | N=248 | N=247 |
Genel yanıt oranı (ORR) | 39,1 (33; 45,2) | 29,1 (23,5; 34,8) |
Klinik fayda oranı (CBR) | 80,2 (75,3; 85,2) | 67,2 (61,4; 73,1) |
Ölçülebilir hastalığı olan hastalar | N=192 | N=199 |
Genel yanıt oranı | 50,5 (43,4; 57,6) | 36,2 (29,5; 42,9) |
Klinik fayda oranı | 81,8 (76,3; 87,2) | 63,8 (57,1; 70,5) |
Ribosiklib artı NSAI alt grubundaki sonuçlar yaş, ırk, önceki adjuvan/ neoadjuvan kemoterapi veya hormonal tedaviler, karaciğer ve/veya akciğer tutulumu ve sadece kemiği tutan metastatik hastalığı içeren farklı alt gruplar genelinde tutarlı olmuştur.
Genel sağkalım verilerinin daha olgun bir güncellemesi (veri kesme tarihi 30 Kasım 2018) Tablo 13 ve Şekil 5 ve 6'da verilmektedir.
İkinci OS analizinde çalışma, OS'de istatistiksel olarak anlamlı bir iyileşme göstererek anahtar ikincil sonlanım noktasını karşılamıştır.
Tablo 13 MONALEESA-7 â Etkililik sonuçları (OS) (veri kesme tarihi 30 Kasım 2018)
| Güncellenmiş analiz | |
Genel sağkalım, genel çalışma popülasyonu | Ribosiklib 600 mg N= 335 | Plasebo N=337 |
Olay sayısı â n [%] | 83 (24,8) | 109 (32,3) |
Medyan OS [ay] (%95 GA) | NE (NE;NE) | 40,9 (37,8; NE) |
Tehlike oranı ( %95 GA) | 0,712 (0,535;0,948) | |
p-değeri | 0,00973 | |
Genel sağkalım, NSAI alt grubu | Ribosiklib 600 mg N=248 | Plasebo N=247 |
Olay sayısı - n [%] | 61 (24,6) | 80 (32,4) |
Medyan OS [ay] (%95 GA) | NE (NE; NE) | 40,7 (37,4; NE) |
Tehlike oranı (%95 GA) | 0,699 (0,501;0,976) | |
GA= güven aralığı, NE = tahmin edilemez, N = hasta sayısı; | ||
Şekil 5 MONALEESA-7: Son OS analizinin Kaplan Meier grafiği (veri kesme tarihi 30 Kasım 2018)
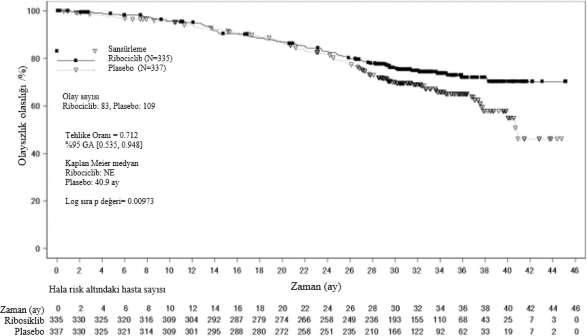
Log-sıra testi ve Cox modeli akciğer ve/veya karaciğer metastazı, ileri evre hastalık için önceki kemoterapi ve IRT başına endokrin kombinasyon partneri ile stratifiye edilmiştir.
Şekil 6 MONALEESA-7: NSAI alan hastalarda son OS analizinin Kaplan Meier grafiği
(veri kesme tarihi 30 Kasım 2018)
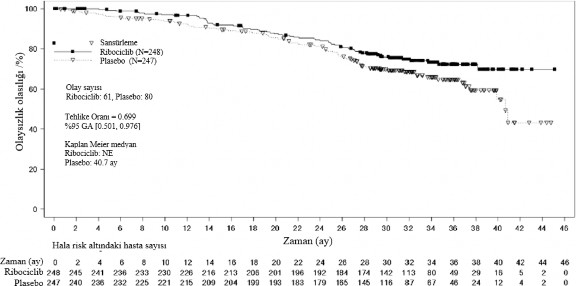
Tehlike oranı stratifiye edilmemiş Cox modeline dayanmaktadır.
Ek olarak, genel çalışma popülasyonundaki 0,692 HR değeri (%95 GA: 0,548, 0,875) ile bu çalışmada daha önce ribosiklib alan hastalarda sonraki basamak tedavide progresyon veya ölüm (PFS2) olasılığı, plasebo kolundaki hastalara göre daha düşük olmuştur. Medyan PFS2, plasebo kolunda 32,3 ay bulunmuştur (%95 GA: 27,6, 38,3) ve ribosiklib kolunda ulaşılmamıştır (%95 GA: 39,4, NE). NSAI alt grubu için benzer sonuçlar gözlenmiş, HR değeri 0,660 (%95 GA: 0,503, 0,868) ile medyan PFS2 plasebo kolunda 32,3 ay olurken (%95 GA: 26,9, 38,3), ribosiklib kolunda ulaşılmamıştır (%95 GA: 39,4, NE).
Çalışma CLEE011F2301 (MONALEESA-3)
Ribosiklib, 2:1 randomize çift kör, plasebo kontrollü, çok merkezli bir faz III klinik çalışmada, önceden endokrin tedavi almamış ya da sadece bir basamak endokrin tedavi almış hormon reseptörü pozitif, HER2-negatif ileri evre meme kanseri olan 726 postmenopozal kadının tedavisinde, tek başına fulvestrant karşısında fulvestrant ile kombinasyon halinde değerlendirilmiştir.
Bu çalışmaya kaydedilen hastaların medyan yaşı 63'tür (aralık 31 - 89). Hastaların %46,7'si 65 yaş ve üzeri olup bunlar arasında 75 yaş ve üzeri hasta oranı %13,8'dir. Dahil edilen hastalar beyaz (%85,3), Asyalı (%8,7) veya siyahtır (%0,7) ve neredeyse tüm hastaların (%99,7) ECOG performans durumu 0 veya 1'dir. Bu çalışmaya birinci ve ikinci basamak hastalar kaydedilmiştir (hastaların %19,1'inde de novo metastatik hastalık söz konusudur). Çalışmaya giriş öncesinde hastaların %42,7'si adjuvan ve %13,1'i neoadjuvan koşullarda kemoterapi almış, %58,5'i adjuvan ve %1,4'ü neoadjuvan koşullarda endokrin tedavisi almış, %21'i ise ilerlemiş meme kanseri koşullarında önceden endokrin tedavisi görmüştür. Çalışma F2301'de %21,2'sinde sadece kemiği tutan hastalık ve %60,5'inde visseral hastalık söz konusudur.
Birincil analiz
Çalışma, tam analiz setinde (randomize edilen tüm hastalar, veri kesme tarihi: 3 Kasım 2017) araştırmacı değerlendirmesine dayanan ve RECIST v1.1 kriterleri kullanılarak 361 progresyonsuz sağkalım (PFS) olayından sonra gerçekleştirilen birincil analizde birincil sonlanım noktasına ulaşmıştır. Birincil PFS analizi tarihinde medyan takip süresi 20,4 ay olmuştur.
Birincil etkililik sonuçları, tam analiz setinde plasebo artı fulvestrant alan hastalar ile karşılaştırıldığında ribosiklib artı fulvestrant alan hastalarda, progresyon veya ölüm bağıl riskinde ribosiklib artı fulvestrant kolu lehine tahmini %41'lik azalmayla, PFS'de istatistiksel olarak anlamlı bir düzelme göstermiştir (tehlike oranı: 0,593, %95 GA: 0,480, 0,732, tek yanlı stratifiye edilmiş log sıra testi p değeri 4,1x10).
Birincil etkililik bulguları körlenmiş bir bağımsız merkezi radyolojik değerlendirme ile %40 görüntüleme alt setinin rastgele merkezi denetimi ile desteklenmiştir (tehlike oranı 0,492; %95 GA: 0,345, 0,703).
İkinci OS ara analizi zamanında PFS için tanımlayıcı bir güncelleme yürütülmüş olup, genel popülasyon ve önceki endokrin tedaviye göre alt gruplarda güncellenmiş PFS bulguları Tablo 14'te özetlenmektedir ve Kaplan-Meier eğrisi Şekil 7'de sunulmaktadır.
Tablo 14 MONALEESA-3(F2301) â Araştırmacı değerlendirmesine dayalı güncellenmiş etkililik PFS sonuçları (veri kesme tarihi 3 Haziran 2019)
| Ribosiklib + fulvestrant N=484 | Plasebo + fulvestrant N=242 |
Progresyonsuz sağkalım genel çalışma popülasyonu | ||
Olay sayısı â n [%] | 283 (58,5) | 193 (79,8) |
Medyan PFS [ay] (%95 GA) | 20,6 (18,6; 24) | 12,8 (10,9 â 16,3) |
Tehlike oranı (%95 GA) | 0,587 (0,488; 0,705) | |
Birinci basamak alt grubu | Ribosiklib + fulvestrant N=237 | Plasebo + fulvestrant N=128 |
Olay sayısı â n [%] | 112 (47,3) | 95 (74,2) |
Medyan PFS [ay] (%95 GA) | 33,6 (27,1; 41,3) | 19,2 (14,9; 23,6) |
Tehlike oranı (%95 GA) | 0,546 (0,415; 0,718) | |
İkinci basamak veya erken relaps alt grubu | Ribosiklib + fulvestrant N=237 | Plasebo + fulvestrant N=109 |
Olay sayısı â n [%] | 167 (70,5) | 95 (87,2) |
Medyan PFS [ay] (%95 GA) | 14,6 (12,5; 18,6) | 9,1 (5,8;11) |
Tehlike oranı (%95 GA) | 0,571 (0,443;0,737) | |
GA=güven aralığı; daha önce endokrin tedavi almamış de novo ileri evre meme kanserli hastalar ve (neo)adjuvan endokrin tedavisinin tamamlanmasından 12 ay sonra relaps olmuş hastalar hastalığı adjuvan tedavi sırasında veya (neo)adjuvan endokrin tedavisinin tamamlanmasından sonraki 12 ay içinde relaps olmuş hastalar ve ileri hastalık için bir basamak endokrin tedaviden sonra progresyon göstermiş hastalar | ||
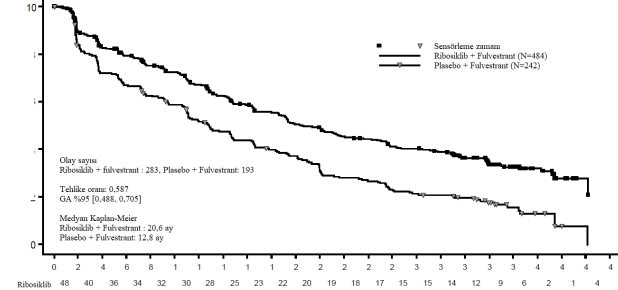
Olaysızlık oranı (%)
Şekil 7 MONALEESA-3 (F2301)â PFS için Araştırmacı değerlendirmesine dayalı Kaplan-Meier grafiği (Veri kesme tarihi: 3 Haziran 2019)
Genel yanıt oranı (ORR) ve RECIST v1.1'e dayalı araştırmacı değerlendirmesine göre klinik fayda oranı (CBR) için etkililik sonuçları Tablo 15'te verilmektedir.
Tablo 15 MONALEESA-3 â Araştırmacı değerlendirmesine dayalı etkililik sonuçları (ORR, CBR) (3 Kasım 2017 veri kesme)
Analiz | Ribosiklib + fulvestrant (%, %95 GA) | Plasebo + fulvestrant (%, %95 GA) |
Tam analiz seti | N=484 | N=242 |
Genel yanıt oranı (ORR) | 32,4 (28,3; 36,6) | 21,5 (16,3;26,7) |
Klinik fayda oranı (CBR) | 70,2 (66,2; 74,3) | 62,8 (56,7;68,9) |
Ölçülebilir hastalığı olan hastalar | N=379 | N=181 |
Genel yanıt oranı | 40,9 (35,9; 45,8) | 28,7 (22,1; 35,3) |
Klinik fayda oranı | 69,4 (64,8;74) | 59,7 (52,5; 66,8) |
Ribosiklib artı fulvestrant ile tedavi edilen hastaların önceden tanımlanmış alt grup analizine dayalı tehlike oranları yaş, önceki tedavi (erken veya ilerlemiş), önceki adjuvan/neoadjuvan kemoterapi veya hormonal tedaviler, karaciğer ve/veya akciğer tutulumu ve sadece kemiği tutan metastatik hastalığı içeren farklı alt gruplar genelinde tutarlı fayda göstermiştir.
Genel Sağkalım Analizi
İkinci genel sağkalım analizinde, çalışma ikincil sonlanım noktasını sağlayarak, genel sağkalımda istatistiksel olarak anlamlı bir iyileşme göstermiştir.
Genel çalışma popülasyonunda ve alt gruplar analizinde bu nihai genel sağkalım analizinden elde edilen bulgular Tablo 16 ve Şekil 8'de sunulmaktadır.
Tablo 16 MONALEESA-3 (F2301) etkililik bulguları (OS) (Veri kesme tarihi: 03- Haz-2019)
| Ribosiklib + fulvestrant | Plasebo + fulvestrant |
Genel çalışma popülasyonu | N=484 | N=242 |
Olay sayısı â n [%] | 167 (34,5) | 108 (44,6) |
Medyan OS [ay] (%95 GA) | NE, (NE;NE) | 40 (37;NE) |
HR (%95 GA) | 0,724 (0,568; 0,924) | |
p-değeri | 0,00455 | |
Birinci basamak alt grubu | n=237 | n=128 |
Olay sayısı â n [%] | 63 (26,6) | 47 (36,7) |
HR (%95 GA) | 0,700 (0,479;1,021) | |
İkinci basamak veya erken relaps alt grubu | n=237 | n=109 |
Olay sayısı â n [%] | 102 (43) | 60 (55) |
HR (%95 GA) | 0,730 (0,530; 1,004) | |
NE = Hesaplanamaz | ||
ve 0,025'lik bir genel anlam düzeyi için Lan-DeMets (O'Brien-Fleming) alfa-harcama fonksiyonu ile tayin edildiği üzere 0,01129'luk bir eşiğe karşı kıyaslanır.
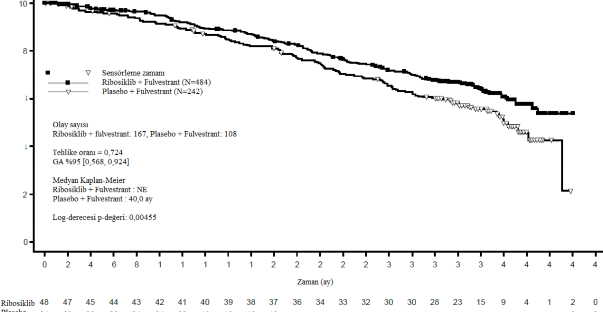
Şekil 8 MONALEESA-3 (F2301) OS Kaplan-Meier grafiği (tam analiz seti [FAS]) (Veri kesme tarihi: 3 Haziran 2019)
Log-sıra testi ve Cox modeli akciğer ve/veya karaciğer metastazları, ileri hastalık için önceki kemoterapi ve IRT'ye göre endokrin kombinasyonu partnerine göre tabakalandırılır.
Ribosiklib kolundaki hastalarda bir sonraki basamak tedavide progresyona veya ölüme (PFS2) kadar geçen süre, genel çalışma popülasyonunda plasebo kolundaki hastalara kıyasla daha uzundur (HR: 0,670 [%95 GA: 0,542, 0,830]). Medyan PFS2, ribosiklib kolu için 39,8 ay (%95
GA: 32,5, NE), plasebo kolunda 29,4 aydır (%95 GA: 24,1, 33,1).
Yaşlı hastalar
MONALEESA-2 ve MONALEESA-3 çalışmalarında ribosiklib alan tüm hastaların temsili oranları ≥65 yaş ve ≥75 yaş arasındadır (bkz. Bölüm 5.1). Bu hastalar ile daha genç hastalar arasında ribosiklibin güvenliliği ve etkililiği bakımından genel farklılıklar gözlenmemiştir (bkz. Bölüm 4.2).
Böbrek yetmezliği olan hastalar
Üç pivot çalışmada (MONALEESA-2, MONALEESA-3 ve MONALEESA-7), normal böbrek fonksiyonu olan 510 (% 53,8) hasta, hafif böbrek yetmezliği olan 341 (%36) hasta ve orta derecede böbrek yetmezliği olan 97 (% 10,2) hasta ribosiklib ile tedavi edilmiştir. Şiddetli böbrek yetmezliği olan hastalar, çalışmalara dahil edilmemiştir. Normal böbrek fonksiyonu olanlara kıyasla, 600 mg başlangıç dozunda ribosiklib alan hafif ve orta derecede böbrek yetmezliği olan hastalarda progresyonsuz sağkalım sonuçları tutarlıdır. Güvenlilik profili, renal kohortlar arasında genel olarak tutarlıdır (bkz. Bölüm 4.8).
5.2. Farmakokinetik özellikler
Genel özelliklerRibosiklibin farmakokinetiği, ilerlemiş meme kanseri olan hastalarda 50 mg ila 1200 mg'lık günlük oral dozlarından sonra incelenmiştir. Sağlıklı gönüllülere 400 mg ile 600 mg arasında tek oral dozlar veya tekrarlı 400 mg dozları (8 gün) verilmiştir.
Emilim:
Ribosiklibin mutlak biyoyararlanımı bilinmemektedir.
Ribosiklib oral kullanımın ardından C'a ulaşma zamanı (T) 1-4 saat arasında olmuştur. Ribosiklib, test edilen doz aralığında (50 - 1200 mg) maruziyette (Cve EAA) oransal değerin biraz üzerinde artışlar sergilemiştir. Tekrarlanan günlük tek doz uygulamaları sonrasında kararlı durumuma genellikle 8 gün sonra ulaşılmıştır ve ribosiklib, 2,51 geometrik ortalama birikme oranı (aralık: 0,97-6,4) ile birikme göstermiştir.
Besin etkisi
Açlık durumu ile karşılaştırıldığında, ribosiklib film kaplı tabletin tek bir 600 mg dozunun yüksek oranda yağ içeren yüksek kalorili bir öğün ile birlikte oral yolla uygulanmasının, ribosiklibin emilim hızı ve ölçüsü üzerinde herhangi bir etkisi olmamıştır.
Dağılım:
Ribosiklibin insan plazma proteinlerine bağlanması in vitro ortamda yaklaşık %70 bulunmuştur ve konsantrasyondan bağımsız olmuştur (10 - 10000 ng/ml). Ribosiklib kırmızı kan hücreleri ile plazma arasında eşit dağılmış, in vivo ortamda kan-plazma oranı 1,04 bulunmuştur. Popülasyon farmakokinetik analizine dayanılarak kararlı durumda görünür dağılım hacmi (Vss/F) 1090 litredir.
Biyotransformasyon:
In vitro ve in vivo çalışmalar ribosiklibin insanda ağırlıklı olarak CYP3A4 aracılığıyla olmak üzere geniş ölçüde hepatik metabolizma ile eliminasyona uğradığını göstermiştir. [C] ribosiklibin 600 mg'lık tek dozunun insanlara oral uygulanmasından sonra ribosiklib için ana metabolik yolaklar, oksidasyonu (dealkilasyon, C ve/veya N-oksijenasyon, oksidasyon (-2H)) ve bunların kombinasyonlarını içermiştir. Ribosiklib faz 1 metabolitlerinin faz II konjügatları N-asetilasyon, sülfasyon, sistein konjügasyonu, glikozilasyon ve glukuronidasyonu içermiştir. Ribosiklib, plazmadaki başlıca dolaşan ilaç kaynaklı entite olmuştur. Dolaşımdaki başlıca metabolitler metabolit M13 (CCI284, N-hidroksilasyon), M4 (LEQ803, N-demetilasyon) ve M1'i (ikincil glukuronid) içermiştir. Ribosiklibin klinik aktivitesi (farmakolojik ve güvenlilik) başta ana ilaç kaynaklı olmuş, dolaşımdaki metabolitlerin göz ardı edilebilir katkısı olduğu görülmüştür.
Ribosiklib geniş ölçüde metabolize olmuş olup, değişmemiş ilaç feçes ve idrarda sırasıyla
%17,3 ve %12,1'e karşılık gelmiştir. Metabolit LEQ803 dışkıda önemli bir metabolit olmuş ve feçes ve idrarda sırasıyla uygulanan dozun yaklaşık %13,9 ve %3,74'ünü temsil etmiştir. Gerek feçes gerekse idrarda sayısız başka metabolit de minör miktarlarda tespit edilmiştir (uygulanan dozun ≤ %2,78'i).
Eliminasyon:
İlerlemiş kanseri olan hastalarda 600 mg'da kararlı durumda geometrik ortalama plazma efektif yarılanma ömrü (birikme oranına dayalı) 32 saat (%63 CV) ve geometrik ortalama görünür oral klirens (CL/F) 25,5 l/saat (%66 CV) bulunmuştur. Sağlıklı gönüllülerdeki çalışmalarda 600 mg
dozunda ribosiklibin geometrik ortalama görünür plazma terminal yarılanma ömrü (T) 29,7 ile 54,7 saat, ribosiklibin geometrik ortalama CL/F değeri ise 39,9 ila 77,5 l/saat aralığında olmuştur.
Ribosiklib ve metabolitleri renal yolağın küçük bir katkısı ile ağırlıklı olarak feçes ile elimine olur. 6 sağlıklı erkek gönüllüde, tek bir oral [C] ribosiklib dozunun uygulanmasından sonra uygulanan toplam radyoaktivitenin %91,7'si 22 gün içinde tespit edilmiştir; feçes ana atılma yolu olup (%69,1) dozun %22,6'sı idrarda tespit edilmiştir.
Doğrusallık/doğrusal olmayan durum:
Ribosiklib, test edilen 50 ila 1200 mg doz aralığında hem tek hem de tekrarlı dozlardan sonra maruziyette (Cve EAA) oransal değerin biraz üzerinde artışlar sergilemiştir. Bu analiz doz gruplarının çoğu için küçük örneklem büyüklükleri ile sınırlıdır ve verilerin çoğu 600 mg doz grubundan gelmektedir.
Hastalardaki karakteristik özellikler
Özel popülasyonlar Böbrek bozukluğu
Böbrek fonksiyonunun ribosiklib farmakokinetiği üzerindeki etkisi 400 mg'lık tek bir ribosiklib dozunda, normal böbrek fonksiyonuna sahip (mutlak GFR [aGFR] ≥90 ml/dakika)14 sağlıklı gönüllü ile hafif böbrek yetmezliği (aGFR 60 ila <90 ml/dakika) olan 8, orta derece böbrek yetmezliği olan (aGFR 30 ile <60 ml/dakika) 6, şiddetli böbrek yetmezliği olan (aGFR 15 ila
<30 ml/dakika) 7 gönüllünün ve son dönem böbrek hastalığı (aGFR <15 ml/dakika) olan (SDBY) 3 hastanın dahil edildiği bir böbrek yetmezliği çalışmasında değerlendirilmiştir.
Normal böbrek fonksiyonu olan gönüllülerde maruz kalmaya göre hafif, orta ve şiddetli böbrek yetmezliği olan hastalarda EAA1,6 kat, 1,9 kat ve 2,7 kat ve C1,8 kat, 1,8 kat ve 2,3 kat artmıştır. Ribosiklibin etkililik ve güvenlilik çalışmaları, hafif böbrek yetmezliği olan hastaların büyük bir kısmını kapsadığından (bkz. Bölüm 5.1), böbrek yetmezliği çalışmasında orta veya şiddetli böbrek yetmezliği olan gönüllülerden elde edilen veriler, normal böbrek fonksiyonu olan ve hafif renal yetmezliği olan gönüllülere ait birleştirilmiş verilerle karşılaştırılmıştır. Normal böbrek fonksiyonu ve hafif böbrek yetmezliği olan gönüllülere ait birleştirilmiş verilerle karşılaştırıldığında, orta ve şiddetli böbrek yetmezliği olan hastalarda EAAsırasıyla 1,6 kat ve 2,2 kat ve Cise 1,5 kat ve 1,9 kat artmıştır. Az sayıda denek nedeniyle SDBY'li denekler için bir kat farkı hesaplanmamıştır, ancak sonuçlar şiddetli böbrek yetmezliği olan deneklere kıyasla ribosiklib maruziyetinde benzer veya biraz daha büyük bir artışa işaret etmektedir.
Böbrek fonksiyonunun ribosiklib farmakokinetiği üzerindeki etkisi, hastalara 600 mg başlangıç dozunun verildiği etkinlik ve güvenlik çalışmalarına dahil edilen kanser hastalarında da değerlendirilmiştir (bkz. Bölüm 5.1). 600 mg ribosiklibin tek doz veya tekrarlı dozlar halinde oral uygulamasını takiben kanser hastalarında yapılan çalışmalardan elde edilen farmakokinetik verilerin bir alt grup analizinde, hafif (n=57) veya orta (n=14) böbrek yetmezliği olan hastalarda ribosiklibin EAAve Cdeğerleri, normal böbrek fonksiyonu olan hastalardaki (n=86) EAAve Cile karşılaştırılabilir olup, hafif veya orta derecede böbrek yetmezliğinin ribosiklib maruziyeti üzerinde klinik olarak anlamlı bir etkisi olmadığını düşündürmektedir.
Karaciğer bozukluğu
Karaciğer bozukluğu olan kansersiz gönüllülerde yürütülen bir farmakokinetik çalışmaya dayanılarak, hafif karaciğer bozukluğunun ribosiklib maruziyetine herhangi bir etkisi olmamıştır (bkz. bölüm 4.2). Ribosiklib için ortalama maruziyet, orta şiddetli (geometrik ortalama oran [GMR]: Ciçin 1,44; EAAiçin 1,28) ve şiddetli (GMR: Ciçin 1,32; EAAiçin 1,29) karaciğer bozukluğu olan hastalarda iki kattan az artış göstermiştir (bkz. Bölüm 4.2).
Normal karaciğer fonksiyonuna sahip 160 meme kanserli hasta ve hafif karaciğer bozukluğuna sahip 47 hastayı içeren bir popülasyon farmakokinetiği analizine dayanılarak, hafif karaciğer bozukluğunun ribosiklib maruziyetine herhangi bir etkisi olmayarak spesifik karaciğer bozukluğu çalışmasının bulgularını desteklemiştir. Ribosiklib orta şiddette veya şiddetli hepatik bozukluğu olan meme kanseri hastalarında araştırılmamıştır.
Yaş, ağırlık, cinsiyet ve ırkın etkisi
Popülasyon farmakokinetik analizi yaş, beden ağırlığı veya cinsiyetin ribosiklibin sistemik maruziyetinde doz ayarlaması gerektirebilecek bir etkisinin olmadığını göstermiştir. Farmakokinetikte ırka bağlı değişikliklerin verileri sonuca varabilmek için çok sınırlıdır.
In vitro etkileşimler
Ribosiklibin sitokrom P450 enzimleri üzerindeki etkisi
İn vitro, ribosiklib klinik açıdan ilgili konsantrasyonlarda CYP1A2, CYP2E1 ve CYP3A4/5'in geri dönüşümlü inhibitörü ve CYP3A4/5'in zamana bağımlı inhibitörüdür. İn vitro değerlendirmeler ribosiklibin klinik açıdan ilgili konsantrasyonlarda CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19 ve CYP2D6'nın aktivitelerini inhibe etme potansiyeline sahip olmadığını göstermiştir. Ribosiklib CYP1A2, CYP2C9 ve CYP2D6'nın zamana bağımlı inhibisyonu için potansiyele sahip değildir.
İn vitro veriler ribosiklibin UGT enzimlerini veya CYP enzimleri CYP2C9, CYP2C19 ve CYP3A4'ü PXR ile indükleme potansiyeline sahip olmadığını göstermektedir. Bu nedenle, VALAMOR'un bu enzimlerin substratlarını etkilemesi olası değildir. İn vitro veriler CAR aracılığıyla CYP2B6'yı indükleme potansiyelini dışlamak için yeterli değildir.
Transporterlerin ribosiklib üzerindeki etkisi
Ribosiklib, in vitroda P-gp için bir substrattır; fakat kütle denge verilerine dayalı olarak, P-gp veya BCRP inhibisyonunun terapötik dozlarda ribosiklib maruziyetini etkileme olasılığı yoktur. Ribosiklib in vitroda, karaciğer alım transporterleri OATP1B1, OATP1B3 veya OCT-1'nin bir substratı değildir.
Ribosiklibin transporterler üzerindeki etkisi:
İn vitro değerlendirmeler, ribosiklibin, ilaç transporterleri P-gp, BCRP, OATP1B1/1B3, OCT1, OCT2, MATE1 ve BSEP'nin aktivitelerini inhibe etme potansiyeline sahip olduğuna işaret etmiştir. Ribosiklib in vitroda klinik açıdan önemli konsantrasyonlarda OAT1, OAT3 veya MRP2'yi inhibe etmemiştir.
5.3. Klinik öncesi güvenlilik verileri
Güvenlilik farmakolojisi
Köpeklerdeki in vivo kardiyak güvenlilik çalışmalarında, önerilen 600 mg dozundan sonra hastalarda elde edilmesi beklenecek maruziyette doz ve konsantrasyon ile ilişkili QTc aralığı
uzaması gösterilmiştir. Artmış maruziyetlerde (beklenen klinik C'ın yaklaşık 5 katı) prematür ventriküler kontraksiyon (PVC'ler) olaylarını tetikleme potansiyeli de mevcuttur.
Tekrarlı doz toksisitesi
Sıçanlarda 27 haftaya ve köpeklerde 39 haftaya varan tekrarlı doz toksisitesi çalışmaları (3 haftalık tedavi/1 haftalık tedavisiz tedavi planı), ribosiklib toksisitesinin ana hedef organı olarak hepatobiliyer sistemi göstermiştir (proliferatif değişiklikler, kolestaz, kum benzeri safra taşı ve koyu safra). Tekrarlı doz çalışmalarında ribosiklibin farmakolojik etkisi ile ilişkili hedef organlar kemik iliğini (hiposellülerite), lenfoid sistem (lenfoid deplesyonu), intestinal mukoza (atrofi), deri (atrofi), kemik (azalmış kemik formasyonu), böbrek (tübüler epitel hücrelerde eş zamanlı dejenerasyon ve rejenerasyon) ve testisi (atrofi) içermiştir. Testiste görülen geri dönüşlülük eğilimi göstermiş atrofik değişikliklerin yanı sıra diğer tüm değişiklikler 4 haftalık tedavisiz periyottan sonra tamamen geri dönüşlü olmuştur. Bu etkiler, testiküler germ hücreler üzerinde, seminiferöz tübüllerde atrofi ile sonuçlanan doğrudan anti-proliferatif etki ile bağlantılı olabilir. Toksisite çalışmalarında hayvanlarda ribosiklibe maruziyet genellikle 600 mg/gün (EAA bazında) çoklu dozları alan hastalarda gözlenenden küçük veya eşit olmuştur.
Üreme toksisitesi/Fertilite
Ribosiklib, sıçanda veya tavşanda maternal toksisite göstermeyen dozlarda fetotoksisite ve teratojenisite göstermiştir. Prenatal maruziyetten sonra EAA bazında en yüksek önerilen doz olan 600 mg/gün dozunda, sırasıyla insandaki maruziyetten daha düşük düzeylerde veya insandaki maruziyetin 1,5 katında ribosiklib ile sıçanlarda daha yüksek implantasyon sonrası kayıp ve azalmış fetal ağırlık insidansları gözlenmiştir ve ribosiklib tavşanlarda teratojeniktir.
Sıçanlarda, geçici olarak değerlendirilmiş ve/veya düşük fetal ağırlıkla ilişkilendirilmiş iskelet değişikliklerinin eşlik ettiği azalmış fetal ağırlık tespit edilmiştir. Tavşanlarda, embriyofetal gelişim üzerine, fetal anomaliler (malformasyonlar ve dış, iç organ ve iskelet varyantları) ve fetal büyüme (daha düşük fetal ağırlıklar) insidansında artış ile kanıtlanmış olan advers etkiler olmuştur. Bu bulgular azalmış/küçük akciğer loblarını ve aort arkında ek damarı ve diyafram fıtığını, aksesuar lobun olmamasını veya (kısmen) kaynaşmış akciğer loblarını ve azalmış/küçük aksesuar akciğer lobunu (30 ve 60 mg/kg), ekstra/ rudimenter onüçüncü kaburgayı ve şekilsiz hiyoid kemiğini ve polekste azalmış parmak kemiği sayısını içermiştir. Herhangi bir embriyofetal mortalite göstergesi söz konusu olmamıştır.
Dişi sıçanlardaki bir fertilite çalışmasında ribosiklib, 300 mg/kg/güne kadarki dozlarda (olasılıkla, EAA bazında en yüksek önerilen doz olan 600 mg/gün dozunda hastalardaki klinik maruziyetten daha düşük veya eşit bir maruziyette) üreme fonksiyonunu, fertiliteyi ya da erken dönem embriyonik gelişimi etkilememiştir.
Ribosiklib erkek fertilitesi çalışmalarında değerlendirilmemiştir. Bununla birlikte, sıçan ve köpek toksisite çalışmalarında, EAA bazında en yüksek önerilen doz olan 600 mg/gün dozundaki maruziyetin altında veya bu maruziyete eşit düzeylerde, testislerde atrofik değişiklikler bildirilmiştir.
Bu etkiler, testiküler germ hücreler üzerinde, seminiferöz tübüllerde atrofi ile sonuçlanan doğrudan anti-proliferatif etki ile bağlantılı olabilir.
Ribosiklib ve metabolitleri sıçan sütüne kolaylıkla geçmiştir. Ribosiklibe maruziyet sütte plazmadıkinden daha yüksektir.
Genotoksisite
Bakteriyel in vitro sistemlerde ve memeli in vivo ve in vitro sistemlerde metabolik aktivasyon içeren veya içermeyen genotoksisite çalışmaları, ribosiklibin genotoksik potansiyeline ilişkin herhangi bir kanıt ortaya koymamıştır.
Karsinojenez
Ribosiklib, sıçanlarda yapılan 2 yıllık bir çalışmada karsinojenite açısından değerlendirilmiştir.
Ribosiklibin 2 yıl boyunca oral yoldan ≥300 mg/kg/gün dozlarda verilmesi, dişi sıçanların uterusunda/serviksinde endometriyal epitelyal tümörler ve glandüler ve skuamöz hiperplazi insidansında artışa ve 50 mg/kg/gün dozunda verilmesi ise erkek sıçanların tiroid bezinde foliküler tümörlerde insidansta artışa neden olmuştur. Neoplastik değişikliklerin görüldüğü dişi ve erkek sıçanlarda kararlı durumda (EAA) ortalama maruziyet, hastalarda önerilen 600 mg/gün dozunda elde edilenin sırasıyla 1,2 ve 1,4 katıdır. Neoplastik değişikliklerin görüldüğü dişi ve erkek sıçanlarda kararlı durumda ortalama maruziyet (EAA), hastalarda 400 mg/gün dozunda elde edilenin sırasıyla 2,2 ve 2,5 katı olmuştur.
Ek neoplastik olmayan proliferatif değişiklikler, artan karaciğer değiştirilmiş odakları (bazofilik ve berrak hücreli) ve erkek sıçanlarda testiküler interstisyel (Leydig) hücre hiperplazisini, sırasıyla ≥5 mg/kg/gün ve 50 mg/kg/gün dozlarında içermiştir.
Rahim/serviks ve testiküler interstisyel (Leydig) hücreler üzerindeki etkiler, hipofiz bezinde laktotrofik hücre fonksiyonunun CDK4 inhibisyonuna bağlı olarak hipotalamus-hipofiz- gonadal ekseni değiştiren uzun süreli hipoprolaktinemi ile ilişkili olabilir.
Erkeklerde tiroid bulguları için potansiyel mekanizmalar, karaciğerde kemirgenlere özgü bir mikrozomal enzim indüksiyonunu ve/veya persistan hedefli (on-target) bir hipoprolaktinemiye ikincil olarak hipotalamus-hipofiz-testis-tiroid ekseninin disregülasyonunu içerir.
Bu mekanizma ile insanlarda östrojen/progesteron oranındaki herhangi bir potansiyel artış, ribosiklibin insanlarda östrojen seviyesini azaltan tedavilerle kombinasyon halinde kullanım endikasyonu olduğu gibi, östrojen sentezi üzerindeki eş zamanlı anti-östrojen tedavisinin bir inhibitör etkisi ile telafi edilecektir.
Prolaktin sentezi ve rolü açısından kemirgenler ve insanlar arasındaki önemli farklılıklar göz önüne alındığında, bu etki biçiminin insanlarda sonuçları olması beklenmemektedir.
 Dış Gebelik
Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep
olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan
bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur.
Dış Gebelik
Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep
olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan
bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur. |
 Ağız Kanseri
Ağız kanserinin en yaygın türleri, dudak, dil, dişetidir. Nadiren
yanak içi veya damak bölgelerini de içine alır.
Ağız Kanseri
Ağız kanserinin en yaygın türleri, dudak, dil, dişetidir. Nadiren
yanak içi veya damak bölgelerini de içine alır. |
İLAÇ GENEL BİLGİLERİ
Farmanova Sağlık Hizmetleri Ltd. Şti
| Satış Fiyatı | 19712.74 TL [ 10 Jul 2023 ] |
| Önceki Satış Fiyatı | 19354.33 TL [ 3 Jul 2023 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699074090721 |
| Etkin Madde | Ribosiklib |
| ATC Kodu | L01EF02 |
| Birim Miktar | 200 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 63 |
| Antineoplastik ve İmmünomodülatör Ajanlar |
| İthal ( ref. ülke : Fransa ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Kalp Krizi Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
 |
Mide Kanseri Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir. |
 |
Grip, Soğuk Algınlığı ve Öksürük Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |