TIOSIVAR 18 mcg inhilasyon tozu sert kapsül (30 kapsül) Kısa Ürün Bilgisi
{ Tiotropium Bromur Monohidrat }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
TİOSİVAR 18 mcg İnhalasyon Tozu, Sert Kapsül
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her inhalasyon tozu kapsülü, 18 mikrogram tiotropium' a eşdeğer, 21,66 mikrogram tiotropium bromür içerir
Yardımcı maddeler
Yardımcı madde olarak, kapsül başına 12,478 mg laktoz (inek sütü kaynaklıdır) içermektedir.
3. FARMASÖTİK FORMU
Beyaz ya da beyazımsı toz içeren kapsüller.
KLİNİK OZELLİKLER
4.1. Terapötik endikasyonlar
Tiotropium bromür, orta ve ağır KOAH (kronik obstruktif akciğer hastalığı) olgularında düzenli kullanıldığında atak sıklığını azaltmakta, semptomları ve yaşam kalitesini düzeltebilmekte, ancak uzun dönemdeki FEVdüşüşünü değiştirmemektedir.
4.2. Pozoloji ve uygulama şekli
Erişkinler4.2. Pozoloji ve uygulama şekli
ErişkinlerTİOSİVAR' ın önerilen dozu, günde bir kez bir kapsül içeriğinin inhale edilmesidir. Önerilen dozdan daha fazla ilaç kullanılmamalıdır.
Uygulama sekli:
Sadece inhalasyon yoluyla kullanılır. Kapsüller ağızdan yutulmaz.
İlacın uygun şekilde uygulandığından emin olmak için, bir doktor veya başka bir sağlık profesyoneli tarafından inhalerin nasıl kullanılacağı hastaya gösterilmelidir. Kuru toz inhalerlerin (DPI) doğru kullanımı tedavinin başarısı için gereklidir. Hastaya kullanma talimatını dikkatlice okumaları ve kullanım talimatları ve talimattaki resimli şemaları izlemeleri önerilir.
Hastaların jelatin kapsülün parçalanabileceğini ve küçük jelatin parçalarının inhalasyondan sonra ağız veya boğaz bölgesine ulaşabileceğini bilmesi önemlidir. Hastaya jelatinin zararsız olduğu, ağızda yumuşayacağı ve yutulabildiği söylenmelidir. Kapsülü bir defadan fazla delmemek suretiyle parçalanma olasılığı asgari düzeye indirilebilir.
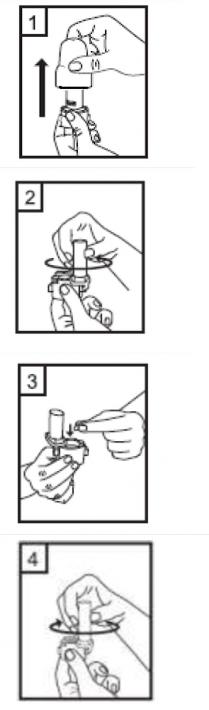
|
1-Kapağı çekip çıkarınız. |
| 2-Kapsül bölmesini açınız. Cihazın tabanını sıkıca tutup, açmak için cihazın üst tarafında bulunan ok yönünde çeviriniz. |
| 3-Parmaklarınızın tamamen kuru olduğundan emin olunuz. Ambalajından bir kapsül çıkarınız ve bu kapsülü cihazın tabanındaki kapsül bölmesine yatık olarak yerleştiriniz. Kapsülleri, kullanımdan hemen önce ambalajından çıkarmanız önemlidir.
ÖNEMLİ: Kapsülü ağızlığın içerisine yerleştirmeyiniz! |
| 4-Ağızlığı âklikâ sesi duyana kadar geri çevirerek kapalı duruma getiriniz.. |
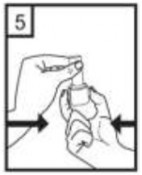
| 5-Tozu kapsülden serbest bırakmak için:
Lütfen dikkat: Bu aşamada jelatin kapsül parçalanabilir ve soluma sırasında küçük jelatin parçaları ağzınıza veya boğazınıza gelebilir. Fakat jelatin yenilebilir nitelikte olduğundan zararsızdır. |
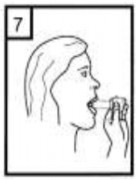
| 6-Nefesinizi kuvvetlice dışarı verin. |
| 7-Ağız parçasını ağzınıza yerleştirin ve başınızı hafifçe geriye doğru eğiniz. Dudaklarınız ile ağızlığı sıkıca sarınız. Olabildiğince hızlı, duraksamadan ve alabildiğiniz kadar derin nefes alınız.
Lütfen dikkat: Nefes alma sırasında, kapsül, kapsül haznesinde titreşir ve bir ses (vızıltı) oluşur. Bu sesi duymadıysanız kapsülün, kapsül bölmesinde sıkışıp sıkışmadığını kontrol ediniz. Bu durumda cihazı açınız ve kapsülü bölmesinde oynatarak gevşetiniz. Daha sonra 7. basamağı tekrarlayınız. Kapsülü sıkıştığı yerden kurtarmak için düğmelere tekrar tekrar BASMAYINIZ. |
Cihazı dik tutun (ağız parçası yukarıda olacak şekilde)
Kenarlardaki iki kulakçığa (düğmelere) AYNI ANDA ve SADECE BİR KEZ basıp bırakınız. Böylelikle cihazdaki kapsülü delmiş oldunuz.
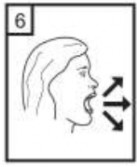
| 8- Cihazın içerisinden nefes aldıktan sonra, nefesinizi olabildiğince tutunuz ve cihazı ağzınızdan çıkarınız. Sonra burnunuzdan nefes veriniz. Kapsül bölmesini açınız ve kapsülde toz kalıp kalmadığını kontrol ediniz. Eğer kalmış ise 6-8 basamakları tekrarlayınız. |
| 9-Kullandıktan sonra boş kapsülü çıkartın ve atınız. Doktorunuzun önerisi doğrultusunda aynı işlemleri diğer kapsül için de tekrarlayınız. |
Temizleme:
Temizleme talimatları için hastalara Kullanma Talimatını dikkatlice okumaları önerilmelidir. Toz kalıntılarını temizlemek için ağız parçasını ve kapsül haznesini KURU ve temiz bir bez ile silin. Temiz yumuşak bir fırça da bu amaçla kullanılabilir.
Cihazı temizlemek için SU KULLANMAYIN.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek yetmezliği: Böbrekleri bozuk olan hastalar TİOSİVAR'ı önerilen dozlarda kullanabilirler. Orta ila şiddetli böbrek yetmezliği olan hastalarda (kreatinin klerensi ≤50 ml/dk) TİOSİVAR kullanımı yakından izlenmelidir (Bkz. 4.4 ve 5.2).
Karaciğer yetmezliği:
Karaciğerleri bozuk olan hastalar TİOSİVAR'ı önerilen dozlarda kullanabilirler (Bkz.5.2).
Pediyatrik popülasyon:
18 yaşından küçük hasta grubunda KOAH durumunda TİOSİVAR' ın kullanım alanı yoktur.
TİOSİVAR' ın kistik fibrozda, çocuklar ve adolesanlardaki güvenliği ve etkinliliği belirlenmemiştir. Bu konuda veri yoktur.
Geriyatrik popülasyon:
Yaşlı hastalar TİOSİVAR' ı önerilen dozlarda kullanabilirler.
4.3. Kontrendikasyonlar
TİOSİVAR, tiotropium bromüre, atropin veya türevlerine, örn. ipratropium ya da oksitropium veya bu ilacın bileşenlerinden herhangi birine karşı aşırı duyarlılık öyküsü olan hastalarda kontrendikedir (Bkz. Bölüm 2 ve Bölüm 6.1; Yardımcı maddeler).
4.4. Özel kullanım uyarıları ve önlemleri
TİOSİVAR, günde bir kez kullanılan bir idame tedavisi bronkodilatörüdür, akut bronkospazm epizotlarının başlangıç tedavisinde, yani kurtarma tedavisi şeklinde kullanılmamalıdır.
TİOSİVAR uygulamasından sonra ani aşırı duyarlılık reaksiyonları oluşabilir.
Diğer antikolinerjik ilaçlarla olduğu gibi, TİOSİVAR dar-açılı glokomu kötüleştirebileceğinden, prostat hiperplazisi ya da mesane boynu obstrüksiyonu bulunan hastalarda idrar güçlüğü oluşturabileceğinden bu hastalarda dikkatle kullanılmalıdır.
İnhalasyon yoluyla alınan ilaçlar, inhalasyonun indüklediği bronkospazma neden olabilirler.
Yeni (<6 ay) miyokard enfarktüsü geçiren hastalarda; stabil olmayan veya yaşamı tehdit edici veya
girişim gerektiren veya son 1 yıl içinde tedavisinde değişiklik yapılmış kardiyak aritmi durumlarında; son 1 yıl içinde kalp yetmezliği nedeniyle (NYHA Sınıf III veya IV) hastaneye yatırılan hastalarda dikkatli kullanılmalıdır. Bu hastalar klinik çalışmalara dahil edilmemiştir ve bu koşullar antikolinerjik etki mekanizmasından etkilenebilir.
Renal fonksiyonlardaki azalmaya bağlı olarak plazma konsantrasyonu arttığı için, orta ile şiddetli böbrek yetmezliği olan hastalarda (kreatinin klerensi ≤ 50 mL/dk) TİOSİVAR, sadece beklenen yararlar potansiyel risklere göre daha üstünse kullanılmalıdır. Şiddetli böbrek yetmezliği olan hastalarda uzun süreli deneyim yoktur (Bkz. 5.2).
Hastalara, TİOSİVAR'ın doğru bir şekilde nasıl kullanılacağı öğretilmelidir. Hastalara tozun göze kaçmaması için dikkatli olmaları öğütlenmelidir. Bu ilacın göze kaçması durumunda, dar- açılı glokomunun ortaya çıkabileceği veya kötüye gidebileceği, konjonktivada konjesyon veya korneada ödem sonucunda gelişen göz kızarmasıyla birlikte gözde ağrı veya rahatsızlık hissi, geçici bulanık görme, haleler veya renkli görüntüler görme, akut dar açılı glokom belirtileri olabileceği konusunda hasta bilgilendirilmelidir. Bu semptomlar herhangi bir kombinasyonu
gelişirse, hasta ilacı kesmeli ve hemen bir uzman hekime başvurmalıdır. Miyotik göz damlalarının, etkili bir tedavi sağlamadıkları kabul edilmektedir.
Antikolinerjik ilaçlarla gözlenen agız kuruluğu uzun dönemde diş çürüklerine yol açabilir. TİOSİVAR günde bir defadan daha sık kullanılmamalıdır (Bkz. 4.9).
TİOÜMİT kapsülleri yalnızca inhaler cihazı ile kullanılmalıdır.
TİOSİVAR laktoz içermektedir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktaz yetmezliği ya da glikoz-galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Düzenli ilaç etkileşimi çalışmaları yürütülmemiş olmakla birlikte, tiotropium bromür inhalasyon tozu, KOAH tedavisinde yaygın olarak kullanılan diğer ilaclar ile beraber, ilaç etkileşimine yönelik klinik bulgular görülmeksizin kullanılmıştır; sempatomimetik bronkodilatatorler, metilksantinler, oral ve inhale steroidler, bu ilaçlar arasındadır.
Uzun etkili beta agonistlerin veya inhale kortikosteroidlerin tiotropium maruziyetini değiştirmediği bulunmuştur.
TİOSİVAR' ın diğer antikolinerjik içeren ilaçlarla birlikte uygulanması henüz çalışılmamıştır ve bu nedenle önerilmemektedir.
Özel popülasyonlara ilişkin ek bilgiler:
Özel veri bulunmamaktadır.
Pediyatrik popülasyon:
Özel veri bulunmamaktadır.
4.6. Gebelik ve laktasyon
Genel tavsiye: Gebelik kategorisi C'dir.
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon): Çocuk doğurma potansiyeli bulunan kadınlar, tedavi süresince tıbben etkili olduğu kabul edilen doğum kontrol yöntemleri kullanmalıdır.
Gebelik dönemi: Gebe kadınlarda kullanımına ilişkin yeterli ve iyi kontrollü çalışmalara dayanan veri mevcut değildir. Hayvanlar çalışmaları, klinik olarak ilgili dozlarda üreme toksisitesi açısından direk veya indirek zararlı etkilere işaret etmemiştir (Bkz. 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. TİOSİVAR, olası yararlar fetüs üzerindeki olası riske üstün olmadıkça, gebelik döneminde kullanılmamalıdır.
Laktasyon dönemi: Tiotropium bromürün insanlarda süte geçip geçmediği bilinmemektedir. Laktasyondaki kemirgenlerde yapılan çalışmalarda, az miktarda tiotropiumun süte geçtiği belirlenmiştir. Bununla birlikte, TİOSİVAR emziren annelerde önerilmez. Tiotropium bromür uzun etkili bir maddedir. Emzirmenin kesilip kesilmeyeceği veya TİOSİVAR tedavisine devam edilip edilmeyeceği kararı, emmenin bebeğe olan yararları ve TİOSİVAR tedavisinin anneye yararları birlikte değerlendirilerek verilmelidir.
Üreme yeteneği/Fertilite: Tiotropium için fertilite ile ilgili klinik veri yoktur. Tiotropium ile yürütülen bir klinik dışı çalışmada, fertilite açısından, herhangi bir advers reaksiyon görülmemiştir (Bkz. 5.3). Tavşanlar ve sıçanlardaki üreme çalışmalarında gebelik, embriyo/fetal geilşim, doğum ve doğum sonrası gelişime yönelik zararlı etkiler, yalnızca anne için toksik olan doz düzeylerinde gösterilebilmiştir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
Araç ve makine kullanma becerileri üzerindeki etkilerine yönelik bir çalışma yapılmamıştır. Baş dönmesi ve bulanık görme olaylarının ortaya çıkması, araç ve makine kullanma becerilerini etkileyebilir.
4.8. İstenmeyen etkiler
Güvenlilik profili özeti
Listelenmiş olan istenmeyen etkilerin çoğu, TİOSİVAR' ın antikolinerjik özelliklerine bağlanabilir.
Advers reaksiyonların tablolu özeti
Aşağıda listelenen advers ilaç reaksiyonları için belirlenen sıklıklar, dört hafta ile dört yıl arasında değişen tedavi dönemlerini kapsayan 28 plasebo kontrollü klinik araştırmaya ait havuzun
tiotropium grubunda (9,647 hasta) gözlenen advers reaksiyonların ham (crude) insidans oranlarına (yani, tiotropium atfedilen olaylar) dayanmaktadır.
Aşağıdaki listede belirtilen istenmeyen etkilerin sıklık oranları şöyle tanımlanır: Çok yaygın ≥ 1/10
Yaygın ≥ 1/100 ilâ < 1/10
Yaygın olmayan ≥ 1/1.000 ilâ < 1/100 Seyrek ≥ 1/10.000 ilâ < 1/1.000
Çok seyrek < 1/10.000
Bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor)
Metabolizma ve beslenme hastalıkları
Bilinmiyor: Dehidratasyon
Sinir sistemi hastalıkları
Yaygın olmayan: Baş dönmesi, baş ağrısı, tat alma bozuklukları Seyrek: Uykusuzluk
Göz hastalıkları
Yaygın olmayan: Bulanık görme
Seyrek: Glokom, göz içi basıncında artış
Kardiyak hastalıklar
Yaygın olmayan: Atriyal fibrilasyon
Seyrek: Supraventriküler taşikardi, taşikardi, palpitasyonlar
Solunum, göğüs bozuklukları ve mediyastinal hastalıklar
Yaygın olmayan: Farenjit, disfoni, öksürük
Seyrek: Bronkospazm, burun kanaması, larenjit, sinüzit
Gastro-intestinal hastalıklar
Yaygın: Ağız kuruluğu
Yaygın olmayan: Stomatit, gastroözofajiyal reflü hastalığı, konstipasyon, bulantı
Seyrek: İntestinal obstrüksiyon (paralitik ileus dahil), gingivit, glossit, orofarenjiyal kandidiyazis, disfaji
Bilinmiyor: Diş çürümesi
Deri ve derialtı dokusu hastalıkları- Bağışıklık sistemi hastalıkları
Yaygın olmayan: Döküntü
Seyrek: Aşırı duyarlılık reaksiyonları (ani reaksiyonlar dahil), ürtiker, kaşıntı Bilinmiyor: Anjiyonörotik ödem, deri infeksiyonu ve deri ülseri, deride kuruluk
Kas-iskelet, bağ dokusu ve kemik hastalıkları
Bilinmiyor: Eklemlerde şişme
Böbrek ve idrar hastalıkları
Yaygın olmayan: İdrar retansiyonu, idrar yapmada güçlük Seyrek: İdrar yolu enfeksiyonu
Seçilmiş advers reaksiyonların açıklaması
Kontrollü klinik çalışmalarda yaygın olarak gözlenen istenmeyen etkiler, hastaların yaklaşık
%4'ünde ortaya çıkan ağız kuruluğu gibi antikolinerjik etkilerdir. 28 klinik çalışmada tiotropium ile tedavi edilen 9.647 hastanın 18' i (%0.2). Ağız kuruluğu nedeniyle çalışmayı bırakmıştır.
Antikolinerjik etkilerle tutarlı ciddi istenmeyen etkiler arasında, glokom, konstipasyon, paralitik ileus dahil intestinal obstrüksiyon ve idrar retansiyonu bulunur.
Diğer özel popülasyonlar
İlerleyen yaşla birlikte antikolinerjik etkilerde artış görülebilir.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirilmeleri gerekmektedir. (www.titck.gov.tr; e-posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
Yüksek dozlarda TİOSİVAR, antikolinerjik bulgu ve semptomlara yol açabilir.
Ancak, sağlıklı gönüllülerde 340 mikrogram tiotropium dozuna kadar inhale edilen tek doz sonrasında, hiçbir sistemik antikolinerjik istenmeyen etki görülmemiştir. Ek olarak, sağlıklı gönüllülerde 170 mikrogram doza kadar tiotropium bromürün 7 gün uygulanmasını takiben ağız kuruluğu dışında ilgili bir advers etki gözlenmemiştir. KOAH hastalarında yapılan çoklu doz bir çalışmada, 4 hafta boyunca günlük maksimum 43 mikrogram tiotropium bromür uygulanması ile önemli bir istenmeyen etki gözlenmemiştir.
Sağlıklı gönüllülerde, günde bir kez 141 mg dozunda tekrarlı inhalasyonları izleyerek, ağız kuruluğu ile birlikte bilateral konjonktivit görülmüş ve bu durum tedavi halen sürmekte iken ortadan kaybolmuştur. KOAH' ı olan kişilerde dört hafta süreyle, günlük maksimum 36 mikrogram tiotropium dozları ile uygulanan çok-dozlu bir çalışmada gözlenen tiotropiuma bağlanabilecek tek istenmeyen olay, ağız kuruluğu olmuştur.
Tiotropium kapsüllerinin oral yoldan alınması ile akut intoksikasyon pek olası değildir, çünkü oral yoldan biyoyararlanımı düşüktür.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Obstruktif akciğer hastalıkları için diğer ilaçlar, inhalerler, Antikolinerjikler, tiotropium
ATC kodu: R03B B04
Etki mekanizması
Tiotropium, klinik tıpta genellikle antikolinerjik olarak adlandırılan, uzun etkili spesifik bir muskarinik reseptör antagonistidir. Tiotropium bromür, bronşiyal düz kaslarda bulunan muskarinik reseptörlere bağlanarak, parasempatik sinir uçlarından salıverilen asetilkolinin kolinerjik (bronkokonstrüktif) etkilerini inhibe eder. M'den M'e kadar olan muskarinik reseptör alt-tiplerine karşı benzer bir afinite gösterir. Hava yollarında, düz kasta bulunan Mreseptörlerini kompetetif ve geri dönüşümlü olarak inhibe ederek gevşeme sağlar. Antagonizmanın yarışmacı ve geri-dönüşümlü olduğu, insan ve hayvan kaynaklı reseptörlerde ve izole organ preparatlarında gösterilmiştir. Klinik öncesi in vitro ve in vivo çalışmalarda, bronkoprotektif etkiler doza bağımlı olmuş ve 24 saatten daha uzun sürmüştür. Etkisinin uzun süreli oluşu, muhtemelen Mreseptörlerinden son derecede yavaş ayrışmasına bağlıdır; ipratropium ile gözlenenden anlamlı derecede daha uzun bir ayrışma yarı ömrüne sahiptir. N-kuaterner bir antikolinerjik olarak tiotropium, inhalasyon yoluyla uygulandığında, topikal olarak (bronko-) selektiftir; sistemik antikolinerjik etkilere yol açmadan önce kabul edilebilir bir terapötik aralık gösterir.
Farmakodinamik etkiler
Tiotropium inhalasyonunu izleyen bronkodilatasyon, esas olarak bölgeye özgü (havayolları üzerinde) bir etki olup, sistemik bir etki değildir.
Mreseptörlerinden ayrışması, Mreseptörlerindekinden daha hızlıdır. Fonksiyonel in vitro çalışmalarda (kinetik olarak kontrol edilmiş), Mreseptörleri için reseptör alt tip selektivitesinin Mreseptörlerinden fazla olduğu gösterilmiştir. Yüksek düzeydeki potens ve reseptörden yavaş ayrışmanın klinikteki karşılığı, KOAH' lı kişilerdeki belirgin ve uzun etkili bronkodilatasyondur.
Kardiyak elektrofizyoloji
Elektrofizyoloji: QT için özel olarak tasarlanmış ve 53 sağlıklı gönüllüyü kapsayan bir çalışmada, 12 gün boyunca 18 mcg ve 54 mcg (yani, terapötik dozun 3 katı) Tiotropium uygulanması, EKG' de QT intervalini anlamlı şekilde uzatmamıştır.
Klinik etkililik ve güvenlilik
Klinik geliştirme programında 2663 KOAH hastası üzerinde yürütülen (1308' ine Tiotropium verilmişti) dördü bir yıl süreli, ikisi ise altı ay süreli randomize, çift-kör çalışma bulunmaktaydı. Bir yıllık program, iki plasebo kontrollü ve iki ipratropium kontrollü araştırmadan oluşmuştur. Altı ay süreli araştırmalar, hem salmeterol hem de plasebo kontrollüydü. Bu çalışmalar, akciğer fonksiyonlarının, dispne, KOAH' ta alevlenme şeklindeki sağlıkla ilgili sonuçlanım ölçümlerinin ve sağlıkla ilişkili yaşam kalitesinin hastaların kendileri tarafından değerlendirilmesini içeriyordu.
Akciğer fonksiyonu
Sözü edilen bu çalışmalarda, günde bir kez uygulanan Tiotropium, akciğer fonksiyonlarında (bir saniyelik zorlu ekspirasyon hacmi, FEVve zorlu vital kapasite, FVC) ilk dozu izleyen 30 dakika içinde belirgin iyileşmeye yol açmış ve bu etki 24 saat süreyle kalıcı olmuştur. Bronkodilatasyon büyük çoğunlukla üçüncü gün gözlenmeye başlanmış ve farmakodinamik kararlı duruma bir hafta içinde ulaşılmıştır. Tiotropium sabah ve akşam doruk ekspiratuar akım hızı (PEFR) düzeylerini, hastalarda yapılan günlük kayıtlarda ölçüldüğü şekliyle, anlamlı olarak iyileştirmiştir. Tiotropium
bromürün bronkodilatör etkisi, herhangi bir tolerans belirtisi olmaksızın, 1 yıl boyunca devam etmiştir.
105 KOAH hastasıyla yürütülen randomize, plasebo kontrollü klinik çalışmada, plasebo ile karşılaştırıldığında, sabah veya akşam uygulanmasından bağımsız olarak, 24 saat süreyle bronkodilatasyon etkisinin devam ettiği gösterilmiştir.
Uzun dönem klinik çalışmalar (6 ay ve 1 yıl)
Dispne, Egzersiz toleransı
Tiotropium bromür dispnede anlamlı iyileşmeler sağlamıştır (Geçiş Dispne Endeksi (Transition Dysponea Index) kullanılarak değerlendirilmiştir). Bu iyileşme, tedavi dönemi boyunca devam etmiştir.
Dispnedeki iyileşmenin egzersiz toleransı üzerindeki etkisi, 433 orta-şiddetli KOAH hastasında yürütülen, 2 randomize, çift kör, plasebo kontrollü çalışmada incelenmiştir. Bu çalışmalarda, 6 hafta süreli Tiotropium tedavisi, bisiklet ergometrisinin semptomlarla sınırlanan dayanıklılık süresini anlamlı oranda (plasebo ile karşılaştırıldığında, %75 maksimum çalışma kapasitesinde
%19.7 (Çalışma A) ve %28.3 (çalışma B) oranında) iyileştirmiştir.
Sağlıkla ilişkili yaşam kalitesi
492 hastada yürütülen, 9 ay süreli, randomize, çift kör, plasebo kontrollü klinik çalışmada, Tiotropium, St. George Solunum Anketi (St. George' s Respiratory Questionnaire =SGRQ) total skoru ile değerlendirilen sağlıkla ilişkili yaşam kalitesini iyileştirilmiştir. Tiotropium ile tedavi edilen hastalardan SGRQ total skorunda anlamlı iyileşmeler (yani >4 birim) gösteren hastaların oranı, plasebo ile karşılaştırıldığında, %10.9 daha yüksek bulunmuştur. (Tiotropium gruplarında
%59.1' e karşı plasebo grubunda %48.2, p=0.029). Gruplar arasındaki ortalama farklılık 4.19 birimdir (p=0.001; güven aralığı: 1.69-6.68). SGRQ skoru alt alanlarındaki iyileşmeler, âsemptomlarâ için: 8.19 birim, âaktiviteâ için: 3.91 birim ve âgünlük yaşam üzerindeki etkileriâ için: 3.61 birimdir. Bu alt alanların tümündeki iyileşmeler istatistiksel olarak anlamlıdır.
KOAH alevlenmeleri
1.829 orta-şiddetli KOAH hastasını içeren bir randomize, çift kör, plasebo kontrollü çalışmada, tiotropium bromür KOAH alevlenmesi yaşayan hastaların oranında istatistiksel olarak anlamlı bir azalma (%32.2' den %27.8' e) sağlamış ve alevlenme sayısında da istatistiksel olarak anlamlı şekilde %19 oranında azalmıştır (1.05 olay/maruziyet hasta yılından 0.85 olay/maruziyet hasta yılına). Ayrıca, KOAH alevlenmesi nedeniyle hastaneye yatan hastaların oranı, tiotropium bromür grubunda %7.0 ve plasebo grubunda %9.5 olmuştur (p=0.056). KOAH nedeniyle hastaneye yatanların sayısı %30 oranında azalmıştır (0.25 olay/maruziyet hasta yılından 0.18 olay/maruziyet hasta yılına).
Önceki yıl içinde alevlenme öyküsü olan 7.376 KOAH hastasında 1 yıl süreli randomize, çift kör, çift sağır maskeleme (double dummy), paralel gruplu çalışmada, günde bir kez 18 mikrogram Tiotropium tedavisi ile, günde iki kez 50 mikrogram salmeterol HFA pMDI tedavisinin, orta ve şiddetli alevlenmelerin insidansı üzerindeki etkisi karşılaştırılmıştır.
Tablo 1: Alevlenme sonlanım noktalarının özeti
Sonlanım noktası | Tiotropium 18 µ N=3.707 | Salmeterol 50 µ (HFA pMDI) N=3.669 | Oran (%95 GA) | P değeri |
İlk alevlenmeye kadar geçen zaman (gün)* | 187 | 145 | 0.83 (0.77-0.90) | <0.001 |
İlk şiddetli alevlenmeye (hastaneye yatma) kadar geçen zaman** | - | - | 0.72 (0.61-0.85) | <0.001 |
≥1 alevlenme geçiren | 1.277 (34.4) | 1.414 (38.5) | 0.90 (0.85- | <0.001 |
hasta, n(%)*** |
|
| 0.95) |
|
≥1 şiddetli (hastaneye | 262 (7.1) | 336 (99.2) | 0.77 (0.66- | <0.001 |
yatma) alevlenme geçiren |
|
| 0.89) |
|
hasta, n(%)*** |
|
|
|
|
Salmeterol ile karşılaştırıldığında, Tiotropium ilk alevlenmeye kadar geçen zamanı uzatmış (187 güne karşı 145 gün), riskte %17 oranında düşme sağlamıştır (tehlike oranı 0.83; %95 güven aralığı (GA) 0.77-0.90; p<0.001).
Tiotropium aynı zamanda ilk şiddetli alevlenmeye (hastaneye yatma) kadar geçen zamanı da uzatır (tehlike oranı 0.72; %95 GA 0.61-0.85; p<0.001).
Uzun dönemli klinik çalışmalar (1 yıldan uzun, 4 yıla kadar)
5.993 randomize hastada yürütülen (3.006 hasta plasebo ve 2.987 hasta Tiotropium almıştır) 4 yıl süreli, randomize, çift kör, plasebo kontrollü klinik çalışmada, Tiotropium ile elde edilen FEViyileşmesi, plasebo ile karşılaştırıldığında, 4 yıl süreyle tutarlı bir seyir izlemiştir. Tiotropium grubunda ≥45 ay tedaviyi tamamlayan hasta oranı plasebo ile karşılaştırıldığında daha yüksektir (%63.8' e karşı %55.4, p<0.001). FEV' deki azalmanın yıllık oranı Tiotropium ile plasebo arasında benzerdi. Tedavi sırasında ölüm riskinde %16 azalma mevcuttu. Ölüm insidans hızı plasebo grubunda 4.79/100 hasta yılına karşı tiotropium grubunda 4.10/100 hasta yılı bulunmuştur (tehlike oranı (tiotropium/plasebo)=0.84, %95 GA=0.73, 0.97). Tiotropium ile tedavi respiratuvar yetmezlik (advers olay bildirimleri ile kaydedilmiştir) riskini %19 oranında (2.09' a karşı 1.68vaka/100 hasta yılı, rölatif risk (tiotropium/plasebo)=0.81, %95 GA=0.65, 0.999) düşürmüştür.
Tiotropium aktif kontrollü çalışma
Uzun süreli, geniş bir randomize, çift kör, aktif kontrollü, gözlem süresi 3 yıla kadar uzayan çalışmada tiotropium inhalasyon için toz içeren kapsül ile tiotropium inhalasyon çözeltisinin
etkililiği ve güvenliliği karşılaştırılmıştır (5.694 hasta tiotropium inhalasyon için toz içeren kapsül, 5.711 hasta da tiotropium inhalasyon çözeltisi almıştır). Primer sonlanım noktaları, ilk KOAH alevlenmesine kadar geçen zaman, tüm nedenlere bağlı mortaliteye kadar geçen zaman ve bir alt çalışmada (906 hasta) çukur FEV' dir (dozlama öncesi).
İlk KOAH alevlenmesine kadar geçen zaman, tiotropium inhalasyon için toz içeren kapsül ve tiotropium inhalasyon çözeltisi çalışmasında sayısal olarak benzerdir (tehlike oranı (tiotropium inhalasyon için toz içeren kapsül/tiotropium inhalasyon çözeltisi) 1.02' dir, %95 GA 0.97-1.08). İlk KOAH alevlenmesine kadar geçen medyan gün sayısı, tiotropium inhalasyon için toz içeren kapsül için 719 gün ve tiotropium inhalasyon çözeltisi için 756 gündür.
Tiotropium inhalasyon için toz içeren kapsülün bronkodilatör etkisi 120 hafta boyunca devam etmiştir ve tiotropium inhalasyon çözeltisi ile benzerdir. Tiotropium inhalasyon çözeltisine karşı tiotropium inhalasyon için toz içeren kapsül için çukur FEV' deki ortalama farklılık 0.010 litredir (%95 GA -0.018-0.038 1).
Tiotropium inhalasyon çözeltisi ile tiotropium inhalasyon için toz içeren kapsülü karşılaştıran pazarlama sonrası TIOSPIR çalışmasında, vital durum takibini de içeren tüm nedenlere bağlı mortalite, çalışma sırasında tiotropium inhalasyon için toz içeren kapsül ve tiotropium inhalasyon çözeltisi için benzer bulunmuştur (tehlike oranı tiotropium inhalasyon için toz içeren kapsül/tiotropium inhalasyon çözeltisi) 1.04, %95 GA 0.91-1.19).
Pediyatrik popülasyon
Avrupa İlaç Ajansı, KOAH ve kistik fibroz için pediyatrik popülasyonun tüm alt gruplarında Tiotropium ile yapılacak çalışmaların sonuçlarını sağlama zorunluluğunu kaldırmıştır (pediyatrik kullanım ile ilgili bilgiler için Bkz. 4.2).
5.2. Farmakokinetik özellikler
Genel özelliklerTiotropium bromür, kiralite göstermeyen bir kuaterner amonyum bileşiğidir ve suda kısmen çözünür. Tiotropium bromür, kuru toz inhalasyonu şeklinde uygulanır. İnhalasyon yolu ile uygulamada genel olarak, verilen dozun büyük çoğunluğu gastrointestinal kanalda, daha az bir kısmı ise, amaçlanan organ olan akciğerde tutulur. Aşağıda açıklanan farmakokinetik verilerin çoğu, tedavi için önerilenden daha yüksek dozlar ile elde edilmiştir.
Emilim:
Sağlıklı genç gönüllüler tarafından kuru toz inhalasyonundan sonra elde edilen %19.5 düzeyindeki mutlak biyoyararlanım değeri, akciğere ulaşan bölümün yüksek ölçüde biyoyararlanılabilir olduğunu düşündürmektedir. Bileşiğin kimyasal yapısından (kuaterner amonyum bileşiği), tiotropiumun gastro-intestinal kanaldan iyi absorbe edilmemesi beklenir. Aynı nedenle besinlerin tiotropium absorpsiyonu üzerinde etkili olması beklenmemektedir. Oral tiotropium solüsyonları, %2-3 düzeyinde bir mutlak biyoyararlanıma sahiptirler. Maksimum plazma tiotropium konsantrasyonları, inhalasyondan 5-7 dakika sonra gözlenmiştir.
Kararlı durumda doruk tiotropium düzeyleri KOAH hastalarında 12.9 pg/ml' dir ve çok kompartmanlı modele uygun olarak, hızla azalır. Kararlı durum çukur plazma konsantrasyonları
1.71 pg/ml' dir.
Tiotropium inhalasyon için toz içeren kapsülün kullanımını takiben elde edilen sistemik maruziyet, tiotropium inhalasyon çözeltisi kullanımı ile benzerdir.
Dağılım:
İlaç plazma proteinlerine %72 oranında bağlanır ve 32 L/kg' lık bir dağılım hacmi gösterir. Akciğerdeki lokal konsantrasyonlar bilinmemektedir, ancak uygulama şekli, akciğerlerde önemli oranda daha yüksek konsantrasyonların varlığını düşündürmektedir. Sıçanlarda yapılan çalışmalarda, tiotropiumun kan beyin bariyerini önemli bir düzeyde geçmediği gösterilmiştir.
Biyotransformasyon:
Biyotransformasyona uğrama derecesi küçüktür. Bu durum, sağlıklı genç gönüllülerde bir doz intravenöz uygulamadan sonra %74 oranında değişmemiş maddenin idrarla atılmasıyla belirlenmiştir. Ester yapısındaki tiotropium, enzimatik olmayan bir yol ile parçalanarak, bir alkol olan N-metilskopin ve ditiyenilglikolik aside parçalanır; bu maddelerin her ikisi de muskarinik reseptörlere bağlanmazlar.
İnsan karaciğer mikrozomları ve insan hepatositleriyle yapılan in vitro deneyler bir miktar ilacın (intravenöz uygulama sonrasında dozun %20'sinden azı), sitokrom P450' ye bağımlı oksidasyon ve daha sonrasında glutatyon konjügasyonu yoluyla, çeşitli Faz II metabolitlerine metabolize olduğunu düşündürmektedir. Bu enzimatik yol CYP450 2D6 (ve 3A4) inhibitörleri olan kinidin, ketokonazol ve gestoden ile inhibe edilebilir. Böylelikle CYP450 2D6 ve 3A4, dozun küçük bir bölümünün eliminasyonundan sorumlu metabolik yolda yer almaktadırlar. Tiotropium bromür, supra-terapötik konsantrasyonlarda bile, insan karaciğer mikrozomlarındaki sitokrom P450 1A1, 1A2, 2B6, 2C9, 2C19, 2D6, 2E1 ya da 3A'yı inhibe etmez.
Eliminasyon:
Tiotropiumun efektif yarılanma ömrü, KOAH hastalarında, 27-45 gündür. Sağlıklı genç gönüllülerde intravenöz uygulanan dozdan sonra total klerens 880 mL/dk, bireyler arası değişkenlik ise %22 oranındaydı. İntravenöz uygulanan tiotropium, idrar yoluyla esas olarak değişmemiş halde atılır (%74). KOAH hastalarında kuru toz inhalasyonundan sonra kararlı duruma kadar üriner ekskresyon, 24 saat içinde, değişmemiş ilacın dozun %7' sidir (1.3mikrogram) geri kalanı büyük oranda barsaklarda emilmemiş ilaç halinde bulunur ve feçes ile elimine edilir. Tiotropiumun renal klerensi, kreatinin klerensini geçer; bu durum idrara sekrete olduğunu işaret etmektedir. KOAH' lı kişiler tarafından, günde bir kez kronik inhalasyondan sonra, farmakokinetik kararlı duruma 7nci günde ulaşılır ve daha sonrasında herhangi bir birikim görülmez.
Doğrusallık/doğrusal olmayan durum:
Tiotropium, gerek intravenöz uygulama, gerekse kuru toz inhalasyonu sonrasında terapötik aralıkta, formülasyondan bağımsız olarak, doğrusal farmakokinetik gösterir.
Hastalardaki karakteristik özellikler
Yaş:
Pediyatrik popülasyon: Bkz. 4.2.
Geriyatrik popülasyon: Esas olarak böbrekler yoluyla atılan bütün ilaçlardan beklendiği gibi, ileri yaş tiotropiumun renal klerensinde bir azalma ile ilişkili bulundu (<65 yaşındaki KOAH hastalarında 365 ml/dk iken, ≥65 yaşındaki KOAH hastalarında 271 ml/dk). Bu durum, EAAveya Cdeğerlerinde ilişkili bir artışla sonuçlanmamıştır.
Böbrek yetmezliği:
KOAH hastalarında tiotropiumun inhalasyonla kararlı duruma kadar günde bir kez uygulamalarını takiben, normal böbrek fonksiyonu olan hastalarla (CL>80 ml/dk) kıyaslandığında, hafif böbrek bozuklukları (CL50-80 ml/dk), hafifçe daha yüksek EAAdeğerleri ile (%1.8-30 daha yüksek) sonuçlanmış, Cdeğerleri ise benzer bulunmuştur.
Böbrek fonksiyonları normal KOAH hastalarıyla kıyaslandığında, orta ile şiddetli böbrek bozukluğu (CL<50 mL/dk) olan KOAH hastalarında intravenöz tiotropium uygulaması, plazma konsantrasyonlarının iki katına çıkmasıyla sonuçlanmış (EAAdeğerinde %82 artış) ve Cdeğerinde %52 artış) ve bu durum kuru toz inhalasyonundan sonraki plazma konsantrasyonları ile doğrulanmıştır.
Karaciğer yetmezliği:
Karaciğer yetersizliğinin tiotropium farmakokinetiği üzerinde önemli bir etkisinin olması belirlenmemektedir. Tiotropium büyük çoğunlukla renal eliminasyon yoluyla (sağlıklı genç gönüllülerde %74) ve enzimatik olmayan basit ester parçalanmasıyla muskarinik reseptörlere bağlanmayan ürünlere ayrılarak vücuttan temizlenmektedir.
Japon KOAH hastaları
Çalışmalar-arası karşılaştırmada, tiotropium inhalasyonunu takiben, kararlı durumda dozlamadan 10 dakika sonra, Japon hastalardaki ortalama doruk tiotropium konsantrasyonları, beyaz ırktan KOAH hastalarına göre %20-70 daha yüksek bulunmuştur. Bununla birlikte, Japon hastalarda beyaz ırktan olanlara göre daha yüksek mortalite veya kardiyak risk sinyali saptanmamıştır. Diğer etnik orijinden ve ırktan kişilerle ilgili farmakokinetik veriler yetersizdir.
Farmakokinetik/Farmakodinamik ilişkiler Doğrudan bir ilişki yoktur.
5.3. Klinik öncesi güvenlilik verileri
Güvenlilik farmakolojisi, tekrarlı doz tosisitesi ve üreme tosisitesi için yürütülen konvansiyonel çalışmalarda gözlenen birçok etki, tiotropium bromürün antikolinerjik özellikleriyle açıklanabilir. Tipik olarak, hayvanlarda, gıda tüketiminde azalma, vücut ağırlığı artışının inhibisyonu, ağız ve burunda kuruluk, lakrimasyonda ve tükürük salgısında azalma, midriyaz ve kalp atım hızında artma gözlenmiştir. Tekrarlı doz toksisite çalışmalarında kaydedilen diğer ilgili etkiler, sıçan ve farelerde rinit ve nazal boşluk ve larinkste epitelyal değişikliklerle ortaya çıkan hafif solunum yolu irritasyonu ile sıçanlarda proteinli depozitlerle birlikte prostatit ve idrar torbasında taş oluşumudur.
Gebelik, embriyonal/fötal gelişim, doğum veya postnatal gelişim üzerindeki zararlı etkiler, sadece anneye toksik olan doz düzeylerinde gösterilmiştir. Tiotropium bromür, sıçanlar ve tavşanlarda
teratojenik değildir. Sıçanlarda yürütülen genel bir üreme ve fertilite çalışmasında, ilaç uygulanan ebeveynlerin veya yavrularının fertilite veya çiftleşme performansı üzerinde, hiçbir dozda, hiçbir advers etki saptanmamıştır.
Solunum (irritasyon) ve ürogenital (prostatit) değişiklikler ve üreme tosisitesi, terapötik maruziyetin 5 katından daha yüksek lokal veya sistemik maruziyet düzeylerinde gözlenmiştir. Genotoksisite ve karsinojenik potansiyel çalışmaları, insanlar için özel bir tehlike göstermemiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Laktoz (inek sütü kaynaklıdır.)
6.2. Geçimsizlikler
TİOSİVAR'ın bilinen bir geçimsizliği yoktur.
6.3. Raf ömrü
Satışa sunulmak üzere paketlenmiş TİOSİVAR inhalasyon tozu kapsülünün raf ömrü 24 aydır.
6.4. Saklamaya yönelik özel tedbirler
25C altında oda sıcaklığında saklanmalıdır. Kapsüller dondurulmamalıdır.
6.5. Ambalajın niteliği ve içeriği
TİOSİVAR 18 mcg İnhalasyon Tozu, Sert Kapsül, HDPE şişelerde ambalajlarda ve aşağıdaki şekilde piyasaya sunulmaktadır:
30 veya 60 kapsül ve monodoz inhaler cihazı içeren karton kutuda, kullanım talimatı ile birlikte.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Özel bir gereklilik yoktur.
Kullanılmamış olan ürün ya da atık materyaller, âTıbbi Atıkların Kontrolüâ ve âAmbalaj ve Ambalaj Atıklarının Kontrolüâ yönetmeliklerine uygun olarak imha edilmelidir.
âSon kullanma tarihi geçmiş veya kullanılmayan ilaçları çöpe atmayınız! Çevre ve Şehircilik Bakanlığınca belirlenen toplama sistemine veriniz.â
 Aşırı Alkol Kullanımı, Alkolizm
Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür.
Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması
gerekmez.
Aşırı Alkol Kullanımı, Alkolizm
Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür.
Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması
gerekmez. |
 Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir.
Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| BRONTIO | 8699525550033 | 329.85TL |
| CORIVA | 8699514550235 | 285.55TL |
| DAYTIO | 8680741550532 | |
| FIXRIVA | 8680881559457 | |
| HELIOS | 8697927550835 | |
| Diğer Eşdeğer İlaçlar |
 |
Deri Kanseri Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör. |
 |
Ruh ve Akıl Sağlığımızı Geliştirmek İyi akıl ve ruh sağlığı sahip olmaktan ziyade, yaptığınız şeylerdir. Akıl ve ruhsal olarak sağlıklı olmak için kendinize değer vermeli ve kendinizi kabul etmelisiniz. |
 |
En Yaygın Alerji Türleri Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir. |
İLAÇ GENEL BİLGİLERİ
Grandi İlaç Sanayi ve Tic.Ltd.Şti.
| Satış Fiyatı | TL |
| Önceki Satış Fiyatı | |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8680264860125 |
| Etkin Madde | Tiotropium Bromur Monohidrat |
| ATC Kodu | R03BB04 |
| Birim Miktar | 18 |
| Birim Cinsi | MCG |
| Ambalaj Miktarı | 30 |
| Solunum Sistemi > Diğer İnhalanlar (solukla içeri çekilen ilaçlar) > Tiotropium Bromür |
| Yerli ve Beşeri bir ilaçdır. |