TARCEVA ROCHE 150 mg 30 film kaplı tablet Farmakolojik Özellikler
{ Erlotinib }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ilaç, protein kinaz inhibitörü, epidermal büyüme faktörü reseptörü (EGFR) tirozin kinaz inhibitörleri
ATC kodu: L01EB02
Etki mekanizması:
Erlotinib epidermal büyüme faktör reseptörü/insan epidermal büyüme faktör tip 1 reseptörünün (EGFR, aynı zamanda HER1 olarak bilinen) inhibitörüdür. EGFR'nin intrasellüler fosforilizasyonunu etkili bir şekilde inhibe eder. EGFR/HER1 reseptörü normal hücre ve kanser hücrelerinin hücre yüzeylerinde eksprese edilir. Klinik dışı modellerde, EGFR fosfotirozininin inhibisyonu hücre stazı ve/veya ölümü ile sonlanmaktadır.
EGFR mutasyonları antiapopitotik ve proliferatif sinyal yollarında konstitütif aktivasyona yol açabilir. Erlotinibin bu EGFR mutasyon pozitif tümörlerde EGFR aracılı sinyalleri engelleyen güçlü etkisi, EGFR'nin mutant kinaz bölgesindeki ATP bağlayan bölgesine erlotinibin sıkıca bağlanmasına atfedilmiştir. Aşağı akım sinyalin engellenmesi nedeniyle, hücre çoğalması durmakta ve intrinsik apopitotik yolla hücre ölümü başlamaktadır. EGFR'yi aktive eden bu mutasyonların ekspresyonunun tetiklendiği fare modellerinde tümör regresyonu gözlenmiştir.
Klinik etkililik
EGFR aktive eden mutasyonları olan hastalarda küçük hücreli dışı akciğer kanserinin (KHDAK) birinci basamak tedavisi (monoterapi olarak TARCEVA uygulaması)
EGFR aktive eden mutasyonları olan KHDAK hastalarının birinci basamak tedavisinde TARCEVA ilacının etkinliği faz III, randomize, açık etiketli çalışmada gösterilmiştir (ML20650, EURTAC). Bu çalışma metastatik veya lokal olarak ileri evre (evre IIIB ve
IV) KHDAK olan, daha önce ilerlemiş hastalığı için kemoterapi veya sistemik antitümör tedavisi almamış, EGFR tirozin kinaz bölgesinde mutasyonları (ekson 19 delesyonu veya ekson 21 mutasyonu) bulunan beyaz ırktan hastalarda gerçekleştirilmiştir. Hastalar günlük TARCEVA 150 mg veya dört döngü platin bazlı ikili kemoterapi almak üzere 1:1 oranında randomize edilmişlerdir.
Birincil sonlanım noktası, araştırmacının değerlendirdiği progresyonsuz sağkalım (PFS) olan çalışmaya ait etkililik sonuçları Tablo 3'te verilmektedir.
Şekil 1: ML20650 (EURTAC) çalışmasında araştırmacı tarafından değerlendirilen PFS için Kaplan-Meier eğrisi (Nisan 2012 kesimli)
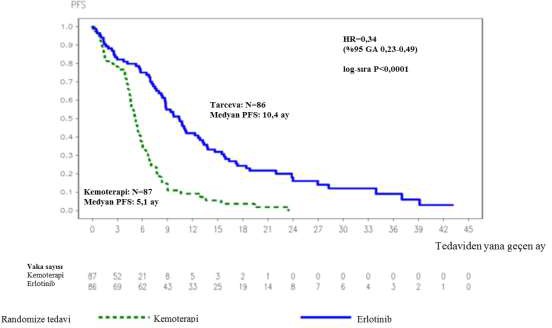
HR: Risk oranı, GA: Güven aralığı, PFS: Progresyonsuz sağkalım
Tablo 3: ML20650 (EURTAC) çalışmasında TARCEVA'nın kemoterapi ile karşılaştırmalı etkililik sonuçları
|
| TARCEVA | Kemoterapi | Risk Oranı (95% GA) | p-değeri |
Önceden |
| n=77 | n=76 |
|
|
planlanmış | |||||
Birincil sonlanım noktası: Progresyonsuz Sağkalım (PFS, ay olarak medyan)* Araştırmacı tarafından değerlendirilen **
Bağımsız inceleme ** |
|
|
|
| |
ara analiz |
|
|
|
| |
(%35 OS |
|
|
|
| |
matürite) (n=153) | 9,4 | 5,2 | 0,42 [0,27-0,64] | p<0,0001 | |
Kesim tarihi: Ağu | 10,4 | 5,4 | 0,47 [0,27-0,78] | p=0,003 | |
2010 |
|
|
|
| |
| En İyi Genel Yanıt Oranı | %54,5 | %10,5 |
| p<0,0001 |
| (CR/PR) |
|
|
|
|
Genel Sağkalım (OS) (ay) | 22,9 | 18,8 | 0,80 [0,47-1,37] | p=0,4170 | |
Araştırma |
| n=86 | n=87 |
|
|
amaçlı analiz (%40 OS matürite) (n=173) | |||||
PFS (ay olarak medyan), Araştırmacı tarafından değerlendirilen |
9,7 |
5,2 | 0,37 [0,27-0,54] |
p<0,0001 | |
En İyi Genel Yanıt Oranı (CR/PR) | %58,1 | %14,9 |
| p<0,0001 | |
Kesim tarihi: Oca 2011 |
OS (ay) |
19,3 |
19,5 | 1,04 [0,65-1,68] |
p=0,8702 |
Güncellenm |
| n=86 | n=87 |
|
|
iş analiz (%62 OS matürite) | |||||
PFS (ay olarak medyan) | 10,4 | 5,1 | 0,34 [0,23-0,49] | p<0,0001 | |
|
|
|
|
| |
(n=173) |
|
|
|
|
|
Kesim tarihi: Nisan |
OS*** (ay) |
22,9 |
20,8 | 0,93 [0,64-1,36] |
p=0,7149 |
2012 |
|
|
|
|
|
CR=komple yanıt; PR=kısmi yanıt
* Hastalığın ilerlemesi veya ölüm riskinde %58'lik bir düşüş gözlemlenmiştir
** Araştırmacı ve IRC arasındaki genel uyum oranı %70'tir.
*** Kemoterapi kolundaki hastaların daha sonra bir EGFR tirozin kinaz inhibitörü ile tedavi alan %82'si ve bu hastaların 2'si dışında tümünün daha sonra TARCEVA kullanması ile yüksek bir çapraz geçiş oranı gözlemlenmiştir.
Birinci basamak kemoterapi sonrası KHDAK'nin idame tedavisi (monoterapi olarak TARCEVA uygulaması)
KHDAK için birinci basamak kemoterapiden sonra idame olarak TARCEVA'nın etkililiği ve güvenliliği, randomize, çift kör, plasebo kontrollü bir çalışmada araştırılmıştır (BO18192, SATURN). Bu çalışma, 4 kür platin bazlı ikili kemoterapiden sonra progresyon göstermemiş, lokal olarak ilerlemiş veya metastatik KHDAK'li 889 hastada gerçekleştirilmiştir. Hastalar, hastalık progresyonuna kadar günde bir kere oral olarak TARCEVA 150 mg veya plasebo almak üzere 1:1 oranında randomize edilmişlerdir. Çalışmanın birincil sonlanım noktası, tüm hastalarda progresyonsuz sağkalımdır (PFS). Temel demografik ve hastalık özellikleri, iki tedavi kolu arasında iyi dengelenmiştir. ECOG PS>1 olan, önemli hepatik veya renal komorbiditesi olan hastalar çalışmaya dahil edilmemiştir.
Bu çalışmada, genel popülasyonda, birincil PFS sonlanım noktası (HR= 0,71 p< 0,0001) ve ikincil OS sonlanım noktası (HR= 0,81 p=0,0088) için fayda görülmüştür. Ancak en büyük fayda, önemli bir PFS faydası (HR=0,10, %95 GA, 0,04 - 0,25; p<0,0001) ve 0,83'lük bir genel sağkalım HR'si (%95 GA, 0,34 -2,02) gösteren, EGFR aktive edici mutasyonları olan hastalarda (n= 49) önceden tanımlanmış bir keşif analizinde gözlenmiştir. EGFR mutasyonu pozitif alt gruptaki plasebo hastalarının
%67'si, EGFR-TKİ'lerle ikinci veya daha ileri basamak tedavisi almıştır.
BO25460 (IUNO) çalışması, tümörleri EGFR aktive edici bir mutasyon (ekson 19 delesyonu veya ekson 21 L858R mutasyonu) bulundurmayan ve dört kür platin bazlı kemoterapiden sonra hastalık progresyonu göstermemiş ileri evre KHDAK'li 643 hastada gerçekleştirilmiştir.
Çalışmanın amacı, erlotinib uygulanan birinci basamak idame tedavisinin genel sağkalımını, hastalığın ilerlemesi sırasında uygulanan erlotinib ile karşılaştırmaktır. Çalışma birincil sonlanım noktasını karşılamamıştır. Tümörü EGFR aktive edici bir mutasyon bulundurmayan hastalarda birinci basamak idame tedavisinde TARCEVA'nın genel sağkalımı, ikinci basamak tedavi olarak uygulanan TARCEVA'dan üstün değildir (HR= 1,02, %95 GA, 0,85 â 1,22, p=0,82). PFS'nin ikincil sonlanım noktası, idame tedavisinde TARCEVA ve plasebo arasında fark göstermemiştir (HR=0,94, %95 GA, 0,80 - 1,11; p=0,48).
BO25460 (IUNO) çalışmasından elde edilen verilere göre, EGFR aktive edici mutasyonu olmayan hastalarda birinci basamak idame tedavisi için TARCEVA kullanımı önerilmemektedir.
En az bir başarısız kemoterapi sonrası KHDAK tedavisi (monoterapi olarak TARCEVA uygulaması)
İkinci-üçüncü basamak tedavi olarak TARCEVA ilacının etkililik ve güvenliliği randomize, çift kör, plasebo kontrollü çalışmada (BR.21) gösterilmiştir. Bu çalışmada yer alan 731 hastada en az bir kemoterapi rejiminden sonra lokal olarak ilerlemiş veya metastatik KHDAK vardır. Hastalar günde bir kere oral olarak TARCEVA 150 mg veya plasebo almak üzere 2:1 oranında randomize edilmişlerdir. Çalışma sonlanım noktaları: genel sağkalım, progresyonsuz sağkalım (PFS), yanıt oranı, yanıt süresi, akciğer kanserine bağlı belirtilerin (öksürük, dispne ve ağrı) kötüleşmesine dek geçen süre ve güvenliliktir. Birincil sonlanım noktası sağkalımdır.
Demografik özellikler iki tedavi grubu arasında dengelidir. Hastaların üçte ikisi erkektir ve yaklaşık üçte birinde başlangıç Doğu Kooperatif Onkoloji Grubu (ECOG) performans durumu (PS) 2 olup, %9'unda başlangıç ECOG PS 3'tür. TARCEVA ve plasebo grubundaki hastaların sırasıyla %93 ve %92 kadarı daha önce platin içeren rejim ve sırasıyla %36 ve %37 kadarı taksan tedavisi almıştır.
TARCEVA grubunda plaseboya göre ölüm için ayarlanan tehlike oranı (HR) 0,73 (%95 GA, 0,60 â 0,87) (p =0,001) olarak saptanmıştır. 12. ayda yaşayan hastaların oranı TARCEVA ve plasebo grupları için sırasıyla %31,2 ve %21,5 olarak saptanmıştır. Medyan genel sağkalım TARCEVA grubunda 6,7 ay iken (%95 GA, 5,5 â 7,8 ay) plasebo grubunda 4,7 aydır (%95 GA, 4,1 â 6,3 ay).
Genel sağkalım üzerine etki farklı hasta alt kümelerinde incelenmiştir. Genel sağkalım üzerine TARCEVA etkisi şu hastalarda benzerdir: başlangıç performans durumu (ECOG) 2-3 (HR = 0,77, %95 GA, 0,6-1,0) veya 0-1 (HR = 0,73, %95 GA, 0,6-0,9),
erkek (HR = 0,76, %95 GA, 0,6-0,9) veya kadın (HR = 0,80, %95 GA, 0,6-1,1), < 65
yaş (HR = 0,75, %95 GA, 0,6-0,9) veya daha yaşlı hastalar (HR = 0,79, %95 GA, 0,6- 1,0), daha önce bir rejim alan hastalar (HR = 0,76, %95 GA, 0,6-1,0) veya daha önce birden fazla rejim alan (HR = 0,75, %95 GA, 0,6-1,0), beyazlar (HR = 0,79, %95 GA,
0,6-1,0) veya Asyalı hastalar (HR = 0,61, %95 GA, 0,4-1,0), adenokarsinomu olanlar (HR = 0,71, %95 GA, 0,6-0,9) veya skuamöz hücreli karsinomu olanlar (HR = 0,67,
%95 GA, 0,5-0,9). Şu hastalarda ise benzer değildir: diğer histolojileri olanlar (HR 1,04, %95 GA, 0,7-1,5), tanıda hastalığı evre IV olan hastalar (HR = 0,92, %95 GA, 0,7-1,2) veya tanıda hastalığı evre < IV olanlar (HR = 0,65, %95 GA, 0,5-0,8). Daha önce hiç sigara içmemiş olan hastalar, şu anda veya eskiden sigara içenlere nazaran (HR = 0,87, %95 GA, 0,71-1,05) erlotinibden daha fazla fayda sağlamıştır (sağkalım HR = 0,42, %95 GA, 0,28-0,64).
EGFR ekspresyon durumu bilinen hastaların %45 kadarında, EGFR pozitif tümörleri olanların tehlike oranı 0,68 (% 95 GA, 0,49-0,94) ve EGFR-negatif tümörü olanların tehlike oranı 0,93 (% 95 GA, 0,63-1,36) olarak saptanmıştır (EGFR pharmDx kit kullanılan IHC ile tanımlanmıştır ve yüzde ondan az boyalı tümör hücresi EGFR negatif olarak tanımlanmıştır. Kalan %55 hastanın EGFR ekspresyon durumu bilinmemektedir ve HR 0,77 (%95 GA, 0,61-0,98) olarak saptanmıştır.
TARCEVA grubunda ortalama PFS 9,7 haftadır (%95 GA, 8,4 â 12,4 hafta) ve
plasebo grubunda 8,0 haftadır (%95 GA, 7,9 â 8,1 hafta).
Objektif yanıt oranı, Solid Tümörlerde Yanıt Değerlendirme Kriterleri'ne (RECIST) göre TARCEVA grubunda %8,9 olarak saptanmıştır (%95 GA, 6,4 â 12,0). İlk 330 hasta merkezi olarak değerlendirilmiştir (yanıt oranı %6,2); 401 hasta araştırmacı tarafından değerlendirilmiştir (yanıt oranı %11,2).
Medyan yanıt süresi 34,3 hafta olup, 9,7 ila 57,6+ hafta arasındadır. Tam yanıt, kısmi yanıt veya stabil hastalık yaşayan hasta oranı sırasıyla TARCEVA ve plasebo gruplarında %44,0 ve 27,5 olarak saptanmıştır (p = 0,004).
TARCEVA için sağkalım faydası, (RECIST'e göre) nesnel tümör yanıtı elde etmeyen hastalarda da gözlenmiştir. Bunun kanıtı, en iyi yanıtı stabil hastalık veya progresif hastalık olan hastalar arasında ölüm için HR'nin 0,82 (%95 GA, 0,68 â 0,99) olmasıyla ortaya konmuştur.
TARCEVA, plaseboya nazaran semptomlar üzerinde de fayda göstermiş olup öksürük, dispne ve ağrının kötüleşmesi için geçen süre anlamlı derecede uzamıştır.
Lokal ileri veya metastatik, sigara içen (yılda ortalama 38 paket) KHDAK hastalarında kemoterapi sonrası ikinci basamak tedavide iki TARCEVA dozunun karşılaştırıldığı (300 mg'a karşılık 150 mg) çift-kör, randomize Faz III çalışmada (MO22162, CURRENTS), 300 mg doz progresyonsuz sağkalım faydası göstermemiştir (sırasıyla 7 hafta ve 6,86 hafta).
Sekonder sonlanım noktalarının tümü primer sonlanım noktalarıyla tutarlıdır ve günde
300 mg ve 150 mg erlotinib ile tedavi edilen hastalar arasında sağkalım farkı görülmemiştir (HR 1,03, %95 GA 0,80 â 1,32). Güvenlilik verileri, 300 mg ve 150 mg dozları arasında karşılaştırılabilirdir ancak, daha yüksek erlotinib dozu alan hastalarda döküntü, interstisyel akciğer hastalığı ve diyare insidansında sayısal bir artış olmuştur.
CURRENTS çalışmasından elde edilen veriler, sigara içen hastalarda önerilen 150 mg doz ile karşılaştırıldığında 300 mg dozla herhangi bir yarar görülmediğini göstermiştir.
CURRENT çalışmasındaki hastalar EGFR mutasyon durumuna göre seçilmemiştir (bkz. Bölüm 4.2, 4.4, 4.5 ve 5.2).
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
Oral uygulama sonrasında erlotinib ortalama doruk plazma düzeylerine oral dozdan yaklaşık 4 saat sonra ulaşır. Normal sağlıklı gönüllülerdeki bir çalışmada yaklaşık
%59'luk bir biyoyararlanım elde edilmiştir. Bir oral doz sonrasındaki biyoyararlanım, yiyeceklerle birlikte arttırılabilir.
Dağılım:
Erlotinib, 232 L'lik ortalama sanal dağılım hacmine sahiptir ve insan tümör dokularına dağılır. Günlük 150 mg oral TARCEVA dozu almakta olan 4 hastada (3'ü küçük hücreli dışı akciğer kanserli (KHDAK), biri de larinks kanserli) yapılan bir çalışmada, tedavinin 9. günündeki cerrahi eksizyonlardan alınan tümör örnekleri, tümördeki erlotinib konsantrasyonlarının ortalama 1,185 ng/g doku olduğunu ortaya koymuştur. Bu da kararlı durumda gözlenen doruk plazma konsantrasyonlarının genel ortalamasının %63'üne karşılık gelmektedir (%5-161 aralığı). Primer aktif metabolitler ortalama 160 ng/g doku konsantrasyonlarında tespit edilmiş olup bu değer de kararlı durumda gözlenen doruk plazma konsantrasyonlarının %113'lük genel ortalamasına denk gelmektedir (%88-130). Plazma protein bağlanması yaklaşık olarak %95'tir. Erlotinib serum albumine ve alfa-1 asit glikoproteine (AAG) bağlanmaktadır.
Biyotransformasyon:
Erlotinib insanlarda karaciğerde hepatik sitokrom enzimleri tarafından, birincil olarak CYP3A4 ve daha az ölçüde CYP1A2 tarafından metabolize edilmektedir. CYP4A4'ün bağırsaktaki, CYP1A1'in akciğerdeki, CYP1B1'in tümör dokusundaki ekstrahepatik metabolizması erlotinibin metabolik klerensine potansiyel olarak yardım eder.
Tespit edilen 3 ana metabolik yol mevcuttur: 1) yan zincirlerden biri veya her ikisinin O-demetilasyonu ve bunu takiben karboksilik aside oksidasyon; 2) asetilen kısmının oksidasyonu ve takiben aril karboksilik aside hidrolizi; ve 3) fenil-asetilen kısmının aromatik hidroksilasyonu. Yan zincirlerden birinin O-demetilasyonu ile oluşan OSI 420 ve OSI 413 primer metabolitleri preklinik in vitro deneyler ve in vivo tümör modellerindeki erlotinib ile karşılaştırılabilir etkiye sahiptir. Bunlar plazmada erlotinibin
<%10'u oranında mevcut bulunup, erlotinib ile benzer farmakokinetik gösterirler.
Eliminasyon:
Erlotinib büyük oranda metabolitleri halinde birincil olarak feçes ile atılırken (>%90), renal eliminasyon bir oral dozun yalnızca küçük bir miktarına (yaklaşık %9) karşılık gelir. Tek ajan olarak TARCEVA verilen 591 hastadaki bir popülasyon farmakokinetik analizi, 36,2 saatlik ortalama yarı-ömürle, 4,47 L/saatlik ortalama görünen klerens
ortaya koymuştur. Bu nedenle, kararlılık durumu plazma konsantrasyonlarına ulaşılmasının yaklaşık 7-8 gün içinde gerçekleşmesi beklenmektedir.
Doğrusallık/doğrusal olmayan durum:
Yeterli veri yoktur.
Hastalardaki karakteristik özellikler
Beklenen görünür klerens ile hasta yaşı, vücut ağırlığı, cinsiyet ve etnik özellikler arasında anlamlı bir ilişki gözlenmemiştir. Erlotinib farmakokinetiğini değiştiren hastaya ait faktörler, serum total bilirubin, albümin ve alfa-1 asit glikoprotein konsantrasyonları ve sigara kullanımının devam etmesidir. Artmış total bilirubin serum konsantrasyonları ve albümin ve alfa-1 asit glikoprotein konsantrasyonları daha yavaş hızda erlotinib klerensi ile birliktelik göstermiştir. Bu farklılıkların klinik relevansı belli değildir. Bununla birlikte, sigara içenlerde daha hızlı bir erlotinib klerensi gözlenmiştir. Bu durum, tek bir oral doz olarak 150 mg erlotinib alan, sigara içmeyen ve halihazırda sigara içen sağlıklı bireylerde yapılan farmakokinetik çalışmada doğrulanmıştır. C'ın geometrik ortalaması sigara içmeyenlerde 1.056 ng/mL iken sigara içenlerde 689 ng/mL olmuştur ve sigara içenler için sigara içmeyenlere göre ortalama oran %65,2'dir (95% GA: 44,3 ila 95,9, p = 0,031). EAA için geometrik ortalama sigara içmeyenlerde 18726 ngxh/mL ve sigara içenlerde 6.718 ngxh/mL olmuştur ve ortalama oran %35,9'dur (95% GA: 23,7 ila 54,3, p < 0,0001). C için geometrik ortalama sigara içmeyenlerde 288 ng/mL ve sigara içenlerde 34,8 ng/mL olmuştur ve ortalama oran %12,1'dir (95% GA: 4,82 ila 30,2, p = 0,0001).
Pivotal faz III KHDAK çalışmasında, halihazırda sigara içenlerde erlotinib için kararlı durum plazma konsantrasyonu 0,65 mcg/mL olmuştur ve bu değer sigarayı bırakanlarda veya hiç sigara içmemiş bireylerde görülen konsantrasyonun iki katından daha azdır (1,28 mcg/mL, n=108). Bu etki ile birlikte görülen erlotinib plazma klerensinde %24'lük bir artış gözlenmiştir. Daha önce sigara içmiş olan KHDAK hastaları üzerinde yapılan faz I doz eskalasyon çalışmasında, kararlı durumdaki farmakokinetik analizleri TARCEVA dozu 150 mg'den maksimum tolere edilebilir doz olan 300 mg'ye artırıldığında erlotinib maruziyetinde doz orantılı artış göstermiştir. Bu çalışmadaki halihazırda sigara içenlerde uygulanan 300 mg dozda kararlı durum plazma konsantrasyonu 1,22 mcg/mL olmuştur (n=17) (bkz. Bölüm 4.2, 4.4, 4.5 ve 5.1).
Farmakokinetik çalışmaların sonuçlarına göre, plazma konsantrasyonlarını düşürebileceği için, halihazırda sigara içen hastalara TARCEVA tedavisi alırken sigarayı bırakmaları önerilmelidir.
Populasyon farmakokinetik analizinden elde edilen sonuçlara göre bir opioid varlığının maruziyeti %11 oranında artırdığı görülmüştür.
Pediyatrik populasyon:
Pediyatrik hastalara özgün çalışmalar bulunmamaktadır.
Geriyatrik populasyon:
Yaşlı hastalara özgün çalışmalar bulunmamaktadır.
Karaciğer yetmezliği:
Erlotinib birincil olarak karaciğer aracılığıyla metabolize edilir. Solid tümörleri olan ve orta derecede hepatik fonksiyon bozukluğu bulunan hastalarda (Child-Pugh skoru 7-9) erlotinib EAA ve C geometrik ortalaması sırası ile 27000 ngxh/mL ve 805 ng/mL olmuştur ve bu değerler primer karaciğer kanseri veya hepatik metastazları olanlar da dahil olmak üzere hepatik fonksiyonları yeterli olan hastalarda sırası ile 29300 ngxh/mL ve 1.090 ng/mL şeklindedir. C değerinin orta derecede hepatik fonskiyon bozukluğu olan hastalarda istatiksel olarak anlamlı derecede daha düşük olmasına karşın bu farkın klinik olarak anlamlı olmadığı düşünülmektedir. Şiddetli hepatik disfonksiyonun erlotinib farmakokinetiği üzerindeki etkisi ile ilgili veri bulunmamaktadır. Populasyon farmakokinetik analizinde, total bilirubinin artmış serum konsantrasyonlarının daha düşük erlotinib klerensi hızı ile ilişkili olduğu görülmüştür.
Böbrek yetmezliği:
Erlotinib ve metabolitlerinin böbrekler tarafından atılımı önemli ölçüde değildir. Tek bir dozun %9'dan azı idrar ile atılmaktadır. Populasyon farmakokinetik analizinde, erlotinib klerensi ve kreatinin klerensi arasında klinik olarak anlamlı bir ilişki görülmemiştir ancak kreatinin klerensi 15 mL/dk'den az olan hastalar ile ilgili bir veri bulunmamaktadır.
5.3. Klinik öncesi güvenlilik verileri
En az bir hayvan türü veya çalışmada gözlenmiş olan kronik doz verilmesine bağlı etkiler kornea (atrofi, ülserasyon), deri (foliküler dejenerasyon ve enflamasyon, kızarıklık ve alopesi), overler (atrofi), karaciğer (karaciğer nekrozu), böbrekler (renal papiller nekroz ve tübüler dilatasyon) ve gastrointestinal sistem (mide boşalmasında gecikme ve diyare) üzerine etkileri içermiştir. Kırmızı kan hücresi parametreleri düşmüş ve beyaz kan hücreleri, öncelikle de nötrofiller artmıştır. Alanin aminotransferaz (ALT), aspartat aminotransferaz (AST) ve bilirubinde tedavi ile ilişkili artışlar meydana gelmiştir. Bu bulgular, klinik olarak anlamlı maruziyetlerin altındaki maruziyetlerde görülmüştür.
Etki mekanizmasına dayanarak, erlotinibin teratojenik olma potansiyeli bulunmaktadır. Sıçanlarda ve farelerde maksimum tolere edilebilir doz ve/veya maternal olarak toksik dozlarda yapılan reproduktif toksikoloji testlerinden elde edilen veriler reproduktif (sıçanlarda embriyotoksisite, tavşanlarda ise embriyo resorpsiyon ve fetotoksisite) ve gelişimsel (yavru büyümesinde düşüş ve sıçanlarda sağkalım) toksisite göstermiştir ancak bu teratojenik değildir ve fertiliteyi olumsuz bozmamıştır. Bu bulgular klinik olarak anlamlı tüm maruziyetlerde görülmüştür.
Konvansiyonel genotoksisite çalışmalarında erlotinib negatif sonuç göstermiştir. Sıçanlarda ve farelerde erlotinib ile yapılan iki yıllık karsinojenisite çalışmaları insan terapötik maruziyetini aşan maruziyetlere kadar negatif olmuştur (C ve/veya EAA'ya dayanarak, sırası ile 2 kata ve 10 kata kadar daha fazla).
Sıçanlarda UV irradyasyonu sonrası hafif derecede fototoksik deri reaksiyonu görülmüştür.
 Lösemi Kan Kanseri
Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür.
Lösemi Kan Kanseri
Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür. |
 Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir.
Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir. |
İLAÇ GENEL BİLGİLERİ
Roche Müstahzarları Sanayi A.Ş.
| Geri Ödeme Kodu | A11815 |
| Satış Fiyatı | 22174.25 TL [ 22 Apr 2024 ] |
| Önceki Satış Fiyatı | 22174.25 TL [ 15 Apr 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699505092027 |
| Etkin Madde | Erlotinib |
| ATC Kodu | L01EB02 |
| Birim Miktar | 150 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 30 |
| Antineoplastik ve İmmünomodülatör Ajanlar |
| İthal ( ref. ülke : Yunanistan ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Ruh ve Akıl Sağlığımızı Geliştirmek İyi akıl ve ruh sağlığı sahip olmaktan ziyade, yaptığınız şeylerdir. Akıl ve ruhsal olarak sağlıklı olmak için kendinize değer vermeli ve kendinizi kabul etmelisiniz. |
 |
Mesane Kanseri Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve hücre içindeki karsinom olarak nitelendirilir. |
 |
Yüksek Tansiyon Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon atardamarlarınızdaki kanın basıncıdır. |