TAGRISSO 80 mg 28 film kaplı tablet Farmakolojik Özellikler
{ Mertinib Mesilat }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ajanlar, protein kinaz inhibitörleri; ATC kodu: L01EB04.
Etki mekanizması
Osimertinib bir Tirozin kinaz İnhibitörüdür (TKI). Duyarlılaştırıcı mutasyonlar (EGFRm) ve TKI-direnç mutasyonu T790M taşıyan Epidermal Büyüme Faktörü Reseptörlerinin (EGFR) geri dönüşümsüz inhibitörüdür.
Farmakodinamik etkiler
İn vitro çalışmalarda osimertinibin, tamamı klinik olarak geçerli EGFR duyarlılaştırıcı mutasyonu ve T790M mutasyonu olan küçük hücreli dışı akciğer kanseri (KHDAK) hücre dizisi aralığında EGFR'ye karşı yüksek potensi ve inhibitör aktivitesi olduğu gösterilmiştir (belirgin IC'ler 6 nM ila 54 nM arasında, fosfo-EGFR'ye karşı). Bu, hücre büyümesinde inhibisyona neden olur ancak doğal-tip hücre dizilerinde EGFR'ye karşı anlamlı düzeyde daha az aktivite gösterir (belirgin IC'ler 480 nM ila 1,8 μM arasında, fosfo-EGFR'ye karşı). Osimertinibin in vivo oral uygulanması, EGFRm ve T790M KHDAK ksenogreft ve transgenik fare akciğer tümörü modellerinde tümör küçülmesi sağlamıştır.
Kardiyak elektrofizyoloji
TAGRISSO'nun QTc aralığını uzatma potansiyeli, AURA2'de günlük 80 mg osimertinib alan
210 hastada değerlendirilmiştir. Osimertinibin QTc aralıkları üzerindeki etkisini değerlendirmek için tek dozu takiben ve kararlı durumda seri EKG'ler çekilmiştir. Yapılan bir farmakokinetik/farmakodinamik analizde, 80 mg'nin ilaç-ilişkili QTc aralığı uzatmasının 14 msn ve üst sınırının 16 msn (%90 GA) olduğu predikte edilmiştir.
Klinik etkililik ve güvenlilik
Daha önceki adjuvan kemoterapi olsun ya da olmasın EGFR mutasyonu pozitif KHDAK'nin adjuvan tedavisi, - ADAURA
Önceden adjuvan kemoterapi ile veya olmadan tam tümör rezeksiyonu geçirmiş EGFR mutasyonu pozitif (Ex19del veya L858R) KHDAK hastalarının adjuvan tedavisi için TAGRISSO'nun etkililiği ve güvenliliği, randomize, çift kör, plasebo kontrollü bir çalışmada kanıtlanmıştır (ADAURA).
Evre IB - IIIA rezeke edilebilir tümörleri bulunan uygun hastaların (Amerikan Ortak Kanser Komisyonu [AJCC] 7. baskıya göre), merkezi bir laboratuvarda biyopsi veya cerrahi numune kullanılarak prospektif olarak gerçekleştirilen cobas EGFR Mutasyon Testi ile tanımlanan EGFR mutasyonlarının (Ex19del veya L858R) bulunması gerekiyordu.
Hastalar, ameliyattan ve uygulanması halinde standart adjuvan kemoterapiden sonra TAGRISSO (n = 339, günde bir defa 80 mg oral) veya plasebo (n = 343) alacak şekilde 1:1
oranında randomize edilmiştir. Adjuvan kemoterapi almayan hastalar 10 hafta içinde ve adjuvan kemoterapi alan hastalar cerrahiyi takip eden 26 hafta içinde randomize edilmiştir. Randomizasyon, EGFR mutasyon tipi (Ex19del veya L858R), etnik köken (Asyalı veya Asyalı olmayan) ve AJCC 7. baskıya göre perkütan transtorasik iğne biyopsisine (pTNM) (IB veya II veya IIIA) dayalı evreleme ile katmanlandırılmıştır. Tedavi, hastalığın nüksetmesine, kabul edilemez toksisiteye kadar veya 3 yıl süreyle uygulanmıştır.
Ana etkililik sonuç ölçütü evre II-IIIA popülasyonunda araştırmacı değerlendirmesine göre hastalıksız sağkalımdır (DFS). Evre IB-IIIA popülasyonunda (genel popülasyon) araştırmacı değerlendirmesine göre DFS ek etkililik sonucu ölçütüdür. Diğer ek etkililik sonucu ölçütleri arasında DFS oranı, genel sağkalım (OS), OS oranı ve sağlıkla ilişkili yaşam kalitesinde (HRQoL) SF-36'da bozulmaya kadar geçen süre yer almaktadır.
Genel popülasyonun başlangıçtaki demografik özellikleri ve hastalık karakteristikleri şu şekildeydi: medyan yaş 63 (aralık 30-86), ≥75 yaş (%11), kadın (%70), Asyalı (%64), hiç
sigara kullanmamış (%72), Dünya Sağlık Örgütü (WHO) performans durumu 0 (%64) veya 1 (%36), evre IB (%31), evre II (%34) ve IIIA (%35). EGFR mutasyonu durumu açısından
%55'i ekson 19 delesyonu ve %45'i ekson 21 L858R ikame mutasyonlarıydı; 9 (%1) hastada aynı zamanda eşzamanlı de novo T790M mutasyonu vardı. Hastaların büyük çoğunluğu (%60) randomizasyondan önce adjuvan kemoterapi almıştır (%26 IB; %71 IIA; %73 IIB;
%80 IIIA). Veri kesim tarihinde, 205 (%61) hasta halen aktif olarak tedavi görüyordu; 3 yıllık tedavi süresini tamamlama fırsatı bulan 73 (%11) hastadan 40'ı (%12) osimertinib kolunda ve 33'ü (%10) plasebo kolundaydı.
TAGRISSO ile hastalığı nükseden 37 hasta vardı. Nüksün en sık bildirildiği bölgeler şunlardı: akciğer (19 hasta); lenf nodları (10 hasta) ve MSS (5 hasta). Plasebo ile hastalığı nükseden 157 hasta vardı. En sık bildirilen bölgeler şunlardı: akciğer (61 hasta); lenf nodları (48 hasta) ve MSS (34 hasta).
ADAURA, evre II-IIIA popülasyonunda plasebo ile tedavi edilen hastalara kıyasla TAGRISSO ile tedavi edilen hastalar için hastalık nüksü veya ölüm riskinde istatistiksel olarak anlamlı bir azalma göstermiştir. Evre IB-IIIA popülasyonunda da benzer sonuçlar gözlenmiştir. DFS analizi sırasında genel sağkalım (OS) verileri olgun değildi. Araştırmacı değerlendirmesine göre ADAURA'dan elde edilen etkililik sonuçları Tablo 2'de özetlenmiştir.
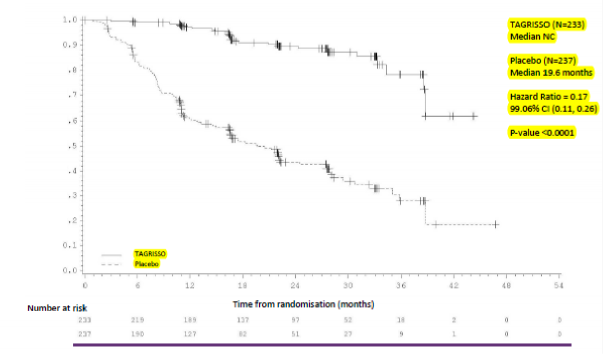
Tablo 2: Araştırmacı değerlendirmesine göre ADAURA çalışmasından elde edilen etkililik sonuçları
| Evre II-IIIA popülasyonu | Evre IB-IIIA popülasyonu | ||
Etkililik Parametreleri | TAGRISSO (N=233) | Plasebo (N=237) | TAGRISSO (N=339) | Plasebo (N=343) |
Hastalıksız Sağkalım (DFS) | ||||
Olay sayısı (%) | 26 (11) | 130 (55) | 37 (11) | 159 (46) |
Rekürren hastalık (%) | 26 (11) | 129 (54) | 37 (11) | 157 (46) |
Ölümler (%) | 0 | 1 (0,4) | 0 | 2 (0,6) |
Medyan, ay (%95 GA) | NC (38,8, NC) | 19,6 (16,6, 24,5) | NC (NC, NC) | 27,5 (22,0, 35,0) |
| Evre II-IIIA popülasyonu | Evre IB-IIIA popülasyonu | ||
Etkililik Parametreleri | TAGRISSO (N=233) | Plasebo (N=237) | TAGRISSO (N=339) | Plasebo (N=343) |
HR (%99,06 GA); P-değeri | 0,17 (0,11, 0,26); < 0,0001 | 0,20 (0,14, 0,30); < 0,0001 | ||
12 ayda DFS oranı (%) (%95 GA) | 97 (94, 99) | 61 (54, 67) | 97 (95, 99) | 69 (63, 73) |
24 ayda DFS oranı (%) (%95 GA) | 90 (84, 93) | 44 (37, 51) | 89 (85, 92) | 52 (46, 58) |
36 ayda DFS oranı (%) (%95 GA) | 78 (65, 87) | 28 (19, 38) | 79 (69, 86) | 40 (32, 48) |
HR = Tehlike Oranı; GA= Güven Aralığı, NC = Hesaplanamaz Araştırmacı değerlendirmesine dayanan DFS sonuçları
HR <1 TAGRISSO lehinedir
TAGRISSO alan hastalar için DFS medyan takip süresi 22,1 ay, plasebo alan hastalar (evre II-IIIA popülasyonu) için 14,9 ay ve plasebo alan hastalar (evre IB-IIIA popülasyonu) için 16,6 aydı.
Şekil 1: Araştırmacı değerlendirmesine göre evre II-IIIA hastalarda Kaplan-Meier Hastalıksız Sağkalım Eğrisi
Şekil 2: Araştırmacı değerlendirmesine göre evre IB-IIIA hastalarda (genel popülasyon) Kaplan-Meier Hastalıksız Sağkalım Eğrisi
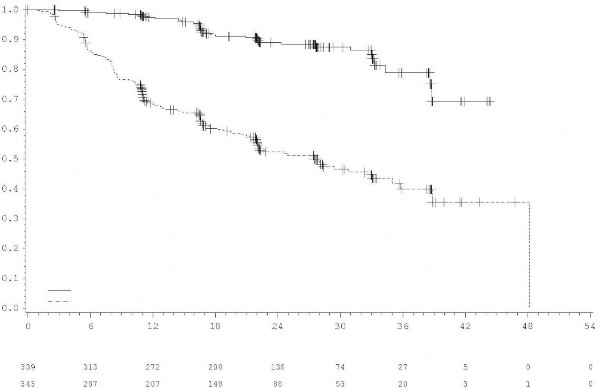
Plaseboya kıyasla TAGRISSO'nun DFS yararı, etnik köken, yaş, cinsiyet ve EGFR mutasyon tipi (Ex19Del veya L858R) dahil olmak üzere analiz edilen tüm önceden tanımlanmış alt gruplarda tutarlıydı.
Plasebo alan hastalara kıyasla TAGRISSO kullanan hastalar için MSS DFS'nin (MSS nüksüne veya ölüme kadar geçen süre) keşifsel bir analizinde genel popülasyon (evre IB-IIIA) için HR'nin 0,18 (%95 GA: 0,10, 0,33; p <0,0001) olduğu görülmüştür.
Hasta Tarafından Bildirilen Sonuçlar
ADAURA'da sağlıkla ilişkili yaşam kalitesi (HRQL), Kısa Form (36) Sağlık Araştırması versiyon 2 (SF-36v2) anketi kullanılarak değerlendirilmiştir. SF-36v2, 12. haftada, 24. haftada ve tedavi tamamlanana veya kesilene kadar randomizasyona göre her 24 haftada bir uygulanmıştır. Genel olarak, HRQL her iki kolda da 30 aya kadar korunmuş olup, evre II-IIIA popülasyonundaki hastaların en az %70'inde SF-36'nın fiziksel bileşeninde klinik olarak anlamlı bir bozulma ya da ölüm (plasebo karşısında TAGRISSO için %76'ya karşılık %70) veya SF-36'nın zihinsel bileşeninde klinik olarak anlamlı bir bozulma ya da ölüm meydana gelmemiştir (plasebo karşısında TAGRISSO için %71'e karşılık %70).
Daha önce tedavi uygulanmamış EGFR mutasyonu pozitif lokal olarak ilerlemiş veya metastatik KHDAK â FLAURA
Daha önce ilerlemiş hastalık için sistemik tedavi uygulanmamış EGFR mutasyonu pozitif lokal ileri, küratif cerrahi ya da radyoterapiye uygun olmayan, veya metastatik KHDAK görülen hastaların tedavisinde TAGRISSO'nun etkililiği ve güvenliliği randomize, çift kör, aktif kontrollü bir çalışmada (FLAURA) ortaya konmuştur. Hastanın tümör dokusu numunelerinin yerel veya merkezi testlerle tespit edildiği üzere EGFR TKI duyarlılığı ile ilişkili olduğu bilinen iki yaygın EGFR mutasyonundan birine (Ex19del veya L858R) sahip olması gerekmiştir.
Hastalar TAGRISSO (n=279, günde bir defa oral yolla 80 mg) veya EGFR TKI karşılaştırma ilacı (n=277; günde bir defa oral yolla 250 mg gefitinib veya günde bir defa oral yolla 150 mg erlotinib) almak üzere 1/1 oranında randomize edilmiştir. Randomizasyon EGFR mutasyonu tipine (Ex19del veya L858R) ve etnisiteye (Asyalı olanlar veya olmayanlar) göre basamaklandırılmıştır. Hastalar tedaviye intolerans ortaya çıkana veya araştırmacı tarafından hastanın artık klinik yarar görmüyor olduğunda karar verilene kadar çalışma tedavisi almıştır. EGFR TKI karşılaştırma ilacı alan hastalarda tümör numunelerinin T790M mutasyonu açısından pozitif sonuç vermesi koşuluyla progresyon sonrası açık etiketli TAGRISSO'ya çaprazlama yapılmasına izin verilmiştir. Primer etkililik sonlanım noktası araştırmacı tarafından değerlendirilen progresyonsuz sağkalım (PFS) olarak belirlenmiştir.
Genel çalışma popülasyonunun başlangıçtaki demografik özellikleri ve hastalık karakteristikleri şöyledir: medyan yaş 64 (aralık 26-93), ≥75 yaş (%14), kadın (%63), Beyaz (%36), Asyalı (%62), hiç sigara kullanmamış (%64), Dünya Sağlık Örgütü (WHO) performans durumu 0 veya 1 (%100), metastatik kemik hastalığı (%36), ekstra-torasik viseral metastazlar (%35), MSS metastazları (%21, başlangıçta MSS lezyonu, tıbbi öykü ve/veya daha önce MSS metastazları için cerrahi ve/veya daha önce radyoterapi uygulanmış olması ile tanımlanan).
TAGRISSO, EGFR TKI komparatörüne kıyasla PFS'de klinik açıdan anlama sahip ve
istatistiksel olarak anlamlı bir iyileşme ortaya koymuştur (sırasıyla medyan 18,9 ay ve 10,2 ay, HR=0,46, %95 GA: 0,37,0,57; P<0,0001). Araştırmacı değerlendirmesine göre FLAURA'dan elde edilen etkililik sonuçları Tablo 3'de özetlenmiştir ve PFS'ye ilişkin Kaplan-Meier eğrisi Şekil 3'de gösterilmektedir. Genel sağkalıma ilişkin nihai analizde (%58 olgunluk) EGFR TKI komparatörüne kıyasla TAGRISSO'ya randomize edilen hastalarda 0.799 HR (% 95,05 GA, 0,641, 0,997) ile istatistiksel olarak anlamlı bir iyileşme ve klinik olarak anlamlı daha uzun medyan sağkalım süresi gösterilmiştir. 12., 18., 24. ve 36. ayda hayatta olanların oranının TAGRISSO ile tedavi uygulanan hastalarda (sırasıyla %89, %81,
%74 ve %54) EGFR TKI komparatörü ile tedavi uygulanan hastalardakine kıyasla (sırasıyla
%83, %71, %59 ve %44) daha yüksek olduğu belirlenmiştir. Progresyon sonrası sonlanım noktaların analizi, PFS yararının takip eden tedavi basamaklarında da korunduğunu göstermiştir.
Tablo 3. Araştırmacının değerlendirmesine göre FLAURA'nın etkililik sonuçları
Etkililik Parametresi |
TAGRISSO (N=279) | EGFR TKI karşılaştırma ilacı (gefitinib veya erlotinib) (N=277) |
Progresyonsuz Sağkalım | ||
Olay sayısı (%62 olgunluk) | 136 (49) | 206 (74) |
Medyan, ay (%95 GA) | 18.9 (15.2, 21.4) | 10.2 (9.6, 11.1) |
HR (%95 GA); P değeri | 0.46 (0.37, 0.57); P<0.0001 | |
Genel Sağkalım | ||
Ölümlerin sayısı, (%58 olgunluk) | 155 (56) | 166 (60) |
Ay olarak medyan OS (%95 GA) | 38.6 (34.5, 41.8) | 31.8 (26.6, 36.0) |
HR (%95.05 GA); P değeri | 0.799 (0.641, 0.997); P=0.0462 ) | |
Objektif Yanıt Oranıâ° | ||
Yanıt sayısı (n), % Yanıt Oranı (%95 GA) | 223 80 (75, 85) | 210 76 (70, 81) |
Odds oranı (%95 GA); P değeri | 1.3 (0.9, 1.9); P=0.2421 | |
Etkililik Parametresi |
TAGRISSO (N=279) | EGFR TKI karşılaştırma ilacı (gefitinib veya erlotinib) (N=277) |
Yanıt Süresi (DoR)â° | ||
Medyan, Ay (%95 GA) | 17.2 (13.8, 22.0) | 8.5 (7.3, 9.8) |
İlk takip eden tedavinin başlangıcından sonra ikinci PFS (PFS2) | ||
İkinci progresyonun gözlendiği hastaların sayısı (%) | 73 (26) | 106 (38) |
Medyan PFS2, Ay (%95 GA) | NC (23.7, NC) | 20.0 (18.0 NC) |
HR (%95 GA); P değeri | 0.58 (0.44, 0.78); P=0.0004 | |
Randomizasyondan takip eden ilk tedaviye veya ölüme kadar geçen süre (TFST) | ||
Takip eden ilk tedaviyi gören veya ölen hastaların sayısı (%) | 115 (41) | 175 (63) |
Medyan TFST, ay (%95 GA) | 23.5 (22.0, NC) | 13.8 (12.3, 15.7) |
HR (%95 GA); P değeri | 0.51 (0.40, 0.64); P<0.0001 | |
Randomizasyondan takip eden ikinci tedaviye veya ölüme kadar geçen süre (TSST) | ||
Takip eden ikinci tedaviyi gören veya ölen hastaların sayısı (%) | 75 (27) | 110 (40) |
Medyan TSST, ay (%95 GA) | NC (NC, NC) | 25.9 (20.0, NC) |
HR (%95 GA); P değeri | 0.60 (0.45, 0.80); P=0.0005 | |
HR=Tehlike oranı; GA=Güven aralığı, NC=Hesaplanabilir değil, PFS, ORR, DOR ve PFS2 sonuçları RECIST araştırmacı değerlendirmesini temel almaktadır
Doğrulanmış olmayan yanıta göre
Medyan takip süresinin TAGRISSO alan hastalar için 15,0 ay, EGFR TKI karşılaştırma ilacı alan hastalar içinse 9,7 ay olduğu hesaplanmıştır.
TAGRISSO alan hastalarda medyan sağkalım takip süresi 35.8 ay ve EGFR TKI karşılaştırıcısı alan hastalar için 27.0 aydı.
PFS, ORR, DoR, PFS2, TFST ve TSST sonuçları 12 Haziran 2017 tarihli veri kesiminden
alınmıştır. Genel sağkalım sonuçları 25 Haziran 2019 tarihli veri kesiminden alınmıştır.
< 1'lik bir HR TAGRISSO lehinedir, >1'lik bir Odds oranı TAGRISSO lehinedir
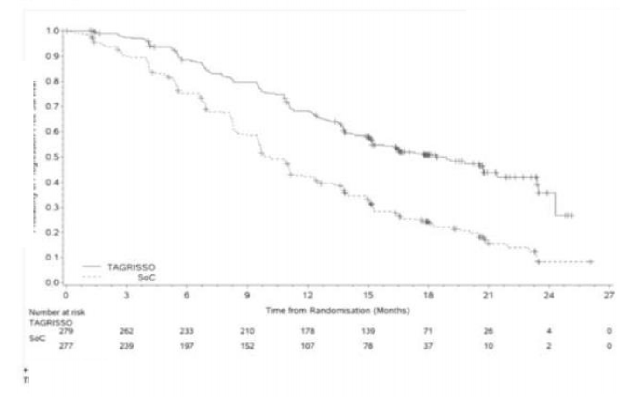
Şekil 3: FLAURA'da araştırmacı tarafından değerlendirilen Progresyonsuz Sağkalımın Kaplan-Meier Eğrileri
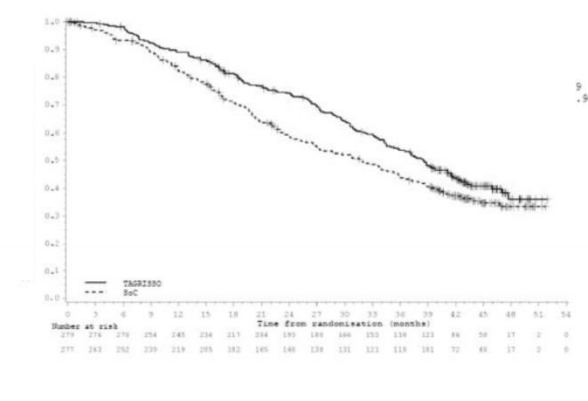
Şekil 4: FLAURA'da Genel Sağkalımın Kaplan-Meier Eğrileri
TAGRISSO'nun EGFR TKI karşılaştırma ilacına kıyasla PFS açısından sağladığı yararın etnisite, yaş, cinsiyet, sigara kullanımı öyküsü, çalışmaya girişteki MSS metastazı durumu ve EGFR mutasyonu tipinin (Ekson 19 delesyonu veya L858R) de aralarında olduğu önceden tanımlanmış olan tüm analiz edilmiş alt gruplarda tutarlılık sergilediği görülmüştür.
FLAURA çalışmasında MSS metastazı etkililik verileri
Nörolojik durumları definitif tedavinin ve steroidlerin tamamlanmasını takip eden en az iki hafta süresince stabil olan steroid gerektirmeyen MSS metastazlı hastalar FLAURA çalışmasında randomize edilmek açısından uygun kabul edilmiştir. 556 hasta içinden 200 hastanın başlangıçta beyin taramalarının mevcut olduğu görülmüştür. MSS metastazlarına sahip 128/556 (%23) hastadan oluşan bir alt grupta bu taramalar üzerinde yapılan bir BICR değerlendirmesi sonuçlanmıştır ve ilgili veriler Tablo 4'de özetlenmektedir. FLAURA'da RECIST v1.1'e göre MSS etkililiği, MSS PFS'de olarak istatistiksel açıdan anlamlı iyileşme olduğunu ortaya koymuştur (HR=0,48, %95 GA 0,26, 0,86; P=0,014).
Tablo 4. FLAURA'da başlangıçtaki bir beyin taramasında MSS metastazları gözlenen hastalarda BICR ile MSS etkililiği
Etkililik Parametreleri | TAGRISSO N = 61 | EGFR TKI komparatörü (gefitinib veya erlotinib) N=67 |
MSS progresyonsuz sağkalım | ||
Olay Sayısı (%) | 18 (30) | 30 (45) |
Medyan, Ay (%95 GA) | NC (16,5, NC) | 13,9 (8,3, NC) |
HR (%95 GA); P-değeri | 0,48 (0,26, 0,86); P = 0,014 | |
6. ayda MSS progresyonsuz ve hayatta (%) (%95 GA) | 87 (74, 94) | 71 (57, 81) |
12. ayda MSS progresyonsuz ve hayatta (%) (%95 GA) | 77 (62, 86) | 56 (42, 68) |
HR = Tehlike Oranı; GA= Güven Aralığı, NC = Hesaplanamaz
HR < 1 TAGRISSO tedavisi lehine iken >1 Odds Oranı (Odds Oranı-OR) TAGRISSO lehinedir
FLAURA'da çalışmaya girişte MSS metastazı durumuna (başlangıçtaki MSS lezyonu bölgesi, tıbbi öykü ve/veya MSS metastazları için uygulanan önceki cerrahi ve/veya önceki radyoterapiye göre tanımlanmıştır) dayalı bir önceden belirlenmiş PFS alt grubu oluşturulmuştur ve Şekil 5'de gösterilmektedir. Çalışmaya girişteki MSS lezyonu durumundan bağımsız olarak, TAGRISSO kolundaki hastalar, EGFR TKI komparatörü kolundakilere kıyasla bir etkililik yararı ortaya koymuştur ve TAGRISSO kolunda yeni MSS lezyonları görülen hastaların sayısının EGFR TKI komparatörü kolundakilere kıyasla daha az sayıda olduğu belirlenmiştir (TAGRISSO, 11/279 [%3,9], EGFR TKI komparatörü, 34/277 [%12,3]). Başlangıçta MSS lezyonu olmayan hastalardan oluşan alt grupta, TAGRISSO kolunda EGFR TKI komparatörü kolundakine kıyasla daha az sayıda yeni MSS lezyonu gözlenmiştir (sırasıyla 7/226 [%3,1], 15/214 [%7,0]).
5.2. Farmakokinetik özellikler
Genel özelliklerOsimertinib farmakokinetik parametreleri, sağlıklı gönüllülerde ve KHDAK hastalarında karakterize edilmiştir. Popülasyon farmakokinetiği analizine göre, osimertinibin belirgin plazma klirensi 14,3 L/sa, belirgin dağılım hacmi 918 L ve terminal yarı ömrü yaklaşık 44 saattir. EAA ve C, 20 ila 240 mg doz aralığında dozla orantılı artış göstermiştir. Osimertinibin günde bir kez uygulanması, yaklaşık 3 kat birikime neden olur ve kararlı durum maruziyetlerine 15 günlük dozlama ile ulaşılır. Kararlı durumda, dolaşımdaki plazma konsantrasyonları 24 saatlik dozlama aralığında tipik olarak 1,6 kat aralığında tutulur.
Emilim:
TAGRISSO'nun oral uygulanmasını takiben osimertinibin pik plazma konsantrasyonlarına 6 (3-24) saatlik medyan (min-maks) tsüresinde ulaşılmıştır ve bazı hastalarda ilk 24 saatte birkaç pik gözlenmiştir. TAGRISSO'nun mutlak biyoyararlanımı 70% (90% GA 67, 73). Hastalardaki klinik farmakokinetik çalışmasına göre 80 mg düzeyinde, besinler osimertinibin biyoyararlanımını klinik olarak anlamlı derecede değiştirmemektedir. (EAA artışı %6 (%90 GA -5, 19) ve Cazalması %7 (%90 GA-19, 6)). Gastrik pH'nin 5 günlük omeprazol dozlamasıyla yükseltildiği ve 80 mg tablet uygulanan sağlıklı gönüllülerde osimertinib maruziyeti etkilenmemiştir (EAA ve Cartışları sırasıyla %7 ve %2) ve maruziyet oranı için
%90 GA, %80-125 sınırları dahilinde tutulmuştur.
Dağılım:
Osimertinibin, kararlı durumda hesaplanan popülasyon ortalama dağılım hacmi (V/F) 918 L olup, dokuya geniş bir dağılıma işaret etmektedir. Osimertinibin plazma protein bağlanması,
%94,7'dir. (% 5.3'i serbest).Osimertinibin aynı zamanda, sıçan ve insan plazma proteinlerine, insan serum albumini ve sıçan ve insan hepatositlerine kovalan bağlandığı gösterilmiştir.
Biyotransformasyon:
İn vitro çalışmalar, osimertinibin ağırlıklı olarak CYP3A4 ve CYP3A5 ile metabolize edildiğine işaret etmektedir. Bununla birlikte, mevcut verilerle alternatif metabolik yollar tamamen göz ardı edilemez. İn vitro çalışmalara göre, klinik öncesi türlerin plazmasında ve insanlarda oral osimertinib dozlamasından sonra 2 tane farmakolojik olarak aktif metabolit (AZ7550 ve AZ5104) tanımlanmıştır; AZ7550, TAGRISSO'ya benzer bir farmakolojik profil göstermiş, buna karşılık AZ5104, mutant ve doğal-tip EGFR için daha yüksek potens göstermiştir. Her iki metabolit de, TAGRISSO'nun hastalara uygulanmasından sonra plazmada yavaşça ortaya çıkmıştır ve medyan (min-maks) tsüreleri sırasıyla 24 (4-72) ve 24 (6-72) saat olmuştur. İnsan plazmasında toplam radyoaktivitenin %0,8'inden ana osimertinib sorumlu olmuştur, 2 metabolit %0,08 ve %0,07 oranlarında katkı göstermiştir ve radyoaktivitenin büyük çoğunluğu kovalan olarak plazma proteinlerine bağlanmıştır. AZ5104 ve AZ7550'nin her ikisinin EAA'ya göre maruziyetlerinin geometrik ortalaması, kararlı durumdaki osimertinib maruziyetinin yaklaşık %10'u olmuştur.
Osimertinibin ana metabolik yolağı, oksidasyon ve dealkilasyondu. İnsanlarda toplu idrar ve fekal numunelerde 5 bileşen dozun >%1'ini oluşturacak şekilde en az 12 bileşen gözlenmiştir; dozun yaklaşık %1,9, %6,6 ve %2,7'sinden değişmemiş osimertinib, AZ5104 ve AZ7550 sorumlu olmuştur ve ayrıca bir sisteinil katılma ürünü (M21) ve bilinmeyen bir metabolit (M25) sırasıyla dozun %1,5 ve %1,9'undan sorumlu olmuştur.
İn vitro çalışmalara göre osimertinib, klinik olarak geçerli konsantrasyonlarda CYP 3A4/5'in kompetitif inhibitörüdür ancak CYP1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6 ve 2E1'in değildir. İn vitro çalışmalara göre osimertinib, hepatik olarak klinik önemli konsantrasyonlarda UGT1A1 ve UGT2B7'nin inhibitörü değildir. UGT1A1'in intestinal inhibisyonu olasıdır ancak klinik etki bilinmemektedir.
Eliminasyon:
20 mg'lik tek oral dozu takiben dozun %67,8'i feçeste geri kazanıldı (%1,2'si ana bileşik olarak), buna karşılık 84 günlük numune alımında uygulanan dozun %14,2'si idrarda bulundu (%0,8 ana bileşik olarak). Değişmemiş osimertinib, %0,8'i idrarda ve %1,2'si feçeste olmak üzere eliminasyonun yaklaşık %2'sinden sorumlu olmuştur.
Doğrusallık/Doğrusal olmayan durum:
EAA ve C, 20 ila 240 mg doz aralığında dozla orantılı artış göstermiştir.
Taşıyıcı proteinlerle etkileşimler:
İn vitro çalışmalarda osimertinibin, OATP1B1 ve OATP1B3 substratı olmadığı gösterilmiştir. İn vitro ortamda osimertinib, klinik olarak geçerli konsantrasyonlarda P-g (P-glikoprotein), OAT1, OAT3, OATP1B1, OATP1B3, MATE1, OCT2 ve MATE2K'yi inhibe etmez. (bkz.
Bölüm 4.5)
İn vitro çalışmalara göre osimertinib, P-gp ve BCRP'nin bir substratıdır, ancak klinik dozlarda klinik olarak anlamlı ilaç etkileşimleri olası değildir.
İn vitro verilere göre osimertinib, BCRP ve P-gp'nin inhibitörüdür.
Hastalardaki karakteristik özellikler
Popülasyon tabanlı bir farmakokinetik analizinde (n=1367), predikte edilen kararlı-durum
maruziyeti (EAA) ve hastanın yaşı (aralık: 25 ila 91 yaş), cinsiyeti (%65 kadın), etnik kökeni (Beyaz, Asyalı, Japon, Çinli ve Asyalı-olmayan-Beyaz-olmayan hastalar) tedavi basamağı ve sigara içme durumu (n=34 sigara içenler, n=419 daha önceden sigara içmiş olanlar) arasında klinik olarak anlamlı ilişki tanımlanmamıştır. Popülasyon FK analizi, vücut ağırlığının anlamlı eş değişken olduğuna işaret etmiş, ve 61 kg medyan vücut ağırlığı için EAA'ye kıyasla 88 kg ve 43 kg (%95 ila %5'lik dilimler) vücut ağırlığı aralığı genelinde beklenen osimertinib EAAdeğişikliği %20'den az olmuştur. Vücut ağırlığının uç noktaları, <43 kg ile
>88 kg aralığı, açısından AZ5104 metabolit oranları sırasıyla %11,8 ila %9,6 aralığında, buna karşılık AZ7550 için sırasıyla %12,8 ila %8,1 aralığında olmuştur. Popülasyon PK analizine göre, 39 g/L şeklindeki medyan başlangıç albümini için EAAile karşılaştırıldığında, 29 ila 46 g/L albümin aralığında beklenen osimertinib EAAdeki değişimin <%30olmasıyla serum albümini anlamlı bir değişken olarak belirlenmiştir. Vücut ağırlığı farklıkları ya da başlangıçtaki albüminden kaynaklanan bu maruziyet değişikliklerinin klinik olarak önemli olmadığı değerlendirilmektedir.
Karaciğer yetmezliği:
Osimertinib daha çok karaciğer yoluyla eliminasyona uğramaktadır. Yapılan bir klinik çalışmada, tek bir 80 mg TAGRISSO dozundan sonra normal karaciğer fonksiyonuna sahip hastalara kıyasla (n=10) farklı türde ileri evre solid tümörleri olan ve hafif (Child Pugh A, ortalama skor = 5,3, n=7) veya orta karaciğer yetmezliğine sahip (Child Pugh B, ortalama skor= 8,2, n=5) hastalarda maruziyette artış gözlenmemiştir. Normal karaciğer fonksiyonuna sahip hastalardaki maruziyete kıyasla, osimertinib EAA ve Ciçin geometrik ortalama oran (%90 GA) hafif karaciğer yetmezliği olan hastalarda %63,3 (47,3; 84,5) ve %51,4 (36;6;
72,3) ve orta şiddetli karaciğer yetmezliği olanlar hastalarda %68,4 (49,6; 94,2) ve %60,7 (41,6; 88,6) idi; AZ5104 metabolit için EAA ve Chafif karaciğer yetmezliği olan hastalarda %66,5 (43,4; 101,9) ve %66,3 (45,3; 96;9) ve orta şiddetli karaciğer yetmezliği
olanlar hastalarda %50,9 (31,7; 81,6) ve %44,0 (28,9; 67,1) idi. Popülasyon FK analizine dayanarak, hepatik fonksiyon belirteçleri (ALT, AST, bilirubin) ve osimertinib maruziyeti arasında herhangi bir ilişki yoktu. Hepatik yetmezlik belirteci serum albümin, osimertinib farmakokinetiğinde bir etki göstermiştir. Yapılan klinik çalışmalarda AST veya ALT değerleri üst normal sınırın (ULN) 2,5 katından yüksek olan hastaları veya altta yatan bir maligniteye bağlı ise, >1,5x ULN toplam bilirubin değeri ile >5,0 x ULN olan hastalar hariç tutulmuştur. Hafif karaciğer yetmezliğine sahip 134 hastanın, orta karaciğer yetmezliğine sahip 8 hastanın ve normal karaciğer fonksiyonuna sahip 1216 hastanın farmakokinetik analizine dayanarak, osimertinib maruziyetleri benzerdi. Şiddetli karaciğer yetmezliğine sahip hastalarda veri mevcut değildir (bkz. Bölüm 4.2).
Böbrek yetmezliği:
Bir klinik çalışmada, tek bir oral 80 mg'lık TAGRISSO dozunun ardından ciddi böbrek yetmezliği olan hastalar (CLcr 15 ila < 30 mL/dak; n=7) normal böbrek fonksiyonu olanlarla (CLcr ≥ 90 mL/dak; n=8) karşılaştırıldığında AUC'de 1.85 katlık (%90 GA; 0.94, 3.64) ve Cda 1.19 katlık (%90 GA: 0.69, 2.07) bir artışı ortaya koymuştur. Ayrıca hafif böbrek bozukluğu olan 593 hasta (CLcr 60 ila < 90 mL/dak), orta düzeyde böbrek bozukluğu olan 254 hasta (CLcr 30 ila < 60 mL/dak), ciddi böbrek bozukluğu olan 5 hasta (CLcr 15 ila < 30 mL/dak) ve normal böbrek fonksiyonuna sahip 502 hastanın (CLcr ≥ 90 mL/dak) popülasyon farmakokinetik analizine göre, osimertinib maruziyetleri benzer olmuştur. CLcr ≤ 10 mL/dak olan hastalar klinik çalışmalara dahil edilmemiştir.
5.3. Klinik öncesi güvenlilik verileri
Sıçanlarda ve köpeklerde yapılan tekrarlı doz toksisitesi çalışmalarında gözlenen ana bulgular; dalaktaki sekonder değişiklikler ile birlikte, kornea epitelini (oftalmoloji muayenesinde köpeklerde korneal translüsensilerin ve opasitelerin eşlik ettiği), gastrointestinal sistem (dil dahil), cilt ve erkek ve dişi reprodüktif sistemlerini etkileyen atrofik, inflamatuvar ve/veya dejeneratif değişikliklerden oluşuyordu. Bu bulgular, 80 mg terapötik dozdaki hastalarda görülenlerin altındaki plazma konsantrasyonlarında görüldü. Dozlamanın 1 ayını takiben ortaya çıkan bulgular 1 aylık dozlama kesilmesi uygulandığında, bazı korneal değişikliklerde kısmi iyileşme görülmesi haricinde büyük oranda geri dönüşümlüydü.
Sıçanlarda yapılan 104 haftalık bir karsinojenisite çalışmasında, günde bir kez 80 mg'lık önerilen klinik dozda, insan EAA'sının 0,2 katı maruziyetlerde lens lifi dejenerasyonu tespit edilmiştir. Lens opasiteleri ilk olarak bu çalışmanın 52. haftasından itibaren fark edilmiş ve artan doz süresi ile insidans ve şiddette kademeli bir artış göstermiştir. Bu bulgunun klinik önemi göz ardı edilemez.
Osimertinib, sinomolgus maymunu (i.v. dozlama), sıçan ve farenin (oral uygulama) sağlam kan-beyin bariyerine nüfuz etmiştir.
Klinik dışı veriler, osimertinib ve metabolitinin (AZ5104) h-ERG kanalını inhibe ettiğine işaret etmektedir ve QTc uzatıcı etki hariç tutulamaz.
Karsinojenite ve mutajenite:
Osimertinib, in vitro ve in vivo analizlerde genetik hasara neden olmamıştır. Osimertinib, 26 hafta boyunca Tg rasH2 transgenik farelere oral yoldan uygulandığında hiçbir karsinojenik potansiyel göstermemiştir.
Sıçanlarda yapılan 104 haftalık karsinojenisite çalışmasında, önerilen günde bir kez 80 mg klinik dozda EAA'nın 0,2 katı maruziyetlerde mezenterik lenf düğümünde proliferatif vasküler lezyonların (anjiyomatöz hiperplazi ve hemanjiyom) insidansında artış gözlenmiştir; bunun insanlar için anlamlı olması muhtemel değildir.
Üreme toksisitesi:
≥ 1 ay boyunca osimertinibe maruz kalan sıçanların ve köpeklerin testislerinde dejeneratif değişiklikler mevcuttu ve sıçanlarda, 3 aylık osimertinib maruziyetini takiben erkek fertilitesinde bir azalma vardı. Bu bulgular, klinik olarak geçerli plazma konsantrasyonlarında görüldü. 1 aylık dozlamayı takiben görülen testislerdeki patoloji bulguları, sıçanlarda geri dönüşümlüydü ancak köpekler için bu lezyonların geri dönüşümlü olduğuna ilişkin kesin bir açıklama yapılamamaktadır.
Hayvanlarda yapılan araştırmalara göre, dişi fertilitesi osimertinib tedavisi ile bozulabilir. Tekrarlanan doz toksisite çalışmalarında, klinik olarak ilgili plazma konsantrasyonlarında osimertinibe ≥1 ay boyunca maruz kalan sıçanlarda yumurtalıklarda anöstrus, korpus luteum dejenerasyonu ve uterus ile vajinada epitel incelmesi insidansında artış görülmüştür. 1 aylık dozlamayı takiben yumurtalıklarda görülen bulgular geri dönüşümlüdür. Sıçanlarda yapılan bir dişi fertilite çalışmasında, 20 mg/kg/gün osimertinib uygulamasının (önerilen günlük 80 mg'lık klinik doza yaklaşık olarak eşit) östrus döngüsü veya gebe kalan dişilerin sayısı üzerinde hiçbir etkisi olmamış, ancak erken embriyonik ölümlere neden olmuştur.Bu bulgular,
1 aylık doz kesilmesinin ardından geri dönüşlü olduğuna dair kanıtlar gösterdi.
Sıçanlarda yapılan bir modifiye embriyofetal gelişim çalışmasında osimertinib, embriyonik implantasyon öncesinde gebe sıçanlarda uygulandığında embriyoletaliteye neden olmuştur. Bu etkiler, annenin tolere edebildiği 20 mg/kg'lik dozda görülmüştür, bu dozun maruziyeti insanlarda önerilen günlük 80 mg'nin maruziyetine (toplam EAA'ya göre) eşdeğerdir. Organogenez sırasında 20 mg/kg ve üzerindeki dozlarda maruziyet, fetal ağırlıkların azalmasına yol açmıştır ancak eksternal veya visseral fetal morfoloji üzerinde advers etki görülmemiştir. Osimertinib, gestasyon döneminde ve sonrasında erken laktasyon dönemine kadar gebe dişi sıçanlara uygulandığında, emzirilen yavrularda osimertinib ve metabolitlerine gösterilebilir maruziyet ve ilaveten yavru sağkalımında azalma ve yavru büyümesinde geri kalma (20 mg/kg ve üzerindeki dozlarda) görülmüştür.
 Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir.
Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir. |
 Dış Gebelik
Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep
olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan
bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur.
Dış Gebelik
Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep
olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan
bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur. |
İLAÇ GENEL BİLGİLERİ
AstraZeneca Türkiye İlaç Sanayi ve Ticaret Ltd.Şti.
| Geri Ödeme Kodu | A16807 |
| Satış Fiyatı | 181263.7 TL [ 26 Apr 2024 ] |
| Önceki Satış Fiyatı | 181263.7 TL [ 22 Apr 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699786092877 |
| Etkin Madde | Mertinib Mesilat |
| ATC Kodu | L01EB04 |
| Birim Miktar | 80 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 28 |
| Antineoplastik ve İmmünomodülatör Ajanlar |
| İthal ( ref. ülke : Isvec ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Omurilik zedelenmeleri Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir. |
 |
Travma Sonrası Bunalımı Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir. |
 |
Kalp Krizi Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |