RYDAPT 25 mg yumuşak kapsül (112 kapsül) Kısa Ürün Bilgisi
{ Midostaurin }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
RYDAPT 25 mg yumuşak kapsül
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Midostaurin 25 mg
Yardımcı maddeler
Etanol anhidröz 83,3 mg
Yardımcı maddelerin tam listesi için bölüm 6.1'e bakınız.
3. FARMASÖTİK FORMU
Yumuşak kapsül
Üzerinde kırmızı mürekkeple âPKC NVRâ yazan, soluk turuncu, oblong kapsül.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
RYDAPT aşağıdaki endikasyonlarda kullanılır:
FLT-3 mutasyonu pozitif akut miyeloblastik lösemi tanısı konulmuş olan ve yoğun kemoterapiye (standart doz 3+7 remisyon indüksiyonu ve yüksek doz ARA-C ile konsolidasyon tedavisi) uygun hastalarda remisyon indüksiyon tedavisi ve postremisyon tedavisi ile kombine olarak,
İlerlemiş sistemik mastositozlu erişkin hastaların tedavisinde.
4.2. Pozoloji ve uygulama şekli
RYDAPT tedavisi, anti-kanser tedavilerinin kullanımında deneyimli bir hekim tarafından başlatılmalıdır.
Midostaurin almadan önce AML hastalarında, valide edilmiş bir test kullanılarak FLT3 mutasyonu (internal tandem duplikasyonu [ITD] veya tirozin kinaz domaini [TKD]) doğrulanmalıdır.
Pozoloji:
Akut miyeloid lösemi (AML)
Önerilen RYDAPT dozu günde iki kere 50 mg'dır.
RYDAPT, indüksiyon ve konsolidasyon kemoterapi sikluslarının 8.-21. günlerinde kemoterapi ile kombine olarak kullanılır. Hematopoietik kök hücre nakli (SCT) almakta olan hastalarda RYDAPT, SCT'ye hazırlık tedavisinden 48 saat önce kesilmelidir.
AML'de doz değişiklikleri:
AML'li hastalarda RYDAPT için doz değişikliklerine yönelik öneriler Tablo 1'de sunulmaktadır.
Tablo 1 AML'li hastalarda RYDAPT için doz kesintisi, azaltılması ve bırakılmasına yönelik öneriler
Faz | Kriterler | RYDAPT dozu |
İndüksiyon ve konsolidasyon | Derece 3/4 pulmoner infiltratlar | Siklusun kalanında RYDAPT'a ara verin. İnfiltrat Derece ≤ 1'e düzeldiğinde RYDAPT'a aynı dozdan devam edin. |
Diğer hematolojik olmayan Derece 3/4 toksisiteler | RYDAPT ile ilişkili olabileceği değerlendirilen toksisiteler Derece ≤ 2'ye düzelene kadar RYDAPT'a ara verin. Daha sonra RYDAPT'a devam edin. | |
QTc aralığının >470 milisaniye ve ≤ 500 milisaniye olması | Siklusun kalanında RYDAPT dozunu günde bir kez 50 mg'a düşürün. Bir sonraki siklusun başında QTc aralığının ≤ 470 milisaniyeye düzelmesi koşuluyla bu siklusun başında RYDAPT'a başlangıç dozundan devam edin. Aksi halde günde bir kez RYDAPT 50 mg'a devam edin. | |
QTc aralığının >500 milisaniye olması | Siklusun kalanında RYDAPT dozlarını durdurun veya ara verin. Eğer bir sonraki siklustan hemen önce QTc aralığı ≤ 470 milisaniyeye düzelirse, RYDAPT'a başlangıç dozundan devam edin. Eğer bir sonraki siklusun başlayacağı zamanda QTc aralığında düzelme olmazsa, o siklus sırasında RYDAPT uygulamayın. RYDAPT, QTc düzelene kadar gereken siklus sayısınca durdurulabilir. |
İlerlemiş SM, SM-AHN ve MCL:
RYDAPT'ın önerilen başlangıç dozu günde iki kez oral yolla 100 mg'dır.
Klinik fayda gözlendiği sürece ya da kabul edilemez toksisite medyana gelene kadar tedaviye
devam edilmelidir.
İlerlemiş SM, SM-AHN ve MCL'de doz değişiklikleri:
İlerlemiş SM'li hastalarda RYDAPT için doz değişikliklerine yönelik öneriler Tablo 2'de sunulmaktadır.
Tablo 2 İlerlemiş SM, SM-AHN ve MCL'li hastalarda RYDAPT için doz kesintisi,
azaltılması ve bırakılmasına yönelik öneriler
Kriterler | RYDAPT dozu |
MCL'si olmayan hastalarda RYDAPT ile ilişkili ANC <1 x 10/l veya başlangıçtaki ANC değeri 0,5-1,5 x 10/l olan hastalarda RYDAPT ile ilişkili ANC <0,5 x 10/l | ANC ≥1 x 10/l olana kadar RYDAPT'a ara verin ve ardından günde iki kez 50 mg ile devam edin ve tolere edildiği takdirde günde iki kez 100 mg'a yükseltin. Eğer düşük ANC >21 gün devam ederse ve RYDAPT ile ilişkili olduğundan şüphe ediliyorsa RYDAPT'ı kesin. |
MCL'si olmayan hastalarda RYDAPT ile ilişkili 50 x 10/l'den düşük trombosit sayısı veya başlangıçtaki trombosit sayısı 25-75 x 10/l olan hastalarda RYDAPT ile ilişkili 25 x 10/l'den düşük trombosit sayısı | Trombosit sayısı ≥ 50 x 10/l olana kadar RYDAPT'a ara verin ve ardından günde iki kez 50 mg ile devam edin ve tolere edildiği takdirde günde iki kez 100 mg'a yükseltin. Eğer düşük trombosit sayısı >21 gün devam ederse ve RYDAPT ile ilişkili olduğundan şüphe ediliyorsa RYDAPT'ı kesin. |
MCL'si olmayan hastalarda RYDAPT ile ilişkili 8 g/dl'nin altında hemoglobin veya başlangıçtaki hemoglobin değeri 8-10 g/dl olan hastalarda RYDAPT ile ilişkili yaşamı tehdit edici anemi | Hemoglobin ≥ 8 g/dl olana kadar RYDAPT'a ara verin ve ardından günde iki kez 50 mg ile devam edin ve tolere edildiği takdirde günde iki kez 100 mg'a yükseltin. Eğer düşük hemoglobin >21 gün devam ederse ve RYDAPT ile ilişkili olduğundan şüphe ediliyorsa RYDAPT'ı kesin. |
Optimal antiemetik tedaviye rağmen Derece 3/4 bulantı ve/veya kusma | RYDAPT'a 3 gün (6 doz) ara verin, ardından günde iki kez 50 mg ile devam edin ve tolere edildiği takdirde aşamalı olarak günde iki kez 100 mg'a yükseltin. |
Diğer Derece 3/4 hematolojik olmayan toksisiteler | Olay Derece ≤2 olana kadar RYDAPT'a ara verin ve ardından günde iki kez 50 mg ile devam edin ve tolere edildiği takdirde günde iki kez 100 mg'a yükseltin. Eğer toksisite 21 gün içinde Derece ≤2'ye düzelmezse veya azaltılmış bir RYDAPT dozunda şiddetli toksisite tekrar meydana gelirse RYDAPT'ı kesin. |
ANC: Mutlak Nötrofil Sayısı CTCAE şiddet derecesi: Derece 1 = hafif semptomlar; 2 = orta şiddetli semptomlar; 3 = ağır semptomlar; 4 = yaşamı tehdit edici semptomlar. | |
Uygulama şekli:
Oral kullanım içindir.
RYDAPT, yaklaşık 12 saat aralıklarla günde iki kere oral yolla alınmalıdır. Kapsüller yemekle birlikte alınmalıdır (bkz. Bölüm 4.5 ve 5.2).
Hastanın toleransına göre yerel tıbbi uygulamalara uygun olarak profilaktik antiemetikler uygulanmalıdır.
RYDAPT kapsüller bir bardak suyla bütün olarak yutulmalıdır. Dozu doğru uygulamak ve kapsül içeriğinin hoş olmayan tadından kaçınmak için kapsüller açılmamalı, ezilmemeli ya da çiğnenmemelidir.
Eğer bir doz kaçırılırsa, hasta bir sonraki dozu planlanmış olan zamanda almalıdır.
Eğer kusma meydana gelirse, hasta ilave bir RYDAPT dozu almamalı, fakat bir sonraki planlanmış dozu almalıdır.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek yetmezliği:
Hafif ila orta şiddette böbrek yetmezliği olan hastalarda doz ayarlaması gerekli değildir. Şiddetli böbrek yetmezliği olan hastalarda klinik deneyim sınırlıdır. Son evre böbrek hastalığı olan hastalarda veri mevcut değildir (bkz. Bölüm 4.4 ve 5.2).
Karaciğer yetmezliği:
Hafif ila orta şiddette (Child-Pugh A ya da B) karaciğer yetmezliği olan hastalarda doz ayarlaması gerekli değildir. Şiddetli karaciğer yetmezliği olan hastalarda midostaurin ve aktif metaboliti CGP62221'e maruziyet, normal karaciğer fonksiyonu olan hastalara göre önemli ölçüde daha düşüktür (bkz. Bölüm 5.2). Bununla birlikte, şiddetli karaciğer yetmezliği olan hastalarda doz ayarlamasının gerekli olduğunu düşündürecek yeterli etkililik verisi bulunmamaktadır.
Pediyatrik popülasyon:
RYDAPT, hematolojik iyileşmenin gecikmesi (uzun süreli şiddetli nötropeni ve trombositopeni gibi) riski nedeniyle antrasiklinler, fludarabin ve sitarabin dahil olmak üzere yoğun pediyatrik AML kombinasyon kemoterapi rejimleriyle kombinasyon halinde kullanılmamalıdır (bkz. Bölüm 4.4 ve 5.1)
Geriyatrik popülasyon:
65 yaş üzerindeki hastalarda doz rejimi ayarlaması gerekli değildir (bkz. Bölüm 5.2). Midostaurin ile 60-70 yaş AML hastalarında sınırlı deneyim mevcuttur ve 70 yaş üzeri AML hastalarında deneyim bulunmamaktadır. ≥60 yaş hastalarda RYDAPT sadece yoğun indüksiyon kemoterapisi almaya uygun olup yeterli performans durumuna sahip olan ve önemli eşlik eden hastalıkları bulunmayan hastalarda kullanılmalıdır.
Akut premiyelositik lösemi:
RYDAPT, akut premiyelositik lösemisi olan hastalarda çalışılmamıştır ve bu nedenle bu hasta popülasyonunda kullanımı önerilmez.
4.3. Kontrendikasyonlar
Etkin madde
birine karşı aşırı duyarlılığı olan hastalarda ve
Kuvvetli CYP3A4 indükleyicileri (örn. rifampisin, Sarı kantaron (Hypericum perforatum), karbamazepin, enzalutamid, fenitoin) ile eşzamanlı kullanımı (bkz. Bölüm 4.5) kontrendikedir.
4.4. Özel kullanım uyarıları ve önlemleri
Nötropeni ve enfeksiyonlar
Monoterapi olarak ve kemoterapi ile kombinasyon halinde RYDAPT alan hastalarda nötropeni meydana gelmiştir (bkz. Bölüm 4.8). Şiddetli nötropeninin (ANC <0,5 x 10/l), ilerlemiş SM, SM-AHN ve MCL çalışmalarında RYDAPT uygulamasına düzelene kadar ara verilmesi ya da tedavinin bırakılması ile genellikle reversibl olduğu görülmüştür. Özellikle tedavi başlangıcında olmak üzere lökositler düzenli olarak takip edilmelidir.
Açıklanamayan şiddetli nötropeni geliştiren hastalarda, Tablo 1 ve 2'de önerildiği şekilde, ANC ≥1x10/l olana kadar RYDAPT tedavisine ara verilmelidir. RYDAPT ile bağlantılı olduğundan şüphelenilen, rekürren ya da uzun süreli şiddetli nötropeni geliştiren hastalarda RYDAPT tedavisi kesilmelidir (bkz. Bölüm 4.2).
RYDAPT monoterapisi başlatılmadan önce tüm aktif ciddi enfeksiyonlar kontrol altına alınmalıdır. Hastalar enfeksiyon işaretleri ve semptomları açısından takip edilmelidir ve enfeksiyon tanısı konulursa, gerekli olması durumunda RYDAPT'ın bırakılması dahil olmak üzere, uygun tedavi geciktirilmeden başlatılmalıdır.
Kardiyak disfonksiyon
Semptomatik konjestif kalp yetmezliği olan hastalar klinik çalışmaların dışında tutulmuştur. İlerlemiş SM, SM-AHN ve MCL çalışmalarında, konjestif kalp yetmezliği (KKY) (bazı ölümler dahil olmak üzere) ve sol ventriküler ejeksiyon fraksiyonunda (LVEF) geçici azalmalar gibi kardiyak disfonksiyon vakaları meydana gelmiştir. AML çalışmasında RYDAPT + kemoterapi ve plasebo + kemoterapi arasında KKY ya da LVEF disfonksiyonu açısından farklılık gözlenmemiştir. Risk altındaki hastalarda RYDAPT dikkatli bir şekilde kullanılmalı ve hastalar yakından takip edilmelidir (başlangıçta ve tedavi sırasında).
Midostaurin ile tedavi edilen hastalarda QTc uzama sıklığının arttığı kaydedilmiştir (bkz. Bölüm 4.8); ancak bu gözlem için mekanistik bir açıklama bulunmamıştır. QTc uzaması açısından risk altında olan hastalara (örn. eşzamanlı tıbbi ürünler ve/veya elektrolit bozuklukları nedeniyle) dikkat etmek gereklidir. Eğer RYDAPT, QT aralığını uzatan tıbbi ürünlerle bir arada alınıyorsa, EKG ile QT aralığı değerlendirmeleri düşünülmelidir.
Pulmoner toksisite
RYDAPT monoterapisi ya da kemoterapiyle kombinasyon halinde RYDAPT ile tedavi edilen hastalarda, bazı vakalarda ölümcül olmak üzere interstisyel akciğer hastalığı (İAH) ve pnömonit meydana gelmiştir. Hastalar İAH/pnömonite işaret eden pulmoner semptomlar açısından takip edilmeli ve ≥3. derece (NCI CTCAE) enfeksiyon kaynaklı bir etiyoloji olmayan İAH /pnömonite işaret eden pulmoner semptomlar yaşayan hastalarda RYDAPT bırakılmalıdır.
Embriyofetal toksisite ve emzirme
Gebe kadınlar, fetusun maruz kalacağı potansiyel risk konusunda bilgilendirilmelidir; gebe kalma potansiyeline sahip kadınlara, RYDAPT ile tedaviye başlamadan önceki 7 gün içinde gebelik testi yapmaları ve RYDAPT tedavisi sırasında ve tedavi durdurulduktan sonra en az 4 ay boyunca etkili doğum kontrol yöntemleri kullanmaları önerilmelidir.
Emzirilen bebeklerde RYDAPT kaynaklı ciddi advers etki potansiyeli nedeniyle, kadınlara RYDAPT tedavisi sırasında ve tedavi sonlandırıldıktan sonra en az 4 ay boyunca çocuk emzirmeyi bırakmaları önerilmelidir (bkz. Bölüm 4.6).
Pediyatrik popülasyon
RYDAPT, hematolojik iyileşmenin gecikmesi (uzun süreli şiddetli nötropeni ve trombositopeni gibi) riski nedeniyle antrasiklinler, fludarabin ve sitarabin dahil olmak üzere yoğun pediyatrik AML kombinasyon kemoterapi rejimleriyle kombinasyon halinde kullanılmamalıdır (bkz. Bölüm 4.2 ve 5.1)
Şiddetli böbrek bozukluğu
Şiddetli böbrek bozukluğu olan hastalarda ve son dönem böbrek hastalığı olanlarda midostaurinin uygulanması düşünülürken dikkatli olunmalıdır ve hastalar toksisite açısından izlenmelidir (bkz. Bölüm 5.2)
Etkileşimler
Midostaurin, bunlarla sınırlı olmamakla birlikte antifungaller (örn. ketokonazol), belirli antiviraller (örn. ritonavir), makrolid antibiyotikler (örn. klaritromisin) ve nefazodon gibi güçlü CYP3A4 inhibitörleri ile bir arada reçete edilirken dikkatli olmak gerekir çünkü bunlar, özellikle de midostaurin tedavisine (yeniden) başlanırken, midostaurinin plazma konsantrasyonunu artırabilirler (bkz. Bölüm 4.5). CYP3A4 aktivitesini güçlü bir şekilde inhibe etmeyen alternatif tıbbi ürünler düşünülmelidir. Tatmin edici terapötik alternatiflerin mevcut olmadığı durumlarda hastalar midostaurin ile ilişkili toksisite bakımından yakından izlenmelidir.
Yardımcı maddeler
RYDAPT, hidrojenize hintyağı içermektedir. Hidrojenize hintyağı, mide bulantısına ve ishale sebep olabilir.
Günlük 100 mg kullanım dozu:
RYDAPT'ın 100 mg'lık bir dozu, 333 mg'a alkole karşılık gelen yaklaşık %14 hacim susuz etanol içerir. Bu değer, 8,5 ml bira veya 3,5 ml şaraba eşdeğerdir. Alkol; alkol ile ilişkili sorunları, epilepsisi veya karaciğer sorunları olan hastalarda veya gebelik ya da emzirme sırasında zararlı olabilir.
Günlük 200 mg kullanım dozu:
RYDAPT'ın 200 mg'lık bir dozu, 666 mg'a alkole karşılık gelen yaklaşık %14 hacim susuz etanol içerir. Bu değer, 17 ml bira veya 7,0 ml şaraba eşdeğerdir. Alkol; alkol ile ilişkili sorunları, epilepsisi veya karaciğer sorunları olan hastalarda veya gebelik ya da emzirme sırasında zararlı olabilir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Midostaurin, bir dizi eşzamanlı tıbbi ürün tarafından indüklenen ya da inhibe edilen CYP3A4 enzimleri aracılığıyla kapsamlı bir hepatik metabolizmaya uğrar.
Diğer tıbbi ürünlerin RYDAPT üzerindeki etkisi
CYP3A4 aktivitesini etkilediği bilinen tıbbi ürünler ya da maddeler, midostaurinin plazma konsantrasyonlarını ve dolayısıyla RYDAPT'ın güvenlilik ve/veya etkililiğini etkileyebilir.
Kuvvetli CYP3A4 indükleyicileri:
RYDAPT'ın kuvvetli CYP3A4 indükleyicileri (örn. karbamazepin, rifampisin, enzalutamid, fenitoin, Sarı kantaron [Hypericum perforatum]) ile eşzamanlı kullanımı kontrendikedir (bkz. Bölüm 4.3). Kuvvetli CYP3A4 indükleyicileri midostaurin ve metabolitlerine (CGP52421 ve CGP62221) maruziyeti azaltır. Sağlıklı gönüllüler üzerinde gerçekleştirilen bir çalışmada, kuvvetli CYP3A4 indükleyicisi rifampisinin (günde 600 mg) tek bir 50 mg'lık midostaurin dozuyla eşzamanlı olarak uygulanması, midostaurin Cdeğerini %73 ve EAAdeğerini
%96 düşürmüştür. CGP62221 de benzer bir patern sergilemiştir. CGP52421'in EAAdeğeri
%60 azalmıştır.
Kuvvetli CYP3A4 inhibitörleri:
Kuvvetli CYP3A4 inhibitörleri midostaurinin kandaki konsantrasyonlarını arttırabilir. 36 sağlıklı gönüllü üzerinde gerçekleştirilen bir çalışmada, kuvvetli CYP3A4 inhibitörü ketokonazol ile tek bir RYDAPT dozunun eşzamanlı uygulanması, midostaurin maruziyetinde anlamlı bir artışa (1,8 kat Cartışı ve 10 kat EAAartışı) yol açmıştır; diğer yandan, aktif metabolitler CGP62221 ve CGP52421'in pik konsantrasyonları yarı yarıya azalmıştır (bkz. Bölüm 5.2). Bir hasta alt kümesinde (N=7) midostaurin, güçlü CYP3A4 inhibitörü itrakonazol ile birlikte kararlı plazma konsantrasyonuna ulaşmış iken (21 gün süreyle günde iki kez 50 mg), midostaurin kararlı durum maruziyeti (C) 2.09-kat artmıştır. CGP52421'in Cdeğeri 1.3 kat artmış, CGP62221 maruziyeti üzerinde ise herhangi bir etki gözlenmemiştir (bkz. Bölüm 4.4).
RYDAPT'ın diğer tıbbi ürünler üzerindeki etkisi
CYP enzimlerinin substratları
Sağlıklı gönüllülerde, kararlı durumda çoklu dozlarda midostaurin (günde iki kez 50 mg) ile tek doz bupropionun (CYP2B6 substratı) birlikte uygulanması, tek başına bupropion uygulaması ile karşılaştırıldığında bupropion EAAve EAAdeğerlerini sırasıyla %48 ve
%49 ve Cdeğerini %55 azaltmıştır. Bu, midostaurinin hafif bir CYP2B6 indükleyicisi olduğunu göstermektedir. CYP2B6'nın substratları olan dar bir terapötik aralığa sahip tıbbi ürünler (örn. bupropion veya efavirenz), midostaurin ile birlikte uygulandığında dikkatli kullanılmalılardır ve optimal maruziyeti sürdürmek için doz ayarlaması gerektirebilirler.
İn vitro verilere göre, midostaurin ve aktif metabolitleri CGP52421 ve CGP62221, CYP1A2 ve CYP2E1 inhibitörleri ve CYP1A2 indükleyicileridir. Bu nedenle, CYP1A2 (örn. tizanidin) ve CYP2E1'in (örn. klorzoksazon) substratları olan dar bir terapötik aralığa sahip tıbbi ürünler, midostaurin ile birlikte uygulandığında dikkatli kullanılmalılardır ve optimal maruziyeti sürdürmek için doz ayarlaması gerektirebilirler.
Taşıyıcıların substratları
Sağlıklı gönüllülerde, tek doz rosuvastatinin (BCRP substratı) tek doz midostaurin (100 mg) ile birlikte uygulanması, rosuvastatin EAAve EAAdeğerlerini sırasıyla %37 ve %48 oranında artırmıştır; Tek başına rosuvastatin uygulamasına kıyasla Cyaklaşık iki kat (2.01 kat) artmıştır. Bu, midostaurinin BCRP substratları üzerinde hafif bir inhibitör etkiye sahip olduğunu göstermektedir. Taşıyıcı BCRP'nin substratları olan dar bir terapötik aralığa sahip tıbbi ürünler (örn. rosuvastatin veya atorvastatin), midostaurin ile birlikte uygulandıklarında dikkatli kullanılmalıdırlar ve optimal maruziyeti sürdürmek için doz ayarlaması gerektirebilirler.
Hormonal kontraseptifler
Sağlıklı kadınlarda, kararlı durumda çoklu midostaurin dozları (günde iki kez 50 mg) ile etinil estradiol ve levonorgestrel içeren oral kontraseptifler arasında klinik olarak anlamlı farmakokinetik ilaç-ilaç etkileşimi olmamıştır. Bu nedenle, midostaurinin birlikte uygulanmasının bu kombinasyonun kontraseptif güvenilirliğini tehlikeye atması beklenmemektedir.
Besinlerle etkileşimler
Sağlıklı gönüllülerde midostaurin emilimi (EAA), RYDAPT standart bir öğünle birlikte uygulandığında ortalama % 22 ve yağ açısından zengin bir öğünle birlikte uygulandığında ortalama % 59 artmıştır. Pik midostaurin konsantrasyonu (C), açken yapılan uygulamayla karşılaştırıldığında, standart bir öğünle %20 ve yağ açısından zengin bir öğünle % 27 azalmıştır (bkz. Bölüm 5.2).
RYDAPT'ın yemek ile alınması önerilir.
4.6. Gebelik ve laktasyon
Gebelik kategorisi: D
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeline sahip kadınlar, hayvan çalışmalarında midostaurinin gelişen fötus açısından zararlı olduğunun gösterildiği konusunda bilgilendirilmelidir. Çocuk doğurma potansiyeline sahip cinsel açıdan aktif kadınların RYDAPT tedavisine başlamadan önceki 7 gün içinde bir gebelik testi yaptırmaları ve RYDAPT kullanırken ve RYDAPT ile tedavi sonlandırıldıktan sonra en az 4 ay boyunca etkili doğum kontrol yöntemleri (%1'den daha düşük gebelik oranlarına neden olan yöntemler) kullanmaları önerilmektedir.
Gebelik dönemi
Midostaurin, gebe bir kadına uygulandığında fetal hasara yol açabilir. Gebe kadınlarda yeterli ve iyi kontrollü çalışmalar yapılmamıştır. Sıçanlar ve tavşanlar üzerinde gerçekleştirilen üreme çalışmalarında, midostaurinin fetotoksisiteye neden olduğu gösterilmiştir (bkz. Bölüm 5.3). RYDAPT gebelik sırasında ya da doğum kontrol yöntemleri kullanmayan, çocuk doğurma potansiyeline sahip kadınlarda önerilmemektedir. Gebe kadınlar, fetusun maruz kalacağı potansiyel risk konusunda bilgilendirilmelidir.
RYDAPT gerekli olmadıkça gebelik döneminde kullanılmamalıdır.
Laktasyon dönemi
Midostaurinin insan sütüyle atılıp atılmadığı bilinmemektedir. Hayvanlar üzerinde yapılan çalısmalar midostaurinin sütle atıldığını göstermektedir. Emzirmenin durdurulup durdurulmayacağına ya da RYDAPT tedavisinin durdurulup durdurulmayacağına/tedaviden kaçınılıp kaçınılmayacağına iliskin karar verilirken, emzirmenin çocuk açısından faydası ve RYDAPT tedavisinin emziren anne açısından faydası dikkate alınmalıdır.
RYDAPT ile tedavi sırasında ve tedavi sonlandırıldıktan sonra 4 ay boyunca bebek
emzirilmemelidir.
Üreme yeteneği/Fertilite
RYDAPT'ın insan fertilitesi üzerindeki etkisine ilişkin veri bulunmamaktadır. Midostaurin ile
gerçekleştirilen havyan çalışmaları bozulmuş fertilite göstermiştir (bkz. Bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
RYDAPT'ın araç ve makine kullanımı üzerinde minör etkileri bulunmaktadır. RYDAPT kullanan hastalarda sersemlik hali ve vertigo bildirilmiştir ve hastanın araç ve makine kullanma becerisi değerlendirilirken bunların göz önünde bulundurulması gerekir.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti
AML
Yeni tanısı konmuş FLT3-mutasyonlu AML'si olan hastalarda RYDAPT'ın güvenlilik değerlendirmesi (günde iki kere 50 mg), 717 hastadan oluşan bir faz III, randomize, çift kör, plasebo kontrollü çalışmayı temel almaktadır. RYDAPT artı standart kemoterapi kolundaki hastalar için toplam medyan maruziyet süresi 42 gün (aralık 2 ila 576 gün) ve plasebo artı standart kemoterapi kolundaki hastalar için 34 gündür (aralık 1 ila 465 gün). İdame fazına girmiş 205 hasta için (RYDAPT kolunda 120 ve plasebo kolunda 85) medyan maruziyet süresi her iki kol için 11 ay (RYDAPT kolundaki hastalar için 16 ila 520 gün; plasebo kolundaki hastalar için 22 ila 381 gün) olarak belirlenmiştir.
RYDAPT kolunda en sık gözlenen advers reaksiyonlar febril nötropeni (% 83,4), mide bulantısı (% 83,4), eksfolyatif dermatit (% 61,6), kusma (% 60,7), baş ağrısı (% 45,9), peteşi (% 35,8) ve yüksek ateş (% 34,5) olmuştur. En sık derece 3/4 advers reaksiyonlar febril nötropeni (% 83,5), lenfopeni (% 20,0), cihazla ilişkili enfeksiyon (% 15,7), eksfolyatif dermatit (% 13,6), hiperglisemi (% 7) ve bulantı (% 5,8) olmuştur. En sık laboratuvar anormalliklerinin hemoglobin düşüşü (% 97,3), ANC düşüşü (% 86,7), ALT artışı (% 84,2), AST artışı (% 73,9) ve hipokalemi (% 61,7) olduğu belirlenmiştir. En sık derece 3/4 laboratuvar anormalliklerinin ANC düşüşü (% 85,8), hemoglobin düşüşü (% 78,5), ALT artışı (% 19,4) ve hipokalemi (% 13,9) olduğu görülmüştür.
Ciddi advers reaksiyonlar RYDAPT ve plasebo kollarında benzer oranda hastalarda meydana gelmiştir. Her iki kolda da en sık görülen advers reaksiyon febril nötropeni (% 16) olmuştur.
Herhangi bir advers reaksiyon nedeniyle çalışma bırakma, RYDAPT kolundaki hastaların % 3,1'inde ve plasebo kolundaki hastaların % 1,3'ünde meydana gelmiştir. RYDAPT kolunda çalışmanın bırakılmasına yol açan ve en sık gözlenen Derece 3/4 advers reaksiyon eksfolyatif dermatittir (% 1,2).
İlerlemiş SM, SM-AHN ve MCL
142 hastayı kapsayan tek kollu, açık etiketli, çok merkezli iki çalışmada, ilerlemiş SM'si olan hastalarda tekli ajan olarak RYDAPT'ın güvenliliği (günde iki kere 100 mg) değerlendirilmiştir. RYDAPT'a medyan maruziyet süresi 11,4 aydır (aralık: 0 ila 81 ay).
En sık gözlenen advers reaksiyonlar mide bulantısı (% 82), kusma (% 68), ishal (% 51), periferik ödem (% 35) ve yorgunluktur (% 31). En sık gözlenen Derece 3/4 advers reaksiyonlar yorgunluk (% 8,5), sepsis (% 7,7), pnömoni (% 7), febril nötropeni (% 7) ve ishaldir (% 6,3). En sık gözlenen ve hematolojik olmayan laboratuar anormallikleri hiperglisemi (% 93,7), toplam bilirubin artışı (% 40,1), lipaz artışı (% 39,4), AST artışı (% 33,8) ve ALT artışı (% 33,1) olarak belirlenmiştir; diğer yandan, en sık gözlenen hematolojik laboratuar anormallikleri mutlak lenfosit sayısında düşüş (% 73,2) ve ANC düşüşü (% 58,5) olduğu görülmüştür. En sık gözlenen Derece 3/4 laboratuar anormallikleri mutlak lenfosit sayısında düşüş (% 45,8), ANC düşüşü (% 26,8), hiperglisemi (% 19) ve lipaz artışı (% 17,6) olmuştur.
Hastaların % 31'inde advers reaksiyonlar nedeniyle doz değişiklikleri (kesinti ya da ayarlama) yapılmıştır. Doz değişikliğine yol açan (insidans ≥% 5) ve en sık gözlenen advers reaksiyonlar mide bulantısı ve kusmadır.
Hastaların % 9,2'sinde tedavinin bırakılmasına yol açan advers reaksiyonlar meydana gelmiştir. En sık gözlenenler (insidans ≥%1) febril nötropeni, mide bulantısı, kusma ve plevra efüzyonudur.
Tablo haline getirilmiş advers reaksiyonların listeleri
Advers reaksiyonlar MedDRA sistem organ sınıfına göre listelenmektedir. Her bir sistem organ sınıfı içinde, advers reaksiyonlar sıklığa göre sıralanmaktadır ve en sık reaksiyonlar ilk olarak yazılmaktadır. Buna ek olarak, aşağıdaki terimler (CIOMS III) kullanılarak, her bir advers reaksiyon için ilgili sıklık kategorisi de sunulmaktadır:
Çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila <1/100); seyrek (≥1/10.000 ila <1/1000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
AML:
Tablo 3'te, yeni tanısı konmuş, FLT3-mutasyonlu AML hastaları üzerinde gerçekleştirilen faz
III çalışmada ve pazarlama sonrası elde edilen deneyimler esnasında bildirilen advers
reaksiyonların sıklık kategorileri gösterilmektedir.
Tablo 3 AML'de gözlenen advers reaksiyonlar
Advers reaksiyon | Tüm dereceler | Derece 3/4 | Sıklık kategorisi |
Rydapt + kemoterapi n=229 % | Rydapt + kemoterapi n=345 % | ||
Enfeksiyonlar ve enfestasyonlar | |||
Cihazla bağlantılı enfeksiyonlar | 24 | 15,7 | Çok yaygın |
Üst solunum yolu enfeksiyonu | 5,2 | 0,6 | Yaygın |
Nötropenik sepsis | 0,9 | 3,5 | Yaygın olmayan |
Kan ve lenf sistemi hastalıkları | |||
Febril nötropeni | 83,4 | 83,5 | Çok yaygın |
Peteşi | 35,8 | 1,2 | Çok yaygın |
Lenfopeni | 16,6 | 20 | Çok yaygın |
Bağışıklık sistemi hastalıkları | |||
Aşırı duyarlılık | 15,7 | 0,6 | Çok yaygın |
Metabolizma ve beslenme hastalıkları | |||
Hiperürikasemi | 8,3 | 0,6 | Yaygın |
Psikiyatrik hastalıklar | |||
İnsomnia | 12,2 | 0 | Çok yaygın |
Sinir sistemi hastalıkları | |||
Baş ağrısı | 45,9 | 2,6 | Çok yaygın |
Senkop | 5,2 | 4,6 | Yaygın |
Tremor | 3,9 | 0 | Yaygın |
Göz hastalıkları | |||
Göz kapağı ödemi | 3,1 | 0 | Yaygın |
Kardiyak hastalıkları | |||
Hipotansiyon | 14,4 | 5,5 | Çok yaygın |
Sinüs taşikardisi | 9,6 | 1,2 | Yaygın |
Hipertansiyon | 7,9 | 2,3 | Yaygın |
Perikard efüzyonu | 3,5 | 0,6 | Yaygın |
Solunum, göğüs bozuklukları ve mediastinal hastalıklar | |||
Epistaksis | 27,5 | 2,6 | Çok yaygın |
Laringeal ağrı | 11,8 | 0,6 | Çok yaygın |
İnterstisyel akciğer hastalığı ve pnömonit | 11,4 | 4,9 | Çok yaygın |
Dispne | 10,9 | 5,5 | Çok yaygın |
Nazofarenjit | 5,7 | 0,9 | Yaygın |
Plevral efüzyon | 8,7 | 0 | Yaygın |
Akut respiratuvar distres sendromu | 2,2 | 2,3 | Yaygın |
Gastrointestinal hastalıklar | |||
Mide bulantısı | 83,4 | 5,8 | Çok yaygın |
Kusma | 60,7 | 2,9 | Çok yaygın |
Stomatit | 21,8 | 3,5 | Çok yaygın |
Üst abdominal ağrı | 16,6 | 0 | Çok yaygın |
Hemoroidler | 15,3 | 1,4 | Çok yaygın |
Anorektal rahatsızlık | 7 | 0,9 | Yaygın |
Abdominal rahatsızlık | 3,5 | 0 | Yaygın |
Deri ve derialtı doku hastalıkları | |||
Eksfolyatif dermatit | 61,6 | 13,6 | Çok yaygın |
Hiperhidroz | 14,4 | 0 | Çok yaygın |
Deride kuruma | 7 | 0 | Yaygın |
Keratit | 6,6 | 0,3 | Yaygın |
Kas-iskelet bozukluklar, bağ doku ve kemik hastalıkları | |||
Sırt ağrısı | 21,8 | 1,4 | Çok yaygın |
Artralji | 14 | 0,3 | Çok yaygın |
Kemik ağrısı | 9,6 | 1,4 | Yaygın |
Uzuvlarda ağrı | 9,6 | 1,4 | Yaygın |
Boyun ağrısı | 7,9 | 0,6 | Yaygın |
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar | |||
Pireksi | 34,5 | 3,2 | Çok yaygın |
Kateter ile bağlantılı tromboz | 3,5 | 2 | Yaygın |
Araştırmalar | |||
Hemoglobin düşüşü* | 97,3 | 78,5 | Çok yaygın |
ANC düşüşü* | 86,7 | 85,8 | Çok yaygın |
ALT artışı* | 84,2 | 19,4 | Çok yaygın |
AST artışı* | 73,9 | 6,4 | Çok yaygın |
Hipokalemi* | 61,7 | 13,9 | Çok yaygın |
Hiperglisemi* | 20,1 | 7 | Çok yaygın |
Hipernatremi* | 20 | 1,2 | Çok yaygın |
Elektrokardiyogramda uzamış QT süresi | 19,7 | 5,8 | Çok yaygın |
Aktive parsiyel tromboplastin zamanı uzaması | 12,7 | 2,6 | Çok yaygın |
Hiperkalsemi* | 6,7 | 0,6 | Yaygın |
Kilo artışı | 6,6 | 0,6 | Yaygın |
*Sıklık, laboratuvar değerlerine dayanmaktadır. | |||
İlerlemiş SM, SM-AHN ve MCL:
Tablo 4'te, ilerlemiş SM, SM-AHN ve MCL'si olan hastalarda gerçekleştirilen iki çalışmadan elde edilen birleştirilmiş verilere dayalı advers reaksiyonların sıklık kategorileri gösterilmektedir.
Tablo 4 İlerlemiş SM, SM-AHN ve MCL'de gözlenen advers reaksiyonlar
Advers reaksiyon | Rydapt (günde 2 kez 100 mg) N=142 | Sıklık kategorisi | |
Tüm dereceler % | Derece ¾ % | ||
Enfeksiyonlar ve enfestasyonlar | |||
İdrar yolu enfeksiyonu | 13 | 2,8 | Çok yaygın |
Üst solunum yolu enfeksiyonu | 11 | 1,4 | Çok yaygın |
Pnömoni | 8,5 | 7,0 | Yaygın |
Sepsis | 7,7 | 7,7 | Yaygın |
Bronşit | 5,6 | 0 | Yaygın |
Oral herpes | 4,9 | 0 | Yaygın |
Sistit | 4,2 | 0 | Yaygın |
Sinüzit | 4,2 | 0,7 | Yaygın |
Erizipel | 3,5 | 1,4 | Yaygın |
Herpes zoster | 3,5 | 0,7 | Yaygın |
Kan ve lenf sistemi hastalıkları | |||
Febril nötropeni | 7,7 | 7,0 | Yaygın |
Bağışıklık sistemi hastalıkları | |||
Aşırı duyarlılık | 2,1 | 0 | Yaygın |
Anafilaktik şok | 0,7 | 0,7 | Yaygın olmayan |
Sinir sistemi hastalıkları | |||
Baş ağrısı | 26 | 1,4 | Çok yaygın |
Sersemlik | 13 | 0 | Çok yaygın |
Dikkat dağınıklığı | 7 | 0 | Yaygın |
Tremor | 6,3 | 0 | Yaygın |
Kulak ve iç kulak hastalıkları | |||
Vertigo | 4,9 | 0 | Yaygın |
Vasküler hastalıklar | |||
Hipotansiyon | 9,2 | 2,1 | Yaygın |
Hematom | 6,3 | 0,7 | Yaygın |
Solunum, göğüs bozuklukları ve mediastinal hastalıklar | |||
Dispne | 18 | 5,6 | Çok yaygın |
Öksürük | 16 | 0,7 | Çok yaygın |
Plevral efüzyon | 13 | 4,2 | Çok yaygın |
Epistaksis | 12 | 2,8 | Çok yaygın |
Orofaringeal ağrı | 4,2 | 0 | Yaygın |
İnterstisyel akciğer hastalığı ve pnömonit | 2,1 | 0 | Yaygın |
Gastrointestinal hastalıklar | |||
Mide bulantısı | 82 | 5,6 | Çok yaygın |
Kusma | 68 | 5,6 | Çok yaygın |
İshal | 51 | 6,3 | Çok yaygın |
Kabızlık | 29 | 0,7 | Çok yaygın |
Dispepsi | 5,6 | 0 | Yaygın |
Gastrointestinal kanama | 4,2 | 3,5 | Yaygın |
Genel hastalıklar ve uygulama bölgesine ilişkin hastalıklar | |||
Periferik ödem | 35 | 3,5 | Çok yaygın |
Yorgunluk | 31 | 8,5 | Çok yaygın |
Pireksi | 27 | 4,2 | Çok yaygın |
Asteni | 4,9 | 0,7 | Yaygın |
Titreme | 4,9 | 0 | Yaygın |
Ödem | 4,2 | 0,7 | Yaygın |
Araştırmalar | |||
Hiperglisemi (açken değil)* | 93,7 | 19,0 | Çok yaygın |
Mutlak lenfosit düşüşü* | 73,2 | 45,8 | Çok yaygın |
ANC düşüşü* | 58,5 | 26,8 | Çok yaygın |
Total bilirubin artışı* | 40,1 | 4,9 | Çok yaygın |
Lipaz artışı* | 39,4 | 17,6 | Çok yaygın |
AST artışı* | 33,8 | 2,8 | Çok yaygın |
ALT artışı* | 33,1 | 3,5 | Çok yaygın |
Amilaz artışı* | 20,4 | 7,0 | Çok yaygın |
Elektrokardiyogramda uzamış QT süresi | 10,6 | 0,7 | Çok yaygın |
Kilo artışı | 5,6 | 2,8 | Yaygın |
Yaralanma, zehirlenme ve prosedür komplikasyonları | |||
Konfüzyon | 6,3 | 0 | Yaygın |
Düşme | 4,2 | 0,7 | Yaygın |
*Sıklık, laboratuvar değerlerine dayanmaktadır. | |||
Seçilen advers reaksiyonların tanımı
Gastrointestinal hastalıklar
AML, İlerlemiş SM, SM-AHN ve MCL hastalarında bulantı, kusma ve ishal gözlenmiştir. İlerlemiş SM, SM-AHN ve MCL hastalarında bu olaylar, hastaların % 26'sında doz ayarlamasına veya dozlara ara verilmesine ve hastaların % 4,2'sinde tedavinin kesilmesine yol açmıştır. Olayların büyük kısmı tedavinin ilk 6 ayında meydana gelmiştir ve destekleyici profilaktik ilaçlarla iyi bir şekilde kontrol altına alınmıştır.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99)
4.9. Doz aşımı ve tedavisi
İnsanlarda doz aşımıyla ilgili olarak bildirilen deneyim sınırlıdır. 600 mg'a kadar tekli dozlar kabul edilebilir bir akut tolerabiliteyle uygulanmıştır. Gözlenen advers reaksiyonlar ishal, karın ağrısı ve kusma olmuştur.
Midostaurin için bilinen spesifik bir antidot bulunmamaktadır. Doz aşımı durumunda hasta, advers reaksiyonların işaret ve belirtileri bakımından yakından izlenmeli ve uygun destekleyici tedavi başlatılmalıdır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ajanlar, protein kinaz inhibitörleri ATC kodu: L01EX10
Etki mekanizması:
Midostaurin FLT3 ve KIT kinaz dahil olmak üzere birden fazla reseptör tirozin kinazı inhibe eder. Midostaurin, ITD ve TKD mutant reseptörlerin ekspresyonunu ya da yabanıl tip reseptörlerin aşırı ekspresyonunu yapan lösemik hücrelerde FLT3 reseptör sinyallemesini inhibe eder ve hücre döngüsünü durdurarak apoptozu indükler. İn vitro veriler midostaurinin hastalarda elde edilen maruziyet düzeylerinde D816V mutant KIT reseptörlerini inhibe ettiğini göstermektedir (ortalama elde edilen maruziyet > IC). İn vitro veriler KIT yabanıl tip reseptörlerinin, bu konsantrasyonlarda çok daha düşük ölçüde inhibe edildiğine işaret etmektedir (ortalama elde edilen maruziyet < IC). Midostaurin, aberan KIT D816V aracılı sinyallemeye müdahale eder ve mast hücre proliferasyonunu, sağkalımını ve histamin serbestlenmesini inhibe eder.
Midostaurin ayrıca PDGFR (trombosit türevli büyüme faktörü reseptörü) ya da VEGFR2 (vasküler endotelyal büyüme faktörü reseptörü 2) gibi birçok diğer reseptör tirozin kinazı ve ayrıca serin/treonin kinaz ailesi PKC'nin (protein kinaz C) bazı üyelerini de inhibe eder.
Midostaurin bu kinazların katalitik alanına bağlanır ve hücrelerdeki ilgili büyüme faktörlerinin mitojenik sinyallemesini inhibe ederek büyümenin durmasına yol açar.
Midostaurin, kemoterapötik ajanlarla (sitarabin, doksorubisin, idarubisin ve daunorubisin) kombinasyon halinde, FLT3-ITD ekspresyonu yapan AML hücre hatlarında sinerjik büyüme inhibisyonuna yol açmıştır.
Farmakodinamik etkiler:
Mürin modellerinde ve insanlarda iki temel metabolit belirlenmiştir: CGP62221 ve CGP52421. FLT3-ITD ekspresyonu yapan hücrelerle gerçekleştirilen proliferasyon deneylerinde, CGP62221 ana bileşiğe benzer bir potens sergilemiştir; diğer yandan, CGP52421 yaklaşık 10-kat daha az potent bulunmuştur.
Kardiyak elektrofizyoloji:
Günde iki kere 75 mg dozla 192 sağlıklı gönüllü üzerinde gerçekleştirilen bir QT çalışmasında, midostaurin ve CGP62221 ile klinik açıdan anlamlı QT uzaması gözlenmemiştir; ancak çalışma süresi, uzun etkili metabolit CGP52421'in QTc uzaması etkilerini tahmin etmek için yeterince uzun değildir. Dolayısıyla midostaurinin ve her iki metabolitin konsantrasyonuyla birlikte QTcF'deki başlangıca göre değişim, ilerlemiş SM, SM-AHN ve MCL'si olan 116 hastada gerçekleştirilen bir faz II çalışmada daha ayrıntılı olarak araştırılmıştır. Günde iki kere 100 mg dozda ulaşılan medyan pik Ckonsantrasyonlarda, midostaurin, CGP62221 ya da CGP52421, klinik açıdan anlamlı QTcF uzamasına yol açma potansiyeli sergilememiştir; çünkü bu konsantrasyon düzeylerinde öngörülen değişimin üst sınırları 10 milisaniyeden düşüktür (sırasıyla 5,8, 2,4 ve 4 msan). İlerlemiş SM, SM-AHN ve MCL popülasyonunda hastaların %25,4'ü 450 msn'den yüksek ve
%4,7'si 480 msn'den yüksek QTcF ile en az bir EKG ölçümüne sahiptir. Klinik etkililik:
AML
Plasebo artı standart kemoterapi karşısında standart kemoterapiyle kombinasyon halinde ve ayrıca tekli ajan idame tedavisi olarak midostaurinin etkililik ve güvenliliği, bir randomize, çift kör, faz III çalışmada 717 hasta üzerinde (18 ila 60 yaş) araştırılmıştır. Bir klinik çalışma deneyimi ile belirlenmiş, yeni tanı konmuş FLT3-mutasyonlu AML hastaları, ardışık olarak, standart daunorubisin (1.-3. günlerde günlük 60 mg/m) / sitarabin (1.-7. günlerde günlük 200
mg/m) indüksiyonu ve yüksek doz sitarabin (1., 3., 5. günlerde 12 saatte 1 3 g/m) konsolidasyonu ile kombinasyon halinde günde iki kere 50 mg midostaurin (n=360) veya plasebo (n=357) (1:1) ve bunu takiben 12 siklusa kadar (28 gün/siklus) başlangıç randomizasyonuna göre kesintisiz midostaurin ya da plasebo tedavisi alacak şekilde randomize edilmiştir. Çalışma çeşitli AML ile ilişkili sitogenetik anormallikleri olan hastaları içerse de, akut premiyelositik lösemisi (M3) ya da tedaviye bağlı AML'si olan hastalar hariç tutulmuştur. Hastalar FLT3 mutasyon durumuna göre sınıflandırılmıştır: TKD, <0,7 allelik oranla ITD ve ≥0,7 allelik oranla ITD.
İki tedavi grubu, hastalık özellikleriyle ilgili başlangıç demografikleri açısından genel olarak dengelenmiştir. Hastaların medyan yaşı 47'dir (aralık: 18 ila 60 yıl), hastaların çoğunda ECOG performans durumu 0 veya 1'dir (% 88,3) ve hastaların çoğunluğunda yeni tanı AML söz konusudur (% 95). Irk bilgisi bildirilmiş olan hastalar arasında % 88,1'i beyaz ırka mensuptur. Hastaların çoğunda (% 77,4) FLT3-ITD mutasyonları olduğu, çoğunluğunda (%
47,6) allelik oranının düşük olduğu (<0,7) hastaların % 22,6'sında FLT3-TKD mutasyonları olduğu belirlenmiştir. Midostaurin kolunda hastaların % 48'i, plasebo kolunda ise hastaların
% 41'i erkektir.
Hematopoietik kök hücre nakline (SCT) devam eden hastalar, kök hücre infüzyonundan önce ya da infüzyon sırasında çalışma tedavisi almayı bırakmıştır. Genel SCT oranı midostaurin artı standart kemoterapi kolunda % 59,4 (214/360) ve plasebo artı standart kemoterapi kolunda % 55,2 (197/357) olarak belirlenmiştir. Tüm hastalar sağkalım açısından takip edilmiştir.
Çalışmanın birincil sonlanım noktası, randomizasyon tarihinden herhangi bir nedenle ölüme kadar geçen süre olarak ölçülen genel sağkalımdır (OS). Birincil analiz, son hastanın randomizasyonundan itibaren minimum yaklaşık 3,5 yıllık bir takipten sonra yapılmıştır. Çalışmada, plasebo artı standart kemoterapi karşısında midostaurin artı standart kemoterapi için ölüm riskinde % 23'lük bir azalmaya birlikte OS'de istatistiksel olarak anlamlı bir iyileşme olduğu gösterilmiştir (bkz. Tablo 6 ve Şekil 1).
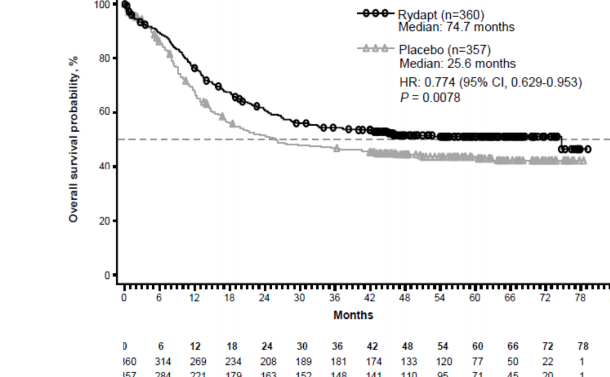
Risk altındaki hastalar
Ay
Ay
To pla m sa ğk alı m ola sılı ğı,
%
RYDAPT (n=360)
Medyan: 74.7 ay
Plasebo (n=357) Medyan: 25.6 ay
Şekil 1 Genel sağkalım için Kaplan-Meier eğrisi, SCT için sansürlenmemiş
Kritik ikincil sonlanım noktası olaysız sağkalımdır (EFS; bir EFS olayı, protokol tedavisi başlatıldıktan sonraki 60 gün içinde tam remisyon (CR) elde edememe, relaps ya da herhangi bir nedenle ölüm olarak tanımlanmıştır). EFS, plasebo artı standart kemoterapi ile karşılaştırıldığında midostaurin artı standart kemoterapiyle istatistiksel olarak anlamlı bir iyileşme göstermiştir (HR: 0,78 [% 95 GA, 0,66 ila 0,93] p = 0,0024), ve medyan EFS
sırasıyla 3 ay ila 8,2 ay; bkz. Tablo 5.
Tablo 5 Midostaurinin AML'de etkililiği
Etkililik Parametresi | Midostaurin n=360 | Plasebo n=357 | HR* (%95 GA) | P- değeri |
Genel Sağkalım (OS) |
|
|
|
|
Medyan OS (ay) (%95 GA) | 74,7 (31,5-NE) | 25,6 (18,6-42.9) | 0,77 (0,63-0,95) | 0,0078 |
5. yılda Kaplan-Meier tahminleri (%95 GA) | 0,51 (0,45-0,56) | 0,43 (0,38-0,49) |
|
|
Olaysız Sağkalım (EFS) |
|
|
|
|
Tedavi başlangıcından sonraki 60 gün içinde CR'ler göz önünde bulundurularak medyan EFS (ay) (%95 GA) | 8,2 (5,4-10,7) | 3,0 (1,9-5,9) | 0,78 (0,66-0,93) | 0,0024 |
İndüksiyon sırasında herhangi bir zamandaki CR'ler göz önünde bulundurularak medyan EFS (ay) (%95 GA) | 10,2 (8,1-13,9) | 5,6 (2,9-6,7) | 0,73 (0,61-0,87) | 0,0001 |
Hastalıksız Sağkalım (DFS) |
|
|
|
|
Medyan DFS (ay) (%95 GA) | 26,7 (19,4-NE) | 15,5 (11,3-23,5) | 0,71 (0,55-0.92) | 0,0051 |
Tam Remisyon (CR) |
|
|
|
|
Tedavi başlangıcından sonraki 60 gün içinde (%) | 212 (58,9) | 191 (53,5) | NE | 0,073 |
İndüksiyon sırasında herhangi bir zamanda (%) | 234 (65,0) | 207 (58,0) | NE | 0,027 |
Kümülatif relaps insidansı (CIR) |
|
|
|
|
Medyan (%95 GA) | NE (25,7-NE) | 17,6 (12,7-46,3) | 0,68 (0,52-0,89) | 0,0023 |
*Randomizasyon FLT3 mutasyon faktörüne göre sınıflandırılmış Cox regresyon modeli kullanılarak tahmin edilmiş tehlike oranı (HR) | ||||
Midostaurin kolu için gün 60 itibariyle CR oranı bakımından midostaurin lehine olan (% 58,9 karşısında % 53,5; p=0,073), indüksiyon sırasındaki tüm CR'ler göz önünde bulundurulduğunda devam eden (% 65 karşısında % 58; p=0,027) bir trend söz konusu olmuştur. Buna ek olarak, indüksiyon sırasında tam remisyon elde eden hastalarda, 12. aydaki kümülatif relaps insidansı midostaurin kolunda % 26 karşısında plasebo kolunda % 41 bulunmuştur.
SCT zamanında sansürlenen gerek OS gerekse EFS için duyarlılık analizleri de, plaseboya kıyasla midostaurin artı standart kemoterapi ile klinik faydayı desteklemiştir.
SCT durumuna göre OS sonuçları Şekil 2'de gösterilmektedir. EFS için, çalışma tedavisi başladıktan sonraki 30 gün içindeki remisyonlar göz önünde bulundurulduğunda, HR değeri SCT'li hastalar için 0,602 (% 95 GA: 0,372-0,974) ve SCT'siz hastalar için 0,827 (% 95 GA: 0,689-0,993) olarak midostaurin lehine sonuç vermiştir.
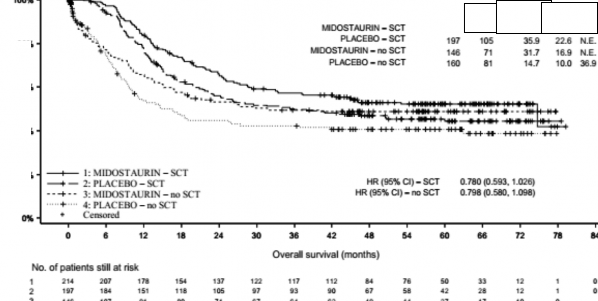
Şekil 2 AML'de SCT durumuna göre genel sağkalım için Kaplan Meier eğrisi
Bir alt grup analizinde kadınlarda göze çarpan bir OS faydası gözlenmemiştir ancak tüm ikincil etkililik sonlanım noktalarında bir tedavi faydası gözlenmiştir (bkz. Tablo 6).
Tablo 6 AML'de cinsiyete göre OS, EFS, CR, DFS ve CIR'a genel bakış
Sonlanım noktası | Genel %95 GA | Erkekler %95 GA | Kadınlar %95 GA |
OS (HR) | 0,774 | 0,533 | 1,007 |
| (0,629-0,953) | (0,392-0,725) | (0,757-1,338) |
EFS (CR indüksiyon) | 0,728 | 0,660 | 0,825 |
(HR) | (0,613-0,866) | (0,506-0,861) | (0,656-1,037) |
CR indüksiyon (OR) | 0,743* | 0,675* | 0,824* |
| (0,550-1,005) | (0,425-1,072) | (0,552-1,230) |
DFS (CR indüksiyon) | 0,663 | 0,594 | 0,778 |
(HR) | (0,516-0,853) | (0,408-0,865) | (0,554-1,093) |
CIR (CR indüksiyon) | 0,676 | 0,662 | 0,742 |
(HR) | (0,515-0,888) | (0,436-1,006) | (0,516-1,069) |
*Olasılık oranı şu şekilde hesaplanmıştır (Tedavide tam remisyon yok/ Tedavide tam remisyon var) / (Plaseboda tam remisyon yok/ Plaseboda tam remisyon var HR= Tehlike oranı; OR=olasılık oranı | |||
60-70 yaş arası hastalardaki etkililik ve güvenlilik, FLT3-ITD mutasyonlu AML hastalarında allojenik SCT dahil konsolidasyon, tekli ajan idame tedavisi ve yoğun indüksiyon ile kombinasyon halinde midostaurinin incelendiği faz II, tek kollu, araştırmacı tarafından başlatılan bir çalışmada değerlendirilmiştir. Nihai analize göre, 2 yılda (birincil sonlanım notası) EFS oranı %34 (%95 CI: 27, 44) ve 60 yaşından büyük hastalarda (440 hastadan 128'i) medyan genel sağkalım 22,7 aydır.
İlerlemiş SM, SM-AHN ve MCL
Hep birlikte ilerlemiş sistemik mastositoz (SM) olarak anılan ilerlemiş SM, SM-AHN ve MCL'li hastalarda midostaurinin etkililiği, açık etiketli, tek kollu ve çok merkezli iki çalışmada (toplam 142 hasta) değerlendirilmiştir.
Pivotal çalışma, ilerlemiş SM'si olan 116 hasta üzerinde gerçekleştirilen çok merkezli, tek kollu bir faz II çalışmadır (Çalışma CPKC412D2201). Midostaurin, hastalık progresyonu ya da tolere edilemeyen toksisiteye kadar günde iki kere 100 mg olarak oral yoldan uygulanmıştır. Kaydedilen 116 hastanın 89'u yanıt değerlendirmesi için uygun kabul edilmiştir ve birincil etkililik popülasyonunu oluşturmuştur. Bunların içinde 73 hastada ilerlemiş SM (57'sinde AHNMD) ve 16'sında MCL (6'sında AHNMD) tespit edilmiştir. Birincil etkililik popülasyonunda medyan yaş 64'tür ve hastaların yarısı ≥65'tir. Hastaların yaklaşık üçte biri (%36) ilerlemiş SM, SM-AHN veya MCL için daha önce anti-neoplastik tedavi görmüştür. Başlangıçta birincil etkililik popülasyonunda, hastaların % 65'inde ≥1 ölçülebilir C bulgusu (trombositopeni, hipoalbuminemi, anemi, yüksek total bilirubini, transfüzyona bağımlı anemi, kilo kaybı, nötropeni, yüksek ALT veya AST) belirlenmiştir. Hastaların % 82'sinde KIT D816V mutasyonu tespit edilmiştir.
Birincil sonlanım noktası toplam yanıt oranıdır (ORR). Yanıt oranları değiştirilmiş Valent ve Cheson kriterlerine göre değerlendirilmiş ve yanıtlar bir çalışma yürütme komitesi tarafından doğrulanmıştır. İkincil sonlanım noktaları şunları kapsamaktadır: yanıt süresi, yanıta kadar geçen süre ve toplam sağkalım. Midostaurinin yanıtları Tablo 7'de sunulmaktadır. KIT D816V durumundan, daha önceki tedavilerin sayısından ve bir AHNMD'nin varlığı ya da yokluğundan bağımsız olarak aktivite gözlenmiştir. Gerek KIT D816V mutasyonu pozitif hastalarda (ORR=% 63) gerekse KIT D816V yabanıl tip veya bilinmeyen hastalarda (ORR=% 43,8) doğrulanmış yanıtlar gözlenmiştir. Bununla birlikte KIT D816V pozitif hastalar 33,9 ay (% 95 GA: 20,7-42) için medyan sağkalım KIT D816V yabanıl tip veya bilinmeyen hastalara kıyasla (10 ay (% 95 GA: 6,9-17,4) daha uzun olmuştur. Hastaların % 46'sında kemik iliği filtrasyonunda % 50'yi aşan azalma ve % 58'sinde serum triptaz düzeylerinde % 50'yı aşan azalma olmuştur. Dalak hacmi, en az 1 başlangıç sonrası değerlendirmesi olan hastaların % 68,9'unda ≥%10 azalmıştır (hastaların % 26,7'sinde ≥% 35 azalma vardır; bu da palpasyonla
% 50 azalmaya tekabül etmektedir).
Yanıta kadar geçen medyan süre 0,3 aydır (aralık: 0,1 ila 3,7 ay). Medyan takip süresi 43 aydır.
Tablo 7 İlerlemiş SM, SM-AHN ve MCL'de RYDAPT'ın etkililiği: birincil etkililik popülasyonu
| Tümü N=89 | İlerlemiş SM N=16 | SM-AHN N=57 | MCL N=16 |
Birincil sonlanım noktası |
|
|
|
|
Genel yanıt, n (%) | 53 (59,6) | 12 (75,0) | 33 (57,9) | 8 (50,0) |
(%95 GA) | (48,6-69,8) | (47,6-92,7) | (44,1-70,9) | (24,7-75,3) |
Majör yanıt, n (%) | 40 (44,9) | 10 (62,5) | 23 (40,4) | 7 (43,8) |
Kısmi yanıt, n (%) | 13 (14,6) | 2 (12,5) | 10 (17,5) | 1 (6,3) |
Stabil hastalık, n (%) | 11 (12,4) | 1 (6,3) | 7 (12,3) | 3 (18,8) |
Progresif hastalık, n (%) | 10 (11,2) | 1 (6,3) | 6 (10,5) | 3 (18,8) |
İkincil sonlanım noktaları |
|
|
|
|
Medyan yanıt süresi, ay (%95 | 18,6 | 36,8 | 10,7 | NR |
GA) | (9,9-34,7) | (5,5-NE) | (7,4-22,8) | (3,6-NE) |
Medyan genel sağkalım, ay (%95 GA) | 26,8 (17,6-34,7) | 51,1 (28,7-NE) | 20,7 (16,3-33,9) | 9,4 (7,5-NE) |
5 yılda Kaplan-Meier tahminleri (%95 GA) | 26,1 (14,6-39,2) | 34,8 (1,7-76,2) | 19,9 (8,6-34,5) | 33,7 (12,3-56,8) |
NE: Tahmin Edilmemiştir; NR: Ulaşılmamıştır Çalışma dışı anti-neoplastik tedavi alan hastaların, yeni tedavide progrese olduğu kabul edilmiştir. | ||||
Her ne kadar çalışma, modifiye Valent ve Cheson kriterlerine göre değerlendirilmek üzere tasarlanmış olsa da, post hoc açıklayıcı analiz olarak etkililik 2013 International Working Group - Myeloproliferative Neoplasms Research ve Treatment - European Competence Network on Mastocytosis (IWG-MRT-ECNM) konsensus kriterlerine göre de değerlendirilmiştir. RYDAPT'a yanıt herhangi bir hüküm olmadan uygulanan bir kompütasyonel algoritma kullanılarak tespit edilmiştir. 116 hastanın 113'ünde IWG yanıt kriterlerine göre belirlenen C bulguları söz konusu olmuştur (C bulgusu olarak assit hariç tutularak). Tüm yanıtlar göz önünde bulundurulmuş ve 12 haftalık doğrulama gerektirmiştir (bkz. Tablo 8).
Tablo 8 Algoritmik yaklaşım kullanılarak IWG-MRT-ECNM konsensus kriterlerine göre midostaurinin ilerlemiş SM, SM-AHN ve MCL'de etkililiği
| Değerlendirilen tüm hastalar | İlerlemiş SM | SM-AHN | MCL | Bilinmeyen alt tip |
| N=113 | N=15 | N=72 | N=21 | N=5 |
Genel yanıt oranı, n (%) | 32 (28,3) | 9 (60) | 15 (20,8) | 7 (33,3) | 1 (20) |
(%95 GA) | (20,2-37,6) | (32,3-83,7) | (12,2-32) | (14,6-57) | (0,5-71,6) |
En iyi genel yanıt, n (%) |
|
|
|
|
|
Tam remisyon | 1 (0,9) | 0 | 0 | 1 ( 4,8) | 0 |
Kısmi remisyon | 17 (15) | 5 (33,3) | 8 (11,1) | 3 (14,3) | 1 (20) |
Klinik düzelme | 14 (12,4) | 4 (26,7) | 7 (9,7) | 3 (14,3) | 0 |
Yanıt süresi * |
|
|
|
|
|
n/N (%) | 11/32 (34,4) | 4/9 (44,4) | 4/15 (26,7) | 3/7 (42,9) | 0/1 (0) |
medyan (%95 GA) | NE (27-NE) | 36,8 (10,3-36,8) | NE (17,3-NE) | NE (4,1-NE) | NE |
Genel sağkalım |
|
|
|
|
|
n/N (%) | 65/113 (57,5) | 4/15 (26,7) | 49/72 (68,1) | 12/21 (57,1) | 0/5 (0) |
medyan (%95 GA) | 29,9 (20,3-42) | 51,1 (34,7-NE) | 22,1 (16,8-32,2) | 22,6 (8,3-NE) | NE |
* Yanıtlar için doğrulama süresi: 12 hafta Analizde C bulgusu olarak assit dışlanmaktadır. Çalışma dışı anti-neoplastik tedavi alan hastaların, yeni tedavide progrese olduğu kabul edilmiştir. | |||||
Destekleyici çalışma, ilerlemiş SM, SM-AHN ve MCL'si olan 26 hasta üzerinde gerçekleştirilmiş bir tek kollu, çok merkezli, açık etiketli bir faz II çalışmadır (CPKC412A2213). Midostaurin 28 günden oluşan sikluslarda günde iki kere 100 mg olarak oral yoldan uygulanmıştır. İkinci siklus sonunda majör yanıt (MR) ya da kısmı yanıtın (PR) olmaması, çalışma tedavisinin bırakılmasına yol açmıştır. 20 (% 76,9) hastada ilerlemiş SM (17'sinde [% 85] AHNMD) ve 6 hastada (% 23,1) MCL vardır (2'sinde [% 33,3] AHNMD). Medyan yaş 64,5'tir ve hastaların yarısı ≥65 yaşındadır. Başlangıçta hastaların % 88,5'inde >1
C bulgusu belirlenmiştir ve hastaların % 69,2'sine daha önce en az bir tane anti-neoplastik rejim uygulanmıştır.
Birincil sonlanım noktası, tedavinin ilk iki siklusu sırasında Valent kriterleri tarafından değerlendirilmiş ORR'dir. On dokuz hasta (% 73,1; % 95 GA = [52,2-88,4]), tedavinin ilk iki siklusu sırasında bir yanıta ulaşmıştır (13 MR; 6 PR). Medyan takip süresi 73 aydır ve medyan yanıt süresine ulaşılmamıştır. Medyan genel sağkalım 40 aydır (hastalar, tedavi bırakıldıktan sonra sağkalım için yalnızca en fazla bir yıl takip edilmiştir).
Pediyatrik popülasyon
Bir Faz II çalışmada, midostaurin, FLT3 mutasyonlu yeni tanı konmuş AML'li pediyatrik hastalarda kemoterapi ile kombinasyon halinde araştırılmıştır. Çalışmaya katılan üç FLT3 mutasyonlu AML hastasından, 2 hastada (10 ve 14 yaş) kemoterapi (1-5 günde 2 g/m/gün
sitarabin, 1-5 günde 30 mg/m/gün fludarabin ve 2.,4. ve 6. günlerde 12 mg/m/gün idarubisini içeren) ile kombinasyon halinde midostaurinin ikinci indüksiyon döngüsünden sonra (günde iki kez 30 mg/m) doz sınırlayıcı toksisiteler (DLT'ler) gözlemlenmiştir. Her iki hasta da, belirgin şekilde gecikmiş hematolojik iyileşmeler göstermiştir (örn., birinci hastada tedavide 44 gün , ikinci hastada tedavide 51 gün süren uzun süreli 4. derece trombositopeni ve ikinci hastada tedavide 46 gün süren 4. derece nötropeni). Her iki hastaya da birinci indüksiyon döngüsünde sitarabin, etoposid ve idarubisin ile kombinasyon halinde midostaurin uygulanmıştır.
5.2. Farmakokinetik özellikler
Genel özelliklerMidostaurin iyi emilim ve kötü çözünürlüğe sahip bir bileşiktir. Metabolitlerinden ikisi farmakolojik aktiviteler göstermiştir (CGP52421 ve CGP62221). Çoklu dozlardan sonra midostaurin ve CGP62221'in farmakokinetiği zamana bağlı olmuş, yaklaşık ilk haftada bir ilk artış gözlenmiş, bunu 28. günde konsantrasyonlarda kararlı duruma ulaşana dek bir düşüş izlemiştir. CGP52421 konsantrasyonlarının midostaurin ve CGP62221 kadar anlamlı ölçüde azaldığı görülmemektedir.
Emilim:
Oral uygulama sonrasında midostaurinin mutlak biyoyararlanımı bilinmemektedir.
İnsanlarda midostaurinin oral uygulama sonrası emilimi hızlıdır ve toplam radyoaktivitenin t'ı dozdan 1-3 saat sonra gözlenmiştir. Popülasyon farmakokinetik analizi hastalarda emilimin günde iki kez 50 mg'ın üzerindeki dozlarda dozla orantılı değerden düşük olduğunu göstermiştir.
Sağlıklı gönüllülerde, tek doz 50 mg midostaurinin tok karnına uygulanmasından sonra midostaurinin EAA değeri 20800 ng*s/ml'ye yükselmiş ve Cdeğeri 963 ng/ml'ye düşmüştür (bkz. Bölüm 4.5). Benzer şekilde CGP52421 ve CGP62221 için de EAA değeri sırasıyla 19000 ve 29200 ng*s/ml'ye yükselmiş ve Cdeğeri 172 ve 455 ng/ml'ye düşmüştür. Ayrıca, yüksek oranda yağ içeren bir öğünle birlikte pik konsantrasyona kadar geçen süre uzamıştır. ttüm entiteler için uzamış, midostaurin medyan tdeğeri 3 saat olmuş, CGP52421 ve CGP62221 için tdeğeri sırasıyla 6 ve 7 saate uzamıştır.
Klinik çalışmalarda RYDAPT'ın etkililiği ve güvenliliği, hafif bir öğünle uygulama
sonrasında incelenmiştir. İlerlemiş SM, SM-AHN ve MCL hastalarında tok karnına midostaurinin 100 mg'lık tek dozunun uygulanmasının ardından midostaurinin EAA, Cve tdeğerleri sırasıyla 49600 ng*s/ml, 2940 ng/ml ve 3 saat olmuştur. CGP52421 için EAAve Cdeğerleri sırasıyla 2770 ng*s/ml ve 299 ng/ml bulunmuştur. CGP62221 için ise EAAve Cdeğerleri sırasıyla 8700 ng*s/ml ve 931 ng/ml olmuştur. Midostaurinin günde iki kez 100 mg oral dozlarından sonra AML ve İlerlemiş SM, SMAHN, MCL hastalarında Cplazma midostaurin değerleri sırasıyla 919 ve 1060 ng/ml olmuştur. AML ve ilerlemiş SM, SM-AHN, MCL popülasyonunda CGP62221'in Cdeğeri sırasıyla 1610 ng/ml ve 2020 ng/ml bulunmuştur. AML ve ilerlemiş SM, SM-AHN, MCL popülasyonunda ise CGP52421'in değeri sırasıyla 8630 ng/ml ve 2860 ng/ml ölçülmüştür.
Dağılım:
Midostaurin, 95,2 L (Vz/F) geometrik ortalamasıyla yüksek bir doku dağılımına sahiptir. Midostaurin ve metabolitleri, eritrositlerden ziyade büyük oranda plazmada dağılır. İn vitro veriler, midostaurinin, albümin, α1-asit glikoprotein (AGP) ve lipoprotein gibi plazma proteinlerine % 98'den yüksek bir oranda bağlandığını göstermiştir.
Biyotransformasyon:
Midostaurin temelde oksidatif yolaklarla olmak üzere CYP3A4 aracılığıyla metabolize edilir. Başlıca plazma bileşenleri midostaurin ve iki majör aktif metabolit olan CGP62221 (O- demetilasyon yoluyla) ve CGP52421'i (hidroksilasyon yoluyla) içermiş olup bunlar, midostaurinin 50 mg'lık tek dozundan 96 saat sonra toplam plazma maruziyetinin sırasıyla % 27,7 ± 2,7'si ve % 38 ± 6,6'sını oluşturmaktadır.
Eliminasyon:
Midostaurin, CGP62221 ve CGP52421'in plazmadaki medyan terminal yarı-ömrü yaklaşık olarak 20,9, 32,3 ve 471 saattir. Sağlıklı gönüllülerde görünür plazma klirensi (CL/F) 2,4-3,1 l/saat bulunmuştur. AML ve ilerlemiş SM, SM-AHN ve MCL hastalarında kararlı durumda midostaurin klirens için popülasyon farmakokinetiği tahminleri 5,9 l/s ve 4,4 l/s olmuştur. İnsan Kütle Denge çalışmasının bulguları, fekal atılımın, büyük oranda metabolitleri şeklinde (dozun % 73'ü) olmak üzere, temel atılım yolu olduğunu göstermiştir (dozun % 78'i); diğer yandan değişmemiş midostaurin, dozun % 3'ünü oluşturmaktadır. Dozun yalnızca % 4'ü idrarda tespit edilmiştir.
Doğrusallık/doğrusal olmayan durum:
Genel olarak midostaurin ve metabolitleri, 25 mg ila 100 mg aralığındaki tek bir dozdan sonra doz-oransallığından önemli bir sapma göstermemiştir. Diğer yandan, günde 50 mg ila 225 mg aralığındaki çoklu dozlardan sonra maruziyette doz oransallığından daha düşük bir artış olmuştur.
Çoklu oral dozları takiben, midostaurin zamana bağlı bir farmakokinetik sergilemiştir; ilk haftada plazma konsantrasyonlarında bir başlangıç artışı olmuş (pik C) ve daha sonra bunu, yaklaşık 28 gün sonraki kararlı duruma kadar zaman içinde bir azalma takip etmiştir (2,5 kat azalma). Midostaurinin azalan konsantrasyonlarının kesin mekanizması net olmamakla birlikte olasılıkla midostaurin ve iki aktif metaboliti CGP52421 ve CGP62221'in CYP3A4 üzerindeki oto-indüksiyon özelliklerinden kaynaklanmaktadır. CGP62221 metabolitinin farmakokinetiği benzer bir eğilim sergilemiştir. Diğer yandan, bir aylık tedaviden sonra midostaurin ile karşılaştırıldığında, CGP52421 konsantrasyonları, ilerlemiş SM, SM-AHN ve MCL için 2,5 kata kadar ve AML için 9 kata kadar artış göstermiştir.
İlaç-ilaç etkileşim potansiyelinin in vitro değerlendirmesi
İn vitro verilere dayanarak, midostaurin ve aktif metabolitleri olan, CGP52421 ve CGP62221'in CYP1A2 ve CYP2E1'nin inhibitörleri ve CYP2B6 (CAR aracılı indüksiyon) ve CYP1A2'nin (AhR aracılı indüksiyon) indükleyicileri oldukları kabul edilir.
In vitro deneyler, midostaurinin, CGP52421 ve CPG62221'in BCRP ve BSEP'yi potansiyel olarak inhibe edebileceğini göstermiştir. Fizyolojik temelli farmakokinetik (PBPK) modellerinin kullanıldığı simülasyonlar, kararlı durumda günde iki kez 50 mg veya 100 mg dozda verilen midostaurinin klinik olarak anlamlı OATP1B inhibisyonuna neden olmasının olası olmadığını öngörmüştür.
Hastalardaki karakteristik özellikler
Yaşlı hastalar:
Farmakokinetik analizlere dayalı olarak, 65 ile 85 yaş arası hastalarda midostaurin ve iki aktif metabolitinin farmakokinetiği üzerinde yaşın önemli bir etkisi tanımlanmamıştır. İlerlemiş SM, SM-AHN ve MCL ya da AML'si olan yetişkin hastalarda, herhangi bir midostaurin doz ayarlaması gerekli değildir.
Pediyatrik hastalar
RYDAPT'ın çocuklar ve adölesanlarda kullanımı önerilmemektedir (bkz. Bölüm 4.2). Pediyatrik hastalarda midostaurinin farmakokinetiği, bir popülasyon farmakokinetiği yaklaşımı kullanılarak, AML ya da MLL-rearranged ALL'li 22 hastada (12'si 0-2 yaş ve 10'u 10-17 yaş) gerçekleştirilen bir faz I, doz yükseltme monoterapi çalışmasında araştırılmıştır. Midostaurinin farmakokinetiği, tek ve çoklu dozlardan sonra 30 mg/m ve 60 mg/m dozları ile doz orantısaldan düşük olmuştur. Pediyatrik hastalardaki sınırlı farmakokinetik veriler nedeniyle, erişkinlerdeki midostaurin farmakokinetiği ile bir karşılaştırma yapılamamaktadır.
Cinsiyet
Midostaurin ve aktif metabolitlerinin klirensi üzerinde cinsiyetin etkisiyle ilgili popülasyon farmakokinetik model analizlerine dayalı olarak, istatistiksel olarak anlamlı bir bulgunun olmadığı görülmüş ve maruziyette beklenen değişikliklerin (<%20) klinik açıdan önemli olmadığı düşünülmüştür. Cinsiyete dayalı olarak midostaurin doz ayarlaması gerekli değildir.
Irk
Beyaz ve Siyah gönüllüler arasında farmakokinetik profil açısından farklılık yoktur. Sağlıklı Japon gönüllüler üzerinde gerçekleştirilen bir faz I çalışmaya göre, Beyazlar ve Siyahlar üzerinde gerçekleştirilen diğer farmakokinetik çalışmalarda gözlenenlerle karşılaştırıldığında, midostaurinin ve metabolitlerinin (CGP62221 ve CGP52421) farmakokinetik profilleri benzerdir. Etnisiteye dayalı olarak midostaurin doz ayarlaması gerekli değildir.
Karaciğer yetmezliği olan hastalar
Özel bir karaciğer yetmezliği çalışmasında, başlangıçta hafif veya orta derecede karaciğer yetmezliği (sırasıyla, Child-Pugh Sınıf A veya B) olan hastalarda 6 gün boyunca günde iki kez 50 mg ve 7. günde tek bir 50 mg dozun oral yoldan uygulanmasından sonra ve şiddetli karaciğer yetmezliği olan hastalarda (Child-Pugh Sınıf C) 50 mg'lık tek doz uygulamasını takiben midostaurinin sistemik maruziyeti, normal karaciğer fonksiyonuna sahip kontroller ile
karşılaştırmalı olarak değerlendirilmiştir. Tüm gruplar için tek veya tekrarlanan dozların ardından 2 ila 3 saat sonra maksimum midostaurin konsantrasyonuna ulaşılmıştır. 1. günde, EAAve C, sağlıklı gönüllüler için sırasıyla 8130 ng*sa/ml ve 1206 ng/ml olmuştur. EAA, hafif ve orta derecede karaciğer yetmezliği olan hastalarda sırasıyla %39 ve %36 oranında azalmıştır. 7. günde, EAA(1. günden 7. güne Ceğrisi altındaki maruziyet) sağlıklı gönüllülerde 5410 ng*sa/ml iken hafif ve orta derecede karaciğer yetmezliği olan hastalarda sırasıyla %35 ve %20 azalmıştır. EAAda 7. günde sırasıyla %28 ve %20 azalmıştır.
Şiddetli karaciğer yetmezliği olan gönüllülerin, kontrol grubuna kıyasla daha düşük geometrik ortalama Cve midostaurin EAAdeğerlerine sahip olduğu görülmüştür (C: 1360 ng/ml, EAA: 30100 ng.sa/ml). Midostaurinin Cve EAAdeğerleri şiddetli karaciğer yetmezliği olan hastalarda sırasıyla ortalama %78 ve %59 azalmıştır.
Son olarak, hastalardan elde edilen uzun vadeli veriler bir popülasyon farmakokinetiği yaklaşımı kullanılarak analiz edilmiştir. İlerlemiş SM, SM-AHN, MCL ve AML popülasyonlarında hafif veya orta derecede karaciğer yetmezliği olan hastalarda karaciğer yetmezliğinin herhangi bir etkisi tanımlanamamıştır.
Genel olarak, normal karaciğer fonksiyonu olan gönüllülere kıyasla hafif, orta veya şiddetli karaciğer yetmezliği olan hastalarda plazma midostaurin ve metabolitlerine (CGP62221 ve CGP5242) maruziyette (EAA) bir artış olmamıştır. Başlangıçta hafif veya orta derecede karaciğer yetmezliği olan hastalarda doz ayarlaması gerekli değildir. Şiddetli karaciğer yetmezliği olan hastalarda midostaurin ve aktif metaboliti CGP62221'e maruziyet, normal karaciğer fonksiyonu olan hastalara göre önemli ölçüde daha düşüktür (bkz. Bölüm 4.2). Bununla birlikte, şiddetli karaciğer yetmezliği olan hastalarda doz ayarlamasının gerekli olduğunu düşündürecek yeterli etkililik verisi bulunmamaktadır.
Böbrek yetmezliği olan hastalar
Renal eliminasyon, midostaurin eliminasyonu için minör bir yolaktır. Midostaurin için özel bir böbrek yetmezliği çalışması yürütülmemiştir. Popülasyon farmakokinetiği analizleri, AML'li (n=180) ve ilerlemiş SM, SM-AHN ve MCL'li (n=141) hastalarda yapılan klinik çalışmalarda elde edilen veriler kullanılarak yürütülmüştür. Dahil edilen 321 hastanın 177'sinde daha önceden var olan hafif (n=113), orta (n=60) ya da şiddetli (n=4) böbrek yetmezliği (15 ml/dak.
≤ kreatinin klirensi [CrCL] <90 ml/dak.) bulunduğu görülmüştür. 144 hastada başlangıçta normal böbrek fonksiyonu (CrCL>90 ml/min) görülmüştür. Popülasyon farmakokinetiği analizlerine dayalı olarak, midostaurin klirensi böbrek yetmezliğinden anlamlı oranda etkilenmemiştir ve dolayısıyla hafif ila orta şiddetli böbrek yetmezliği olan hastalarda doz ayarlaması gerekli değildir.
5.3. Klinik öncesi güvenlilik verileri
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Makrogolgliserol hidroksistearat MakrogolSusuz etanol
Mısır yağı mono-di-trigliseritleri All-rac-α-tokoferol
Jelatin (Domuz kaynaklı) Gliserol
Titanyum dioksit (E171) Demir oksit sarı (E172) Demir oksit kırmızı (E172) Saf su
Karmin (E120) (Cochenille louse kaynaklı) Hipromelloz 2910
Propilen glikol
6.2. Geçimsizlikler
Geçerli değildir.
6.3. Raf ömrü
36 ay
6.5. Ambalajın niteliği ve içeriği
Kutuda; 4 yumuşak kapsül içeren PA/AL/PVC blisterler 112 (4x28) yumuşak kapsül içeren çoklu paketler
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj Atıklarının Kontrolü Yönetmeliğiâne uygun olarak imha edilmelidir.
 Deri Kanseri
Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör.
Deri Kanseri
Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör. |
 Astım
Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır.
Astım
Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
 |
Şizofrenlik Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler hakkında bilgi verecektir. |
 |
Belsoğukluğu, Chlamydia ve Frengi Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve boğazda enfeksyona sebep olabilir. |
 |
İnme İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına yol açar. |
İLAÇ GENEL BİLGİLERİ
Novartis Sağlık,Gıda ve Tarım Ürünleri San. Tic. A.Ş.
| Satış Fiyatı | 258455.14 TL [ 26 Apr 2024 ] |
| Önceki Satış Fiyatı | 258455.14 TL [ 22 Apr 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699504190151 |
| Etkin Madde | Midostaurin |
| ATC Kodu | L01EX10 |
| Birim Miktar | 25 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 112 |
| Antineoplastik ve İmmünomodülatör Ajanlar |
| İthal ( ref. ülke : Yunanistan ) ve Beşeri bir ilaçdır. |