REAMPLA 125 mg kapsül (21 kapsül) Farmakolojik Özellikler
{ Palbosiklib }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapotik grup (ATC kodu): Antineoplastik ilaçlar, protein kinaz inhibitörleri, siklin-
bağımlı kinaz (CDK) inhibitörleri ATC kodu: L01EF01.
Palbosiklib siklin bağımlı kinaz (CDK) 4'ün ve 6'nın yüksek seçiciliğe sahip, geri dönüşlü bir inhibitörüdür. Siklin D1 ve CDK 4/6, hücresel proliferasyona neden olan birden fazla sinyal yolağının akışında rol alan enzimlerdendir.
Palbosiklib, CDK4/6'nın inhibisyonu yoluyla hücrenin G1 hücre döngüsü fazından S fazına ilerlemesini engelleyerek, hücre proliferasyonunu azaltmaktadır. Palbosiklibin moleküler profili meme kanseri hücre hattı panelinde test edilmesi; özellikle ER-pozitif meme kanserlerinde olmak üzere luminal meme kanserine karşı yüksek etkililik gösterdiğini ortaya koymuştur. Test edilen hücre hatlarında, retinoblastomun (Rb) kaybı palbosiklib etkilik kaybı ile ilişkili olmuştur. Bununla birlikte taze tümör örnekleri ile yapılan bir takip çalışmasında RB1 ekspresyonu ve tümör yanıtı arasında bir ilişki gözlemlenmemiştir. Aynı şekilde, hastadan elde edilen ksenograft (PDX) in vivo modellerde, palbosiklibe verilen yanıtla aralarında bir ilişki gözlemlenmemiştir. Mevcut klinik veriler klinik etkililik ve güvenlilik bölümünde bildirilmektedir (bkz. Bölüm 5.1).
İleri evre meme kanseri olan 77 hastada palbosiklibin kalp atım hızı aralığına göre düzeltilmiş QT aralığı (QTc) üzerine etkisi; başlangıca göre değişiklik ve ilgili farmakokinetik verileri değerlendiren eş zamanlı elektrokardiyografi (EKG) kullanılarak değerlendirilmiştir. Palbosiklib önerilen günlük 125 mg dozunda QTc'yi klinik olarak anlamlı şekilde uzatmamıştır (Doz şeması 3/1).
Randomize Faz 3 Çalışma PALOMA-2: letrozol ile kombine REAMPLA
ER-pozitif, HER2-negatif küratif amaçlı rezeksiyon ya da radyasyon tedavisi yapılamayan lokal olarak ilerlemiş ya da ileri evre hastalıkları için daha önce sistemik tedavi almamış metastatik meme kanseri hastası kadınlarda yapılan uluslararası, randomize, çift kör, plasebo
kontrollü, paralel gruplu, çok merkezli bir çalışmada letrozol ile kombine palbosiklib etkililiği letrozol artı plasebo ile karşılaştırmalı olarak değerlendirilmiştir.
Toplam 666 postmenopozal hasta 2:1 oranında palbosiklib ile letrozol koluna ya da plasebo ile letrozol koluna randomize edilmiş ve hastalığın yerine (viseral/viseral olmayan); (neo) adjuvan tedavinin bitiminden hastalığın nüksetmesine kadar geçen hastalıksız süreye (yeni başlayan metastatik ï£12 aya karşı >12 ay) ve önceki (neo) adjuvan kanser tedavilerin türüne (daha önce hormonal tedavi alanlara karşı daha önce hormonal tedavi almayanlar) göre ayrılmıştır. İleri evre semptomatik, viseral yayılmış, kısa sürede yaşamı tehdit eden komplikasyon gelişim riski olan hastalar (masif, kontrolsüz efüzyonları [plevral, perikardial, peritoneal], pulmoner lenfanjiti ve %50 üzerinde karaciğer tutulumu olan hastalar dahil) çalışmaya alınmak için uygun bulunmamıştır.
Hastalar, hangisi daha önce olursa objektif hastalık progresyonuna, semptomatik kötüleşmeye, kabul edilemez toksisite gelişimine, ölüme, ya da olurun geri çekilmesine kadar atandıkları tedaviyi almaya devam etmiştir. Tedavi kolları arasında çapraz geçişe izin verilmemiştir.
Hastaların başlangıçtaki demografik özellikleri ve prognostik özellikleri palbosiklib artı letrozol kolu ile plasebo artı letrozol kolları arasında uyumlu şekilde eşleştirilmiştir. Bu çalışmaya kaydedilen hastaların medyan yaşı 62 (aralık 28-89) olarak hesaplanmış ve hastaların
%48,3'ü kemoterapi alırken %56,3'ü ileri evre meme kanseri tanısından önce (neo) adjuvan anti-hormonal tedavi almış, %37,2'si ise daha önce (neo) adjuvan tedavi olarak sistemik tedavi almamıştır. Hastaların çoğunluğunda (%97,4) başlangıçta metastatik hastalık varken,
%23,6'sında yalnızca kemikte hastalık ve %49,2'sinde viseral hastalık görülmüştür.
Çalışmanın birincil sonlanım noktası araştırıcının değerlendirdiği, Tümörlerde Yanıt Değerlendirme Kriterleri (RECIST) Versiyon 1.1'e göre progresyonsuz sağkalım (PFS) olmuştur. İkincil etkililik sonlanım noktaları objektif yanıtı (OY), klinik yarar yanıtını (KYY), güvenliliği ve yaşamâkalitesinde değişikliği (YKD) kapsamıştır.
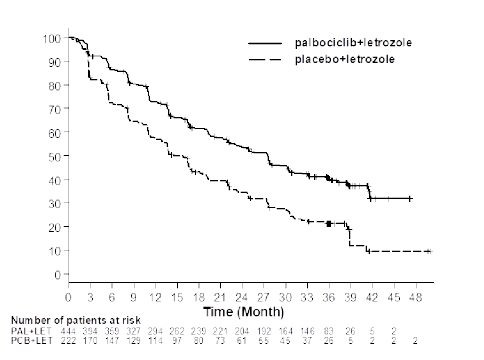
26 Şubat 2016 veri kesim tarihinde, çalışmada birincil hedef olan PFS'nin iyileştirilmesi amacına ulaşılmıştır. Gözlenen tehlike oranı (HR) palbosiklib ile letrozol lehine 0,576 (%95 güven aralığı [GA]: 0,46-0,72) ve kademeli log-sıra testi 1-yönlü p değeri <0,000001 olmuştur. 15 aylık bir ek izlemeden sonra birincil ve ikincil sonlanım noktalarının güncellenmiş bir analizi yapılmıştır (veri kesim tarihi: 31 Mayıs 2017). Toplam 405 PFS olayı gözlenmiştir; sırasıyla palbosiklib ile letrozol kolunda 245 olay (%55,2) ve karşılaştırma kolunda 160 olay (%72,1).
Tablo 6, araştırıcı ve bağımsız inceleme değerlendirmesine göre, PALOMA 2 çalışmasının
birincil ve güncellenmiş analizlerine dayanan etkililik sonuçlarını göstermektedir.
Tablo 6. PALOMA 2 (tedavi amaçlı popülasyon) â Birincil ve güncellenmiş veri kesim
tarihine göre etkililik sonuçları
| Birincil Analiz (26 Şubat 2016 Veri Kesmi) | Güncellenmiş Analiz (31 Mayıs 2017 Veri Kesmi) | ||
| REAMPLA ile Letrozol (N = 444) | Plasebo ile Letrozol (N = 222) | REAMPLA ile Letrozol (N = 444) | Plasebo ile Letrozol (N = 222) |
Bağımsız değerlendirmeye göre progresyonsuz sağkalım
Olay sayısı (%) | 194 (43,7) | 137 (61,7) | 245 (55,2) | 160 (72,1) |
Ortanca PFS [ay (%95 GA)] | 24,8 (22,1- NE) | 14,5 (12,9-17,1) | 27,6 (22,4-30,3) | 14,5 (12,3- 17,1) |
Tehlike Oranı [(%95 GA) ve p-değeri] | 0,576 (0,463-0,718), p<0,000001 | 0,563 (0,461-0,687), p<0,000001 |
Bağımsız değerlendirmeye göre progresyonsuz sağkalım
Olay sayısı (%) | 152 (34,2) | 96 (43,2) | 193 (43,5) | 118 (53,2) |
Ortanca PFS [ay (%95 GA)] | 30,5 (27,4-NE) | 19,3 (16,4- 30,6) | 35,7 (27,7- 38,9) | 19,5 (16,6- 26,6) |
Tehlike oranı (%95 GA) ve tek yönlü p değeri | 0,653 (0,505-0,844), p=0,000532 | 0,611 (0,485-0,769), p=0,000012 | ||
OY* [%(%95 GA)] | 46,4 (41,7- 51,2) | 38,3 (31,9-45,0) | 47,5 (42,8-52,3) | 38,7 (32,3- 45,5) |
OY* ölçülebilir hastalık [% (%95 GA)] | 60,7 (55,2- 65,9) | 49,1 (41,4-56,9) | 62,4 (57,0-67,6) | 49,7 (42,0- 57,4) |
KYY* [% (%95 GA)] | 85,8 (82,2- 88,9) | 71,2 (64,7-77,0) | 85,6 (82,0-88,7) | 71,2 (64,7- 77,0) |
N=Hasta sayısı; GA=Güven aralığı; TE=Tahmin edilemez; OY=Objektif yanıt; KYY=Klinik yarar yanıtı; PFS=Progresyonsuz sağkalım.
* İkincil sonlanım noktalarının sonuçları RECIST 1.1 versiyonuna göre doğrulanmış ve doğrulanmamış yanıtlara dayanmaktadır.
31 Mayıs 2017 veri kesim tarihine dayalı olarak PFS için Kaplan-Meier eğrisi Şekil 1'de gösterilmektedir.
Süre (Ay)
Risk altındaki hasta sayısı
Progresyonsuz Sağkalım Olasılığı (%)
Şekil 1. Kaplan-Meier progresyonsuz sağkalım grafiği (araştırıcının değerlendirmesi, tedavi amaçlı popülasyon) â PALOMA-2 çalışması (31 Mayıs 2017)
PAL=Palbosiklib; LET=Letrozol; PCB=Plasebo.
Tedavi etkisinin iç tutarlılığını araştırmak için prognostik faktörlere ve başlangıç özelliklerine göre önceden belirlenmiş bir dizi alt grup PFS analizi yapılmıştır. Ayrıştırma faktörlerine ve
başlangıç özelliklerine göre tanımlanan ayrı hasta alt gruplarında hastalık progresyonu ve ölüm
riskinde palbosiklib ile letrozol kolu lehine bir azalma gözlenmiştir.
31 Mayıs 2017 veri kesim tarihine göre, riskteki bu düşüş şu alt gruplarda gözlenmeye devam etmiştir: (1) viseral metastazları olan hastalarda (HR= 0,62 [%95 GA: 0,47-0,81], ortanca PFS [mPFS] 19,3 aya karşılık 12,3 ay) ya da viseral metastazı olmayan hastalarda (HR= 0,50 [%95 GA: 0,37-0,67], mPFS 35,9 aya karşılık 17,0 ay) ve (2) yalnızca kemikte hastalığı olan hastalarda (HR= 0,41 [%95 GA: 0,26-0,63], mPFS 36,2 aya karşılık 11,2 ay) ya da hastalığı
yalnızca kemikte olmayanlarda (HR= 0,62 [%95 GA: 0,50-0,78], mPFS 24,2 aya karşılık 14,5 ay) belirgin olmuştur. Benzer şekilde, immünohistokimya (IHC) ile tümörlerinde Rb proteini ekspresyonunun pozitif olduğu gösterilen 512 hastada hastalık progresyonu ve ölüm riskinde palbosiklib ile letrozol kolu lehine bir azalma gözlenmiştir (HR =0,543 [%95 GA: 0,433- 0,681], mPFS 27,4 aya karşılık 13,7 ay). IHC ile tümörlerinde Rb ekspresyonu negatif olan 51 hastada tedavi kolları arasındaki fark istatistiksel olarak anlamlı olmamıştır; palbosiklib ile letrozol koluna karşılık plasebo ile letrozol kolu sırasıyla (HR =0,868 [%95 GA: 0,424-1,777], mPFS 23,2 aya karşılık 18,5 ay).
31 Mayıs 2017 güncellenmiş veri kesim tarihine göre, viseral hastalık olan ve olmayan hasta alt gruplarında değerlendirilen ek etkililik ölçümleri (OY ve İlk tümör yanıtına kadar geçen süre (TYKGS)) Tablo 7'de gösterilmektedir.
Tablo 7. PALOMAâ2 çalışmasından viseral ve viseral dışı hastalıkta etkililik sonuçları (tedavi amaçlı popülasyon; 31 Mayıs 2017 veri kesim tarihi)
| Viseral hastalığı | Viseral dışı hastalık | ||
| REAMPLA ile letrozol (N=214) | Plasebo ile letrozol (N=110) | REAMPLA ile letrozol (N=230) | Plasebo ile letrozol (N=112) |
OY [%(%95 GA)] | 59,8 (52,9-66,4) | 46,4 (36,8-56,1) | 36,1 (29,9-42,7) | 31,3 (22,8-40,7) |
TYKGS, Ortanca [ay (aralık)] | 5,4 (2,0-30,4) | 5,3 (2,6-27,9) | 3,0 (2,1-27,8) | 5,5 (2,6-22,2) |
N=Hasta sayısı; GA=Güven aralığı; OY= RECIST 1.1 versiyonuna göre doğrulanmış ve doğrulanmamış objektif yanıtlar; TYKGS=İlk tümör yanıtına kadar geçen süre.
Güncellenen analizler sırasında, randomizasyondan takip eden ikinci tedaviye kadar geçen medyan süre palbosiklib ile letrozol kolunda 38,8 ay ve plasebo ile letrozol kolunda 28,8 ay, HR=0,73 (%95 GA: 0,58-0,91) olmuştur.
Randomize Faz 3 Çalışma PALOMA-3: fulvestrant ile kombine REAMPLA
Menopoz durumundan bağımsız olarak, daha önce (neo) adjuvan ya da metastatik çerçevede verilen endokrin tedaviden sonra hastalığı ilerlemiş HR-pozitif, HER2-negatif, küratif amaçlı rezeksiyon ya da radyasyon tedavisi yapılamayan lokal olarak ilerlemiş ya da metastatik meme kanseri hastası kadınlarda yapılan uluslararası, randomize, çift kör, paralel gruplu, çok merkezli bir çalışmada fulvestrant ile kombine palbosiklibin etkililiği fulvestrant artı plasebo kullanımı ile karşılaştırmalı olarak değerlendirilmiştir.
İleri evre hastalık için adjuvan endokrin tedavi sırasında ya da tamamlandıktan sonra 12 ay içinde ya da önceki endokrin tedavi sırasında ya da tamamlandıktan sonra 1 ay içinde progresyon göstermiş toplam 521 premenopozal/perimenopozal ve postmenopozal dönemdeki kadın 2:1 oranında palbosiklib ile fulvestrant koluna ya da plasebo ile fulvestrant koluna randomize edilmiş; önceki hormonal tedaviye belgelenmiş duyarlılık, çalışmaya girişte menopoz durumu (premenozal/perimenopozal duruma karşılık postmenopozal durum) ve viseral metastazlarının varlığına göre gruplandırılmıştır. Premenopozal/perimenopozal kadınlar LHRH agonisti goserelin kullanmıştır. İleri evre/metastatik, semptomatik, viseral yayılmış hastalığı olan, kısa sürede yaşamı tehdit edici komplikasyon yaşama riski bulunan (masif, kontrolsüz efüzyonları [plevral, perikardial, peritoneal], pulmoner lenfanjiti ve %50 üzerinde karaciğer tutulumu olan hastalar dâhil) hastalar çalışmaya alınmak için uygun bulunmamıştır.
Hastalar, hangisi daha önce olursa nesnel hastalık progresyonuna, semptomatik kötüleşmeye, kabul edilemez toksisite gelişimine, ölüme, ya da olurun geri çekilmesine kadar atandıkları tedaviyi almaya devam etmiştir. Tedavi kolları arasında çapraz geçişe izin verilmemiştir.
Hastaların başlangıçtaki demografik özellikleri ve prognostik özellikleri palbosiklib artı fulvestrant kolu ile plasebo artı fulvestrant kolları arasında uyumlu şekilde eşleştirilmiştir. Bu çalışmaya kaydedilen hastaların medyan yaşı 57 (aralık 29-88) olmuştur. Her bir tedavi kolunda hastaların çoğunluğu beyaz ırktandı, önceki hormonal tedaviye duyarlıydı ve postmenopozal dönemdeydi. Ortalama %20 hasta pre/perimenopozaldi. Tüm hastalar daha önce sistemik tedavi almıştı ve her bir tedavi kolundaki hastaların çoğunluğu primer tanıları için daha önce bir kemoterapi almıştı. Hastaların yarısından çoğunda (%62) bir ECOG PS=0 ve %60'ında viseral metastazlar vardı ve %60'ı primer tanıları için birden fazla hormonal tedavi rejimi almışlardı.
Çalışmanın birincil sonlanım noktası, (RECIST) 1.1'e göre araştırıcının değerlendirildiği PFS olmuştur. Destekleyici PFS analizleri Bağımsız Merkezi Radyolojik Değerlendirmeye dayanmıştır. İkincil etkililik sonlanım noktaları OY, KYY, genel sağkalım (OS), güvenlilik ve ağrı sonlanım noktasında kötüleşmeye kadar geçen süreyi (TTD) kapsamıştır.
Çalışma, planlanan PFS olaylarının %82'si üzerinden yapılan ara analizde araştırıcının değerlendirdiği PFS'nin uzaması olan birincil hedefine ulaşmıştır. Sonuçlar önceden belirlenmiş Haybittle-Peto etkililik sınırını geçerek (α=0,00135), PFS'de istatistiksel olarak anlamlı bir uzama ve klinik olarak anlamlı bir tedavi etkisi göstermiştir.
Etkililik verilerinin daha ileri bir güncellemesi Tablo 8'de verilmektedir.
Ortalama 45 aylık bir takip süresinden sonra, final genel sağkalım (OS) analizi 310 olaya (randomize hastaların 60%'ı) dayalı olarak gerçekleştirildi. Palbosiklib artı fulvestrant kolundaki medyan OS'de plasebo artı fulvestrant koluna kıyasla 6,9 aylık bir fark gözlenmiştir; bu sonuç 0,0235 (tek taraflı) olarak belirlenen anlamlılık düzeyinde istatistiksel olarak anlamlı bulunmamıştır. Plasebo artı fulvestrant kolunda randomize edilen hastaların 15,5%'i, progresyon sonrası tedavi olarak palbosiklib ve diğer CDK inhibitörlerinden kullanmıştır.
Araştırıcı tarafından değerlendirilen PALOMA-3 çalışmasının PFS ve final OS sonuçları Tablo 8'de, ilgili Kaplan-Meier eğrisi Şekil 2 ve 3'te gösterilmektedir.
Tablo 8. Etkililik sonuçlarıâ PALOMA-3 çalışması (Araştırıcının değerlendirmesi tedavi amaçlı popülasyon)
| Güncellenmiş analiz (23 Ekim 2015 veri kesmi) | |
REAMPLA ile fulvestrant (N=347) | Plasebo ile fulvestrant (N=174) | |
Progresyonsuz sağkalım (PFS) |
| |
Olay sayısı (%) | 200 (57,6) | 133 (76,4) |
Ortanca [ay (%95 GA)] | 11,2 (9,5-12,9) | 4,6 (3,5-5,6) |
Tehlike oranı (%95 GA) ve p değeri | 0,497 (0,398-0,62), p<0,000001 | |
İkincil etkililik sonlanım noktaları | ||
OY [% (%95 GA)] | 26,2 (21,7-31,2) | 13,8 (9-19,8) |
OY (ölçülebilir hastalık) [% (%95 GA] | 33,7 (28,1-39,7) | 17,4 (11,5-24,8) |
KYY [% (%95 GA)] | 68 (62,8-72,9) | 39,7 (32,3-47,3) |
Final genel sağkalım (OS) (Veri kesim tarihi 13 Nisan 2018) | ||
Olay sayısı (%) | 201 (57,9) | 109 (62,6) |
Ortanca [ay (%95 GA)] | 34,9 (28,8 â 40,0) | 28,0 (23,6 -34,6) |
Tehlike oranı (%95 GA) ve p değeri | 0,814 (0,644 - 1,029) p=0,0429 | |
KYY=Klinik yarar yanıtı; GA=Güven aralığı; N=Hasta sayısı; OY=Objektif yanıt
İkincil sonlanım noktalarının sonuçları RECIST 1.1 versiyonuna göre doğrulanmış ve doğrulanmamış yanıtlara dayanmaktadır.
*İstatistiksel olarak anlamlı değil.
aracılığı ile log-rank testinden elde edilmiş tek taraflı p değeri
Şekil 2. Kaplan-Meier progresyonsuz sağkalım grafiği (araştırıcı değerlendirmesi, tedavi amaçlı popülasyon) â PALOMA-3 çalışması (Veri kesim tarihi 23 Ekim 2015)
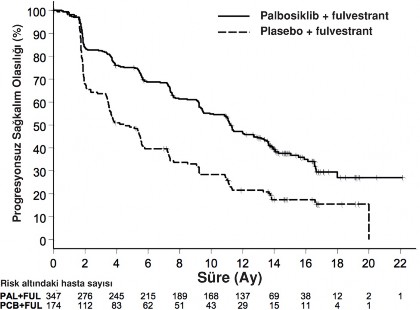
FUL=Fulvestrant; PAL=Palbosiklib; PCB=Plasebo.
Stratifikasyon faktörlerine ve başlangıç özelliklerine göre tanımlanan tüm hasta alt gruplarında, palbosiklib ile fulvestrant kolunda hastalık progresyonu ve ölüm riskinde azalma gözlenmiştir. Bu durum, premenopozal/perimenopozal kadınlarda (HR=0,46 [%95 GA: 0,28-0,75]) ve postmenopozal kadınlarda (HR = 0,52 [%95 GA: 0,4-0,66]) ve viseral metastatik hastalığı olan hastalarda (HR =0,5 [%95 GA: 0,38-0,65]) ve viseral metastazları olmayan hastalarda (HR = 0,48 [%95 GA: 0,33-0,71]) belirgin olmuştur.
Ayrıca metastatik hastalık için önceki tedavi basamaklarından bağımsız olarak fayda
gözlenmiştir; tedavi basamağı 0 (HR=0,59 [%95 GA: 0,37-0,93]), 1 (HR=0,46 [%95 GA: 0,32-
0,64]), 2 (HR=0,48 [%95 GA: 0,3-0,76]) ya da ≥3 (HR = 0,59 [%95 GA: 0,28-1,22]).
Şekil 3 Kaplan-Meier genel sağkalım grafiği (araştırıcı değerlendirmesi, tedavi amaçlı
popülasyon) â PALOMA-3 çalışması (Veri kesim tarihi 13 Nisan 2018)
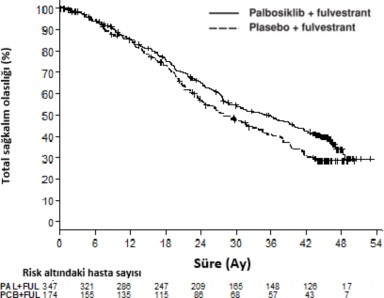
FUL=Fulvestrant; PAL=Palbosiklib; PCB=Plasebo.
Viseral hastalık olan ve olmayan hasta alt gruplarında değerlendirilen ek etkililik ölçümleri (OY
ve İlk tümör yanıtına kadar geçen süre (TYKGS)) Tablo 9'da gösterilmektedir.
Tablo 9. PALOMAâ3 çalışmasının viseral ve viseral olmayan hastalıkta etkililik
sonuçları (tedavi amaçlı popülasyon)
| İç Organ Hastalığı | İç Organ Dışı Hastalık |
| ||
| REAMPLA | Plasebo | REAMPLA | Plasebo | |
ile fulvestrant | ile | ile | ile | ||
(N=206) | fulvestrant | fulvestrant | fulvestrant | ||
| (N=105) | (N=141) | (N=69) | ||
OY [%, (%95 GA)] | 35,0 | 13,3 | 13,5 | 14,5 | |
| (28,5-41,9) | (7,5-21,4) | (8,3-20,2) | (7,2-25) | |
TYKGS, Ortanca [ay | 3,8 | 5,4 | 3,7 | 3,6 | |
(aralık)] | (3,5-16,7) | (3,5-16,7) | (1,9-13,7) | (3,4-3,7) | |
N=Hasta sayısı; GA=Güven aralığı; OY= RECIST 1.1 versiyonuna göre doğrulanmış ve doğrulanmamış objektif yanıtlar; TYKGS=İlk tümör yanıtına kadar geçen süre.
Hasta tarafından bildirilen semptomlar Avrupa Kanser Araştırması ve Tedavisi Örgütü (EORTC) yaşam kalitesi anketi (QLQ)-C30 ve Meme Kanseri Modülü (EORTC QLQ-BR23) kullanılarak değerlendirilmiştir. Palbosiklib ile fulvestrant kolunda toplam 335 hasta ve tek başına fulvestrant kolunda 166 hasta başlangıçta ve başlangıçtan sonra en az bir ziyarette anketi doldurmuştur.
Kötüleşmeye kadar geçen süre, başlangıç ve başlangıca göre ağrı semptom skorlarında ≥10 puan artış olması arasında geçen süre olarak önceden tanımlanmıştır. Fulvestranta palbosiklibin eklenmesi; plasebo artı fulvestrant ile karşılaştırıldığında ağrı semptomunda kötüleşmeye kadar geçen süreyi anlamlı olarak geciktirerek bir semptom yararı sağlamıştır (ortanca 8 aya karşılık 2,8 ay; HR=0,64 [%95 GA: 0,49-0,85]; p<0,001).
Avrupa İlaç Ajansı, meme kanseri tedavisinde tüm pediatrik popülasyon alt kümelerinde REAMPLA çalışmalarının sonuçlarını sunma zorunluluğunu kaldırmıştır (pediatrik kullanım hakkında bilgi için bkz. Bölüm 4.2).
5.2. Farmakokinetik özellikler
Palbosiklibin farmakokinetiği, ileri meme kanseri hastalarını içeren solid tümörlü hastalarda ve
sağlıklı kişilerde karakterize edilmiştir.
Gıda etkisi: Açlık koşullarında palbosiklib emilimi ve maruziyeti, popülasyonun yaklaşık
%38; düşük-yağlı gıdaların alınması durumunda sırasıyla %12 ve %27; ve orta-yağlı gıdaların alınması durumunda sırasıyla %13 ve %24 artmıştır. Ek olarak gıda alımı, hem bireyler arası hem de bireyiçi palbosiklib maruziyet değişkenliğini belirgin olarak azaltmıştır. Bu sonuçlara göre, palbosiklib gıda ile alınmalıdır (bkz. Bölüm 4.2).
Palbosiklibin insan plazması proteinlerine in vitro bağlanması, konsantrasyondan bağımsız olarak yaklaşık %85 oranındadır. Karaciğer fonksiyonundaki kötüleşme artışı ile in vivo olarak insan plazmasında palbosiklibin ortalama serbest fraksiyonu (f) kademeli olarak artmıştır. Böbrek fonksiyonundaki kötüleşme ile in vivo insan plazmasındaki ortalama palbosiklib f'da belirgin bir eğilim gözlenmemiştir. In vitro olarak, palbosiklibin insan hepatositlerinin içine alınması başlıca pasif difüzyon yoluyla olmuştur. Palbosiklib OATP1B1'in ya da OATP1B3'ün bir substratı değildir.
In vitro ve in vivo çalışmalar, palbosiklibin insanlarda büyük ölçüde hepatik metabolizmaya
uğradığını göstermiştir. 125 mg [C] palbosiklibin 125 mg tek dozunun insanlara oral yolla
uygulanmasının ardından, palbosiklib için majör primer metabolik yolaklar oksidasyon ve sülfonasyon olmuştur. Açilasyon ve glukuronidasyon ise minör yolaklar olarak katkı sağlamıştır. Palbosiklib, plazmada dolaşan ve ilaç kaynaklı en büyük madde olarak bulunmuştur.
Ürünün büyük çoğunluğu metabolitler şeklinde atılmıştır. Palbosiklibin sülfamik asit konjugatı, uygulanan dozun %25,8'ini oluşturan ve dışkıda bulunan ana ilaç-ilişkili bileşen olarak saptanmıştır. İnsan hepatositleri ile gerçekleştirilen in vitro çalışmalarda, karaciğer sitozolik ve S9 fraksiyonları ve rekombinant SULT enzimleri, esas olarak CYP3A'nın ve SULT2A1'in palbosiklib metabolizmasında yer aldığını ortaya koymuştur.
İleri meme kanseri hastalarında palbosiklibin görünür oral klirensinin (CL/F) geometrik
ortalaması 63 L/saat ve plazma eliminasyon yarılanma ömrü 28,8 saat olmuştur. Tek doz oral
[
medyan %92'si 15 gün içinde geri kazanılmış; dışkı (dozun %74'ü) ana atılım yolu olmuştur, dozun %17'si ise idrar yoluyla geri kazanılmıştır. Dışkı ve idrarda değişmemiş palbosiklib atılımı sırasıyla %2 ve %7 oranında olmuştur.
In vitro olarak klinik konsantrasyonlarda palbosiklib bir CYP1A2, 2A6, 2B6, 2C8, 2C9, 2C19
ve 2D6 inhibitörü değildir ve CYP1A2, 2B6, 2C8 ve 3A4 indükleyicisi değildir.
In vitro değerlendirmeler klinik konsantrasyonlarda pablosiklibin organik anyon taşıyıcısı (OAT)1, OAT3, organik katyon taşıyıcısı (OCT)2, organik anyon taşıyıcısı polipeptid (OATP)1B1, OATP1B3 ve safra tuzu atım pompasının (BSEP) etkileri üzerinde inhibisyon potansiyelinin düşük olduğunu göstermektedir.
Hastalardaki karakteristik özellikler
Kanser hastası 183 kişide (yaşları 22 ile 89 arasında ve vücut ağırlıkları 38 ile 123 kg arasında değişen 50 erkek ve 133 kadın hasta) yapılan bir popülasyon farmakokinetik analizine göre cinsiyetin maruz kalınan palbosiklib seviyesine etkisi bulunmamıştır ve yaş ve vücut ağırlığının maruz kalınan palbosiklib seviyesine klinik olarak önemli bir etkisi yoktur.
REAMPLA'nın farmakokinetiği, 18 yaşından küçük olan hastalar üzerinde değerlendirilmemiştir.
Karaciğer yetmezliği
%7, %38 ve %72 artmıştır. Ek olarak Ulusal Kanser Enstitüsü (NCI) sınıflamasına göre hafif karaciğer yetmezliği [total bilirubin ≤ Normalin Üst Sınırı (NÜS) ve Aspartat Aminotransferaz (AST) > NÜS ya da total bilirubin >1-1,5 Ã NÜS ve herhangi bir seviyede AST] olan 40 hastayı da kapsayan 183 ileri evre kanser hastasından oluşan bir popülasyonda yapılan farmakokinetik analize göre, hafif karaciğer yetmezliğinin palbosiklibin farmakokinetiği üzerinde etkisi bulunmamıştır.
Böbrek yetmezliği
Etnik köken
5.3. Klinik öncesi güvenlilik verileri
Karsinojenite
Palbosiklib, 6 aylık bir transgenik fare ve 2 yıllık bir sıçan çalışmasında karsinojenisite açısından değerlendirilmiştir. Palbosiklib, transgenik farelerde 60 mg/kg/gün dozuna kadar karsinojenisite açısından negatif bulunmuştur (Etki gözlenmeyen düzey [NOEL] EAA'ya göre insan klinik maruziyetinin yaklaşık 11 katı). Palbosiklib ile ilişkili neoplastik bulgular 30 mg/kg/gün dozda erkek sıçanların merkezi sinir sisteminde mikroglial hücre tümörlerinin sıklığında artışı içermekte olup; dişi sıçanlarda 200 mg/kg/gün'e kadar herhangi bir dozda neoplastik bulguya rastlanmamıştır. Palbosiklib ile ilgili karsinojenisite etkilerine ilişkin NOEL, erkek ve dişilerde sırasıyla 10 mg/kg/gün (EAA'ya göre insan klinik maruziyetinin yaklaşık 2 katı) ve 200 mg/kg/gün (EAA'ya göre insan klinik maruziyetinin yaklaşık 4 katı) olmuştur. Erkek sıçan neoplastik bulgularının insanlarla ilişkisi bilinmemektedir.
Genotoksisite
Bir bakteriyel ters mutasyon (Ames) analizinde palbosiklib mutajenik bulunmamıştır ve in vitro insan lenfosit kromozumu anormalliği analizinde yapısal bir kromozom anomalisini indüklememiştir.
Palbosiklib ≥100 mg/kg/gün dozlarında in vitro olarak Çin Hamsteri Over hücrelerinde ve erkek sıçan kemik iliği hücrelerinde anöjenik bir mekanizmayla mikroçekirdekleri indüklemiştir. EAA'ya göre hayvanların maruz kaldığı anöjenisite için etki gözlenmeyen düzey, insan klinik maruziyet dozları ile karşılaştırıldığında yaklaşık 7 kat yüksektir.
Fertilitenin bozulması
Palbosiklib 300 mg/kg/gün dozuna (EAA'ya göre insan klinik maruziyetinin yaklaşık üç katı) kadar test edilen herhangi bir dozda dişi sıçanlarda çiftleşme ve fertiliteyi etkilememiştir ve tekrarlayan doz toksisite çalışmasında sıçanlarda 300 mg/kg/gün ve köpekte 3 mg/kg/gün dozlarına (EAA'ya göre insan klinik maruziyetinin sırasıyla yaklaşık 5 ve 3 katı) kadar dişi üreme organlarında advers etki gözlenmemiştir.
Sıçanlarda ve köpeklerde saptanan klinik dışı bulgulara dayanarak palbosiklibin erkek bireylerde üreme fonskiyonunu ve fertilitesini bozma potansiyeli olduğu düşünülmektedir. Testiste, epididimde, prostatta ve seminal vezikülde palbosiklibe bağlı bulgular arasında organ ağırlığında azalma, atrofi veya dejenerasyon, hipospermi, tübül içinde hücre artıklarının birikmesi, sperm hareketliliğinde ve yoğunluğunda azalma ve sekresyonda azalma vardır. Bu bulgular, sıçanlarda ve/veya köpeklerde; EAA'ya göre insan klinik maruziyetinden sırasıyla ≥9 kat daha yüksek ya da subterapötik dozlarda gözlenmiştir. Sıçanlarda ve köpeklerde sırasıyla 4 ve 12 hafta süreyle doz uygulanmadığında erkek üreme organı üzerindeki etkilerde kısmi olarak geri dönüş gözlenmiştir. Erkek üreme organı bulgularına karşın, EAA'ya göre insan klinik maruziyetinden 13 kat daha yüksek seviyelerde erkek sıçanların çiftleşme ve fertilitesi üzerinde etki saptanmamıştır.
Gelişimsel toksisite
Palbosiklib, hücre döngüsünün düzenlenmesinde rol alan siklin bağımlı kinaz 4 ve 6'nın geri dönüşlü inhibitörüdür. Bu nedenle eğer gebelik sırasında kullanılırsa fetüsün zarar görme riski vardır. Palbosiklibin gebe hayvanlarda fetotoksik olduğu saptanmıştır. ≥100 mg/kg/gün dozlarda sıçanlarda iskelet değişikliği (yedinci servikal vertebrada kot sıklığında artış) sıklığında artış gözlenmiştir. Sıçanlarda anneye toksik olan 300 mg/kg/gün dozda (EAA'ya göre insan klinik maruziyetinin 3 katı) fetal vücut ağırlığında azalma gözlenirken tavşanlarda anneye toksik olan 20 mg/kg/gün dozda (EAA'ya göre insan klinik maruziyetinin 4 katı) ön bacaklarda falanksların küçük olması dahil iskelet değişiklikleri sıklığında artış gözlenmiştir. Fetüsün gerçekte maruz kaldığı seviye ve çapraz-plasenta transferi incelenmemiştir.
 Depresyonu Anlamak
Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel
olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur?
Depresyonu Anlamak
Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel
olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur? |
 Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir.
Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
İLAÇ GENEL BİLGİLERİ
Pfizer İlaçları Ltd.Şti.
| Satış Fiyatı | 38856.16 TL [ 26 Apr 2024 ] |
| Önceki Satış Fiyatı | 38856.16 TL [ 22 Apr 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8681308150035 |
| Etkin Madde | Palbosiklib |
| ATC Kodu | L01EF01 |
| Birim Miktar | 125 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 1 |
| Antineoplastik ve İmmünomodülatör Ajanlar |
| İthal ( ref. ülke : Belcika ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Ruh ve Akıl Sağlığımızı Geliştirmek İyi akıl ve ruh sağlığı sahip olmaktan ziyade, yaptığınız şeylerdir. Akıl ve ruhsal olarak sağlıklı olmak için kendinize değer vermeli ve kendinizi kabul etmelisiniz. |
 |
Sırt Ağrısı Sırt ağrısı birden bire ortaya çıkıp şiddetli (akut) olabilir veya zamanla gelişip daha uzun süreli sorunlara (kronik) neden olabilir. |
 |
En Yaygın Alerji Türleri Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir. |