POMALEM 3 mg sert kapsül (21 sert kapsül) Kısa Ürün Bilgisi
{ Pomalidomid }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
POMALEM 3 mg sert kapsül
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Her bir kapsülde;
Etkin madde
Pomalidomid 3 mg
Yardımcı maddeler
Yardımcı maddeler için Bölüm 6.1'e bakınız.
3. FARMASÖTİK FORMU
Sert kapsül
âDEVAâ baskılı, opak koyu mavi kapak ve â3 mgâ baskılı açık yeşil opak gövdeli 4 numara kapsül içinde açık sarı-sarı renkli, yabancı partikül içermeyen toz
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
POMALEM, bortezomib ve deksametazon ile kombinasyon halinde, daha önce lenalidomid de dahil olmak üzere en az bir tedavi rejimi alan, bu tedavilere dirençli veya nüks eden multipl miyelomlu erişkin hastaların tedavisinde endikedir.
POMALEM, deksametazonla kombinasyon halinde, aşağıda belirtilen koşulları taşıyan multipl miyelom tanılı yetişkin hastaların tedavisinde endikedir:
Otolog kök hücre nakline uygun olmayan hastalarda bortezomib ve lenalidomid dahil en az iki dizi tedavi sonrası nüks eden veya bu tedavilere dirençli hastalık varlığında endikedir.
4.2. Pozoloji ve uygulama şekli
Tedavi, multipl miyelom tedavisinde deneyimli bir hekimin denetiminde başlatılmalı ve izlenmelidir.
Klinik veya laboratuvar bulgularına göre doza devam edilebilir veya doz ayarlaması yapılabilir (bkz. Bölüm 4.4).
Pomalidomidin bortezomib ve dekzametazon ile kombinasyonu
Önerilen başlangıç dozu, tekrarlanan 21 günlük sikluslar halinde 1 ve 14. günler arası günde bir defa ağızdan 4 mg POMALEM'dir.
Pomalidomid, Tablo 1'de gösterildiği gibi, bortezomib ve deksametazon ile kombinasyon halinde uygulanır.
Bortezomibin önerilen başlangıç dozu, Tablo 1'de gösterilen günlerde günde bir kez intravenöz veya subkütan olarak 1,3 mg/m2'dir. Önerilen deksametazon dozu, Tablo 1'de gösterilen günlerde günde bir kez oral olarak 20 mg'dır.
Bortezomib ve deksametazon ile kombine edilen pomalidomid tedavisi, hastalığın ilerlemesi veya kabul edilemez toksisite oluşana kadar verilmelidir.
Tablo 1. Bortezomib ve deksametazon ile kombinasyon halinde POMALEM için önerilen dozaj şeması
1-8.Sikluslar | Gün (21 günlük döngü) | ||||||||||||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 |
Pomalidomid (4 mg) | ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠|
|
|
|
|
|
|
|
Bortezomib (1,3 mg/m) | ⢠|
|
| ⢠|
|
|
| ⢠|
|
| ⢠|
|
|
|
|
|
|
|
|
|
|
Deksametazon (20 mg) * | ⢠| ⢠|
| ⢠| ⢠|
|
| ⢠| ⢠|
| ⢠| ⢠|
|
|
|
|
|
|
|
|
|
| |||||||||||||||||||||
9.Siklus sonrası | Gün (21 günlük döngü) | ||||||||||||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 |
Pomalidomid (4 mg) | ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠|
|
|
|
|
|
|
|
Bortezomib (1,3 mg/m) | ⢠|
|
|
|
|
|
| ⢠|
|
|
|
|
|
|
|
|
|
|
|
|
|
Deksametazon (20 mg) * | ⢠| ⢠|
|
|
|
|
| ⢠| ⢠|
|
|
|
|
|
|
|
|
|
|
|
|
* 75 yaş üstü hastalar için bkz. Özel popülasyonlara ilişkin ek bilgiler.
Pomalidomid doz ayarlaması veya ara verilmesi
Yeni bir pomalidomid siklusunu başlatmak için nötrofil sayısının ≥1x10/L ve trombosit sayısının ≥50x 10/L olması gerekmektedir.
Advers reaksiyonlarla ilgili olarak pomalidomid tedavisine ara verilmesi veya dozunun azaltılması ile ilgili bilgiler, Tablo 2'de ve doz seviyeleri Tablo 3'de belirtilmiştir:
Tablo 2: Pomalidomidin doz ayarlaması için bilgiler
Toksisite | Doz ayarlaması | ||||||
Nötropeni* MNS** <0,5 x 10/L veya Febril nötropenik ateş (ateş ≥ 38,5°C ve MNS <1x 10/L) | Siklusun geri kalanı için pomalidomid tedavisine ara verilir. Haftalık TKS*** takibi yapılır. | ||||||
MNS ≥1 x 10/L'ye döndüğünde | Pomalidomid tedavisine önceki seviye düşük doz ile tekrar başlanır. | dozdan | bir | ||||
Takip eden <0,5 x 10/L'nin altına her düşüşte | Pomalidomid tedavisine ara verilir. | ||||||
MNS ≥1 x 10/L'ye döndüğünde | Pomalidomid tedavisine önceki seviye düşük doz ile tekrar başlanır. | dozdan | bir | ||||
Trombositopeni Trombosit sayısı <25 x 10/L | Siklusun geri kalanı için pomalidomid tedavisine ara verilir. Haftalık TKS*** takibi yapılır. | ||||||
Trombosit döndüğünde | sayısı | ≥50 | x | 10/L'ye | Pomalidomid tedavisine önceki seviye düşük doz ile tekrar başlanır. | dozdan | bir |
Takip eden <25 x 10/L'nin altına her düşüşte | Pomalidomid tedavisine ara verilir. | ||||||
Trombosit sayısı ≥50 x 10/L'ye döndüğünde | Pomalidomid tedavisine önceki seviye düşük doz ile tekrar başlanır. | dozdan | bir | ||||
Döküntü Döküntü = 2-3. Derece | Doz kesilmesi veya pomalidomid tedavisinin kesilmesi düşünülmelidir. | ||||||
Döküntü = Derece 4 veya kabarma (anjiyoödem, anafilaktik reaksiyon, eksfolyatif veya büllöz döküntü dahil veya Stevens-Johnson sendromu (SJS), Toksik Epidermal Nekroliz (TEN) veya Eozinofili ve Sistemik Semptomlarla İlaç Reaksiyonundan (DRESS) ile ilaç reaksiyonu şüphesi varsa) | Tedaviyi kalıcı olarak durdurun (bkz. Bölüm 4.4). | ||||||
Diğer
Diğer ≥ Derece 3 pomalidomid ile ilgili advers reaksiyonlar | Siklusun geri kalanı için pomalidomid tedavisi durdurulur. Bir sonraki döngüde tedaviye önceki dozdan bir seviye düşük doz ile devam edilir (Dozlama başlamadan önce advers reaksiyonlar geçmeli ya da ≤2. dereceye dönmelidir). | ||||||
â Bu tabloda yer alan doz ayarlama bilgileri, hem pomalidomid, bortezomib ve deksametazon kombinasyonu hem de pomalidomid dekzametazon kombinasyonu için geçerlidir.
* Nötropeni durumunda hekim büyüme faktörlerinin kullanımını göz önünde bulundurmalıdır. **MNSâMutlak Nötrofil Sayısı; ***TKSâTam Kan Sayımı
Tablo 3. Pomalidomid doz azaltma basamakları â
Doz Düzeyi | Pomalidomid dozu |
Başlangıç dozu | 4 mg |
Doz seviyesi -1 | 3 mg |
Doz seviyesi -2 | 2 mg |
Doz seviyesi -3 | 1 mg |
â Bu tabloda yer alan doz ayarlama bilgileri, hem pomalidomid, bortezomib ve deksametazon kombinasyonu hem de pomalidomid dekzametazon kombinasyonu için geçerlidir.
Dozun 1 mg'a düşürülmesi sonrasında advers reaksiyonlar ortaya çıkarsa, ilaç kesilmelidir. Güçlü CYP1A2 inhibitörleri
Güçlü CYP1A2 inhibitörleri (örn., siprofloksasin, enoksasin ve fluvoksamin) pomalidomid ile birlikte uygulanırsa pomalidomid dozu %50 azaltılmalıdır.
Bortezomib doz modifikasyonu veya kesilmesi
Bortezomibe bağlı advers reaksiyonlar için doz kesilmesi veya azaltmaları ile ilgili talimatlar için, hekimler bortezomib (KÜB)'ne başvurmalıdır.
Deksametazon doz modifikasyonu veya kesilmesi
Düşük doz deksametazona bağlı advers reaksiyonlar için doz kesilmesi veya azaltmaları ile ilgili talimatlar Tablo 4 ve 5'te özetlenmiştir.
Tablo 4. Deksametazon doz ayarlaması için bilgiler
Toksisite | Doz Değişikliği |
Dispepsi = 1-2. Derece
Dispepsi ≥3. Derece | Aynı dozda devam edilir ve histamin (H) blokörleri veya eşdeğerleri ile tedavi edilir. Semptomlar devam ederse, doz bir düzey azaltılır.
Semptomlar kontrol altına alınana kadar tedaviye ara verilir. Deksametazona ara verilse dahi pomalidomid tedavisine devam edilir. Tedaviye önceki dozdan daha düşük bir doz düzeyinde devam edilir ve H2 blokörü veya eşdeğeri eklenir. |
Ödem ≥3. Derece | Gerektiğinde diüretikler kullanılır ve doz bir düzey azaltılır. |
Konfüzyon veya duygu durum değişikliği ≥2. Derece | Semptomlar düzelene kadar tedaviye ara verilir. Tedaviye önceki dozdan daha düşük bir doz düzeyinde devam edilir. |
Kas güçsüzlüğü ≥2. Derece | Kas güçsüzlüğü ≤1. dereceye dönene kadar |
| tedaviye ara verilir. Tedaviye önceki dozdan daha düşük bir doz düzeyinde devam edilir. |
Hiperglisemi ≥3. Derece | Doz, bir düzey azaltılır. Gerektiğinde insülin veya oral hipoglisemik ilaçlarla tedavi edilir. |
Akut pankreatit | Deksametazon tedavi rejiminden çıkarılır. |
Diğer ≥ 3. Derece deksametazonla ilgili advers reaksiyonlar | Advers reaksiyonlar ≤2. dereceye dönene kadar deksametazon dozu durdurulur. Tedaviye önceki dozdan daha düşük bir doz düzeyinde devam edilir. |
Eğer toksisitelerin düzelmesi 14 günden fazla sürerse, deksametazon dozu bir önceki dozdan daha düşük bir doz seviyesinde devam edecektir.
Tablo 5. Deksametazon doz azaltma basamakları
Doz Düzeyi | ≤ 75 yaş Doz (Siklus 1-8: 21 günlük siklusun 1, 2, 4, 5, 8, 9, 11, 12 günleri Siklus ≥ 9: 21 günlük siklusun 1, 2, 8, 9 günleri) | > 75 yaş Doz (Siklus 1-8: 21 günlük siklusun 1, 2, 4, 5, 8, 9, 11, 12 günleri Siklus ≥ 9: 21 günlük siklusun 1, 2, 8, 9 günleri) |
Başlangıç dozu | 20 mg | 10 mg |
Doz seviyesi -1 | 12 mg | 6 mg |
Doz seviyesi -2 | 8 mg | 4 mg |
Eğer 75 yaş ve altındaki hasta 8 mg'ı veya 75 yaş üstü hasta 4 mg'ı tolere edemezse deksametazon kesilmelidir.
Tedavi rejiminin herhangi bir bileşeninin kalıcı olarak kesilmesi durumunda, kalan diğer tıbbi ürünlerin devamlılığı doktorun takdirine bağlıdır.
4.3. Kontrendikasyonlar
Gebelik,
Gebelik önleme programının tüm koşullarına uymadığı takdirde, çocuk doğurma potansiyeli olan kadınlar (bkz. bölüm 4.4 ve 4.6),
Gerekli doğum kontrol önlemlerini takip edemeyen veya önlemlerine uyamayan erkek hastalar (bkz. bölüm 4.4),
Etkin madde
POMALEM ile kombinasyon halinde verilen diğer tıbbi ürünler hakkında bilgi için, ilgili güncel KÜB'e bakınız.
4.4. Özel kullanım uyarıları ve önlemleri
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Diğer tıbbi ürünlere pomalidomidin etkisi
Pomalidomidin, P450 izoenzimlerinin substratları veya taşıyıcıları ile birlikte uygulanmasının, P450 izoenzim inhibisyonu veya indüksiyonu veya taşıyıcı inhibisyonuna bağlı klinik olarak anlamlı farmakokinetik ilaç-ilaç etkileşmelerine neden olması beklenmemektedir. Bu tür ilaç-ilaç etkileşim potansiyeli, pomalidomidin kombine oral kontraseptiflerin farmakokinetiği üzerine potansiyel etkisi dahil olmak üzere, klinik olarak değerlendirilmemiştir (bkz. bölüm 4.4).
Diğer tıbbi ürünlerin pomalidomide etkisi
Pomalidomid, CYP1A2 ve CYP3A4/5 tarafından kısmi olarak metabolize edilir. Ayrıca P- glikoproteinin de bir substratıdır. Pomalidomidin güçlü CYP3A4/5 ve P-gp inhibitörü olan ketokonazol ile veya güçlü CYP3A4/5 indükleyicisi olan karbamazepin ile eş zamanlı uygulanmasının, pomalidomide maruziyet üzerinde klinik olarak anlamlı etkisi bulunmamaktadır. Güçlü CYP1A2 inhibitörü olan fluvoksaminin pomalidomid ile ketokonazol varlığında eş zamanlı olarak uygulanması, pomalidomid ve ketokonazole kıyasla, pomalidomide ortalama maruziyeti %90 güven aralığı ile [%91 ila %124] %107 oranında artırmıştır. Tek başına bir CYP1A2 inhibitörünün metabolizma değişikliklerine katkısını değerlendirmek üzere yapılan ikinci bir çalışmada, pomalidomid ile tek başına fluvoksaminin eş zamanlı olarak uygulanması pomalidomide ortalama maruziyeti, tek başına pomalidomide
kıyasla %90 güven aralığı ile [%98 ila %157) %125 artırmıştır. Güçlü CYP1A2 inhibitörleri (örn., siprofloksasin, enoksasin ve fluvoksamin) pomalidomid ile eş zamanlı olarak uygulanırsa, pomalidomid dozu %50 azaltılmalıdır.
Pomalidomidin güçlü CYP1A2 inhibitörleri (örn., siprofloksasin, enoksasin ve fluvoksamin) ile eşzamanlı uygulanması halinde, hastalar advers reaksiyonlar açısından yakından takip edilmelidir.
Deksametazon
Multipl miyelom hastalarında 4 mg'a kadar olan çoklu pomalidomid dozlarıyla, 20 mg ila 40 mg arasında deksametazonun (CYP3A dahil çeşitli CYP enzimlerinin hafif ila orta derecede indükleyicisi) eş zamanlı olarak uygulanmasının, pomalidomidin tek başına uygulanmasına kıyasla, pomalidomidin farmakokinetiği üzerine herhangi bir etkisi olmamıştır.
Deksametazonun, varfarin üzerine olan etkisi bilinmemektedir. Tedavi sırasında varfarin konsantrasyonunun yakından takip edilmesi tavsiye edilir.
Özel popülasyonlara iliskin ek bilgiler Pediyatrik popülasyon:
Multipl Miyelom endikasyonu için 0-17 yaş arası çocuklarda pomalidomidin uygun bir kullanımı yoktur.
POMALEM ile kombine edilen ürünlerin diğer ilaçlar ile etkileşimleri hakkında ek bilgi için ilgili ilaçların güncel KÜB'ne bakınız.
4.6. Gebelik ve laktasyon
Gebelik Kategorisi: X
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeli olan kadınlar etkili doğum kontrol yöntemi kullanmalıdır. Pomalidomid insan semeninde bulunmaktadır. Önlem olarak pomalidomid kullanmakta olan tüm erkek hastalar, eşleri gebe ise ya da eşlerin çocuk doğurma potansiyelinin olması ve herhangi bir doğum kontrol yöntemi kullanmaması durumunda tedavi süresince, tedaviye ara verilmesi sırasında ve tedavi kesildikten sonra 7 gün süreyle prezervatif kullanmalıdır (bkz. bölüm 4.3 ve 4.4).
Çocuk doğurma potansiyeli olan kadınlar tedaviye başlamadan 4 hafta önce ve süresince (ve tedavinin ardından 4 haftaya kadar) etkili doğum kontrolü uygulamak zorundadırlar (bkz. bölüm 4.3 ve 4.4).
Pomalidomid gebelik boyunca ve gebeliği önlemek için tüm koşullara uyulmadıkça, çocuk doğurma potansiyeli olan kadınlarda kontrendikedir (bkz. bölüm 4.3 ve 4.4).
Gebelik dönemi
POMALEM gebelik döneminde kontrendikedir (bkz. bölüm 4.3).
Pomalidomidin insanlarda teratojenik etkisi olması beklenmektedir.
Pomalidomid ile tedavi edilen kadınlarda gebelik ortaya çıkması halinde, tedavi durdurulmalıdır ve hasta değerlendirme ve tavsiye için teratoloji konusunda uzman veya deneyimli bir hekime sevk edilmelidir. Pomalidomid kullanmakta olan bir erkeğin eşinde gebelik ortaya çıkması halinde, erkeğin eşinin değerlendirme ve tavsiye için teratoloji konusunda uzman veya deneyimli bir hekime sevk edilmesi önerilir.
Laktasyon dönemi
Pomalidomidin insan sütüyle atılıp atılmadığı bilinmemektedir. Pomalidomid anneye uygulandıktan sonra, emziren sıçanların sütünde tespit edilmiştir. Anne sütü alan bebeklerde pomalidomide bağlı advers reaksiyon görülme olasılığı nedeniyle, çocuk için emzirmenin ve kadın için terapinin faydalarını dikkate alarak, emzirmenin mi yoksa tedavinin mi kesileceğine dair bir karar verilmelidir.
Üreme yeteneği/Fertilite
Pomalidomidin hayvanlarda fertiliteyi olumsuz olarak etkilediği ve hayvanlarda teratojenik olduğu gösterilmiştir. Gebe tavşanlara uygulandıktan sonra, pomalidomid plasentaya geçmiştir ve fetal kanda tespit edilmiştir (bkz. bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
Pomalidomidin araç ve makine kullanma yeteneği üzerine hafif veya orta derecede bir etkisi bulunmaktadır.
Pomalidomid kullanımı ile yorgunluk, depresif bilinç düzeyi, konfüzyon ve baş dönmesi bildirilmiştir. Hastalar pomalidomid ile tedavi edilirken araç, makine kullanmamaları veya tehlikeli işler yapmamaları konusunda uyarılmalıdır.
4.8. İstenmeyen etkiler
Güvenlilik profili özeti
Pomalidomidin bortezomib ve dekzametazon ile kombinasyonu
En sık bildirilen kan ve lenf sistemi hastalıkları nötropeni (%46,8), trombositopeni (%36,7) ve anemidir (%28,4). En sık bildirilen advers reaksiyon periferik duyusal nöropatidir (%47,8). En sık bildirilen 3. veya 4. derece advers reaksiyonlar, nötropeni (%41,7), trombositopeni (%27,3) ve anemi (14,0) gibi kan ve lenf sistemi hastalıklarıdır. En sık bildirilen ciddi advers reaksiyon pnömonidir (%11,5). Bildirilen diğer ciddi advers reaksiyonlar arasında pireksi (%4,0), alt solunum yolu enfeksiyonu (%2,9), pulmoner emboli (%2,9), influenza (%2,9) ve akut böbrek hasarı (%2,9) yer almaktadır.
4.9. Doz aşımı ve tedavisi
Sağlıklı gönüllülerde, pomalidomid'in 50 mg'a kadar çıkan tek doz ve multipl miyelomlu hastalarda günde bir defa çoklu 10 mg dozlarında çalışma yapılmış olup doz aşımıyla ilişkili olarak ciddi advers reaksiyonlar bildirilmemiştir. Çalışmalarda pomalidomidin hemodiyaliz ile uzaklaştırılabildiği bulunmuştur.
Doz aşımı durumunda, destek tedavisi tavsiye edilmektedir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: İmmünosupresanlar, diğer immünosupresanlar ATC kodu: L04AX06
Etki mekanizması:
Pomalidomid direkt antimiyelom tümorisidal ve immünomodülatör aktiviteye sahiptir ve multipl miyelom tümör hücrelerinin çoğalmasında rol oynayan stromal hücre desteğini inhibe eder. Pomalidomid spesifik olarak hematopoietik tümör hücrelerinin proliferasyonunu inhibe
eder ve apopitozisi indükler. Ek olarak, pomalidomid lenalidomide dirençli multipl miyelom hücre dizilerinin proliferasyonunu inhibe eder ve lenalidomide duyarlı ve lenalidomide dirençli hücre dizilerinin her ikisinde de tümör hücrelerinin apopitozisi indüklemede deksametazon ile sinerjistik etki gösterir. Pomalidomid T hücreleri ve Doğal Öldürücü (Natural Killer, NK) hücrelerinin düzenlediği bağışıklığı güçlendirir ve monositler tarafından pro-enflamatuvar sitokinlerin (örn., TNF-α ve IL-6) üretilmesini inhibe eder. Pomalidomid, endotel hücrelerinin göçü ve adhezyonunu engelleyerek, anjiyogenezi de inhibe eder.
Pomalidomid, deoksiribonükleik asit (DNA) hasar bağlayıcı protein 1 (DDB1), cullin 4 (CUL4) ve cullins-1 regülatörünü (Roc1) içeren bir E3 ligaz kompleksinin bir parçası olan protein sereblonuna (CRBN) doğrudan bağlanır ve kompleks içinde CRBN'nin otomatik ubikütinasyonunu inhibe edebilir. E3 ubikütin ligazları, çeşitli substrat proteinlerinin poli- ubikütinasyonundan sorumludur ve pomalidomid tedavisi ile gözlenen pleyiotropik hücresel etkileri kısmen açıklayabilir.
Pomalidomid in vitro varlığında substrat proteinleri Aiolos ve Ikaros, ubikütinasyon ve daha sonra doğrudan sitotoksik ve immünomodülatör etkilere yol açan bozulma için hedeflenir. İn vivo olarak, pomalidomid tedavisi, nükseden lenalidomid-refrakter multipl miyelomlu hastalarda Ikaros seviyelerinde azalmaya yol açmıştır.
Klinik etkililik ve güvenlilik
Pomalidomidin bortezomib ve deksametazon ile kombinasyon tedavisinde
Lenalidomid de dahil olmak üzere en az bir dizi tedavi almış ve son tedavide veya sonrasında hastalık progresyonu göstermiş daha önce tedavi edilen multipl miyelomlu erişkin hastalarda bortezomib ve düşük doz deksametazon (Pom+Btz+DD-Deks) ile kombinasyon halinde pomalidomidin etkililiği ve güvenliliği, Faz III çok merkezli, randomize, açık etiketli çalışmada (CC-4047-MM-007) bortezomib ve düşük doz deksametazon (Btz+DD-Dks) ile karşılaştırılmıştır. Çalışmaya toplam 559 hasta katılmıştır. 281 hasta Pom+Btz+DD-Deks kolunda ve 278 hasta Btz+DD-Deks kolunda randomize edilmiştir. Hastaların %54'ü erkektir ve genel nüfusun medyan yaşı 68'dir (min: 27 â maks: 89 yaş). Hastaların yaklaşık %70'i lenalidomid tedavisine cevap vermemiştir (Pom+Btz+DD-Deks'te %71,2, Btz+DD-Deks'te
%68,7). Hastaların yaklaşık %40'ı 1. relapstadır ve hastaların yaklaşık %73'ü önceki tedavi olarak bortezomib almıştır.
Pom+Btz+DD-deks kolundaki hastalara uygulanmıştır. Her 21 günlük siklusun 1 ila 14. günlerinde oral olarak 4 mg pomalidomid uygulanmıştır. Her iki çalışma kolundaki hastalara, 1 ila 8 siklusları için 21 günlük bir siklusun 1, 4, 8 ve 11. günlerinde ve 9 ve sonrası sikluslar için 21 günlük bir siklusun 1 ve 8. günlerinde bortezomib (1,3 mg/m2/doz) uygulanmıştır. Her iki çalışma kolundaki hastalara 1 ila 8 arasındaki sikluslar için 21 günlük bir siklusun 1, 2, 4,
5, 8, 9, 11 ve 12. günlerinde ve 9. siklustan itibaren sonraki 21 günlük döngünün 1, 2, 8 ve 9 günlerinde düşük doz deksametazon (20 mg/gün [≤ 75 yaşında] veya 10 mg/gün [> 75 yaşında]) uygulanmıştır. Toksisiteyi yönetmek için gerektiğinde dozlar azaltılmış ve tedavi geçici olarak kesilmiş veya durdurulmuştur. (bkz. Bölüm 4.2).
Tedavi amaçlı popülasyon (ITT) için birincil etkililik sonlanım noktası, IMWG kriterlerine dayalı olarak Bağımsız Değerlendirme Kararlaştırma Kurulunun (IRAC) değerlendirmesine göre progresyonsuz sağkalım (Progression Free Survival - PFS)'dır. Ortalama 15,9 aylık takipten sonra, Pom+Btz+DD-deks kolunda medyan PFS süresi 11,20 aydır (%95 GA: 9,66; 13,73). Btz + DD-deks kolunda, medyan PFS süresi 7,1 aydır (%95 GA: 5,88; 8,48).
26 Ekim 2017 tarihli veri kesme tarihi kullanılarak genel etkililik veri özeti Tablo 10'da sunulmuştur. ITT popülasyonunda PFS için Kaplan-Meier eğrisi Şekil 1'de gösterilmektedir.
Tablo 10- Genel etkililik özeti
| Pom+Btz+DD-Deks (N = 281) | Btz+DD-Deks (N = 278) |
PFS (ay) |
| |
Medyana zaman (% 95 GA) | 11,20 (9,66; 13,73) | 7,10 (5,88; 8,48) |
HR (% 95 GA), P-değeri | 0,61 (0,49; 0,77); <0,0001 | |
ORR, n (%) | % 82,2 | % 50,0 |
sCR | 9 (3,2) | 2 (0,7) |
CR | 35 (12,5) | 9 (3,2) |
VGPR | 104 (37,0) | 40 (14,4) |
PR | 83 (29,5) | 88 (31,7) |
OR (95% GA) , P-değeri | 5,02 (3,35; 7,52); <0,001 | |
DoR (ay) |
| |
Medyana zaman (% 95 GA) | 13,7 (10,94 ; 18,10) | 10,94 (8,11 ; 14,78) |
HR (% 95 GA) | 0,76 (0,56; 1,02) | |
Btz = bortezomib; GA = Güven aralığı; CR = Tam yanıt; DoR = Yanıt süresi; HR = Tehlike oranı; DD-Deks = düşük doz deksametazon; OR = Olasılık oranı; ORR = Genel yanıt oranı; PFS = progresyonsuz sağkalım; POM = pomalidomid; PR = Kısmi yanıt; sCR = Kati tam yanıt VGPR = Çok iyi kısmi yanıt.
≤ 5,5 mg/L'ye karşı> 5,5 mg/L) ile CMH testine bağlıdır.
Pom+Btz+DD-deks kolunda medyan tedavi süresi 8,8 ay (12 tedavi siklusu) ve Btz+DD-deks kolunda 4,9 aydır (7 tedavi siklusu).
PFS avantajı, yalnızca bir önceki tedavi rejimini alan hastalarda daha belirgindir. Önceden bir 26 antimiyelom tedavisi alan hastalarda ortalama PFS süresi Pom+Btz+DD-deks kolunda 20,73 ay (% 95 GA: 15,11; 27,99) ve Btz+DD-deks kolunda 11,63 aydır (%95 GA: 7,52,
15,74).
Pom+Btz+DD-deks tedavisi ile %46 risk azalması gözlendi (HR = 0,54; %95 GA: 0,36;
0,82).
Şekil 1. IMWG Kriterlerine Dayalı olarak IRAC Değerlendirmesi ile Progresyonsuz Sağkalım (Sınıflandırılmış Log Sıra Testi) (ITT Popülasyonu)
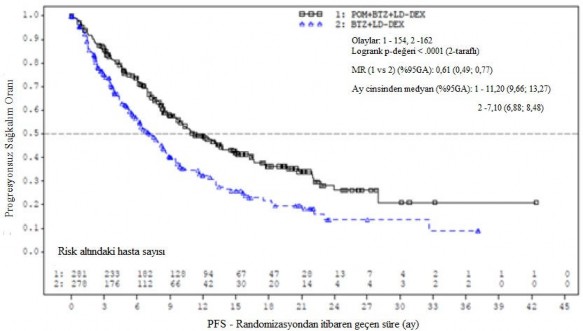
Veri kesim tarihi: 26 Ekim 2017
Genel sağkalım (OS) için 15 Eylül 2018 tarihli veri kesimi kullanılarak (26,2 aylık medyan takip süresi) yakın zamandaki ara analizine göre, Kaplan-Meier tahminleri ile medyan OS zamanı Pom+Btz+DDdeks kolu için 40,5 ay ve Btz +DDdeks kolu için 30,5 aydır (Genel olay oranı %43,3 ile birlikte HR = 0,91, % 95 GA: 0,70; 1,18,).
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: İmmünosupresanlar, diğer immünosupresanlar ATC kodu: L04AX06
Etki mekanizması:
Pomalidomid direkt antimiyelom tümorisidal ve immünomodülatör aktiviteye sahiptir ve multipl miyelom tümör hücrelerinin çoğalmasında rol oynayan stromal hücre desteğini inhibe eder. Pomalidomid spesifik olarak hematopoietik tümör hücrelerinin proliferasyonunu inhibe
eder ve apopitozisi indükler. Ek olarak, pomalidomid lenalidomide dirençli multipl miyelom hücre dizilerinin proliferasyonunu inhibe eder ve lenalidomide duyarlı ve lenalidomide dirençli hücre dizilerinin her ikisinde de tümör hücrelerinin apopitozisi indüklemede deksametazon ile sinerjistik etki gösterir. Pomalidomid T hücreleri ve Doğal Öldürücü (Natural Killer, NK) hücrelerinin düzenlediği bağışıklığı güçlendirir ve monositler tarafından pro-enflamatuvar sitokinlerin (örn., TNF-α ve IL-6) üretilmesini inhibe eder. Pomalidomid, endotel hücrelerinin göçü ve adhezyonunu engelleyerek, anjiyogenezi de inhibe eder.
Pomalidomid, deoksiribonükleik asit (DNA) hasar bağlayıcı protein 1 (DDB1), cullin 4 (CUL4) ve cullins-1 regülatörünü (Roc1) içeren bir E3 ligaz kompleksinin bir parçası olan protein sereblonuna (CRBN) doğrudan bağlanır ve kompleks içinde CRBN'nin otomatik ubikütinasyonunu inhibe edebilir. E3 ubikütin ligazları, çeşitli substrat proteinlerinin poli- ubikütinasyonundan sorumludur ve pomalidomid tedavisi ile gözlenen pleyiotropik hücresel etkileri kısmen açıklayabilir.
Pomalidomid in vitro varlığında substrat proteinleri Aiolos ve Ikaros, ubikütinasyon ve daha sonra doğrudan sitotoksik ve immünomodülatör etkilere yol açan bozulma için hedeflenir. İn vivo olarak, pomalidomid tedavisi, nükseden lenalidomid-refrakter multipl miyelomlu hastalarda Ikaros seviyelerinde azalmaya yol açmıştır.
Klinik etkililik ve güvenlilik
Pomalidomidin bortezomib ve deksametazon ile kombinasyon tedavisinde
Lenalidomid de dahil olmak üzere en az bir dizi tedavi almış ve son tedavide veya sonrasında hastalık progresyonu göstermiş daha önce tedavi edilen multipl miyelomlu erişkin hastalarda bortezomib ve düşük doz deksametazon (Pom+Btz+DD-Deks) ile kombinasyon halinde pomalidomidin etkililiği ve güvenliliği, Faz III çok merkezli, randomize, açık etiketli çalışmada (CC-4047-MM-007) bortezomib ve düşük doz deksametazon (Btz+DD-Dks) ile karşılaştırılmıştır. Çalışmaya toplam 559 hasta katılmıştır. 281 hasta Pom+Btz+DD-Deks kolunda ve 278 hasta Btz+DD-Deks kolunda randomize edilmiştir. Hastaların %54'ü erkektir ve genel nüfusun medyan yaşı 68'dir (min: 27 â maks: 89 yaş). Hastaların yaklaşık %70'i lenalidomid tedavisine cevap vermemiştir (Pom+Btz+DD-Deks'te %71,2, Btz+DD-Deks'te
%68,7). Hastaların yaklaşık %40'ı 1. relapstadır ve hastaların yaklaşık %73'ü önceki tedavi olarak bortezomib almıştır.
Pom+Btz+DD-deks kolundaki hastalara uygulanmıştır. Her 21 günlük siklusun 1 ila 14. günlerinde oral olarak 4 mg pomalidomid uygulanmıştır. Her iki çalışma kolundaki hastalara, 1 ila 8 siklusları için 21 günlük bir siklusun 1, 4, 8 ve 11. günlerinde ve 9 ve sonrası sikluslar için 21 günlük bir siklusun 1 ve 8. günlerinde bortezomib (1,3 mg/m2/doz) uygulanmıştır. Her iki çalışma kolundaki hastalara 1 ila 8 arasındaki sikluslar için 21 günlük bir siklusun 1, 2, 4,
5, 8, 9, 11 ve 12. günlerinde ve 9. siklustan itibaren sonraki 21 günlük döngünün 1, 2, 8 ve 9 günlerinde düşük doz deksametazon (20 mg/gün [≤ 75 yaşında] veya 10 mg/gün [> 75 yaşında]) uygulanmıştır. Toksisiteyi yönetmek için gerektiğinde dozlar azaltılmış ve tedavi geçici olarak kesilmiş veya durdurulmuştur. (bkz. Bölüm 4.2).
Tedavi amaçlı popülasyon (ITT) için birincil etkililik sonlanım noktası, IMWG kriterlerine dayalı olarak Bağımsız Değerlendirme Kararlaştırma Kurulunun (IRAC) değerlendirmesine göre progresyonsuz sağkalım (Progression Free Survival - PFS)'dır. Ortalama 15,9 aylık takipten sonra, Pom+Btz+DD-deks kolunda medyan PFS süresi 11,20 aydır (%95 GA: 9,66; 13,73). Btz + DD-deks kolunda, medyan PFS süresi 7,1 aydır (%95 GA: 5,88; 8,48).
26 Ekim 2017 tarihli veri kesme tarihi kullanılarak genel etkililik veri özeti Tablo 10'da sunulmuştur. ITT popülasyonunda PFS için Kaplan-Meier eğrisi Şekil 1'de gösterilmektedir.
Tablo 10- Genel etkililik özeti
| Pom+Btz+DD-Deks (N = 281) | Btz+DD-Deks (N = 278) |
PFS (ay) |
| |
Medyana zaman (% 95 GA) | 11,20 (9,66; 13,73) | 7,10 (5,88; 8,48) |
HR (% 95 GA), P-değeri | 0,61 (0,49; 0,77); <0,0001 | |
ORR, n (%) | % 82,2 | % 50,0 |
sCR | 9 (3,2) | 2 (0,7) |
CR | 35 (12,5) | 9 (3,2) |
VGPR | 104 (37,0) | 40 (14,4) |
PR | 83 (29,5) | 88 (31,7) |
OR (95% GA) , P-değeri | 5,02 (3,35; 7,52); <0,001 | |
DoR (ay) |
| |
Medyana zaman (% 95 GA) | 13,7 (10,94 ; 18,10) | 10,94 (8,11 ; 14,78) |
HR (% 95 GA) | 0,76 (0,56; 1,02) | |
Btz = bortezomib; GA = Güven aralığı; CR = Tam yanıt; DoR = Yanıt süresi; HR = Tehlike oranı; DD-Deks = düşük doz deksametazon; OR = Olasılık oranı; ORR = Genel yanıt oranı; PFS = progresyonsuz sağkalım; POM = pomalidomid; PR = Kısmi yanıt; sCR = Kati tam yanıt VGPR = Çok iyi kısmi yanıt.
≤ 5,5 mg/L'ye karşı> 5,5 mg/L) ile CMH testine bağlıdır.
Pom+Btz+DD-deks kolunda medyan tedavi süresi 8,8 ay (12 tedavi siklusu) ve Btz+DD-deks kolunda 4,9 aydır (7 tedavi siklusu).
PFS avantajı, yalnızca bir önceki tedavi rejimini alan hastalarda daha belirgindir. Önceden bir 26 antimiyelom tedavisi alan hastalarda ortalama PFS süresi Pom+Btz+DD-deks kolunda 20,73 ay (% 95 GA: 15,11; 27,99) ve Btz+DD-deks kolunda 11,63 aydır (%95 GA: 7,52,
15,74).
Pom+Btz+DD-deks tedavisi ile %46 risk azalması gözlendi (HR = 0,54; %95 GA: 0,36;
0,82).
Şekil 1. IMWG Kriterlerine Dayalı olarak IRAC Değerlendirmesi ile Progresyonsuz Sağkalım (Sınıflandırılmış Log Sıra Testi) (ITT Popülasyonu)

Veri kesim tarihi: 26 Ekim 2017
Genel sağkalım (OS) için 15 Eylül 2018 tarihli veri kesimi kullanılarak (26,2 aylık medyan takip süresi) yakın zamandaki ara analizine göre, Kaplan-Meier tahminleri ile medyan OS zamanı Pom+Btz+DDdeks kolu için 40,5 ay ve Btz +DDdeks kolu için 30,5 aydır (Genel olay oranı %43,3 ile birlikte HR = 0,91, % 95 GA: 0,70; 1,18,).
5.2. Farmakokinetik özellikler
Genel ÖzelliklerEmilim:
Pomalidomid, maksimum plazma konsantrasyonuna (C) doz uygulamasından sonraki 2 ila 3 saat içerisinde ulaşacak şekilde, tek oral doz olarak uygulamayı takiben en az %73 oranında emilir. Pomalidomidin sistemik maruziyeti (EAA) yaklaşık olarak doğrusal ve dozla orantılı bir şekilde artar. Çoklu dozları takiben, EAA'da pomalidomid %27 ila %31 arası bir birikim oranına sahiptir.
Yüksek yağlı ve yüksek kalorili öğünle birlikte uygulanması ortalama plazma C'ını yaklaşık %27'ye kadar azaltarak emilim hızını yavaşlatır, ancak ortalama EAA'da %8'lik bir azalmayla genel emilim miktarı üzerinde minimal bir etkiye sahiptir. Pomalidomid yemeklerle birlikte veya yemeklerden ayrı olarak alınabilir.
Dağılım:
Pomalidomid kararlı durumda 62 ve 138 L arasında bir ortalama sanal dağılım hacmine (Vd/F) sahiptir. Pomalidomid, günde bir defa 2 mg dozunda 4 gün boyunca uygulandıktan
sonra, doz sonrası 4. saatte (yaklaşık olarak T) sağlıklı bireylerin semenine, plazma düzeyinin %67'si kadar bir konsantrasyonda dağılır. In vitro pomalidomid enantiyomerlerinin insan plazmasındaki proteinlere bağlanma oranı %12 ila %44 arasında değişmektedir ve konsantrasyona bağımlı değildir.
Biyotransformasyon:
Pomalidomid, tek bir oral doz [C]-pomalidomid (2 mg) uygulanmış sağlıklı bireylerde in vivo ortamda dolaşımdaki majör bileşendir (yaklaşık olarak plazma radyoaktivitesinin %70'i). Ana veya plazma toplam radyoaktivitesine göre >%10 oranında herhangi bir metabolit bulunmamıştır.
Atılan radyoaktivitenin baskın metabolik yolları, sonraki glukuronidasyon ile hidroksilasyon veya hidrolizdir. In vitro, CYP1A2 ve CYP3A4 pomalidomidin CYP-aracılı hidroksilasyonunda yer alan birincil enzimler olarak belirlenirken, CYP2C19 ve CYP2D6'nın küçük ek katkılarının olduğu saptanmıştır. Pomalidomid aynı zamanda in vitro bir P- glikoprotein substratıdır. Pomalidomidin güçlü CYP3A4/5 ve P-gp inhibitörü ketokonazol ile veya güçlü CYP3A4/5 indükleyicisi karbamazepin ile eş zamanlı uygulanmasının, pomalidomid maruziyeti üzerine klinik olarak anlamlı bir etkisi olmamıştır. Güçlü CYP1A2 inhibitörü fluvoksaminin ketokonazol varlığında pomalidomid ile birlikte uygulanması pomalidomid ile ketokonazole kıyasla pomalidomide ortalama maruziyeti %90 güven aralığı ile [%91 ila %124] %107'ye kadar artırmıştır. Tek başına bir CYP1A2 inhibitörünün metabolizma değişikliklerine etkisini değerlendirmek üzere yapılan ikinci bir çalışmada, pomalidomid ile tek başına fluvoksaminin eş zamanlı olarak uygulanması pomalidomide ortalama maruziyeti, tek başına pomalidomide kıyasla %90 güven aralığı ile [%98 ila %157)
%125 artırmıştır. Güçlü CYP1A2 inhibitörleri (örn., siprofloksasin, enoksasin ve fluvoksamin) pomalidomid ile eş zamanlı olarak uygulanırsa, pomalidomid dozu %50 azaltılmalıdır. CYP1A2 izoformunun tütün ile indüklendiği göz önünde bulundurularak, sigara içenlere pomalidomid uygulamasının, pomalidomidin sigara içmeyenlerdeki maruziyeti ile karşılaştırıldığında maruziyet ile ilgili olarak klinik etkisi olmamıştır.
In vitro verilere dayalı olarak pomalidomid sitokrom P-450 izoenzimlerinin bir inhibitörü veya indükleyicisi değildir ve çalışılmış herhangi bir ilaç taşıyıcısını inhibe etmemiştir. Pomalidomid bu yolakların substratları ile eş zamanlı uygulandığında, klinik olarak anlamlı ilaç-ilaç etkileşmeleri beklenmez.
Eliminasyon:
Pomalidomid, sağlıklı gönüllülerde yaklaşık 9,5 saatlik ve multipl miyelomu olan hastalarda yaklaşık 7,5 saatlik medyan plazma yarılanma ömrü ile elimine edilir. Pomalidomid, yaklaşık 7-10 L/s'lik ortalama toplam vücut klerensine (CL/F) sahiptir.
Sağlıklı bireylere tek doz oral [C]-pomalidomid (2 mg) uygulanmasını takiben radyoaktif dozun %73 ve %15'i sırasıyla idrar ve feçes ile atılırken, uygulanan radyoaktif karbon dozunun %2 ve %8'i idrar ve feçeste pomalidomid şeklinde atılmıştır.
Pomalidomid atılmadan önce büyük ölçüde metabolize edilir, ortaya çıkan metabolitler başlıca idrarla atılır. İdrardaki baskın 3 metabolit (hidroliz veya hidroksilasyon ve ardından glukuronidasyon ile oluşan), idrara geçen dozun sırasıyla yaklaşık %23, %17 ve %12'sini oluşturur.
CYP-bağımlı metabolitler, toplam atılan radyoaktivitenin yaklaşık %43'ünü oluştururken, CYP-bağımlı-olmayan hidrolitik metabolitler %25'ini ve değişmeden atılan pomalidomid de
%10'unu oluşturur (%2 idrarla ve %8 feçes ile).
Popülasyon Farmakokinetikleri
İki kompartmanlı bir modelin kullanıldığı popülasyon farmakokinetik analizine göre, sağlıklı gönüllüler ve MM hastaları benzer görünür klerense (CL/F) ve sanal santral dağılım hacmine (V/F) sahiptir. Pomalidomid periferik dokularda sağlıklı gönüllülerdekine göre 3,7 kat daha yüksek sanal periferik dağılım klerensi (Q/F) ve 8 kat daha yüksek sanal periferik dağılım hacmi (V/F) olacak şekilde tümörler tarafından daha yüksek oranda alınmıştır.
Hastalardaki karakteristik özellikler
Böbrek yetmezliği:
Bu popülasyonda yapılan farmakokinetik analizler böbrek yetmezliği olan hastalarda (kreatinin klerensi veya hesaplanmış glomerüler filtrasyon hızı [eGFR] ile tanımlanan) pomalidomid farmakokinetik parametrelerinin normal böbrek fonksiyonuna (CrCl ≥60 mL/dakika) sahip hastalarla önemli düzeyde farklılık göstermediği görülmüştür. Pomalidomide ortalama normalize EAA maruziyeti, normal böbrek fonksiyonuna sahip hastalara kıyasla orta şiddette böbrek yetmezliği olan hastalarda (eGFR ≥30 ila ≤ 45 mL/dakika/1,73 m) %90 güven aralığı ile [%77,4 ila %120,6] %98,2'dir. Pomalidomide ortalama normalize EAA maruziyeti normal böbrek fonksiyonuna sahip hastalara kıyasla diyaliz gerektirmeyen ciddi böbrek yetmezliği olan hastalarda (CrCl <30 mL/dakika veya eGFR <30 mL/dakika/1,73 m) %90 güven aralığı ile [%79,7 ila %127] %100,2'dir. Pomalidomide ortalama normalize EAA maruziyeti normal böbrek fonksiyonuna sahip hastalara kıyasla diyaliz gerektiren ciddi böbrek yetmezliği olan hastalarda (CrCl <30 mL/dakika, diyaliz gerektiren) %90 güven aralığı ile [%7,5 ila %70] %35,8 artmıştır. Bu böbrek yetmezliği gruplarının her birinde pomalidomide maruziyette ortalama değişiklikler doz ayarlaması gerektirecek bir boyutta değildir.
Karaciğer yetmezliği:
Farmakokinetik parametreler sağlıklı gönüllülere kıyasla karaciğer yetmezliği olan hastalarda (Child-Pugh kriterleri ile tanımlanan) çok hafif düzeyde değişiklik göstermiştir. Pomalidomide ortalama maruziyet sağlıklı gönüllülere kıyasla hafif düzeyde karaciğer yetmezliği olan hastalarda %90 güven aralığı ile [%9 ila %110] %51 artmıştır. Pomalidomide ortalama maruziyet sağlıklı gönüllülere kıyasla orta düzeyde karaciğer yetmezliği olan hastalarda %90 güven aralığı ile [%13 ila %119] %58 artmıştır. Pomalidomide maruziyet sağlıklı gönüllülere kıyasla ağır karaciğer yetmezliği olan hastalarda %90 güven aralığı ile [%24 ila %138] %72 artmıştır. Bu yetmezlik gruplarının her birinde pomalidomide
maruziyetteki ortalama artışlar doz şeması veya doz ayarlaması gerektirecek boyutta değildir (bkz. bölüm 4.2).
Pediyatrik popülasyon:
Nükseden veya progresif primer beyin tümörü olan çocuklarda ve genç erişkinlerde tek bir oral pomalidomid dozunu takiben, ortalama Tmaks değeri dozdan 2 ila 4 saat sonrasıdır ve 74,8 (%59,4), 79,2 (%51.7) ve 104 (%18,3) ng/mL geometrik ortalama Cmaks (%CV) değerleri sırasıyla 1,9, 2,6 ve 3,4 mg/m2 doz seviyelerine karşılık gelmektedir. EAAve EAA, düşük 2 dozda yaklaşık 700 ila 800 saat·ng/mL aralığında ve yüksek dozda yaklaşık 1200 saat·ng/mL aralığında toplam maruziyetle benzer eğilimleri izlemiştir. Tahmini yarı ömürleri, yaklaşık 5 ila 7 saat aralığındadır.
MTD'de yaşa ve steroid kullanımına göre tabakalaşmaya atfedilebilecek net bir eğilim yoktur. Genel olarak veriler, EAA'nın pomalidomid dozundaki artışla neredeyse orantılı olarak arttığını, C'taki artışın ise genellikle orantılı olandan daha az olduğunu göstermektedir.
1,9 mg/m/gün ila 3,4 mg/m/gün oral uygulama doz seviyelerini takiben pomalidomidin farmakokinetiği, tekrarlayan veya progresif pediyatrik beyin tümörlerinde bir Faz 1 ve Faz 2 çalışmasının entegre bir analizinde 4 ila 20 yaş arası 70 hastada belirlenmiştir. Pomalidomid konsantrasyon-zaman profilleri, birinci dereceden absorpsiyonlu ve eliminasyonlu sahip tek bölmeli bir PK modeli ile uygun bir şekilde tanımlanmıştır. Pomalidomid, orta derecede değişkenlikle doğrusal ve zamanla değişmeyen bir farmakokinetik (PK) sergiledi. CL/F, Vc/F, Ka, pomalidomidin gecikme süresinin tipik değerleri sırasıyla 3,94 L/saat, 43 L, 1,45 saat ve 0,454 saattir. Pomalidomidin terminal eliminasyon yarı ömrü 7,33 saattir. Vücut yüzey alanı (BSA) dışında, yaş ve cinsiyet dahil olmak üzere test edilen ortak değişkenlerin hiçbiri pomalidomid farmakokinetiği (PK) üzerinde etkiye sahip değildir. BSA, pomalidomid CL/F ve Vc/F'nin istatistiksel olarak anlamlı bir ortak değişkeni olarak tanımlanmış olmasına rağmen, BSA'nın maruziyet parametreleri üzerindeki etkisi klinik olarak anlamlı kabul edilmemiştir.
Genel olarak, çocuklar ve yetişkin hastalar arasında pomalidomid farmakokinetiği (PK) açısından önemli bir fark yoktur.
Geriyatrik hastalarda:
Sağlıklı gönüllülerde ve multipl miyelomlu hastalarda yapılan farmakokinetik analizlerde, hasta yaşının (19-83 yaş) pomalidomidin oral klerensi üzerinde anlamlı bir etkisi olmadığı gözlenmiştir. Klinik çalışmalarda, pomalidomid kullanan yaşlı (>65 yaş) hastalarda doz ayarlaması gerekmemiştir (bkz. bölüm 4.2).
5.3. Klinik öncesi güvenlilik verileri
Tekrarlanan doz toksisite çalışmaları
Sıçanlarda, pomalidomid 50, 250 ve 1000 mg/kg/gün dozunda 6 ay süreyle kronik olarak uygulandığında iyi tolere edilmiştir. 1000 mg/kg/güne kadar herhangi bir advers bulgu tespit edilmemiştir (4 mg klinik doza göre 175 kat maruziyet).
Pomalidomid, maymunlarda, 9 ay kadar süreyle tekrarlanan doz çalışmalarında incelenmiştir. Bu çalışmalarda maymunlar, pomalidomidin etkilerine sıçanlardan daha yüksek duyarlılık göstermiştir. Maymunlarda gözlenen başlıca toksisiteler, hematopoietik/lenforetiküler sistemle ilişkilendirilmiştir. Maymunlarda 0,05, 0,1 ve 1 mg/kg/gün dozları ile yapılan 9 aylık çalışmada, 1 mg/kg/gün dozunda 6 hayvanda morbidite ve erken ötenazi bildirilmiştir ve bu pomalidomide yüksek maruziyetteki (4 mg klinik doza göre 15 kat maruziyet oranı) immünosupresif etkilere (stafilokok enfeksiyonu, azalmış periferik kan lenfositleri, kalın bağırsakta kronik enflamasyon, histolojik lenfoid azalması ve kemik iliğinde hiposellülerite) bağlanmıştır. 4 maymunun erken ötenazisine neden olan bu immünosüpresif etkiler kötü sağlık koşulları (sulu dışkı, iştahsızlık, besin alımının azalması ve kilo kaybı) yüzündendir; bu hayvanların histopatolojik incelemeleri, kalın bağırsaklarda kronik enflamasyon ve ince bağırsaklarda villöz atrofi olduğunu göstermiştir. Stafilokok enfeksiyonu 4 maymunda görülmüştür; bu hayvanlardan 3'ü antibiyotik tedavisine yanıt vermiştir ve 1 hayvan tedavi edilmeden ölmüştür. Ayrıca, akut miyelojenöz lösemi ile uyumlu bulgular bir maymunun ötenazisine yol açmıştır; bu hayvanda gözlenen klinik gözlemler ve klinik patoloji ve/veya kemik iliği değişiklikleri immünosupresyon ile tutarlı olmuştur. ALP ve GGT düzeyindeki yükselmeler ile ilişkili minimum veya hafif safra kanalı proliferasyonu da 1 mg/kg/gün dozunda gözlenmiştir. İyileşen hayvanlar değerlendirildiğinde, 1 mg/kg/gün grubundaki 1 hayvanda görülen intrahepatik safra kanallarının proliferasyonu haricindeki, tüm tedaviyle ilişkili bulguların dozun kesilmesinden 8 hafta sonrasında geriye döndüğü görülmüştür. Advers Etkinin Gözlenmediği En Düşük Doz 0,1 mg/kg/gün olmuştur (4 mg klinik doza göre 0,5 kat maruziyet oranı).
Genotoksisite/karsinojenisite
Pomalidomid, bakteri ve memeli mutasyon deneylerinde, mutajenik olarak bildirilmemiştir ve insan periferik kan lenfositlerinde kromozomal sapmaları veya 2000 mg/kg/güne kadar olan dozların uygulandığı sıçanların kemik iliklerinde polikromatik eritrositlerde mikroçekirdek oluşmasını indüklememiştir. Karsinojenisite çalışmaları gerçekleştirilmemiştir.
Fertilite ve erken embriyonik gelişim
Sıçanlardaki fertilite ve erken embriyonik gelişim çalışmasında, pomalidomid erkek ve dişi sıçanlara 25, 250 ve 1.000 mg/kg/gün dozlarında uygulanmıştır. Gebeliğin 13. günündeki uterus muayenesinde ortalama canlı embriyo sayısında azalma ve tüm doz düzeylerinde implantasyon sonrası canlı embriyo kayıplarında artma görülmüştür. Bu nedenle, bu gözlenen etkiler için Advers Etkinin Gözlenmediği En Düşük Doz <25 mg/kg/gündür (Bu test edilen en düşük dozda EAA39.960 ng.s/mL (nanogram*saat/mililitre) ve maruziyet oranı 4 mg klinik doza göre 99 kattır). Bu çalışmada tedavi edilen erkekler, tedavi edilmemiş dişilerle çiftleştirildiklerinde, tüm uterus parametreleri kontroller ile benzer olmuştur. Bu sonuçlara dayalı olarak, gözlenen etkiler dişilerin tedavi edilmelerine bağlanmıştır.
Embriyo-fetal gelişim
Pomalidomidin, sıçanlar ve tavşanlara majör organogenez sırasında uygulandığında teratojenik olduğu bulunmuştur. Sıçan embriyofetal gelişim toksisite çalışmasında, idrar torbasının yokluğu, tiroit bezinin yokluğu ve lumbal ve torasik vertebral unsurların (merkezi
ve/veya nöral kemerler) birleşmesi ve yanlış dizilmesi şeklindeki malformasyonlar tüm doz düzeylerinde (25, 250 ve 1.000 mg/kg/gün) gözlenmiştir.
Bu çalışmada herhangi bir maternal toksisite gözlenmemiştir. Bu nedenle, maternal Advers Etkinin Gözlenmediği En Düşük Doz 1.000 mg/kg/gün ve gelişimsel toksisite için Advers Etkinin Gözlenmediği En Düşük Doz <25 mg/kg/gündür (EAAGebeliğin 17. gününde test edilen bu en düşük dozda 34.340 ng.s/mL ve maruziyet oranı 4 mg klinik doza göre 85 kattır). Pomalidomid, tavşanlara 10 ila 250 mg/kg arasında değişen dozlarla uygulandığında, embriyo-fetal malformasyonlar meydana getirmiştir. Tüm dozlarda özellikle 250 mg/kg/gün dozunda kardiyak anomalilerde artma görülmüştür. 100 ve 250 mg/kg/gün dozlarında, implantasyon sonrası kayıplarda hafif artışlar ve fetal vücut ağırlığında hafif azalmalar meydana gelmiştir. 250 mg/kg/gün dozunda, fetal malformasyonlar ekstremite anomalilerini (bükük ve/veya dönmüş ön- ve/veya arka-bacaklar, eklenmemiş veya eksik parmaklar) ve eşlik eden iskelet malformasyonlarını (kemikleşmemiş metakarpal, yanlış dizilmiş falanks ve metakarpal, eksik parmak, kemikleşmemiş falanks ve kısa kemikleşmemiş veya bükülmüş tibia); beyinde orta derecede lateral ventrikül genişlemesini; sağ subklavyen arterin anormal yerleşmesini; akciğerlerde orta lobun olmamasını; düşük-yerleşimli böbreği; değişmiş karaciğer morfolojisini; eksik veya kemikleşmemiş pelvisi; fazladan torasik kaburgalar için artmış bir ortalamayı ve kemikleşmiş tarsallar için azalmış bir ortalamayı içermektedir. 100 ve 250 mg/kg/gün dozlarında maternal vücut kilo alımında hafif azalma, trigliseridlerde belirgin azalma ve mutlak ve göreceli dalak ağırlıklarında belirgin azalma gözlenmiştir. Maternal Advers Etkinin Gözlenmediği En Düşük Doz 10 mg/kg/gün ve gelişimsel Advers Etkinin Gözlenmediği En Düşük Doz <10 mg/kg/gündür (EAA, Gebeliğin 19. gününde bu test edilen en düşük dozda 418 ng.s/mL olmuştur ve bu da 4 mg klinik dozdan elde edilen ile benzerdir).
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Mannitol (E421) Prejelatinize nişasta Sodyum stearil fumarat Sert kapsül:
Titanyum dioksit Sarı demir oksit Siyah demir oksit Patent mavisi V Jelatin (sığır jelatini)
İndigotin-FD&C Blue2 Eritrosin- FD&C Red3
6.2. Geçimsizlikler
Yeterli veri yoktur.
6.3. Raf ömrü
24 ay
6.4. Saklamaya yönelik özel tedbirler
25°C altındaki oda sıcaklığında saklayınız.
6.5. Ambalajın niteliği ve içeriği
Ürünümüzün primer ambalaj malzemesi PVC/Aklarâ Alüminyum folyo blisterdir. Blisterler karton kutular içerisine paketlenir. Bir kutu içerisinde 21 adet sert kapsül blister ambalajlarda kullanma talimatı ile birlikte sunulmaktadır.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kapsüller açılmamalı veya ezilmemelidir. Pomalidomid tozu cilt ile temas ederse, cilt hemen ve iyice sabun ve su ile yıkanmalıdır. Pomalidomid mukoz membranlarla temas ederse bol su ile yıkanmalıdır.
Sağlık uzmanları ve bakıcılar, blister veya kapsülü tutarken tek kullanımlık eldivenler giymelidir. Eldivenler cildin maruz kalmasını önlemek için işi bittikten sonra dikkatlice çıkarılmalı, sızdırmaz plastik polietilen torbaya konulmalı ve bölgesel gerekliliklere uygun olarak atılmalıdır. Daha sonra eller su ve sabunla iyice yıkanmalıdır. Hamile olan veya hamile olabileceğinden şüphelenen kadınlar, blister veya kapsülü tutmamalıdır (bkz. Bölüm 4.4).
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj Atıklarının Kontrolü Yönetmelikâlerine uygun olarak imha edilmelidir.
 Asperger Sendromu
Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde,
gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır.
Asperger Sendromu
Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde,
gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |
 Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir.
Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| POMALEM | 8699525159731 | 80,770.45TL |
| Diğer Eşdeğer İlaçlar |
 |
Şizofrenlik Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler hakkında bilgi verecektir. |
 |
Yüksek Tansiyon Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon atardamarlarınızdaki kanın basıncıdır. |
 |
Ruh ve Akıl Sağlığımızı Geliştirmek İyi akıl ve ruh sağlığı sahip olmaktan ziyade, yaptığınız şeylerdir. Akıl ve ruhsal olarak sağlıklı olmak için kendinize değer vermeli ve kendinizi kabul etmelisiniz. |
İLAÇ GENEL BİLGİLERİ
Deva Holding A.Ş.
| Satış Fiyatı | 82875.52 TL [ 26 Apr 2024 ] |
| Önceki Satış Fiyatı | 82875.52 TL [ 22 Apr 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699525159755 |
| Etkin Madde | Pomalidomid |
| ATC Kodu | L04AX06 |
| Birim Miktar | 3 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 21 |
| Antineoplastik ve İmmünomodülatör Ajanlar > İmmünsupresif Ajanlar |
| Yerli ve Beşeri bir ilaçdır. |