NEXPLANON 68 mg implant Klinik Özellikler
{ Etonogestrel }
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Kontrasepsiyon
Güvenliliği ve etkililiği 18-40 yaş arası kadınlarda belirlenmiştir.
4.2. Pozoloji ve uygulama şekli
Pozoloji/uygulama sıklığı ve süresiNEXPLANON yerleştirilmeden önce gebelik olasılığı dışlanmalıdır.
Uygulama yerinde 3 yıl kalabilen 1 implant.
NEXPLANON'un sadece aplikatör kullanımı ve implantın yerleştirme-çıkarma eğitimini tamamlamış olan doktorlar tarafından yerleştirilmesi ve çıkarılması önemle tavsiye edilir. Uygun olduğu durumlarda, implantın yerleştirme ve çıkarma teknikleri için eğitim alan doktorların gözetmenliği talep edilebilir.
İmplant yerleştirilmeden önce, âNEXPLANON nasıl yerleştirilir' ve âNEXPLANON nasıl çıkarılır' bölümlerindeki (bkz. Bölüm 4.2) yerleştirme ve çıkarma talimatlarını dikkatlice okuyunuz ve uygulayınız.
Eğer NEXPLANON'un güvenli bir şekilde yerleştirilmesi ve/veya çıkarılması için gerekli adımlardan emin değilseniz, lütfen prosedürü denemeyiniz.
NEXPLANON nasıl kullanılır:
NEXPLANON uzun etkili bir hormonal kontraseptiftir. Deri altına tek bir implant yerleştirilir
ve üç yıl boyunca orada bırakılabilir. Yerleştirildiği tarihten sonra, en fazla üç yıl içinde
implantı çıkarınız. Kullanıcı, herhangi bir zamanda NEXPLANON çıkarmak isteyebileceği ve implantın üç yıldan daha uzun süre kullanılamayacağı konusunda bilgilendirilmelidir. Sağlık çalışanları kilolu kadınlarda implantı daha erken değiştirmeyi düşünebilir (bkz. Bölüm 4.4). İmplant çıkarıldıktan hemen sonra yeni bir implantın yerleştirilmesi kontrasepsiyonu sürdürecektir. Eğer kadın NEXPLANON kullanımına devam etmek istemez fakat gebelikten korunmaya devam etmek isterse, başka bir kontraseptif yöntem önerilmelidir.
NEXPLANON implantının başarılı bir şekilde kullanılabilmesi ve daha sonra da çıkarılabilmesi için, implant deri altına, talimatlara uygun şekilde, dikkatlice ve doğru olarak yerleştirilmelidir.
Eğer implant talimatlara uygun şekilde ve doğru zamanda yerleştirilmezse, bu durum istenmeyen gebelikle sonuçlanabilir (bkz. Bölüm 4.2 NEXPLANON nasıl yerleştirilir ve NEXPLANON ne zaman yerleştirilir).
Deri altından daha derine yerleştirilen (derin yerleştirme) implant, elle hissedilemeyebilir ve yerinin tespit edilmesi ve/veya çıkarılması zor olabilir (bkz. Bölüm 4.2 NEXPLANON nasıl çıkarılır ve bkz. Bölüm 4.4)
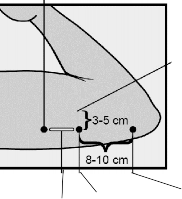
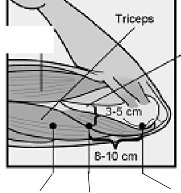
NEXPLANON implantı, genellikle kullanılmayan kolun üst bölümünün iç tarafına subdermal olarak DERİNİN HEMEN ALTINA yerleştirilmelidir. Yerleştirme yeri humerus medial epikondilinin yaklaşık 8-10 cm (3-4 inç) yukarısında triseps kasının üzerine gelecek şekilde ve biseps ve triseps kaslarının arasındaki oluğun (sulkus) 3-5 cm (1,25-2 inç) posteriorundadır (aşağıda). Bu bölge, sulkus içinde ve çevresinde yer alan büyük kan damarları ve sinirlerden kaçınmayı amaçlamaktadır (bkz. Şekil 2a, 2b ve 2c) .
Yerleştirilme tamamlandıktan hemen sonra, implantın varlığı palpasyonla doğrulanmalıdır. İmplantın palpe edilemediği durumlarda ya da implantın varlığından kuşku duyulduğu zaman, (bkz. bölüm 4.2 NEXPLANON nasıl yerleştirilir başlığı altında yer alan âEğer implant yerleştirmeden sonra palpasyonla hissedilmezseâ).
NEXPLANON'un ambalajında kadının, implantın seri numarasını yazacağı bir Kullanıcı Kartı vardır. Sağlık çalışanlarından da Kullanıcı Kartı'na implantın yerleştirilme tarihini, hangi kola yerleştirildiğini ve çıkarılması amaçlanan tarihi kaydetmeleri istenmektedir. Ambalajda ayrıca sağlık çalışanlarının seri numarasını kaydetmeleri için yapışkanlı etiketler de vardır.
NEXPLANON ne zaman yerleştirilir:
ÖNEMLİ: İmplant yerleştirilmeden önce gebelik olasılığını dışlayınız.
Yerleştirilme işleminin ne zaman yapılacağı, aşağıda belirtildiği üzere kadının yakın zamandaki kontrasepsiyon hikayesine bağlıdır:
Öncesinde hormonal kontrasepsiyon kullanılmamışsa
İmplant, kadının kanaması devam ediyor olsa bile menstrüal siklusun 1. günü (menstrüasyon kanamasının ilk günü) ve 5. günü arasında yerleştirilmelidir.
Eğer yerleştirme önerildiği şekilde yapılırsa, ilave kontrasepsiyon gerekli değildir. Eğer yerleştirme için önerilen zamandan sapılırsa, kadına yerleştirme sonrası 7 güne kadar bir bariyer yöntem kullanılması tavsiye edilmelidir. Eğer halihazırda ilişkiye girilmişse, gebelik olasılığı dışlanmalıdır.
Hormonal kontraseptif yöntemden NEXPLANON'a geçiş
Kombine hormonal kontraseptif yönteminden geçiş yapılırsa (kombine oral kontraseptif
(kombine OK), vajinal halka ya da transdermal flaster)
İmplant tercihen, önceki kombine OK tedavisinin son etkin tablet (etkin madde içeren son tablet) kullanım gününden sonraki gün, fakat en geç olarak tabletsiz dönem veya önceki kombine oral kontraseptifin en son plasebo tabletini takiben yerleştirilmelidir. Vajinal halka ya da transdermal flaster kullanıldığı durumlarda, tercihen flasterin çıkarıldığı gün içinde olmak üzere, en geç sonraki uygulama gününe kadar istenilen zamanda implant yerleştirilmelidir.
Eğer yerleştirme önerildiği şekilde yapılırsa, ilave kontrasepsiyon gerekli değildir. Eğer yerleştirme için önerilen zamandan sapılırsa, kadına yerleştirme sonrası 7 güne kadar bir bariyer yöntem kullanılması tavsiye edilmelidir. Eğer halihazırda ilişkiye girilmişse, gebelik olasılığı dışlanmalıdır.
Yalnızca-progestagen yönteminden geçiş yapılırsa (örn: yalnızca-progestagen içeren doğum kontrol hapı, enjekte edilebilen kontraseptif, implant ya da rahim içi sistem (RİS)
Yalnızca-progestagen yöntemlerinin birçok çeşidi olduğundan, implant aşağıdaki şekilde yerleştirilmelidir.
Enjekte edilebilen kontraseptifler: Planlanmış bulunan bir sonraki enjeksiyon gününde,
enjeksiyon yerine implant yerleştirilmelidir.
Yalnızca-progestagen içeren doğum kontrol hapı: Kadın ayın herhangi bir gününde yalnızca- progestagen içeren doğum kontrol hapından NEXPLANON kullanımına geçiş yapabilir. İmplant, son tablet alımından sonraki 24 saat içinde yerleştirilmelidir.
İmplant/ Rahim içi sistem (RİS): Önceki implantın veya RİS'in çıkarıldığı aynı gün implant yerleştirilebilir.
Eğer yerleştirme önerildiği şekilde yapılırsa, ilave kontrasepsiyon gerekli değildir. Eğer yerleştirme için önerilen zamandan sapılırsa, kadına yerleştirme sonrası 7 güne kadar bir bariyer yöntem kullanılması tavsiye edilmelidir. Eğer halihazırda ilişkiye girilmişse, gebelik olasılığı dışlanmalıdır.
Düşük veya kürtaj sonrasında
İlk trimester: İlk trimesterdeki düşük ve kürtaj sonrası 5 gün içinde implant yerleştirilmelidir.
İkinci trimester: İkinci trimesterdeki düşük ve kürtaj sonrası implant 21 ila 28. günler arasında yerleştirilmelidir.
Eğer yerleştirme önerildiği şekilde yapılırsa, ilave kontrasepsiyon gerekli değildir. Eğer yerleştirme için önerilen zamandan sapılırsa, kadına yerleştirme sonrası 7 güne kadar bir bariyer yöntem kullanılması tavsiye edilmelidir. Eğer halihazırda ilişkiye girilmişse, gebelik olasılığı dışlanmalıdır.
Doğum sonrasında
Emzirme durumunda: İmplant doğum sonrası dördüncü haftadan sonra yerleştirilmelidir (bkz. Bölüm 4.6). Kadınlara yerleştirme sonrası 7 güne kadar bir bariyer yöntem kullanılması önerilmelidir. Eğer halihazırda ilişkiye girilmişse, gebelik olasılığı dışlanmalıdır.
Emzirmeme durumunda: İmplant doğum sonrası 21 ila 28. günler arasında yerleştirilmelidir. Eğer yerleştirme önerildiği şekilde yapılırsa, ilave kontrasepsiyon gerekli değildir. Eğer implant doğum sonrası 28 günden sonra yerleştirilirse, kadına yerleştirme sonrası 7 güne
kadar bir bariyer yöntem kullanılması tavsiye edilmelidir. Eğer halihazırda ilişkiye girilmişse, gebelik olasılığı dışlanmalıdır.
Uygulama şekli
NEXPLANON nasıl yerleştirilir:
NEXPLANON implantının başarılı bir şekilde kullanılabilmesi ve daha sonra da çıkarılabilmesi için, talimatlara göre dikkatlice ve doğru olarak subdermal yerleştirilmesi gerekir. Yerleştirilme sonrası gerek sağlık çalışanları gerekse kadın implantı palpasyonla, yerleştirildiği yerde hissedebilmelidir.
İmplant genellikle kullanılmayan kolun üst bölümünün iç tarafına derinin hemen altına subdermal olarak yerleştirilmelidir.
Deri altından daha derine yerleştirilen (derin yerleştirme) implant, elle hissedilemeyebilir ve yerinin tespit edilmesi ve/veya çıkarılması zor olabilir (bkz. bölüm 4.2 ve bölüm 4.4) İmplant çok derine yerleştirilirse, sinirler veya damarlar zarar görebilir. İmplant derine veya hatalı olarak yerleştirilirse, parestezi (sinir hasarına bağlı) veya yerleştirildiği yerden uzaklaşma (kas içerisine veya fasyaya yerleştirilmesine bağlı) ve seyrek olarak damar içerisine yerleştirilme görülebilir. NEXPLANON'un yerleştirilmesi, aseptik koşullar altında ve yalnızca, prosedürü bilen bir doktor tarafından gerçekleştirilmelidir. İmplantın yerleştirilmesi yalnızca, implantın önceden yüklenmiş olduğu aplikatör ile gerçekleşmelidir.
Yerleştirme Prosedürü
İmplantın derinin hemen altına yerleştirildiğinden emin olmak için, sağlık çalışanı aplikatörü kolun üzerinden değil, yandan gözlemleyerek iğnenin ilerlemesini görecek şekilde konumlanmalıdır. Yandan bakıldığında, yerleştirilme yeri ve iğnenin derinin hemen altındaki hareketi açık şekilde görülebilmelidir.
Açıklama amacıyla, şekiller sol iç kolu göstermektedir.
Kadının, genellikle kullanmadığı kolu dirsekten bükülmüş ve dışa doğru dönmüş durumda muayene masasına yatırılmalı ve eli başının altında (veya mümkün olduğunca yakın) durmalıdır (Şekil 1).

Şekil 1
Yerleştirme yeri, genellikle kullanılmayan kolun üst bölümünün iç tarafı olarak belirlenir. Yerleştirme yeri, humerus medial epikondilinden yaklaşık 8-10 cm (3-4 inç) yukarısında ve biseps ve triseps kaslarının arasındaki oluğun (sulkus) 3-5 cm (1,25-2 inç) posteriorunda (aşağıda) olmalıdır (bkz. Şekil 2a, 2b ve 2c). Bu bölge, sulkusun içinde ve çevresinde bulunan büyük kan damarları ve sinirlerden kaçınmayı amaçlamaktadır. İmplantın bu bölgeye yerleştirilmesi mümkün değilse (örneğin ince kollu kadınlar), sulkustan mümkün olduğunca uzağa yerleştirilmelidir.
Cerrahi bir işaret kalemiyle birincisi implantın yerleştirileceği yere, ikincisi bunun 5 santimetre (2 inç) proksimaline (omuza doğru) olmak üzere iki işaret koyulmalıdır (Şekil 2a ve 2b). İkinci işaret (kılavuz işaret) daha sonra, yerleştirilme işlemi sırasında yön gösteren bir kılavuz olarak kullanılacaktır.
Kılavuz işaret
Sulkus Sulkus
P D P D
Yerleştirmeden sonra implantın yeri
Yerleştirme
yeri
Medial
epikondil
Kılavuz işaret
Yerleştirme
yeri
Medial
epikondil
Şekil 2a Şekil 2b
P: proksimal (omuza doğru) D: distal (dirseğe doğru)
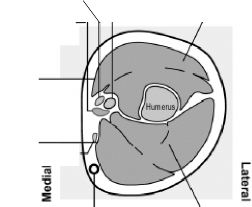
Median siniri
Basilik damarı
Kol
atardamarı
Biseps kası
Sulkus
alanı
Yerleştirmeden sonra implant
Şekil 2c
Triseps kası
Dirsekten bakıldığı şekliyle, sol üst kolun kesiti Medial (kolun iç tarafı)
Lateral (kolun dış tarafı)
Kol işaretlendikten sonra, yerleştirme yerinin kolun iç kısmında doğru bölgede olduğu teyit edilir.
Deri, yerleştirme yerinden kılavuz işaretine kadar antiseptik bir solüsyon ile temizlenmelidir.
Yerleştirme yerine anestezi uygulanmalıdır. (örneğin; hemen deri altına, planlanan yerleştirme kanalı boyunca % 1'lik 2 mL lidokain enjekte edilerek veya anestezik spreyle).
Steril tek kullanımlık NEXPLANON aplikatör içeren implant blisterinden çıkarılmalıdır. Eğer sterilitesinden şüphe edilirse, aplikatör kullanılmamalıdır.

Mor renkli sürgü (Henüz dokunmayınız)
Aplikatörü, iğnenin hemen yukarısında olan, yüzey bölgesinden tutunuz. Ok yönünde gösterildiği üzere horizontal olarak kaydırarak iğnenin üzerindeki koruyucu saydam kapağı çıkarınız (Şekil 3). Eğer kapak aplikatörden kolayca ayrılmıyorsa, aplikatör kullanılmamalıdır. İğnenin ucundan içeriye bakıldığında, beyaz renkli implantı görmelisiniz. İğne geri çekilip implantın aplikatörden zamanından önce serbest kalmasını sağlayacağından, iğneyi deri altına tümüyle sokuncaya kadar mor renkli sürgüye dokunmayınız.
Şekil 3
Mor renkli sürgü zamanından önce serbest bırakılırsa, yeni bir aplikatör ile prosedür yeniden başlatılır.
Kılavuz işaret
Yerleştirme yeri
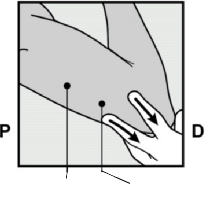
Yerleştirme yeri çevresindeki deri, boşta olan elle dirseğe doğru gerilir (Şekil 4).
Şekil 4
İmplant subdermal olarak derinin hemen altına yerleştirilmelidir (bkz Bölüm 4.4). İmplantın derinin hemen altına yerleştirildiğinden emin olmak için, kendinizi
aplikatörü kolun üzerinden değil, yandan gözlemleyerek iğnenin ilerlemesini görecek şekilde konumlandırmalısınız. Yandan bakıldığında, yerleştirme yerini ve iğnenin derinin hemen altındaki hareketini açık şekilde görebilirsiniz (bkz Şekil 6).
İğne, ucu deriyle 30°'den biraz az açı yapacak şekilde deriye batırılır. (Şekil 5a).
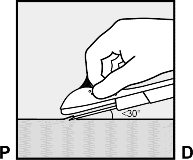
Şekil 5a
İğneyi, konik uç (ucun eğimli ağzı) derinin hemen altında olacak şekilde (daha fazla değil) yerleştiriniz (Şekil 5b). Eğer iğneyi, konik uçtan daha derine sokarsanız, sadece konik uç deri altında kalana kadar iğneyi geri çekiniz.
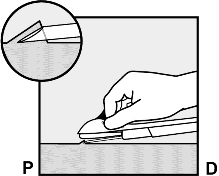
Şekil 5b
Aplikatör aşağıya doğru indirilip neredeyse yatay konuma getirilir. Deri altına yerleştirmeyi kolaylaştırmak için, iğne tüm uzunluğu boyunca ileriye doğru kaydırılırken, deri iğne ile kaldırılır (Şekil 6). Hafif bir direnç hissedilebilir ama aşırı güç kullanılmamalıdır. İğne deri altına tamamen girmezse, implant gereken şekilde yerleştirilemeyecektir.
İğnenin yerleşimi tamamlanmadan önce iğne ucu deriden çıkarsa, iğne geri çekilmeli ve yerleştirme işlemini tamamlamak için deri altı pozisyonuna yeniden ayarlanmalıdır.
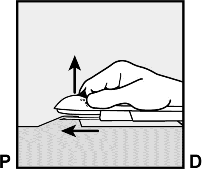
Şekil 6
Tam olarak yerleşen iğne ile aplikatörü aynı pozisyonda tutunuz (Şekil 7). Eğer gerekirse, aplikatörü sabit tutmak için serbest olan elinizi kullanabilirsiniz.
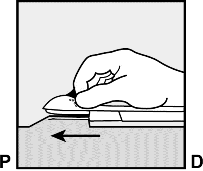
Şekil 7
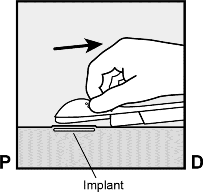
Mor renkli sürgünün kilidini, hafifçe aşağıya doğru bastırarak açınız (Şekil 8a). Duruncaya kadar sürgünün tamamını arkaya doğru çekiniz.
Mor renkli sürgüyü hareket ettirirken, aplikatörü hareket ettirmeyiniz (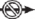 ) (Şekil 8b). İmplant şimdi deri altındaki en son pozisyonundadır ve iğne aplikatörün gövdesi içerisinde kilitlidir. Aplikatör şimdi çıkarılabilir (Şekil 8c).
) (Şekil 8b). İmplant şimdi deri altındaki en son pozisyonundadır ve iğne aplikatörün gövdesi içerisinde kilitlidir. Aplikatör şimdi çıkarılabilir (Şekil 8c).
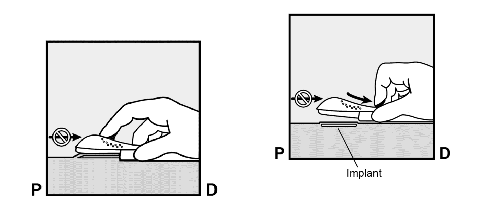
Şekil 8a Şekil 8b
Şekil 8c
Eğer aplikatör bu işlem boyunca aynı pozisyonda kalmazsa veya mor renkli sürgü arkaya doğru tamamen çekilmezse, implant gereken şekilde yerleşmeyecek ve yerleşim yerinden çıkacaktır.
Eğer implant, yerleşim yerinden çıkıyorsa, implantı çıkarınız ve yeni bir aplikatör kullanarak aynı yerleşim yerinde yeni bir işlem gerçekleştiriniz. Yerleşim yerinden çıkan implantı kesite doğru geri itmeyiniz.
4.3. Kontrendikasyonlar
Yalnızca progestagen içeren kontraseptifler aşağıdaki koşulların herhangi birinin varlığında kullanılmamalıdır. NEXPLANON kullanımı sırasında bu durumlardan herhangi biri ortaya çıkarsa, ürünün kullanımı hemen durdurulmalıdır.
NEXPLANON içindeki etkin maddeye ya da yardımcı maddelerden herhangi birine karşı aşırı duyarlılık.
Bilinen veya şüphelenilen gebelik.
Aktif venöz tromboembolik bozukluk.
Bilinen veya şüphe edilen, cinsel steroidlere duyarlı kötü huylu hastalıklar (maligniteler).
Karaciğer tümörlerinin varlığı veya öyküsü (benign veya malign)
Uzun süre karaciğer fonksiyon değerlerinin normale dönmediği ciddi karaciğer hastalığı ya
da öyküsü.
Tanı konmamış vajinal kanama.
4.4. Özel kullanım uyarıları ve önlemleri
Aşağıdaki durum / risklerden herhangi biri ortaya çıktığında, her kadın için progestagen kullanımının yararları ile olası riskleri değerlendirilmeli ve NEXPLANON kullanımına başlamadan önce kadın ile konuşulmalıdır. Bu durumlardan herhangi birinin artması, şiddetlenmesi ya da ilk kez ortaya çıkması halinde kadın, sağlık çalışanına başvurmalıdır. Daha sonra sağlık çalışanı NEXPLANON kullanımına devam edilip edilmeyeceğine karar vermelidir.
Meme karsinomu
Meme kanseri riski genel olarak yaş ile artmaktadır. (Kombine) Oral kontraseptiflerin (OK) kullanımı sırasında meme kanseri tanısı riski hafif düzeyde artmaktadır. Bu risk artışı OK kullanımının kesilmesinden sonraki 10 yıl içinde yavaşça ortadan kalkar ve kullanım süresi ile ilişkili değildir, fakat OK kullanılan yaş ile ilişkilidir. Kombine OK kullanan 10.000 kadında tanı konulması beklenen olgu sayısı (kesildikten sonra 10 yıla dek), aynı yaşlarda hiç kullanmamış yaş gruplarına göre hesaplanmıştır: 4,5/4 (16-19 yaş), 17,5/16 (20-24 yaş), 48,7/44 (25-29 yaş), 110/100 (30-34 yaş), 180/160 (35-39 yaş) ve 260/230 (40-44 yaş).
Yalnızca progestagen içeren kontraseptif yöntem kullanıcılarının riski, muhtemelen kombine OK kullananların riski ile benzer büyüklüktedir. Bununla birlikte, bu yöntemler için elde edilen kanıtlar ile sağlıklı bir sonuca varılmamıştır. Tüm yaşam boyu meme kanseri riski ile karşılaştırıldığında, OK ile ilişkili olan risk artışı düşüktür. OK kullanıcıları arasında meme kanseri tanısı konulmuş olguların, OK kullanmamış olgulara kıyasla daha az ilerlemiş olgular olması eğilimi söz konusudur. OK kullanıcılarında gözlenen risk artışının daha erken tanı ve OK biyolojik etkilerinden ya da her ikisinden kaynaklanması olasıdır.
Karaciğer bozukluğu
Akut veya kronik karaciğer fonksiyonu bozuklukları meydana geldiğinde, kadın muayene olmak ve danışmak için doktoruna başvurmalıdır.
Trombotik ve diğer vasküler olaylar
Epidemiyolojik araştırmalar kombine OK (östrojen + progestagen) kullanımı ile venöz tromboembolizm (VTE, derin ven trombozu ve pulmoner emboli) ve arteriyel tromboembolizm (ATE, miyokard infarktüsü ve iskemik inmeler) insidansı artışını ilişkilendirmiştir. Östrojenik bileşen yokluğunda sadece progestagen içeren kontraseptif olarak kullanılan etonogestrel (desogestrel'in biyolojik olarak aktif metaboliti) için bu bulguların klinik önemi bilinmemektedir.
Sınırlı epidemiyolojik veri, implant kullanan kadınlarda artmış VTE veya ATE riskini düşündürmemektedir, ancak etonogestrel implantı kullanan kadınlarda pazarlaması sonrası VTE ve ATE rapor edilmiştir. VTE ve ATE riskini artırdığı bilinen risk faktörlerinin değerlendirilmesi önerilir.
Tromboembolik bozukluk geçmişi olan kadınların nüksetme olasılığı konusunda uyarılmaları gereklidir. Tromboz durumunda implant çıkarılmalıdır. Ameliyat veya hastalık nedeniyle uzun süreli hareketsizlik durumunda implantın çıkarılması düşünülmelidir.
Kan basıncında artış
NEXPLANON kullanımı sırasında sürekli hipertansiyon ortaya çıktığında ya da kan basıncında anlamlı bir artış antihipertansif tedaviye yeterli yanıt vermediğinde, NEXPLANON çıkarılmalıdır.
Karbonhidrat metabolik etkisi
Sadece progestagen içeren kontraseptiflerin kullanımının periferik insülin direnci ve glukoz toleransı üzerinde etkisi olabilir. Bu nedenle, diyabet hastası kadınlar NEXPLANON kullanımının ilk aylarında yakından izlenmelidirler.
Kloazma
Özellikle kloazma gravidarum öyküsü olan kadınlarda, seyrek olarak kloazma ortaya çıkabilir. Kloazmaya yatkınlığı olan kadınlar, NEXPLANON kullanırken güneş ya da UV ışınlarına maruz kalmaktan kaçınmalıdır.
Vücut ağırlığı
NEXPLANON'un kontraseptif etkisi, etonogestrelin plazma düzeyleri ile ilişkilidir. Plazma düzeyleri vücut ağırlığı ile ters orantılıdır ve yerleştirildikten sonra zaman geçtikçe azalır. Kilolu kadınlarda klinik deneyim 3 yıl kullanım ile sınırlıdır. Bu nedenle bu kadınlarda üçüncü yıldaki kontraseptif etkinin normal ağırlıktaki kadınlardakinden daha düşük olabileceği düşünülmelidir. Doktorlar kilolu kadınlarda implantın daha erken değiştirilmesini düşünebilirler.
İmplantın yerleştirilmesiyle ilgili komplikasyonlar
Derin ilk yerleştirmeye (aynı zamanda bkz. 4.2. âNEXPLANON nasıl yerleştirilir') ve/veya dış etkilere (örn: implantın manipule edilmesi ya da temas içeren sporlar) bağlı olarak implantın yerleştirme alanından başka bir yere hareket ettiğine dair raporlar vardır. Ayrıca, nadir olarak pazarlama sonrası raporlarda implantın derine yerleştirilmesine veya intravasküler yerleştirilmesine bağlı olarak implant koldaki kan damarlarında veya pulmoner arterde bulunmuştur. İmplantın orijinal yerleştirme alanından hareket etmiş olduğu bu durumlarda implantın lokalizasyonu çok zor olabilir ve çıkarma işlemi için daha geniş bir insizyon ve cerrahi operasyon gerekebilir (aynı zamanda bkz. 4.2. âNEXPLANON nasıl çıkarılır'). Eğer implant palpe edilemezse, medikal açıdan uygun olur olmaz yerinin tespit edimesi ve çıkarılması önerilmektedir. Eğer implant çıkarılmazsa, kontrasepsiyon ve progestagenle ilgili istenmeyen etkilerin riski, kadının istediği zaman aralığından daha uzun süreli etkili olabilirler.
Özellikle âNEXPLANON nasıl yerleştirilir' (bkz. 4.2) bölümündeki talimatlara göre yerleştirilmediğinde ya da lokal inflamasyon durumlarında, implant yerinden çıkabilir.
Over kistleri
Tüm düşük doz hormonal kontraseptiflerle, foliküler gelişim görülebilir ve seyrek olarak folikül normal döngüdeki boyuta kadar büyümeye devam edebilir. Genel olarak büyüyen foliküller kendiliğinden ortadan kalkar. Sıklıkla asemptomatiktirler; bazı olgularda hafif karın ağrısına neden olabilirler. Nadiren cerrahi girişim gerektirirler.
Ektopik gebelik
Yalnız progestagen içeren geleneksel kontraseptiflerin ektopik gebeliği önlemedeki etkileri, bu yöntemlerin kullanımı süresince ovülasyonların sıklığı ile ilişkili olduğundan, kombine OK tedavisi kadar iyi değildir. NEXPLANON'nun ovulasyonu baskılamasına rağmen, amenore ya da karın ağrısı olan kadınlarda ayırıcı tanıda ektopik gebelik de dikkate alınmalıdır.
Psikiyatrik bozukluklar
Depresif duygudurum ve depresyon, hormonal kontraseptif kullanımının iyi bilinen istenmeyen etkileridir (bkz. Bölüm 4.8). Depresyon ciddi olabilir ve intihar eğilimi ve intihar için bilinen bir risk faktörüdür. Kadınların, tedaviye başladıktan kısa bir süre sonra da dahil olmak üzere, duygudurum değişiklikleri ve depresif belirtiler durumunda doktorlarıyla iletişime geçmeleri tavsiye edilmelidir.
Diğer durumlar
Aşağıdaki durumlar gebelik ve cinsiyet steroidleri kullanımında bildirilmiştir, fakat progestagen kullanımıyla ilişkisi saptanamamıştır; kolestaz ile ilişkili sarılık ve/veya kaşıntı, safra kesesi taşı oluşumu; porfiri; sistemik lupus eritematozus, hemolitik üremik sendrom; Sydenham koresi, gestasyonal herpes , otoskleroza bağlı duyma kaybı ve (kalıtımsal) anjiyoödem.
Tıbbi muayene/danışmanlık
NEXPLANON ilk olarak yerleştirilmeden ya da değiştirilmeden önce tam bir tıbbi öykü alınmalıdır (tıbbi soygeçmiş) ve gebelik olmadığından emin olunmalıdır. Kontrendikasyonlar (bkz. Bölüm 4.3.) ve uyarılar (bkz. Bölüm 4.4.) kılavuzluğunda, kan basıncı ölçülmeli ve fiziki muayene yapılmalıdır. NEXPLANON yerleştirilmesinden üç ay sonra da bir muayene yapılması önerilir. Bu muayenede, kan basıncı ölçülmeli, sorular ve yakınmalar dinlenmeli ve istenmeyen etkiler sorulmalıdır. Daha sonraki periyodik muayenelerin sıklığı ve tarzı, klinik karar kılavuzluğunda kişiye göre ayarlanmalıdır. İmplant her genel sağlık kontrolü muayenesinde elle kontrol edilmelidir. Kadın, genel sağlık kontrolleri arasındaki herhangi bir zamanda implantını eliyle hissedemediği zaman hemen doktoruna haber vermesi konusunda bilgilendirilmelidir.
Kadınlara NEXPLANON kullanımının HIV enfeksiyonu (AIDS) ya da diğer cinsel yolla bulaşan hastalıklara karşı korumadığı açıklanmalıdır.
Etkililiğin azalması
NEXPLANON'un etkililiği, eşzamanlı kullanılan tıbbi ürünlerle azalabilir (bkz. 4.5.).
Menstrüel kanama düzeninde değişiklikler
NEXPLANON kullanımı sırasında, muhtemelen kadınların menstrüel kanama düzeninde önceden tahmin edilemeyen değişiklikler olabilir. Bu değişiklikler şunları içerebilir; kanama sıklıklarında değişiklikler (kanama olmaması, daha az sıklıkta olması, çok sık veya devamlı olması) ve kanama yoğunluğunda (azalması veya artması) veya süresinde değişiklikler. 5 kadından 1'inde amonere bildirilirken, yine 5 kadından 1'inde sık ve/veya uzun süreli kanama bildirilmiştir. İlk üç aydaki kanama profili birçok kadında, daha sonraki kanama profillerinin yaklaşık olarak tahmin edilmesini sağlar. Bilgi, danışmanlık ve kanama günlüğü kullanımı gibi destekler, kadının kanama düzenini kabul etmesini kolaylaştırabilir. Vajinal kanama değerlendirmesi, kişiye özel olarak yapılmalıdır ve jinekolojik patoloji ya da gebeliği dışlamak için muayeneyi içerebilir.
İn situ kırılan veya bükülen implantlar
Dış etkiler nedeniyle hastanın kolundayken kırılan veya bükülen implantlar rapor edilmiştir. Kırılan implant parçasının kolun içinde hareket etmesi ayrıca rapor edilmiştir. İn vitro verilere göre, implant kırıldığında ya da büküldüğünde, etonogestrelin salım hızı çok az artabilir. Bu değişikliğin klinik olarak anlamlı etkileri olması beklenmez.
Ancak, implant kırıldığında çıkarılmalıdır ve tamamen çıkarılmış olması önemlidir. Bkz. implant çıkarma prosedürleri için Bölüm 4.2 (palpasyonla hissedilebilen veya hissedilemeyen).
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Not: Olası etkileşimleri belirlemek için birlikte kullanılan ilaçların ürün bilgilerine başvurulmalıdır.
Diğer tıbbi ürünlerin NEXPLANON üzerine etkisi
Mikrozomal enzimleri indükleyen ilaçlarla etkileşim seks hormonlarının yıkımında artışa ve
menstrüel kanama ve/veya kontrasepsiyonda başarısızlığa neden olabilir.
İdame edilmesi
Enzim indüksiyonu tedaviden sonraki birkaç gün içerisinde gözlemlenebilir. Maksimum enzim indüksiyonu genel olarak birkaç hafta içerisinde gözlemlenir. İlaç tedavisini bıraktıktan sonra, enzim indüksiyonu yaklaşık 4 hafta boyunca devam edebilir.
Hepatik enzim indükleyici ilaç ya da bitkisel ürünleri alan kadınlar NEXPLANON'un etkililiğinin azalabileceği konusunda uyarılmalıdır. İmplantın çıkarılması gerekmemektedir; ancak kadınların birlikte ilaç kullandıkları dönemde ve tedavinin bırakılmasını takiben 28 gün boyunca maksimum korumayı elde etmek için ek hormonal olmayan kontraseptif yöntemi kullanmaları önerilmektedir.
Literatürde aşağıdaki etkileşimler bildirilmiştir (esas olarak kombine kontraseptiflerle ancak bazen NEXPLANON dahil sadece progestajen içeren kontraseptiflerle):
Hormonal kontraseptiflerin yıkımını artıran maddeler (enzim indüksiyonu ile hormonal kontraseptiflerin etkililiği azalır), örneğin:
Barbitüratlar, bosentan, karbamazepin, fenitoin, primidon, rifampin ve HIV/HCV tedavisinde kullanılan ritonavir, efavirenz, boseprevir, nevirapin ve muhtemelen felbamat, griseofulvin, okskarbazepin, topiramat ve St. John's Wort (Hypericum perforatum) gibi bitkisel ürünler.
Hormonal kontraseptiflerin yıkımında çeşitli etkileri olan maddeler
Hormonal kontraseptiflerle birlikte kullanıldığında HIV proteaz inhibitörlerinin ve nükleozid olmayan ters transkriptaz inhibitörlerinin birçok kombinasyonu ve HCV inhibitörleri ile de kombinasyonları, etonogestrel dahil progestinlerin plazma konsantrasyonlarını artırabilir ya da azaltabilir. Bu değişikliklerin net etkileri bazı vakalarda klinik olarak anlamlı olabilir.
Bundan dolayı, potansiyel etkileşimleri belirlemek ve ilgili tavsiyeler yönünden birlikte kullanılan HIV/HCV ilaçlarının ürün bilgilerine bakılmalıdır. Herhangi bir şüphe durumunda, proteaz inhibitörü ya da nükleozid olmayan ters transkriptaz inhibitör tedavisi alan kadınlar
ek bir bariyer kontraseptif yöntemi kullanılmalıdır.
Hormonal kontraseptiflerin yıkımını azaltan maddeler (enzim inhibitörleri)
CYP3A4 mikrozomal enzimlerini kuvvetli inhibe eden ilaçlar (örn; ketokonazol, itrakonazol, klaritromisin) veya orta derecede inhibe eden ilaçlar (flukonazol, diltiazem, eritromisin), etonogestrel dahil, progestinlerin serum konsantrasyonlarını artırabilir.
NEXPLANON'un diğer tıbbi ürünler üzerine etkisi
Hormonal kontraseptifler diğer ilaçların metabolizmaları ile etkileşebilir. Dolayısıyla, plazma ve doku konsantrasyonlarını artırabilir (örn; siklosporin) veya azaltabilir (örn; lamotrijin).
Özel popülasyonlara ilişkin ek bilgiler:
Özel popülasyonlar ile yapılmış herhangi bir etkileşim çalışması yoktur.
Pediyatrik popülasyon:
Pediyatrik popülasyon ile yapılmış herhangi bir etkileşim çalışması yoktur.
Laboratuvar testleri:
Kombine OK ile elde edilen veriler, kontraseptif steroidlerin, karaciğer, tiroid, adrenal bez ve renal işlevlerle ilgili biyokimyasal testler, taşıyıcı proteinlerin serum düzeyleri örn; kortikosteroid bağlayan protein ve lipid/ lipoprotein fraksiyonları, karbonhidrat metabolizması parametreleri ve pıhtılaşma ve fibrinoliz parametreleri gibi belli laboratuvar testlerinin sonuçlarını etkileyebileceğini göstermiştir. Değişiklikler genellikle normal sınırlar içinde kalmaktadır. Yalnızca progestagen içeren kontraseptiflerin etki derecesi bilinmemektedir.
4.6. Gebelik ve laktasyon
Gebelik kategorisi: X
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Bu tıbbi ürünün endikasyonu kontrasepsiyon olduğu için bu başlık geçerli değildir.
Gebelik dönemi
NEXPLANON gebelik döneminde uygulandığı taktirde ciddi doğum kusurlarına yol açmaktadır/yol açtığından şüphelenilmektedir.
NEXPLANON gebelik sırasında kontrendikedir. NEXPLANON kullanımı sırasında gebelik ortaya çıkarsa, NEXPLANON çıkarılmalıdır. Hayvan çalışmaları çok yüksek doz progestagenik maddelerin dişi fötuslarda maskülinizasyona yol açabildiğini göstermiştir. Yaygın epidemiyolojik çalışmalarda, gebelik öncesinde OK kullanan kadınların çocuklarında doğum defekti artışı ya da gebelik sırasında istenmeden kullanıldığında teratojenik etki saptanmamıştır. Olasılıkla bütün OK'ler ile ilgili olmasına karşın, bu durumun NEXPLANON için de geçerli olup olmadığı belli değildir.
Etonogestrel- ve desogestrel- içeren çeşitli ürünler (etonogestrel, desogestrelin bir metabolitidir) ile ilişkili farmakovijilans verileri risk artışı göstermemiştir.
Laktasyon dönemi
Klinik veriler, NEXPLANON anne sütünün üretimini ve niteliğini (protein, laktoz ya da yağ konsantrasyonu) etkilemediğini bildirir. Bununla birlikte, etonogestrel anne sütüne az miktarda geçer. Günlük ortalama 150 mL/kg süt tüketimi temelinde, etonogestrel salımından bir ay sonra bebekte saptanan etonogestrel dozu günlük ortalama yaklaşık 27 nanogram/kg/gün olmuştur. Yaklaşık olarak bu, vücut ağırlığına göre düzeltilmiş maternal günlük dozun yaklaşık %2,2'sine ve hesaplanan mutlak maternal günlük dozun yaklaşık %0,2'sine eşittir. Sütteki etonogestrel konsantrasyonu laktasyon periyodu sırasında zaman geçtikçe azalır.
Doğumdan sonraki 4-8 haftalık dönemde implant kullanmaya başlamış annelerin 38 çocuğuna ilişkin uzun dönemli veri mevcuttur. 38 çocuk ortalama 14 ay boyunca anne sütü almışlar ve
36 aylık olana dek izlenmişlerdir. Büyüme değerlendirmeleri, fiziksel ve psikomotor gelişimleri, anneleri RİA kullanan bebeklere (n=33) kıyasla fark göstermemiştir. Bununla birlikte çocuğun gelişimi ve büyümesi dikkatle izlenmelidir. Var olan veriler temelinde, NEXPLANON laktasyon sırasında kullanılabilir ve doğumdan 4 hafta sonra yerleştirilebilir.
Üreme yeteneği/Fertilite
Etonogestrelin kontraseptif etkililiği geri dönüşlüdür, implant çıkarıldıktan sonra normal menstrüel döngü hızla geri döner.
4.7. Araç ve makine kullanımı üzerindeki etkiler
Farmakodinamik profiline göre, NEXPLANON'un araç ve makine kullanımı üzerine etkisi yoktur veya etkisi ihmal edilebilir.
4.8. İstenmeyen etkiler
NEXPLANON kullanımı sırasında, kadınların menstrüel kanama düzeninde önceden tahmin edilemeyen değişiklikler olması muhtemeldir. Bu değişiklikler şunları içerebilir: kanama sıklıklarında değişiklikler (kanama olmaması, daha az sıklıkta olması, çok sık veya devamlı olması), kanama yoğunluğunda değişiklikler (azalması veya artması) veya süresinde değişiklikler. 5 kadından 1'inde amenore bildirilirken, yine 5 kadından 1'inde sık ve/veya uzun süreli kanama bildirilmiştir. Ara sıra ağır kanama rapor edilmiştir. Klinik çalışmalarda kanama değişiklikleri tedavinin bırakılmasında en yaygın gerekçe olmuştur (yaklaşık %11). İlk üç aydaki kanama profili birçok kadında, daha sonraki kanama profillerinin yaklaşık olarak tahmin edilmesini sağlar.
Klinik çalışmalarda saptanan olası ilişkili istenmeyen etkiler MedDRA sistemine göre aşağıda belirtilmektedir.
Çok yaygın (≥1/10); yaygın (≥1/100 ila ≤1/10); yaygın olmayan (≥1/1.000 ila ≤1/100); seyrek (≥1/10.000 ila ≤1/1.000); çok seyrek (≤1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Enfeksiyonlar ve enfestasyonlar
Çok yaygın: Vajinal enfeksiyon
Yaygın olmayan: Farenjit, rinit, idrar yolu enfeksiyonu
Bağışıklık sistemi hastalıkları
Yaygın olmayan: Aşırı duyarlılık
Metobolizma ve beslenme hastalıkları
Yaygın: İştah artması
Psikiyatrik hastalıklar
Yaygın: Duygulanımda değişkenlik, depresif duygudurum, sinirlilik, libido azalması Yaygın olmayan: Anksiyete, insomnia
Sinir sistemi hastalıkları
Çok yaygın: Baş ağrısı
Yaygın: Baş dönmesi (sersemlik hali)
Yaygın olmayan: Migren, somnolans
Vasküler hastalıklar
Yaygın: Sıcak basması
Gastrointestinal hastalıklar
Yaygın: Karın ağrısı, bulantı, flatulans Yaygın olmayan: Kusma, kabızlık,ishal
Deri ve derialtı doku hastalıkları
Çok yaygın: Akne
Yaygın: Saç dökülmesi
Yaygın olmayan: Hipertrikoz, kaşıntı, döküntü
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları
Yaygın olmayan: Sırt ağrısı, artralji, miyalji, iskelet kas ağrısı
Böbrek ve idrar yolu hastalıkları
Yaygın olmayan: Dizüri
Üreme sistemi ve meme hastalıkları
Çok yaygın: Memede hassasiyet; memede ağrı, düzensiz mensturüasyon Yaygın: Dismenore, over kisti
Yaygın olmayan: Genital akıntı, vulvovajinal rahatsızlık, galaktore, meme büyümesi, genital
kaşıntı
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Yaygın: İmplant yerinde ağrı, implant yerinde reaksiyon, yorgunluk, grip benzeri hastalık, ağrı
Yaygın olmayan: Yüksek ateş, ödem
Araştırmalar
Çok yaygın: Vücut ağırlığında artış Yaygın: Vücut ağırlığında azalma
Pazarlama sonrası gözlemler sırasında, seyrek durumlarda klinik olarak anlamlı kan basıncı yükselmesi gözlenmiştir. Sebore de bildirilmiştir. Anafilaktik reaksiyonlar, ürtiker, anjioödem, anjioödem agrevasyonu ve/veya herediter anjioödem agrevasyonu ortaya çıkabilir.
İmplantın yerleştirilmesi veya çıkarılması prosedürü ile bağlantılı olarak aşağıdaki istenmeyen etkiler bildirilmiştir:
İmplantın yerleştirilmesi ya da çıkarılması morarma, bazı durumlarda hematom dahil, hafif lokal iritasyon, ağrı ya da kaşıntıya neden olabilir.
İmplantın yerleştirilmesi vazovagal reaksiyonlara (hipotansiyon, baş dönmesi veya senkop gibi) neden olabilir.
İmplant bölgesinde fibroz meydana gelebilir, skar ya da apse oluşabilir. Parestezi ya da parestezi benzeri olaylar oluşabilir. Göğüs duvarı da dahil olmak üzere implantın çıkması ya da yer değiştirmesi raporlanmıştır. Nadir durumlarda, implant pulmoner arteri de içerecek şekilde damarda bulunmuştur. İmplantın pulmoner arterde bulunduğu bazı durumlarda göğüste acı ve/veya solunum yolu hastalıkları (örneğin dispne, öksürük, hemoptiz) raporlanmıştır; diğerleri asemptomatik olarak raporlanmıştır (aynı zamanda bkz. Bölüm 4.4.). Talimatlara uyulmazsa (bkz. Bölüm 4.2) hatalı yerleştirme, lokalizasyonda zorlanma ve implantın çıkarılmasında zorlanma gerçekleşebilir. İmplant çıkarılırken cerrahi girişim gerekebilir.
Seyrek olarak ektopik gebelik bildirilmiştir (bkz. bölüm 4.4.).
Kombine oral (kontraseptif) kullanan kadınlarda birkaç (ciddi) istenmeyen etki bildirilmiştir. Bunlar, venöz tromboembolik hastalıklar, arteriyel tromboembolik hastalıklar, hormon-bağımlı tümörler (örn; karaciğer tümörleri, meme kanseri) ve kloasma, bölüm 4.4'de daha detaylı olarak tartışılmıştır.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; eposta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
Bir implant her zaman yenisi yerleştirilmeden önce çıkarılmalıdır. Etonogestrel ile ilişkili doz aşımı verisi bulunmamaktadır. Genel olarak kontraseptif doz aşımının ciddi zararlı etkilerini bildiren rapor bulunmamaktadır.
 HIV ve Aids
HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan
Virüsdür). Bu virüs AIDS hastalığına sebep olur.
HIV ve Aids
HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan
Virüsdür). Bu virüs AIDS hastalığına sebep olur. |
 Rahim Boyu ( Serviks ) Kanseri
Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden
sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir.
Rahim Boyu ( Serviks ) Kanseri
Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden
sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir. |
İLAÇ GENEL BİLGİLERİ
Organon Turkey İlaçları Ltd. Şti.
| Satış Fiyatı | 4064.7 TL [ 3 May 2024 ] |
| Önceki Satış Fiyatı | 4064.7 TL [ 26 Apr 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8683280337299 |
| Etkin Madde | Etonogestrel |
| ATC Kodu | G03AC08 |
| Birim Miktar | 68 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 1 |
| Ürogenital Sistem ve Cinsiyet Hormonları > Sistemik Hormonal Gebeliği Önleyici İlaçlar > Etonogestrel |
| İthal ( ref. ülke : Italya ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Rahim Boyu ( Serviks ) Kanseri Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir. |
 |
Depresyonu Anlamak Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur? |
 |
Diyabet Hastalığı Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |