IG VENA 10 gr/200 ml IV inf. için solüsyon içeren flakon Saklanması
{ Human Immunglobulin Iv }
Enfeksiyona Karşı Kullanılan (Antienfektif) İlaçlar > İmmünoglobülinler > İmmunglobulin Onko Koçsel İlaç San. Tic. A.ş | Güncelleme : 17 May 20135.IG VENA'in saklanması
AŞAĞIDAKİ BİLGİLER BU ÜRÜNÜ UYGULAYACAK SAĞLIK PERSONELİ İÇİNDİR
Ig VENA uygulanmadan önce oda ya da vücut sıcaklığına getirilmelidir.
Uygulanacak çözelti partikül ve renk değişiklikleri açısından görsel olarak kontrol edilir. Berrak olmayan ve tortu içeren çözeltiler kullanılmamalıdır.
İnsan normal immünglobulini ilk 30 dakikada 0.3 ml/kg/saat hızıyla intravenöz olarak uygulanmalıdır. Hasta tarafından iyi tolere edilirse uygulama hızı kademeli olarak maksimum saatte 4.8 ml/kga kadar artırılabilir. Sınırlı sayıda hastadan elde edilen klinik veriler, yetişkinlerdeki 4.8 ml/kg/saatlik bir infüzyon hızını iyi tolere edilebilen primer immün yetmezlik (PID) hastalarının, 7.2 ml/kg/saat infüzyon hızını tolere edebildiklerini göstermiştir.
İnfüzyonla ilişkili yan etki görülmesi durumunda infüzyon hızı azaltılmalı ya da infüzyon durdurulmalıdır
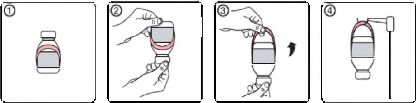
Askılı etiketin kullanımına ilişkin talimatlar
1. Flakonun askılı etiket ile başlangıç görünümü
2. Flakonu baş aşağı çevirin
3. Askıyı etiketinden çıkararak etkinleştirin
4. Flakonu infüzyon standına asmak için bu askıdan yararlanın
Özel önlemler
Bazı ciddi advers reaksiyonlar infüzyon hızı nedeniyle olabilir.
Aşağıdakiler sağlanarak potansiyel komplikasyonların genellikle önüne geçilebilir:
Ürünün yavaş olarak yapılan ilk enjeksiyonu ile hastaların normal insan immünoglobüline duyarlılığı olmaz (uygulama hızı 0,46-0,92 mL/kg/sa),
İnfüzyon süresi boyunca herhangi bir belirti için hastalar dikkatle izlenir. Özellikle, ilk
defa normal insan immünoglobulin kullanan hastalar, alternatif bir
IVIg ürününü değiştiren ya da bir önceki infüzyon üzerinden uzun zaman geçen hastalar ilk infüzyon süresince ve ilk infüzyondan sonraki ilk birkaç saat süreyle potansiyel advers belirtileri bulmak için, gözlem altında tutulmalıdır. Diğer bütün hastalar, uygulamadan sonra en az 20 dakika süreyle gözlem altında tutulmalıdır.
Bütün hastalarda, IVIg kullanımı aşağıdakileri gerektirmektedir:
IVIg uygulamasına başlanmadan önce yeterli hidrasyon
İdrar çıkışının izlenmesi
Serum kreatinin düzeyinin izlenmesi
Kıvrım diüretikleri ile eş zamanlı kullanımın engellenmesi
Advers reaksiyon vakalarında, uygulama hızı azaltılmalı veya infüzyon durdurulmalıdır.
Tedavi gereksinimi advers reaksiyonun şiddetine ve niteliğine bağlıdır.
Şok vakasında, şok için standart medikal tedavi uygulanmalıdır.
Pedivatrik popülasvon
Pediyatrik popülasyon için özel tedbir veya izleme gerekli değildir.
Pediyatik popülasyonda (0-18 yaş) herhangi bir farklılık beklenmez.
T romb oemb oli zm
IVIg uygulaması ile riskli hastalarda immünoglobulinin yüksek akış hızı nedeniyle kan viskozitesinde görülen göreceli artışa bağlı olduğu düşünülen tromboembolik olaylar (miyokard infarktüsü, serebrovasküler olay (inme dahil), pulmoner emboli ve derin ven trombozu gibi) arasındaki ilişkiyi gösteren klinik çalışma mevcuttur. Obez ve daha önceden trombotik olay risk faktörü taşıyan (ilerlemiş yaş, hipertansiyon, diyabet, vasküler hastalık veya trombotik vaka öyküsü, belirli veya kalıtsal trombofıli hastalığı olan hastalar, uzun süreli hareketsiz kalma, ciddi hipovolemisi olan hastalar, kan viskozite artışı olan hastalar) hastalarda IVIg reçetelenirken ve infüzyonunda tedbirler alınmalıdır.
Tromboembolik advers reaksiyon görülme riski olan hastalara IVIg ürünleri minimum infüzyon hızında ve uygun dozda uygulanmalıdır.
Akut renal yetmezlik
IVIg tedavisi gören hastalarda, akut renal yetersizlik vakaları bildirilmiştir. Birçok vakada, mevcut renal yetmezlik, diyabet, hipovolemi, aşırı kilo, nefrotoksik tıbbi ürünlerin beraberinde verilmesi ya da 65 yaşını aşmış olmak gibi risk faktörleri tanımlanmıştır.
Renal yetmezlik durumunda, IVIg kullanımına devam edilmemesi değerlendirilmelidir Böbrek fonksiyon bozukluğu ya da akut böbrek yetmezliğinin sukroz, glukoz ve maltoz gibi çeşitli yardımcı maddeler içeren birçok IVIg preparatlarının kullanımıyla ilişkili olabileceği bildirilmiş olmasına rağmen, olguların çoğundan, stabilizör olarak sukroz içeren preparatlar sorumlu tutulmaktadır. Risk altındaki hastalarda, sukroz içermeyen IVIg ürünleri kullanımı düşünülebilir.
Akut renal yetmezliği görülme riski olan hastalara IVIg ürünleri minimum infüzyon hızında ve uygun dozda uygulanmalıdır.
Aseptik menenjit sendromu
Aseptik menenjit sendromunun IVIg tedavisi ile ilişkili olarak görüldüğü bildirilmiştir.
IVIg tedavisinin kesilmesi birkaç gün içinde aseptik menenjit sendromunun sekel olmadan remisyonununa neden olmuştur. Sendrom genellikle IVIg tedavisini takiben birkaç saat ila 2 gün içinde başlar. Serebrospinal sıvı çalışmaları yaygın olarak, genellikle granülositik
o
serilerden her mm de birkaç bin hücre pleositoz ve birkaç yüz mg/dlye yükselmiş protein seviyeleri ile pozitiftir.
Aseptik menenjit sendromu, yüksek dozda (2 g/kg) IVIg tedavisi ile ilişkili olarak daha sık meydana gelebilir.
Hemolitik anemi
IVIg ürünleri, hemolizinler gibi etki gösteren kan grubu antikorları içerir ve pozitif direkt anti globülin reaksiyonuna (Coombstesti) ve nadiren hemolize neden olan immünoglobulin ile in vivo boyanmış kırmızı kan hücrelerini indükler. IVIg tedavisi kırmızı kan hücreleri sekestrasyonunu artırdığından dolayı tedaviden sonra hemolitik anemi gelişebilir. IVIg tedavisi alanlar hemolizin klinik bulgu ve belirtileri açısından izlenmelidirler (bkz. bölüm 4.8).
Doz önerileri
Pozoloji ve uygulama sıklığı endikasyona göre değişir.
Replasman tedavisinde hastadaki farmakokinetik ve klinik yanıta bağlı olarak dozun bireysel olarak ayarlanması gerekebilir. Bir rehber olarak aşağıdaki doz şemaları verilmektedir.
Primer immün yetmezliklerde replasman tedavisi
Doz, bir sonraki infüzyondan önce ölçülen serum IgG düzeyinin en az 500-600 mg/dL düzeyinde kararlı olarak sürdürülmesini sağlayacak şekilde ayarlanmalıdır. Bu dengenin sağlanabilmesi için tedavinin başlangıcından itibaren 3-6 ay gereklidir.
Önerilen başlangıç dozu bir seferde verilen 0.4-0.8 g/kg infüzyonu takiben her 3-4 haftada bir uygulanan en az 0.2 g/kgdır.
Serum immünoglobulin düzeyinin 500-600 mg/dL olacak şekilde sabit tutulabilmesi için gereken doz ortalama 02-08 g/kg düzeyindedir.
Kararlı serum düzeyi sağlandıktan sonra doz aralığı 3 ile 4 hafta arasında değişir.
Hastanın klinik yanıtı ile birlikte kararlı serum düzeyleri ölçülmeli ve değerlendirilmelidir. Klinik yanıta bağlı olarak ( ör: enfeksiyon sıklığı) daha yüksek kararlı serum düzeylerinin sağlanması amacıyla doz ve/veya doz aralığının ayarlanması düşünülebilir.
Kronik Lenfositik Lösemi tanısı olup, hipogammaglobulinemisi bulunan ve profilaktik antibiyotiklerin yetersiz kaldığı, tekrarlayan bakteriyel enfeksiyon gelişen olgularda,
Multipl Miyelom tanısı olup hipogammaglobulinemisi (IgG<500 mg/dL) bulunan ve pnömokok immünizasyonun yetersiz kaldığı tekrarlayan bakteriyel enfeksiyon gelişen olgularda,
Konjenital AIDS ve tekrarlayan enfeksiyonların görüldüğü çocuklar ve adölesanlarda;
Tavsiye edilen doz 3-4 haftada bir uygulanan 0.2-0.4 g/kgdır.
Allojenik kök hücre nakli sonrası bakteriyemi ve tekrarlayan sinopulmoner enfeksiyonu olup, IgG düzeyi < 400 mg/dL olan hastalarda;
Tavsiye edilen doz 3-4 haftada bir uygulanan 0.2-0.4 g/kgdır. Kararlı serum düzeyleri 500 mg/dL üzerinde tutulmalıdır.
Primer immün trombositopeni
İki alternatif doz şeması vardır:
Birinci gün 0.8-1 g/kg dozunda uygulanır; doz 3 gün içerisinde bir kez tekrarlanabilir.
2-5 gün süreyle 0.4 g/kg/gün dozunda uygulanır.
Relaps olduğunda tedavi tekrarlanabilir.
Guillain Barre Sendromu
5 gün süreyle 0.4 g/kg/gün dozunda uygulanır.
Kawasaki Hastalığı
8-12 saat süreyle tek doz olarak uygulanan 2g/kgdır ve asetil salisilik asit ile kombine olarak verilir.
Multifokal Motor Nöropati (MMN) hastalığında
Başlangıç dozu: 2-5 gün süreyle bölünmüş dozlarda toplam 2g/kg İdame dozu: 2-6 haftada bir 1-2 g/kg
Kronik inflamatuvar denıiyelinizan polinöropati (KIDP)
Önerilen başlangıç dozu: 2-5 ardışık günde bölünmüş dozlarda toplam 2g/kgdır. Yanıt alınamaması durumunda 3 haftada bir lg/kg total doz 1-2 günde verilir ve 2 ay sonunda yanıt alınamazsa tedavi kesilir.
İdame dozu: başlangıç tedavisine yanıt alınmışsa 3 haftada bir 0.4-1 g/kg total doz 1-2 günde uygulanır. Maksimum yarar elde edilen doz önerilir ve doz doktor tarafından belirlenir. En düşük etkin idame dozu belirlenene kadar doz azaltılır ve uygulama sıklığı ayarlanır.
Myastenia Gravis
Diğer özel tedavilere cevap vermeyen kritik fazda 5 gün süreyle 0.4 g/kg/gün dozunda uygulanır.
Pediyatrik popülasyon
Çocuklar ve adölesanlardaki (0-18 yaş) pozoloji her bir endikasyon için erişkinlerden farklı değildir ve yukarıda belirtilen durumlardaki klinik sonlanımlara göre ayarlanır.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek/Karaciğer yetmezliği:
IVIG tedavisi uygulanan hastalarda akut böbrek yetmezliği vakaları bildirilmiştir. Böbrek yetmezliği riski bulunan hastalarda, IVIG preparatları uygulanabilir en düşük infüzyon hızında ve dozda kullanılmalıdır. (Bkz. Bölüm 4.4).
Karaciğer yetmezliği olan hastalara ilişkin ek bir bilgi bulunmamaktadır.
Pediyatrik popülasyon:
Yukarıda bahsedilen her durumda pozoloji vücut ağırlığına göre ve klinikte alınan yanıta göre verildiğinden, çocuklarda ve adölesanlarda (0-18 yaş) pozoloji değişmez.
Geriyatrik popülasyon:
IVIG tedavisi uygulanan hastalarda akut böbrek yetmezliği vakaları bildirilmiştir. Bu vakaların çoğunda kişinin 65 yaşın üzerinde olması dahil belirli risk faktörlerinin olduğu bildirilmiştir.
Ayrıca IVIG uygulaması ile yüksek riskli hastalarda tromboembolik olaylar arasında bağlantıyı gösteren klinik kanıtlar mevcuttur. Bu nedenle ileri yaş dahil trombotik olay açısından risk faktörlerini taşıyan hastalarda IVIG reçetelenip infüzyonu uygulanırken dikkatli hareket edilmeli, uygulanabilir en düşük infüzyon hızında ve dozda kullanılmalıdır. (Bkz. Bölüm 4.4)
 HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan
Virüsdür). Bu virüs AIDS hastalığına sebep olur.
HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan
Virüsdür). Bu virüs AIDS hastalığına sebep olur.
 Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür.
Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür.
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| FLEBOGAMMA | 8699769980061 | |
| FLEBOGAMMA% | 8699769980405 | 39,049.14TL |
| GAMUNEX | 8699702980844 | |
| GAMUNEX-C | 869976980214 | |
| GAMİMUNE-N | 8699702984019 | |
| GENIVIG | 8699783980023 | 22,602.02TL |
| IG | 8680972009045 | 2,527.01TL |
| IMMUTECT | 8699535980851 | 38,263.90TL |
| INTRATECT | 8682328749001 | 42,697.38TL |
| KIOVIG | 8699556981127 | |
| Diğer Eşdeğer İlaçlar |
 Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür.
Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür.
 HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan
Virüsdür). Bu virüs AIDS hastalığına sebep olur.
HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan
Virüsdür). Bu virüs AIDS hastalığına sebep olur.
 Her yıl milyonlarca insan yiyeceklere alerji gösteriyor.
Her yıl milyonlarca insan yiyeceklere alerji gösteriyor.
İLAÇ GENEL BİLGİLERİ
Onko Koçsel İlaç San. Tic. A.ş
| Geri Ödeme Kodu | A03735 |
| Satış Fiyatı | 35990.55 TL [ 22 Apr 2024 ] |
| Önceki Satış Fiyatı | 35952.99 TL [ 15 Apr 2024 ] |
| Original / Jenerik | Jenerik İlaç |
| Reçete Durumu | Mor Reçeteli bir ilaçdır. |
| Barkodu | 8699650981436 |
| Etkin Madde | Human Immunglobulin Iv |
| ATC Kodu | J06BA02 |
| Birim Miktar | 10 |
| Birim Cinsi | G |
| Ambalaj Miktarı | 200 |
| Enfeksiyona Karşı Kullanılan (Antienfektif) İlaçlar > İmmünoglobülinler > İmmunglobulin |
| İthal ( ref. ülke : Italya ) ve Beşeri bir ilaçdır. |
İLAÇ FİYATLARI
| Tarihi | İlaç Fiyatı |
|---|---|
| 22 Apr 2024 | 35,990.55 TL |
| 15 Apr 2024 | 35,952.99 TL |
| 5 Apr 2024 | 35,952.99 TL |
| 1 Apr 2024 | 35,951.24 TL |
| 26 Mar 2024 | 35,951.24 TL |
| 11 Mar 2024 | 36,221.20 TL |
| 4 Mar 2024 | 34,887.90 TL |
| 23 Feb 2024 | 34,887.90 TL |
| 2024 / 2008 İlaç Fiyatları |