DESITAB 50 mg IV enjeksiyonluk çözelti HAZIRLAMADA KULLANILACAKKONSANTRE için toz Klinik Özellikler
{ Decitabine }
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
DESİTAB aşağıdaki hastalıkların tedavisinde endikedir:
DESİTAB (desitabin) Dünya Sağlık Örgütü (WHO)'nun miyelodisplastik sendrom (MDS) sınıflandırmasına göre aşırı blast artışı gösteren dirençli anemi tip I ve tip II (RAEB-1 ve RAEB-2) erişkin hastaların tedavisinde endikedir. Ayrıca ek olarak diğer miyelodisplastik sendrom alt tiplerinde eşlik eden sitogenetik kötü risk, ağır dishematopoez, yoğun enfeksiyonla seyreden lökopeni, klinik kanamalara neden olabilecek trombositopeni ve tranfüzyonlarla düzeltilemeyen
Bu bedlgee r5i0n70rseafyrılaı Eklteektrroannikeİmmzia Khaanlulneuruiynadrıencadeeelekkturolnliak nollıalrıark.imzalanmıştır. nden kontrol edilebilir. Güvenli elektronik imza aslı ile aynıdır.
DESİTAB, standart indüksiyon kemoterapisi için aday olmayan yetişkinlerde, Dünya Sağlık Örgütü (WHO)'nun sınıflandırmasına göre yeni tanı konmuş de novo ya da sekonder akut miyeloid lösemi (AML) tedavisinde endikedir.
4.2. Pozoloji ve uygulama şekli
4.3. Kontrendikasyonlar
Desitabin ya da yardımcı maddelerinden herhangi birine karşı aşırı duyarlılığı olduğu bilinen
hastalarda kontrendikedir (bkz. Bölüm 6.1).
Laktasyon döneminde kontrendikedir (bkz. Bölüm 4.6).
4.4. Özel kullanım uyarıları ve önlemleri
Miyelosupresyon
DESİTAB tedavisi ile MDS'li ya da AML'li hastalarda kemik iliği baskılanması ve bu baskılanmaya bağlı enfeksiyon ve kanama dahil komplikasyonlarda alevlenme görülebilir. Bu nedenle hastalar, potansiyel olarak ölümcül olaylarla sonuçlanabilen ciddi enfeksiyonlar (bakteri, mantar ya da virüs gibi herhangi bir patojenden dolayı) için yüksek risk altındadır (bkz. Bölüm 4.8). Hastalar enfeksiyonun belirtileri ve işaretleri için izlenmeli ve derhal tedavi edilmelidir. AML klinik çalışmalarında, hastaların çoğunda başlangıçta Evre 3/4 kemik iliği baskılanması vardı. Başlangıçta Evre 2 kemik iliği baskılanması olan hastalarda, kemik iliği baskılanmasının kötüleşmesi hastaların çoğunda görüldü ve başlangıçta Evre 1 veya 0 olan hastalardan daha sıktı. DESİTAB ile oluşan kemik iliği baskılanması geri dönüşlüdür. Klinik açıdan gerekli olduğunda ve her bir tedavi siklusu öncesinde tam kan ve trombosit sayımı düzenli bir şekilde yapılmalıdır. Kemik iliği baskılanması ya da baskılanmaya bağlı komplikasyonların görülmesi durumunda, Bölüm 4.2 ve 4.8'de önerildiği şekilde DESİTAB tedavisi kesilebilir, doz azaltılabilir ya da destekleyici önlemler alınabilir.
Solunum sistemi, göğüs bozuklukları ve mediastinal hastalıklar
Desitabin alan hastalarda, enfeksiyon etiyolojisinin belirtileri olmamasına rağmen interstisyel akciğer hastalığı (ILD) (pulmoner infiltrasyonlar, organize pnömoni ve pulmoner fibröz dahil) vakaları raporlanmıştır. ILD'yi dışlamak için, akut başlangıç ya da pulmoner semptomların açıklanamayan kötüleşmesi durumunda hastalar dikkatli bir şekilde değerlendirilmelidir. Eğer ILD olduğu tespit edilirse, uygun tedavi başlatılmalıdır (bkz. Bölüm 4.8).
Karaciğer yetmezliği
Karaciğer yetmezliği olan hastalarda kullanım araştırılmamıştır. DESİTAB'ı karaciğer yetmezliği olan hastalarda kullanırken dikkatli olunmalı ve hastalar yakından izlenmelidir (bkz. Bölüm 4.2 ve 5.2).
Böbrek yetmezliği
Şiddetli böbrek yetmezliği olan hastalarda kullanım çalışılmamıştır. DESİTAB'ı şiddetli böbrek yetmezliği olan hastalarda (Kreatin klerensi [CrCl] <30 mL/dak) kullanırken dikkatli olunmalı ve
hastalar yakından izlenmelidir (bkz. Bölüm 4.2).
Bu belge 5070 sayılı Elektronik İmza Kanunu uyarınca ellektronik ollarak iimzalanmıştır. Doküman https://www.turkiye.gov.tr/saglik-titck-ebys
adresinden kontrol edilebilir. Güvenli elektronik imza aslı ile aynıdır.
Kalp hastalığı
Ağır konjestif kalp yetmezliği ya da klinik olarak unstabil kalp hastalığı hikayesi olan hastalar klinik çalışmalara alınmamıştır ve bu nedenle DESİTAB'ın bu hastalardaki etkililik ve güvenliliği kanıtlanmamıştır.
DESİTAB her mL'sinde 1 mmol (23 mg)'dan daha az sodyum ihtiva eder. Sodyuma bağlı herhangi bir etki beklenmez. İntravenöz infüzyon için sulandırıldıktan ve seyreltildikten sonra, seyreltmek için kullanılan infüzyon sıvısına bağlı olarak bu ilaç bir dozunda 0,6 ila 6 mmol arasında sodyum içerebilir. Bu sebeple kontrollü sodyum diyetinde hastalarda dikkatli olunmalıdır. DESİTAB her mL'sinde 1 mmol (39 mg)'dan daha az potasyum ihtiva eder. Enjeksiyon yerinde ağrıya neden olabilir. İntravenöz infüzyon için sulandırıldıktan ve seyreltildikten sonra, seyreltmek için kullanılan infüzyon sıvısına bağlı olarak bu ilaç bir dozunda 1 ila 10 mmol arasında potasyum içerebilir. Bu sebeple azalmış böbrek fonksiyonu olan veya kontrollü potasyum diyetinde hastalarda dikkatli olunmalıdır.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Desitabinle gerçekleştirilen herhangi bir resmi klinik ilaç etkileşim çalışması bulunmamaktadır. Ardışık fosforilasyon ile aktive olan (intraselüler fosfokinaz aktivitesi yoluyla) ve/veya desitabinin inaktivasyonunda rol alan enzimlerle (sitidin deaminaz gibi) metabolize olan diğer maddeler ile ilaç â ilaç etkileşimine girme olasılığı vardır. Bu yüzden bu aktif maddeler desitabin ile kombine edilirken dikkatli olunmalıdır.
Birlikte uygulanan ilaçların desitabin üzerine etkisi:
Desitabinin metabolizması sitokrom (CYP) 450 enzim sistemi tarafından değil de oksidatif deaminasyon yoluyla olduğundan, bu enzim sistemi tarafından yönetilen metabolik ilaç etkileşimleri beklenmez.
Desitabinin birlikte uygulanan ilaçlar üzerindeki etkileri:
Desitabin, in vitro olarak plazma proteinlerine ihmal edilebilecek kadar düşük derecelerde (<%1) bağlandığından, birlikte uygulanan ilaçlar tarafından desitabinin plazma proteinlerinden ayrılması mümkün değildir. Desitabin, P-glikoprotein (P-gp) aracılı in vitro taşıma olayının zayıf bir inhibitörüdür ve bu nedenle de birlikte uygulanan ilaçların P-gp aracılı taşınmasını etkilemesi beklenmez (Bkz Bölüm 5.2).
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek yetmezliği:
Bu belge 5070 sayılı Elektronik İmmza Kanunu uyarınca elektronik olarak imzalanmıştır. nden kontrol edilebilir. Güvenli elektronik imza aslı ile aynıdır.
Herhangi bir etkileşim çalışması yapılmamıştır.
Karaciğer yetmezliği:
Herhangi bir etkileşim çalışması yapılmamıştır.
Pediyatrik popülasyon:
Herhangi bir etkileşim çalışması yapılmamıştır.
Geriyatrik popülasyon:
Herhangi bir etkileşim çalışması yapılmamıştır.
4.6. Gebelik ve laktasyon
Gebelik Kategorisi: D
Çocuk doğurma potansiyeli bulunan kadınlar/doğum kontrolü (Kontrasepsiyon)
DESİTAB kullanmakta olan doğurganlık çağındaki kadınlara kontraseptif yöntemler kullanmaları ve gebe kalmamaları önerilmelidir. DESİTAB kullanımından ne kadar süre sonra hamile kalınması güvenlidir bilinmemektedir. Erkekler etkili bir doğum kontrol yöntemi kullanmalıdırlar. Erkeklere, DESİTAB kullanırken ve tedaviyi tamamladıktan sonra 3 ay süreyle çocuk sahibi olmamaları önerilir (bkz. Bölüm 5.3).
Hormonal doğum kontrol yöntemleri ile desitabin kullanımı çalışılmamıştır.
Gebelik dönemi
DESİTAB'ın gebe kadınlarda kullanımına ilişkin yeterli veri yoktur. Yapılan çalışmalar desitabinin fare ve sıçanlarda teratojen etkili olduğunu göstermiştir (bkz. Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. Hayvanlarda gerçekleştirilen çalışmalar ve etki mekanizması nedeniyle DESİTAB gebelik döneminde ve etkili bir doğum kontrol yöntemi kullanmayan çocuk doğurma potansiyeli olan kadınlarda kullanılmamalıdır. Gebelikte kullanımı veya hastanın DESİTAB kullanırken gebe kalması durumunda hasta, fetusa olabilecek hasar konusunda bilgilendirilmelidir.
Laktasyon dönemi
Desitabin ya da metabolitlerinin süte geçip geçmedikleri bilinmemektedir. DESİTAB laktasyon döneminde kontrendikedir; bu nedenle bu dönemde desitabin tedavisine gerek duyulursa emzirmeye son verilmelidir (bkz. Bölüm 4.3).
Doküman https://www.turkiye.gov.tr/saglik-titck-ebys
adresinden kontrol edilebilir. Güvenli elektronik imza aslı ile aynıdır.
Üreme yeteneği /Fertilite
İnsanda fertilite üzerinde desitabinin etkisine ilişkin herhangi bir veri yoktur.
Klinik dışı hayvan çalışmalarında, desitabin erkek fertilitesini değiştirmiştir ve mutajeniktir. DESİTAB tedavisine bağlı infertilite olasılığı nedeniyle, erkek hastalar, tedavi öncesi spermlerini saklama; çocuk doğurma potansiyeli olan kadın hastaların ise oosit kriyoprezervasyonu konusunda bir uzmandan destek almaları önerilmektedir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
DESİTAB'ın araç ve makina kullanımı üzerinde hafif etkisi vardır. Hastalar tedavi sırasında anemi gibi olumsuz etkilerin görülebileceği konusunda bilgilendirilmelidir. Bu nedenle araç ve makine kullanımı sırasında dikkatli olmaları önerilmelidir.
4.8. İstenmeyen etkiler
Güvenlilik profili özeti
Rapor edilen en yaygın advers ilaç reaksiyonları (≥%35) ateş, anemi ve trombositopenidir.
En yaygın Evre 3/4 advers ilaç reaksiyonları (≥%20) pnömoni, trombositopeni, nötropeni, febril
nötropeni ve anemidir.
Klinik çalışmalarda, DESİTAB ile tedavi edilen hastaların %30'u ve karşılaştırıcı kolda tedavi edilen hastaların %25'i tedavi sırasında ya da ilacın son dozundan sonra 30 gün içinde ölümle sonuçlanan advers olaylar yaşamışlardır.
DESİTAB ile tedavi edilen grupta, advers olayların neden olduğu tedavinin kesilmesi durumu erkeklere göre kadınlarda daha yüksek bir insidanstaydı (%43'e karşı %32).
DESİTAB ile tedavi edilen 293 AML hastasında rapor edilen advers ilaç reaksiyonları aşağıda özetlenmiştir. Bir sonraki bölümde AML klinik çalışmalarından ve pazarlama sonrası deneyim ile elde edilen veriler yansıtılmaktadır.
Aşağıdaki sıklık grupları kullanılmıştır:
Çok yaygın (≥1/10), yaygın (≥1/100 ila <1/10); yaygın olmayan (≥ 1/ 1.000 ila <1/100); seyrek (≥1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden tahmin edilemiyor).
Enfeksiyon ve enfestasyonlar
Çok yaygın: Pnömoni, idrar yolu enfeksiyonu, bütün diğer enfeksiyonlar (viral, bakteriyel,
fungal)
sayılı Elektronik
Yaygın: Septik şok, sepsis, sinüzit
Kan ve lenf sistemi hastalıkları
Çok yaygın: Febril nötropeni, nötropeni, trombositopeni, anemi, lökopeni
Yaygın olmayan: Pansitopeni
Bağışıklık sistemi hastalıkları
Yaygın: Anafilaktik reaksiyon dahil hipersensitivite
Sinir sistemi hastalıkları
Çok yaygın: Baş ağrısı
Solunum sistemi, göğüs bozuklukları ve mediastinal hastalıklar
Çok yaygın : Epistaksis
Bilinmiyor: İnterstisyel akciğer hastalığı
Gastrointestinal hastalıklar
Çok yaygın: Diyare, kusma, bulantı Yaygın: Stomatit
Bilinmiyor: Nötropenik kolit dahil enterokolit, çekum iltihabı
Deri ve deri altı dokusu hastalıkları
Yaygın olmayan: Akut febril nötrofilik dermatoz (Sweet's sendromu)
Genel sistem hastalıkları ve uygulamayla ilgili reaksiyonlar
Çok yaygın: Ateş
Seçilmiş advers ilaç reaksiyonlarının tanımı Hematolojik advers ilaç reaksiyonları
DESİTAB tedavisiyle en sık olarak bildirilen hematolojik advers ilaç reaksiyonları arasında febril
nötropeni, trombositopeni, nötropeni, anemi ve lökopeni bulunur.
Desitabin tedavisi alan hastalarda, merkezi sinir sistemi (MSS) kanaması (%2) ve gastrointestinal (GI) kanama (%2) gibi şiddetli trombositopeniye bağlı kanamayla ilişkili ve bazıları ölümle
sonuçlanan ciddi advers ilaç reaksiyonları bildirilmiştir.
nden kontrol edilebilir. Güvenli elektronik imza aslı ile aynıdır.
Hematolojik advers ilaç reaksiyonları rutin tam kan sayımları ile izlenerek ve gerektiğinde erken destekleyici tedaviler uygulanarak yönetilmelidirler. Destekleyici tedaviler arasında tedaviyi yürüten kliniğin protokollerine göre profilaktik antibiyotik kullanımı ve/veya nötropeni için büyüme faktörü (örn. G-CSF) desteği ile anemi ya da trombositopeni için transfüzyonlar yer alır. Desitabin uygulamasının ertelenmesi gereken durumlar için Bölüm 4.2'ye bakınız.
Enfeksiyonlar ve enfestasyonlarda advers ilaç reaksiyonları
Desitabin tedavisi alan hastalarda ölümle sonuçlanabilen septik şok, sepsis, pnömoni ve diğer enfeksiyonlarla (viral, bakteriyel ve fungal) ilişkili ciddi advers ilaç reaksiyonları bildirilmiştir.
Gastrointestinal hastalıklar
Desitabin tedavisi sırasında nötropenik kolit dahil enterekolit ve çekum iltihabı vakaları bildirilmiştir. Enterokolit septik komplikasyonlara neden olabilir ve fatal sonuçlar ile ilişkilendirilebilir.
Solunum sistemi, göğüs bozuklukları ve mediastinal hastalıklar
Desitabin alan hastalarda, enfeksiyöz etiyolojisinin belirtileri olmamasına rağmen interstisyel akciğer hastalığı (ILD) (pulmoner infiltrasyonlar, organize pnömoni ve pulmoner fibröz dahil) vakaları raporlanmıştır.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr/; e-posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
İnsanlarda doz aşımıyla ilgili doğrudan bir deneyim ve spesifik bir antidotu bulunmamaktadır. Ancak ilk yapılan klinik çalışmalar ve yayınlanmış literatürde mevcut terapötik dozların 20 kat fazlası dozlarda, uzamış nötropeni ve trombositopeni dahil kemik iliği baskılanmasında artış bildirilmiştir. Toksisite durumu advers ilaç reaksiyonlarının, öncelikle kemik iliği baskılanmasının alevlenmeleri şeklinde ortaya çıkar. Doz aşımının tedavisi destekleyici tedavi olmalıdır.
Doküman https://www.turkiye.gov.tr/saglik-titck-ebys
adresinden kontrol edilebilir. Güvenli elektronik imza aslı ile aynıdır.
Farmakoterapötik grup: Antineoplastik ajanlar, antimetabolitler, pirimidin analogları
ATC Kodu: L01BC08
Etki mekanizması
Desitabin (5-aza-2'-deoksisitidin), düşük dozlarda selektif olarak DNA metiltransferaz enzimlerini inhibe eden bir sitidin deoksinükleosit analogudur; bu inhibisyon tümör baskılayıcı genlerin reaktivasyonu ile sonlanabilen gen promoter hipometilasyonuna, hücresel diferensiyon indüksiyonu veya programlanmış hücre ölümünü takiben hücre yaşlanmasına neden olur.
Klinik deneyim:
MDS'de yapılan klinik çalışmalar
Faz-II Çalışma (DACO-020): 5 Günlük Tedavi Rejimi
FAB sınıflandırmasına göre herhangi bir alt gruptan miyelodisplastik sendromu olan hastalarda Desitabin'in etkililiğini değerlendirmek amacıyla açık etiketli, tek kollu, çok merkezli bir çalışma (DACO-20) yürütülmüştür. Bu çalışmada IPSS sınıflandırması açısından Int-1, Int-2 ya da yüksek riskli prognostik puanı olan 99 hastaya 5-günlük tedavi şeması doğrultusunda 1. ve 5. günler arasında 20 mg/m dozda her 4 haftada 1 siklus ve bir saatlik intravenöz infüzyon şeklinde Desitabin uygulanmıştır. Tablo 1'de özetlenen çalışma sonuçları faz-III çalışmada elde edilenlerle uyumlu bulunmuştur.
Tablo 1 : Faz-II çalışma DACO-020'de Desitabin'in etkililiği
Parametre | DACOGEN (n=99) | |
Toplam yanıt oranı (CR + mCR + PR) | 33 | (%33) |
Tam remisyon (CR) | 17 | (%17) |
Kemik iliği tam remisyon (mCR) | 16 | (%16) |
Toplam iyileşme oranı (CR + mCR + PR + HI) | 51 | (%52) |
CR = tam remisyon; mCR = kemik iliği tam remisyon; |
|
|
PR = kısmi remisyon; HI = hematolojik iyileşme. |
|
|
Kaynak: DACO-020 CSR |
|
|
Faz-III Çalışma (D-0007): 3 Günlük Tedavi Şeması
Randomize, açık etiketli, çok merkezli, kontrollü gruplu bir çalışmada (D-0007) Desitabin, FAB
sınıflandırma kriterlerine uyan ve IPSS sınıflandırmasına göre yüksek risk, Int-2 ile Int-1
prognostik skorlu 170 miyelodisplastik sendromlu hastada değerlendirilmiştir. Bu çalışmada Desitabin 3-günlük tedavi şemasına göre 6 haftalık siklus şeklinde ardarda 3 gün süreyle her sekiz saatte bir, vücut ağırlığının metrekaresi başına 15 mg dozunda ve üç saatlik sürekli intravenöz infüzyon şeklinde uygulanmıştır.
Faz-III klinik çalışmada, tüm IPSS alt gruplarında CR'lar ya da PR'lar görülmüştür. Ancak Tablo 2'de görüldüğü gibi Int-2 ve yüksek riskli olarak sınıflandırılan hasta alt gruplarında yararlı etki daha fazla belirgindir.
Tablo 2: Çalışma D-0007'de IPSS alt gruplarına göre etkililik
![]()
Desitabin Destek bakımı
IPSS alt grubu Toplam yanıt AML ya da ölüme Toplam yanıt AML ya da ölüme
oranı kadar geçen oranı kadar geçen (CR + PR) medyan süre (gün) (CR + PR) medyan süre (gün)
Tüm hastalar | 15/89 (%17) | 340 | 0/81 | 219 |
Int-2 ve yüksek riskli | 11/61 (%18) | 335 | 0/57 | 189 |
Int-2 | 7/38 (%18) | 371 | 0/36 | 263 |
Yüksek riskli | 4/23 (%17) | 260 | 0/21 | 79 |
AML = Akut miyeloid lösemi; CR = tam remisyon; IPSS = Uluslararası Prognostik Puanlama Sistemi; Int-2 = Orta derece-2; PR = kısmi remisyon
Kaynak: D-0007 CSR
AML'de yapılmış klinik çalışmalar
Açık etiketli, randomize, çok merkezli bir faz-III çalışmayla (DACO-016) WHO sınıflamasına göre yeni tanımlanmış de novo veya sekonder AML hastalarında Desitabin kullanımı araştırılmıştır. Desitabin tedavisi (n=242), ya tek başına destek tedavisi (n=28, %11,5) ya da her 4 haftada bir tekrarlanacak şekilde 10 gün boyunca günde tek doz subkutan 20 mg/m sitarabin tedavisinden (n=215, %88.5) oluşan tedavi seçimi (TC, n=243) ile karşılaştırılmıştır. Çalışmada Desitabin her 4 haftada bir tekrarlanacak şekilde 5 gün ardarda tek defada bir saatlik intravenöz infüzyonla 20 mg/m dozunda uygulanmıştır.
Standart indüksiyon kemoterapi adayı olarak düşünülen hastalar sıralanan temel nitelikler doğrultusunda çalışmaya dahil edilmemiştirler. Tedaviye alınan (ITT) popülasyonun medyan yaşı
73 yıl idi (64 ila 91 yaş arası). Hastaların %36'sı başlangıçta sitogenetik olarak kötü risk grubundadır. Geri kalan hastalar sitogenetik olarak orta risk grubundandı. Olumlu sitogenetiğe sahip hastalar çalışmaya dahil edilmemiştir. Çalışmaya katılan hastaların %25'inin ECOG
performans skoru ≥2'dir. Hastaların %81'inin önemli komorbiditesi (enfeksiyon, kalp yetersizliği,
Doküman https://www.turkiye.gov.tr/saglik-titck-ebys
adresinden kontrol edilebilir. Güvenli elektronik imza aslı ile aynıdır.
akciğer yetersizliği gibi) bulunmaktaydı. Desitabin ile tedavi edilen hastaların %86,4'ü (209) beyaz, %13,6'sı (33) ise Asya kökenlidir.
Çalışmanın primer sonlanım noktası genel sağ kalım olarak belirlenmiştir. İkincil sonlanım noktası olarak bağımsız uzman değerlendirmesiyle tam remisyon oranı alınmıştır. Progresyonsuz sağ kalım ve olaysız sağ kalım ise üçüncül sonlanım noktalarıydı.
ITT popülasyonunda medyan genel sağ kalım Desitabin ile tedavi edilenlerde 7,7 ay iken, TC kolunda 5,0 ay olarak bulunmuştur (Tehlike oranı [hazard ratio; HR] 0,85; %95 Güven aralığı [GA]: 0,69, 1,04, p=0,1079). Aradaki fark istatistiksel olarak anlamlı düzeylere ulaşamamasına rağmen Desitabin kolunda, ölüm riskinde %15'lik bir azalmayla sağ kalımda olumlu bir etki bulundu (Şekil 1). Potansiyel olarak hastalığı modifiye eden sonraki tedavilerin (örn. indüksiyon kemoterapisi ya da hipometilasyon ajanları) etkisinden arındırıldığında toplam sağ kalım Desitabin kolunda ölüm riskinde %20'lik bir azalma gösteriyordu (HR=0,80; 95% GA: 0,64; 0,99, p-
değeri=0,0437).
Şekil 1. Genel Sağ kalım (ITT Popülasyon)
Ove
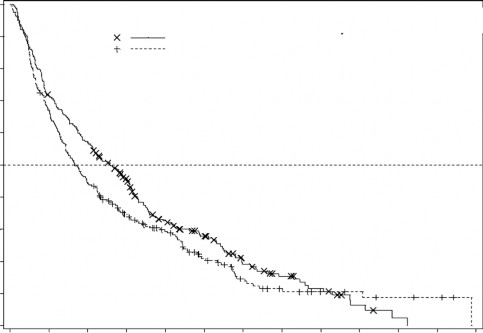
N Ölüm (%) Medyan %95 GA
Sağ kalan deneklerin oranı
İlave bir yıllık tamamlanmısağ kalım verileri ile yapılan analizde, Desitabin'in genel sağ kalım
üzerindeki etkisi TC kolundakine kıyasla klinik olarak anlamlı bir iyileşme göstermiştir (sırasıyla 7,7 aya karşılık 5,0 ay, HR=0,82; %95 GA: 0,68, 0,99, nominal p-değeri=0,0373, Şekil 2).
Doküman https://www.turkiye.gov.tr/saglik-titck-ebys
adresinden kontrol edilebilir. Güvenli elektronik imza aslı ile aynıdır.
Şekil 2. Olgunlaşmış Genel Sağ kalım Verisinin Analizi (ITT Popülasyon)
Overall Survival
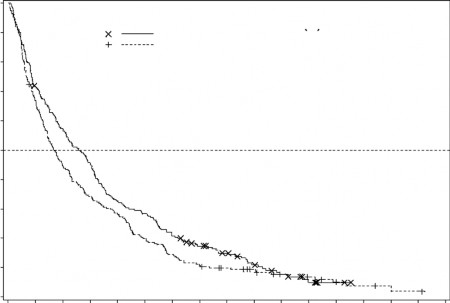
NÖlüm(%)Medyan %95GA
Sağ kalan deneklerin oranı
|
| Süre (ay) |
|
|
|
| |||
ITT popülasyonda yapılan ilk analizlere göre, tam remisyon oranında (CR+CRp) Desitabin kolundaki hastalar lehine istatistiksel olarak anlamlı bir farklılık sağlandı [Tam remisyon oranı Desitabin kolunda %17,8 (43/242); TC kolunda %7,8 (19/243), tedavi farkı %9,9 (% 95 GA: 4,07; 15,83), p=0,0011]. CR veya CRp sağlanan hastalarda en iyi yanıtın alınması için gereken medyan süre ve en iyi yanıtın devam süresi sırasıyla 4.3 ay ve 8.3 ay idi. Progresyonsuz sağ kalım Desitabin kolundaki hastalarda [3,7 ay (%95 GA: 2,7; 4,6)] TC kolunda hastalardakine [2,1 ay (% 95 GA: 1,9; 3,1)] göre istatistiksel olarak anlamlı derecede daha uzundu (HR=0,75; %95 GA: 0,62; 0,91, p=0,0031). Diğer sonlanım noktaları ile birlikte bu sonuçlar Tablo 3'de gösterilmektedir.
Tablo 3: DACO-016 çalışmasında Diğer Etkililik Sonlanım Noktaları (ITT popülasyonu) | |||
Sonuçlar | Desitabin n = 242 | TC (birleştirilmiş grup) n = 243 |
p-değeri |
CR + CRp | 43 (%17,8) | 19 (%7,8) | 0,0011 |
OR=2,5 (1,40; 4,78) | |||
CR | 38 (%15,7) | 18 (%7,4) | - |
nden kontrol edilebilir. Güvenli elektronik imza aslı ile aynıdır.
EFS | 3,5 (2,5; 4,1) | 2,1 (1,9; 2.8) | 0,0025 |
| HR=0.75 | ||
| (0,62; 0.90) | ||
PFS | 3,7 | 2,1 | 0,0031 |
(2,7; 4.6) | (1,9; 3,1) | ||
| HR=0.75 | ||
| (0,62; 0,91) | ||
CR = tam remisyon; CRp= tam olmayan trombosit iyileşmesi ile birlikte tam remisyon, EFS = olaysız sağ | |||
kalım, PFS = progresyonsuz sağ kalım, OR = Odds oranı, HR = tehlike oranı | |||
- = Mevcut değil |
|
|
|
Önceden belirlenmiş hastalıkla ilişkili alt gruplarda (örn., sitogenetik risk, Eastern Cooperative Oncology Group [ECOG] puanı, yaş, AML'nin tipi ve başlangıç kemik iliği blast sayısı) bulunan genel sağ kalım ve tam remisyon oranları, toplam çalışma popülasyonunda bulunanlarla uyumluydu.
Desitabin ile tedavi edilen hastalar (%11, 24/223), TC kolundakiler ile karşılaştırıldığında (%6, 13/212) daha fazla hipergliseminin kötüleşmesini deneyimlediler.
Desitabin'in başlangıç tedavisinde kullanımı, WHO sınıflamasına göre AML'si olan 60 yaş üstü 55 hastada açık etiketli, tek kollu bir Faz-II çalışmayla da (DACO-017) değerlendirildi. Primer sonlanım noktası bağımsız uzmanlarca gözden geçirilerek değerlendirilen CR olarak belirlendi. Çalışmanın ikincil sonlanım noktası toplam sağ kalım idi. Desitabin, her 4 haftada bir tekrarlanmak üzere 5 gün peşpeşe günde tek dozda 1 saatlik intravenöz infüzyonla 20 mg/m dozunda uygulandı. ITT analizinde Desitabin ile tedavi gören 13/55 hastada %23,6'lık bir CR oranı (%95 GA: %13,2 ila %37) gözlendi. CR sağlanması için medyan süre 4,1 ay idi ve CR'nun medyan devam süresi 18,2 ay idi. ITT popülasyonda medyan genel sağ kalım 7,6 ay idi (%95 GA: 5,7, 11,5).
Akut promyelositik lösemi ya da merkezi sinir sistemi (MSS) lösemisi olan hastalarda Desitabin'in
etkililiği ve güvenliliği değerlendirilmemiştir.
 Gıda Alerjisi
Her yıl milyonlarca insan yiyeceklere alerji gösteriyor.
Gıda Alerjisi
Her yıl milyonlarca insan yiyeceklere alerji gösteriyor. |
 Travma Sonrası Bunalımı
Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden
rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir.
Travma Sonrası Bunalımı
Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden
rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir. |
İLAÇ GENEL BİLGİLERİ
Dfl Ecza Deposu İlaç Pazarlama Tic Ltd Şti
| Satış Fiyatı | 12005.51 TL [ 3 May 2024 ] |
| Önceki Satış Fiyatı | 12005.51 TL [ 26 Apr 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8681917098025 |
| Etkin Madde | Decitabine |
| ATC Kodu | L01BC08 |
| Birim Miktar | 50 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 1 |
| Antineoplastik ve İmmünomodülatör Ajanlar > Antimetabolitler > Decitabine |
| İthal ( ref. ülke : Almanya ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Rahim Boyu ( Serviks ) Kanseri Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir. |
 |
Mide Kanseri Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir. |
 |
Tiroid Kanseri En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur. |