CEFORCE 0.5 G IM enjeksiyonluk çözelti hazırlamak için toz ve çözücü Farmasötik Özellikler
{ Seftriakson }
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Her 2 ml %1 Lidokain hidroklorür çözeltisi içeren ampulde; Lidokain hidroklorür
Sodyum klorür
Sodyum hidroksit / hidroklorik asit (pH ayarlayıcı) Enjeksiyonluk su
6.2. Geçimsizlikler
CEFORCE içeren çözeltiler diğer ajanlar ile karıştırılmamalı veya diğer ajanlara eklenmemelidir. Özellikle, kalsiyum içeren seyrelticiler (örneğin Ringer çözeltisi veya Hartmann çözeltisi) seftriakson flakonlarını rekonstitüe etmek için veya rekonstitüe edilmiş bir flakonu IV uygulama için daha fazla seyreltmek için kullanılmamalıdır, çünkü çökelti oluşabilir. Seftriakson ve kalsiyum içeren çözeltiler karıştırılmamalı veya aynı anda uygulanmamalıdır.
Literatürlerde seftriaksonun amsakrin, vankomisin, flukonazol, aminoglikozidler ve labetalol ile geçimsiz olduğu bildirilmiştir.
6.3. Raf ömrü
36 ay
6.4. Saklamaya yönelik özel tedbirler
25°C altındaki oda sıcaklığında saklayınız.
6.5. Ambalajın niteliği ve içeriği
CEFORCE 0.5 g IM enjeksiyonluk çözelti hazırlamak için toz ve çözücü kutu içerisinde 1 adet flakon
+ 1 adet 2 ml %1 Lidokain HCl içeren çözücü ampul
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj ve Ambalaj Atıklarının Kontrolü Yönetmelikâlerine uygun olarak imha edilmelidir.
Kural olarak, çözeltiler hazırlandıktan sonra hemen kullanılmalıdır.
Çözeltilerin renkleri, konsantrasyon ve saklama süresine bağlı olarak açık sarı ile bal rengi arasında değişir. Solüsyonun renginin değişmesi ilacın etki ve toleransını etkilemez.
İntramüsküler enjeksiyon: İntramüsküler enjeksiyon için 0.5 g CEFORCE 2 ml %1'lik lidokain çözeltisinde çözülür ve derin intragluteal enjeksiyon şeklinde uygulanır. Her iki tarafa da 1 g'dan fazla enjekte edilmemesi önerilmektedir. Lidokain içermeyen IM enjeksiyonlar ağrılıdır. Lidokain çözeltisi asla IV uygulanmamalıdır.
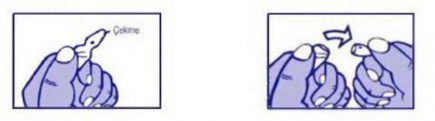
Ampulün baş kısmı ok yönünde aşağıya çekilir. Testere kullanılmasına gerek yoktur.
 En Yaygın Alerji Türleri
Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir.
En Yaygın Alerji Türleri
Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir. |
 Rahim Boyu ( Serviks ) Kanseri
Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden
sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir.
Rahim Boyu ( Serviks ) Kanseri
Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden
sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| AVISEF | 8680407100293 | 147.63TL |
| BAKTISEF | 8699536270012 | |
| BULSEF | 8680080000361 | 204.79TL |
| CEFADAY | 8699578270469 | |
| CEFAMED | 8680080270351 | 204.79TL |
| Diğer Eşdeğer İlaçlar |
 |
Mesane Kanseri Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve hücre içindeki karsinom olarak nitelendirilir. |
 |
Ağız Kanseri Ağız kanserinin en yaygın türleri, dudak, dil, dişetidir. Nadiren yanak içi veya damak bölgelerini de içine alır. |
 |
Travma Sonrası Bunalımı Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir. |
İLAÇ GENEL BİLGİLERİ
İstanbul İlaç Sanayi ve Tic. A.Ş.
| Satış Fiyatı | 64.12 TL [ 10 May 2024 ] |
| Önceki Satış Fiyatı | 64.12 TL [ 3 May 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699567270029 |
| Etkin Madde | Seftriakson |
| ATC Kodu | J01DD04 |
| Birim Miktar | 0.5 |
| Birim Cinsi | G |
| Ambalaj Miktarı | 1 |
| Enfeksiyona Karşı Kullanılan (Antienfektif) İlaçlar > Diğer BetaLaktam Antibakteriyeller > Seftriakson |
| Yerli ve Beşeri bir ilaçdır. |