CALQUENCE 100 mg sert kapsül (56 kapsül) Farmakolojik Özellikler
{ Acalabrutinib }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ajanlar, protein kinaz inhibitörleri ATC kodu: L01EL02
Etki mekanizması
Akalabrutinib, Bruton tirozin kinazın (BTK) seçici bir inhibitörüdür. BTK, B hücresi antijen reseptörü (BCR) ve sitokin reseptör yolaklarının sinyal molekülüdür. B hücrelerinde, BTK sinyalizasyonu B hücresinin hayatta kalmasına ve çoğalmasına neden olur ve hücresel adezyon, hücreler arası haberleşme ve kemotaksis için gereklidir.
Akalabrutinib ve aktif metaboliti ACP-5862, BTK aktif bölgesinde bir sistein kalıntısı ile kovalent bir bağ oluşturur ve minimum hedef dışı etkileşimlerle BTK'nin geri dönüşsüz inaktivasyonuna yol açar.
Farmakodinamik etkiler
Günde iki kez 100 mg akalabrutinib dozları uygulanan, B hücresi maligniteleri olan hastalarda, periferik kanda ≥%95'lik medyan kararlı durum BTK varlığı 12 saat boyunca sürdürülmüş ve önerilen doz aralığı boyunca BTK'nın inaktivasyonu ile sonuçlanmıştır.
Kardiyak elektrofizyoloji
Akalabrutinibin QTc aralığı üzerindeki etkisi, plasebo ve pozitif kontrollü randomize, çift kör kapsamlı bir QT çalışmasında 46 sağlıklı erkek ve kadın gönüllüde değerlendirilmiştir. Önerilen maksimum dozun 4 katı supraterapötik bir dozda, CALQUENCETM, QT/QTc aralığını klinik olarak ilgili herhangi bir ölçüde uzatmamıştır (örn., ≤ 10 ms) (bkz. Bölüm 4.4, 4.8 ve 5.3).
Klinik etkililik ve güvenlilik
Daha önce tedavi edilmemiş KLL hastaları
CALQUENCETM'in daha önce tedavi edilmemiş KLL'de güvenliliği ve etkililiği, 535 hastayı içeren randomize, çok merkezli, açık etiketli bir Faz 3 çalışmasında (ELEVATE-TN) değerlendirilmiştir. Hastalar, CALQUENCETM artı obinutuzumab, CALQUENCETM monoterapisi veya obinutuzumab artı klorambusil almıştır. ELEVATE-TN çalışmasına 65 yaş ve üzeri veya 18 ile 65 yaşları arasında, eşzamanlı eşlik eden diğer hastalıkları bulunan hastalar dahil edilmiştir. Hastaların 27,9'unda CrCl <60 mL/dakikadır. 65 yaşın altındaki hastaların %16,1'inin medyan CIRS-G skoru 8'dir. Çalışmada, hastaların antitrombotik ajan almasına izin verilmiştir. Varfarin veya eşdeğer K vitamini antagonistleri ile antikoagülasyon gerektiren hastalar çalışma dışı tutulmuştur.
Hastalar 1:1:1 oranında aşağıdakileri almak üzere 3 kola randomize edilmiştir.
CALQUENCETM artı obinutuzumab (CALQUENCETM + G): CALQUENCETM 100 mg, hastalık progresyonu veya kabul edilemez toksisiteye kadar 1. döngü 1.günden başlayarak günde iki kez uygulanmıştır. Obinutuzumab, maksimum 6 tedavi döngüsü için 2. kür 1.
günden itibaren uygulanmıştır. 2. döngüden başlamak üzere, 1. ve 2. günlerde 1000 mg
obinituzumab (1. günde 100 mg, 2. günde 900 mg), 8. ve 15. günlerde 1000 mg obinituzumab,
3. döngüden 7. döngüye kadar ise her döngünün 1. gününde 1000 mg obinituzumab uygulanmıştır. Her döngü 28 gündür.
CALQUENCETM monoterapisi: CALQUENCETM 100 mg, hastalık progresyonuna veya kabul edilemez toksisiteye kadar günde iki kez uygulanmıştır.
Obinutuzumab artı klorambusil (GClb): Obinutuzumab ve klorambusil maksimum 6 tedavi döngüsü süresiyle uygulanmıştır. 1. ve 2. günlerde (1. günde 100 mg ve 2. günde 900 mg), 1. döngüde 8. ve 15. günlerde obinutuzumab 1.000 mg, ardından Döngü 2'den 6'ya kadar 1. günde 1.000 mg uygulanmıştır. Klorambusil 0,5 mg/kg 1. ila 6, Döngülerin 1. ve 15. günlerinde uygulanmıştır. Her döngü 28 gündür.
Hastalar 17p delesyon mutasyon durumuna (var ya da yok), ECOG performans durumuna (0 veya 1'e karşı 2) ve coğrafi bölgeye (Kuzey Amerika ve Batı Avrupa'ya karşı diğer) göre katmanlandırılmıştır. Doğrulanmış hastalık progresyonundan sonra, GClb kolunda randomize edilen 45 hasta, CALQUENCETM monoterapisine geçmiştir. Tablo 5'te, çalışma popülasyonunun temel demografik özellikleri ve hastalık özellikleri özetlenmektedir.
Tablo 5: Daha önce tedavi edilmemiş KLL (ELEVATE-TN) hastalarında başlangıç hasta karakteristikleri
Karakteristikler | CALQUENCE + obinutuzumab N=179 | CALQUENCE monoterapisi N=179 | Obinutuzumab + klorambusil N=177 |
Yaş, yıl; medyan (aralık) | 70 (41-88) | 70 (44-87) | 71 (46-91) |
Erkek; % | 62 | 62 | 59,9 |
Beyaz ırk; % | 91,6 | 95 | 93,2 |
ECOG performans durumu 0-1; % | 94,4 | 92,2 | 94,4 |
Tanıdan itibaren medyan süre (ay) | 30,5 | 24,4 | 30,7 |
≥ 5 cm nodları içeren kitlesel (bulky) hastalık; % | 25,7 | 38 | 31,1 |
Sitogenetik/FISH Kategorisi; % |
|
|
|
17p delesyonu | 9,5 | 8,9 | 9 |
11q delesyonu | 17,3 | 17,3 | 18,6 |
TP53 mutasyonu | 11,7 | 10,6 | 11,9 |
Mutasyonsuz IGHV | 57,5 | 66,5 | 65,5 |
Kompleks karyotip (≥ 3 anormallik) | 16,2 | 17,3 | 18,1 |
Rai evresi; % |
|
|
|
0 | 1.7 | 0 | 0,6 |
I | 30,2 | 26,8 | 28,2 |
II | 20,1 | 24,6 | 27,1 |
III | 26,8 | 27,9 | 22,6 |
IV | 21,2 | 20,7 | 21,5 |
Birincil sonlanım noktası, CALQUENCETM + G koluna karşı GClb kolunun, tedavi ile ilişkili lenfositoz ile ilgili bir açıklama eklenerek Uluslararası Kronik Lenfositik Lösemi Çalıştayı (IWCLL) 2008 kriterlerine göre bir Bağımsız İnceleme Komitesi (IRC) tarafından değerlendirilen progresyonsuz sağkalımdır (PFS) (Cheson 2012). Medyan 28,3 aylık takip süresiyle IRC'nin PFS'si, GClb koluna kıyasla CALQUENCETM + G kolunda daha önce tedavi edilmemiş KLL hastalarında hastalık progresyonu veya ölüm riskinde %90 istatistiksel olarak anlamlı bir azalma
olduğunu göstermiştir. Etkililik sonuçları Tablo 6'da sunulmaktadır. PFS için Kaplan-Meier eğrileri Şekil 1'de gösterilmektedir.
Tablo 6: KLL hastalarında (ELEVATE-TN) IRC Değerlendirmelerine göre etkililik sonuçları
| CALQUENCE + obinutuzumab N=179 | CALQUENCE monoterapisi N=179 | Obinutuzumab + klorambusil N=177 |
Progresyonsuz sağkalım | |||
Olay sayısı (%) | 14 (7,8) | 26 (14,5) | 93 (52,5) |
PD, n (%) | 9 (5) | 20 (11.2) | 82 (46,3) |
Ölüm olayları (%) | 5 (2,8) | 6 (3,4) | 11 (6,2) |
Medyan (%95 GA), ay | Ulaşılmamıştır | Ulaşılmamıştır (34,2, Ulaşılmamıştır) | 22,6 (20,2, 27,6) |
HR â (%95 GA) | 0,10 (0,06, 0,17) | 0,20 (0,13, 0,30) | - |
p değeri | < 0,0001 | < 0,0001 | - |
24 aylık tahmin % (%95 GA) | 92,7 (87,4, 95,8) | 87,3 (80,9, 91.7) | 46,7 (38,5, 54,6) |
Genel sağkalım | |||
Ölüm olayları (%) | 9 (5) | 11 (6,1) | 17 (9,6) |
Tehlike Oranı (%95 GA) â | 0,47 (0,21, 1.06) | 0,60 (0,28, 1.27) | - |
En iyi genel yanıt oranı (CR + CRi + nPR + PR) | |||
ORR, n (%) (%95 GA) | 168 (93,9) (89,3, 96,5) | 153 (85,5) (79,6, 89,9) | 139 (78,5) (71.9, 83,9) |
P değeri | < 0,0001 | 0,0763 | - |
CR, n (%) | 23 (12,8) | 1 (0,6) | 8 (4,5) |
CRi, n (%) | 1 (0,6) | 0 | 0 |
nPR, n (%) | 1 (0,6) | 2 (1.1) | 3 (1.7) |
PR, n (%) | 143 (79,9) | 150 (83,8) | 128 (72,3) |
GA = güven aralığı; HR = tehlike oranı; CR = tam yanıt; CRi = tamamlanmamış kan sayımı geri kazanımı ile tam yanıt; nPR = nodüler kısmi yanıt; PD= Progresif hastalık; PR = kısmi yanıt
* IRC değerlendirmesine göre
â Katmanlı Cox-Orantılı-Tehlikeler modeline göre
a her iki kol için Medyan OS'ye ulaşılmamıştır.
Şekil 1: KLL (ELEVATE-TN) hastalarında IRC ile değerlendirilen PFS'nin Kaplan-Meier eğrisi (ITT Popülasyonu)
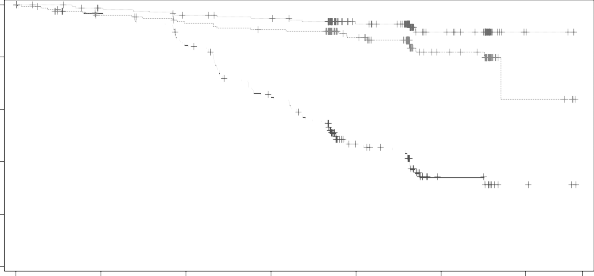
Calquence+G
Calquence
GClb
Progresyonsuz sağ kalım(%)
![]()
Randomizasyondan sonra geçen süre (ay)
Riskli hasta sayısı | ||||||||||||||
Ay | 0 | 3 | 6 | 9 | 12 | 15 | 18 | 21 | 24 | 27 | 30 | 33 | 36 | 39 |
CALQUENCE | 179 | 166 | 161 | 157 | 153 | 150 | 148 | 147 | 103 | 94 | 43 | 40 | 4 | 3 |
CALQUENCE+G | 179 | 176 | 170 | 168 | 163 | 160 | 159 | 155 | 109 | 104 | 46 | 41 | 4 | 2 |
GClb | 177 | 162 | 157 | 151 | 136 | 113 | 102 | 86 | 46 | 41 | 13 | 13 | 3 | 2 |
Obinutuzumablı veya obinutuzumabsız CALQUENCETM için PFS sonuçları, yüksek riskli özellikler dahil olmak üzere alt gruplar arasında tutarlı olmuştur. Yüksek riskli KLL popülasyonunda (17p delesyonu, 11q delesyonu, TP53 mutasyonu veya mutasyona uğramamış IGHV), obinutuzumablı veya obinutuzumabsız CALQUENCETM'in PFS Tehlike Oranları, obinutuzumab artı klorambusil karşısında sırasıyla 0,08 [%95 GA (0,04, 0,15)] ve 0,13 [%95 GA
(0,08, 0,21)] olarak bulunmuştur.
Tablo 7: PFS'nin alt grup analizi (ELEVATE-TN Çalışması)
| CALQUENCE monoterapisi | CALQUENCE+G | ||||
N | Tehlike oranı | %95 GA | N | Tehlike oranı | %95 GA | |
Tüm olgular | 179 | 0,20 | (0,13, 0,30) | 179 | 0,10 | (0,06, 0,17) |
Del 17P |
|
|
|
|
|
|
Evet | 19 | 0,20 | (0,06, 0,64) | 21 | 0,13 | (0,04, 0,46) |
Hayır | 160 | 0,20 | (0,12, 0,31) | 158 | 0,09 | (0,05, 0,17) |
TP53 mutasyonu |
|
|
|
|
|
|
Evet | 19 | 0,15 | (0,05, 0,46) | 21 | 0,04 | (0,01, 0,22) |
Hayır | 160 | 0,20 | (0,12, 0,32) | 158 | 0,11 | (0,06, 0,20) |
Del 17P veya/ve |
|
|
|
|
|
|
TP53 mutasyonu |
|
|
|
|
|
|
Evet | 23 | 0,10 | (0,03, 0,34) | 25 | (0,03, 0,34) | (0,09, 0,48) |
Hayır | 156 | 0,10 | (0,05, 0,18) | 154 | (0,05, 0,18) | (0,21, 0,61) |
| CALQUENCE monoterapisi | CALQUENCE+G | ||||
N | Tehlike oranı | %95 GA | N | Tehlike oranı | %95 GA | |
IGHV mutasyonu |
|
|
|
|
|
|
Mutasyonlu | 58 | 0,69 | (0,31, 1,56) | 74 | 0,15 | (0,04, 0,52) |
Mutasyonsuz | 119 | 0,11 | (0,07, 0,19) | 103 | 0,08 | (0,04, 0,16) |
Del 11q |
|
|
|
|
|
|
Evet | 31 | 0,07 | (0,02, 0,22) | 31 | 0,09 | (0,03, 0,26) |
Hayır | 148 | 0,26 | (0,16, 0,41) | 148 | 0,10 | (0,05, 0,20) |
Kompleks Karyotip |
|
|
|
|
|
|
Evet | 31 | 0,10 | (0,03, 0,33) | 29 | 0,09 | (0,03, 0,29) |
Hayır | 117 | 0,27 | (0,16, 0,46) | 126 | 0,11 | (0,05, 0,21) |
Daha önce en az bir tedavi almış KLL hastaları
CALQUENCETM'in nükseden veya refrakter KLL'deki güvenliliği ve etkililiği, BCL-2 inhibitörleri veya B hücresi reseptör inhibitörleri hariç en az bir tedavi almış 310 hastayı içeren randomize, çok merkezli, açık etiketli bir faz 3 çalışmada (ASCEND) değerlendirilmiştir. Hastalar CALQUENCETM monoterapisi veya araştırmacının tercihi olan idelalisib artı rituksimab veya bendamustin artı rituksimab ile tedavi edilmiştir. Çalışmada hastaların antitrombotik ajanlar almasına izin verilmiştir. Varfarin veya eşdeğer K vitamini antagonistleri ile antikoagülasyon gerektiren hastalar çalışma dışı bırakılmıştır.
Hastalar, aşağıdakilerden birini almak üzere 1:1 oranında randomize edilmiştir:
Hastalık progresyonuna ya da kabul edilemez toksisiteye kadar günde iki kez 100 mg CALQUENCETM veya
Araştırmacının tercihi:
İlk döngünün 1. gününde rituksimab 375 mg/m2 IV ile kombinasyon halinde günde iki kez 150 mg idelalisib, ardından 4 doz boyunca her 2 haftada bir 500 mg/m2 IV, ardından toplam 8 infüzyon olmak üzere 4 haftada bir 3 doz
6 döngüye kadar her 28 günlük döngünün 1. gününde rituksimab (375 mg/m2/500 mg/m2) ile kombinasyon halinde bendamustin 70 mg/m2 (her 28 günlük döngünün 1. ve 2. günü)
5.2. Farmakokinetik özellikler
Akalabrutinib ve aktif metaboliti ACP-5862'nin farmakokinetiği (FK), sağlıklı gönüllülerde veB hücresi maligniteleri olan hastalarda çalışılmıştır. Akalabrutinib, doz oransallığı gösterir ve hem akalabrutinib hem de ACP-5862, 75 ila 250 mg'lık bir doz aralığında neredeyse doğrusal FK sergiler. Popülasyon FK modellemesi, akalabrutinib ve ACP-5862'nin FK'sinin farklı B hücresi maligniteleri olan hastalar arasında benzer olduğunu göstermektedir. B hücresi maligniteleri (KLL dahil) olan hastalarda önerilen günde iki kez 100 mg dozunda, zaman eğrisi boyunca plazma konsantrasyonunun altındaki geometrik ortalama kararlı durum günlük alan (EAA) ve maksimum plazma konsantrasyonu (C) akalabrutinib için sırasıyla 1679 ngâ¢s/mL ve 438 ng/mL ve ACP-5862 için sırasıyla 4166 ngâ¢s/mL ve 446 ng/mL'dir.
Emilim:
En yüksek plazma konsantrasyonlarına kadar geçen süre (T) akalabrutinib için 0,5-1,5 saat ve ACP-5862 için 1,0 saattir. CALQUENCETM'in mutlak biyoyararlanımı %25 bulunmuştur.
Yiyeceklerin akalabrutinib üzerindeki etkisi:
Sağlıklı gönüllülerde yüksek oranda yağ ve yüksek oranda kalori içeren bir öğünle (yaklaşık 918 kalori, 59 gram karbonhidrat, 59 gram yağ ve 39 gram protein) tek bir 75 mg akalabrutinib dozunun uygulanması, aç karnına uygulanan doza kıyasla ortalama EAA'yı etkilememiştir. Sonuçta oluşan C%69 azalmış ve T1-2 saat gecikmiştir.
Dağılım:
İnsan plazma proteinine geri dönüşlü bağlanma, akalabrutinib için %99,4 ve ACP-5862 için %98,8 olmuştur. İn vitro ortalama kan/plazma oranı akalabrutinib için 0,8 ve ACP-5862 için 0,7'dir. Akalabrutinib için ortalama kararlı durum dağılım hacmi (Vss) yaklaşık 34 L'dir.
Biyotransformasyon/Metabolizma
In vitro ortamda akalabrutinib, ağırlıklı olarak CYP3A enzimleri tarafından ve küçük ölçüde de glutatyon konjugasyonu ve amid hidrolizi ile metabolize edilir. ACP-5862, plazmadaki ana metabolit olarak tanımlanmıştır ve bu metabolit, esas olarak ve akalabrutinib maruziyetinden yaklaşık 2 ila 3 kat daha yüksek geometrik ortalama maruziyet (EAA) ile CYP3A aracılı oksidasyonla metabolize edilmiştir. ACP-5862, BTK inhibisyonu açısından akalabrutinibden yaklaşık %50 daha az potenttir.
In vitro çalışmalar, akalabrutinibin klinik olarak ilgili konsantrasyonlarda CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, UGT1A1 veya UGT2B7'yi inhibe etmediğini ve bu CYP'lerin substratlarının klirensini etkilemesinin olası olmadığını göstermektedir.
In vitro çalışmalar, ACP-5862'nin klinik olarak ilgili konsantrasyonlarda CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP3A4/5, UGT1A1 veya UGT2B7'yi inhibe
etmediğini ve bu CYP'lerin substratlarının klirensini etkilemesinin olası olmadığını göstermektedir.
Taşıma proteinleri ile etkileşimler
In vitro çalışmalar, akalabrutinib ve ACP-5862'nin P-gp ve BCRP substratları olduğunu göstermektedir. Bununla birlikte, BCRP inhibitörleri ile birlikte uygulama, klinik olarak ilgili ilaç etkileşimlerine neden olma olasılığı düşüktür. Bir OATP1B1/1B3 inhibitörü (600 mg rifampin, tek doz) ile birlikte uygulama, akalabrutinib Cve EAA değerlerinde sırasıyla 1,2 kat ve 1,4 kat (N = 24, sağlıklı gönüllüler) artışa neden olmuştur ki bu farklar klinik olarak anlamlı değildir.
Akalabrutinib ve ACP-5862, klinik olarak ilgili konsantrasyonlarda P-gp, OAT1, OAT3, OCT2, OATP1B1, OATP1B3 ve MATE2-K'yi inhibe etmez. Akalabrutinib, bağırsak BCRP'yi inhibe edebilirken, ACP-5862, klinik olarak ilgili konsantrasyonlarda MATE1'i inhibe edebilir (bkz. Bölüm 4.5). Akalabrutinib, MATE1'i inhibe etmezken ACP-5862, klinik olarak ilgili konsantrasyonlarda BCRP'yi inhibe etmez.
Eliminasyon
Tek bir oral 100 mg akalabrutinib dozunu takiben, akalabrutinibin terminal eliminasyon yarılanma ömrü (t) 1 ila 2 saat olmuştur. Aktif metabolit ACP-5862'nin t'si yaklaşık 7 saattir.
Ortalama görünür oral klirens (CL/F), B hücresi maligniteleri olan hastalarda akalabrutinib için 134 L/saat ve ACP-5862 için 22 L/saattir.
Sağlıklı gönüllülerde radyoaktif işaretli tek bir 100 mg [14C]-akalabrutinib dozunun uygulanmasının ardından, dozun %84'ü feçeste ve dozun %12'si idrarda tespit edilmiş, dozun
%2'sinden azının ise değişmemiş akalabrutinib olduğu belirlenmiştir.
Hastalardaki karakteristik özellikler
Popülasyon FK analizine göre, yaş (> 18 yaş), cinsiyet, ırk (Beyaz, Afrikalı Amerikalı) ve vücut ağırlığı, akalabrutinib ve aktif metaboliti ACP-5862'nin FK'si üzerinde klinik olarak anlamlı etkilere sahip değildir.
Pediatrik popülasyon
18 yaşın altındaki hastalarda CALQUENCETM ile herhangi bir farmakokinetik çalışma yapılmamıştır.
Böbrek yetmezliği
Akalabrutinib minimal renal eliminasyona uğrar. Böbrek yetmezliği olan hastalarda farmakokinetik bir çalışma yapılmamıştır.
Popülasyon FK analizine göre, hafif böbrek yetmezliği olan (MDRD ile tahmini eGFR 60 ila 89 mL/dk/1,73 m2 arasında) 408 gönüllüde, orta derecede böbrek yetmezliği olan 109 gönüllüde (eGFR 30 ila 59 mL/dk/1,73m2 arasında), normal böbrek fonksiyonuna sahip (eGFR 90 mL/dk/1,73m2'den büyük veya buna eşit) 192 gönüllüye göre klinik olarak anlamlı bir farmakokinetik fark gözlenmemiştir. Akalabrutinibin farmakokinetiği, şiddetli böbrek yetmezliği (eGFR 29 mL/dk/1,73m2'den az) veya diyaliz gerektiren böbrek yetmezliği olan hastalarda karakterize edilmemiştir. Kreatinin düzeyleri kurumsal ULN'nin 2,5 katından daha yüksek olan hastalar klinik çalışmalara dahil edilmemiştir (bkz. Bölüm 4.2).
Karaciğer yetmezliği
Akalabrutinib, karaciğerde metabolize edilir. Özel karaciğer yetmezliği (KY) çalışmalarında, normal karaciğer fonksiyonu olan gönüllülerle (n= 6) karşılaştırıldığında, akalabrutinib maruziyeti (EAA), sırasıyla hafif (n= 6) (Child-Pugh A), orta (n=6) (Child-Pugh B) ve şiddetli (n= 8) (Child- Pugh C) karaciğer yetmezliği olan gönüllülerde 1,9 kat, 1,5 kat ve 5,3 kat artmıştır. Bununla birlikte, orta dereceli karaciğer yetmezliği grubundaki gönüllüler, ilaçların eliminasyon kapasitesi ile ilgili belirteçlerde önemli ölçüde etkilenmemişlerdir, bu nedenle, bu çalışmada orta derecede karaciğer yetmezliğinin etkisi muhtemelen olduğundan düşük hesaplanmıştır. Popülasyon FK analizine göre, hafif (n= 79) veya orta (n= 6) dereceli karaciğer yetmezliği (toplam bilirubin, ULN'nin 1,5 ila 3 katı arasında ve herhangi bir AST düzeyi) olan hastalar arasında, karaciğer fonksiyonu normal (n= 613) (toplam bilirubin ve ULN dahilinde AST düzeyi) gönüllülere kıyasla klinik olarak anlamlı bir fark gözlenmemiştir (bkz. bölüm 4.2).
5.3. Klinik öncesi güvenlilik verileri
Karsinojenisite:
Akalabrutinib ile karsinojenisite çalışmaları yapılmamıştır.
Genotoksisite/Mutajenisite/Fototoksisite:
Akalabrutinib, bakteriyel ters mutasyon analizinde, in vitro kromozom aberasyon tayininde veya
in vivo fare kemik iliği mikronükleus tayininde mutajenik etki göstermemiştir.
Akalabrutinibin 3T3 hücre hattı kullanılarak yapılan bir in vitro fototoksisite tayininde olası bir fototoksik potansiyele sahip olduğu bulunmuştur (bkz. Bölüm 4.4).
Tekrarlı doz toksisitesi
Sıçanlarda, tüm doz seviyelerinde pankreasta minimal ila hafif şiddette mikroskobik bulgular (adacıklarda hemoraji/pigment/enflamasyon/fibroz) gözlenmiştir. Sıçanlarda 30 mg/kg/gün Advers Etkinin Gözlenmediği Seviyenin (NOAEL) kullanıldığı 6 aya kadar sürelere sahip çalışmalarda, böbreklerde minimal ila hafif şiddette advers olmayan bulgular (tübüler bazofili, tübüler rejenerasyon ve enflamasyon) gözlenmiştir. Erkek ve dişi sıçanlarda NOAEL'deki ortalama maruziyet (EAA), günde iki kez 100 mg'lık önerilen dozda klinik maruziyetin sırasıyla 0,6 ve 1 katına karşılık gelir. Kronik sıçan çalışmasında geri dönüşlü böbrek (orta derecede tübüler dejenerasyon) ve karaciğer (münferit hepatosit nekrozu) bulgularının gözlemlendiği Advers
Etkinin Gözlendiği En Düşük Seviye (LOAEL) 100 mg/kg/gün olmuş ve günde iki kez 100 mg'lık önerilen dozdaki klinik maruziyetin 4,2 katı büyük bir maruziyet marjı vermiştir. Köpeklerde 9 ay süreli çalışmalarda NOAEL, önerilen klinik dozda klinik EAA'nın 3 katı maruziyete karşılık gelen 10 mg/kg/gün olmuştur. Köpeklerde 30 mg/kg/gün'de (klinik EAA'nın 9 katı) böbrekte minimal tübüler dejenerasyon, dalak ağırlıklarında hafif düşüşler ve kırmızı hücre kütlesinde geçici minimal ila hafif düşüşler ve ALT ve ALP'de artışlar gözlenmiştir. Sıçanlarda (miyokardiyal hemoraji, enflamasyon, nekroz) ve köpeklerde (perivasküler/vasküler enflamasyon) kardiyak toksisiteler, yalnızca tolere edilen maksimum dozun (MTD) üzerindeki dozlarda çalışmalar sırasında ölen hayvanlarda gözlenmiştir. Kalp bulguları olan sıçanlarda ve köpeklerde maruziyet, sırasıyla klinik EAA'nın en az 6,8 katı ve 25 katıdır. Kalp bulguları sadece MTD'nin üzerindeki dozlarda gözlendiğinden bu bulgular için geri dönüşlülük değerlendirilememiştir.
Üreme toksikolojisi
Önerilen dozda sırasıyla klinik EAA'nın 10 veya 9 katı maruziyetlerde erkek veya dişi sıçanlarda fertilite üzerinde hiçbir etki gözlenmemiştir.
Gebe sıçanlarda, günde iki kez 100 mg'lık önerilen dozda, hastalarda EAA'nın yaklaşık 9 katı maruziyetlerde, embriyofetal gelişim ve sağkalım üzerinde herhangi bir etki gözlenmemiştir. İki sıçan üreme çalışmasında, günde iki kez 100 mg klinik maruziyetin 2,3 katından büyük maruziyetlerde distosi (uzamış/zor doğum) gözlenmiştir. Fetal sıçan plazmasında akalabrutinib ve aktif metabolitinin varlığı doğrulanmıştır. Akalabrutinib ve aktif metabolitinin, emziren sıçanların sütünde mevcut olduğu görülmüştür.
Gebe tavşanlarda yapılan bir embriyofetal çalışmada, önerilen dozda insan EAA değerinden 2,4 kat daha fazla olan maternal toksisite üreten maruziyet düzeylerinde fetal vücut ağırlığında azalma ve kemikleşmede gecikme gözlenmiştir.
 Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir.
Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
 HIV ve Aids
HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan
Virüsdür). Bu virüs AIDS hastalığına sebep olur.
HIV ve Aids
HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan
Virüsdür). Bu virüs AIDS hastalığına sebep olur. |
İLAÇ GENEL BİLGİLERİ
AstraZeneca Türkiye İlaç Sanayi ve Ticaret Ltd.Şti.
| Satış Fiyatı | 94928.81 TL [ 10 May 2024 ] |
| Önceki Satış Fiyatı | 94928.81 TL [ 3 May 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Kısıtlanmış Beyaz Reçeteli bir ilaçdır. |
| Barkodu | 8699786150010 |
| Etkin Madde | Acalabrutinib |
| ATC Kodu | L01EL02 |
| Birim Miktar | 100 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 56 |
| Antineoplastik ve İmmünomodülatör Ajanlar |
| İthal ( ref. ülke : Isvec ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
En Yaygın Alerji Türleri Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir. |
 |
Doğum Sonrası Depresyonu Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından tecrübe edilen stresli bir durumdur. |
 |
Şizofrenlik Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler hakkında bilgi verecektir. |