BRAFTOVI 75 mg sert kapsül (42 adet) Farmakolojik Özellikler
{ Enkorafenib }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ilaç, protein kinaz inhibitörleri ATC kodu: L01EC03
Etki mekanizması
Enkorafenib, güçlü ve oldukça seçici bir ATP-rekabetçi küçük molekül RAF kinaz inhibitörüdür. Enkorafenibin BRAF V600E, BRAF ve CRAF enzimlerine karşı inhibe edici konsantrasyon 50 (IC50) sırasıyla 0.35, 0.47 ve 0.30 nM olarak belirlenmiştir. Enkorafenib ayrışma yarı ömrü >30 saattir ve uzun süreli pERK inhibisyonu ile sonuçlanmıştır. Enkorafenib, çeşitli mutasyona uğramış BRAF kinaz formlarını (V600E, D ve K) eksprese eden tümör hücrelerinde RAF/MEK/ERK yolunu baskılar. Spesifik olarak, enkorafenib in vitro ve in vivo BRAF V600E, D ve K mutant melanom hücre büyümesini ve BRAF V600E mutant kolorektal kanser hücresi büyümesini inhibe eder. Enkorafenib, yabanıl tip BRAF eksprese eden hücrelerde RAF/MEK/ERK sinyalini inhibe etmez.
Binimetinib ile kombinasyon
Enkorafenib ve binimetinib (MEK inhibitörü, bkz. binimetinib KÜB, bölüm 5.1), MAPK yolunu inhibe ederek daha yüksek anti-tümör aktivitesi ile sonuçlanır.
Ek olarak, enkorafenib ve binimetinib kombinasyonu, in vivo olarak BRAF V600E mutant insan melanom ksenograftlarında direncin ortaya çıkmasını önlemiştir.
Setuksimab ile kombinasyon
BRAF mutantı CRC'nin RAF inhibitörlerine direncinin ana mekanizmalarından biri, BRAF aracılığıyla sinyal iletimini atlayarak EGFR'nin yeniden aktivasyonu olarak tanımlanmıştır. Bir BRAF inhibitörü, örn. enkorafenib ve EGFR'yi hedefleyen ajanların kombinasyonları, örn. setuksimabın klinik olmayan modellerde anti-tümör etkinliğini iyileştirdiği gösterilmiştir
Klinik etkililik ve güvenlilik
BRAF V600 mutant rezeke edilemeyen veya metastatik melanom
Enkorafenib ile binimetinib kombinasyonunun güvenliliği ve etkililiği, bir BRAF testi kullanılarak tespit edilen rezeke edilemeyen veya metastatik BRAF V600 E veya K mutantı melanom olan hastalarda 2 bölümlü Faz III, randomize (1:1:1) aktif kontrollü, açık etiketli, çok merkezli bir çalışmada değerlendirilmiştir (Çalışma CMEK162B2301). Hastalarda histolojik olarak doğrulanmış kutanöz veya bilinmeyen primer melanom vardır, ancak uveal veya mukozal melanomu olanlar çalışma dışı bırakılmıştır. Hastaların, rezeke edilemeyen lokal olarak ilerlemiş veya metastatik hastalık için önceden adjuvan tedavi ve bir önceki immünoterapi sırası almalarına izin verilmiştir. BRAF/MEK inhibitörleri ile önceden tedaviye izin verilmemiştir.
Çalışma CMEK162B2301, Bölüm 1
Bölüm 1'de, çalışmadaki hastalar günde iki kez ağızdan 45 mg binimetinib artı ağızdan günde 450 mg enkorafenib (Combo 450, n = 192), ağızdan günde 300 mg enkorafenib (bundan sonra Enco 300, n = 194 olarak anılacaktır) veya günde iki kez oral yoldan 960 mg vemurafenib (bundan sonra Vem, n = 191 olarak anılacaktır) almak üzere randomize edilmiştir. Tedavi, hastalık progresyonuna veya
kabul edilemez toksisiteye kadar devam etmiştir. Randomizasyon, Amerikan Ortak Kanser Komitesi (AJCC) Aşaması (IIIB, IIIC, IVM1a veya IVM1b, IVM1c'ye karşı) ve Doğu İşbirliği Onkoloji Grubu (ECOG) performans durumu (0'a 1) ve rezeke edilemeyen veya metastatik hastalık için önceki immünoterapi tarafından katmanlara ayrılmıştır. (evet ya da hayır)
Primer etkililik sonlanım noktası, Combo 450'nin vemurafenib ile karşılaştırıldığı ve kör bir bağımsız inceleme komitesi tarafından değerlendirildiği progresyonsuz sağkalım (PFS) olmuştur. Araştırmacılar tarafından değerlendirildiği şekliyle PFS (araştırmacı değerlendirmesi) destekleyici bir analizdir. İlave ikincil sonlanı noktası, Combo 450'nin enco 300 ile PFS karşılaştırmasını içemektedir. Combo 450 ile vemurafenib veya Enco 300 arasındaki diğer ikincil etkinlik karşılaştırmaları, BIRC ve araştırmacı değerlendirmesi tarafından değerlendirildiği şekliyle genel sağ kalım (OS), objektif yanıt oranı (ORR), yanıt süresi (DoR) ve hastalık kontrol oranını (DCR) içeriyordur.
Hastaların medyan yaşı 56 (aralık 20-89), %58'i erkek, %90'ı beyaz ırktandı ve hastaların %72'sinin başlangıç ECOG performans durumu 0'dı. Çoğu hastada metastatik hastalık vardı (%95) ve Evre IVM1c idi. (%64); Hastaların %27'sinde başlangıç serum laktat dehidrogenaz (LDH) yükselmiş ve hastaların %45'inde başlangıçta tümör tutulumu olan en az 3 organ ve %3.5'inde beyin metastazı vardı. 27 hasta (%5) önceden kontrol noktası inhibitörleri (anti-PD1/PDL1 veya ipilimumab) almıştı (Combo 450 kolunda 8 hasta (%4); vemurafenib kolunda 7 hasta (%4); Enco 300 kolunda 12 hasta
(6 %) metastatik ortamda 22 hasta (Combo 450 kolunda 6 hasta; vemurafenib kolunda 5 hasta; Enco
300 kolunda 11 hasta) ve adjuvan ortamda 5 hasta (Combo 450 kolunda 2 hasta; vemurafenib kolunda
2 hasta dahil) ; Enco 300 kolunda 1 hasta.
Medyan maruziyet süresi Combo 450 ile tedavi edilen hastalarda 11.7 ay, 300 mg ekcorafenib ile tedavi edilen hastalarda 7.1 ay ve vemurafenib ile tedavi edilen hastalarda 6.2 ay olmuştur. Combo 450 için medyan rölatif doz yoğunluğu (RDI), binimetinib için %99.6 ve enkorafenib için %100 idi; medyan RDI, Enco 300 için %86,2 ve vemurafenib için %94.5 idi.
CMEK162B2301 çalışmasının 1. Bölümü, vemurafenib ile tedavi edilen hastalara kıyasla Combo 450 ile tedavi edilen hastalarda PFS'de istatistiksel olarak anlamlı bir iyileşme göstermiştir. Tablo 4 ve Şekil 1, kör bir bağımsız radyoloji komitesi tarafından verilerin merkezi olarak gözden geçirilmesine dayanan PFS ve diğer etkinlik sonuçlarını özetlemektedir.
Araştırmacı değerlendirmesine dayalı etkinlik sonuçları, bağımsız merkezi değerlendirme ile tutarlıydı. Katmanlaştırılmamış alt grup analizleri, başlangıçta LDH, ECOG performans durumu ve AJCC aşaması dahil olmak üzere Combo 450 lehine nokta tahminleri gösterdi.
Tablo 6: Çalışma CMEK162B2301, Bölüm 1: Progresyonsuz sağ kalım ve onaylanmış genel yanıt sonuçları (bağımsız merkezi inceleme)
| Enkorafenib + binimetinib n = 192 (Combo 450) | Enkorafenib
n = 194 (Enco 300) | Vemurafenib
n = 191 (Vem) |
Son tarih: 19 Mayıs 2016 | |||
PFS (birincil analiz) | |||
Olayların sayısı (İlerleyen hastalık (PD)) (%) |
98 (51.0) |
96 (49.5) |
106 (55.5) |
Ortalama, ay (%95 CI) | 14.9 (11.0, 18.5) | 9.6 (7.5,14.8) | 7.3 (5.6, 8.2) |
HR (%95 CI) (vs Vem) p değeri (katmanlı log- aşaması) | 0.54 (0.41, 0.71) < 0.001 |
|
|
HR (%95 CI) (vs. Vem) Nominal p-değeri |
| 0.68 (0.52, 0.90) 0.007 |
|
HR (%95 CI) (vs Enco 300) p değeri (katmanlı log- aşaması) | 0.75 (0.56, 1.00) 0.051 |
|
|
Onaylanmış genel yanıtlar | |||
Genel yanıt oranı, n (%) (95 % CI) | 121 (63.0) (55.8, 69.9) | 98 (50.5) (43.3, 57.8) | 77 (40.3) (33.3, 47.6) |
CR, n (%) | 15 (7.8) | 10 (5.2) | 11 (5.8) |
PR, n (%) | 106 (55.2) | 88(45.4) | 66 (34.6) |
SD, n (%) | 46 (24.0) | 53(27.3) | 73 (38.2) |
DCR, n (%) (%95 CI) | 177 (92.2) (87.4, 95.6) | 163 (84.0) (78.1, 88.9) | 156 (81.7) (75.4, 86.9) |
Yanıt süresi | |||
Ortalama, ay (%95 CI) | 16.6 (12.2, 20.4) | 14.9 (11.1, NE) | 12.3 (6.9, 16.9) |
Güncellenmiş analiz, son tarih: 07 Kasım 2017 | |||
PFS | |||
Olayların sayısı (ilerlemiş hastalık) (%) | 113 (58.9) | 112 (57.7) | 118 (61.8) |
Ortalama ay (%95 CI) | 14.9 (11.0, 20.2) | 9.6 (7.4,14.8) | 7.3 (5.6, 7.9) |
HR (%95 CI) (vs. Vem) Nominal p-değeri | 0.51 (0.39, 0.67) <0.001 |
|
|
HR (%95 CI) (vs. Vem) Nominal p-değeri |
| 0.68 (0.52, 0.88) 0.0038 |
|
HR (%95 CI) (vs Enco 300) Nominal p-değeri | 0.77 (0.59,1.00) 0.0498 |
|
|
CI = güven aralığı; CR = tam yanıt; DCR = hastalık kontrol oranı (CR+PR+SD+Non-CR/Non-PD; Non- CR/Non-PD sadece CR'ye ulaşamayan veya PD'si olan hedef lezyonu olmayan hastalar için geçerlidir); HR
= risk oranı; NE = tahmin edilemiyor; PFS = progresyonsuz sağ kalım; PR = kısmi yanıt; SD = stabil hastalık. Vem = vemurafenib.
Şekil 1: Çalışma CMEK162B2301, Bölüm 1: Kaplan-Meier bağımsız merkezi incelemeye göre progresyonsuz sağ kalım grafiği (son tarih 19 Mayıs 2016)
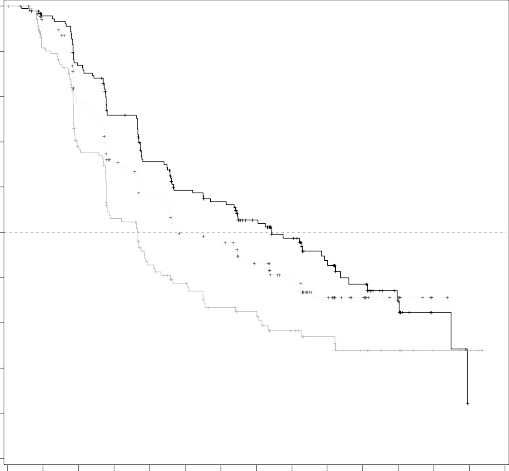
Median PFS (months) 14.9 9.6 7.3
100
90
80
Probability of Progression Free Survival(%)
70
60
50
40
30
20
10
0
0 2 4 6 8 10 12 14 16 18 20 22 24 26 28
Time (months)
|
| ||||||||||||||
| |||||||||||||||
| |||||||||||||||
Çalışma CMEK162B2301 Bölüm 1'in (son tarih 07 Kasım 2017) bir ara OS analizi, vemurafenib ile karşılaştırıldığında Combo 450 için OS'de istatistiksel olarak anlamlı bir gelişme göstermiştir (bkz. Tablo 5 ve Şekil 2).
Her tedavi kolundaki hastaların benzer bir oranı, daha sonra kontrol noktası inhibitörleriyle, esas olarak pembrolizumab, nivolumab ve ipilimumab ile tedavi görmüştür (%34,4 Combo 450 kolu,
%36,1 enkorafenib kolu, %39,8 vemurafenib kolu).
Tablo 7: Çalışma CMEK162B2301, Bölüm 1: Genel sağ kalım ara sonuçları (son tarih: 7 Kasım 2017)
| Enkorafenib + binimetinib n = 192 (Combo 450) | Enkorafenib n = 194 (Enco 300) | Vemurafenib n = 191 (Vem) |
OS | |||
Olayların sayısı (%) | 105 (54.7) | 106 (54.6) | 127 (66.5) |
Ortalama ay | 33.6 | 23.5 | 16.9 |
(%95 CI) | (24.4, 39.2) | (19.6, 33.6) | (14.0, 24.5) |
12 ayda sağ kalım | 75.5% | 74.6% | 63.1% |
(%95 CI) | (68.8, 81.0) | (67.6, 80.3) | (55.7, 69.6) |
24 ayda sağ kalım | 57.6% | 49.1% | 43.2% |
(%95 CI) | (50.3, 64.3) | (41.5, 56.2) | (35.9, 50.2) |
HR (%95 CI) (vs Vem) | 0.61 (0.47, 0.79) |
|
|
p-değeri ((katmanlı log- | < 0.0001 | ||
aşaması) |
| ||
HR (95 % CI) (vs. Enco 300) | 0.81 (0.61,1.06) |
|
|
p-değeri ((katmanlı log- | 0.061 | ||
aşaması) |
| ||
Şekil 2: Çalışma CMEK162B2301, Bölüm 1: Kaplan-Meier Genel sağ kalım (son tarih: 7 Kasım 2017)
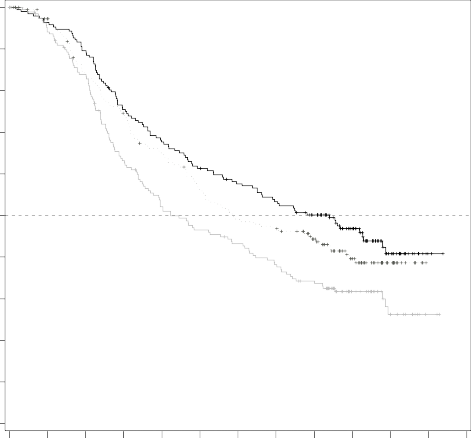
Median OS (months) 33.6 23.5 16.9
| ||||||||||||
| ||||||||||||
Yaşam Kalitesi (QoL) (son tarih: 19 Mayıs 2016)
Sağlıkla ilgili Yaşam Kalitesi, işlevsellik, melanom semptomları ve tedaviye bağlı advers reaksiyonun hasta tarafından bildirilen sonuçları (PRO) ölçümlerini araştırmak için Kanser Tedavisinin Fonksiyonel Değerlendirilmesi-Melanom (FACT M), Avrupa kanser araştırma ve tedavi organizasyon grubu temel yaşam kalitesi anketi (EORTC QLQ C30) ve EuroQoL 5 Boyut-5 Düzey sınavı (EQ 5D 5L) kullanıldı. Diğer tedavilere kıyasla Combo 450 ile tedavi edilen hastalarda FACT M ve EORTC QLQ C30'da %10'luk kesin bir bozulma önemli ölçüde gecikmiştir. FACT M skorunda kesin %10 bozulmaya kadar geçen medyan süre, Combo 450 kolunda ulaşılmadı ve fark 0.46 (%95 CI: 0.29, 0.72) için bir HR ile vemurafenib kolunda 22.1 aydı (%95 CI: 15.2, NE). EORTC QLQ C30 skorunda %10'luk kesin bozulmaya kadar geçen sürenin analizi, benzer sonuçlar verdi.
Combo 450 alan hastalar, tüm ziyaretlerde başlangıç EQ-5D-5L indeks skorundan ortalama değişiklikte herhangi bir değişiklik veya hafif bir iyileşme bildirirken, vemurafenib veya enkorafenib alan hastalar tüm ziyaretlerde düşüşler bildirmiştir (istatistiksel anlamlı farklılıklar ile). Skordaki zaman içindeki değişimin değerlendirilmesi, EORTC QLQ C30 için ve FACT M için tüm ziyaretlerde
aynı eğilimi verdi.
Çalışma CMEK162B2301, Bölüm 2
CMEK162B2301 çalışmasının 2. Bölümü, binimetinibin enkorafenib ve binimetinib kombinasyonuna katkısını değerlendirmek için tasarlanmıştır.
Günde iki kez ağızdan 45 mg binimetinib (Combo 300, n = 258) ile kombinasyon halinde kullanılan günlük 300 mg enkorafenib için PFS, Enco 300 için PFS (n = 280, Bölüm 1'den 194 hasta ve Bölüm'den 86 hasta dahil) karşılaştırılmıştır. 2). Bölüm 2'ye kayıt, tüm Bölüm 1 hastaları randomize edildikten sonra başladı.
9 Kasım 2016 kapanış tarihindeki Ön Bölüm 2 verileri, Combo 300 için 9.2 aya (%95 CI: 7.4, 11.0) kıyasla 12.9 aylık (%95 CI: 10.1, 14.0) iyileştirilmiş medyan PFS tahmini ile binimetinib'in katkısını göstermiştir, Enco 300 (Bölüm 1 ve 2) için bağımsız merkezi incelemesi (BIRC) için. Araştırmacı değerlendirmesi için benzer sonuçlar gözlemlendi.
BIRC için teyit edilen ORR, Combo 300 için %65.9 (%95 GA: 59.8, 71.7) ve Enco 300 için %50,4 (%95 CI 44.3, 5Saklamaya yönelik özel tedbirler tedbirler) idi (Bölüm 1 ve 2). BIRC için doğrulanmış yanıtlar için medyan DOR, Combo 300 için 12.7 ay [%95 GA: 9.3, 15.1] ve Enco 300 için 12.9 ay [95 % GA: 8.9, 15.5] idi. Medyan tedavi süresi, Enco 300, 52.1 hafta vs 31.5 haftaya karşı Combo 300 için daha uzundu.
Kardiyak elektrofizyoloji
Günde iki kez 45 mg binimetinib ile kombinasyon halinde günde bir kez 450 mg enkorafenibin (Combo 450) birleştirilmiş çalışmalarının güvenlilik analizinde, 450 mg enkorafenib artı binimetinib'de yeni QTc uzaması > 500 msn insidansı %0.7 (2/268) olmuştur ve enkorafenib tek ajan grubunda %2,5 (5/203). Tedavi öncesi değerlere kıyasla > 60 ms'lik QTc uzaması, enkorafenib ve binimetinib grubunda %4,9 (13/268) hastada ve enkorafenib tek ajan grubunda %3,4 (7/204) gözlenmiştir (bkz. Bölüm 4.2 ve 4.4).
BRAF V600E Mutant Metastatik Kolorektal Kanser - Çalışma ARRAY-818-302
Setuksimab ile kombinasyon halinde enkorafenib, randomize, aktif kontrollü, açık etiketli, çok merkezli bir çalışmada değerlendirilmiştir (ARRAY 818-302 BEACON CRC). Uygun hastaların, önceki 1 veya 2 rejimden sonra ilerlemiş BRAF V600E mutant metastatik kolorektal kansere sahip olması gerekiyordu. Kayıtlı hastalar, tümör RAS durumu ile ilgili olarak yerel olarak onaylanmış etikete göre setuksimab almaya uygundu. RAF inhibitörlerinin, MEK inhibitörlerinin veya EGFR inhibitörlerinin önceden kullanımı yasaklanmıştır. Randomizasyon, Doğu Kooperatif Onkoloji Grubu (ECOG) performans skoruna, irinotekan ve setuksimab kaynağının önceki kullanımına göre katmanlara ayrılmıştır.
Toplam 665 hasta, onaylı SmPC'sine (n=220) göre dozlanan setuksimab ile kombinasyon halinde günde 300 mg oral enkorafenib veya oral yoldan 45 mg binimetinib ile kombinasyon halinde günde oral olarak 300 mg enkorafenib almak üzere randomize edildi (1:1:1). günde iki kez ve setuksimab, onaylı SmPC'sine (n=224) veya Kontrole (setuksimab ile irinotekan veya setuksimab ile irinotekan/5- florourasil/folinik asit (FOLFIRI), n= 221) göre dozlandı. Tedavi, hastalık progresyonuna veya kabul edilemez toksisiteye kadar devam etti.
Etkililik sonuç ölçütleri, enkorafenib 300 mg ile setuksimab kombinasyonunu Kontrol ile karşılaştıran, kör bir bağımsız inceleme komitesi (BIRC) tarafından değerlendirildiği üzere genel sağkalım (OS) ve genel yanıt oranı (ORR) idi. Diğer etkinlik ölçütleri aşağıdaki Tablo 8'de özetlenmiştir.
Hastaların ortanca yaşı 61 (26-91 arası), %47'si erkek ve %83'ü beyazdı. Hastaların %51'inin başlangıç ECOG performans durumu 0 idi ve %51'i önceden irinotekan aldı. Hastaların %46.8'inde başlangıçta tümör tutulumu olan en az 3 organ vardı.
Setuksimab ile kombinasyon halinde 300 mg enkorafenib ile tedavi edilen hastalarda medyan maruziyet süresi 3.2 ay ve irinotekan/setuksimab veya FOLFIRI/setuksimab (Kontrol kolu) ile tedavi edilen hastalarda 1.4 ay olmuştur. 300 mg enkorafenib ve setuksimab kombinasyonu ile tedavi edilen hastalarda, medyan bağıl doz yoğunluğu (RDI) enkorafenib için %98 ve setuksimab için %93.5 olmuştur. Kontrol kolunda medyan RDI setuksimab için %85.4, irinotekan için %75.7 idi ve Folinik asit ve 5-FU alan hasta alt grubunda medyan RDI sırasıyla %75.2 ve %75 idi.
Setuksimab ile kombinasyon halinde 300 mg enkorafenib, Kontrol ile karşılaştırıldığında OS, ORR ve PFS'de istatistiksel olarak anlamlı bir iyileşme göstermiştir. Etkinlik sonuçları Tablo 8 ve Şekil 3 ve 4'te özetlenmiştir.
Araştırmacı değerlendirmesine dayalı etkinlik sonuçları, bağımsız merkezi değerlendirme ile tutarlıydı.
Tablo 8: Çalışma ARRAY-818-302: Etkililik Sonuçları
| Setuksimab ile Enkorafenib | Setuksimab ile irinotekan veya setuksimab ile FOLFIRI (Kontrol) |
Son tarih: 11 Şubat 2019 (birincil analiz) | ||
OS | ||
Hasta sayısı | 220 | 221 |
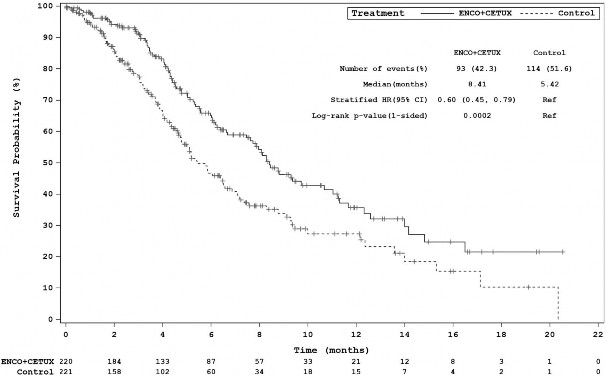
Olayların sayısı (%) | 93 (42.3) | 114 (51.6) |
Ortalama ay (95% CI) | 8.4 (7.5-11.0) | 5.4 (4.8, 6.6) |
HR (95% CI) (vs | 0.60 (0.41-0.88) |
|
Kontrol) |
| |
p-değeri | 0.0002 | |
Ortalama takip | 7.6 | 7.2 |
süresi, aylar (95% |
|
|
CI) | (Saklamaya yönelik özel tedbirler tedbirler, 9.20) | (6.1, 8.1) |
ORR (BIRC başına) | ||
Hasta sayısı | 113 | 107 |
ORR n (%) | 23 (20.4) | 2 (1.9) |
(95% CI) | (13.4, 29.0) | (0.2, 6.6) |
P-değeri | <0.0001 |
|
CR, n (%) | 6 (5.3) | 0 |
PR, n (%) | 17 (15.0) | 2 (1.9) |
SD, n (%) | 57 (50.4) | 26 (24.3) |
DCR, n (%) | 84 (74.3) | 33 (30.8) |
(95% CI) | (65.3, 82.1) | (22.3, 40.5) |
PFS (BIRC başına) | ||
Hasta sayısı | 220 | 221 |
Olayların sayısı (%) | 133 (60.5) | 128 (57.9) |
Ortalama PFS, aylar (95% CI) | 4.2 (3.7, 5.4) | 1.5 (1.5, 1.7) |
HR (95% CI) | 0.40 (0.30, 0.55 |
|
P-değeri | < 0.0001 | |
Güncellenmiş analiz, son tarih: 15 Ağustos 2019 | ||
OS | ||
Hasta sayısı | 220 | 221 |
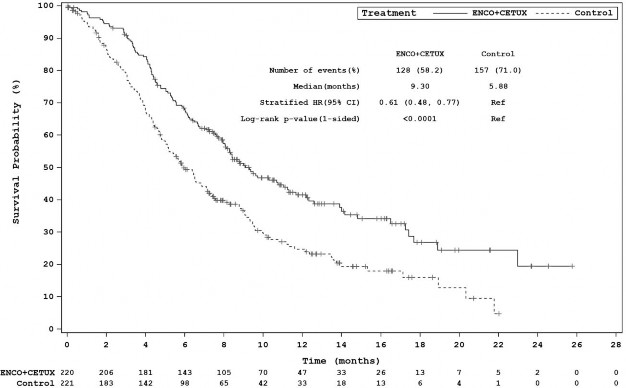
Olayların sayısı (%) | 128 (58.2) | 157 (71.0) |
Ortalama, aylar (95% CI) | 9.3 (8.0, 11.3) | 5.9 (5.1, 7.1) |
HR (95% CI) (vs | 0.61 (0.48, 0.77) |
|
Kontrol) |
| |
p-değer | < 0.0001 | |
Ortalama takip | 12.3 | 12.9 |
süresi, aylar (95% |
|
|
CI) | (11.1, 14.1) | (10.9, 14.6) |
ORR (BIRC başına) | ||
Hasta sayısı | 220 | 221 |
ORR n (%) | 43 (19.5) | 4 (1.8) |
(95% CI) | (14.5, 25.4) | (0.5, 4.6) |
p-değer | <0.0001 |
|
CR, n (%) | 7 (3.2) | 0 |
PR, n (%) | 36 (1Saklamaya yönelik özel tedbirler tedbirler) | 4 (1.8) |
SD, n (%) | 117 (53.2) | 59 (26.7) |
DCR, n (%) | 167 (75.9) | 69 (31.2) |
(95% CI) | (69.7, 81.4) | (25.2, 37.8) |
PFS (BIRC başına) | ||
Hasta sayısı | 220 | 221 |
Olayların sayısı (%) | 167 (75.9) | 147 (66.5) |
Ortalama PFS, aylar | 4.3 | 1.5 |
(95% CI) | (4.1, 5.5) | (1.5, 1.9) |
HR (95% CI) | 0.44 (0.35, 0.55) |
|
P-değer | < 0.0001 | |
CI = Güven aralığı; CR = Tam yanıt; HR = Tehlike oranı; ORR = Genel yanıt oranı; OS = Genel hayatta kalma; PR = Kısmi yanıt; SD = Stabil hastalık, DCR: Hastalık kontrol oranı (CR+PR+SD+CR-olmayan/PD- olmayan; CR-olmayan/PD-olmayan, yalnızca CR'ye ulaşamayan veya PD'si olan, ölçülemeyen bir hastalığı olan hastalar için geçerlidir.)
Şekil 3: Çalışma ARRAY-818-302: Kaplan-Meier Genel Sağkalım (son tarih: 11 Şubat 2019)
Şekil 4: Çalışma ARRAY-818-302: Genel Sağkalım Kaplan-Meier grafiği (son tarih: 15 Ağustos 2019)
Kardiyak Elektrofizyoloji
Kolorektal endikasyonda ayarlanan Faz 3 (ARRAY-818-302) güvenlik analizinde, tedavi öncesi ile karşılaştırıldığında yeni QTcF uzaması >500 msinsidansı %3.2 (7/216) ve QTcF uzaması >60 ms idi. değerleri enkorafenib + setuksimab kolundaki hastaların %8,8'inde (19/216) gözlenmiştir (bkz. Bölüm 4.2 ve 4.4).
Pediyatrik popülasyon
Avrupa İlaç Ajansı, melanomda pediyatrik popülasyonun bir veya daha fazla alt grubunda enkorafenib ile yapılan çalışmaların sonuçlarını sunma yükümlülüğünü ertelemiştir (pediyatrik kullanım hakkında bilgi için bkz. bölüm 4.2).
Avrupa İlaç Ajansı, kolorektal karsinomda pediyatrik popülasyonun tüm alt gruplarında enkorafenib ile yapılan çalışmaların sonuçlarını sunma zorunluluğundan feragat etmiştir (pediyatrik kullanım hakkında bilgi için bkz. bölüm 4.2).
5.2. Farmakokinetik özellikler
Enkorafenibin farmakokinetiği, BRAF V600E veya K mutasyonunu barındıran ileri ve rezeke edilemeyen veya metastatik kutanöz melanom dahil olmak üzere solid tümörlü hastalarda ve sağlıklı deneklerde ve BRAF V600E mutasyonlu metastatik kolorektal kanserli erişkin hastalarda incelenmiştir. Enkorafenibin farmakokinetiğinin, tekli ve çoklu dozlardan sonra yaklaşık olarak doz
doğrusal olduğu gösterilmiştir. Günde bir kez tekrarlanan dozlamadan sonra, 15 gün içinde kararlı durum koşullarına ulaşıldı. Yaklaşık 0,5'lik birikim oranı, muhtemelen CYP3A4'ün otomatik indüksiyonundan kaynaklanmaktadır. EAA'nın denekler arası değişkenliği (%CV) %12.3 ile %68.9 arasında değişmektedir.
Emilim:
Oral uygulamadan sonra enkorafenib, medyan Tdeğeri 1.5 ile 2 saatte hızla emilir. Sağlıklı deneklerde tek oral 100 mg [C] binimetinib dozunun ardından enkorafenib dozunun en az %86'sı emilmiştir. Yüksek yağlı, yüksek kalorili bir yemekle birlikte 100 mg'lık tek bir enkorafenib dozunun uygulanması, maksimum binimetinib konsantrasyonunu (C) %36 azaltırken, konsantrasyon- zaman eğrisi (EAA) altındaki alan değişmemiştir. Sağlıklı gönüllülerde yapılan bir ilaç etkileşimi çalışması, mide pH'ını değiştiren bir ajanın (rabeprazol) varlığında enkorafenib maruziyet derecesinin değişmediğini göstermiştir.
Dağılım:
Enkorafenib, in vitro olarak insan plazma proteinlerine orta derecede (%86.1) bağlanır. Sağlıklı gönüllülerde 100 mg'lık [C] tek oral enkorafenib dozunu takiben, ortalama (SD) kan-plazma konsantrasyon oranı 0,58 (0,02) ve ortalama (%CV) görünür dağılım hacmi (Vz/F)'dir. enkorafenib 226 L'dir (%32.7).
Biyotransformasyon:
Sağlıklı deneklerde 100 mg [C] tek oral enkorafenib dozunu takiben, metabolizmanın enkorafenib için ana klirens yolu olduğu bulundu (geri kazanılan radyoaktif dozun yaklaşık %88'i). Enkorafenibin baskın biyotransformasyon reaksiyonu, N-dealkilasyonuydu. Diğer ana metabolik yollar, hidroksilasyon, karbamat hidrolizi, dolaylı glukuronidasyon ve glukoz konjugat oluşumunu içeriyordu.
Eliminasyon:
Sağlıklı deneklerde 100 mg'lık [C] tek oral enkorafenib dozunun ardından, radyoaktivite hem feçeste hem de idrarda eşit olarak elimine edilmiştir (ortalama %47.2). İdrarda radyoaktivitenin
%1.8'i enkorafenib olarak atılmıştır. Enkorafenibin ortalama (%CV) görünür klerensi (CL/F) 27.9 L/saat (%9.15) olmuştur. Medyan (aralık) enkorafenib terminal yarı ömrü (T1/2) 6.32 saat olmuştur (3.74 ila 8.09 saat).
İlaç etkileşimleri
Enkorafenib ve setuksimab arasında herhangi bir ilaç ilaç etkileşimi yoktur.
CYP enzimlerinin enkorafenib üzerindeki etkisi
Enkorafenib, CYP3A4, CYP2C19 ve CYP2D6 tarafından metabolize edilir. İn vitro olarak, CYP3A4'ün insan karaciğer mikrozomlarında enkorafenibin toplam oksidatif klirensine katkıda bulunan ana enzim olduğu (~%83.3), ardından CYP2C19 ve CYP2D6'nın (sırasıyla ~%16,0 ve
%0,71) olduğu tahmin edilmiştir.
Enkorafenibin CYP substratları üzerindeki etkisi
In vitro deneyler, enkorafenib'in UGT1A1, CYP2B6, CYP2C9 ve CYP3A4/5'in nispeten güçlü bir geri dönüşümlü inhibitörü ve ayrıca zamana bağlı bir CYP3A4 inhibitörü olduğunu göstermektedir. Enkorafenib, insan primer hepatositlerinde CYP1A2, CYP2B6, CYP2C9 ve CYP3A4'ü indükledi. 1. Gün ve 15. Günde CYP2B6, CYP1A2, CYP2C9, CYP2C19 ve CYP2D6 için prob substratları ile birlikte uygulanan 450 mg enkorafenib simülasyonlarının tümü, klinik olarak anlamlı etkileşimlerin beklenmediğini göstermiştir. Bağırsak ekstraksiyonuna tabi tutulan CYP3A4 ve UGT1A1 substratları ile birlikte uygulama için, küçük ila orta düzeyde bir etkileşim beklenir. Binimetinib bir UGT1A1 substratı olsa da, bağırsak ekstraksiyonuna uğramaz ve bu nedenle enkorafenib ile DDI beklenmez. Ek olarak, binimetinib enkorafenib ile birlikte uygulandığında klinik olarak maruziyette herhangi bir farklılık gözlenmemiştir.
Taşıyıcıların encorafenib üzerindeki etkisi
Enkorafenib'in P glikoprotein (P gp) taşıyıcılarının bir substratı olduğu bulundu. Enkorafenib yüksek içsel geçirgenlik gösterdiğinden, Pgp'nin inhibisyonunun enkorafenib konsantrasyonlarında klinik olarak önemli bir artışla sonuçlanması olası değildir. Birkaç alım taşıyıcı ailesinin (OCT1, OATP1B1, OATP1B3 ve OATPB1) katılımı, ilgili taşıyıcı inhibitörleri kullanılarak in vitro olarak araştırıldı. Veriler, hepatik alım taşıyıcılarının, enkorafenib'in birincil insan hepatositlerine dağılımında yer almadığını göstermektedir.
Enkorafenib'in taşıyıcılar üzerindeki etkisi
Enkorafenib, in vitro olarak hepatik taşıyıcı OCT1'i inhibe etti, ancak klinik olarak etkili bir inhibitör olması olası değildir. İn vitro çalışmalara dayanarak, enkorafenibin klinik konsantrasyonlarda renal taşıyıcılar OCT2, OAT1, OAT3 ve hepatik taşıyıcılar OATP1B1 ve OATP1B3'ü inhibe etme potansiyeli vardır. Ek olarak, enkorafenib, beklenen klinik konsantrasyonlarda bağırsakta P-gp'yi ve BCRP'yi inhibe edebilir.
Özel popülasyonlar
Geriyatrik Popülsyon
Bir dizi farmakokinetik analize dayanarak, yaşın enkorafenib dağılım hacmi üzerinde önemli bir ortak değişken olduğu, ancak yüksek değişkenlik olduğu bulundu. Bu değişikliklerin küçük boyutu ve yüksek değişkenliği göz önüne alındığında, bunların klinik olarak anlamlı olması olası değildir ve yaşlı hastalar için doz ayarlamasına gerek yoktur.
Cinsiyet
Bir dizi farmakokinetik analize dayanarak cinsiyet, klirens veya dağılım hacmi üzerinde anlamlı bir model değişkeni olarak bulunmamıştır. Sonuç olarak, cinsiyete bağlı olarak enkorafenib maruziyetinde önemli bir değişiklik beklenmemektedir.
Vücut ağırlığı
Bir dizi farmakokinetik analize dayanarak, vücut ağırlığının klerens ve dağılım hacmi üzerinde önemli bir model değişkeni olduğu bulundu. Bununla birlikte, klirensteki küçük değişiklik büyüklüğü ve modelde tahmin edilen dağılım hacmindeki yüksek değişkenlik göz önüne alındığında, ağırlığın enkorafenib'in açığa çıkması üzerinde klinik olarak anlamlı bir etkisi olması olası değildir.
Irk
Asyalılar ve Asyalı olmayanlar arasında enkorafenibin farmakokinetği açısından klinik olarak anlamlı farklar yoktur. Diğer ırklarda veya etnik kökenlerde enkorafenibin maruziyetindeki potansiyel farklılıkları değerlendirmek için yeterli veri yoktur.
Karaciğer yetmezliği
Özel bir klinik çalışmanın sonuçları, hafif karaciğer yetmezliği olan hastalarda (Child Pugh Sınıf A) normal karaciğer fonksiyonuna sahip gönüllülere kıyasla %25 daha yüksek toplam enkorafenib maruziyetini göstermektedir. Bu, bağlanmamış enkorafenib maruziyetinde %55'lik bir artış anlamına gelir.
Enkorafenib'in farmakokinetiği, orta (Child Pugh Sınıf B) veya şiddetli (Child Pugh Sınıf C) karaciğer yetmezliği olan hastalarda klinik olarak değerlendirilmemiştir. Enkorafenib, Fizyolojik esaslı farmakokinetik (PBPK) modellemesine dayalı olarak öncelikle karaciğer yoluyla metabolize edildiğinden ve elimine edildiğinden, orta ila şiddetli karaciğer yetmezliği olan hastalarda, hafif karaciğer yetmezliği olan hastalardan daha fazla maruziyet artışı olabilir. Orta veya şiddetli karaciğer yetmezliği olan hastalarda doz önerisi yapılamaz (bkz. bölüm 4.2 ve 4.4).
Böbrek yetmezliği
Enkorafenib, minimal renal eliminasyona uğrar. Böbrek yetmezliğinin enkorafenibin farmakokinetiği üzerindeki etkisini değerlendirmek için bir klinik çalışma yapılmamıştır.
Bir dizi farmakokinetik analizde, hafif (eGFR 60 ila 90 mL/dak/1.73 m2) veya orta (eGFR 30 ila 59 mL/dak/1.73 m2) böbrek yetmezliği olan hastalarda enkorafenibin görünen total vücut klerensi (Cl/F)'nde belirgin bir eğilim gözlenmemiştir. Normal böbrek fonksiyonu olan denekler (eGFR ≥90 mL/dak/1.73 m2). Hafif ve orta derecede böbrek yetmezliği olan hastalarda CL/F'de küçük bir düşüş (≤%5) öngörülmüştür, bu da klinik olarak anlamlı olması muhtemel değildir. Enkorafenibin farmakokinetiği, şiddetli böbrek yetmezliği olan hastalarda çalışılmamıştır.
5.3. Klinik öncesi güvenlilik verileri
4 haftalık ve 13 haftalık sıçan toksisite çalışmalarında, klinik belirtiler, vücut ağırlığında azalma epididimlerde ve prostat ağırlıklarında azalma ve testis, epididim, mide ve deride mikroskobik bulgular kaydedildi. Bu bulguların kısmen tersine çevrilebilirliği, 4 haftalık bir iyileşme döneminden sonra kaydedildi. Ek olarak, 13 haftalık sıçan toksisite çalışmasında, ≥ 100 mg/kg/gün dozlarda geri dönüşümlü klinik patoloji değişiklikleri kaydedilmiştir. 4 haftalık çalışma için NOAEL oluşturulamadı. 13 haftalık çalışmada belirlenen NOAEL, insan terapötik maruziyetlerinin 10 katından fazlaydı.
4 haftalık ve 13 haftalık maymun toksisite çalışmasında, insan terapötik maruziyetlerinin biraz üzerinde izole/sporadik kusma ve diyare epizodlarının yanı sıra oftalmik lezyonlar gözlenmiştir. Oftalmik lezyonlar kısmen geri dönüşümlüydü ve retinada dış çubuklar ve koniler tabakası ile foveadaki merkezi makulada retina pigmentli epitelyum arasında bir ayrılma veya ayrılmadan oluşuyordu. Bu gözlem, insanlarda merkezi seröz benzeri koryoretinopati veya merkezi seröz retinopati olarak tanımlanana benzerdi.
Enkorafenib genotoksik değildir.
Enkorafenib ile doğurganlık çalışmaları yapılmamıştır. 13 haftalık sıçan toksikolojisi çalışmalarında, 6 mg/kg/gün'de (terapötik dozda insan maruziyetinin 5 katından fazla doz seviyesi) enkorafenib tedavisi, tübüler dejenerasyon ve oligospermi ile testis ve epididim ağırlıklarının azalmasına neden olmuştur. 13 haftalık çalışmada, en yüksek doz seviyesinde (60 mg/kg/gün) kısmi tersine çevrilebilirlik kaydedilmiştir.
Sıçanlarda yapılan embriyo-fetal gelişim çalışması, enkorafenib'in daha düşük fetal ağırlıklar ve iskelet gelişiminde gecikmeler ile fetal toksisiteye neden olduğunu göstermiştir.
Tavşanlarda yapılan embriyo-fetal gelişim çalışması, enkorafenib'in daha düşük fetal ağırlıklar ve iskelet gelişiminde geçici değişiklikler ile fetal toksisiteye neden olduğunu göstermiştir. Bazı fetüslerde aort arkında dilatasyon gözlendi.
Enkorafenib, bir in vitro 3T3 Nötr Kırmızı Alım Testinde fototoksik olmuştur. Enkorafenib, in vivo fare duyarlılaştırma deneyinde bir duyarlılaştırıcı değildir. Toplu olarak, bu veriler enkorafenib'in fototoksik potansiyel riskine ve hastalarda terapötik dozlarda minimal duyarlılık riskine sahip olduğunu göstermektedir.
 Astım
Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır.
Astım
Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
 Dış Gebelik
Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep
olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan
bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur.
Dış Gebelik
Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep
olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan
bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur. |
İLAÇ GENEL BİLGİLERİ
Pierre Fabre İlaç A.Ş.
| Satış Fiyatı | 52550.36 TL [ 10 May 2024 ] |
| Önceki Satış Fiyatı | 52550.36 TL [ 3 May 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Kısıtlanmış Beyaz Reçeteli bir ilaçdır. |
| Barkodu | 8699749000055 |
| Etkin Madde | Enkorafenib |
| ATC Kodu | L01EC03 |
| Birim Miktar | 75 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 42 |
| Antineoplastik ve İmmünomodülatör Ajanlar |
| İthal ( ref. ülke : Italya ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Doğum Sonrası Depresyonu Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından tecrübe edilen stresli bir durumdur. |
 |
Belsoğukluğu, Chlamydia ve Frengi Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve boğazda enfeksyona sebep olabilir. |
 |
Ağız Kanseri Ağız kanserinin en yaygın türleri, dudak, dil, dişetidir. Nadiren yanak içi veya damak bölgelerini de içine alır. |