ALUNBRIG 90 mg ve 180 mg film kaplı tablet TEDAVIYE başlangıç paketi (90 mg 7 TAB +180 mg 21 TAB) Farmakolojik Özellikler
{ Brigatinib }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ilaç, protein kinaz inhibitörleri ATC kodu: L01ED04
Etki mekanizması
Brigatinib, insülin-benzeri büyüme faktörü 1 reseptörü (IGF-1R) ve ALK'yı, c-ros onkogen 1(ROS1), hedefleyen bir tirozin kinaz inhibitörüdür. Brigatinib, in vitro ve in vivo tayinlerde ALK'nin otofosforilasyonunu ve aşağı yönlü sinyal proteini STAT3'ün ALK aracılı fosforilasyonunu inhibe etmiştir.
Brigatinib, farelerde EML4-ALK ve NPM-ALK füzyon proteinlerini eksprese eden hücre hatlarının in vitro proliferasyonunu inhibe etmiştir ve EML4-ALK-pozitif KHDAK ksenograft büyümesinin doza bağlı inhibisyonunu göstermiştir.
Brigatinib; G1202R ve L1196M dahil, ALK inhibitörlerine direnç ile ilişkilendirilen EML4- ALK'nın mutant formlarını eksprese eden hücrelerin canlılığını in vitro ve in vivoda inhibe etmiştir.
Kardiyak elektrofizyoloji
Çalışma 101'de, ilerlemiş malignansili 123 hastada 30 mg ila 240 mg'lık günlük brigatinib dozu ile ALUNBRİG'in QT aralığını uzatma potansiyeli değerlendirilmiştir. Başlangıç noktasından maksimum ortalama QTcF (Friedericia yöntemi ile düzeltilmiş QT) değişimi 10 milisaniyeden kısa olmuştur. Bir maruziyet-QT analizi, konsantrasyona bağlı herhangi bir QTc aralığı uzaması olmadığını öne sürmüştür.
Klinik etkililik ve güvenlilik
ALTA 1L
ALUNBRİG'in güvenliliği ve etkililiği; daha önceden ALK-hedefli bir tedavi almamış ve ilerlemiş ALK-pozitif KHDAK'lı 275 yetişkin hastada gerçekleştirilen randomize (1:1), açık etiketli, çok merkezli bir çalışmada (ALTA 1L) değerlendirilmiştir.
Uygunluk kriterleri; lokal bir bakım standardı testine dayalı olarak belgelenen bir ALK düzenlemesine sahip ve ECOG performans skoru 0-2 olan hastaların dahil edilmesine izin vermiştir.
Hastaların lokal olarak ilerlemiş veya metastatik ortamda önceden 1 taneye kadar kemoterapi rejimi almasına izin vermiştir. Leptomeningeal metastazlar da dahil olmak üzere tedavi edilmiş veya tedavi edilmemiş merkezi sinir sistemi (CNS) metastazları olan nörolojik olarak stabil hastalar uygundur. Pulmoner interstisyel hastalığı, ilaca bağlı pnömonit veya radyasyon pnömoniti öyküsü olan hastalar çalışma dışı bırakılmıştır.
Hastalar; günde bir kez 90 mg'lık dozda 7 günlük bir tedavi sonrası günde bir kez 180 mg (N=137) ALUNBRİG veya oral olarak günde iki defa krizotinib 250 mg (N= 138) almak üzere 1:1 oranında randomize edilmiştir. Randomizasyon beyin metastazı (var, yok) ve lokal olarak ilerlemiş veya metastatik hastalık için önceden kemoterapi kullanımı (evet, hayır) ile katmanlara ayrılmıştır.
Hastalık progresyonu yaşayan krizotinib kolundaki hastalara ALUNBRİG ile tedavi görmeleri için çapraz geçiş önerildi. Krizotinib koluna randomize edilen ve son analiz zamanına kadar çalışma tedavisini bırakan 121 hastanın tamamı arasında, 99 (%82) hastaya müteakip ALK tirozin kinaz inhibitörleri (TKI'ler) verildi. Krizotinib koluna randomize edilen seksen (%66) hasta, daha sonra ALUNBRİG tedavisi aldı; buna, çalışmada çapraz geçiş yapan 65 (%54) hasta da dahildir.
Majör sonuç ölçümü, Çift Kör Hakemli Bağımsız İnceleme Komitesi (BIRC) tarafından değerlendirilen Solid Tümörlerdeki Yanıt Değerlendirme Kriteri'ne (RECIST v1.1) göre progresyonsuz sağkalım (PFS) olmuştur. BIRC tarafından değerlendirilen ilave sonuç ölçümleri, doğrulanmış objektif yanıt oranını (ORR), yanıt süresini (DOR), yanıt verilene kadar geçen süreyi, hastalık kontrol oranını (DCR), intrakraniyal ORR'yi, intrakraniyal PFS'yi ve intrakraniyal DOR'u içermiştir. Araştırmacı tarafından değerlendirilen sonuçlar arasında PFS ve genel sağkalım yer almıştır.
ALTA 1L'deki temel demografik özellikler ve hastalık özellikleri şu şekildedir: medyan yaş 59 (% 32'si 65 yaş ve üzeri olmak üzere 27 â89 arası), % 59 beyaz ırk ve % 39 Asyalı, % 55 kadın, % 39 ECOG PS 0 ve % 56 ECOG PS 1, % 58 hiç sigara kullanmamış, % 93 hastalık evresi IV, % 96 adenokarsinoma histolojisine sahip, % 30 başlangıçta CNS metastazına sahip, % 14 daha önce beyin için radyoterapi almış ve % 27 daha önce kemoterapi almış. Ekstratorasik metastaz bölgelerine beyin (hastaların % 30'u), kemik (hastaların % 31'i) ve karaciğer (hastaların % 20'si) dahildir. Medyan bağıl doz yoğunluğu ALUNBRİG için %97, krizotinib içinse %99 idi.
ALUNBRİG kolunda 11 aylık medyan takip süresinde gerçekleştirilen primer analizde; ALTA 1L çalışması, BIRC tarafından PFS'de istatistiksel olarak anlamlı bir iyileşme gösteren primer sonlanma noktasını karşılamıştır.
ALUNBRİG kolunda 24,9 aylık medyan takip süresinde 28 Haziran 2019'da protokole göre belirlenmiş bir ara analiz gerçekleştirilmiştir. ITT popülasyonunda BIRC'ye göre medyan PFS, ALUNBRİG kolunda 24 ay ve krizotinib kolunda 11 aydı (HR =0,49 [%95 GA (0,35, 0,68)], p
<0,0001).
ALUNBRİG kolunda medyan 40.4 aylık takip süresinde gerçekleştirilen son hasta son temas tarihi olan 29 Ocak 2021 ile protokolde belirtilen nihai analizin sonuçları aşağıda sunulmuştur.
Tablo 4: ALTA 1L'deki Etkililik Sonuçları (ITT Popülasyonu)
Etkililik Parametreleri | ALUNBRİG N = 137 | Krizotinib N = 138 |
Medyan takip süresi (ay) | 40,4 (aralık: 0â52,4) | 15,2 (aralık: 0,1â51,7) |
Birincil etkililik parametreleri | ||
PFS (BIRC) | ||
Olaylı Hasta Sayısı, n (%) | 73 (%53,3) | 93 (%67,4) |
İlerleyen Hastalık, n (%) | 66 (%48,2)b | 88 (%63,8)c |
Ölüm, n (%) | 7 (%5,1) | 5 (%3,6) |
Medyan (ay cinsinden) (%95 CI) | 24,0 (18,5, 43,2) | 11,1 (9,1, 13) |
Tehlike oranı (%95 CI) | 0,48 (0,35, 0,66) | |
Log-rank p-değeri | <0,0001 | |
İkincil etkililik parametreleri | ||
Doğrulanmış Objektif Yanıt Oranı (BIRC) | ||
Yanıtlayanlar, n (%) (%95 CI) | 102 (%74,5) (66,3, 81,5) | 86 (%62,3) (53,7, 70,4) |
p-değeri | 0,033 | |
Tam Yanıt, % | %24,1 | %13 |
Kısmi Yanıt, % | %50,4 | %49,3 |
Doğrulanmış Yanıtın Süresi (BIRC) | ||
Ortanca (ay) (%95 CI) | 33,2 (22,1, NE) | 13,8 (10,4, 22,1) |
Genel Sağkalım | ||
Olay Sayısı, n (%) | 41 (%29,9) | 51 (%37) |
Medyan (ay cinsinden) (%95 CI) | NE (NE, NE) | NE (NE, NE) |
Tehlike oranı (%95 CI) | 0,81 (0,53, 1,22) | |
Günlük sıralaması p değeri | 0,3311 | |
36 ayda Genel Sağkalım | %70,7 | %67,5 |
Şekil 1: ALTA 1L'de BIRC Tarafından Progresyonsuz Sağkalımın Kaplan-Meier Çizimi
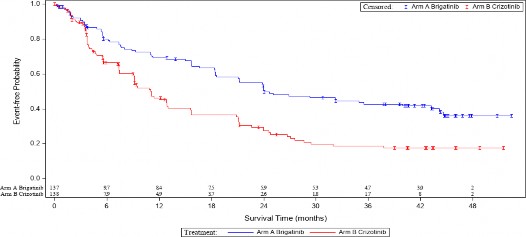
Bu şekildeki sonuçlar, son hasta son temas tarihi olan 29 Ocak 2021 ile yapılan son etkililik analizine dayanmaktadır.
Başlangıçta herhangi bir beyin metastazı olan hastalarda ve ölçülebilir beyin metastazları (en uzun çap ≥ 10 mm) olan hastalarda RECIST v1.1'e göre intrakraniyal etkililiğim BIRC değerlendirmesi Tablo 5'te özetlenmiştir.
Tablo 5: ALTA 1L'deki Hastalarda BIRC-Değerlendirmeli İntrakraniyal Etkililik
Etkililik Parametreleri | Başlangıçta Ölçülebilir Beyin Metastazları Olan Hastalar | |
ALUNBRİG N= 18 | Krizotinib N= 23 | |
Doğrulanmış İntrakraniyal Objektif Yanıt Oranı | ||
Yanıtlayan, n (%) (% 95 CI) | 14 (% 77,8) (52,4, 93,6) | 6 (% 26,1) (10,2, 48,4) |
p-değeri | 0.0014 | |
Tam yanıt %'si | % 27,8 | %0 |
Kısmi yanıt %'si | % 50 | % 26,1 |
Doğrulanmış İntrakraniyal Yanıt Süresi | ||
Medyan (ay) (% 95 CI) | 27,9 (5,7, NE) | 9,2 (3,9, 9,2) |
| Başlangıçta Herhangi bir Beyin Metastazı Olan Hastalar | |
ALUNBRİG N= 47 | ALUNBRİG N= 49 | |
Doğrulanmış İntrakraniyal Objektif Yanıt Oranı | ||
Yanıtlayan, n (%) (% 95 CI) | 31 (% 66) (50,7, 79,1) | 7 (%14,3) (5,9, 27,2) |
p-değeri | <0.0001 | |
Tam yanıt (%) | % 44,7 | % 2 |
Kısmi yanıt (%) | % 21,3 | % 12,2 |
Doğrulanmış İntrakraniyal Yanıt Süresi | ||
Medyan (ay) (% 95 CI) | 27,1 (16,9, 42,8) | 9,2 (3,9, NE) |
İnkraniyal PFS | ||
Olayları olan hasta sayısı, n (%) | 27 (%57,4) | 35 (%71,4) |
Progresif hastalık, n (%) | 27 (%57,4) | 32 (%65,3) |
Ölüm, n (%) | 0 (%0) | 3 (%6,1) |
Medyan (ay) (% 95 CI) | 24 (12,9, 30,8) | 5,5 (3,7, 7,5) |
Tehlike oranı (% 95 CI) | 0,29 (0,17, 0,51) | |
Log-sıra p-değeri | < 0,0001 | |
CI= Güven aralığı; NE= Tahmin edilebilir değildir.
Bu tablodaki sonuçlar, son hasta son temas tarihi olan 29 Ocak 2021 ile yapılan son etkililik analizine dayanmaktadır. Lokal olarak ilerlemiş veya metastatik hastalık için önceden kemoterapi varlığı ile sırasıyla log-rank testi ve Cochran Mantel-Haenszel testi ile katmanlara ayrılmıştır.
≥ % 20 intrakraniyal hedef lezyon çapı büyümesi veya hedef olmayan intrakraniyal lezyonların kesin progresyonu) veya ölüm veya sansürleme tarihine kadar ölçülmüştür.
ALTA
ALUNBRİG'in güvenliliği ve etkililiği; krizotinib tedavisine progresyon gösteren, lokal olarak ilerlemiş veya metastatik ALK-pozitif KHDAK'lı 222 yetişkin hastada gerçekleştirilen randomize (1:1), açık etiketli, çok merkezli bir çalışmada (ALTA) değerlendirilmiştir.
Uygunluk kriterleri; valide edilmiş bir teste dayalı olarak belgelenen bir ALK düzenlemesine sahip öncesinde kemoterapi almış, ECOG Performans Durumu 0-2 olan ve hastaların dahil edilmesine izin vermiştir. İlave olarak, merkezi sinir sistemi (CNS) metastazı olan hastalar, nörolojik olarak stabil olmaları ve kortikosteroid dozunda artış gerektirmedikleri sürece, dahil edilmiştir. Pulmoner interstiyal hastalık veya ilaç ile ilişkili pnömoni geçmişi olan hastalar hariç tutulmuştur. Pulmoner interstisyel hastalığı veya ilaca bağlı pnömonit öyküsü olan hastalar çalışma dışı bırakılmıştır.
Hastalar; günde bir kez 90 mg (90 mg'lık rejim, N=112) veya günde bir kez 90 mg'lık dozda 7 günlük bir tedavi sonrası günde bir kez 180 mg (180 mg'lık rejim, N=110) ALUNBRİG almak üzere 1:1 oranında randomize edilmiştir. Medyan takip süresi 22,9 ay olmuştur. Randomizasyon beyin metastazı (var, yok) ve krizotinib tedavisine en iyi cevap (tam veya kısmi yanıt, diğer herhangi bir yanıt/bilinmeyen) ile katmanlara ayrılmıştır.
Majör sonuç ölçümü, araştırmacı tarafından değerlendirilen Solid Tümörlerdeki Yanıt Değerlendirme Kriteri'ne (RECIST v1.1) göre objektif yanıt oranını (ORR) doğrulamıştır. İlave sonuç ölçümleri; Bağımsız İnceleme Komitesi (IRC) tarafından değerlendirilen doğrulanmış ORR'yi, yanıt verilene kadar geçen süreyi; progresyonsuz sağkalımı (PFS); yanıt süresini (DOR); genel sağkalımı ve IRC tarafından değerlendirilen intrakraniyal ORR, intrakraniyal DOR'yi içermiştir.
ALTA'daki temel demografik özellikler ve hastalık özellikleri şu şekildedir: medyan yaş 54 (% 23'ü 65 yaş ve üzeri olmak üzere 18 â82 arası), % 67 beyaz ırk ve % 31 Asyalı, % 57 kadın, % 36 ECOG PS 0 ve % 57 ECOG PS 1, % 7 ECOG PS2, % 60 hiç sigara kullanmamış, % 35 daha evvel sigara kullanmış, %5 mevcut durumda sigara içen, % 98 Evre IV, % 97 adenokarsinom ve % 74 daha önce kemoterapi almış. Ekstratorasik metastazların en yaygın olduğu bölgelere % 69 beyin (% 62'si daha önce beynine radyasyon almış), % 39 kemik ve % 26 karaciğer dahildir.
ALTA analizinden elde edilen etkililik sonuçları Tablo 6'da özetlenmektedir ve araştırmacı tarafından değerlendirilen PFS için Kaplan-Meier (KM) eğrisi Şekil 2'de gösterilmektedir.
Tablo 6: ALTA'daki Etkililik Sonuçları (ITT Popülasyonu)
Etkililik parametreleri | Araştırmacı Değerlendirmesi | IRC Değerlendirmesi | ||
90 mg'lık rejim* N= 112 | 180 mg'lık rejim N= 110 | 90 mg'lık rejim* N= 112 | 180 mg'lık rejim N= 110 | |
Objektif yanıt oranı | ||||
(%) | % 46 | % 56 | % 51 | % 56 |
CI | (35, 57) | (45, 67) | (41, 61) | (47, 66) |
Yanıt süresi | ||||
Medyan (ay) | 1,8 | 1,9 | 1,8 | 1,9 |
Yanıt süresi | ||||
Medyan (ay) | 12,0 | 13,8 | 16,4 | 15,7 |
% 95 güven aralığı | (9,2, 17,7) | (10,2, 19,3) | (7,4, 24,9) | (12,8, 21,8) |
Progresyonsuz sağkalım | ||||
Medyan (ay) | 9,2 | 15,6 | 9,2 | 16,7 |
% 95 güven aralığı | (7,4, 11,1) | (11,1, 21) | (7,4, 12,8) | (11,6, 21,4) |
Genel sağkalım | ||||
Medyan (ay) | 29,5 | 34,1 | NA | NA |
%95 güven aralığı | (18,2, NE) | (27,7, NE) | NA | NA |
12 aylık sağkalım olasılığı (%) | % 70,3 | % 80,1 | NA | NA |
CI= Güven aralığı; NE = tahmin edilebilir değildir; NA= Uygulanamaz
*Günde bir kez 90 mg'lık rejim
Şekil 2: Araştırmacının Değerlendirdiği Sistemik Progresyonsuz Sağkalım: Tedavi Kolu ile ITT Popülasyonu (ALTA)
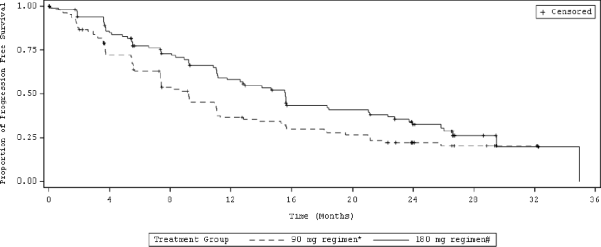
Kısaltmalar: ITT = Tedavi amaçlı
Not: Progresyonsuz sağkalım tedavinin başlangıcından, ilk olarak hangisinin meydana geldiğine bakılmaksızın hastalık progresyonunun ilk olarak kanıtlandığı veya ölüme kadar olan tarihe kadar geçen süre olarak belirlenmiştir.
*90 mg günlük tedavi rejimi
ALTA'da başlangıçtaki ölçülebilir beyin metastazları (en uzun çap ≥10 mm) olan hastalardaki intrakraniyal ORR ve intrakraniyal yanıt süresinin IRC değerlendirmeleri Tablo 7'de özetlenmektedir.
Tablo 7: Başlangıçta Ölçülebilir Beyin Metastazı olan Hastalardaki İntrakraniyal Etkililik
IRC ile değerlendirilen etkililik parametresi | Başlangıçtaki Ölçülebilir Beyin Metastazına Sahip Hastalar | |
90 mg'lık rejim* (N=26) | 180 mg'lık rejim (N=18) | |
İntrakraniyal objektif yanıt oranı | ||
(%) | % 50 | % 67 |
%95 güven aralığı | (30, 70) | (41, 87) |
İntrakraniyal hastalık kontrol oranı | ||
(%) | % 85 | % 83 |
%95 güven aralığı | (65, 96) | (59, 96) |
İntrakraniyal yanıt sürekliliği | ||
Medyan (ay) | 9,4 | 16,6 |
%95 güven aralığı | (3,7, 24,9) | (3,7, NE) |
%CI = Güven aralığı; NE = tahmin edilebilir değildir
*Günde bir kez 90 mg'lık rejim
Başlangıçta beyin metastazı olan hastalarda, intrakraniyal hastalık kontrol oranı 90 mg kolunda (N= 81) % 77.8 (% 95 CI: 67,2 â 86,3) ve 180 mg kolunda (N= 74) % 85,1 (% 95 CI: 75-92,3) olmuştur.
Çalışma 101
Ayrı bir doz bulma çalışmasında, ALK-pozitif KHDAK'ı olan ve krizotinibde progresyon gösteren 25 hastaya günde bir defa 90 mg'lık dozda 7 günlük bir tedavi sonrası günde 1 defa 180 mg ALUNBRİG uygulanmıştır. Bu hastaların 19'u araştırmacı değerlendirmesi ile doğrulanmış objektif bir yanıt göstermiştir (% 76; % 95 CI: 55, 91) ve yanıt veren 19 hasta arasında yanıtın KM tahmini medyan süresi 26,1 ay (% 91 CI: 7,9, 26,1) olmuştur. KM medyan PFS 16,3 aydır (% 95 CI: 9,2,
NE) ve 12 aylık genel sağkalım olasılığı % 84.0 (% 95 CI: 62,8, 93,7) olmuştur.
Pediyatrik popülasyon
Avrupa İlaç Ajansı, akciğer karsinomasında (küçük hücreli ve küçük hücreli dışı karsinoma) pediyatrik popülasyonun tüm alt gruplarında ALUNBRİG ile gerçekleştirilen çalışmaların sonuçlarını sunma yükümlülüğünden muaf tutmuştur (pediyatrik kullanıma ilişkin bilgi için bölüm 4.2'ye bakınız).
5.2. Farmakokinetik özellikler
Genel ÖzelliklerEmilim:
Çalışma 101'de, hastalara brigatinibin tekli oral doz (30 â 240 mg) uygulamasını takiben pik konsantrasyonu için medyan süre (T), dozlama sonrası 1-4 saat aralığında değişmiştir. Tekli bir dozdan sonra ve kararlı durumda, sistemik maruziyet 60 mg â 240 mg/gün doz aralığı boyunca doz orantısaldır. Tekrarlı dozlama sonrasında makul bir akümülasyon gözlenmiştir (geometrik ortalama akümülasyon oranı: 1,9 â 2,4). 90 mg ve 180 mg'lık günlük dozlarda brigatinibin geometrik ortalama kararlı durum C'ı sırasıyla 552 ve 1452 ng/mL'dir ve ilgili EAAsırasıyla 8,165 ve 20,276 h.ng/mL'dir. Brigatinib P-gp ve BCRP taşıyıcı proteinlerinin bir substratıdır.
Yüksek-yağlı öğün sonrası brigatinib uygulanan sağlıklı gönüllülerde; bir gece boyunca açlık sonrası Cve EAA ile karşılaştırıldığında; EAA üzerinde bir etkisi olmaksızın brigatinib C'ı
% 13'e indirgenmiştir. Brigatinib yemeklerle birlikte veya yemekten bağımsız olarak uygulanabilir.
Dağılım:
Brigatinib insan plazma proteinlerine orta derecede (% 91) bağlanmıştır ve bağlanma konsantrasyona bağlı değildir. Kan-plazma konsantrasyonu oranı 0,69'dur. Hastalara günde bir defa 180 mg brigatinib uygulanmasını takiben; kararlı durumda brigatinib dağılımının görünür geometrik hacim ortalaması (VF) 307 L olmuştur ve bu durum dokulara orta derecede bir dağılım olduğunu göstermektedir.
Biyotransformasyon:
İn vitro çalışmalar; brigatinibin primer olarak CYP2C8 ve CYP3A4 ile, ve çok daha düşük bir düzeyde CYP3A5 ile metabolize olduğunu göstermiştir.
Oral olarak 180 mg'lık tekli [C]-brigatinib dozunun sağlıklı gönüllülere uygulanmasını takiben; N-demetilasyon ve sistein konjugasyonu iki majör metabolik klerens yolu olmuştur. Kombine edilmiş idrar ve dışkıda, radyoaktif dozun % 48, % 27 ve % 9,1'i sırasıyla değişmemiş brigatinib, N-desmetik brigatinib (AP26123) ve brigatinib sistein konjugatı olarak atılmıştır. Değişmemiş brigatinib, AP26123 (% 3,5) ile birlikte dolaşımdaki majör radyoaktif bileşenlerdir (% 92), ayrıca primer metabolit in vitroda da gözlenmiştir. Hastalarda; kararlı durumda, AP26123'ün plazma EAA'sı brigatinib maruziyetinin % 10'undan az olmuştur. In vitro kinaz ve hücresel tayinlerde, AP26123 metaboliti brigatinibden yaklaşık 3-kat daha düşük bir potens ile ALK'yı inhibe etmiştir.
Eliminasyon:
Günde bir defa 180 mg brigatinib verilen hastalarda; kararlı durumda brigatinibin görünür geometrik ortalama oral klerensi (CL/F), 8,9 L/saat ve medyan plazma eliminasyon yarılanma süresi 24 saattir.
Brigatinibin primer atılım yolu dışkı yoluyladır. 6 sağlıklı erkek gönüllüye [C] brigatinibin tekli 180 mg oral dozunun uygulanmasını takiben; uygulanan dozun % 65'i dışkıda ve % 25'i idrarda saptanmıştır. Değişmemiş brigatinib dışkı ve idrarda toplam radyoaktivitenin sırasıyla % 41 ve % 86'sını temsil etmiştir, geri kalan kısım metabolitler olmuştur.
Hastalardaki karakteristik özellikler
Karaciğer yetmezliği:
Brigatinibin farmakokinetiği; normal karaciğer fonksiyonuna sahip sağlıklı gönüllülerde (N=9), hafif karaciğer yetmezliği olan (Child-Pugh sınıf A, N=6), orta derecede karaciğer yetmezliği olan (Child-Pugh sınıf B, N=6) veya şiddetli karaciğer yetmezliği olan (Child-Pugh sınıf C, N=6) hastalarda karakterize edilmiştir. Brigatinib farmakokinetiği; normal karaciğer fonksiyonuna sahip sağlıklı gönüllüler ve hafif (Child-Pugh sınıf A) veya orta dereceli (Child-Pugh sınıf B) karaciğer yetmezliği olan hastalar arasında benzerdir. Normal karaciğer fonksiyonuna sahip sağlıklı gönüllüler ile karşılaştırıldığında, şiddetli karaciğer yetmezliği (Child-Pugh sınıf C) olan hastalarda bağlanmamış EAA% 37 daha yüksek olmuştur (bkz. bölüm 4.2.).
Böbrek yetmezliği:
Brigatinib farmakokinetiği; popülasyon farmakokinetik analizleri esas alındığında, normal böbrek fonksiyonuna sahip hastalar ve hafif â orta dereceli böbrek yetmezliği (eGFR ≥ 30 mL/dk) olan hastalarda benzerdir. Bir farmakokinetik çalışmada; normal böbrek fonksiyonuna sahip hastalar (eGFR ≥ 90 mL/dk, N=8) ile karşılaştırıldığında, şiddetli böbrek yetmezliği (eGFR <30 mL/dk, N=6) olan hastalarda bağlanmamış EAA% 94 daha yüksek olmuştur (bkz. bölüm 4.2.).
Irk ve cinsiyet:
Popülasyon farmakokinetik analizleri; ırk veya cinsiyetin brigatinib farmakokinetikleri üzerinde
herhangi bir etkisi olmadığını göstermiştir.
Yaş, vücut ağırlığı ve albümin konsantrasyonları:
Popülasyon farmakokinetik analizleri; vücut ağırlığı, yaş ve albümin konsantrasyonunun brigatinib farmakokinetikleri üzerinde klinik olarak anlamlı bir etkisi olmadığını göstermiştir.
5.3. Klinik öncesi güvenlilik verileri
Brigatinib ile gerçekleştirilen güvenlilik farmakoloji çalışmalarında pulmoner etkiler (solunum hızında değişim; insan C'ının 1-2 katı), kardiyovasküler etkiler (kalp atım hızında ve kan basıncında değişim; insan C'ının 0,5 katı) ve renal etkiler (renal fonksiyonda azalma; insan C'ının 1-2,5 katı) için potansiyel tespit edilmiş; ancak QT uzaması veya nörofonksiyonal etki potansiyeli görülmemiştir.
Klinik kullanımla ilişkili olabilecek şekilde klinik maruziyet seviyelerine benzer maruziyet seviyelerinde hayvanlarda görülen advers reaksiyonlar gastrointestinal sistem, kemik iliği, gözler, testisler, karaciğer, böbrek, kemik ve kalple ilgilidir. Bu etkiler genellikle dozlamanın yapılmadığı iyileşme periyodu boyunca geri dönüşümlüdür; ancak, gözler ve testislerdeki etkiler iyileşmenin olmaması nedeniyle belirgin istisnalardır. Tekrarlı doz toksisite çalışmalarında, maymunlarda insan EAA'sının 0,2 katı ve üzerinde akciğer değişimleri (köpüksü alveolar makrofajlar) görülmüştür; ancak bunlar minimal düzeyde olup normal maymunlarda arka plan bulguları olarak rapor edilenlere benzer özellik göstermiştir ve bu maymunlarda solunum rahatsızlığına dair herhangi bir klinik kanıt bulunmamıştır.
Brigatinib ile karsinojenisite çalışmaları gerçekleştirilmemiştir.
Brigatinib, bakteriyel ters mutasyon (Ames) veya memeli hücre kromozomal aberasyon testlerinde in vitroda mutajenik değildir; ancak sıçan kemik iliği mikronukleus testinde mikronukleus sayısını küçük miktarda arttırmıştır. Mikronukleus indüksiyonunun mekanizması anormal kromozom segragasyonudur (aneugenisite) ve kromozomlar üzerinde klastojenik bir etkisi yoktur. Bu etki günlük 180 mg dozda insan maruziyetinin yaklaşık 5 katında gözlemlenmiştir.
Brigatinib erkek fertilitesini bozabilir. Tekrarlı-doz hayvan çalışmalarında testiküler toksisite gözlenmiştir. Sıçanlardaki bulgular; düşük ağırlıklı testisler, seminal veziküller ve prostat bezini ve testiküler tübüler dejenerasyonu içermektedir; bu etkiler, iyileşme dönemi boyunca geri dönüşümlü olmamıştır. Maymunlardaki bulgular; mikroskobik hipospermatogenez bulgusu ile birlikte testislerin boyutunda küçülmeyi içermektedir; bu etkiler, iyileşme dönemi boyunca geri dönüşümlü olmuştur. Genel olarak; sıçan ve maymunlarda erkek üreme organları üzerindeki bu etkiler, günde bir kez 180 mg'lık doz alan hastalarda gözlenen EAA değerinin 0,2 katı ve üzeri maruziyetlerde meydana gelmiştir. Sıçan ve maymunlardaki genel toksikoloji çalışmalarında dişi üreme organları üzerinde belirgin bir advers etki gözlenmemiştir.
Organogenez sırasında gebe sıçanlara günlük brigatinib dozlarının verildiği bir embryo-fötal gelişim çalışmasında; günde bir kez 180 mg dozda insan maruziyetindeki EEA değerinin yaklaşık 0,7 katı gibi düşük dozlarda doza bağlı iskelet anormallikleri gözlenmiştir. Bulgular arasında embriyo-letalite, fötal gelişimde yavaşlama ve iskelet değişimleri yer almaktadır.
 Şizofrenlik
Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu
sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler
hakkında bilgi verecektir.
Şizofrenlik
Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu
sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler
hakkında bilgi verecektir. |
 Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış.
Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
İLAÇ GENEL BİLGİLERİ
Takeda İlaçları ve Ticaret Ltd.Şti.
| Satış Fiyatı | 71929.98 TL [ 22 Apr 2024 ] |
| Önceki Satış Fiyatı | 71929.98 TL [ 15 Apr 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Kısıtlanmış Beyaz Reçeteli bir ilaçdır. |
| Barkodu | 8699456090189 |
| Etkin Madde | Brigatinib |
| ATC Kodu | L01ED04 |
| Birim Miktar | 90+180 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 7+21 |
| Antineoplastik ve İmmünomodülatör Ajanlar |
| İthal ( ref. ülke : Avusturya ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Ağız Kanseri Ağız kanserinin en yaygın türleri, dudak, dil, dişetidir. Nadiren yanak içi veya damak bölgelerini de içine alır. |
 |
Doğum Sonrası Depresyonu Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından tecrübe edilen stresli bir durumdur. |
 |
Aşırı Alkol Kullanımı, Alkolizm Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür. Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması gerekmez. |