ADEPIRON tablet 500 mg 20 tablet Farmakolojik Özellikler
{ Metamizol Sodyum }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
:
Farmakoterapötik grubu: Pirazolonlar ATC Kodu: N02BB02
Metamizol analjezik, antipiretik ve antispazmodik özellikleri olan bir pirazolon türevidir . Metamizol büyük olasılıkla kombine bir santral ve periferik etki şekline sahiptir. Afferent lifler, omur ilik ve periakuaduktal gri madde düzeyindeki santral etki mekanizmaları metamizolün analjezik etkisine katkıda bulunabilir.
metabolitinin (4-N-metilaminoantipirin) kombine bir santral ve periferik etki modeline sahip olabileceğini göstermektedir.
5.2. Farmakokinetik özellikler
:
Metamizol ve metabolitlerinin farmakokinetiği tam olarak araştırılmamıştır. Fakat aşağıdaki
bilgiler verilebilir:
Emilim: Oral uygulamadan sonra metamizol tamamen aktif metaboliti olan 4-N-
metilaminoantipirine (MAA) hidrolize olur. MAA'nın mutlak biyoyararlanımı yaklaşık olarak
%90'dır ve oral uygulama sonrası intravenöz uygulamaya oranla biraz daha yüksektir. Metamizol besinlerle birlikte alındığında MAA'nın farmakokinetiği fark edilir bir değişikliğe uğramaz.
Biyotransformasyon: Klinik etkiyi temel olarak MAA ve bir dereceye kadar da 4- aminoantipirin (AA) sağlar. AA'nın EAA değerleri MAA'nın EAA değerinin yaklaşık % 25'ini oluşturur. 4-N-asetilaminoantipirin (AAA) ve 4-N-formilaminoantipirin (FAA) gibi metabolitlerin klinik etkileri yok gibi görünmektedir. Tüm metabolitler için lineer olmayan bir farmakokinetik gözlenir. Bu bulgunun klinik önemi hakkında bir yargıya varılabilmesi için daha fazla çalışmaya ihtiyaç vardır. Kısa dönemli tedavide metabolitlerin birikiminin fazla bir klinik anlamı yoktur.
Metamizol plasenta bariyerini geçer.
Dağılım: Proteine bağlanma düzeyleri MAA için % 58, AA için % 48, FAA için % 18 ve AAA için %14'dür. Bir intravenöz doz sonrası metamizolün plazma yarılanma ömrü yaklaşık 14 dakikadır.
Eliminasyon: Radyoaktif işaretli intravenöz dozun yaklaşık % 96'sı idrar, yaklaşık % 6'sı ise feçes yoluyla atılır. Tek bir oral dozdan sonra metabolitlerin % 85'i idrarla atılmış ve bunun
% 3 ± % 1'i MAA, % 6 ± % 3'ü AA, % 26 ± % 8'i AAA ve % 23 ± % 4'ü FAA'dan
oluşmuştur. 1 g'lık tek bir oral metamizol dozundan sonra renal klerens MAA için 5 ml±2 ml/dk., AA için 38 ml±13 ml/dk., AAA için 61 ml ± 8 ml/dk., ve FAA için 49 ml ± 5 ml/dk olmuştur. Aynı dozdan sonraki plazma yarılanma ömürleri de MAA için 2,7 ± 0,5 saat, AA için 3,7 ± 1,3 saat, AAA için 9,5 ± 1,5 saat ve FAA için 11,2 ± 1,5 saat olmuştur. Metamizol metabolitleri anne sütüne geçerler.
Doğrusallık/doğrusal olmayan durum: Tüm metabolitler için lineer olmayan bir farmakokinetik gözlenir. Bu bulgunun klinik önemi hakkında bir yargıya varılabilmesi için daha fazla çalışmaya ihtiyaç vardır.
Hastalardaki karakteristik özellikler
Geriyatrik popülasyon:
Yaşlı hastaların tedavisinde EAA 2-3 kat artar. Bu hastalarda yüksek dozlardan kaçınılmalıdır.
Karaciğer yetmezliği:
Karaciğer sirozu olan hastalarda, tek dozluk oral uygulama sonrasında, MAA ve FAA'nın yarılanma ömrü 3 kat artmıştır (10 saat), ancak AA ve AAA'daki artış bu kadar belirgin olmamıştır. Bu hastalarda yüksek dozlardan kaçınılmalıdır.
Böbrek yetmezliği:
Böbrek fonksiyonu bozulmuş olan hastalara ait mevcut veriler bazı metabolitler için (AAA ve FAA) eliminasyonun azaldığını göstermektedir. Bu hastalarda yüksek dozlardan kaçınılmalıdır.
Biyoyararlanım:
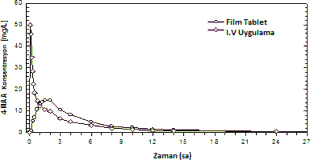
1987'de 12 gönüllü ile gerçekleştirilen, film kaplı tabletlerin referans ürünle (2 dakikalık IV uygulama) karşılaştırıldığı bir biyoyararlanım araştırmasında, 4-MAA için aşağıdaki sonuçlar gösterilmiştir:
| Film kaplı tablet (1 g) | i.v. uygulama (1 g) |
Doruk plazma konsantrasyonu (C) [mg/l] | 17,3 ± 7,54 | 56,5 ± 12,2 |
Doruk plazma konsantrasyonu süresi (tmax) [s] | 1,42 ± 0,54 | Enjeksiyon sonu |
Konsantrasyon-zaman eğri altı alan (EAA) [mg s/l] | 80,9 ± 34,1 | 71,2 ± 13,7 |
(Değerler ortalama ve standart sapma olarak gösterilmektedir)
Film kaplı tabletin 4-MAA plazma konsantrasyonu için EAA ile ölçülen mutlak biyoyararlanımı %93 olmuştur.
Şekil 3: Konsantrasyon-zaman grafiğinde ortalama plazma eğrilerinin referans ürünle karşılaştırılması
5.3. Klinik öncesi güvenlilik verileri
Akut toksisite:
Metamizolün fare ve sıçanlardaki en düşük letal dozları: oral yolla yaklaşık 4000 mg/kg vücut ağırlığı; intravenöz olarak yaklaşık 2300 mg metamizol/kg vücut ağırlığı veya 400 mg MAA/kg vücut ağırlığıdır.
İntoksikasyon belirtileri ise taşipne, sedasyon ve premortal konvülziyonlar olmuştur.
Kronik toksisite:
Metamizolün, sıçanlarda günlük 150 mg/kg vücut ağırlığı dozlarda, köpeklerde ise günlük 50 mg/kg vücut ağırlığı dozlarda 4 hafta boyunca uygulanması tolere edilmiştir.
Farklı hayvan türlerinde subkronik ve kronik toksisite çalışmaları gerçekleştirilmiştir. Sıçanlarda 6 ay süreyle günlük 100-900 mg/kg vücut ağırlığı, vücut ağırlığı dozunda metamizol uygulanmıştır. En yüksek dozda (900 mg/kg), 13. haftadan sonra retikülositlerde ve Heinz cisimciklerinde artışsaptanmıştır.
Köpeklerde 6 ay süreyle günlük 30-600 mg/kg vücut ağırlığı dozlarında metamizol uygulanmıştır. Günde 300 mg/kg dozlarından itibaren, doza bağlı hemolitik anemi ve böbrek ve karaciğer işlevlerinde bozulma gözlenmiştir.
Daha yüksek dozlar her iki cinste de serum kimyasında değişikliğe ve karaciğer ve dalakta hemosiderozise sebep olmuş; ayrıca kemik iliği toksisitesi ve anemi belirtileri saptanmıştır.
In vitro ve in vivo deneyler, aynı test sistemlerinde metamizol için çelişkili sonuçlar vermiştir. Karsinojenite:
Sıçanlarda yapılan uzun süreli çalışmalarda karsinojenik potansiyeli gösteren bir bulguya rastlanmamıştır. Uzun süreli üç çalışmadan ikisinde, yüksek dozlarda karaciğer hücreli adenomlarda artış bildirilmiştir.
Mutajenite:
Literatürde hem pozitif hem de negatif sonuçlar tanımlanmıştır. Ancak belirtilen Hoechst dereceli materyal ile yapılan in-vitro ve in-vivo çalışmalar mutajenik potansiyele ilişkin bir bulgu göstermemiştir.
Üreme toksisitesi:
Sıçan ve tavşanlarda yapılan embriyotoksisite çalışmalarında teratojenik potansiyel gösterilmemiştir.
Tavşanlarda, maternal toksisite göstermeyen 100 mg/kg/gün dozunda letal etkiler bildirilmiştir. Sıçanlarda fatal embriyotoksik etkiler, maternal toksisite gözlenen doz aralığında ortaya çıkmıştır. Sıçanlarda 100 mg/kg/gün'ün üzerindeki dozlar, gestasyon süresinde uzama ve doğum sürecinde bozulmayla beraber, yavrularda mortalite artışına neden olmuştur.
Fertilite testlerinde, 250 mg/kg/gün'ün üzerindeki dozlarda döl veren jenerasyonun gebelik
oranında hafif bir azalma gösterilmiştir. F1 jenerasyonun fertilitesi etkilenmemiştir.
Metamizol metabolitleri anne sütüne geçmektedir. Emzirenlerdeki etkilerine dair bir bilgi
mevcut değildir.
 Tiroid Kanseri
En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur.
Tiroid Kanseri
En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur. |
 Lösemi Kan Kanseri
Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür.
Lösemi Kan Kanseri
Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür. |
İLAÇ GENEL BİLGİLERİ
Adeka İlaç ve Kimyasal Ürünler San. Ve Tic. A.Ş.
| Geri Ödeme Kodu | A00370 |
| Satış Fiyatı | 59.88 TL [ 26 Apr 2024 ] |
| Önceki Satış Fiyatı | 59.88 TL [ 22 Apr 2024 ] |
| Original / Jenerik | Jenerik İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699587011862 |
| Etkin Madde | Metamizol Sodyum |
| ATC Kodu | N02BB02 |
| Birim Miktar | 500 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 20 |
| Sinir Sistemi > NONNARKOTİK ANALJEZİKLER > Metamizol Sodyum |
| Yerli ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Deri Kanseri Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör. |
 |
Kolon, Rektum yada Bağırsak Kanseri Bağırsak kanseri kolon veya rektumda (arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir şekilde tedavi edilir. |
 |
HIV ve Aids HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan Virüsdür). Bu virüs AIDS hastalığına sebep olur. |