ZELASS-M %0.05 steril göz damlası 6 ml Kısa Ürün Bilgisi
{ Azelastin Hcl }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
ZELASS-M % 0,05 göz damlası Steril
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Her 1 ml göz damlası:
Etkin madde
Azelastin hidroklorür 0,5 mg (% 0,05) (0,45 mg Azelastin'e eşdeğer) Her damla 0,015 mg azelastin hidroklorür içerir.
Yardımcı maddeler
Benzalkonyum klorür 0,125 mg/ml Yardımcı maddeler için bölüm 6.1'e bakınız.
3. FARMASÖTİK FORMU
Steril göz damlası
Gözle görünür partikül içermeyen, berrak, renksiz çözelti.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Erişkinler ve 4 yaş ve üzerindeki çocuklarda mevsimsel alerjik konjonktivit semptomlarının tedavisinde ve önlenmesinde kullanılır.
Erişkinler ve 12 yaş ve üzerindeki çocuklarda mevsimsel olmayan (pereniyal) alerjik konjonktivit semptomlarının tedavisinde kullanılır.
4.2. Pozoloji ve uygulama şekli
Pozoloji/Uygulama sıklığı ve süresi:Mevsimsel alerjik konjonktivit:
Erişkinler ve 4 yaş ve üzerindeki çocuklar için önerilen doz, her göze günde 2 defa 1'er damladır, gerektiğinde doz günde 4 defaya çıkarılabilir. Alerjen ile karşılaşma bekleniyor ise ZELASS-M, karşılaşma öncesinde profilaktik olarak kullanılabilir.
Mevsimsel olmayan (pereniyal) alerjik konjonktivit:
Erişkinler ve 12 yaş ve üzerindeki çocuklar için önerilen doz her göze günde 2 defa (sabah ve akşam) 1'er damladır, gerektiğinde dozaj günde 4 defaya çıkarılabilir.
Güvenliliği ve etkililiği 6 hafta süreli klinik çalışmalarda gösterildiği için, kullanım süresi maksimum 6 hafta ile sınırlandırılmalıdır. Hastalara, semptomları kötüleşirse veya 48 saat sonra düzelmezse doktorlarına başvurmaları önerilmelidir.
Uygulama şekli:
Göze uygulanır.
Alt gözkapağı bir elin işaret parmağı ile çekilerek, konjonktival keseye uygulanır. Damlalığın ucu herhangi bir yere değdirilmemelidir.
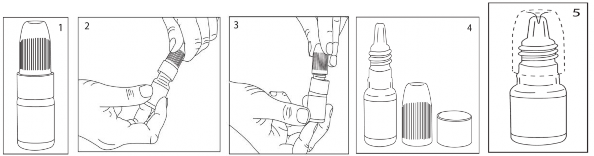
ZELASS-M'nin şişesini alınız.
4.3. Kontrendikasyonlar
Etken madde veya bölüm 6.1.'de listelenen yardımcı maddelerden herhangi birine aşırı duyarlılık durumlarında kontrendikedir.
4.4. Özel kullanım uyarıları ve önlemleri
ZELASS-M göz enfeksiyonlarının tedavisi için uygulanmaz. Diğer uyarılar için bkz. 4.5 ve 4.6.
ZELASS-M gözde iritasyona neden olabilen koruyucu madde benzalkonyum klorür içermektedir. Yumuşak kontak lenslerle temastan kaçınılmalıdır. Uygulama öncesinde kontak lensler çıkarılmalı ve hasta lensleri tekrar takmadan önce en az 15 dakika beklemelidir. Yumuşak kontak lenslerde renk bozulmasına neden olduğu bilinmektedir.
Benzalkonyum klorürün göz tahrişine, kuru göz semptomlarına neden olduğu ve gözyaşı filmi ile kornea yüzeyini etkileyebildiği bildirilmiştir. ZELASS-M %0,05 göz damlası kuru göz hastalarında ve korneanın zarar görebileceği hastalarda dikkatle kullanılmalıdır. Uzun süreli kullanım durumunda hastalar izlenmelidir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Azelastin ile spesifik etkileşim çalışmaları yapılmamıştır.
Yüksek oral dozlarda azelastin ile etkileşim çalışmaları yapılmıştır, ancak göz damlasının uygulanması sonrası sistemik düzeyleri pikogram aralığında olduğundan azelastin ile herhangi bir ilişki taşımamaktadır.
Özel popülasyonlara ilişkin ek bilgiler
Özel popülasyonlara ilişkin veri bulunmamaktadır.
Pediyatrik popülasyon:
Pediyatrik popülasyona ilişkin veri bulunmamaktadır.
4.6. Gebelik ve laktasyon
Gebelik Kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeli bulunan kadınlara verilirken tedbirli olunmalıdır.
Gebelik dönemi
Azelastinin gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir.
İnsanlarda hamilelik sırasında azelastin güvenliliğini saptamak için mevcut bilgiler yetersizdir.
Hayvanlar üzerinde yapılan çalışmalar, gebelik / embriyonal / fetal gelişim / doğum ya da doğum sonrası gelişim ile ilgili olarak doğrudan ya da dolaylı zararlı etkiler olduğunu göstermemektedir (bkz. kısım 5.3).
Gebe kadınlara verilirken tedbirli olunmalıdır.
Yüksek dozlarda oral azelastinin deney hayvanlarında advers etkileri (fetus ölümü, gelişme geriliği ve iskelet malformasyonu) indüklediği gösterilmiştir. Lokal oküler uygulama minimal sistemik maruziyetle (piktogram aralığında) sonuçlanacaktır.
Laktasyon dönemi
Azelastin düşük miktarlarda süte geçmektedir.
ZELASS-M'in emzirme döneminde kullanımı önerilmemektedir.
Üreme yeteneği/Fertilite
İnsanlarda üreme yeteneği üzerindeki etkiler araştırılmamıştır.
4.7. Araç ve makine kullanımı üzerindeki etkiler
ZELASS-M'in uygulanması sonrası görülebilecek hafif, geçici iritasyonun büyük miktarlarda görmeyi etkilemesi beklenmez. Ancak, eğer görme üzerine geçici etkiler oluşursa, hastaya araç ve makine kullanımı öncesi bu etkiler geçinceye kadar beklenmesi önerilmelidir.
4.8. İstenmeyen etkiler
Şu terimler ve sıklık dereceleri kullanılmıştır:
Çok yaygın (≥1/10); yaygın (≥1/100, < 1/10); yaygın olmayan (≥1/1.000, < 1/100); seyrek (≥1/10.000, < 1/1.000), çok seyrek (< 1/10.000), bilinmiyor (eldeki verilerden hareketle
Bağışıklık sistemi hastalıkları
Çok seyrek: Alerjik reaksiyonlar (kızarıklık ve pruritus gibi)
Sinir sistemi hastalıkları
Yaygın değil: Acı tat
Göz hastalıkları
Yaygın: Geçici olarak gözde hafif irritasyon
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0312 218 35 99)
4.9. Doz aşımı ve tedavisi
Oküler doz aşımı sonrası spesifik reaksiyonlar bilinmemektedir ve oküler yolla uygulamayla doz aşımı reaksiyonları beklenmemektedir.
İnsanlarda azelastin hidroklorürün toksik dozlarının uygulanmasıyla ilgili herhangi bir deneyim bulunmamaktadır. Hayvan deneylerinin sonuçlarına bağlı olarak aşırı dozaj veya intoksikasyon durumunda merkezi sinir sisteminde bozukluklar beklenebilir. Bu bozuklukların tedavisi semptomatik olmalıdır. Bilinen antidotu yoktur.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Oftalmolojikler, dekonjestanlar ve antialerjikler, diğer antialerjikler ATC Kodu: S01GX07
Bir fitalazinon türevi olan azelastin, selektif H1 antagonist özellikleri olan güçlü ve uzun etkili antialerjiktir. Ek olarak, topikal oküler uygulama sonrası anti-inflamatuvar etkisi saptanmıştır.
İn vivo (klinik öncesi) ve in vitro çalışmalara ait veriler, azelastinin, lökotrien, histamin, PAF ve serotonin gibi erken ve geç evre alerjik reaksiyonlarda rol oynayan kimyasal mediyatörlerin sentez veya salınımını inhibe ettiğini göstermektedir.
Bugüne kadar, yüksek dozda oral azelastin ile tedavi edilen hastalardaki uzun dönem tedavinin çoklu doz çalışmalarında gösterildiği gibi EKG değerlendirmelerinde, düzeltilmiş QT (QTc) aralığı üzerine azelastinin klinik olarak önemli herhangi bir etkisi olmadığı gösterilmiştir.
Oral yoldan azelastin ile tedavi edilen 3.700'den fazla hastada, azelastin ile ilişkili ventriküler aritmi ya da torsade de pointes gözlenmemiştir.
Alerjik konjonktivit semptomlarının hafifletilmesi 15-30 dakika içerisinde fark edilmelidir.
5.2. Farmakokinetik özellikler
Genel özellikler (sistemik farmakokinetik)
Emilim:
Oral uygulamayı takiben, azelastin hızlı bir şekilde emilirken %81 oranında biyoyararlanım göstermektedir. Gıdaların emilime etkisi yoktur.
Dağılım:
Dağılım hacmi yüksektir ve daha çok periferdedir. Proteinlere bağlanma düzeyi, göreceli olarak düşüktür (%80-90, ilaç etkileşimi reaksiyonları açısından endişeye neden olmayacak kadar düşük bir düzey).
Biyotransformasyon:
Terapötik olarak aktif metabolit N-Desmetil azelastin'dir.
Eliminasyon:
Tek doz azelastinden sonra plazma eliminasyon yarı ömrü azelastin için yaklaşık 20 saat ve terapötik olarak aktif metabolit olan N-Desmetil azelastin için yaklaşık 45 saattir. Atılım başlıca feçes yoluyla gerçekleşmektedir. Uygulanan dozun küçük bir kısmının uzamış atılımı, ilacın entero-hepatik sirkülasyona uğradığını düşündürmektedir.
Hastalardaki karakteristikler (oküler farmakokinetik)
Doğrusallık /Doğrusal olmayan durum:
Azelastinin (her gözde günde dört kez) tekrar oküler uygulamasını takiben, Ckararlı durum plazma azelastin hidroklorür düzeyleri çok düşüktür ve kantifikasyon limit düzeyinde veya altında tespit edilmiştir.
5.3. Klinik öncesi güvenlilik verileri
Azelastin hidroklorür kobaylarda herhangi bir duyarlaştırıcı potansiyeli göstermemiştir.
Azelastin, bir dizi in vitro ve in vivo testlerde herhangi bir genotoksik potansiyel ve sıçan ve farelerde karsinojenik potansiyel göstermemiştir.
Erkek ve dişi sıçanlarda, azelastinin 3 mg/kg/gün'den büyük oral dozlarında fertilite indeksinde doza bağlı azalmaya neden olmuştur; bununla birlikte kronik toksisite çalışmaları sırasında dişi veya erkek üreme organlarında ilaca bağlı herhangi bir değişiklik bulunmamıştır.
Sıçan, fare ve tavşanlarda embriyotoksik ve teratojenik etkiler, sadece maternal toksik dozlarda ortaya çıkmıştır (örneğin; 68,6 mg/kg/gün dozunda tavşan ve sıçanlarda iskelet malformasyonları gözlenmiştir).
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Benzalkonyum klorür Sorbitol (%70'lik sıvı) Hipromelloz Disodyum EDTA Sodyum hidroksit Enjeksiyonluk su
6.2. Geçimsizlikler
Bilinmemektedir.
6.3. Raf ömrü
24 ay
ZELASS-M ağzı açıldıktan sonra 28 günden daha uzun süre kullanılmamalıdır. Bu süre içerisinde ilaç 25°C altındaki oda sıcaklığında saklanmalıdır.
6.4. Saklamaya yönelik özel tedbirler
25°C altındaki oda sıcaklığında saklanmalıdır.
6.5. Ambalajın niteliği ve içeriği
6 ml ürün içeren, damlalıklı, opak, düşük yoğunluklu polietilen şişe ve çevirmeli beyaz PP kapak kullanılmaktadır. Bir kutu içinde kullanma talimatı ile birlikte sunulmaktadır.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller, âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj Atıklarının Kontrolü Yönetmeliğiâne uygun olarak imha edilmelidir.
 Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir.
Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir. |
 En Yaygın Alerji Türleri
Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir.
En Yaygın Alerji Türleri
Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| ALLERGODİL | 8699783540210 | |
| AZENOSE | 8699293545965 | 106.61TL |
| NAZALASTIN | 8680150540032 | 112.46TL |
| NAZETIN | 8699591540150 | 112.46TL |
| ZELASS | 8699525610058 | |
| Diğer Eşdeğer İlaçlar |
 |
Rahim Boyu ( Serviks ) Kanseri Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir. |
 |
Asperger Sendromu Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde, gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |
 |
Grip, Soğuk Algınlığı ve Öksürük Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |
İLAÇ GENEL BİLGİLERİ
Deva Holding A.Ş.
| Geri Ödeme Kodu | A16016 |
| Satış Fiyatı | 92.01 TL [ 22 Apr 2024 ] |
| Önceki Satış Fiyatı | 92.01 TL [ 15 Apr 2024 ] |
| Original / Jenerik | Jenerik İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699525610065 |
| Etkin Madde | Azelastin Hcl |
| ATC Kodu | S01GX07 |
| Birim Miktar | 0.0005 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 6 |
| Duyu Organları > NONSPESİFİK KONJONKTİVİT |
| Yerli ve Beşeri bir ilaçdır. |