XEPLION 50mg/0.50ml IM uzun salımlı süspansiyon içeren kullanıma hazır enjektör Farmakolojik Özellikler
{ }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Diğer antipsikotikler ATC kodu: N05A X13
XEPLION paliperidonun (+)- ve (-)- rasemik karışımını içerir.
Etki mekanizması:
Paliperidon palmitat, paliperidona hidrolize olur (Bkz. Bölüm 5.3). Paliperidon, daha çok serotonerjik 5-HT2A antagonistik aktivitesi olan merkezi etkili dopamin D2 antagonistidir.
Paliperidon, aynı zamanda alfa-1 ve alfa-2 adrenerjik reseptörlerin ve H1 histaminerjik reseptörlerin antagonisti olarak etki eder. Paliperidonun kolinerjik muskarinik veya B1- ve B2- adrenerjik reseptörlere afinitesi yoktur. (+)- ve (-)- paliperidon enantiyomerlerinin farmakolojik aktivitesi, kalitatif ve kantitatif olarak benzerdir.
Şizofrenide etkili olan diğer ilaçlarda olduğu gibi paliperidonun etki mekanizması bilinmemektedir. Ancak, ilacın şizofrenideki terapötik aktivitesinin, dopamin Tip 2 (D2) ve serotonin Tip 2 (5HT2A) reseptör antagonizmasının kombinasyonu ile kontrol edildiği öne sürülmüştür. D2 ve 5HT2A dışındaki diğer reseptörlerdeki antagonizma, paliperidonun diğer etkilerinin bazılarını açıklayabilir.
Elektrofizyoloji
Oral paliperidonun QT aralığı üzerindeki etkileri, şizofreni ve şizoafektif bozukluğu olan erişkinlerde yapılan iki randomize, çift-kör, çok merkezli, faz 1 çalışmasında ve şizofrenili
erişkinlerde yapılan aktif kontrollü, 6 haftalık, sabit dozlu etkinlik çalışmalarında değerlendirilmiştir.
İlk faz 1 çalışmasında (n=141), denekler 7 gün süre ile günde bir kere hızlı salımlı oral paliperidon (4 mgdan 8 mga titre edilerek) veya tek doz moksifloksasin (400 mg) almak üzere randomize olarak ayrılmışlardır. Günde tek doz 8 mg hızlı salımlı oral paliperidon (n=50, Cmax ss= 113 ng/ml) ile elde edilen ortalama kararlı durum maksimum plazma konsantrasyonu, deltoid kas içine uygulanan önerilen maksimum 150 mglık XEPLION dozu ile gözlenen 2 kat daha yüksek maruziyete göre daha yüksek bulunmuştur (öngörülen ortalama Cmax ss = 50 ng/ml). Model-ayarlı, gün-ortalamalı lineer-deriveli QT düzeltmesinde (QTcLD), XEPLION tedavi grubunda (n=50) 5.5 milisaniyelik (ms) ortalama artış
saptanmıştır (%90 CI: 3.66; 7.25).
İkinci faz 1 çalışmasında (n=109) denekler; plasebo, maksimum önerilen oral uzatılmış salımlı paliperidon dozu (günde bir kere 12 mg) ve bunu takiben önerilen aralığın üzerinde bir doza titrasyon (günde bir kere 18 mg) veya aynı farmakolojik ilaç sınıfından bir ilacı (günde iki kez 400 mg ketiapin) aktif kontrol olarak alacak şekilde rastgele ayrılmışlardır. Bu 10 günlük eşit etkinlik çalışmasında, birincil karşılaştırma 12 mg uzatılmış salımlı paliperidon ile ketiapin arasında yapılmıştır. Her bireyin saptanan tmax değerinde QTcLDde başlangıca göre en düşük kareler ortalamasının değişikliği, 12 mg uzatılmış salımlı paliperidon için (ortalama Cmax 34 ng/ml), günde iki kez 400 mg ketiapin ile karşılaştırıldığında (ortalama Cmax 1183 ng/ml) 5.1 ms daha düşük bulunmuştur (%90 CI: -9.2; -0.9). Bu değer önceden belirlenmiş 10 ms olan eşit etkinlik kriterine uygundur. Her bireyin saptanan tmax değerinde QTcLDde başlangıca göre ortalama değişiklik, 18 mg uzatılmış salımlı paliperidon için (ortalama Cmax 53 ng/ml), günde iki kez 400 mg ketiapin ile karşılaştırıldığında (ortalama Cmax 1183 ng/ml) 2.3 ms daha düşük bulunmuştur (%90 CI: -6.8; 2.3).
Her bireyin saptanan tmax değerinde QTcLDde ortalama değişiklik, eşzamanlı plasebo grubunda saptanan ortanca tmax değerinde (karşılaştırılan aktif ilacın) QTcLDde başlangıca göre ortalama değişiklikle karşılaştırıldığında, 12 mg uzatılmış salımlı paliperidon için 1.5 ms daha yüksek (%90 CI: -3.3; 6.2) ve günde iki kez 400 mg ketiapin için 8.0 ms daha yüksek (%90 CI: 3.1; 12.9) bulunmuştur. Her bireyin saptanan tmax değerinde QTcLDde ortalama değişiklik, eşzamanlı plasebo grubunda saptanan ortanca tmax değerinde (karşılaştırılan aktif ilacın) QTcLDde başlangıca göre ortalama değişiklikle karşılaştırıldığında, 18 mg uzatılmış salımlı paliperidon için 4.9 ms daha yüksek (%90 CI: --0.5; 10.3) ve günde iki kez 400 mg ketiapin için 7.5 ms daha yüksek (%90 CI: 2.5; 12.5) bulunmuştur.
Bu çalışmaların hiçbirisinde herhangi bir zamanda deneklerde, başlangıca göre 60 milisaniyeyi geçen bir değişiklik veya 500 milisaniyeyi geçen bir QTcLD görülmemiştir.
Oral uzatılmış salımlı paliperidonla ilgili sabit dozlu üç etkinlik çalışmasında, standardize edilmiş bir yöntem kullanılarak belirli günlerde (beklenen Cmax sürelerini içeren) 15 zaman noktasında, kapsamlı elektrokardiyografi (ECG) ölçümleri alınmıştır. Uzatılmış salımlı paliperidon ile tedavi edilen 836 denek, olanzapin ile tedavi edilen 357 denek ve plasebo ile tedavi edilen 350 deneğin toplu verilerine göre herhangi bir zaman noktasında, herhangi bir tedavi grubunda ortalama QTcLD artışı 5 milisaniyeyi geçmemiştir. Bu çalışmalar esnasında, uzatılmış salımlı 12 mg paliperidon ve olanzapin gruplarının her birisinde bir denekte bir zaman noktasında 60 milisaniyeyi geçen değişiklik olmuştur (sırası ile 62 ve 110 milisaniye artışları).
XEPLION un dört sabit dozlu etkinlik çalışmasında, deneklerin tamamında 60 milisaniyeyi geçen QTcLD değişikliği olmamış ve herhangi bir zaman noktasında 500 milisaniyeden fazla QTcLD değeri görülmemiştir. Uzun süreli nüksü önleme çalışmasında, deneklerin tamamında 60 milisaniyeyi geçen QTcLD değişikliği olmamıştır ve bir denekte 507 milisaniyelik QTcLD değeri saptanmıştır (Bazett düzeltilmiş QT aralığı [QTcB] 483 milisaniye). Bu hastada ayrıca kalp hızı 45 atım/dakika bulunmuştur.
Klinik Etkinlik
XEPLIONun şizofreninin akut tedavisinde etkililiği, şizofreni için DSM-IV kriterlerini karşılayan akut nüks gelişmiş yatan erişkin hastalarda yapılan kısa süreli (biri 9 haftalık ve üçü 13 haftalık) çift-kör, randomize, plasebo kontrollü, sabit dozlu dört çalışmada değerlendirilmiştir. Bu çalışmalarda I XEPLIONun sabit dozları, 9 haftalık çalışmada 1. , 8.
ve 36. günlerde ve 13 haftalık çalışmalarda ek olarak 64. günde verilmiştir (ilk iki doz için bir haftalık aralıklarla ve daha sonra idame için 4 haftada bir).
Etkinlik, Pozitif ve Negatif Sendrom Ölçekleri (PANSS) kullanılarak değerlendirilmiştir.
PANSS, pozitif semptomları, negatif semptomları, dağınık düşünceleri, kontrol edilemeyen
saldırganlık/heyecanı ve anksiyete/depresyonu değerlendirmek için beş faktörden oluşan
valide edilmiş çok maddeli bir ölçektir. Fonksiyon, Kişisel ve Sosyal Performans (PSP) ölçeği
kullanılarak değerlendirilmiştir. PSP, sosyal olarak yararlı aktivite alanlarında kişisel ve
sosyal fonksiyonu ölçen ve klinisyenin derecelendirdiği valide edilmiş bir ölçektir: iş ve
çalışma, kişisel ve sosyal ilişkiler, kendi kendine bakım ve rahatsız edici ve agresif
davranışlar. Sosyal, kişisel ve kendi kendine bakım alanlarında disfonksiyonun şiddeti, bu
aktiviteleri başkalarının yardımı ile ve başkalarının yardımı olmaksızın uygulamada zorluk
derecesi (yok, hafif, aşikar, belirgin, şiddetli) ile ölçülür. Benzer şekilde, agresif davranışlarda
Sayfa 21 / 33
disfonksiyonun şiddeti, agresif davranışların varlığı veya yokluğu (kabalık, başkalarına toplum içinde hakaret etmek, nesneleri kırmak, sözlü tehditler, fiziksel saldırı) ve bu davranışların sıklığı ile ölçülür.
XEPLIONun üç sabit dozunu (başlangıçta 150 mglık deltoid enjeksiyon ve bunu takiben 25 mg/4 hafta, 100 mg/4 hafta veya 150 mg/4 hafta şeklinde 3 gluteal veya deltoid doz) plasebo ile karşılaştıran 13 haftalık çalışmada (n=636), XEPLIONun üç dozu da, PANSS toplam puanını düzeltmek açısından plaseboya göre üstün bulunmuştur. Bu çalışmada, hem 100 mg/4 hafta hem de 150 mg/4 haftalık tedavi grupları PSP puanı açısından plaseboya göre istatistiksel olarak anlamlı üstünlük göstermişken, 25 mg/4 haftalık tedavi grubu üstünlük göstermemiştir. Bu bulgular, tedavi süresi boyunca etkililiği ve PANSSde düzelmeyi desteklemektedir ve dördüncü gün kadar erken dönemde gözlenmiştir. Sekizinci günde ise 25 mg ve 150 mglık XEPLION gruplarında plaseboya göre anlamlı farklılık gözlenmiştir.
XEPLIONun üç sabit dozunu (50 mg/4 hafta, 100 mg/4 hafta ve 150 mg/4 hafta) plasebo ile karşılaştıran diğer bir 13 haftalık çalışmada (n=349), sadece 100 mg/4 haftalık XEPLION grubu, PANSS toplam puanında düzelme açısından plaseboya göre üstün bulunmuştur. Bu çalışmada, hem 50 mg/4 hafta, hem de 100 mg/4 hafta dozları, PSP puanını düzeltmek açısından plaseboya üstün bulunmuştur. Bu çalışmaya 150 mglık bir doz dahil edilmesine rağmen, bu dozu alan gönüllü sayısı, bu dozun etkililiği ile ilgili kesin sonuçlara varmak için yeterli değildir.
XEPLIONun üç sabit dozunu (25 mg/4 hafta, 50 mg/4 hafta ve 100 mg/4 hafta) plasebo ile karşılaştıran üçüncü 13 haftalık çalışmada (n=513), XEPLIONun üç dozu da, PANSS toplam puanını düzeltmek açısından plaseboya göre üstün bulunmuştur. Bu çalışmada, paliperidon doz grupların tamamında, PSP puanı açısından plaseboya göre istatistiksel olarak anlamlılık saptanmamıştır.
XEPLIONun iki sabit dozunu (50 mg/4 hafta ve 100 mg/4 hafta) plasebo ile karşılaştıran 9 haftalık çalışmada (n=197), XEPLIONun iki dozu da, PANSS toplam puanını düzeltmek açısından plaseboya göre üstün bulunmuştur.
XEPLION un şizofrenide semptomatik kontrolü idame etmek açısından etkililiği, şizofreni için DSM-IV kriterlerini karşılayan erişkin gönüllüleri içeren uzun süreli çift-kör, plasebo kontrollü, esnek dozlu bir çalışmada belirlenmiştir. Bu çalışma, 33 haftalık açık etiketli akut tedavi ve stabilizasyon fazı ve randomize, plasebo kontrollü bir faz (nüks açısından gözlem yapmak üzere) içermiştir. Değişken uzunlukta çift-kör faz esnasında, hastalar stabilizasyon fazında aldıkları aynı XEPLIONun doz grubuna (ortanca süre 171 gün [aralıklar 1 gün-407 gün] [4 haftada bir uygulanan 25 mg, 50 mg veya 100 mg]) veya plasebo grubuna (ortalama süre 105 gün [aralıklar 8 gün-441 gün] randomize olarak ayrılmıştır. Toplam 410 stabilize hasta, şizofreni semptomlarında nüks oluşana kadar, XEPLION veya plasebo gruplarına randomize olarak ayrılmıştır. Nüks, aşağıdakilerden birinin veya daha fazlasının ilk olarak ortaya çıkma zamanı olarak tanımlanmıştır. Bunlar; psikiyatrik hospitalizasyon, iki ardışık değerlendirmede toplam PANSS puanında >%25 artış (başlangıç puanı >40 ise) veya 10 puanlık artış (başlangıç puanı <40 ise), kasıtlı olarak kendi kendini yaralamak, saldırgan davranış, intihar/öldürmeye eğilimli düşünceler veya PANSS maddelerinin P1 (Delüzyonlar), P2 (kavramsal disorganizasyon), P3 (Halüsinasyonla ilgili davranış), P6 (Şüphecilik/perseküsyon), P7 (Düşmanlık) veya G8 (işbirliği yapamama) ardışık iki değerlendirmesinde puanın >5 (maksimum başlangıç puanı <3 ise) veya >6 (maksimum başlangıç puanı 4 ise) olmasıdır. Primer etkinlik değişkeni, nükse kadar geçen süre olmuştur.
Daha önceden planlanmış bir ara analiz (68 nüks olayı yaşandıktan sonra), nükse kadar geçen sürenin, XEPLION ile tedavi edilen hastalarda, plaseboya kıyasla anlamlı derecede daha uzun olduğunu göstermiştir ve etkililiğin devam ettiği gösterildiğinden çalışma erken sonlandırılmıştır.
5.2. Farmakokinetik özellikler
Emilim:
Sudaki çözünürlüğünün aşırı düşük olmasına bağlı olarak paliperidon palmitat, intramüsküler enjeksiyondan sonra paliperidona hidroliz olmadan önce yavaşça çözünür ve sistemik dolaşıma absorbe olur. Tek bir intramüsküler enjeksiyonu takiben paliperidonun plazma konsantrasyonları, 13 günlük ortalama tmax süresi içinde yavaş yavaş yükselerek maksimum plazma konsantrasyonlarına yükselir. İlacın salınması, birinci gün kadar erken bir zamanda başlar ve 126 gün kadar sürer.
Deltoid kas içine tek doz intramüsküler enjeksiyonunu takiben (25 mg-150 mg), gluteal kas içine enjeksiyonla karşılaştırıldığında ortalama olarak %28 daha yüksek bir Cmax gözlenmiştir.
1. günde 150 mg ve 8. günde 100 mgın iki başlangıç deltoid intramüsküler enjeksiyonu, terapötik konsantrasyonlara hızla ulaşılmasına yardımcı olur. XEPLIONun salım profili ve doz rejimi, terapötik konsantrasyonların devam etmesini sağlamaktadır. 100 mglık
Sayfa 23 / 33
XEPLION dozu için ortalama kararlı durum doruk noktası: iki dalga arasındaki çukur oranı, gluteal uygulamayı takiben 1.8 ve deltoid uygulamayı takiben 2.2 olmuştur. 25 mg-150 mglık doz aralığında XEPLION uygulamasını takiben paliperidonun görünen ortalama yarılanma ömrü 25 ile 49 gün arasında değişmiştir.
Paliperidon palmitat uygulamasını takiben paliperidonun (+) ve (-) enantiyomerleri birbirine dönüşür ve yaklaşık olarak 1.6-1.8lik bir EAA (+)/(-) oranına ulaşır.
Dağılım:
Popülasyon analizine göre paliperidonun görünen dağılım hacmi 391 litredir. Rasemik paliperidon plazma proteinine %74 oranında bağlanır.
Biyotransformasyon:
1 mg hızlı salımlı 14C-paliperidonun tek bir oral dozunun uygulanmasından 1 hafta sonra, dozun %59u idrarla değişmeden atılmıştır. Bu durum, paliperidonun karaciğerde ileri derecede metabolize olmadığını göstermektedir. Hiçbirisi verilen dozun %6.5inden fazlasını kapsamayan in vivo dört metabolik yolak tanımlanmıştır: dealkilasyon, hidroksilasyon, dehidrojenasyon ve benzisoksazolün bölünmesi. In vitro çalışmalar, paliperidon metabolizmasında CYP2D6 ve CYP3A4ün rol oynadığını göstermesine rağmen, paliperidonun metabolizmasında in vivo olarak bu izoenzimlerin önemli bir rol oynadığına dair bir kanıt yoktur. Popülasyon farmakokinetik analizleri, oral paliperidonun uygulanmasından sonra paliperidonun görünen klerensinde CYP2D6 substratlarının hızlı metabolize edicileri ile yavaş metabolize edicileri arasında ayırt edilebilir fark göstermemiştir.
İnsan karaciğer mikrozomlarında yapılan in vitro çalışmalar, paliperidonun, CYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4 ve CYP3A5i içeren sitokrom P450 izoenzimleri tarafından metabolize edilen ilaçların metabolizmasını büyük ölçüde inhibe etmediğini göstermiştir.
In vitro çalışmalar, paliperidonun bir P-gp substratı olduğunu ve yüksek konsantrasyonlarda P-gpnin zayıf bir inhibitörü olduğunu göstermiştir. In vivo veriler yoktur ve klinik ilişki bilinmemektedir.
Eliminasyon:
1 mg hızlı salımlı 14C-paliperidonun tek bir oral doz uygulanması ile verilen radyoaktivitenin yaklaşık %80i idrarda ve %11i feçeste bulunmuştur.
Doğrusallık/Doğrusal olmayan durum:
XEPLION uygulamasını takiben toplam paliperidon maruziyeti, 25 mg-150 mglık doz aralığının üzerinde dozla orantılı olmuştur ve 50 mgı aşan dozlarda Cmax için dozla-orantıdan düşüktür.
Uzun etkili paliperidon palmitat enjeksiyonu ile oral uzatılmış salımlı paliperidonun karşılaştırılması
XEPLION, paliperidonu ayda bir uygulamak üzere tasarlanmıştır. Uzatılmış salımlı oral paliperidon ise günde bir kere uygulanır. Şekil 1, önerilen başlangıç rejimi kullanılarak XEPLION uygulamasını takiben 5 hafta süre ile paliperidonun ortanca farmakokinetik profilini, oral uzatılmış salımlı tablet (6 mg veya 12 mg) uygulaması ile karşılaştırmalı olarak sunmaktadır. XEPLIONun başlangıç rejimi (1. gün/8. günde deltoid kas içine 150 mg/100 mg), tedaviyi oral destek kullanmaksızın başlatırken kararlı durum paliperidon konsantrasyonlarına hızla ulaşmak üzere tasarlanmıştır.
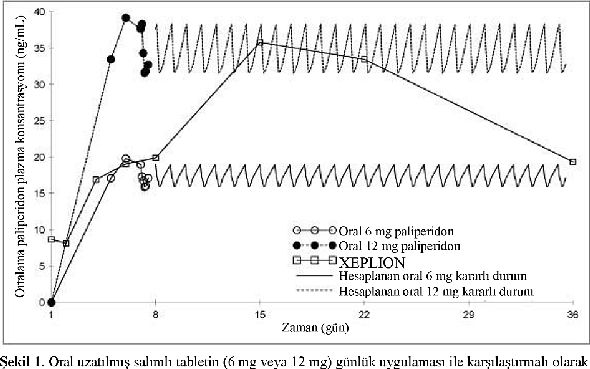
önerilen başlangıç rejimi kullanılarak (1.gün/8.günde deltoid kas içine 150 mg/100 mg paliperidona eşdeğer paliperidon palmitat ile başlangıç) XEPLIONun uygulamasını takiben 5 hafta süre ile paliperidon için ortalama farmakokinetik profillerini takiben ortalama plazma konsantrasyonu-zaman profilleri.
Genel olarak, XEPLION ile gözlenen genel başlangıç plazma düzeyleri, 6 mg-12 mg uzatılmış salımlı oral paliperidon ile gözlenen maruziyet sınırları içinde bulunmuştur.
XEPLION başlangıç rejiminin kullanılması, en düşük değerlerin görüldüğü doz öncesi günlerde bile (8. gün ve 36. gün) hastaların, 6 mg-12 mg uzatılmış salımlı oral paliperidonun bu maruziyet penceresinde kalmalarını sağlamıştır. XEPLION uygulamasını takiben paliperidon farmakokinetiği için gönüllüler arasında değişkenlik, uzatılmış salımlı oral paliperidon tabletlerinde belirlenen değişkenliğe göre daha az bulunmuştur. İki ürün arasındaki ortanca farmakokinetik profillerindeki fark nedeni ile farmakokinetik özelliklerini direkt olarak karşılaştırılırken dikkatli olmak gerekir.
Hastalardaki karakteristik özellikler
Karaciğer yetmezliği:
Paliperidon, karaciğerde yaygın şekilde metabolize edilmemektedir. XEPLION, karaciğer yetmezliği olan hastalarda incelenmemiş olmasına rağmen, hafif veya orta derece karaciğer yetmezliği olan hastalarda doz ayarlaması gerekli değildir. Orta derecede karaciğer yetmezliği olan (Child-Pugh sınıf B) hastalarda oral paliperidon ile yapılan bir çalışmada, serbest paliperidonun plazma konsantrasyonu, sağlıklı deneklerle benzerdir. Paliperidon, ağır karaciğer yetmezliği olan hastalarda incelenmemiştir.
Böbrek yetmezliği:
Hafif böbrek yetmezliği olan hastalarda XEPLION dozu azaltılmalıdır. XEPLIONun, orta veya ağır böbrek yetmezliği olan hastalarda kullanılması önerilmez (Bkz. Bölüm 4.2). Değişik derecelerde böbrek yetmezliği olan deneklerde, tek bir oral 3 mg uzatılmış salımlı tablet paliperidon dozunun dağılımı incelenmiştir. Paliperidon eliminasyonu, azalan kreatinin klerensi ile birlikte azalmıştır. Paliperidonun toplam klerensi, bozulmuş böbrek fonksiyonu olan hastalar arasında hafif böbrek yetmezliğinde (CrCl =50 - <80 ml/dak) ortalama %32, orta böbrek yetmezliğinde (CrCl= 30 - <50 ml/dak) ortalama %64 ve ağır böbrek yetmezliğinde (CrCl=10 - <30 ml/dak) ortalama %71 azalmıştır. Bu durum sağlıklı deneklerle karşılaştırıldığında, maruziyette (EAAinf) sırası ile 1.5, 2.6 ve 4.8 kat ortalama artışa denk düşer. Hafif böbrek yetmezliği olan deneklerde XEPLION ile sınırlı sayıda gözleme ve farmakokinetik simülasyonlara göre, hafif böbrek yetmezliği olan hastalarda önerilen XEPLION başlangıç dozu tedavinin birinci gününde 100 mglık doz ve bir hafta sonra 75 mgdır; daha sonra ayda bir (4 haftada bir) 50 mglık enjeksiyonlarla devam edilir (Bkz.
Bölüm 4.2).
Yaşlılarda:
Sadece yaşa bağlı dozaj ayarlaması önerilmez. Ancak, kreatinin klerensinde yaşla ilgili azalma nedeni ile doz ayarlaması gerekli olabilir (Bkz. Bölüm 5.2 ve Bölüm 4.2).
Irk:
Oral paliperidon ile yapılan çalışmaların popülasyon farmakokinetiği analiz verileri, XEPLION uygulamasını takiben paliperidonun farmakokinetiğinde ırka bağlı farklılıkların kanıtını göstermemiştir.
Cinsiyet:
Erkekler ve kadınlar arasında klinik olarak anlamlı fark gözlenmemiştir.
Sigara kullanım durumu:
5.3. Klinik öncesi güvenlilik verileri
Toksikoloji
Oral uygulanan paliperidonun yanı sıra, dopamin D2 reseptörlerini antagonize eden diğer ilaçlarda olduğu gibi intramüsküler olarak uygulanan paliperidon palmitat tekrarlanan-doz toksisitesi çalışmalarında serum prolaktin düzeylerini yükseltmiştir.
Karsinojenisite
İntramüsküler olarak enjekte edilen paliperidon palmitatın karsinojenik potansiyeli sıçanlarda değerlendirilmiştir. 10, 30 ve 60 mg/kg/aylık dozlarda dişi sıçanlarda meme bezi adenokarsinomlarında istatistiksel olarak anlamlı bir artış olmuştur. Erkek sıçanlarda, XEPLIONun mg/kg esas alınarak 150 mglık maksimum önerilen insan dozunun 1.2 ve 2.2 katı olan 30 ve 60 mg/kg/aylık dozlarda meme bezi adenomları ve karsinomlarında istatistiksel olarak anlamlı bir artış görülmüştür.
Risperidonun aktif bir metaboliti olan oral paliperidonun karsinojenik potansiyeli, farelerde
ve sıçanlarda yürütülen risperidon çalışmalarına göre değerlendirilmiştir. Risperidon, farelere
18 ay süre ile ve sıçanlara 25 ay süre ile 10 mg/kg/gün şeklinde uygulanmıştır. Hipofiz bezi
Sayfa 27 / 33
adenomları, endokrin pankreas adenomları ve meme bezi adenokarsinomlarında istatistiksel olarak anlamlı artışlar olmuştur. Diğer antipsikotik ilaçların kronik olarak uygulanmasından sonra, kemirgenlerde meme, hipofiz ve endokrin pankreas tümörlerinde bir artış saptanmış ve bu artışın uzatılmış dopamin D2 antagonizmasına bağlı olduğu düşünülmüştür. Kemirgenlerde bu tümör bulgularının insan riski ile ilişkisi bilinmemektedir.
Mutajenisite
Ames ters mutasyon testinde, fare lenfoma tayininde ve sıçan mikronükleus testinde paliperidonun mutajenik potansiyeli ile ilgili bulgu saptanmamıştır. Paliperidon palmitat, Ames ters mutasyon testinde veya fare lenfoma tayininde genotoksik özellikler göstermemiştir.
Fertilitede bozukluk
Oral paliperidon tedavisi, prolaktin- ve santral sinir sistemi- aracılı etkiler ile sonuçlanmış olmasına rağmen, erkek ve dişi sıçanların fertilitesi etkilenmemiştir. Maternal olarak toksik bir dozda, dişi sıçanların canlı embriyo sayısında hafif bir düşüş göstermiştir.
 Lösemi Kan Kanseri
Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür.
Lösemi Kan Kanseri
Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür. |
 Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir.
Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
İLAÇ GENEL BİLGİLERİ
Johnson & Jonhson Sıhhi Malzeme San. ve Tic.Ltd.Şti.
| Satış Fiyatı | TL |
| Önceki Satış Fiyatı | |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | |
| İthal ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Pankreas Kanseri Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir. |
 |
Travma Sonrası Bunalımı Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir. |
 |
Depresyonu Anlamak Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur? |