TECENTRIQ 1200 mg/20 ml infüzyonluk çözelti hazırlamak için konsantre Kısa Ürün Bilgisi
{ Atezolizumab }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
TECENTRIQ 1200 mg/20 ml infüzyonluk çözelti hazırlamak için konsantre Steril
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
20 mL konsantre bir flakon içinde 1200 mg atezolizumab içerir.
Dilüsyondan sonra 1 mL solüsyon yaklaşık olarak 4,4 mg atezolizumab içerir (bkz. Bölüm 6.6).
Atezolizumab, rekombinant DNA teknolojisiyle Çin hamsteri yumurtalık hücrelerinde üretilen, bir Fc bölgesi değiştirilmiş, hümanize IgG1 anti-programlı ölüm-ligandı 1 (PD-L1) monoklonal antikorudur.
Yardımcı maddeler
Yardımcı maddeler için Bölüm 6.1'e bakınız.
3. FARMASÖTİK FORMU
İnfüzyonluk çözelti hazırlamak için steril konsantre Berrak, renksiz ila hafif sarımsı sıvı
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Erken Evre Küçük Hücreli Dışı Akciğer Kanseri (EE-KHDAK)
TECENTRIQ, PD-L1 ekspresyonu tümör hücrelerinde (TC) ≥ %50 olan, yetişkin Evre II-IIIA küçük hücreli dışı akciğer kanseri hastalarında, rezeksiyonu ve platin bazlı kemoterapiyi takiben, adjuvan tedavide monoterapi olarak endikedir. Non-skuamöz küçük hücreli dışı akciğer kanserlerinde EGFR ve ALK mutasyonlarının negatif olması gereklidir. Hastalık nüksü veya kabul edilemez toksisite olmadıkça maksimum 1 yıl süreyle kullanımı uygundur.
Metastatik Küçük Hücreli Dışı Akciğer Kanseri (KHDAK)
TECENTRIQ'in, performans durumu ECOG 0-1 olan, EGFR, ALK, ROS negatif, semptomatik beyin metastazı olmayan, lokal ileri ve/veya metastatik küçük hücreli dışı akciğer kanseri (KHDAK) nedeniyle daha önce 1-2 basamak kemoterapi almış ve progresyon gelişmiş
hastaların tedavisinde tekrar progresyona kadar kullanımı endikedir.
TECENTRIQ, EGFR mutant ya da ALK pozitif olmayan ve PD-L1 ekspresyonu tümör hücrelerinde (TC) ≥ %50 ya da tümör infiltre edici immün hücrelerde ≥ %10 olan, aktif beyin metastazı olmayan, ECOG 0 veya 1 metastatik küçük hücreli dışı akciğer kanseri yetişkin hastaların birinci basamak tedavisinde monoterapi olarak endikedir. Yassı hücreli KHDAK hastalarında EGFR ve/veya ALK durumunun belirlenmiş olması aranmaz.
TECENTRIQ, ECOG performans skoru 0-1 olan, yeterli kardiyak, renal ve hepatik fonksiyonları bulunan, aktif beyin metastazı olmayan, EGFR ya da ALK mutasyonları bulunmayan ve eş zamanlı immünsüpresif veya kortikosteroid tedavisi almayan metastatik yassı hücreli olmayan KHDAK hastalarının birinci basamak tedavisinde, nab-paklitaksel ve karboplatinli kemoterapi rejimi ile kombine olarak progresyona kadar kullanımı endikedir. Tedavi sonu progresyonda diğer PD-1 ve PD-L1 inhibitörleri kullanılamaz.
Küçük Hücreli Akciğer Kanseri (KHAK)
TECENTRIQ'in, karboplatin ve etoposidle kombine olarak yaygın evre küçük hücreli akciğer kanseri olan yetişkin hastaların birinci basamak tedavisinde kullanımı endikedir.
Hepatoselüler Kanser
TECENTRIQ'in bevacizumab ile kombine olarak, daha önce sistemik tedavi görmemiş, ECOG performans durumu 0 ve 1 olan, Child-Pugh skoru A olan, metastatik veya lokorejyonel tedaviye uygun olmayan rezeke edilemeyen hepatoselüler karsinomlu yetişkin hastaların tedavisinde kullanımı endikedir.
4.2. Pozoloji ve uygulama şekli
TECENTRIQ, kanser tedavisinde deneyimli bir hekimin gözetimi altında uygulanmalıdır. KHDAK hastalarında PD-L1 testi:
TECENTRIQ monoterapisi
Erken evre KHDAK ve birinci basamak metastatik KHDAK hastalarının tedaviye uygunluğu, valide edilmiş bir test ile teyid edilmiş PD-L1 tümör ekspresyonuna göre yapılmalıdır (bkz. Bölüm 5.1).
Pozoloji/Uygulama sıklığı ve süresi:
TECENTRIQ monoterapisi
Önerilen TECENTRIQ dozu, üç haftada bir intravenöz yoldan uygulanan 1200 mg'dır.
TECENTRIQ kombinasyon tedavisi
Non-skuamoz KHDAK â TECENTRIQ ile nab-paklitaksel ve karboplatin kombinasyonu
İndüksiyon fazında, 1. günde önerilen TECENTRIQ dozu intravenöz yoldan uygulanan 1200
mg ve takiben sırasıyla nab-paklitaksel ve karboplatindir. Nab-paklitaksel 8. ve 15. günlerde intravenöz yoldan uygulanır. Bu rejim 4 veya 6 siklus boyunca her 3 haftada bir uygulanır.
İndüksiyon fazını, kemoterapi olmadan, yalnızca 3 haftada bir 1200 mg intravenöz yoldan TECENTRIQ uygulanan idame fazı takip eder.
KHAK â TECENTRIQ ile karboplatin ve etoposid kombinasyonu
İndüksiyon fazında, 1. günde önerilen TECENTRIQ dozu intravenöz yoldan uygulanan 1200 mg ve takiben sırasıyla karboplatin ve etoposiddir. Etoposid 2. ve 3. günlerde intravenöz yoldan uygulanır. Bu rejim 4 siklus boyunca her 3 haftada bir uygulanır.
İndüksiyon fazını, kemoterapi olmadan, yalnızca 3 haftada bir 1200 mg intravenöz yoldan TECENTRIQ uygulanan idame fazı takip eder.
Hepatoselüler Kanser (HSK)
TECENTRIQ ile bevacizumab kombinasyonu
Önerilen TECENTRIQ dozu 1200 mg'dır ve bunu takiben 15 mg/kg bevacizumab ile üç haftada bir intravenöz yoldan uygulanır.
Tedavi süresi:
2. Basamak Küçük Hücreli Dışı Akciğer Kanseri (KHDAK) ve Hepatoselüler Kanser (HSK)
Klinik faydanın kaybedilmesine (bkz. Bölüm 5.1) veya yönetilemeyen toksisiteye kadar hastaların TECENTRIQ ile tedavi edilmeleri önerilmektedir.
Erken Evre Küçük Hücreli Dışı Akciğer Kanseri
Hastalık nüksü veya kabul edilemez toksisite olmadıkça hastaların 1 yıl boyunca TECENTRIQ ile tedavi edilmeleri önerilmektedir. 1 yıldan uzun süren tedavi süresi çalışılmamıştır.
1. Basamak Küçük Hücreli Dışı Akciğer Kanseri (KHDAK) (TECENTRIQ monoterapi
Hastalık progresyonuna veya yönetilemeyen toksisiteye kadar hastaların TECENTRIQ ile tedavi edilmeleri önerilmektedir.
1. Basamak non-skuamoz Küçük Hücreli Dışı Akciğer Kanseri (KHDAK) (TECENTRIQ ile nab-paklitaksel ve karboplatin kombinasyonu)
Hastalık progresyonuna veya yönetilemeyen toksisiteye kadar hastaların TECENTRIQ ile tedavi edilmeleri önerilmektedir.
Hastalık progresyonundan sonra devam eden TECENTRIQ tedavisiyle atipik yanıtlar (yani ilk olarak hastalık progresyonu ve ardından tümörde küçülme) gözlenmiştir. Hekimin takdirine bağlı olarak hastalık progresyonundan sonra tedavi uygulanması düşünülebilir.
Geciken veya atlanan dozlar:
Planlanmış bir TECENTRIQ dozu atlanırsa mümkün olan en kısa sürede uygulanmalıdır. Uygulama planı, dozlar arasında 3 haftalık bir aralık korunacak şekilde ayarlanmalıdır.
Tedavi sırasında doz modifikasyonları:
TECENTRIQ için doz azaltımı önerilmez.
İmmünite ile ilişkili advers reaksiyon | Şiddet | Tedavi modifikasyonu |
Pnömonit | 2. derece | TECENTRIQ tedavisine ara verilir.
Olay 12 hafta içinde 0. derece veya 1. dereceye iyileştiğinde ve kortikosteroidler günde ≤10 mg prednizon eşdeğerine düşürüldüğünde tedaviye devam edilebilir. |
3. veya 4. derece | TECENTRIQ tedavisi tamamen kesilir. | |
Hepatoselüler kanseri olmayan hastalarda hepatit | 2. derece: (ALT veya AST >3-5 x normalin üst sınırı [NÜS] veya
kan bilirubin >1,5-3 x NÜS) | TECENTRIQ tedavisine ara verilir.
Olay 12 hafta içinde 0. derece veya 1. dereceye iyileştiğinde ve kortikosteroidler günde ≤10 mg prednizon veya eşdeğerine düşürüldüğünde tedaviye devam edilebilir. |
3. veya 4. derece: (ALT veya AST >5 x NÜS
veya
kan bilirubin >3 x NÜS) | TECENTRIQ tedavisi tamamen kesilir. | |
Hepatoselüler kanserli hastalarda hepatit | Eğer AST veya ALT başlangıçta normal seviyelerde olup >3 x ila ≤10 x NÜS'e yükselirse
veya
Eğer AST veya ALT başlangıçta >1 x ila ≤3 x NÜS olup >5 x ila ≤10 x NÜS'e yükselirse
veya | TECENTRIQ tedavisine ara verilir.
Olay 12 hafta içinde 0. derece veya 1. dereceye iyileştiğinde ve kortikosteroidler günde ≤10 mg prednizon veya eşdeğerine düşürüldüğünde tedaviye devam edilebilir. |
Doz gecikmesi veya kesilmesi (ayrıca bkz. Bölüm 4.4 ve 4.8): Tablo 1: TECENTRIQ için doz modifikasyon tavsiyesi
İmmünite ile ilişkili advers reaksiyon | Şiddet | Tedavi modifikasyonu |
| Eğer AST veya ALT başlangıçta >3 x ila ≤5 x NÜS olup >8 x ila ≤10 x NÜS'e yükselirse |
|
Eğer AST veya ALT >10 x NÜS'e yükselirse
veya
total bilirubin >3 x NÜS'e yükselirse | TECENTRIQ tedavisi tamamen kesilir. | |
Kolit | 2. veya 3. derece diyare (başlangıca göre ≥4 dışkı/gün)
veya Semptomatik kolit | TECENTRIQ tedavisine ara verilir.
Olay 12 hafta içinde 0. derece veya 1. dereceye iyileştiğinde ve kortikosteroidler günde ≤10 mg prednizon veya eşdeğerine düşürüldüğünde tedaviye devam edilebilir. |
4. derece diyare veya kolit (yaşamı tehdit edici; acil müdahale endike) | TECENTRIQ tedavisi tamamen kesilir. | |
Hipotiroidizm veya hipertiroidizm | Semptomatik | TECENTRIQ tedavisine ara verilir.
Hipotiroidizm: Semptomlar tiroid replasman tedavisi ile kontrol altına alındığında ve TSH düzeyleri düşmeye başladığında tedaviye devam edilebilir.
Hipertiroidizm: Semptomlar anti-tiroid bir tıbbi ürün ile kontrol altına alındığında ve tiroid fonksiyonu iyileşmeye başladığında tedaviye devam edilebilir. |
Adrenal yetmezlik | Semptomatik | TECENTRIQ tedavisine ara verilir.
Semptomlar 12 hafta içinde 0. derece veya 1. dereceye iyileştiğinde ve kortikosteroidler günde ≤10 |
İmmünite ile ilişkili advers reaksiyon | Şiddet | Tedavi modifikasyonu |
|
| mg prednizon veya eşdeğerine düşürüldüğünde ve hastanın durumu replasman tedavisinde stabil hale geldiğinde tedaviye devam edilebilir. |
Hipofizit | 2. veya 3. derece | TECENTRIQ tedavisine ara verilir.
Semptomlar 12 hafta içinde 0. derece veya 1. dereceye iyileştiğinde ve kortikosteroidler günde ≤10 mg prednizon veya eşdeğerine düşürüldüğünde ve hastanın durumu replasman tedavisinde stabil hale geldiğinde tedaviye devam edilebilir. |
4. derece | TECENTRIQ tedavisi tamamen kesilir. | |
Tip 1 diabetes mellitus | 3. veya 4. derece hiperglisemi (açlık glukozu >250 mg/dL veya 13,9 mmol/L) | TECENTRIQ tedavisine ara verilir.
İnsülin replasman tedavisinde metabolik kontrol elde edildiğinde tedaviye devam edilebilir. |
Döküntü/Şiddetli kutanöz advers reaksiyonlar | 3. derece
veya şüpheli Stevens- Johnson sendromu (SJS) veya toksik epidermal nekroliz (TEN) | TECENTRIQ tedavisine ara verilir.
Semptomlar 12 hafta içinde 0. derece veya 1. dereceye iyileştiğinde ve kortikosteroidler günde ≤10 mg prednizon veya eşdeğerine düşürüldüğünde tedaviye devam edilebilir. |
4. derece
veya doğrulanmış Stevens- Johnson sendromu (SJS) veya toksik epidermal nekroliz (TEN) | TECENTRIQ tedavisi tamamen kesilir. | |
Miyastenik sendrom/ miyastenia gravis, Guillain-Barré sendromu ve meningoensefalit | Tüm dereceler | TECENTRIQ tedavisi tamamen kesilir. |
İmmünite ile ilişkili advers reaksiyon | Şiddet | Tedavi modifikasyonu |
Pankreatit | Serum amilaz veya lipaz düzeylerinde 3. veya 4. derece yükselme (> 2 NÜS) veya 2. veya 3. derece pankreatit | TECENTRIQ tedavisine ara verilir.
Serum amilaz ve lipaz düzeyleri 12 hafta içinde 0. derece veya 1. dereceye iyileştiğinde veya pankreatit semptomları düzeldiğinde ve kortikosteroidler günde ≤10 mg prednizon veya eşdeğerine düşürüldüğünde TECENTRIQ ile tedaviye devam edilebilir. |
4. derece veya herhangi bir derecede nükseden pankreatit | TECENTRIQ tedavisi tamamen kesilir. | |
Miyokardit | 2. derece veya üzeri | TECENTRIQ tedavisi tamamen kesilir. |
Nefrit | 2. derece (kreatinin düzeyi > başlangıca göre 1,5 â 3 x veya >1,5 â 3 x NÜS) | TECENTRIQ tedavisine ara verilir.
Olay 12 hafta içinde 0. derece veya 1. dereceye iyileştiğinde ve kortikosteroidler günde ≤10 mg prednizon veya eşdeğerine düşürüldüğünde tedaviye devam edilebilir. |
3. veya 4. derece (kreatinin düzeyinde başlangıca göre 3 kat artış veya NÜS'e göre 3 kat artış) | TECENTRIQ tedavisi tamamen kesilir. | |
Miyozit | 2. veya 3. derece | TECENTRIQ tedavisine ara verilir |
4. derece veya 3. derecede nükseden miyozit | TECENTRIQ tedavisi tamamen kesilir. | |
Perikardiyal bozukluklar | 1. derece perikardit | TECENTRIQ tedavisine ara verilir |
2. derece veya üzeri | TECENTRIQ tedavisi tamamen kesilir | |
Hemofagositik lenfohistiyositoz | Şüpheli hemofagositik lenfohistiyositoz | TECENTRIQ tedavisi tamamen kesilir |
İmmünite ile ilişkili diğer advers reaksiyonlar | 2. veya 3. derece | Olay 12 hafta içinde 0. derece veya 1. dereceye iyileşene ve kortikosteroidler günde ≤10 mg prednizon veya |
İmmünite ile ilişkili advers reaksiyon | Şiddet | Tedavi modifikasyonu |
|
| eşdeğerine düşürülene kadar TECENTRIQ tedavisine ara verilir. |
4. derece veya 3. derece nükseden advers olaylar | TECENTRIQ tedavisi tamamen kesilir. (replasman hormonlarıyla kontrol altına alınan endokrinopatiler hariç) | |
Diğer Advers reaksiyonlar | Şiddet | Tedavi Modifikasyonu |
İnfüzyonla ilişkili reaksiyonlar | 1. veya 2. derece | İnfüzyon hızı azaltılır veya kesilir.
Olay düzeldikten sonra tedavi sürdürülebilir. |
3. veya 4. derece | TECENTRIQ tedavisi tamamen kesilir. |
Not: Toksisite dereceleri, Ulusal Kanser Enstitüsü Advers Olaylar için Ortak Terminoloji Kriterleri, Versiyon 4.0'a (NCI-CTCAE v.4) uygundur.
TECENTRIQ ile tedavi edilen hastalara ilacın riskleri hakkında bilgi veren Hasta Uyarı Kartları verilmelidir.
Uygulama şekli:
TECENTRIQ intravenöz kullanıma yöneliktir. TECENTRIQ infüzyonları intravenöz puşe veya bolus şeklinde uygulanmamalıdır.
İlk TECENTRIQ dozu 60 dakika uygulanmalıdır. İlk infüzyon tolere edilirse, sonraki tüm infüzyonlar 30 dakikada uygulanabilir.
Tıbbi ürünün uygulanmadan önceden seyreltilmesi ve kullanımına ilişkin talimatlar için Bölüm
6.6'ya bakınız.
Özel popülasyonlara ilişkin ek bilgiler:
Karaciğer yetmezliği:
Popülasyon farmakokinetik analizine göre hafif veya orta düzeyde karaciğer bozukluğu olan hastalarda doz ayarlaması gerekli değildir. Şiddetli karaciğer bozukluğu olan hastalara ilişkin veri mevcut değildir (bkz. Bölüm 5.2).
Böbrek yetmezliği:
Popülasyon farmakokinetik analizine göre hafif ve orta derecede böbrek bozukluğu olan hastalarda doz ayarlaması gerekli değildir (bkz. Bölüm 5.2). Şiddetli böbrek bozukluğu olanlara ait bilgi, bu popülasyonda bir sonuca varmak için çok azdır.
Pediyatrik popülasyon:
TECENTRIQ'in çocuklarda ve 18 yaş altındaki adolesanlarda güvenliliği ve etkililiği gösterilmemiştir. Mevcut olan veriler Bölüm 4.8, 5.1 ve 5.2'de anlatılmıştır ancak pozoloji ile ilgili herhangi bir tavsiye verilememektedir.
Geriyatrik popülasyon:
Popülasyon farmakokinetik analizine göre 65 yaş ve üstündeki hastalarda TECENTRIQ doz ayarlaması gerekli değildir (bkz. Bölüm 4.8 ve 5.1).
Doğu Kooperatif Onkoloji Grubu (ECOG) performans statüsü ≥2
ECOG performans statüsü ≥2 olan hastalar Küçük Hücreli Dışı Akciğer Kanseri (KHDAK), Erken Evre Küçük Hücreli Akciğer Kanseri (EE-KHAK), 2. Basamak Ürotelyal Kanser ve Hepatoselüler Kanser klinik çalışmalarına dahil edilmemiştir (bkz. Bölüm 4.4 ve 5.1).
4.3. Kontrendikasyonlar
TECENTRIQ'in etkin maddesi atezolizumaba veya Bölüm 6.1'de listelenen yardımcı maddelerden herhangi birine aşırı duyarlılığı olan hastalarda kontrendikedir.
4.4. Özel kullanım uyarıları ve önlemleri
İmmünite ile ilişkili advers reaksiyonlar:TECENTRIQ ile tedavi sırasında oluşan immünite ile ilişkili advers reaksiyonların çoğu ilacın kesilmesi ve kortikosteroidlerin veya destekleyici tedavinin başlatılmasıyla geri döndürülebilir olmuştur. Birden fazla vücut sistemini etkileyen immünite ile ilişkili advers reaksiyonlar görülmüştür ve bu reaksiyonlar TECENTRIQ'in son dozundan sonra da oluşabilir.
İmmünite ile ilişkili şüpheli advers reaksiyonlar için etyolojiyi doğrulamak veya diğer nedenleri dışlamak için yeterli değerlendirme yapılmalıdır. Advers etkilerin şiddetine bağlı olarak, TECENTRIQ tedavisine ara verilir ve kortikosteroid uygulanır. Olay ≤ 1. dereceye iyileştiğinde kortikosteroid kullanımı ≥1 ay boyunca azaltılarak kesilmelidir. İmmünite ile ilişkili istenmeyen reaksiyonların kortikosteroid kullanımı ile kontrol edilemediği hastalarda, klinik çalışmalardan elde edilen sınırlı verilere dayanarak, diğer sistemik immunosupresan ajanların kullanımı düşünülebilir.
Herhangi bir 3. derece immünite ile ilişkili advers reaksiyon ikinci defa ortaya çıkarsa ve replasman hormonlar ile kontrol edilen endokrinopatiler hariç herhangi bir 4. derece immünite ile ilişkili advers reaksiyon görülürse TECENTRIQ tedavisi tamamen kesilmelidir (bkz. Bölüm 4.2 ve 4.8).
İmmünite ile ilişkili pnömonit:
TECENTRIQ ile yürütülen klinik çalışmalarda ölümcül vakalar da dahil olmak üzere pnömonit vakaları gözlenmiştir (bkz. Bölüm 4.8). Hastalar pnömonit belirtileri ve semptomları için izlenmeli ve immünite ile ilişkili pnömonit dışındaki sebepler dışlanmalıdır.
2. derece pnömonit durumunda TECENTRIQ ile tedaviye ara verilmeli ve günde 1-2 mg/kg
vücut ağırlığı prednizon veya eşdeğeri ile tedavi başlatılmalıdır. Semptomlar ≤1. dereceye iyileşirse kortikosteroidler ≥1 ay boyunca azaltılarak kesilmelidir. Olay 12 hafta içinde ≤1. dereceye iyileşirse ve kortikosteroidler günde ≤10 mg prednizon veya eşdeğerine düşürülürse TECENTRIQ ile tedaviye devam edilebilir. 3. veya 4. derece pnömonit durumunda TECENTRIQ ile tedavi kalıcı olarak bırakılmalıdır.
İmmünite ile ilişkili hepatit:
TECENTRIQ ile yürütülen klinik çalışmalarda bazıları ölümcül sonuçlara yol açan hepatit vakaları gözlenmiştir (bkz. Bölüm 4.8). Hastalar hepatit belirtileri ve semptomları için izlenmelidir.
Aspartat aminotransferaz (AST), alanin aminotransferaz (ALT) ve bilirubin, TECENTRIQ ile tedavi öncesinde ve tedavi sırasında periyodik olarak ve klinik çalışmalarda belirtildiği gibi izlenmelidir.
Hepatoselüler kanseri olmayan hastalarda 2. derece olay (ALT veya AST >3-5 x NÜS veya kan bilirubin >1,5-3 x NÜS) 5-7 günden uzun süre devam ederse TECENTRIQ ile tedaviye ara verilmeli ve günde 1-2 mg/kg vücut ağırlığı prednizon veya eşdeğeri ile tedavi başlatılmalıdır. Olaylar ≤1. dereceye iyileşirse kortikosteroidler ≥1 ay boyunca azaltılarak kesilmelidir.
Olay 12 hafta içinde ≤1. dereceye iyileşirse ve kortikosteroidler günde ≤10 mg prednizon veya eşdeğerine düşürülürse TECENTRIQ ile tedaviye devam edilebilir. 3. veya 4. derece olaylarda (ALT veya AST >5 x NÜS veya kan bilirubin >3 x NÜS) TECENTRIQ ile tedavi kalıcı olarak bırakılmalıdır.
Hepatoselüler kanseri olan hastalarda, ALT veya AST başlangıçtaki normal sınırlardan >3 ila
≤10 x NÜS'e; veya başlangıçtan >1 ila ≤3 x NÜS'ten >5 ila ≤10 x NÜS'e; veya başlangıçtan
>3 ila ≤5 x NÜS'ten >8 ila ≤10 x NÜS'e yükselir ve 5-7 günden uzun süre devam ederse TECENTRIQ ile tedaviye ara verilmeli ve günde 1-2 mg/kg vücut ağırlığı prednizon veya eşdeğeri ile tedavi başlatılmalıdır. Olaylar ≤1. dereceye iyileşirse kortikosteroidler ≥1 ay boyunca azaltılarak kesilmelidir.
12 hafta içinde olaylar ≤1. dereceye iyileşirse ve kortikosteroidler günde ≤10 mg veya eşdeğerine azaltılırsa TECENTRIQ tedavisine devam edilebilir. ALT veya AST >10 x NÜS veya total bilirubin >3 x NÜS'e yükselirse TECENTRIQ tedavisi tamamen kesilmelidir.
İmmünite ile ilişkili kolit:
TECENTRIQ ile yürütülen klinik çalışmalarda diyare veya kolit vakaları gözlenmiştir (bkz. Bölüm 4.8). Hastalar kolit belirtileri ve semptomları için izlenmelidir.
2. veya 3. derece diyare (başlangıca göre ≥4 dışkı/gün artış) veya kolit (semptomatik) durumunda TECENTRIQ ile tedaviye ara verilmelidir. 2. derece diyare veya kolit durumunda semptomlar >5 gün devam ederse veya nüksederse, günde 1-2 mg/kg vücut ağırlığı prednizon veya eşdeğeri ile tedavi başlatılmalıdır. 3. derece diyare veya kolit durumunda IV kortikosteroidlerle (1-2 mg/kg vücut ağırlığı/gün metilprednizolon veya eşdeğeri) tedavi başlatılmalı ve semptomlar iyileşmeye başladığında günde 1-2 mg/kg vücut ağırlığı prednizon veya eşdeğerine geçilmelidir. Semptomlar ≤1. dereceye iyileşirse kortikosteroidler ≥1 ay boyunca azaltılarak kesilmelidir. Olay 12 hafta içinde ≤1. dereceye iyileşirse ve kortikosteroidler günde ≤10 mg prednizon veya eşdeğerine düşürülürse TECENTRIQ ile
tedaviye devam edilebilir. 4. derece (yaşamı tehdit edici; acil müdahale endike) diyare veya kolit durumunda TECENTRIQ ile tedavi kalıcı olarak bırakılmalıdır. Kolit ile ilişkili potansiyel gastrointestinal perforasyon komplikasyonu dikkate alınmalıdır.
İmmünite ile ilişkili endokrinopatiler:
TECENTRIQ ile yürütülen klinik çalışmalarda hipotiroidizm, hipertiroidizm, adrenal yetmezlik, hipofizit ve diyabetik ketoasidoz dahil olmak üzere tip 1 diabetes mellitus vakaları gözlenmiştir (bkz. Bölüm 4.8).
Hastalar endokrinopatilerin klinik belirtileri ve semptomları için izlenmelidir. Tiroid fonksiyonu TECENTRIQ ile tedavi öncesinde ve tedavi sırasında periyodik olarak izlenmelidir. Başlangıçta anormal tiroid fonksiyon testleri olan hastaların uygun şekilde tedavi edilmesi düşünülmelidir.
Tiroid fonksiyonu testleri anormal olan asemptomatik hastalar TECENTRIQ alabilir. Semptomatik hipotiroidizm durumunda TECENTRIQ ile tedaviye ara verilmeli ve tiroid hormonu replasmanı gerektiğinde başlatılmalıdır. İzole hipotiroidizm kortikosteroidler kullanılmadan replasman tedavisi ile yönetilebilir. Semptomatik hipertiroidizm durumunda TECENTRIQ ile tedaviye ara verilmeli ve bir anti-tiroid tıbbi ürün gerektiği gibi başlatılmalıdır. Semptomlar kontrol altına alındığında ve tiroid fonksiyonu iyileştiğinde TECENTRIQ ile tedaviye devam edilebilir.
Semptomatik adrenal yetmezlik durumunda TECENTRIQ ile tedaviye ara verilmeli ve intravenöz kortikosteroid (günde 1-2 mg/kg vücut ağırlığı metilprednizolon veya eşdeğeri) ile tedavi başlatılmalıdır. Semptomlar iyileştiğinde günde 1-2 mg/kg vücut ağırlığı prednizon veya eşdeğeri ile tedavi uygulanmalıdır. Semptomlar ≤1. dereceye iyileşirse kortikosteroidler ≥1 ay boyunca azaltılarak kesilmelidir. Olay 12 hafta içinde ≤1. dereceye iyileşirse ve kortikosteroidler günde ≤10 mg prednizon veya eşdeğerine düşürülürse ve hastanın durumu replasman tedavisinde stabilse (gerekli ise) tedaviye devam edilebilir.
2. veya 3. derece hipofizit için TECENTRIQ kesilmeli ve intravenöz kortikosteroidler (1 ila 2 mg/kg vücut ağırlığı/gün metilprednizolon veya eşdeğeri) ile tedavi başlatılmalı ve ihtiyaca göre hormon replasman tedavisi başlatılmalıdır. Belirtiler düzeldiğinde 1 ila 2 mg/kg vücut ağırlığı/gün prednizon veya eşdeğeri ile tedavi uygulanmalıdır. Semptomlar ≤ 1. dereceye iyileşirse, kortikosteroidler ≥ 1 ay boyunca azaltılarak kesilmelidir. Olay, 12 hafta içinde ≤ 1. dereceye iyileşir ve kortikosteroidler günde ≤ 10 mg prednizona veya eşdeğerine düşürülürse ve hasta replasman tedavisinde (eğer gerekli ise) stabil kalırsa, tedaviye devam edilebilir. 4. derece hipofizit için TECENTRIQ tedavisi kesilmelidir.
Tip 1 diabetes mellitus için insülin tedavisi başlatılmalıdır. ≥3. derece hiperglisemi (açlık glukozu >250 mg/dL veya 13,9 mmol/L) durumunda TECENTRIQ ile tedaviye ara verilmelidir. İnsülin replasman tedavisinde metabolik kontrol elde edilirse TECENTRIQ ile tedaviye devam edilebilir.
İmmünite ile ilişkili meningoensefalit:
TECENTRIQ ile yürütülen klinik çalışmalarda meningoensefalit gözlenmiştir (bkz. Bölüm 4.8). Hastalar menenjit veya ensefalitin klinik belirtileri ve semptomları için izlenmelidir.
Herhangi bir derece menenjit veya ensefalit durumunda TECENTRIQ ile tedavi kalıcı olarak
bırakılmalıdır. İntravenöz kortikosteroidler (günde 1-2 mg/kg vücut ağırlığı metilprednizolon veya eşdeğeri) ile tedavi başlatılmalı ve hastanın durumu iyileştiğinde 1-2 mg/kg vücut ağırlığı prednizon veya eşdeğerine geçilmelidir.
İmmünite ile ilişkili nöropatiler:
TECENTRIQ alan hastalarda yaşamı tehdit edici olabilen miyastenik sendrom/miyastenia gravis veya Guillain-Barré sendromu gözlenmiştir. Hastalar motor ve duyusal nöropati semptomları için izlenmelidir.
Herhangi bir derece miyastenik sendrom/miyastenia gravis veya Guillain-Barré sendromu durumunda TECENTRIQ ile tedavi kalıcı olarak bırakılmalıdır. Günde 1-2 mg/kg dozda prednizon veya eşdeğeri ile sistemik kortikosteroidlerin başlatılması düşünülmelidir.
İmmünite ile ilişkili pankreatit:
TECENTRIQ ile yürütülen klinik çalışmalarda serum amilaz ve lipaz düzeylerinde artışlar dahil olmak üzere pankreatit gözlenmiştir (bkz. Bölüm 4.8). Hastalar akut pankreatiti düşündüren belirtiler ve semptomlar için yakından izlenmelidir.
Serum amilaz veya lipaz düzeylerinde ≥3. derece artış (> 2 NÜS) veya 2. veya 3. derece pankreatit durumunda TECENTRIQ ile tedaviye ara verilmeli ve günde 1-2 mg/kg vücut ağırlığı IV metilprednizolon veya eşdeğeri ile tedavi başlatılmalıdır. Semptomlar iyileştiğinde günde 1-2 mg/kg vücut ağırlığı prednizon veya eşdeğeri ile tedavi uygulanmalıdır. Serum amilaz ve lipaz düzeyleri 12 hafta içinde ≤1. dereceye iyileştiğinde veya pankreatit semptomları düzeldiğinde ve kortikosteroidler günde ≤10 mg prednizon veya eşdeğerine düşürüldüğünde TECENTRIQ ile tedaviye devam edilebilir. 4. derece veya herhangi bir derecede nükseden pankreatit durumunda TECENTRIQ ile tedavi kalıcı olarak bırakılmalıdır.
İmmünite ile ilişkili miyokardit:
TECENTRIQ ile yürütülen klinik çalışmalarda ölümcül vakalar da dahil olmak üzere miyokardit gözlemlenmiştir (bkz. Bölüm 4.8). Hastalar miyokarditi düşündüren belirtiler ve semptomlar açısından izlenmelidir. Miyokardit, miyozitin klinik bir belirtisi de olabilir ve uygun bir şekilde tedavi edilmelidir.
Kardiyak veya kardiyopulmoner semptomları olan hastalar, uygun önlemlerin erken evrede başlatılmasını sağlamak için potansiyel miyokardit açısından değerlendirilmelidir. Miyokardit şüphesi varsa, TECENTRIQ ile tedaviye ara verilmeli ve günde 1-2 mg/kg vücut ağırlığı prednizon veya eşdeğeri ile sistemik kortikosteroidler başlatılmalı ve güncel klinik kılavuzlara göre tanısal incelemeler ile birlikte hızlı kardiyoloji konsültasyonu yapılmalıdır. Miyokardit tanısı konulduğunda, ≥2. derece miyokardit durumunda TECENTRIQ ile tedavi kalıcı olarak bırakılmalıdır (bkz. Bölüm 4.2).
İmmünite ile ilişkili nefrit:
TECENTRIQ ile yürütülen klinik çalışmalarda nefrit gözlemlenmiştir (bkz. Bölüm 4.8). Hastalar renal fonksiyonda değişiklikler açısından yakından izlenmelidir.
2. derece nefrit durumunda TECENTRIQ ile tedaviye ara verilmeli ve günde 1-2 mg/kg vücut ağırlığı prednizon veya eşdeğeri ile sistemik kortikosteroidler başlatılmalıdır. Olay, 12 hafta
içinde ≤1. dereceye iyileşir ve kortikosteroidler günde ≤ 10 mg prednizona veya eşdeğerine düşürüldüğünde tedaviye devam edilebilir. 3. veya 4. derece nefrit durumunda TECENTRIQ ile tedavi kalıcı olarak bırakılmalıdır.
İmmünite ile ilişkili miyozit:
TECENTRIQ ile yürütülen klinik çalışmalarda ölümcül vakalar da dahil olmak üzere miyozit vakaları gözlenmiştir (bkz. Bölüm 4.8). Hastalar miyozit belirtileri ve semptomları açısından izlenmelidir. Olası miyoziti olan hastalar miyokardit belirtileri açısından izlenmelidir.
Bir hastada miyozit belirti ve semptomları gelişirse, yakın takibe alınmalı ve hasta vakit kaybetmeden değerlendirme ve tedavi için bir uzmana yönlendirilmelidir. 2. veya 3. derece miyozit durumunda TECENTRIQ ile tedaviye ara verilmeli ve günde 1-2 mg/kg vücut ağırlığı prednizon veya eşdeğeri ile sistemik kortikosteroidler başlatılmalıdır. Semptomlar ≤ 1. dereceye iyileşirse, klinik olarak belirtildiği gibi kortikosteroidler azaltılarak kesilebilir. Olay, 12 hafta içinde ≤1. dereceye iyileşir ve kortikosteroidler günde ≤ 10 mg prednizona veya eşdeğerine düşürüldüğünde tedaviye devam edilebilir. 4. derece. veya 3. derece tekrarlayan miyozit durumunda ya da kortikosteroid dozu başlangıçtan sonraki 12 hafta içinde günde ≤ 10 mg prednizon eşdeğerine düşürülemediğinde TECENTRIQ ile tedavi kalıcı olarak bırakılmalıdır.
İmmünite ile ilişkili şiddetli kutanöz advers reaksiyonlar:
TECENTRIQ ile tedavi edilen hastalarda, Stevens-Johnson sendromu (SJS) ve toksik epidermal nekroliz (TEN) dahil olmak üzere immünite ile ilişkili şiddetli kutanöz advers reaksiyonlar bildirilmiştir. Hastalar şüpheli şiddetli cilt reaksiyonları açısından izlenmeli ve diğer sebepler dışlanmalıdır. Şüpheli şiddetli kutanöz advers reaksiyonları varlığında hastalar daha ileri teşhis ve takip için bir uzmana yönlendirilmelidir.
Advers reaksiyonların şiddetine bağlı olarak, 3. derece cilt reaksiyonu durumunda TECENTRIQ ile tedaviye ara verilmeli ve günde 1-2 mg/kg vücut ağırlığı prednizon veya eşdeğeri ile sistemik kortikosteroidler başlatılmalıdır. Olay, 12 hafta içinde ≤1. dereceye iyileşir ve kortikosteroidler günde ≤ 10 mg prednizona veya eşdeğerine düşürüldüğünde TECENTRIQ tedavisine devam edilebilir. 4. derece cilt reaksiyonları durumunda TECENTRIQ ile tedavi kalıcı olarak bırakılmalı ve kortikosteroid uygulanmalıdır.
Stevens-Johnson sendromu (SJS) ve toksik epidermal nekroliz (TEN) şüphesi olan hastalarda TECENTRIQ ile tedaviye ara verilmelidir. Doğrulanmış Stevens-Johnson sendromu (SJS) ve toksik epidermal nekroliz (TEN) vakalarında TECENTRIQ ile tedavi kalıcı olarak bırakılmalıdır.
Daha önce diğer immün sistemi stimüle edici ajanlarla tedavi sırasında şiddetli veya hayatı tehdit eden cilt advers reaksiyonlar yaşayan hastaların TECENTRIQ tedavisine başlanması dikkatli olarak değerlendirilmelidir.
İmmünite ile ilişkili perikardiyal bozukluklar
TECENTRIQ ile perikardit, perikardiyal efüzyon ve kardiyak tamponad gibi bazıları ölümcül sonuçlara yol açan perikardiyal bozukluklar gözlenmiştir (bkz. Bölüm 4.8). Hastalar, perikardiyal bozuklukların klinik belirtileri ve semptomları açısından izlenmelidir.
1. derece perikardit şüphesi durumunda TECENTRIQ tedavisi durdurulmalı ve mevcut klinik kılavuzlara göre tanısal çalışmalarla derhal kardiyoloji konsültasyonu başlatılmalıdır. ≥ 2. derece perikardiyal bozukluklardan şüphelenildiğinde, TECENTRIQ tedavisi kesilmeli, 1 ila 2 mg/kg vücut ağırlığı/gün prednizon veya eşdeğeri dozunda sistemik kortikosteroidlerle acil tedaviye başlanmalı ve mevcut klinik kılavuzlar doğrultusunda tanısal tetkik ile derhal kardiyoloji konsültasyonu başlatılmalıdır. Bir perikardiyal bozukluk olayı tanısı konulduktan sonra, ≥ 2. derece perikardiyal bozukluklar için TECENTRIQ tedavisi kalıcı olarak kesilmelidir (bkz. Bölüm 4.2).
Hemofagositik lenfohistiyositoz
TECENTRIQ alan hastalarda ölümcül vakalar dahil olmak üzere hemofagositik lenfohistiyositoz (HLH) bildirilmiştir (bkz. Bölüm 4.8). Atipik veya uzamış sitokin salınım sendromu varlığı durumunda HLH değerlendirilmelidir. Hastalar HLH'nin klinik belirtileri ve semptomları açısından izlenmelidir. Şüpheli HLH durumunda TECENTRIQ kalıcı olarak kesilmeli ve hastalar ileri tanı ve tedavi için bir uzmana yönlendirilmelidir.
İmmünite ile ilişkili diğer advers reaksiyonlar:
TECENTRIQ'in etki mekanizması göz önünde bulundurulduğunda, enfektif olmayan sistitin de dahil olduğu immünite ile ilişkili diğer potansiyel advers reaksiyonlar görülebilir.
Diğer sebepleri dışlamak için tüm şüpheli immünite ile ilişkili advers reaksiyonları değerlendiriniz. Hastalar immünite ile ilişkili advers reaksiyonlarına ait işaretler ve semptomlar açısından gözlenmeli ve reaksiyonun şiddetine göre, klinik gerekliliğe göre tedavi modifikasyonu ve kortikosteroidler ile yönetilmelidir (Bkz. Bölüm 4.2 ve 4.8).
İnfüzyon ile ilişkili reaksiyonlar:
TECENTRIQ ile infüzyon ile ilgili reaksiyonlar gözlenmiştir (bkz. Bölüm 4.8).
1. veya 2. derece infüzyon ile ilişkili reaksiyon görüldüğünde infüzyon hızı düşürülmeli veya tedavi kesilmelidir. 3. veya 4. derece infüzyon ile ilgili reaksiyon görüldüğünde TECENTRIQ tedavisi tamamen sonlandırılmalıdır. 1. veya 2. derece infüzyon ile ilişkili reaksiyon görülen hastalar yakından izlenerek TECENTRIQ almaya devam edebilir; bu hastalarda antipiretik ve antihistaminiklerle premedikasyon değerlendirilebilir.
Hastalığa spesifik önlemler
TECENTRIQ'in, daha önce tedavi almamış sisplatine uygun olmayan ürotelyal kanseri olan hastalarda kullanılması
Imvigor210 Kohort 1 çalışma popülasyonunun başlangıç ve prognostik hastalık karakterizasyonu, klinikteki sisplatine uygun olmayan ama karboplatin bazlı kombinasyon kemoterapi kullanımına uygun olan hastalar ile genel olarak karşılaştırabilir olmuştur. Herhangi bir kemoterapi için uygun olmayan hastalara ait alt grup için veriler yetersizdir, bu nedenle TECENTRIQ bu hastalarda dikkatli kullanılmalı ve bireysel olarak potansiyel risk ve yarar dengesi dikkatli olarak değerlendirilmelidir.
Hepatoselüler kanseri olan hastalarda TECENTRIQ'in bevacizumab ile birlikte kullanılması
Child-Pugh B karaciğer hastalığı olan, TECENTRIQ ile bevacizumab kombinasyon tedavisi
alan HSK hastalarına ait veriler çok sınırlıdır ve mevcut durumda Child-Pugh C karaciğer hastalığı olan HSK hastalarına ait veri bulunmamaktadır.
Bevacizumab ile tedavi edilen hastalarda hemoraji riski yüksektir ve TECENTRIQ ile birlikte bevacizumab kullanan hepatoselüler kanserli hastalarda ölümcül olayları da kapsayan şiddetli gastrointestinal hemoraji vakaları bildirilmiştir. Hepatoselüler kanseri olan hastalarda TECENTRIQ ile birlikte bevacizumab tedavisine başlamadan önce klinik pratik olarak özofageal varislerin taranması ve tedavisi yapılmalıdır. Kombinasyon tedavisi ile 3. veya 4. derece kanama geçiren hastalarda bevacizumab tedavisi tamamen kesilmelidir. Konu ile ilgili bevacizumab Kısa Ürün Bilgisine bakınız.
TECENTRIQ ile birlikte bevacizumab tedavisi sırasında diyabetes mellitus ortaya çıkabilir. Hekimler TECENTRIQ ile birlikte bevacizumab tedavisi öncesinde ve periyodik olarak tedavi boyunca klinik olarak gerekliliklere göre kan glukoz seviyelerini takip etmelidir.
1. Basamak Küçük Hücreli Dışı Akciğer Kanseri tedavisinde monoterapi olarak TECENTRIQ kullanımı
Hekimler Küçük Hücreli Dışı Akciğer Kanseri (KHDAK) olan hastalarda monoterapi olarak 1. Basamak tedavisine başlamadan önce TECENTRIQ'in gecikmeli etkisini değerlendirmelidir. TECENTRIQ ile kemoterapi karşılaştırmasında randomizasyondan sonraki 2,5 ay boyunca görülen daha yüksek ölüm vaka sayısını uzun süreli sağkalım faydası takip etmiştir. Erken ölüm vakaları ile ilgili spesifik faktör(ler) tespit edilmemiştir (bkz. Bölüm 5.1).
Klinik çalışmalardan dışlanan hastalar:
Aşağıdaki koşullara sahip hastalar klinik çalışmalara dahil edilmemiştir: Otoimmün hastalık geçmişi, pnömonit geçmişi, aktif beyin metastazı, HIV, hepatit B ya da hepatit C enfeksiyonu (Hepatoselüler kanseri olmayan hastalar için), önemli kardiyovasküler hastalığı ve yetersiz hematolojik ve hedef organ fonksiyonu. Kayıttan 28 gün önce canlı, zayıflatılmış bir aşı uygulanan hastalar, çalışmaya başlamadan önceki 4 hafta içerisinde sistemik immün sistemi uyarıcı ajanlar veya 2 hafta içerisinde sistemik immunosupresif ajanlar kullanan hastalar ve çalışmaya başlamadan 2 hafta önce terapötik oral veya IV antibiyotik kullanan hastalar klinik çalışmalara alınmamıştır.
Biyoteknolojik ürünlerin takip edilebilirliği:
Biyoteknolojik ürünlerin takip edilebilirliğinin sağlanması için uygulanan ürünün ticari ismi ve seri numarası mutlaka hasta dosyasına kaydedilmelidir.
Hasta Uyarı Kartı:
TECENTRIQ reçete eden hekimler, TECENTRIQ tedavisinin risklerini hastalarına açıklamalıdır. TECENTRIQ ile tedavi edilen hastalara ilacın riskleri hakkında bilgi veren Hasta Uyarı Kartları verilmeli ve kartı her zaman yanlarında taşımaları söylenmelidir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
TECENTRIQ ile herhangi bir resmi farmakokinetik ilaç etkileşimi çalışması yapılmamıştır. TECENTRIQ dolaşımdan katabolizma ile temizlendiğinden metabolik ilaç-ilaç etkileşimleri beklenmemektedir.
TECENTRIQ ile tedaviye başlamadan önce, TECENTRIQ'in farmakodinamik aktivitesine ve etkililiğine yapabilecekleri potansiyel etkiler nedeniyle sistemik kortikosteroidlerin veya immunosupresanların kullanılmasından kaçınılmalıdır. Bununla birlikte, sistemik kortikosteroidler veya diğer immunosupresif maddeler, TECENTRIQ tedavisine başladıktan sonra immünite ile ilişkili advers reaksiyonların tedavisinde kullanılabilir (bkz. Bölüm 4.4).
Özel popülasyonlara ilişkin ek bilgiler:
TECENTRIQ ile herhangi bir farmakokinetik ilaç etkileşimi çalışması yapılmamıştır.
Pediyatrik popülasyon:
TECENTRIQ ile pediyatrik popülasyonda herhangi bir farmakokinetik ilaç etkileşimi çalışması yapılmamıştır.
4.6. Gebelik ve laktasyon
:Gebelik kategorisi: D
Çocuk doğurma potansiyeli bulunan kadınlar/doğum kontrolü (kontrasepsiyon):
Çocuk doğurma potansiyeline sahip kadınlar TECENTRIQ ile tedavi sırasında ve tedaviden 5 ay sonraya kadar etkili bir doğum kontrol yöntemi kullanmalıdır.
Gebelik dönemi:
TECENTRIQ'in hamile kadınlar üzerinde etkisine dair herhangi bir veri bulunmamaktadır. TECENTRIQ ile gelişimsel çalışmalar ve üreme çalışmaları yapılmamıştır. Hayvan çalışmalarıyla, PD-L1/PD-1 yolak inhibisyonunun fare gebelik modellerinde immünite ile ilişkili, fetüs ölümüyle sonuçlanan fetüs gelişiminin reddine sebep olduğu gösterilmiştir (bkz. Bölüm 5.3). Bu sonuçlar, etki mekanizmasına bağlı olarak potansiyel bir risk oluşturmakta olup, gebelik döneminde TECENTRIQ uygulamasının artmış düşük veya ölü doğum oranları dahil olmak üzere fetal zarara sebep olabileceğini göstermektedir.
TECENTRIQ bir insan G1 immunoglobulinidir (IgG1) ve IgG1'in plasenta bariyerini aştığı bilinmektedir. Bu nedenle, TECENTRIQ'in anneden gelişmekte olan fetüse geçme potansiyeli bulunmaktadır.
Gebe kadınların klinik durumu TECENTRIQ ile tedavi gerektirmedikçe gebelik sırasında TECENTRIQ kullanılmamalıdır.
Laktasyon dönemi:
TECENTRIQ'in anne sütüne geçip geçmediği bilinmemektedir. TECENTRIQ bir monoklonal antikordur ve ilk gelen sütte bulunması ve daha sonra da az miktarda sütte bulunması beklenmektedir. Yeni doğanlar ve infantlar üzerindeki risk dışlanamaz. Emzirmenin çocuk için faydaları ve tedavinin anne için faydaları dikkate alınarak emzirmenin durdurulması veya TECENTRIQ tedavisinin durdurulması kararlaştırılmalıdır.
Üreme yeteneği/fertilite:
TECENTRIQ'in fertilite üzerindeki olası etkilerine ilişkin veri bulunmamaktadır. TECENTRIQ'in doğurganlık üzerindeki etkisini değerlendirme amaçlı reprodüktif ve gelişimsel toksisite çalışmaları yapılmamıştır. Bununla birlikte, 26 haftalık yinelenen doz toksisitesi çalışmasında, önerilen dozda TECENTRIQ kullanan hastalarda menstrüel siklusta eğri altında kalan alanı yaklaşık 6 katına çıkardığı ve geri dönüşümlü olduğu görülmüştür (bkz. Bölüm 5.3). Erkek reprodüktif organları üzerinde etki görülmemiştir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
TECENTRIQ'in araç ve makine kullanma yeteneği üzerinde küçük bir etki göstermesi söz konusudur. Yorgunluk hisseden hastalara semptomlar hafifleyene kadar araç ve makine kullanmamaları tavsiyesinde bulunulmalıdır (bkz. Bölüm 4.8).
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti:TECENTRIQ monoterapisinin güvenliliği, çoklu tümör tiplerinde 4349 hastadaki havuzlanmış verilere dayandırılmıştır. En yaygın advers reaksiyonlar (>%10); yorgunluk (%30,1), iştah kaybı (%21,3), bulantı (%20), döküntü (%19,3), pireksi (%19), öksürük (%18,6), diyare (%18),
dispne (%17,2), artralji (%16,7), asteni (%13,2), pirürit (%13,2), sırt ağrısı (%12,8), kusma (%12,5), idrar yolu enfeksiyonu (%11,5) ve baş ağrısı (%10,3) olmuştur.
TECENTRIQ'in diğer tıbbi ürünlerle kombinasyonunda kullanımının güvenliliği, çoklu tümör tiplerinde 4535 hastada değerlendirilmiştir. En yaygın advers reaksiyonlar (≥%20); anemi (%36,8), nötropeni (36,6), bulantı (%35,5), yorgunluk (%33,1), trombositopeni (%27,1), diyare
(%27,6), döküntü (%27,8), alopesi (%28,1), konstipasyon (%25,8), iştah azalması (%24,7), periferal nöropati (%24,4) olmuştur.
Adjuvan Küçük Hücreli Dışı Akciğer Kanseri koşulunda TECENTRIQ kullanımı
Küçük hücreli dışı akciğer kanseri (KHDAK) hasta popülasyonunda adjuvan ortamda TECENTRIQ'in güvenlilik profili (IMpower010), genel olarak ileri evre ortamında genel havuzlanmış monoterapi güvenlilik profili ile tutarlı olmuştur. Bununla birlikte, ileri evre hastalığı olan havuzlanmış monoterapi popülasyonunda immün sistemle ilişkili advers reaksiyonlarının insidansı %38,4 iken, IMpower010 çalışmasında atezolizumabın immün sistemle ilişkili advers reaksiyonlarının insidansı %51,7 olmuştur. Adjuvan ortamda immün sistemle ilgili yeni advers reaksiyonlar saptanmamıştır.
Ciddi advers reaksiyonlara dair detaylı bilgiler Bölüm 4.4 Özel kullanım uyarıları ve önlemleri bölümünde verilmektedir.
Advers reaksiyonların tablo halinde listesi
Advers İlaç Reaksiyonları (ADR), MedDRA sistem organ sınıfına (SOC) ve sıklık kategorilerine göre Tablo 2'de TECENTRIQ monoterapi veya kombinasyon tedavisi için listelenmiştir. Kombinasyon tedavisi kullanılan klinik çalışmalarda raporlanmasa bile, tek başına TECENTRIQ ile veya kemoterapiler ile ortaya çıkabileceği bilinen advers reaksiyonlar, kombinasyon tedavisi sırasında ortaya çıkabilir.
Aşağıdaki sıklık kategorileri kullanılmıştır:
Çok yaygın (≥1/10), yaygın (≥1/100 ila <1/10), yaygın olmayan (≥1/1000 ila <1/100), seyrek (≥1/10.000 ila <1/1000), çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Her bir sıklık grubunda advers reaksiyonlar azalan ciddiyet sırasına göre yazılmıştır.
Tablo 2: TECENTRIQ ile tedavi edilen hastalarda meydana gelen advers reaksiyonların özeti
TECENTRIQ monoterapi | TECENTRIQ kombinasyon tedavisi | |
Enfeksiyonlar ve enfestasyonlar | ||
Çok yaygın | İdrar yolları enfeksiyonu | Akciğer enfeksiyonu |
Yaygın |
| Sepsis |
Kan ve lenf listemi hastalıkları | ||
Çok yaygın |
| Anemi, trombositopeni, nötropeni, lökopeni |
Yaygın | Trombositopeni | Lenfopeni |
Seyrek | Hemofagositik lenfohistiyositoz | Hemofagositik lenfohistiyositoz |
Bağışıklık sistemi hastalıkları | ||
Yaygın | İnfüzyonla ilgili reaksiyon | İnfüzyonla ilgili reaksiyon |
Endokrin hastalıklar | ||
Çok yaygın |
| Hipotiroidizm |
Yaygın | Hipotiroidizm , Hipertiroidizm | Hipertiroidizm |
Yaygın olmayan | Diabetes mellitus, Adrenal yetmezlik |
|
Seyrek | Hipofizit |
|
Metabolizma ve beslenme hastalıkları | ||
Çok yaygın | İştah kaybı | İştah kaybı |
Yaygın | Hipokalemi, Hiponatremi, Hiperglisemi | Hipokalemi, Hiponatremi, Hipomagnezemi |
Sinir sistemi hastalıkları | ||
Çok yaygın | Baş ağrısı | Periferal nöropati, Baş ağrısı |
Yaygın |
| Senkop, Baş dönmesi |
Yaygın olmayan | Guillain-Barré sendromu, Meningoensefalit |
|
Seyrek | Miyastenik sendrom |
|
Göz Hastalıkları | ||
Seyrek | Üveit |
|
Kardiyak hastalıklar | ||
Yaygın | Perikardiyal bozukluklar |
|
Yaygın olmayan |
| Perikardiyal bozukluklar |
Seyrek | Miyokardit |
|
Vasküler hastalıklar | ||
Çok yaygın |
| Hipertansiyon |
Yaygın | Hipotansiyon |
|
Solunum, göğüs bozuklukları ve mediastinal hastalıklar | ||
Çok yaygın | Dispne, Öksürük | Dispne, Öksürük, nazofarenjit |
TECENTRIQ monoterapi | TECENTRIQ kombinasyon tedavisi | |
Yaygın | Pnömonit, Hipoksi, Nazofarenjit | Disfoni |
Gastrointestinal hastalıklar | ||
Çok yaygın | Bulantı, Kusma, Diyare | Bulantı, Kusma, Diyare, Konstipasyon |
Yaygın | Kolit, Karın ağrısı, Disfaji, Orafaringeal ağrı | Stomatit, Disguzi |
Yaygın olmayan | Pankreatit |
|
Hepatobiliyer hastalıkları | ||
Yaygın | AST artışı, ALT artışı, Hepatit | AST artışı, ALT artışı |
Deri ve deri altı doku hastalıkları | ||
Çok yaygın | Döküntü, Pirürit | Döküntü, Pirürit, Alopesi |
Yaygın | Ciltte kuruluk |
|
Yaygın olmayan | Şiddetli kutanöz advers reaksiyonlar, Psoriazis | Şiddetli kutanöz advers reaksiyonlar, Psoriazis, |
Seyrek | Pemfigoid | Pemfigoid |
Kas-İskelet bozuklukları, bağ doku ve kemik hastalıkları | ||
Çok yaygın | Artralji, Sırt ağrısı, | Artralji, Kas-iskelet ağrısı, Sırt ağrısı, |
Yaygın | Kas-iskelet ağrısı |
|
Yaygın olmayan | Miyozit |
|
Böbrek ve idrar hastalıkları | ||
Yaygın | Kanda kreatinin yükselmesi | Proteinüri, Kanda kreatinin yükselmesi |
Yaygın olmayan | Nefrit |
|
Bilinmiyor | Enfektif olmayan sistit |
|
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar | ||
Çok yaygın | Pireksi, Yorgunluk, Asteni | Pireksi, Yorgunluk, Asteni, Periferal ödem |
Yaygın | Grip benzeri hastalık, Ürperme |
|
Araştırmalar | ||
Yaygın |
| Kanda alkalin fosfataz yükselmesi |
Seçilen advers reaksiyonların açıklaması:
Aşağıdaki veriler, klinik çalışmalarda TECENTRIQ monoterapi ile oluşan anlamlı advers reaksiyonlarla ilgili bilgileri yansıtır (bkz. Bölüm 5.1). TECENTRIQ kombinasyonu ile ortaya çıkan advers reaksiyonlara ait detaylı bilgiler, eğer advers reaksiyon TECENTRIQ monoterapiye göre klinik olarak anlamlı bir farklılık gösteriyorsa karşılaştırmalı olarak verilmiştir. Bu advers reaksiyonlar için yönetim kılavuzları Bölüm 4.2 ve 4.4'te açıklanmaktadır.
İmmünite ile ilişkili pnömonit:
Pnömonit, TECENTRIQ monoterapi alan hastaların %3 (130/4349) kadarında meydana gelmiştir. 130 hasta içinde iki olay ölümcül olmuştur. Başlangıca kadar geçen medyan süre 4 ay (aralık: 3 gün â 29,8 ay) olmuştur. Medyan süre 1,6 ay (aralık: 1 (bir) gün â 27,8+ ay; "+" sansürlenmiş bir değeri gösterir) olmuştur. Pnömonit, 29 hastada (%0,7) TECENTRIQ'in bırakılmasına yol açmıştır. Kortikosteroid kullanımı gerektiren pnömonit, TECENTRIQ monoterapi alan hastaların %1,7'sinde (76/4349) meydana gelmiştir.
İmmünite ile ilişkili hepatit:
Hepatit, TECENTRIQ monoterapi alan hastaların %1,7'sinde (75/4349) meydana gelmiştir. 75 hasta içinde iki ölümcül olay olmuştur. Başlangıca kadar geçen medyan süre 1,6 ay (aralık: 7 gün â 18,8 ay) olmuştur. Medyan süre 2,1 ay (aralık: 1 (bir) gün â 22+ ay; "+" sansürlenmiş bir değeri gösterir) olmuştur. Hepatit, 13 hastada (<%0,3) TECENTRIQ'in bırakılmasına yol açmıştır. Kortikosteroid kullanımı gerektiren hepatit, TECENTRIQ monoterapi alan hastaların %0,5'inde (22/4349) meydana gelmiştir.
İmmünite ile ilişkili kolit:
Kolit, TECENTRIQ monoterapi alan hastaların %1,1'inde (50/4349) meydana gelmiştir. Başlangıca kadar geçen medyan süre 5,1 ay (aralık: 15 gün â 17,2 ay) olmuştur. Medyan süre 1,2 ay (aralık: 1 (bir) gün â 35,9+ ay; "+" sansürlenmiş bir değeri gösterir) olmuştur. Kolit, 17 hastada (%0,4) TECENTRIQ'in bırakılmasına yol açmıştır. Kortikosteroid kullanımı gerektiren kolit TECENTRIQ monoterapi alan hastaların %0,6'sında (24/4349) meydana gelmiştir.
İmmünite ile ilişkili endokrinopatiler:
Tiroid bozuklukları
Hipotiroidizm, TECENTRIQ monoterapi alan hastaların %7,6'sında (331/4349) meydana gelmiştir. Başlangıca kadar geçen medyan süre 4,3 ay (aralık: 1 (bir) gün â 34,5 ay) olmuştur. Adjuvan küçük hücreli dışı akciğer kanseri ortamında TECENTRIQ monoterapisi alan hastaların %17,4'ünde (86/495) hipotiroidizm meydana gelmiştir. Başlangıca kadar geçen medyan süre 4 ay (aralık: 22 gün - 11,8 ay) olmuştur.
Hipertiroidizm, TECENTRIQ monoterapi alan hastaların %2,1'inde (93/4349) meydana gelmiştir. Başlangıca kadar geçen medyan süre 2,6 ay (aralık: 1 (bir) gün â 24,3 ay) olmuştur. Adjuvan küçük hücreli dışı akciğer kanseri ortamında TECENTRIQ monoterapi alan hastaların %6,5'inde (32/495) hipertiroidizm meydana gelmiştir. Başlangıca kadar geçen medyan süre 2,8 ay (aralık: 1 (bir) gün - 9,9 ay) olmuştur.
Adrenal yetmezlik
Adrenal yetmezlik, TECENTRIQ monoterapi alan hastaların %0,5'inde (21/4349) meydana gelmiştir. Başlangıca kadar geçen medyan süre 6,1 ay (aralık: 2 (iki) gün â 21,4 ay) olmuştur. Adrenal yetmezlik 5 (beş) hastada (%0,1) TECENTRIQ'in bırakılmasına neden olmuştur. Kortikosteroid kullanımı gerektiren adrenal yetmezlik TECENTRIQ monoterapi alan hastaların %0,4'ünde (17/4349) meydana gelmiştir.
Hipofizit
Hipofizit, TECENTRIQ monoterapi alan hastaların %0,1'inden azında (4/4349) meydana gelmiştir. Başlangıca kadar geçen medyan süre 56,1 aydır (aralık: 23 gün â 13,7 ay). Üç hastada (< %0,1) kortikosteroid kullanımı gerekmiştir ve 1 hastada (< %0,1) TECENTRIQ tedavisi durdurulmuştur.
Hipofizit, nab-paklitaksel ve karboplatinle kombinasyon halinde atezolizumab almış olan hastaların %0,4'ünde (2/473) meydana gelmiştir. Başlangıca kadar geçen medyan süre, 5,2 ay (aralık: 5,1 â 5,3 ay) olmuştur. Her iki hastada kortikosteroid kullanılması gerekmiştir.
Diabetes mellitus
Diabetes mellitus, TECENTRIQ monoterapi alan hastaların % 0,5'inde (20/4349) meydana gelmiştir. Medyan süre 5,5 ay (aralık: 4 (dört) gün â 29 ay) olmuştur. Diabetes mellitus, hastaların %0,1'inden azında (3/4349) TECENTRIQ'in bırakılmasına yol açmıştır.
Diabetes mellitus, TECENTRIQ ile birlikte bevacizumab alan hepatoselüler kanserli hastaların % 2,0'ında (10/493) meydana gelmiştir. Başlangıca kadar geçen medyan süre 4,4 ay (aralık: 1,2 ay â 8,3 ay) olmuştur. TECENTRIQ tedavisinin bırakılmasına neden olacak bir diabetes mellitus olayı görülmemiştir.
İmmünite ile ilişkili meningoensefalit:
Meningoensefalit, TECENTRIQ monoterapi alan hastaların %0,4'ünde (18/4349) meydana gelmiştir. Başlangıca kadar geçen medyan süre 16 gün (aralık: 1 (bir) gün â 12,5 ay) olmuştur. Medyan süre 22 gün (aralık: 6 gün 14,5+ ay; "+" sansürlenmiş bir değeri gösterir) olmuştur.
Kortikosteroid kullanımını gerektiren meningoensefalit TECENTRIQ tedavisi alan hastaların %0,2'sinde (10/4349) meydana gelmiştir ve sekiz hastada (%0,2) TECENTRIQ'in bırakılmasına yol açmıştır.
İmmünite ile ilişkili nöropatiler:
Guillain-Barré sendromu ve demiyalizan polinöropati, TECENTRIQ monoterapi alan hastaların %0,1'inde (6/4349) meydana gelmiştir: Bu olay için başlangıca kadar geçen medyan süre 4,1 ay (aralık: 17 gün â 8,1 ay) olmuştur. Medyan süre 8 ay (aralık: 19 gün â 24,5 ay+, "+" sansürlenmiş bir değeri gösterir). 1 (bir) hasta (< %0,1), Guillain-Barré sendromu nedeniyle TECENTRIQ kullanımını bırakmıştır. Kortikosteroid kullanımı gerektiren Guillain-Barré sendromu TECENTRIQ monoterapi alan hastaların %0,1'inden azında (3/4349) meydana gelmiştir.
Miyastenik sendrom:
Miyestenia gravis, TECENTRIQ monoterapi alan hastaların %0,1'inden azında (1 (bir)/4349) meydana gelmiştir. Başlangıca kadar geçen süre 1,2 aydır.
İmmünite ile ilişkili pankreatit:
Yüksek amilaz ve yüksek lipaz dahil olmak üzere pankreatit, TECENTRIQ monoterapi alan hastaların %0,7'sinde (32/4349) meydana gelmiştir. Başlangıca kadar geçen medyan süre 5,5 ay (aralık: 1 (bir) gün â 24,8 ay) olmuştur. Medyan süre 24 gün (aralık: 3 gün â 22,4+ ay; "+" sansürlenmiş bir değeri gösterir) olmuştur. Pankreatit, 3 hastada (<%0,1) TECENTRIQ'in bırakılmasına yol açmıştır. Kortikosteroid kullanımı gerektiren pankreatit vakaları TECENTRIQ monoterapi alan hastaların %0,1'inde (5/4349) meydana gelmiştir.
İmmünite ile ilişkili miyokardit:
Miyokardit, TECENTRIQ monoterapi alan hastaların %0,1'inden azında (3/4349) meydana gelmiştir.Adjuvan küçük hücreli dışı akciğer kanseri ortamında 3 vakadan biri ölümcül olmuştur. Başlangıca kadar geçen medyan süre 2,1 ay (aralık: 1,5 â 4,9 ay) olmuştur. Geçen medyan süre 14 gün (aralık: 14 gün â 2,8 ay) olmuştur. Miyokartidiki hastada (<%0,1) TECENTRIQ'in bırakılmasına neden olmuştur. İki hastada (< %0,1) kortikosteroid kullanımına gerek duyulmuştur.
İmmünite ile ilişkili nefrit:
Nefrit, TECENTRIQ alan hastaların %0,2'sinden az hastada (10/4349) meydana gelmiştir. Başlangıca kadar geçen medyan süre 5 ay (aralık: 2 gün â 17,5 ay) olmuştur. Nefrit 5 (beş) hastada (< %0,1) TECENTRIQ'in bırakılmasına neden olmuştur. Dört hastada (< %0,1) kortikosteroid kullanımına gerek duyulmuştur.
İmmünite ile ilişkili miyozit:
Miyozit, TECENTRIQ monoterapi alan hastaların %0,5'inde (20/4349) meydana gelmiştir. Başlangıca kadar geçen medyan süre 3,3 aydır (aralık: 12 gün ile 11 ay). Medyan süre 5,7 ay (aralık: 2 (iki) gün ile 36,9 +ay; + sansürlenmiş bir değeri gösterir). Miyozit 2 (iki) hastada (< %0,1) TECENTRIQ'in bırakılmasına neden olmuştur. 7 (yedi) hastada (%0,2)
kortikosteroid kullanımına gerek duyulmuştur.
İmmünite ile ilişkili şiddetli kutanöz advers reaksiyonlar:
TECENTRIQ monoterapi alan hastaların %0,6'sında (28/4349) şiddetli kutanöz advers reaksiyonlar meydana gelmiştir. 28 hastadan birinde ölümcül olay meydana gelmiştir. Başlangıca kadar geçen medyan süre 5,2 aydır (aralık: 4 (dört) gün ile 15,5 ay). Medyan süre 2,4 ay (aralık: 1 (bir) gün ile 37,5 +ay; + sansürlenmiş bir değeri gösterir). Şiddetli kutanöz advers reaksiyonlar 3 (üç) hastada (< %0,1) TECENTRIQ tedavisinin bırakılmasına neden olmuştur.TECENTRIQ monoterapi alan hastaların %0,2'sinde (9/4349) kortikosteroid kullanımına gerek duyulmuştur.
İmmünite ile ilişkili perikardiyal bozukluklar:
TECENTRIQ monoterapisi alan hastaların %1,1'inde (47/4349) perikardiyal bozukluklar meydana gelmiştir. Medyan başlangıç süresi 1,4 aydır (aralık: 6 gün ila 17,5 ay). Medyan süre 1,4 aydır (aralık: 0 ila 19,3+ ay; "+" sansürlenmiş bir değeri gösterir). Perikardiyal bozukluklar 3 (< %0,1) hastada TECENTRIQ tedavisinin kesilmesine neden olmuştur. Kortikosteroid kullanımını gerektiren perikardiyal bozukluklar hastaların %0,2'sinde (7/4349) meydana gelmiştir.
İmmünojenisite:
Çoklu faz III çalışmaları karşılaştırılmasında, hastaların %13,1 ile %54,1'i tedaviye yeni başlayan anti-ilaç antikorları (ADA) geliştirmiştir. Tedavi sonucu oluşmuş anti-ilaç antikoru (ADA) gelişen hastaların başlangıçta genel olarak sağlık durumu ve hastalık karakteristikleri açısından daha zayıf olduğu görülmüştür. Başlangıçtaki bu sağlık ve hastalık karakteristiklerindeki dengesizlikler, farmakokinetik, etkililik ve güvenlilik analizlerinin yorumlanmasında karışıklık yaratabilmektedir. Anti-ilaç antikorlarının (ADA) etkililiğe etkisini araştırmak için başlangıçtaki sağlık ve hastalık karakteristiklerindeki dengesizlikleri ayarlayan keşif analizleri yapılmıştır. Bu analizlerde ADA geliştiren hastaların, ADA geliştirmeyen hastalara kıyasla etkililik faydasında azalma ihtimali gözardı edilmemiştir. Anti- ilaç antikorlarının başlangıca kadar geçen medyan süresi 3 (üç) ila 5 (beş) hafta olmuştur.
TECENTRIQ monoterapisi (N=3460) ve kombinasyon tedavileri (N=2285) ile tedavi edilen hastalardan elde edilen hasta havuzu verilerinden, ADA-pozitif popülasyonunda ADA-negatif popülasyonuna kıyasla gözlenen advers olayların sıklığı sırasıyla: Monoterapi için; 3. ve 4. derece advers olaylar %46,2'ye karşı %39,4, ciddi advers olaylar %39,6'ya karşı %33,3, tedavinin kesilmesine neden olan advers olaylar %8,5'e karşı %7,8 iken; Kombinasyon tedavisi için 3. ve 4. derece advers olaylar %63,9'a karşı %60,9, ciddi advers olaylar %43,9'a karşı 35,6, tedavinin kesilmesine neden olan advers olaylar % 22,8'e karşı %18,4 olmuştur (kombinasyon tedavisi için). Ancak mevcut verilerden yola çıkarak olası ilaç advers reaksiyonlarının yolağı hakkında kesin sonuçlara varılamamaktadır.
Pediyatrik popülasyon
TECENTRIQ'in çocuklar ve adölesanlardaki güvenliliği bilinmemektedir. 69 pediyatrik hastada (<18 yaş) yapılan bir klinik çalışmada yeni bir güvenlilik sinyali oluşmamıştır ve güvenlilik profili erişkinlerinki ile karşılaştırılabilirdir.
Geriyatrik popülasyon
TECENTRIQ monoterapi alan 65 yaş ve üzerindeki hastalar ile daha genç hastalar arasında genel olarak bir güvenlilik farklılığı gözlemlenmemiştir.
Impower150, IMpower133 ve IMpower110 çalışmalarından elde edilen veriler, 75 yaş ve üzeri hasta grubu hakkında değerlendirme yapılması için çok sınırlıdır.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks:0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
TECENTRIQ doz aşımına ilişkin bilgi mevcut değildir.
Doz aşımı durumunda, hastalar advers reaksiyon belirtileri veya semptomları bakımından yakından izlenmeli ve uygun semptomatik tedavi başlatılmalıdır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastikler ve immünomodülatör ajanlar, monoklonal antikorlar ve antikor ilaç konjugatları, PD-1/PDL-1 (Programlanmış Hücre Ölüm Proteini 1/ Ölüm Ligandı 1) İnhibitörleri
ATC kodu: L01FF05
Etki mekanizması:
PD-L1, tümör hücreleri ve/veya tümör infiltre eden immün hücrelerinde eksprese olabilir ve tümör mikroortamında anti-tümör immün yanıtının inhibisyonuna katkıda bulunabilir. PD- L1'in T hücrelerinde ve antijen sunan hücrelerde bulunan PD-1 ve B7.1 reseptörlerine bağlanması sitotoksik T hücresi aktivitesini, T hücresi çoğalmasını ve sitokin üretimini baskılar.
Atezolizumab Fc bölgesi değiştirilmiş, hümanize bir immünoglobülin G1 (IgG1) monoklonal bir antikorudur; doğrudan PD-L1'e bağlanır ve PD-1 ve B7.1 reseptörlerinin ikili blokajını sağlayarak, antikor bağımlı sellüler sitotoksisiteyi indüklemeden antitümör immün yanıtın yeniden aktive edilmesi de dahil, immün yanıtın PD-L1/PD-1 aracılı inhibisyonunu serbest bırakır. Atezolizumab, PD-L2/PD-1 etkileşimini koruyarak PD-L2/PD-1 aracılı inhibitör sinyallerin devam etmesine izin verir.
Klinik etkililik ve güvenlilik:
Küçük hücreli dışı akciğer kanseri:
Erken evre küçük hücreli dışı akciğer kanserinin adjuvan tedavisi
IMpower010 (GO29527): Rezeke edilmiş KHDAK'lı hastalarla sisplatin bazlı kemoterapiden sonra randomize faz III çalışma
Evre IB (tümörler ≥ 4cm) â IIIA KHDAK'lı hastaların adjuvan tedavisi için atezolizumabın etkililiğini ve güvenliliğini değerlendirmek üzere bir faz III, açık etiketli, çok merkezli, randomize çalışma olan GO29527 (IMpower010) yürütülmüştür (Kanser evrelendirme sistemine ilişkin Uluslararası Kanser Kontrolü Birliği/Amerikan Ortak Kanser Komitesi, 7. Baskısına göre).
Aşağıdaki seçim kriterleri, terapötik endikasyona dahil olan ve 7. baskı evreleme sistemine göre evre II - IIIA hasta popülasyonunu yansıtan yüksek nüks riski olan hastaları tanımlar:
Tümör boyutu ≥ 5 cm veya N1 veya N2 durumunun eşlik ettiği herhangi bir boyuttaki tümörler veya torasik yapılara invaze olan tümörler (doğrudan parietal plevra, göğüs duvarı, diyafram, frenik sinir, mediastinal plevra, parietal perikard, mediasten, kalp, büyük damarlar, trakea, rekürren laringeal sinir, özofagus, vertebral gövde, karinaya invaze) veya ana bronşu karinanın
< 2 cm distalinde tutan ancak karina tutulumu olmayan tümörler veya tüm akciğerin atelektazisi veya obstrüktif pnömonisi ile bağlantılı tümörler veya primer olarak aynı lobda veya farklı ipsilateral lobda ayrı nodül(ler)e sahip tümörler.
Çalışma, mediasten, kalp, büyük damarlar, trakea, rekürren laringeal sinir, özofagus, vertebral cisim ve karinaya invaze tümörleri olan N2 durumundaki hastaları veya farklı bir ipsilateral lobda ayrı tümör nodülleri olan hastaları içermemiştir.
Toplamda 1280 kaydedilmiş hasta tam tümör rezeksiyonu yaptırmış ve 4 sikluse kadar sisplatin bazlı kemoterapi almaya uygun olmuştur. Sisplatin bazlı kemoterapi rejimleri Tablo 3'te tarif edilmektedir.
Tablo 3: Adjuvan tedavi rejimleri (IMpower010)
Sisplatin bazlı adjuvan kemoterapi: Belirtilen tedavi rejimlerinden biri ile her 21 günlük siklusun 1.gününde IV olarak 75 mg/m sisplatin | 1. ve 8. gün intravenöz olarak 30 mg/m vinorelbin |
1. gün intravenöz olarak 75 mg/m dosetaksel | |
1. ve 8. gün intravenöz olarak 1250 mg/m gemsitabin | |
1. gün intravenöz olarak 500 mg/m pemetreksed (non-skuamöz) |
Sisplatin bazlı kemoterapinin (dört siklusa kadar) tamamlanmasından sonra toplamda 1005 hasta 1:1 oranında atezolizumab (Kol A) veya en iyi destekleyici bakımı (BSC) (Kol B) almaya randomize edilmiştir. Atezolizumab, hastalık nüksü veya kabul edilemez toksisite görülmediği sürece 16 döngüye kadar her 3 haftada bir IV infüzyonla 1200 mg'lık sabit dozda uygulanmıştır. Randomizasyon cinsiyet, hastalık evresi ve PD-L1 ekspresyonuna göre sınıflandırılmıştır.
Hastalar, otoimmün hastalık öyküsüne sahiplerse; randomizasyondan önceki 28 gün içinde canlı, attenüe aşı uygulaması yapılmışsa; randomizasyondan önceki 4 hafta içinde sistemik immunostimulatör ajanlar veya 2 hafta içinde immunosupresif ilaçlar uygulanmışsa hariç
tutulmuştur. Tümör değerlendirmeleri randomizasyon fazının başlangıcında ve 1. siklus, 1. gününün ardından ilk yıl boyunca her 4 ayda bir ve ardından beş yıla kadar her 6 ayda bir ve sonrasında yılda bir yürütülmüştür.
ITT popülasyonunun demografik bilgileri ve başlangıçtaki hastalık özellikleri tedavi kolları arasında iyi dengelenmiştir. Medyan yaş 62 olup (aralık: 26 ila 84) hastaların %67'si erkektir. Hastaların çoğu Beyaz (%73) ve %24'ü Asyalıdır. Çoğu hasta sigara içicisidir veya geçmişte içmiştir (%78) ve hastalarda başlangıç ECOG performans durumu 0 (%55) veya 1'dir (%44). Genelde hastaların %12'sinde evre IB, %47'sinde evre II ve %41'inde evre IIIA hastalık mevcuttur. Tümörleri VENTANA PD-L1 (SP263) Analizi ile ölçüldüğü üzere TC'de PD-L1 ekspresyonu ≥ %1 ve ≥ %50 olan tümörleri olan hastaların yüzdesi sırasıyla %55 ve %26 olmuştur.
Birincil etkililik sonucu ölçümü araştırmacı tarafından değerlendirilen hastalıksız sağkalımdır (HS). Hastalıksız sağkalım, randomizasyon tarihinden aşağıdakilerden birinin meydana geldiği tarihe kadar geçen süre olarak tanımlanmıştır: ilk belgelenmiş hastalık nüksü, yeni primer KHDAK veya herhangi bir nedenle ölüm (hangisi daha önce olursa). Birincil etkililik hedefi, PD-L1 ≥ %1 TC evre II IIIA hasta popülasyonunda HS'yi değerlendirmektir. Kritik ikincil etkililik hedefleri, PD-L1 ≥ %50 TC evre II-IIIA hasta popülasyonunda HS'yi ve ITT popülasyonunda genel sağkalımı (GS) değerlendirmektir.
Ara hastalıksız sağkalım analizi zamanında, çalışma birincil sonlanım noktasını sağlamıştır. Medyan takip süresi yaklaşık 32 aydır. EGFR mutasyonları veya ALK yeniden düzenlemeleri olmayan PD-L1 ≥ %50 TC evre II- IIIA hastalarının analizinde (n = 209), BSC koluna kıyasla atezolizumab kolunda HS'de klinik olarak anlamlı bir iyileşme gözlenmiştir (Tablo 4). Genel sağkalım (GS) verileri EGFR mutasyonları ve ALK yeniden düzenlemeleri olmaksızın, PD-L1
≥ %50 TC evre II- IIIA hasta popülasyonunda genel olarak bildirilen yaklaşık %16,3 oranında ölüm ile hastalıksız sağkalımda ara analizi sırasında olgunlaşmamıştır. Genel sağkalımın keşifsel analizi bu hasta popülasyonunda 0,39'luk sınıflandırılmış bir HR (%95 GA:0,18, 0,82) ile en iyi destekleyici bakıma karşı atezolizumab lehine bir eğilimi düşündürmüştür.
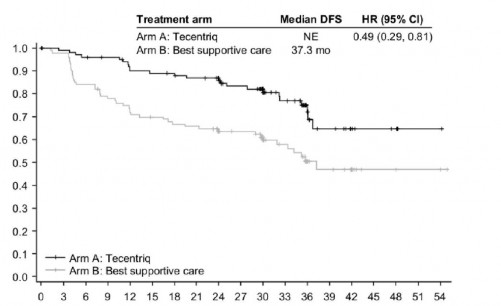
EGFR mutasyonları ve ALK yeniden düzenlemeleri olmayan PD-L1 ≥ %50 TC evre II- IIIA hasta popülasyonu için ana etkililik bulguları Tablo 4'te özetlenmektedir. Hastalıksız sağkalım için Kaplan-Meier eğrisi Şekil 1'de sunulmaktadır.
Tablo 4: EGFR mutasyonları veya ALK yeniden düzenlemeleri olmayan PD-L1 ekspresyonu ≥ %50 TC evre II- IIIA hasta popülasyonunda etkililik özeti (IMpower010)
Etkililik sonlanım noktası | A kolu (Atezolizumab) | B kolu (En iyi destekleyici tedavi) |
Araştırmacı tarafından değerlendirilen hastalıksız sağkalım (HS) |
n=106 |
n=103 |
Olayların sayısı (%) | 24 (%22,6) | 45 (%437) |
Hastalıksız sağkalımın (HS) medyan süresi (ay) | NE | 37,3 |
%95 GA | NE, NE | 30,1, NE |
Sınıflandırılmış risk oranı (%95 GA) | 0,49 (0,29,0,81) | |
3 yıllık hastalıksız | 75,1 | 50,4 |
sağkalım oranı (%)
HS=Hastalıksız sağkalım, GA=Güven Aralığı, NE=öngörülemiyor
Şekil 1: EGFR mutasyonları veya ALK yeniden düzenlemeleri olmayan PD-L1 ekspresyonu ≥ %50 TC evre II- IIIA hasta popülasyonunda (IMpower010) hastalıksız sağkalım için Kaplan-Meier eğrisi
|
Süre (ay)
![]()
NE=öngörülemiyor
En iyi destekleyici tedavi koluna kıyasla atezolizumab kolunda gözlenen hastalıksız sağkalım iyileşmesi, hem non-skuamoz KHDAK hastaları (sınıflandırılmamış risk oranı: 0,35 , %95 GA: 0,18, 0,69; medyan hastalıksız sağkalım NE'ye (NE= öngörülemiyor) karşı 35,7 ay) hem de skuamoz KHDAK hastaları (sınıflandırılmamış risk oranı: 0,60 ,%95 GA: 0,29 , 1,26; medyan hastalıksız sağkalım 36,7'ye karşı NE (NE=öngörülemiyor) ay) içeren EGFR mutasyonları veya ALK yeniden düzenlemeleri olmayan PD-L1 ≥%50 TC evre II-IIIA hasta popülasyonunda önceden belirtilmiş alt grupların çoğu arasında tutarlı şekilde gösterilmiştir.
Birinci basamak küçük hücreli dışı akciğer kanseri
IMpower130 (GO29537): Daha önce kemoterapi uygulanmamış metastatik non- skuamoz KHDAK hastalarında nab-paklitaksel ve karboplatinle kombinasyona yönelik randomize faz III çalışma.
Daha önce kemoterapi uygulanmamış metastatik non-skuamoz KHDAK hastalarında nab- paklitaksel ve karboplatinle kombinasyon halinde atezolizumabın etkililik ve güvenliliğini değerlendirmek üzere bir faz III, açık etiketli, randomize çalışma (GO29537 (IMpower130)) gerçekleştirilmiştir. EGFR mutasyonları veya ALK rearanjmanları olan hastalarda daha önce tirozin kinaz inhibitörleriyle tedavi almış olma koşulu aranmıştır.
Hastalar, Amerikan Ortak Kanser Komitesi (AJCC) 7. baskıya göre evrelendirilmiştir. Otoimmün hastalık öyküsü olan, randomizasyondan önceki 28 gün içinde canlı ve zayıflatılmış
aşı uygulanmış, randomizasyondan önceki 4 hafta içinde immünostimülatör ajan veya randomizasyondan önceki 2 hafta içinde sistemik immünosüpresif ilaç uygulanmış ve aktif veya tedavi edilmemiş MSS metastazları olan hastalar çalışmaya alınmamıştır. Daha önce CD137 agonistleri veya immün kontrol noktası blokaj tedavileri (anti-PD-1 ve anti-PD-L1 terapötik antikorları) almış hastalar çalışmaya uygun değildir. Bununla birlikte, daha önce anti- CTLA-4 tedavisi almış olan hastalar, en son dozun randomizasyondan en az 6 hafta önce alınmış olması ve anti-CTLA-4'ten kaynaklanan şiddetli immün ilişkili advers etki öyküsü (NCI 3 ve 4. Derece) olmaması koşuluyla çalışmaya alınmıştır. Tümör değerlendirmeleri, 1. Siklustan sonra ilk 48 hafta boyunca 6 haftada bir ve daha sonra 9 haftada bir yapılmıştır. Tümör numuneleri, tümör hücreleri (TC) ve tümörü infiltre eden immün hücreler (IC) üzerindeki PD-L1 ekspresyonu bakımından değerlendirilmiştir ve bulgular, aşağıda açıklanan analizler için PD-L1 ekspresyonu alt gruplarının tanımlanmasında kullanılmıştır.
EGFR mutasyonları veya ALK rearanjmanları olanlar dahil olmak üzere hastalar, Tablo 5'te açıklanan tedavi rejimlerinden biri uygulanmak üzere çalışmaya alınmış ve 2:1 oranında randomize edilmiştir. Randomizasyon grupları; cinsiyet, karaciğer metastazları varlığı ve TC ve IC üzerindeki PD-L1 ekspresyonuna göre oluşturulmuştur. Tedavi rejimi B alan hastaların hastalık progresyonundan sonra çapraz geçiş yaparak atezolizumab monoterapisi almasına izin verilmiştir.
Tablo 5: İntravenöz tedavi rejimleri (IMpower130)
Tedavi Rejimi | İndüksiyon (Dört veya altı kez 21 günlük sikluslar) | İdame (21 günlük sikluslar) |
A | Atezolizumab (1200 mg) + nab-paklitaksel (100 mg/m) + karboplatin (EAA 6) | Atezolizumab (1200 mg) |
B | Nab-paklitaksel (100 mg/m) + karboplatin (EAA 6) | En iyi destekleyici tedavi veya pemetrexed |
ITT-WT olarak tanımlanan çalışma popülasyonunun (n=679) demografik özellikleri ve başlangıçtaki hastalık özelliklerinin tedavi kolları arasında dengeli olduğu görülmüştür. Medyan yaş 64'tür (aralık: 18-86 yaş). Hastaların çoğu erkek (%59) ve beyazdır (%90). Hastaların %14,7'sinde başlangıçta karaciğer metastazı olduğu ve çoğu hastanın (%90) sigara kullanmakta olduğu veya geçmişte kullandığı görülmüştür. Hastaların çoğunun başlangıç ECOG performans durumunun 1 olduğu (%59) ve <%1 oranında PD-L1 ekspresyonu sergilediği (yaklaşık %52) görülmüştür. İndüksiyon tedavisinin ardından yanıt durumu stabil hastalık, kısmi yanıt veya tam yanıt olan 107 Kol B hastası arasında 40 hasta pemetrexed geçiş idame tedavisi almıştır.
Primer analiz, EGFR mutasyonları veya ALK rearanjmanları olanlar hariç olmak üzere, ITT- WT olarak tanımlanan bütün hastalarda (n=679) gerçekleştirilmiştir. Hastalarda medyan sağkalım takip süresi 18,6 ay olup, hastalar kontrole kıyasla atezolizumab, nab-paklitaksel ve
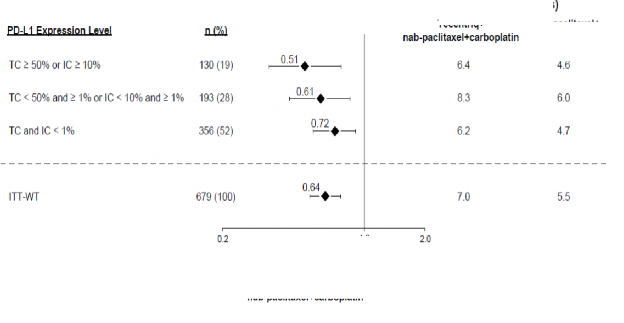
karboplatinle OS ve PFS'de iyileşme göstermiştir. Temel bulgular, Tablo 6'da özetlenmiştir ve OS ve PFS'ye ait Kaplan-Meier eğrileri sırasıyla Şekil 2 ve 4'te sunulmuştur. PD-L1 ekspresyonuna göre OS ve PFS için elde edilen keşifsel bulgular, sırasıyla Şekil 3 ve 5'te özetlenmiştir. Karaciğer metastazları olan hastalar, nab-paklitaksel ve karboplatine kıyasla atezolizumab, nab-paklitaksel ve karboplatinle PFS veya OS'de iyileşme göstermemiştir (sırasıyla PFS için 0,93 HR, %95 CI: 0,59, 1,47 ve OS için 1,04 HR, %95 CI: 0,63, 1,72).
Atezolizumab, nab-paklitaksel ve karboplatin kolundaki hastaların %7,3'üne karşılık nab- paklitaksel ve karboplatin kolundaki hastaların %59'u hastalık progresyonunun ardından çapraz geçiş tedavisi olarak atezolizumab (bütün hastaların %41'i) dahil olmak üzere herhangi bir kanser immünoterapisi almıştır.
Daha uzun takip süresine (medyan: 24,1 ay) sahip bir keşifsel analizde, her iki koldaki medyan OS birincil analize göre değişmemiş olup, HR=0,82'dir (%95 CI: 0,67, 1,01).
Tablo 6: Primer analizde IMpower130'da kanıtlanan etkililiğin özeti (ITT-WT popülasyon)
Etkililik sonlanım noktaları Kol A Atezolizumab + nab-paklitaksel + karboplatin | Kol B Nab- paklitaksel + karboplatin |
Ortak-birincil sonlanım noktaları | |
OS n=451 n=228 Ölüm sayısı (%) 226 (%50,1) 131 (%57,5) Olaylara kadar geçen medyan süre (ay) 18,6 13,9 %95 GA (16, 21,2) (12, 18,7) Gruplandırılmış risk oranı (%95 GA) 0,79 (0,64, 0,98) p-değeri 0,033 12 aylık OS (%) 63 56 | |
Araştırmacı tarafından değerlendirilen PFS (RECIST v1.1) n=451 n=228 Olay sayısı (%) 347 (%76,9) 198 (%86,8) Medyan PFS süresi (ay) 7 5,5 %95 GA (6,2, 7,3) (4,4, 5,9) Gruplandırılmış risk oranı (95% GA) 0,64 (0,54, 0,77) p-değeri < 0,0001 12 aylık PFS (%) %29 %14 | |
Diğer sonlanım noktaları |
Araştırmacı tarafından değerlendirilen ORR (RECIST v1.1)^ n=447 n=226 Doğrulanmış yanıt veren sayısı (%) 220 (%49,2) 72 (%31,9) %95 GA (44,5, 54) (25,8, 38,4) Tam yanıt sayısı (%) 11 (%2,5) 3 (%1,3) Kısmi yanıt sayısı (%) 209 (%46,8) 69 (%30,5) |
Araştırmacı tarafından değerlendirilen doğrulanmış DOR (RECIST 1.1)^ n=220 n=72 Medyan (ay olarak) 8,4 6,1 %95 GA (6,9, 11,8) (5,5, 7,9) |
^ Doğrulanmış ORR ve DoR, keşifsel sonlanım noktalarıdır
PFS=progresyonsuz sağkalım; RECIST=Solid Tümörlerde Yanıt Değerlendirme Kriterleri v1.1.; GA=güven aralığı; ORR=objektif yanıt oranı; DOR=yanıt süresi; OS=Genel sağkalım
Ban-pac
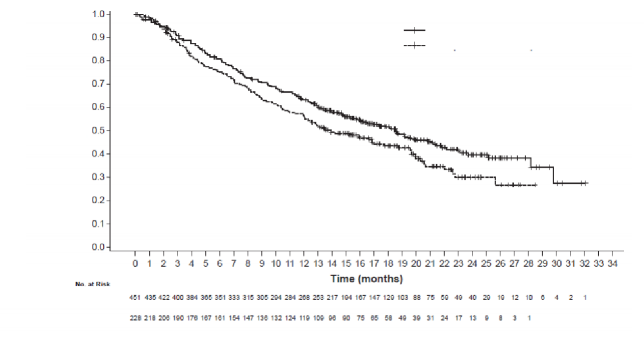
Şekil 2: Genel sağkalıma ait Kaplan-Meier eğrileri (IMpower130)
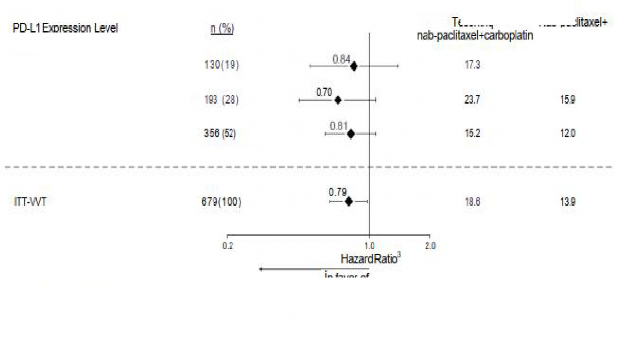
TC > %50 veya IC > %10
TC < %50 ve > %1 veya IC
<%10 ve ≥ %1
TC ve IC < %1
Şekil 3: PD-L1 ekspresyonuna göre genel sağkalımı gösteren meta analiz diyagramı (IMpower130)
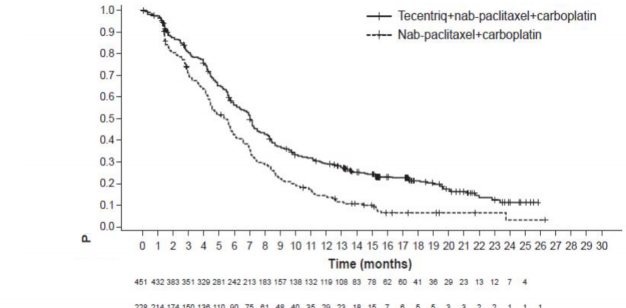
Şekil 4: Progresyonsuz sağkalıma ait Kaplan-Meier eğrileri (IMpower130)
TC≥ %50 veya IC ≥ %10
TC < %50 ve ≥ %1 veya IC
<%10 ve ≥ %1
TC ve IC < %1
Şekil 5: PD-L1 ekspresyonuna göre progresyonsuz sağkalımı gösteren meta analiz diyagramı (IMpower130)
IMpower110 (GO29431): Kemoterapi tedavisi almamış metastatik KHDAK hastalarında yapılan randomize Faz III çalışma
Kemoterapi kullanmamış, metastatik KHDAK hastalarında atezolizumabın etkililiğini ve güvenliliğini değerlendirmek için Faz III, açık etiketli, çok merkezli, randomize bir çalışma olan IMpower110 yürütülmüştür. Hastalardaki PD-L1 ekspresyonu ≥%1 TC (PD-L1 tümör hücrelerinin ≥%1'i boyanmıştır) veya ≥%1 IC (tümör bölgesinin ≥%1'ini kapsayan tümör- infiltre edici immün hücreleri PD-L1 boyanmıştır) VENTANA PD-L1 (SP142) Testine dayanmaktadır.
Toplamda 572 hasta randomize edilmiş ve 1:1 oranında atezolizumab (A kolu) veya kemoterapi (B kolu) verilmiştir. Atezolizumab, araştırmacı tarafından değerlendirildiği şekilde klinik fayda kaybına veya kabul edilmeyen toksisiteye kadar üç haftada bir intravenöz yolla 1200 mg sabit dozla verilmiştir. Kemoterapi rejimleri Tablo 7'de gösterilmektedir. Randomizasyon cinsiyet, ECOG performans statüsü, histoloji ve TC ile IC'de PD-L1 tümör ekspresyonu ile katmanlaştırılmıştır.
Tablo 7: Kemoterapi intravenöz tedavi rejimleri (IMpower110)
Tedavi rejimi | İndüksiyon (Dört veya altı 21 günlük sikluslar) | İdame (21 günlük sikluslar) |
B (Skuamoz olmayan) | Sisplatin (75 mg/m) + pemetreksed (500 mg/m) veya karboplatin (EAA 6) + pemetreksed (500 mg/m) | Pemetreksed (500 mg/m) |
B (Skuamoz) | Sisplatin (75 mg/m) + gemsitabin (1250 mg/m) veya karboplatin (EAA 5) + | En iyi destekleyici bakım |

gemsitabin (1000 mg/m)
Otoimmün hastalık, randomizasyondan önceki 28 gün içinde canlı, zayıflatılmış aşı uygulaması, 4 hafta içinde sistemik immün sistemi uyarıcı ajanların uygulanması veya randomizasyondan önceki 2 hafta içinde sistemik immün sistemi baskılayıcı ilaçlar öyküsü, aktif veya tedavi edilmemiş merkezi sinir sistemi metastazları olan hastalar çalışma dışı bırakılmıştır. Tümör değerlendirmeleri, 1. siklus, 1.gün ve bunu takip eden ilk 48 hafta boyunca 6 haftada bir ve daha sonra her 9 haftada bir yürütülmüştür.
EGFR mutasyonları veya ALK yeniden düzenlemeleri olmayan (n=554) PD-L1 ekspresyonu
≥ %1 TC veya ≥ %1 IC olan hastalarda demografik ve çalışma başlangıcı hastalık özellikleri tedavi kolları arasında iyi dengelenmiştir. Medyan yaş 64,5 (dağılım: 30 ila 87) olup hastaların %70'i erkektir. Hastaların çoğunluğu beyaz (%84) ve Asyalıdır (%14). Hastaların çoğu halen sigara kullanmaktadır veya öncesinde kullanmıştır (%87) ve hastalarda başlangıç ECOG performans durumu 0 (%36) veya 1'dir (%64).
Genel olarak, hastaların %69'unda skuamoz olmayan hastalık ve hastaların %31'inde skuamoz hastalık vardır. EGFR mutasyonları veya ALK yeniden düzenlemeleri olmayan (n=205) yüksek PD-L1 ekspresyonu olan (PD-L1 ≥ %50 TC veya ≥ %10 IC) hastalarda demografik ve çalışma başlangıcı hastalık özellikleri genellikle daha geniş çalışma popülasyonunu temsil etmiş ve tedavi kolları arasında dengeli olmuştur.
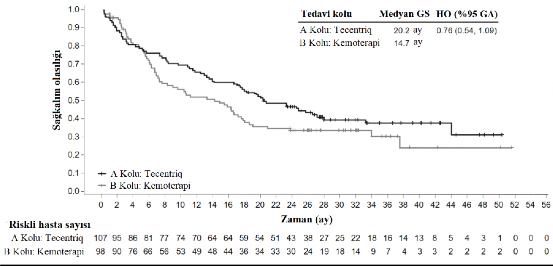
Birincil sonlanım noktası, genel sağkalım (GS) olmuştur. Geçici genel sağkalım analizi sırasında, EGFR mutasyonları veya ALK yeniden düzenlemeleri olanlar (n=205) hariç olmak üzere yüksek PD-L1 ekspresyonu olan hastalar, kemoterapiye kıyasla atezolizumaba (Kol A) randomize edilen hastalar için genel sağkalımda istatistiksel olarak anlamlı iyileşme göstermiş (B kolu) (risk oranı 0,59, %95 GA: 0,4, 0,89; medyan genel sağkalım 20,2 aya karşı 13,1 ay) olup iki taraflı p değeri 0,0106 bulunmuştur. Yüksek PD-L1 ekspresyonu olan hastalarda ortanca sağkalım takip süresi 15,7 ay olmuştur.
Bu hastalarda daha uzun bir takip süresi (medyan: 31,3 ay) içeren bir keşifsel genel sağkalım analizinde atezolizumab kolu için medyan genel sağkalım, birincil genel sağkalım ara analizine göre (20,2 ay) değişmemiş ve kemoterapi kolu için 14,7 olmuştur (risk oranı 0,76, %95 GA: 0,54, 1,09). Keşifsel analizdeki anahtar sonuçlar Tablo 8'de özetlenmiştir. Yüksek PD-L1 ekspresyonu olan hastalarda genel sağkalım ve progresyonsuz sağkalım için Kaplan-Meier eğrileri Şekil 6 ve 7'de sunulmaktadır. Atezolizumab kolunda (16/107, %15) kemoterapi koluna kıyasla (10/98, %10,2) hastaların daha yüksek bir oranı ilk 2,5 ay içinde ölüm yaşamıştır. Erken ölümlerle ilişkili herhangi bir spesifik faktör/faktörler tanımlanamamıştır.
Tablo 8: Yüksek PD-L1 ekspresyonu ≥%50 TC veya ≥%10 IC olan hastalarda etkililik özeti (IMpower110)
Etkililik sonlanım noktaları | A Kolu (Atezolizumab) | B Kolu (Kemoterapi) |
Birincil sonlanım noktası | ||
Genel sağkalım | n=107 | n=98 |
Ölüm sayısı (%) | 64 (%59,8) | 64 (%65,3) |
Olaylara kadar geçen medyan süre (ay) | 20,2 | 14,7 |
%95 GA | (17,2, 27,9) | (7,4, 17,7) |
Sınıflandırılmış risk oranı (%95 GA) | 0,76 (0,54, 1,09) | |
12 aylık genel sağkalım (%) | 66,1 | 52,3 |
İkincil sonlanım noktaları | ||
Araştırmacı tarafından değerlendirilen PS (RECIST v1.1) | n=107 | n=98 |
Olay sayısı (%) | 82 (%76,6) | 87 (%88,8) |
Medyan PS süresi (ay) | 8,2 | 5 |
%95 GA | (6,8, 11,4) | (4,2, 5,7) |
Sınıflandırılmış risk oranı (%95 GA) | 0,59 (0,43, 0,81) | |
12 aylık progresyonsuz sağkalım (%) | 39,2 | 19,2 |
Araştırmacı tarafından değerlendirilen OYO (RECIST v1.1)^ | n=107 | n=98 |
Yanıt verenlerin sayısı (%) | 43 (%40,2) | 28 (%28,6) |
%95 GA | (30,8, 50,1) | (19,9, 38,6) |
Tam yanıt sayısı (%) | 1 (%0,9) | 2 (%2) |
Kısmi yanıt sayısı (%) | 42 (%39,3) | 26 (%26,5) |
Araştırmacı Tarafından Değerlendirilen YS (RECIST v1.1)^ | n=43 | n=28 |
Medyan (ay) | 38,9 | 8,3 |
%95 GA | (16,1, TE) | (5,6, 11) |
Şekil 6: Yüksek PD-L1 ekspresyonu ≥%50 TC veya ≥%10 IC olan hastalarda genel sağkalım için Kaplan-Meier eğrisi (IMpower110)
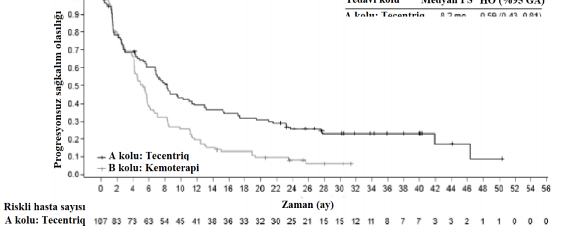
A kolu: Tecentriq 8.2 ay 0.59 (0.43 , 0.81)
B kolu: Kemoterapi 5 ay
Şekil 7: Yüksek PD-L1 ekspresyonu ≥%50 TC veya ≥%10 IC olan hastalarda progresyonsuz sağkalım için Kaplan-Meier eğrisi (IMpower110)
Kemoterapi koluna kıyasla atezolizumab kolunda gözlemlenen genel sağkalım iyileşmesi, hem skuamoz olmayan küçük hücreli dışı akciğer kanseri hastaları HR 0,62, %95 GA: 0,4, 0,96; medyan genel sağkalım 20,2'ye karşı 10,5 ay) hem de skuamoz küçük hücreli dışı akciğer kanseri hastalarını (HR 0,56, %95 GA: 0,23, 1,37; 15,3 aya karşı medyan genel sağkalıma ulaşılamaması) içeren alt gruplarda tutarlı bir şekilde gösterilmiştir. 75 yaş ve üzeri hastalara ve hiç sigara içmemiş hastalara ilişkin veriler, bu alt gruplarda sonuç çıkarmak için çok sınırlıdır.
İkinci basamak küçük hücreli dışı akciğer kanseri
OAK (GO28915): kemoterapi tedavisi almış lokal ileri veya metastatik KHDAK hastalarında yapılan randomize Faz III çalışma
Platin içeren bir rejim uygulanırken veya sonrasında progresyon görülmüş, lokal ileri veya metastatik KHDAK olan hastalarda, atezolizumab ile dosetakselin etkililik ve güvenlilik
karşılaştırılmasının yapıldığı Faz III, açık etiketli, çok merkezli, uluslararası, randomize bir çalışma olan GO28915 (OAK) yürütülmüştür. Bu çalışma, otoimmün hastalık öyküsü olan, aktif veya kortikosteroid-bağımlı beyin metastazı öyküsü olan, başlangıçtan önceki 28 gün içinde canlı, attenüe aşı olmuş, başlangıçtan önceki 4 hafta içinde sistemik immunostimulatör ajan uygulanmış veya başlangıçtan önceki 2 hafta içinde sistemik immunosupresif tıbbi ürün kullanmış hastalar çalışmaya alınmamıştır. Tümör değerlendirmeleri ilk 36 hafta boyunca her 6 haftada bir ve sonra her 9 haftada bir gerçekleştirilmiştir. Tümör örnekleri, tümör hücrelerinde (TC) ve tümör sızdıran bağışıklık hücrelerinde (IC) PD-L1 ifadesi için prospektif olarak değerlendirilmiştir.
Toplamda 1225 hasta kayıt edilmiştir ve analiz planına göre randomize edilen ilk 850 hasta primer etki analizine dahil edilmiştir. Randomizasyon PD-L1 IC ekspresyon durumu, önceki kemoterapi rejimlerinin sayısı ve histolojiye göre tabakalandırılmıştır. Hastalar 1:1 oranında atezolizumab veya dosetaksel almak üzere randomize edilmiştir.
Atezolizumab üç haftada bir intravenöz infüzyon yoluyla 1200 mg sabit dozda uygulanmıştır. Doz azaltımına izin verilmemiştir. Hastalar, araştırmacı tarafından değerlendirilecek klinik fayda kaybına kadar tedavi edilmiştir. Dosetaksel, progresyona kadar her üç haftalık siklusun
1. gününde intravenöz infüzyon yoluyla 75 mg/m uygulanmıştır. Tedavi edilen tüm hastalar için, medyan tedavi süresi dosetaksel kolu için 2,1 ay ve atezolizumab kolu için 3,4 aydır.
Primer analiz hasta popülasyonunun demografik ve başlangıç özellikleri tedavi kolları arasında genel olarak iyi değerlendirilmiştir. Medyan yaş 64 yaştır (aralık: 33-85) ve hastaların %61'i erkektir. Hastaların çoğu beyaz ırktandır (%70). Hastaların yaklaşık olarak üçte birinde non- skuamoz hastalık vardır (%74). %10'unda EGFR mutasyonu, %0,2'sinde ALK yeniden düzenlenmesi ve %10'unda başlangıçta santral sinir sistemi metastazları vardır. Hastaların çoğu halen veya önceden tütün kullanıcısıdır (%82). Başlangıçta ECOG performans skoru 0 (%37) veya 1'dir (%63). Hastaların %75'i önceden yalnızca bir platin bazlı tedavi rejimi almıştır.
Birincil etkililik sonlanım noktası, randomizasyon tarihinden herhangi bir nedenle ölüme kadar geçen süre olarak tanımlanan GS'dir (genel sağkalım). 21 aylık medyan sağkalım takip süresini içeren bu çalışmanın anahtar sonuçları Tablo 9'da özetlenmiştir. ITT popülasyonu (tedavi amaçlı) için Kaplan-Meier eğrileri Şekil 8'de sunulmuştur. Şekil 9, ITT ve PD-L1 alt gruplarındaki GS sonuçlarını özetlemekte olup , TC ve IC'de % 1'in altında PD-L1 ekspresyonu olanları da içeren tüm alt gruplarda atezolizumab ile GS faydasını göstermektedir.
Tablo 9: OAK çalışmasından primer analiz popülasyonunda etkililik çalışması (tüm gelenler)*
Etkililik sonlanım noktası | Atezolizumab (n=425) | Dosetaksel (n=425) |
Birincil Etkililik Sonlanım Noktası |
|
|
GS |
|
|
Ölüm sayısı (%) | 271 (%64) | 298 (%70) |
Olaylara kadar geçen medyan süre (ay) | 13,8 | 9,6 |
%95 GA | (11,8; 15,7) | (8,6; 11,2) |
Sınıflandırımış risk oranı (%95 GA) | 0,73 (0,62; 0,87) | |
p değeri** | 0,0003 |
|
Etkililik sonlanım noktası | Atezolizumab (n=425) | Dosetaksel (n=425) |
12 aylık GS*** | 218 (%55) | 151 (%41) |
18 aylık GS*** | 157 (%40) | 98 (%27) |
İkincil Etkililik Sonlanım Noktaları |
|
|
Araştırmacı tarafından değerlendirilen PS (RECIST v1.1) | ||
Olay sayısı (%) | 380 (%89) | 375 (%88) |
Medyan PS süresi (ay) | 2,8 | 4 |
%95 GA | (2,6; 3) | (3,3; 4,2) |
Sınıflandırılmış risk oranı (%95 GA) | 0,95 (0,82; 1,1) | |
Araştırmacı Tarafından Değerlendirilen OYO (RECIST v1.1) | ||
Yanıt verenlerin sayısı (%) | 58 (%14) | 57 (%13) |
%95 GA | (10,5; 17,3) | (10,3;17) |
Araştırmacı Tarafından Değerlendirilen YS (RECIST v1.1) | ||
| n=58 | n=57 |
Medyan (ay) | 16,3 | 6,2 |
%95 GA | (10; TE) | (4,9; 7,6) |
GA=güven aralığı; YS=yanıt süresi; TE=Tahmin edilemiyor; OYO=objektif yanıt oranı; GS=genel sağkalım; PS=progresyonsuz sağkalım; RECIST-STCDK=Solid Tümörlerde Cevap Değerlendirme Kriterleri v1.1.
*Primer analiz popülasyonu randomize edilen ilk 850 hastayı içerir
â IC düzeyleri, tümör sızdıran bağışıklık hücrelerindeki PD-L1 ekspresyonuna, önceki kemoterapi rejimi sayısı ve histolojiye göre sınıflandırılmıştır.
** sınıflandırılmış log-sıra sıralamasına göre
*** Kaplan-Meier hesaplamalarına göre
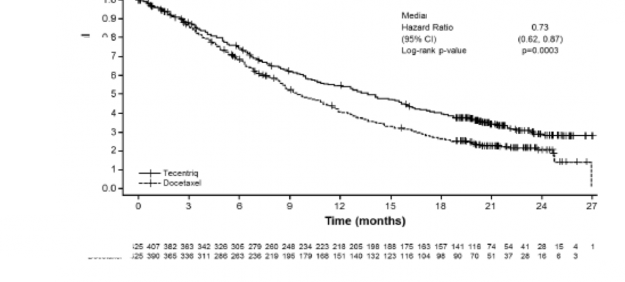
Zaman (ay)
Sağkalım olasılığı
Şekil 8: Primer analiz popülasyonunda genel sağkalım için Kaplan-Meier eğrisi (tüm gelenler) (OAK)
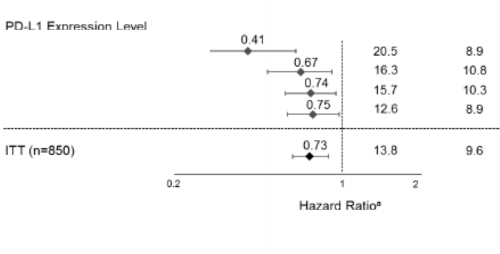
Şekil 9: Primer analiz popülasyonunda PD-L1 ekspresyonuna göre genel sağkalım meta- analiz diyagramı (OAK)
PD-L1 Ekspresyon Seviyesi
TC≥ %50 veya IC ≥ %10 (n=137) TC veya IC ≥ %5 (n=265)
TC veya IC ≥ %1 (n=463) TC ve IC < %1 (n=379)
Medyan GS (ay) TECENTRIQ Dosetaksel
TECENTRIQ
lehine
TC ve IC ≥ % 1için sınıflandırılmış HR. Diğer açıklayıcı altgruplar içi sınıflandırılmamış HR
TC: Tümör hücreleri; IC: İmmün hücreleri; HR: Risk oranı
Hem non-skuamoz KHDAK hastalarında (atezolizumab and dosetaksel için sırasıyla; risk oranı [HR]: 0,73, 95% GA: 0,6, 0,89; medyan GS< 15,6'ya karşı 11,2 ay) hem de skuamoz KHDAK
hastalarında (atezolizumab and dosetaksel için sırasıyla HR: 0,73, 95% GA: 0,54, 0,98; medyan GS: 8,9 vs. 7,7 ay) dosetaksel ile karşılaştırılan GS değerlerinde gelişme görülmüştür. Gözlemlenen GS gelişimi, başlangıçta beyin metastazı olanlar (atezolizumab and dosetaksel için sırasıyla; risk oranı [HR]: 0,54, 95% GA: 0,31, 0,94; medyan GS< 20,1 vs. 11,9 ay) ve hiç tütün tüketmemiş olanlar (atezolizumab and dosetaksel için sırasıyla; risk oranı [HR]: 0,71, 95% GA: 0,47, 1,08; medyan GS< 16,3 vs. 12,6 ay) dahil olmak üzere altgruplar arasında tutarlı bir biçimde gösterilmiştir. Bununla birlikte, EGFR mutasyonlu hastalar dosetaksele karşılık atezolizumab kullanımında gelişmiş GS göstermemişlerdir (atezolizumab ve dosetaksel için sırasıyla; risk oranı [HR]: 1,24, 95% GA: 0,71, 2,18; medyan GS< 10,5 âe karşı 16,2 ay).
EORTC QLQ-LC13 ile ölçüldüğünde, hasta bildirimli göğüs ağrısındaki kötüleşmeye kadar zamanın, dosetaksele karşılık atezolizumab için (HR: 0,71, 95% GA: 0,49, 1,05; iki kolda da medyana ulaşılmamıştır) uzadığı görülmüştür. EORTC QLQ-LC13 ile ölçülen diğer akciğer kanseri semptomları (örn. öksürük, dispne ve kol/omuz ağrısı) için kötüleşme süreleri atezolizumab ve dosetaksel için benzerdir. Bu sonuçlar çalışmanın açık etiketli dizaynına dayanarak dikkatle yorumlanmıştır.
POPLAR (GO28753): kemoterapi tedavisi almış lokal ileri veya metastatik KHDAK hastalarında yapılan randomize Faz II çalışma
PD-L1 ekspresyonundan bağımsız olarak platin içeren rejim uygulanırken ya da sonrasında progresyon görülmüş, lokal ileri veya metastatik KHDAK olan hastalarda Faz II, çok merkezli, uluslararası, randomize, açık etiketli, kontrollü bir çalışma olan GO28753 (POPLAR) çalışması da yürütülmüştür. Birincil etkililik sonlanım noktası, genel sağkalımdır. Toplam 287 hasta 1:1 oranında TECENTRIQ (klinik fayda kaybına kadar üç haftada bir intravenöz infüzyon yoluyla 1200 mg) ya da dosetaksel (progresyona kadar her üç haftalık siklusun 1. (birinci) gününde intravenöz infüzyon yoluyla 75 mg/m) almak üzere randomize edilmiştir. Randomizasyon, PD-L1 IC ekspresyon durumu, önceki kemoterapi rejimlerinin sayısı ve histolojiye göre
tabakalandırılmıştır.
Gözlemlenen toplam 200 ölüm ve 22 aylık medyan sağkalım takibi ile güncelleştirilmiş analiz; dosetaksel ile tedavi edilen hastalarda medyan sağkalım 9,7 ay ve atezolizumab ile tedavi edilen hastalarda medyan sağkalım 12,6 ay (HR: 0,69% 95 GA: 0,52, 0,92) olarak göstermiştir. Atezolizumab ve dosetaksel için Objektif Yanıt Oranı (OYO) sırasıyla %15,3'e karşı %14,7, medyan Yanıt Süresi (YS) ise 18,6 ay ve 7,2 aydır.
Küçük hücreli akciğer kanseri:
IMpower133 (GO30081): kemoterapi tedavisi almamış yaygın evre KHAK hastalarında karboplatin ve etoposidle kombinasyon halinde yapılan randomize Faz I/III çalışma
Kemoterapi kullanmamış, yaygın evre KHAK hastalarında atezolizumabın karboplatin ve etoposid ile kombinasyon halinde kullanıldığında etkililiğini ve güvenliliğini değerlendirmek için Faz I/III, randomize, çok merkezli, çift-kör, plasebo kontrollü bir çalışma olan IMpower133 yürütülmüştür.
Aktif veya tedavi edilmemiş beyin metastazı olan, otoimmün hastalık öyküsü olan, randomizasyondan önceki 4 hafta içinde canlı, attenüe aşı olmuş, randomizasyondan önceki 1 (bir) hafta içinde sistemik immunostimulatör ajan uygulanmış hastalar çalışmaya alınmamıştır.
Tümör değerlendirmeleri 1. (birinci) siklusun 1. (birinci) gününü takiben ilk 48 hafta boyunca her 6 haftada bir ve sonra her 9 haftada bir gerçekleştirilmiştir. Hastalık progresyonundan sonra tedavi edilen hastaların tümör değerlendirmeleri kullanımın bırakılmasına kadar her 6 haftada bir gerçekleştirilmiştir.
Toplamda 403 hasta kayıt edilmiştir ve 1:1 oranında Tablo 10'daki tedavi rejimlerinden birini almak üzere randomize edilmiştir. Randomizasyon cinsiyet, ECOG performans skoru ve beyin metastaz varlığına göre sınıflandırılmıştır.
Tablo 10: Intravenöz tedavi rejimi (IMpower133)
Tedavi rejimi | İndüksiyon (21-günlük 4 siklus) | İdame (21-günlük siklus) |
A | atezolizumab (1200 mg) + karboplatin (EAA 5) ve etoposid (100 mg/m) | atezolizumab (1200 mg) |
B | plasebo + karboplatin (EAA 5) ve etoposid (100 mg/m) | plasebo |
Hasta popülasyonunun demografik ve başlangıç özellikleri tedavi kolları arasında genel olarak benzer değerlendirilmiştir. Hastaların %10'u 75 yaş ve üzeri olmakla beraber medyan yaş 64 yıldır (aralık: 26-90 yaş). Hastaların çoğunluğu erkektir (%65), beyaz ırktandır (%80), %9'unda beyin metastazı vardır ve çoğu halen veya önceden tütün kullanıcısıdır (%97). Başlangıçta
ECOG performans skoru 0 (%35) veya 1(bir)'dir (%65).
Primer analizde, hastaların medyan sağkalım takip süresi 13,9 aydır. Kontrol koluna kıyasla atezolizumab ile karboplatin ve etoposid kombinasyonu ile genel sağkalımda istatistiksel olarak anlamlı bir gelişme gözlendi (risk oranı (HR) 0,7 %95 GA: 0,54, 0,91; ortalama genel sağkalım : 12,3 aya 10,3 ay). Uzun dönem takipli araştırma genel sağkalım analizinde (ortalama: 22,9 ay), her iki koldaki ortalama genel sağkalım, başlangıç genel sağkalım ara analizine göre değişmemiştir. Araştırma analizi yanında başlangıç analiziden elde edilen Progresyonsuz Sağkalım (PS), Objektif Yanıt Oranı (OYO)ve Yanıt Süresi (YS) sonuçları Tablo 11'de özetlenmiştir. Genel sağkalım ve progresyonsuz sağkalım sonuçlarını gösteren Kaplan-Meier eğrileri Şekil 10'da ve 11'de sunulmuştur. Beyin metastazı olan hastalar için veriler bu popülasyonla ilgili sonuç çıkarmak için çok sınırlıdır.
Tablo 11: Etkililik özeti (IMpower133)
Etkililik sonlanım noktası | A kolu (atezolizumab + karboplatin + etoposid) | B kolu (plasebo + karboplatin + etoposid) |
Eş Sonlanım Noktaları | ||
GS analizi | n=201 | n=202 |
Ölüm sayısı (%) | 142 (%70,6) | 160 (%79,2) |
Olaylara kadar geçen medyan süre (ay) | 12,3 | 10,3 |
%95 GA | (10,8; 15,8) | (9,3; 11,3) |
Tabakalandırılmış risk oranı (%95 GA) | 0,76 (0,6; 0,95) | |
p değeri |
0,0154*** | |
12 aylık GS (%) | 51,9 | 39 |
Araştırmacı tarafından değerlendirilen PS (RECIST-STCDK v1.1)** ^ | n=201 | n=202 |
Olay sayısı (%) | 171 (%85,1) | 189 (%93,6) |
Medyan PS süresi (ay) | 5,2 | 4,3 |
%95 GA | (4,4; 5,6) | (4,2; 4,5) |
Sınıflandırılmış risk oranı (%95 GA) | 0,77 (0,62; 0,96) | |
p değeri | 0,017 |
|
6 aylık PS (%) | 30,9 | 22,4 |
12 aylık PS (%) | 12,6 | 5,4 |
Diğer sonlanım noktaları | ||
Araştırmacı Tarafından Değerlendirilen OYO (RECIST-STCDK v1.1)** ^ | n=201 | n=202 |
Yanıt verenlerin sayısı (%) | 121 (%60,2) | 130 (%64,4) |
%95 GA | (53,1; 67) | (57,3; 71) |
Tam yanıt sayısı (%) | 5 (%2,5) | 2 (%1) |
Parsiyel yanıt sayısı (%) | 116 (%57,7) | 128 (%63,4) |
Araştırmacı Tarafından Değerlendirilen YS (RECIST-STCDK v1.1)** ^ | n=121 | n=130 |
Etkililik sonlanım noktası | A kolu (atezolizumab + karboplatin + etoposid) | B kolu (plasebo + karboplatin + etoposid) |
Medyan (ay) | 4,2 | 3,9 |
%95 GA | (4,1; 4,5) | (3,1; 4,2) |
PS=progresyonsuz sağkalım; RECIST-STCDK=Solid Tümörlerde Cevap Değerlendirme Kriterleri v1.1.; GA=güven aralığı; OYO=objektif yanıt oranı; YS=objektif yanıt süresi;
GS=genel sağkalım
* Araştırma GS final analizi klinik kesim tarihi 21 Ocak 2019
**PS, OYO ve YS analizi klinik kesim tarihi 24 Nisan 2018
*** Sadece tanımlayıcı amaçlar için
^ Onaylanan OYO ve YS araştırma sonlanım noktasıdır
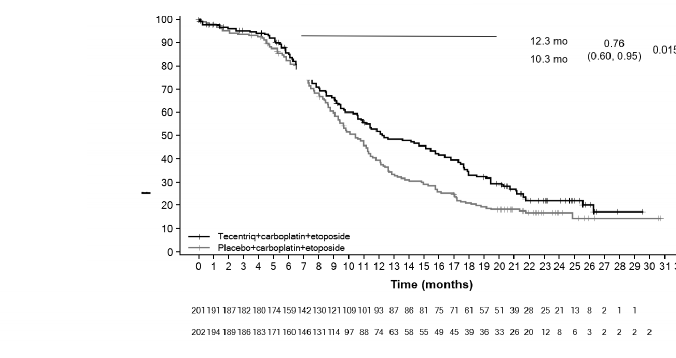
Tedavi kolu
Medyan GS HR (%95 GA) p-değeri
Genel sağkalım (%)
Şekil 10: Genel sağkalım için Kaplan-Meier eğrisi (IMpower133)
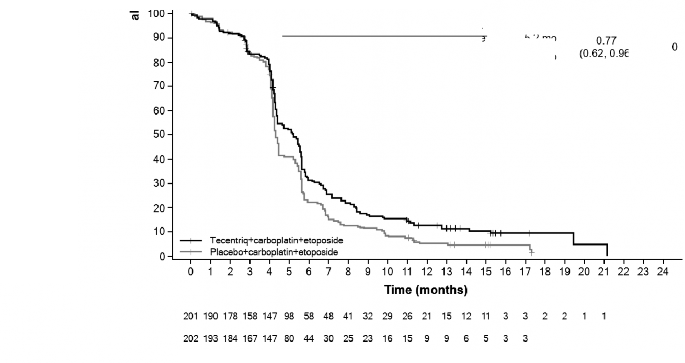
Progresyonsuz sağkalım (%)
Şekil 11: Progresyonsuz sağkalım için Kaplan-Meier eğrisi (IMpower133)
Ürotelyal Kanser:
IMvigor211 (GO29294): Daha önce kemoterapi ile tedavi edilmiş lokal ileri veya metastatik evre ürotelyal kanserli hastalar üzerinde yapılan randomize çalışma
Platin içeren bir rejim sırasında veya sonrasında hastalık ilerlemesi görülen lokal ileri veya metastatik evre ürotelyal kanserli hastalarda kemoterapiye (araştırmacının seçimine bağlı olarak vinflunin, dosetaksel veya paklitaksel) kıyasla atezolizumabın etkililiğini ve güvenliliğini değerlendirmek için faz III, açık etiketli, çok merkezli, uluslararası, randomize bir çalışma (IMvigor211) yürütülmüştür. Otoimmün hastalık öyküsü olan, aktif veya kortikosteroid-bağımlı beyin metastazı olan, kayıttan önceki 28 gün içinde canlı, attenüe aşı uygulanmış ve kayıttan önceki 4 (dört) hafta içinde sistemik immunostimulatör ajan veya 2 (iki) hafta içinde sistemik immunosupresif tıbbi ürün uygulanmış hastalar bu çalışmadan dışlanmıştır. Tümör değerlendirmeleri ilk 54 hafta boyunca her 9 (dokuz) haftada bir ve sonrasında her 12 haftada bir gerçekleştirilmiştir. Tümör örnekleri, tümörü infiltre eden immün hücrelerde (IC) PD-L1 ekspresyonu için prospektif olarak değerlendirilmiş ve sonuçlar aşağıda açıklanan analizler için PD-L1 ekspresyon alt gruplarını tanımlamak için kullanılmıştır.
Toplam 931 hasta kaydedilmiştir. Hastalar atezolizumab ya da kemoterapi almak üzere randomize edilmiştir (1 (bir):1(bir)). Randomizasyon kemoterapi (vinflunin ya da taksan), IC'de PD-L1 ekspresyon durumu (<%5 (beş)'e karşı ≥%5 (beş)), prognostik risk faktörlerinin sayısı (0'a karşı 1(bir)-3 (üç)) ve karaciğer metastazına (evete karşı hayır) göre sınıflandırılmıştır. Prognostik risk faktörleri arasında önceki kemoterapiden itibaren ï¼3 (üç) ay geçmesi, ï¾ 0 ECOG performans durumu ve ï¼ 10 g/dL hemoglobin yer almıştır.
Atezolizumab, 3 (üç) haftada bir intravenöz infüzyon yoluyla 1200 mg sabit dozda
uygulanmıştır. Atezolizumab dozunun azaltımına izin verilmemiştir. Hastalar, araştırmacı tarafından değerlendirildiği şekilde klinik faydanın kaybedilmesine veya kabul edilemez toksisite görülene kadar tedavi edilmiştir. Vinflunin, hastalığın ilerlemesine veya kabul edilemez toksisite görülene kadar her 3 (üç) haftalık döngünün 1. (birinci) gününde intravenöz infüzyon yoluyla 320 mg/m dozunda uygulanmıştır. Paklitaksel, hastalığın ilerlemesine veya kabul edilemez toksisite görülene kadar her 3 (üç) haftalık döngünün 1. (birinci) gününde 3 (üç) saat boyunca intravenöz infüzyon yoluyla 175 mg/m dozunda uygulanmıştır. Dosetaksel, hastalığın ilerlemesine veya kabul edilemez toksisite görülene kadar her 3 (üç) haftalık döngünün 1. (birinci) gününde intravenöz infüzyon yoluyla 75 mg/m dozunda uygulanmıştır. Tedavi edilen tüm hastalarda medyan tedavi süresi atezolizumab kolu için 2,8 ay, vinflunin ve paklitaksel kolları için 2,1 ay ve dosetaksel kolu için 1,6 ay olmuştur.
Primer analiz popülasyonunun demografik ve başlangıç hastalık özellikleri tedavi kolları arasında dengeli olmuştur. Medyan yaş 67 (aralık: 31-88) olup hastaların %77,1'i erkektir. Hastaların çoğunluğu (%72,1) beyaz ırktan olup kemoterapi kolundaki hastaların %53,9'u vinflunin almış, başlangıçta hastaların %71,4'ünde en az bir kötü prognostik risk faktörü ve %28,8'inde karaciğer metastazı mevcuttur. Başlangıç ECOG performans durumu 0 (%45,6) veya 1 (%54,4) olmuştur. Hastaların %71,1'inde primer tümör yeri mesanedir ve hastaların %25,4'ünde üst sistem ürotelyal karsinomu mevcuttur. Hastaların %24,2'si daha önce sadece platin içeren adjuvan veya neoadjuvan tedavi almış ve bu hastalarda 12 ay içinde hastalık ilerlemesi görülmüştür.
IMvigor211 için primer etkililik sonlanım noktası genel sağkalımdır (GS). Araştırmacı tarafından değerlendirilen Solid Tümörlerde Yanıt Değerlendirme Kriterleri (RECIST) v1.1'e göre değerlendirilen sekonder etkililik sonlanım noktaları objektif yanıt oranı (OYO), progresyonsuz sağkalım (PS) ve yanıt süresidir (YS). IC2/3, IC1/2/3ve ITT (tedavisi amaçlanan, yani tüm katılanlar) popülasyonlarında tedavi kolu ve kontrol kolu arasındaki GS karşılaştırmaları, aşağıdaki şekilde %5'lik iki taraflı seviyede sınıflandırılmış bir log-sıra testine dayalı hiyerarşik, sabit sıralı bir prosedür kullanılarak test edilmiştir: aşama 1) IC2/3popülasyonu; aşama 2) IC1/2/3 popülasyonu; aşama 3) tüm katılanlar popülasyonu. Aşama 2 ve 3'ün her birine ait GS sonuçları, ancak önceki aşamaya ait sonuç istatistiksel olarak anlamlıysa, istatistiksel anlamlılık açısından resmi olarak test edilebilmiştir.
Medyan sağkalım takibi 17 aydır. IMvigor211 çalışmasının primer analizi primer genel sağkalım sonlanım noktasını karşılamamıştır. Atezolizumab, daha önce tedavi edilmiş, lokal ileri evre veya metastatik ürotelyal karsinomlu hastalarda kemoterapiye kıyasla istatistiksel olarak anlamlı bir sağkalım faydası göstermemiştir. Önceden belirlenmiş hiyerarşik test sırasına göre, 0,87'lik bir genel sağkalım risk oranı ile önce IC 2/3popülasyonu test edilmiştir (%95 GA: 0,63, 1,21; atezolizumab ve kemoterapi için medyan genel sağkalım sırasıyla 11,1 aya karşı 10,6 ay). Sınıflandırılmış log-sıra p değeri 0,41'dir ve bu nedenle sonuçlar bu popülasyonda istatistiksel olarak anlamlı kabul edilmemiştir. Sonuç olarak, IC1/2/3 veya tüm katılanlar popülasyonunda genel sağkalım için herhangi bir istatistiksel anlamlılık testi gerçekleştirilememiş ve bu analizlerin sonuçları açıklayıcı olarak değerlendirilmiştir. Tüm katılanlar popülasyonundaki kilit sonuçlar Tablo 12'de özetlenmiştir. Tüm katılanlar popülasyonunda Kaplan Meier genel sağkalım eğrisi Şekil 12'de sunulmaktadır.
ITT popülasyonunda 34 aylık bir medyan sağkalım takip süresi ile açıklayıcı bir güncellenmiş sağkalım analizi gerçekleştirilmiştir. Medyan genel sağkalım, 0,82'lik bir risk oranı (%95 GA: 0,71, 0,94) ile atezolizumab kolunda 8,6 ay (%95 GA: 7,8, 9,6) ve kemoterapi kolunda 8 ay (%95 GA: 7,2, 8,6) olmuştur. 12 aylık genel sağkalım oranları için primer analizde gözlemlenen eğilim ile uyumlu olarak, atezolizumab kolundaki hastalarda, ITT popülasyonundaki
kemoterapi koluna kıyasla sayısal olarak daha yüksek 24 ve 30 aylık genel sağkalım oranları gözlemlenmiştir. 24. ayda sağ olan hastaların yüzdesi (KM tahmini) kemoterapi kolunda %12,7 ve atezolizumab kolunda %22,5; 30. ayda sağ olan hastaların yüzdesi (KM tahmini) ise kemoterapi kolunda %9,8 ve atezolizumab kolunda %18,1 olmuştur.
Tablo 12: Tüm katılanlarda etkililik özeti (IMvigor211)
Etkililik sonlanım noktası | Atezolizumab (n = 467) | Kemoterapi (n = 464) |
Primer etkililik sonlanım noktası | ||
GS* | ||
Ölüm sayısı (%) | 324 (%69,4) | 350 (%75,4) |
Olaylara kadar geçen medyan süre (ay) | 8,6 | 8 |
%95 GA | 7,8, 9,6 | 7,2, 8,6 |
Sınıflandırılmış risk oranı (%95 GA) | 0,85 (0,73, 0,99) | |
12 aylık GS (%)** | %39,2 | %32,4 |
Sekonder ve açıklayıcı sonlanım noktaları | ||
Araştırmacı tarafından değerlendirilen PS (RECIST v1.1) | ||
Olay sayısı (%) | 407 (%87,2) | 410 (%88,4) |
Medyan PS süresi (ay) | 2,1 | 4 |
%95 GA | 2,1, 2,2 | 3,4, 4,2 |
Sınıflandırılmış risk oranı (%95 GA) | 1,1 (0,95, 1,26) | |
Araştırmacı tarafından değerlendirilen OYO (RECIST v1.1) | n = 462 | n = 461 |
Doğrulanmış yanıt verenlerin sayısı (%) | 62 (%13,4) | 62 (%13,4) |
%95 GA | 10,45, 16,87 | 10,47, 16,91 |
Tam yanıt sayısı (%) | 16 (%3,5) | 16 (%3,5) |
Kısmi yanıt sayısı (%) | 46 (%10) | 46 (%10) |
Stabil hastalık sayısı (%) | 92 (%19,9) | 162 (%35,1) |
Araştırmacı tarafından değerlendirilen YS (RECIST v1.1) | n = 62 | n = 62 |
Medyan (ay) *** | 21,7 | 7,4 |
%95 GA | 13, 21,7 | 6,1, 10,3 |
GA=güven aralığı; YS=yanıt süresi; OYO=objektif yanıt oranı; GS=genel sağkalım; PS=progresyonsuz sağkalım; RECIST = Katı Tümörlerde Yanıt Değerlendirme Kriterleri v1.1.
* Tüm katılanlar popülasyonunda GS analizi sınıflandırılmış log-sıra testine göre gerçekleştirilmiş ve sonuç sadece açıklama amaçlı olarak sunulmuştur (p = 0,0378); önceden belirlenmiş analiz hiyerarşisine göre, tüm katılanlar popülasyonunda GS analizi için p değeri istatistiksel olarak anlamlı kabul edilememektedir.
Ç Kemoterapi (vinflunin ya da taksan), IC'de durum (< %5 (beş)'e karşı ≥ %5(beş)), prognostik risk faktörlerinin sayısı (0'a karşı 1(bir)-3(üç)) ve karaciğer metastazına (evete karşı hayır) göre sınıflandırıldı.
** Kaplan-Meier tahminine göre.
*** Yanıtlar atezolizumab kolunda yanıt verenlerin %63'ünde ve kemoterapi kolunda yanıt verenlerin %21'inde devamlıydı.
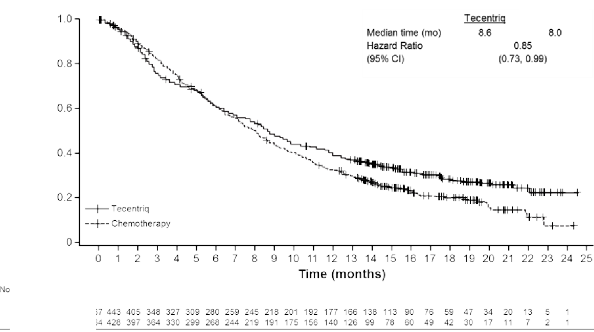
Şekil 12: Kaplan Meier genel sağkalım eğrisi (IMvigor211)
IMvigor210 (GO29293): Sisplatin tedavisi için uygun bulunmayan, daha önceden tedavi edilmemiş ürotelyal kanserli hastalar üzerinde yapılan tek kollu çalışma
Lokal ileri veya metastatik evre ürotelyal kanserli (ürotelyal mesane kanseri olarak da bilinir) hastalar üzerinde faz II, çok merkezli, uluslararası, iki kohortlu, tek kollu bir klinik çalışma (IMvigor210) yürütülmüştür.
Çalışmada toplam 438 hasta ve iki hasta kohortu vardır. Kohort 1'e, sisplatin bazlı kemoterapiye uygun bulunmayan veya uygun olmayan ya da platin içeren bir neoadjuvan veya adjuvan kemoterapi rejimi ile uygulanan tedaviden en az 12 ay sonra hastalık ilerlemesi görülen, daha önce tedavi görmemiş, lokal ileri veya metastatik evre ürotelyal kanserli hastalar dahil edilmiştir. Kohort 2'ye ise, lokal ileri veya metastatik evre ürotelyal kanserli için en az bir platin bazlı kemoterapi rejimi alan veya platin içeren bir neoadjuvan veya adjuvan kemoterapi rejimi ile uygulanan tedaviden sonraki 12 ay içinde hastalık ilerlemesi görülen hastalar dahil edilmiştir.
Kohort 1'de, 119 hasta hastalığın ilerlemesine kadar intravenöz infüzyon yoluyla 3 (üç) haftada bir 1200 mg atezolizumab ile tedavi edilmiştir. Medyan yaş 73'tür. Hastaların çoğu (%81) erkek ve çoğunluğu (%91) beyaz ırktan olmuştur.
Kohort 1'e, ECOG performans durumu 0 olan 45 hasta (%38), ECOG performans durumu 1 olan 50 hasta (%42) ve ECOG performans durumu 2 olan 24 hasta (%20), Bajorin risk faktörü (ECOG performans durumu ≥ 2 ve viseral metastaz) olmayan 35 hasta (%29), bir Bajorin risk faktörü olan 66 hasta (%56) ve iki Bajorin risk faktörü olan 18 hasta (%15), böbrek işlev bozukluğu olan (glomerüler filtrasyon hızı [GFR] < 60 mL/dk) 84 hasta (%71) ve karaciğer metastazı olan 25 hasta (%21) dahil edilmiştir.
Kohort 1'in primer etkililik sonlanım noktası, bağımsız bir değerlendirme tesisi (IRF) tarafından RECIST v1.1 kullanılarak değerlendirilen objektif yanıt oranı (OYO) olarak doğrulanmıştır.
Primer analiz, tüm hastalar en az 24 hafta süreyle takip edildiğinde gerçekleştirilmiştir. Tüm katılanlarda medyan tedavi süresi 15 hafta ve medyan sağkalım takip süresi 8,5 ay olmuştur. RECIST v1.1'e göre IRF tarafından değerlendirilen klinik olarak anlamlı OYO'lar gösterilmiş; ancak önceden belirlenmiş %10'luk bir geçmiş kontrol yanıt oranı ile karşılaştırıldığında, anlamlı faydaya ulaşılamamıştır. IRF RECIST v1.1'e göre doğrulanmış OYO'lar PD-L1 ekspresyonu ≥%5 olan hastalarda %21,9 (%95 GA: 9,3, 40), PD-L1 ekspresyonu ≥%1 olan
hastalarda %18,8 (%95 GA: 10,9, 29) ve tüm katılanlarda %19,3 (%95 GA: 12,7, 27,6) olmuştur. Herhangi bir PD-L1 ekspresyon alt grubunda veya tüm katılanlarda medyan yanıt süresine (YS) ulaşılmamıştır. Yaklaşık %40'lık bir olay-hasta oranı ile genel sağkalım matür değildir. Tüm hasta alt gruplarında (PD-L1 ekspresyonu ï³ %5 ve ï³%1) ve tüm katılanlarda medyan genel sağkalım 10,6 ay olmuştur.
Kohort 1 için gerçekleştirilen ve 17,2 aylık bir medyan sağkalım takip süresi ile güncellenmiş olan analiz Tablo 13'te özetlenmektedir. Herhangi bir PD-L1 ekspresyon alt grubunda veya tüm katılanlarda medyan YS'ye ulaşılmamıştır.
Tablo 13: Güncellenmiş etkililik özeti (IMvigor210 Kohort 1)
Etkililik sonlanım noktası | IC'de PD-L1 ekspresyonu ≥%5 olanlar | IC'de PD-L1 ekspresyonu ≥%1 olanlar |
Tüm Katılanlar |
OYO (IRF tarafından değerlendirilen; RECIST v1.1) | n = 32 | n = 80 | n = 119 |
Yanıt verenlerin sayısı (%) | 9 (%28,1) | 19 (%23,8) | 27 (%22,7) |
%95 GA | 13,8, 46,8 | 15, 34,6 | 15,5, 31,3 |
Tam yanıt sayısı (%) %95 GA | 4 (%12,5) (3,5, 29) | 8 (%10) (4,4, 18,8) | 11 (%9,2) (4,7, 15,9) |
Kısmi yanıt sayısı (%) %95 GA | 5 (%15,6) (5,3, 32,8) | 11 (%13,8) (7,1, 23,3) | 16 (%13,4) (7,9, 20,9) |
YS (IRF tarafından değerlendirilen; RECIST v1.1) | n = 9 | n = 19 | n = 27 |
Olay görülen hastalar (%) | 3 (%33,3) | 5 (%26,3) | 8 (%29,6) |
Medyan (ay) (%95 GA) | TE (11,1, TE) | TE (TE) | TE (14,1, TE) |
PS (IRF tarafından değerlendirilen; RECIST v1.1) | n = 32 | n = 80 | n = 119 |
Olay görülen hastalar (%) | 24 (%75) | 59 (%73,8) | 88 (%73,9) |
Medyan (ay) (%95 GA) | 4.1 (2,3, 11,8) | 2.9 (2,1, 5,4) | 2.7 (2,1, 4,2) |
GS | n = 32 | n = 80 | n = 119 |
Olay görülen hastalar (%) | 18 (%56,3) | 42 (%52,5) | 59 (%49,6) |
Medyan (ay) (%95 GA) | 12,3 (6, TE) | 14,1 (9,2, TE) | 15,9 (10,4, |
|
|
| TE) |
1 yıllık GS oranı (%) | %52,4 | %54,8 | %57,2 |
GA = güven aralığı; YS = yanıt süresi; IC = tümörü infiltre eden immün hücreler; IRF = bağımsız değerlendirme tesisi; TE = tahmin edilemiyor; OYO = objektif yanıt oranı; GS = genel sağkalım; PS = progresyonsuz sağkalım; RECIST = Katı Tümörlerde Yanıt Değerlendirme Kriterleri v1.1.
Kohort 2'de, ko-primer etkililik sonlanım noktaları, bir IRF tarafından RECIST v1.1 kullanılarak değerlendirilen OYO ve Modifiye RECIST (mRECIST) kriterlerine göre araştırmacı tarafından değerlendirilen OYO olarak doğrulanmıştur. 310 hasta, klinik faydanın kaybedilmesine kadar 3 (üç) haftada bir intravenöz infüzyon yoluyla 1200 mg atezolizumab ile tedavi edilmiştir. Kohort 2'nin primer analizi, tüm hastalar en az 24 hafta süreyle takip edildiğinde gerçekleştirilmiştir. Çalışma Kohort 2'deki ko-primer sonlanım noktalarını karşılamış; bu da önceden belirlenmiş %10'luk bir geçmiş kontrol yanıt oranı ile karşılaştırıldığında, IRF tarafından RECIST v1.1 kullanılarak değerlendirilen ve araştırmacı tarafından mRECIST kullanılarak değerlendirilen istatistiksel olarak anlamlı OYO'lar göstermiştir.
Kohort 2'de 21,1 aylık bir medyan sağkalım takip süresi ile de analiz gerçekleştirilmiştir. IRF RECIST v1.1'e göre doğrulanmış OYO'lar, PD-L1 ekspresyonu ≥%5 olan hastalarda %28 (%95 GA: 19,5, 37,9), PD-L1 ekspresyonu ≥%1 olan hastalarda %19,3 (%95 GA: 14,2, 25,4)
ve tüm katılanlarda %15,8 (%95 GA: 11,9, 20,4) olmuştur. Araştırmacı tarafından değerlendirilen mRECIST'e göre doğrulanmış OYO ise PD-L1 ekspresyonu ≥%5 olan hastalarda %29 (%95 GA: 20,4, 38,9), PD-L1 ekspresyonu ≥%1 olan hastalarda %23,7 (%95
GA: 18,1, 30,1) ve tüm katılanlarda %19,7 (%95 GA: 15,4, 24,6) olmuştur. Tüm katılanlar popülasyonunda IRF RECIST v1.1'e göre tam yanıt oranı %6,1 (%95 GA: 3,7, 9,4) olmuştur. Kohort 2'de, herhangi bir PD-L1 ekspresyon alt grubunda veya tüm katılanlarda medyan YS'ye ulaşılmamış; ancak PD-L1 ekspresyonu <%1 olan hastalarda ulaşılmıştır (13,3 ay; %95 GA 4,2, TE). 12. ayda GS oranı tüm katılanlarda %37 olmuştur.
IMvigor130 (WO30070): Tedavi edilmemiş lokal ileri evre veya metastatik ürotelyal karsinomlu hastalarda monoterapi olarak ve platin bazlı kemoterapi ile kombinasyon halinde atezolizumabın değerlendirildiği faz III çok merkezli, randomize, plasebo kontrollü çalışma.
Sağkalım verilerinin ilk aşamada gözden geçirilmesini takiben bağımsız bir Veri İzleme Kurulu (İDMC) tarafından verilen tavsiyeye dayanılarak, tümörlerinde PD-L1 ekspresyonu düşük olan (PD-L1 ile boyanmış, tümörü infiltre eden immün hücrelerin [IC], tümör alanının <%5'ini kaplaması) hastaların atezolizumab monoterapisi koluna eklenmesi, bu alt grubun genel sağkalımında azalma gözlemlendikten sonra durdurulmuştur. İDMC, halihazırda monoterapi koluna randomize edilmiş ve monoterapi kolunda tedavi görmekte olan hastalar için herhangi bir tedavi değişikliği tavsiye etmemiştir. Başka bir değişiklik tavsiye edilmemiştir.
Hepatoselüler kanser:
IMbrave150 (YO40245): Bevacizumab ile kombinasyon halinde, daha önce sistemik tedavi almamış rezeke edilemeyen hepatoselüler kanserli hastalarda randomize faz III çalışma
Daha önce sistemik tedavi görmemiş lokal ileri veya metastatik evre ve/veya rezeke edilemeyen hepatoselüler kanserli hastalarda bevacizumab ile kombinasyon halinde atezolizumabın
etkililiği ve güvenliliğini değerlendirmek üzere, faz III, randomize, çok merkezli, uluslararası, açık etiketli bir çalışma olan IMbrave150 yürütülmüştür. Toplamda 501 hasta (2:1) oranında ya intravenöz infüzyon ile her 3 haftada bir uygulanan atezolizumab (1200 mg) ve 15 mg/kg bevacizumaba ya da günde iki kez oral yolla uygulanan sorafenib 400 mg'a randomize edilmiştir. Randomizasyon coğrafi bölge (geri kalan dünya ülkelerine karşı Japonya hariç Asya), makrovasküler invazyon ve/veya ekstrahepatik yayılma (yoka karşı var), başlangıç âº- fetoprotein (AFP) (≥400 ng/mL'ye karşı <400 ng/mL) ve ECOG performans durumuna (1'e karşı 0) göre sınıflandırılmıştır. Her iki koldaki hastalar klinik fayda kaybına veya kabul edilemez toksisiteye kadar tedavi almıştır. Hastalar atezolizumab veya bevacizumabı bırakıp (örn. advers olaylardan dolayı) klinik fayda kaybı veya tekli ajan ile ilişkili kabul edilemez toksisiteye kadar tekli ajan tedavisine devam edebilmiştir.
Çalışmaya hastalığı cerrahi ve/veya bölgesel tedavilere uygun olmayan veya cerrahi ve/veya bölgesel tedavilerden sonra ilerleyen Child-Pugh A, ECOG 0/1'e sahip ve daha önce sistemik tedavi almamış yetişkinler kaydedeilmiştir. Kanama (ölümcül olaylar dahil) bevacizumab ile bilinen bir advers reaksiyondur ve üst gastrointestinal kanama HSK'li hastalarda yaygın ve hayati risk taşıyan bir komplikasyondur. Bu nedenle, hastaların tedaviden önceki 6 ay içinde varis varlığı açısından değerlendirilmesi zorunlu tutulmuş ve tedaviden önceki 6 ay içinde varise bağlı kanama geçirmişlerse, kanama veya yüksek kanama riski olan tedavi edilmemiş ya da yeterince tedavi edilmemiş varisleri varsa çalışmadan hariç tutulmuştur. Aktif hepatit B'li hastalar için çalışma tedavisine başlamadan önce 28 gün içinde HBV DNA< 500 IU/mL ve çalışmaya dahil olmadan önce ve çalışma boyunca minimum 14 günlük standart anti-HBV tedavisi gerekli olmuştur.
Hastalar ayrıca, orta şiddette veya şiddetli asitleri; hepatik ensefalopati öyküleri, hepatik ensefalopati öyküsü, bilinen fibrolameller HSKsi, sarkomatoid HSK'si, mikst kolanjiokarsinomu ve HSK'si, HBV ve HCV'nin aktif koenfeksiyonu, otoimmün hastalık öyküleri varsa, randomizasyondan önceki 4 (dört) hafta içinde canlı, attenüe aşı uygulanmışsa; randomizasyondan önceki 4 (dört) hafta içinde sistemik immunostimulatör ajan veya 2 (iki) hafta içinde immunsupresif ilaçlar uygulanmışsa; tedavi edilmemiş veya kortikosteroide bağımlı beyin metastazları varsa da hariç tutulmuştur. Tümör değerlendirmeleri 1. (birinci) Döngü, 1. (birinci) Günden sonraki ilk 54 hafta boyunca her 6 (altı) haftada bir, ardından her 9 (dokuz) haftada bir yürütülmüştür.
Çalışma popülasyonunun demografik ve başlangıç hastalık özellikleri tedavi kolları arasında iyi dengelenmiştir. Medyan yaş 65 olup (aralık: 26 ila 88), hastaların %83'ü erkektir. Hastaların çoğu Asyalı (%57) ve beyazdır (%35). %40'ı Asya'dan (Japonya hariç), %60'ı geri kalan dünya ülkelerindendir. Hastaların yaklaşık %75'i makrovasküler invazyon ve/veya esktrahepatik yayılma ile başvururken, %37'sinde başlangıç AFP değeri ≥400 ng/mL'dir. Başlangıç ECOG performans durumu 0 (%62) veya 1 (bir)'dir (%38). HSK gelişimi açısından birincil risk faktörleri hastaların %48'inde Hepatit B virüsü enfeksiyonu, hastaların %22'sinde Hepatit C virüsü enfeksiyonu ve hastaların %31'inde viral olmayan hastalıktır. HSK, hastaların
%82'sinde Barselona Kliniği Karaciğer Kanseri (BCLC) evre C, hastaların %16'sında evre B ve hastaların %3 (üç)'ünde evre A olarak sınıflandırılmıştır.
Eş-primer etkililik sonlanım noktaları RECIST v1.1'e göre GS (genel sağkalım) ve bağımsız değerlendirme merkezi (IRF) tarafından değerlendirilen PS'dir (progresyonsuz sağkalım). Birincil analiz zamanında hastalar 8,6 aylık medyan sağkalım takibi süresine sahiptir. Veriler sorafenibe kıyasla atezolizumab + bevacizumab ile RECIST v1.1'e göre IRF tarafından değerlendirildiği üzere PS ve GS'de istatistiksel anlamlı bir iyileşme göstermiştir. İstatistiksel anlamlı bir iyileşme, ayrıca RECIST v1.1'e ve HSK değiştirilmiş RECIST'e (mRECIST) göre
IRF tarafından doğrulanmış objektif yanıt oranında da (OYO) gözlenmiştir. Primer analize ait kritik etkililik bulguları Tablo 14'te özetlenmektedir.
15,6 aylık ortanca sağkalım takip süresi ile tanımlayıcı bir güncellenmiş etkililik analizi yürütülmüştür. Medyan GS, atezolizumab + bevacizumab kolunda 19,2 ay (%95 GA: 17, 23,7)
iken sorafenib kolunda 13,4 ay (%95 GA: 11,4, 16,9) olup risk oranı 0,66'dır (%95 GA: 0,52, 0,85). RECIST v1.1 doğrultusunda IRF değerlendirmesine göre medyan progresyonsuz sağkalım, atezolizumab + bevacizumab kolunda 6,9 ay (%95 GA: 5,8, 8,6) iken sorafenib
kolunda 4,3 ay (%95 GA: 4, 5,6) olup risk oranı değeri 0,65'tir (%95 GA: 0,53, 0,81).
RECIST v1.1'e göre IRF ile değerlendirilen genel yanıt oranı, atezolizumab + bevacizumab kolunda %29,8 (%95 GA: 24,8, 35) iken sorafenib kolunda %11,3 (%95 GA: 6,9, 17,3) olmuştur. Doğrulanmış yanıt verenlerde RECIST v1.1 doğrultusunda IRF değerlendirmesine göre ortanca yanıt süresi (YS), atezolizumab + bevacizumab kolunda 18,1 aya (%95 GA: 14,6, tahmin edilemiyor (TE)) kıyasla sorafenib kolunda 14,9 ay bulunmuştur (%95 GA: 4,9, 17).
Genel sağkalım (güncellenmiş analiz) ve progresyonsuz sağkalım (primer analiz) için Kaplan- Meier eğrileri Şekil 13 ve 14'te sunulmaktadır.
Tablo 14: Etkililik özeti (IMbrave150 primer analiz)
Kritik etkililik sonlanım noktası: | Atezolizumab+bevacizumab | Sorafenib |
GS | n=336 | n=165 |
Ölüm sayısı (%) | 96 (%28,6) | 65 (%39,4) |
Olaya kadar geçen medyan süre (ay) | TE | 13,2 |
%95 GA | (TE, TE) | (10.4, TE) |
Sınıflandırılmış risk oranı | 0,58 (0,42, 0,79) | |
p değeri | 0,0006 | |
6 aylık GS (%) | %84,8 | %72,3 |
IRF tarafından değerlendirilen PS, RECIST 1.1 | n=336 | n=165 |
Olay sayısı (%) | 197 (%58,6) | 109 (%66,1) |
Medyan PS süresi (ay) | 6,8 | 4,3 |
%95 GA | (5,8, 8,3) | (4, 5,6) |
Sınıflandırılmış risk oranı | 0,59 (0,47, 0,76) | |
p değeri | <0,0001 | |
6 aylık PS | %54,5 | %37,2 |
IRF tarafından değerlendirilen OYO, RECIST 1.1 | n=326 | n=159 |
Doğrulanmış yanıt veren sayısı (%) | 89 (%27,3) | 19 (%11,9) |
%95 GA | (22,5, 32,5) | (7,4, 18) |
p-değeri | <0,0001 | |
Kritik etkililik sonlanım noktası: | Atezolizumab+bevacizumab | Sorafenib |
Tam yanıtların sayısı (%) | 18 (%5,5) | 0 |
Kısmi yanıtların sayısı (%) | 71 (21,8) | 19 (%11,9) |
Stabil hastalık sayısı (%) | 151 (%46,3) | 69 (43,4) |
IRF ile değerlendirilen YS, RECIST 1.1 | n=89 | n=19 |
Ay cinsinden medyan | TE | 6,3 |
%95 GA | (TE, TE) | (4,7, TE) |
Aralık (ay) | (1,3+, 13,4+) | (1,4+, 9,1+) |
IRF tarafından değerlendirilen OYO, HSK mRECIST | n=325 | n=158 |
Doğrulanmış yanıt veren sayısı (%) | 108 (%33,2) | 21 (%13,3) |
%95 GA | (28,1, 38,6) | (8,4, 19,6) |
p-değeri | <0,0001 | |
Tam yanıtların sayısı (%) | 33 (%10,2) | 3 (%1,9) |
Kısmi yanıtların sayısı (%) | 75 (%23,1) | 18 (%11,4) |
Stabil hastalık sayısı (%) | 127 (%39,1) | 66 (%41,8) |
IRF ile değerlendirilen YS, HSK mRECIST | n=108 | n=21 |
Ay cinsinden medyan | TE | 6,3 |
%95 GA | (TE, TE) | (4,9, TE) |
Aralık (ay) | (1,3+, 13,4+) | (1,4+, 9,1+) |
Coğrafi bölgeye (geri kalan dünya ülkelerine karşı Japonya hariç Asya), makrovasküler invazyon ve/veya ekstrahepatik yayılma (yoka karşı var), başlangıç âº-fetoprotein (AFP) (≥400'e karşı <400 ng/mL) göre sınıflandırılmıştır + Sansürlü bir değeri gösterir PS = progresyonsuz sağkalım; RECIST = Solid Tümörlerde Yanıt Değerlendirme Kriterleri v1.1; CC mRECIST = Hepatoselüler Karsinom İçin Değiştirilmiş RECIST Değerlendirmesi; GA = güven aralığı; OYO = objektif yanıt oranı; YS = yanıt süresi; GS = genel sağkalım; TE = Tahmin edilemiyor; N/A=geçerli değildir | ||
İki taraflı sınıflandırılmış log-sıra testi temelinde
5.2. Farmakokinetik özellikler
Genel özelliklerAtezolizumaba maruziyet 1 (bir) mg/kg vücut ağırlığı - 20 mg/kg vücut ağırlığı doz aralığında 3 (üç) haftada bir uygulanan sabit doz 1200 mg doz ile orantılı olarak artmıştır. 472 hastayı içeren bir popülasyon analizi, aşağıdaki doz aralığı için atezolizumab farmakokinetiğini açıklamıştır: Birinci derece eliminasyonla bir doğrusal iki bölmeli dağılım modeli ile 1 - 20 mg/kg vücut ağırlığı. Bir popülasyon farmakokinetik analizi, 6 (altı)-9 (dokuz) hafta tekrarlı dozlamadan sonra kararlı durumun elde edildiğini öne sürmektedir. Eğri altındaki alanda, maksimum konsantrasyon ve en düşük konsantrasyonda sistemik birikim sırasıyla 1,91; 1,46 ve 2,75 kat olmuştur.
Emilim:
Atezolizumab intravenöz infüzyon şeklinde uygulanır. Diğer uygulama yollarıyla yapılan çalışmalar olmamıştır.
Dağılım:
Popülasyon farmakokinetik analizi, bir hastada merkezi kompartman dağılım hacminin 3,28 L ve kararlı durumunda hacmin 6,91 L olduğunu göstermektedir.
Biyotransformasyon:
Atezolizumabın metabolizması doğrudan araştırılmamıştır. Antikor klerensi esas olarak katabolizmayla gerçekleşir.
Eliminasyon:
Popülasyon farmakokinetik analizi, atezolizumabın klerensinin 0,2 L/gün ve tipik terminal eliminasyon yarı ömrünün 27 gün olduğunu göstermektedir.
Özel popülasyonlara ilişkin ek bilgiler:
Popülasyon farmakokinetiği ve maruziyet-yanıt analizlerine göre aşağıdaki faktörlerin atezolizumabın farmakokinetiği üzerinde bir etkisi yoktur: yaş, (21-89 yaş), bölge, etnik köken, böbrek bozukluğu, hafif karaciğer bozukluğu, PD-L1 ekspresyonu düzeyi veya ECOG durumu. Vücut ağırlığı, cinsiyet, pozitif ADA durumu, albümin seviyeleri ve tümör yükünün atezolizumab farmakokinetiği üzerindeki etkisi istatistiki olarak anlamlı ancak klinik olarak
anlamlı değildir. Doz ayarlanması önerilmemektedir. Pediyatrik popülasyon:
Pediyatrik (<18 yaş, n= 69) ve genç erişkin (18-30 yaş, n=18) hastalarda yapılan bir erken faz, çok merkezli, açık etiketli çalışmadan elde edilen farmakokinetik sonuçlar, atezolizumab klerensi ve dağılım hacminin, normal vücut ağırlığında her 3 (üç) hafta 15 mg/kg vücut ağırlığı alan pediyatrik hastalar ve 1200 mg atezolizumab alan genç erişkin hastalar arasında karşılaştırılabilir olduğunu göstermiştir. Maruziyetin ise, vücut ağırlığı düştükçe pediyatrik hastalarda arttığı gözlenmiştir. Bu değişiklikler, atezolizumab konsantrasyonunun terapötik hedef maruziyetinin altına düşmesi ile bağlantılı değildir. 2 yaş altındaki çocuklar için veriler sınırlıdır, bu nedenle kesin sonuçlara varılamamaktadır.
Geriyatrik popülasyon:
Yaşlı hastalarda TECENTRIQ için özel bir çalışma yapılmamıştır. Yaşın atezolizumabın farmakokinetiği üzerindeki etkisi bir popülasyon farmakokinetik analizinde değerlendirilmiştir. Yaş, 21-89 yaş aralığındaki (n=472) ve medyan 62 yaşındaki hastalar temel alındığında, atezolizumabın farmakokinetiğini etkileyen önemli bir kovaryant olarak tanımlanmamıştır. <65 yaşındaki (n=274), 65-75 yaşındaki (n=152) ve >75 yaşındaki (n=46) hastalarda atezolizumabın farmakokinetiğinde klinik açıdan anlamlı bir fark gözlenmemiştir (bkz. Bölüm 4.2).
Böbrek yetmezliği:
Böbrek bozukluğu olan hastalarda TECENTRIQ için özel bir çalışma yapılmamıştır. Popülasyon farmakokinetik analizinde, böbrek fonksiyonu normal (90 mL/dk/1,73 m veya üzeri eGFR; n=140) olan hastalarla karşılaştırıldığında, hafif (60 - 89 mL/dk/1,73 m eGFR; n=208) veya orta şiddetli (30 - 59 mL/dk/1,73 m eGFR; n=116) böbrek bozukluğu olan hastalarda atezolizumabın klerensinde klinik açıdan önemli farklar bulunmamıştır. Yalnızca birkaç hastada şiddetli böbrek bozukluğu vardır (eGFR 15 - 29 mL/dk/1,73 m; n=8) (bkz. Bölüm 4.2). Şiddetli böbrek yetmezliğinin atezolizumabın farmakokinetiği üzerindeki etkisi bilinmemektedir.
Karaciğer yetmezliği:
Karaciğer bozukluğu olan hastalarda TECENTRIQ için özel bir çalışma yapılmamıştır. Popülasyon farmakokinetik analizinde hafif karaciğer bozukluğu (bilirubin ≤NÜS ve AST>NÜS veya bilirubin <1 â 1,5 x NÜS ve herhangi bir AST) veya orta düzeyde karaciğer bozukluğu (bilirubin <1,5 â 3 x NÜS ve herhangi bir AST) olan hastalarda normal karaciğer fonksiyonu (bilirubin ve AST ≤NÜS) olan hastalara kıyasla atezolizumabın klerensi bakımından klinik olarak önemli farklar bulunmamıştır. Şiddetli karaciğer bozukluğu olan hastalara ilişkin veri mevcut değildir (bilirubin > 3 x NÜS ve herhangi bir AST). Karaciğer bozukluğu, Ulusal Kanser Enstitüsü (NCI) karaciğer fonksiyon bozukluğu kriterlerine göre tanımlanmıştır (bkz. Bölüm 4.2). Şiddetli karaciğer yetmezliğinin (bilirubin > 3 x NÜS ve herhangi bir AST) atezolizumabın farmakokinetiği üzerindeki etkisi bilinmemektedir.
5.3. Klinik öncesi güvenlilik verileri
Karsinojenisite:TECENTRIQ'in karsinojenik potansiyelini belirlemek için karsinojenisite çalışması yapılmamıştır.
Mutajenisite:
TECENTRIQ'in mutajenik potansiyelini belirlemek için mutajenisite çalışması yapılmamıştır. Bununla birlikte, monoklonal antikorların DNA veya kromozomları değiştirmesi beklenmemektedir.
Fertilite:
TECENTRIQ ile herhangi bir fertilite çalışması yapılmamıştır. Bununla birlikte, kronik toksisite çalışmasına sinomolgus maymunlarında erkek ve dişi üreme organlarının değerlendirilmesi dahil edilmiştir. Atezolizumabın dişi maymunlara tahmini EAA'da uygulanması (önerilen dozu alan hastalardaki EAA'nın yaklaşık 6 katı), geri dönüşümlü olarak düzensiz adet döngüsü paternine ve yumurtalıklarda yeni oluşturulmuş korpus lutea eksikliğine neden olmuştur. Erkek üreme organları üzerinde herhangi bir etki olmamıştır.
Teratojenisite:
TECENTRIQ ile hayvanlarda üreme veya teratojenisite çalışmaları yapılmamıştır. Hayvan çalışmaları, PD-L1/PD-1 yolağının inhibisyonunun büyümekte olan fetüsün reddi riskinde immünite ile ilişkili artışa ve böylelikle fetal ölüme yol açabileceğini ortaya koymuştur. TECENTRIQ uygulamasının gebelik üzerinde advers bir reaksiyona yol açması beklenir ve embriyo-fetal letalitesi de dahil olmak üzere insan fetüsü için bir risk oluşturur.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
L-histidin
Glasiyal asetik asit Sükroz
Polisorbat 20 Enjeksiyonluk su
6.2. Geçimsizlikler
6.2. Geçimsizlikler
6.3. Raf ömrü
Açılmamış flakon: 36 ay
Seyreltilmiş çözelti: Hazırlama zamanından sonra ortam sıcaklığında (≤30°C) 24 saat ve 2- 8°C'de 30 güne kadar kullanımdaki kimyasal ve fiziksel stabilite gösterilmiştir.
Mikrobiyolojik açıdan, hazırlanan infüzyonluk çözelti hemen kullanılmalıdır. Hemen kullanılmazsa, kullanım sırasındaki saklama süreleri ve kullanım öncesi koşullar kullanıcının sorumluluğundadır ve normalde, seyreltme kontrollü ve valide aseptik koşullarda yapılmadığı sürece, 2-8°C'de 24 saatten fazla veya ortam sıcaklığında (≤25°C) 8 saatten fazla olmamalıdır.
6.4. Saklamaya yönelik özel tedbirler
Buzdolabında saklayınız (2°C-8°C).
Işıktan korumak için flakonu karton kutusunda saklayınız. Dondurmayınız. Çalkalamayınız.
Tıbbi ürünün seyreltme sonrasında saklama koşulları için bkz. Bölüm 6.3.
6.5. Ambalajın niteliği ve içeriği
20 mL infüzyonluk konsantre çözelti içeren tapalı (butil kauçuk) flakon (Tip I cam). Bir flakonluk paket.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
TECENTRIQ herhangi bir antimikrobiyal koruyucu veya bakteriyostatik ajan içermemektedir ve hazırlanan çözeltinin steril olmasını sağlamak için bir sağlık mesleği mensubu tarafından aseptik teknik ile hazırlanmalıdır.
Aseptik hazırlama, taşıma ve saklama
İnfüzyonun hazırlanması sırasında aseptik temas sağlanmalıdır. Hazırlama işlemi:
Eğitilmiş personel tarafından aseptik koşullar altında, özellikle de parenteral ürünlerin aseptik hazırlanmasına ilişkin iyi uygulama kuralları doğrultusunda yapılmalıdır.
İntravenöz ajanların güvenli teması için standart önlemleri kullanarak laminer hava akımı veya biyolojik güvenlik kabininde hazırlanmalıdır.
Aseptik koşulların idamesini sağlamak için hazırlanan intravenöz infüzyon çözeltisine uygun saklama işlemi ile devam etmelidir.
Çalkalamayınız.
Seyreltme talimatları:
20 mL TECENTRIQ konsantresi flakondan çekilmeli ve içinde sodyum klorür 9 mg/mL (% 0,9) enjeksiyonluk çözelti bulunan bir PVC, polietilen (PE) veya poliolefin infüzyon torbası içine seyreltilmelidir. Seyreltmeden sonra çözeltinin final konsantrasyonu 3,2 ila 16,8 mg/mL olmalıdır.
Torba, köpük oluşumuna izin vermeden çözeltiyi karıştırmak için yavaşça alt üst edilmelidir. İnfüzyon hazırlandığında hemen uygulanmalıdır (bkz. Bölüm 6.3).
Parenteral tıbbi ürünler uygulanmadan önce partiküller ve renk değişimi açısından çıplak gözle
incelenmelidir. Partiküller veya renk değişimi gözlenirse çözelti kullanılmamalıdır.
TECENTRIQ ile ürüne temas eden polivinil klorür (PVC), polietilen (PE) veya poliolefin (PO) yüzeyleri olan intravenöz torbalar arasında geçimsizlik gözlenmemiştir. İlave olarak, polietersülfon veya polisülfon içeren düz eksenli filtre membranları ve infüzyon setleri ile PVC, PE, polibutadien veya polieterüretan içeren diğer infüzyon yardımcıları ile de geçimsizlik gözlenmemiştir. Düz eksenli filtre membranlarının kullanılması seçime bağlıdır.
Diğer ilaçları aynı infüzyon hattında birlikte uygulamayınız.
Kullanılmamış/son kullanma tarihi geçmiş ilaçların imhası:
Tıbbi ürünlerinin çevreye salınması en aza indirilmelidir. İlaçlar, atık suyla birlikte atılmamalıdır ve evsel atıklarla imhasından kaçınılmalıdır.
Kullanılmamış olan ürünler ya da atık materyaller, âTıbbi Atıkların Kontrolü Yönetmeliği'' ve âAmbalaj Atıklarının Kontrolü Yönetmeliğiâne uygun olarak imha edilmelidir.
 Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış.
Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
 Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir.
Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
 |
Asperger Sendromu Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde, gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |
 |
Doğum Sonrası Depresyonu Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından tecrübe edilen stresli bir durumdur. |
 |
Tiroid Kanseri En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur. |
İLAÇ GENEL BİLGİLERİ
Roche Müstahzarları Sanayi A.Ş.
| Satış Fiyatı | 65712.83 TL [ 26 Apr 2024 ] |
| Önceki Satış Fiyatı | 65712.83 TL [ 22 Apr 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699505763460 |
| Etkin Madde | Atezolizumab |
| ATC Kodu | L01XC32 |
| Birim Miktar | 1200/20 |
| Birim Cinsi | MG/ML |
| Ambalaj Miktarı | 1 |
| Antineoplastik ve İmmünomodülatör Ajanlar > Diğer Kanser İlaçları |
| İthal ( ref. ülke : Isvicre ) ve Beşeri bir ilaçdır. |