SYNFLORIX 0.5 ml enj. için sus.içeren kul.hazır enjektör Kısa Ürün Bilgisi
{ Streptokokus Pnomoni Polisakkaritleri Serotip 1 + Streptococcus Pneumoniae Polisakkaridi Serotip 4 }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
SYNFLORIX 0,5 mL IM enjeksiyon için süspansiyon içeren kullanıma hazır enjektör Pnömokokal polisakkarit konjuge aşısı (adsorbe)
Steril
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her bir 0,5 mL doz:Pnömokokal polisakkarit serotip 11,21 mikrogram
Pnömokokal polisakkarit serotip 41,23 mikrogram
Pnömokokal polisakkarit serotip 51,21 mikrogram
Pnömokokal polisakkarit serotip 6B1,21 mikrogram
Pnömokokal polisakkarit serotip 7F1,21 mikrogram
Pnömokokal polisakkarit serotip 9V1,21 mikrogram
Pnömokokal polisakkarit serotip 141,21 mikrogram
Pnömokokal polisakkarit serotip 18C1,33 mikrogram
Pnömokokal polisakkarit serotip 19F1,43 mikrogram
Pnömokokal polisakkarit serotip 23F1,21 mikrogram
1 aluminyum fosfata adsorbe edilmiş toplam 0,5 mg Al+3
2 protein D taşıyıcı proteinine (tiplendirilemeyen Haemophilus influenzae'dan
elde edilen) konjuge edilmiş..................................................................... 9-16 mikrogram
3 tetanoz toksoidi taşıyıcı proteinine konjuge edilmiş................................. 5-10 mikrogram
4 difteri toksoidi taşıyıcı proteinine konjuge edilmiş................................... 3-6 mikrogram
Yardımcı maddeler
SYNFLORIX 0.5 mL'lik tek dozunda 1 mmol´den (23 mg) daha az sodyum ihtiva eder. Diğer yardımcı maddeler için Bölüm 6.1'e bakınız.
3. FARMASÖTİK FORMU
Enjeksiyonluk süspansiyon.
Aşı bulanık, beyaz renkli bir süspansiyondur.
İğne kılıfını çıkarınız, kılıf bazen sert şekilde kapalı olabilir.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
6 hafta ile 5 yaş arası bebek ve çocuklarda Streptococcus pneumoniae'nin neden olduğu invazif hastalık, pnömoni ve akut orta kulak iltihabına karşı aktif bağışıklama için endikedir. Spesifik pnömokok serotiplerine karşı sağlanan korumaya dair bilgi bölüm 4.4 ve 5.1'de bulunmaktadır.
SYNFLORIX farklı coğrafi bölgelerdeki epidemiyolojik değişkenliklerin yanısıra farklı yaş gruplarındaki pnömokokal hastalıkların etkisini dikkate alan resmi sağlık önerilerine dayanarak kullanılmalıdır.
4.2. Pozoloji ve uygulama şekli
Pozoloji / Uygulama sıklığı ve süresi
SYNFLORIX kullanımı bağışıklık takvimi resmi sağlık önerilerine dayandırılmalıdır.
Daha önce bir doz SYNFLORIX ile aşılanan kişilerin aşılama programını SYNFLORIX ile
tamamlaması önerilir.
6 hafta ile 6 aylık arası bebeklerde
Üç dozluk primer seri
Optimal korumayı sağlamak için önerilen bağışıklama serileri her biri 0,5 mL'den oluşan 4 doz içerir. Primer infant serisi; ilk dozun genellikle 2. ayda uygulandığı ve dozlar arasında en az 1 ay ara olan üç doz içerir. İlk doz 6 haftalıkken verilebilir. Rapel (dördüncü) doz, son primer dozun en az 6 ay sonrasında, önerilir ve 9 aylıktan itibaren (tercihen 12. ve 15. aylar arasında) verilebilir (bkz. bölüm Özel kullanım uyarıları ve önlemleri ve bölüm Farmakodinamik özellikler).
İki dozluk primer seri
Alternatif olarak, SYNFLORIX rutin infant bağışıklama programının parçası olarak verildiğinde, her biri 0,5 mL'den oluşan 3 dozluk bir seri halinde verilebilir. İlk doz 6 haftalıktan itibaren, ikinci doz ise ilk dozdan 2 ay sonra uygulanabilir. Rapel (üçüncü) doz, son primer dozun en az 6 ay sonrasında önerilir ve 9 aylıktan itibaren (tercihen 12. ve 15. aylar arasında) verilebilir.(bkz. bölüm Farmakodinamik özellikler).
Gebeliğin 27-36. haftasında (preterm) doğan bebekler
Gebeliğin en az 27. haftasından sonra doğan preterm bebeklerde önerilen bağışıklama serisi, her biri 0,5 mL olan dört dozdan oluşmaktadır. Primer infant serisi, ilk dozu 2 aylıkken verilen ve dozlar arasında en az 1 aylık ara bulunan üç dozdan oluşmaktadır. Son primer dozdan en az 6 ay sonra rapel (dördüncü) doz uygulanması önerilmektedir (bkz. bölüm Özel kullanım uyarıları ve önlemleri ve bölüm Farmakodinamik özellikler).
Daha önce aşılanmamış olan 7 ay ve üzeri bebekler ve çocuklar
7-11 aylık bebekler: Aşılama takvimi, dozlar arasında en az 1 ay olmak kaydıyla 0,5 mL'lik 2 primer dozu kapsamaktadır. Rapel (üçüncü) dozun yaşamın 2. yılında, son dozdan en az 2 ay sonra olmak kaydıyla uygulanması önerilir.
4.3. Kontrendikasyonlar
Etkin madde
Her bir 0,5 mL doz:
Diğer aşılarda olduğu gibi, akut şiddetli ateşli hastalığı olanlarda SYNFLORIX uygulaması ertelenmelidir. Ancak, soğuk algınlığı gibi hafif bir enfeksiyon varlığı, aşılamanın ertelenmesine sebep olmamalıdır.
4.4. Özel kullanım uyarıları ve önlemleri
Bağışıklama Öncesi
İyi klinik uygulamalar yaklaşımı gereğince, özellikle daha önceki bağışıklama ve istenmeyen olayların ortaya çıkma ihtimali ile ilişkili olarak, bağışıklama öncesi bebeğin/çocuğun tıbbi özgeçmişi gözden geçirilmeli ve fiziki muayene yapılmalıdır.
Enjekte edilen tüm aşılarda olduğu gibi aşının uygulanmasının ardından nadiren görülen bir anafilaktik durum ortaya çıkması ihtimaline karşı gereken tıbbi önlemler her zaman alınmış olmalıdır.
Çok prematüre bebekler (gebeliğin 28. haftasında ve daha önce doğanlar) ve özellikle solunum sistemi gelişimi eksikliği hikayesi olanlarda primer bağışıklama serilerinin uygulanmasında potansiyel apne riskine karşı 48-72 saat respiratuvar izlem gerekmektedir. Bu grup yenidoğanlarda aşılamanın yararı yüksek olduğundan, aşılama alıkonmamalı ve ertelenmemelidir.
SYNFLORIX hiçbir koşulda intravasküler ya da intradermal uygulanamaz. SYNFLORIX'in subkütan uygulanmasına dair herhangi bir veri mevcut değildir.
2 yaşından itibaren çocuklarda herhangi bir aşılama sonrasında veya hatta öncesinde iğne ile enjeksiyona psikojenik bir yanıt olarak senkop (bayılma) görülebilir. Bayılmalara bağlı yaralanmaları önlemek için gerekli prosedürlerin hazır olması önemlidir.
Diğer intramusküler aşılarda olduğu gibi, trombositopeni veya herhangi bir koagülasyon bozukluğu olan hastalara SYNFLORIX uygulanmasında çok dikkatli olunmalıdır, çünkü bu kişilerde intramusküler uygulamayı takiben kanama gözlenebilir.
Aşının Sağladığı Korumaya İlişkin Bilgiler
Difteri, tetanoz ve Haemophilus influenzae tip b'ye karşı bağışıklama için de resmi tavsiyeler izlenmelidir.
SYNFLORIX'in, aşının içeriğinde bulunmayan çapraz-reaktif 19A serotipi haricindeki diğer pnömokok serotiplerine karşı (bkz. bölüm Farmakodinamik özellikler) veya tiplendirilemeyen Haemophilus influenzae´ya karşı koruma sağladığına dair yeterli kanıt bulunmamaktadır. SYNFLORIX diğer mikroorganizmalara karşı koruma sağlamaz.
Herhangi bir aşıda olduğu gibi, SYNFLORIX de aşılanan bütün bireyleri, aşının içeriğinde bulunan serotiplerin ve çapraz-reaktif 19A serotipinin neden olduğu invazif pnömokok hastalığına, pnömoniye ve otitis media´ya karşı korumayabilir. Bununla birlikte, aşıda bulunan Streptococcus pneumonia serotipleri haricinde birçok mikroorganizmanın da otitis media ve pnömoniye neden olmasından dolayı bu hastalıklara karşı sağlanan korumanın sınırlı ve aşının içeriğinde bulunan serotipler ve çapraz-reaktif 19A serotipinin neden olduğu invazif hastalığa karşı sağlanan korumadan belirgin ölçüde daha düşük olması beklenmektedir (bkz. bölüm Farmakodinamik özellikler).
Klinik çalışmalarda SYNFLORIX aşıda bulunan tüm 10 serotipe karşı immun yanıt sağlanmıştır, fakat yanıtların büyüklükleri serotipler arasında değişmektedir. Serotipler 1 ve 5'e karşı fonksiyonel immun yanıt büyüklüğü tüm diğer aşı serotiplerine göre daha düşüktür. Serotipler 1 ve 5'e karşı bu daha düşük fonksiyonel immun yanıtın bu serotiplerin neden olduğu invazif hastalık, pnömoni veya otitis media'ya karşı daha düşük etkinlikle sonuçlanıp sonuçlanmayacağı bilinmemektedir (bkz. bölüm Farmakodinamik özellikler).
Aşılama serilerinde, çocukların yaşlarına uygun olan SYNFLORIX doz rejimi uygulanmalıdır (bkz. bölüm 4.2 Pozoloji ve uygulama şekli).
İmmünosüpresif Tedavi ve İmmün Yetmezlik
Çocuklarda immunosupresif tedavi kullanımı, genetik bozukluk, HIV enfeksiyonu, doğum öncesi anti-retroviral tedavi ve/veya HIV maruziyeti veya diğer sebeplerle bağışıklık cevabı yetersizliği, aşılamaya karşı antikor yanıtını zayıflatabilir.
HIV enfeksiyonlu bebekler (DSÖ sınıflandırmasına göre asemptomatik veya hafif semptomları olan), HIV pozitif annelerden doğan HIV negatif bebekler, orak hücre hastalığı olan çocuklar ve dalak disfonksiyonu olan çocuklar için güvenlilik ve immünojenite verileri mevcuttur (bkz. bölüm İstenmeyen etkiler ve Farmakodinamik özellikler). Diğer spesifik immün yetmezliği olan gruplarda yer alan kişiler için SYNFLORIX'e ilişkin güvenlilik ve immünojenite verileri mevcut değildir ve aşılama bireysel bazda değerlendirilmelidir (bkz. bölüm 4.2 Pozoloji ve uygulama şekli).
Konjuge pnömokok aşısı kullanımı Streptococcus pneumoniae kaynaklı invazif hastalık açısından yüksek riske yol açan rahatsızlıkların (orak hücreli anemi, aspleni, HIV enfeksiyonu, kronik hastalık veya immün sistemin baskılandığı durumlar) görüldüğü 2 yaş ve üzeri çocuklarda 23-valanlı polisakkarit pnömokok aşısı kullanımının yerini tutmayabilir. Önerildiğinde, risk altında olan ve SYNFLORIX ile primer aşılamaları yapılmış 24 ay ve üzeri çocuklarda 23-valanlı polisakkarit pnömokok aşısı uygulanmalıdır. Konjuge pnömokok aşısı (SYNFLORIX) ve 23-valanlı polisakkarit pnömokok aşısı arasındaki süre en az 8 hafta olmalıdır. SYNFLORIX ile primer aşılaması yapılmış çocuklara polisakkarit pnömokok aşısı uygulamasının polisakkarit pnömokok ya da konjuge pnömokok aşısından ilave dozlara yetersiz duyarlılığa neden olup olmayacağını gösteren veriler mevcut değildir.
Antipiretiklerin Profilaktik Kullanımı
Aşılamadan önce veya aşılamadan hemen sonra profilaktik amaçla antipiretik uygulanması, aşılama sonrası febril reaksiyonların şiddetini ve insidansını azaltır. Profilaktik amaçla antipiretik uygulanması, ateş şikayetinde azalmaya neden olmakla birlikte febril konvülziyon gibi ateş ile ilişkili şikayetlerin önlenmesinde etkili değildir. Parasetamol ve ibuprofen ile elde edilen klinik veriler profilaktik parasetamol kullanımının ateş oranını azaltırken, profilaktik ibuprofen kullanımının ateş oranını azaltmada kısıtlı etki gösterdiğini düşündürmektedir. Klinik verilere göre, profilaktik parasetamol kullanımı SYNFLORIX'e karşı bağışıklık cevabını azaltabilmektedir. Ancak bu gözlemin klinik olarak anlamlılığı bilinmemektedir.
Aşağıdaki durumlarda profilaktik antipiretik (ateş düşürücü) tıbbi ürünlerin kullanımı önerilmektedir:
Tam hücreli boğmaca içeren aşılarla SYNFLORIX´in aynı anda uygulandığı çocuklarda febril reaksiyonların daha yüksek oranlarda görülmesinden dolayı (bkz. bölüm İstenmeyen etkiler).
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Diğer aşılarla birlikte kullanım
SYNFLORIX monovalan aşılardan hepatit B aşısı (HBV), inaktif çocuk felci aşısı (IPV), Haemophilus influenzae tip b aşı (Hib), suçiçeği aşısı (V), meningokokal serogrup C konjuge aşısı (CRMve TT konjugatları), meningokokal serogrup A, C, W-135 ve Y konjuge aşısı (TT konjugat), oral çocuk felci aşısı (OPV) ve oral rotavirüs aşısı ile kombinasyon aşılarından DTPa-HBV-IPV/Hib ve DTPw-HBV/Hib dahil difteri-tetanoz-aselüler pertussis aşısı (DTPa), difteri-tetanoz-tam hücreli boğmaca aşısı (DTPw), kızamık-kabakulak-kızamıkçık aşısı (MMR) ile aynı anda uygulanabilir. Farklı enjekte edilebilir aşılar daima farklı enjeksiyon bölgelerine uygulanmalıdır.
Klinik çalışmalara göre aynı anda uygulanan aşıların bağışıklık cevapları ve güvenlilik profilleri etkilenmemiştir, sadece inaktif poliovirüs tip 2 cevabı için çalışmalar arasında tutarsız sonuçlar (%78 ila %100 aralığında seroprotektif etki) gözlenmiştir. Buna ek olarak, meningokokal serogruplar A, C, W-135 ve Y aşısı (TT konjugat), önceden 3 doz SYNFLORIX ile aşılanmış çocuklarda ikinci yaşta bir rapel SYNFLORIX dozu ile eş zamanlı uygulandığında; pnömokokal serotip (18 C) için daha düşük antikor geometrik ortalama konsantrasyonu (GMC) ve opsonofagositik tayin geometrik ortalama titresi (OPA GMT) gözlenmiştir. Eş zamanlı uygulamanın diğer dokuz pnömokokal serotip üzerinde bir etkisi yoktur. Hib-TT konjugat, difteri ve tetanoz antijenlerine karşı antikor cevabında artış gözlenmiştir. Bu gözlemlerin klinik anlamlılığı bilinmemektedir.
Sistemik immunosupresif ilaçlar ile birlikte kullanım:
Diğer aşılarda olduğu gibi, immunosupresif tedavi alan hastalarda yeterli cevap elde edilemeyebilir.
Profilaktik antipiretik uygulaması ile birlikte kullanım:
Klinik veriler, aşılama sonrası olası febril reaksiyon oranını azaltmak için profilaktik parasetamol uygulamasının SYNFLORIX'e karşı bağışıklık yanıtını azaltabileceğini göstermektedir. Ancak, ilgili gözlemin klinik anlamı bilinmemektedir (bkz. bölüm Özel kullanım uyarıları ve önlemleri).
Diğer tıbbi ürünler ile birlikte kullanım:
Yukarıda belirtilen diğer aşılarla birlikte kullanımı haricinde diğer tıbbi ürünler ile etkileşimi konusunda ayrıca bir çalışma bulunmamaktadır.
Özel popülasyonlara ilişkin ek bilgiler:
Özel popülasyona ilişkin ayrı bir etkileşim çalışması yapılmamış olup, bölüm 4.5'te belirtilen bilgiler geçerlidir.
Pediyatrik Popülasyon:
SYNFLORIX'in pediatrik popülasyonda diğer aşılarla birlikte uygulanması ve HIV+ çocuklarda (10Pn-PD-DIT-034) ve OHH'li çocuklarda (10Pn-PD-DIT-064) uygulanması klinik çalışmalarla değerlendirilmiştir. Bu veriler, sağlıklı çocuklardan elde edilen birlikte kullanım verileriyle birlikte bölüm 4.5 âde verilmektedir.
4.6. Gebelik ve laktasyon
Gebelik kategorisi: B
SYNFLORIX'in yetişkinlerde kullanımı hedeflenmemiştir. İnsanlarda gebelik ve emzirme sırasında kullanımına ve hayvan üreme çalışmalarına ilişkin veri yoktur.
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Çocuklarda kullanılması nedeniyle geçerli değildir.
Gebelik dönemi
Çocuklarda kullanılması nedeniyle geçerli değildir.
Laktasyon dönemi
Çocuklarda kullanılması nedeniyle geçerli değildir.
Üreme yeteneği / Fertilite
Hayvan üreme çalışmalarına ilişkin veriler yeterli değildir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
Çocuklarda kullanılması nedeniyle geçerli değildir.
4.8. İstenmeyen etkiler
SYNFLORIX'in güvenlilik değerlendirmesinin dayandığı klinik çalışmalarda 63.905 doz
SYNFLORIX 22.429 sağlıklı bebekte ve 137 preterm infantta primer aşılamada uygulanmıştır.
19.466 çocuğa ve 116 preterm infanta yaşamlarının 2. yılı içinde rapel SYNFLORIX dozu uygulanmıştır. Ayrıca, daha önce aşılanmamış 2-5 yaş arası 435 çocukta (285 kişiye 2 doz SYNFLORIX uygulanmıştır) güvenlilik değerlendirilmiştir. Tüm çalışmalarda, SYNFLORIX önerilen çocukluk aşılarıyla aynı anda uygulanmıştır.
Bebeklerde, primer aşılamadan sonra en sık gözlenen advers reaksiyonlar tüm dozların % 41'i ve % 55'inde sırasıyla enjeksiyon bölgesinde kızarıklık ve iritabilitedir. Rapel aşılamayı takiben en sık gözlenen advers reaksiyonlar enjeksiyon bölgesinde ağrı ve iritabilitedir ve bu advers reaksiyonlar sırasıyla yaklaşık olarak % 51 ve % 53 oranında görülmüştür. Bu reaksiyonların çoğu hafif ile orta şiddettedir ve etkileri uzun sürmez.
Primer aşılama takviminin sonraki dozlarında advers reaksiyon insidansı ve şiddetinde bir artış gözlenmemiştir.
Primer aşılama serisini takiben 12 aydan küçük infantlar ve 12 aydan büyük çocuklarda, enjeksiyon bölgesinde ağrı dışında lokal reaktojenisite benzerdir. Enjeksiyon bölgesinde ağrı
insidansı yaşla birlikte artmıştır: 12 aydan küçük infantların % 39'undan fazlasında, 12 aydan büyük çocukların %58'inden fazlasında ağrı olduğu bildirilmiştir.
Rapel aşılama sonrasında 12 aydan büyük çocuklarda enjeksiyon yeri reaksiyonları yaşama olasılığı, SYNFLORIX ile primer aşılama sırasında bebeklerde gözlenen oranlar ile karşılaştırıldığında daha yüksektir.
12 ila 23 aylık çocuklarda yakalama (catch-up) dozundan sonra, primer ve rapel aşılama sırasında bebeklerde gözlenen oranlar ile karşılaştırıldığında ürtiker daha sık bildirilmiştir (yaygın olmayan sıklık).
Eş zamanlı olarak tam hücreli boğmaca aşısı uygulanan çocuklarda reaktojenite daha yüksektir. Bir klinik çalışmada çocuklara DTPw içeren aşıyla eş zamanlı olarak, SYNFLORIX (N=603) veya 7-valanlı aşı (N=203) uygulanmıştır. İlk aşılama turundan sonra, SYNFLORIX uygulanan çocuklarda ≥38°C ve >39°C ateşi olanların oranı sırasıyla %86,1 ve %14,7 iken aynı oranlar 7- valan içeren aşı uygulananlarda yine sırasıyla %82,9 ve %11,6 olarak bildirilmiştir.
Karşılaştırmalı klinik çalışmalarda, her bir aşılamadan sonraki 4 gün içinde bildirilen lokal ve genel advers olayların insidansı, 7-valan içeren aşı ile aşılama sonrası görülenlerle aynı aralıktadır.
Tüm yaş grupları için aşılamadan kaynaklanabilecek olan advers reaksiyonlar (primer immünizasyon veya rapel doz sonrasında) görülme sıklığı açısından aşağıdaki şekilde sınıflandırılmıştır.
Sıklıkları aşağıdaki şekilde rapor edilmiştir :
Çok yaygın (⥠1/10); yaygın (⥠1/100 < 1/10); yaygın olmayan (⥠1/1.000 < 1/100); seyrek (⥠1/10.000 < 1/1.000); çok seyrek (≤ 1/10.000), izole bildirimler dahil
Bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor)
Her sıklık grubunda, istenmeyen etkiler ciddiyetin azalmasına göre sunulmuştur.
Klinik çalışma verileri
Bağışıklık sistemi hastalıkları
Seyrek: Alerjik reaksiyonlar (alerjik dermatit, atopik dermatit, egzema gibi) Çok seyrek: Anjiyoödem
Metabolizma ve beslenme hastalıkları
Çok yaygın: İştah kaybı
Psikiyatrik hastalıklar
Çok yaygın: İritabilite
Yaygın olmayan: Anormal ağlama
Sinir sistemi hastalıkları
Çok yaygın: Uykululuk hali (sersemlik)
Seyrek: Konvülsiyonlar (febril konvülsiyonlar dahil)
Vasküler hastalıklar
Çok seyrek: Kawasaki hastalığı
Solunum, göğüs bozuklukları ve mediastinal hastalıklar
Yaygın olmayan: Prematüre infantlarda apne (Gebeliğin 28. Haftasında ve daha önce doğan) (bkz. bölüm Özel kullanım uyarıları ve önlemleri)
Gastrointestinal hastalıklar
Yaygın olmayan: İshal, kusma
Deri ve derialtı doku hastalıkları
Yaygın olmayan: Döküntü Seyrek: Ürtiker
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Çok yaygın: Ağrı, kızarıklık, enjeksiyon bölgesinde şişme, ateş ï³38°C rektal (2 yaşından küçüklerde)
Yaygın: Enjeksiyon bölgesinde sertleşme gibi enjeksiyon bölgesi reaksiyonları, ateş >39°C rektal (2 yaşından küçüklerde)
Yaygın olmayan: Enjeksiyon bölgesinde hematom, hemoraji ve nodül gibi enjeksiyon bölgesi reaksiyonları
Ek olarak primer serilerin rapel doz uygulaması ve/veya yakalama dozu uygulamasının ardından aşağıdaki istenmeyen reaksiyonlar rapor edilmiştir.
Sinir sistemi hastalıkları
Yaygın olmayan: Baş ağrısı (2 â 5 yaş arası)
Gastrointestinal hastalıklar
Yaygın olmayan: Bulantı (2 â 5 yaş arası)
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Yaygın: Ateş ï³38°C rektal (2-5 yaş arası)
Yaygın olmayan: Prurit gibi enjeksiyon bölgesi reaksiyonları, ateş >40°C rektal (2 yaşından küçüklerde), ateş >39°C rektal (2-5 yaş arası), enjeksiyon yapılan uzvun, bazı durumlarda yandaki eklem de dahil olacak şekilde yaygın olarak şişmesi
Pazarlama sonrası veriler Bağışıklık sistemi hastalıkları Çok seyrek: Anafilaksi
Sinir sistemi hastalıkları
Seyrek: Hipotonik-hiporesponsif episod
Özel popülasyonlar
SYNFLORIX'in güvenliliği, primer aşılama yapılan 83 HIV pozitif (HIV+/+) bebek (DSÖ sınıflandırmasına göre asemptomatik veya hafif semptomları olan), HIV pozitif annelerden doğmuş 101 HIV negatif bebek (HIV+/-) ve orak hücre hastalığı (SCD) olan 50 bebekte değerlendirilmiştir. Bunlardan sırasıyla 76, 96 ve 49 bebek bir rapel doz almıştır. SYNFLORIX'in güvenliliği aynı zamanda aşılamanın 7-11 aylıkken başlatıldığı, tümüne rapel aşı uygulanmış SCD'li 50 çocukta ve aşılamanın 12-23 aylıkken başlatıldığı SCD'li 50 çocukta değerlendirilmiştir. Bulgular bu yüksek riskli gruplar ve sağlıklı çocuklar arasında SYNFLORIX için benzer reaktojenisite ve güvenlilik profiline işaret etmektedir.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)âne bildirmeleri gerekmektedir. (www.titck.gov.tr; e-posta: tufam@titck.gov.tr; tel: 0800 314 00 08; faks: 0312 218 35 99)
4.9. Doz aşımı ve tedavisi
Doz aşımı vakası bildirilmemiştir.
âİmmünojenisite verileri
âİmmünolojik açıdan 7-valanlı PCV aşısına göre aşağı olmayan etkililik (non-inferiority) Dünya Sağlık Örgütü (DSÖ) tarafından önerildiği üzere, invazif pnömokokal hastalığa karşı potansiyel etkililik değerlendirmesi SYNFLORIX ve daha önce koruyucu etkililiği değerlendirilmiş olan diğer pnömokok konjuge aşısı (7-valan içeren konjuge pnömokok aşısı) ile ortak bulunan yedi serotipe karşı immün yanıtların karşılaştırılmasına dayanır. SYNFLORIX içeriğinde bulunan ilave üç serotipe immün yanıt ayrıca değerlendirilmiştir.
Aşıyı uygulayınız.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Aşılar, Pnömokokal aşılar ATC kodu: J07AL52
âEpidemiyolojik veriler
Aşıda bulunan 10 pnömokkal serotip, 5 yaşın altındaki çocuklarda invazif pnömokokal hastalıklarda yaklaşık %56 ila %90'ını kapsayan Avrupa'daki major hastalık etkeni serotipleri temsil etmektedir. Bu yaş grubunda, 1, 5 ve 7F serotipleri incelenen ülkelere ve incelenen zaman aralıklarına göre invazif pnömokok hastalıklarının %3,3 ile %24,1´ini oluşturur.
Tüm dünyada farklı etiyolojilere bağlı pnömoni çocukluk morbiditesi ve mortalitesinin önde gelen sebeplerindendir. Prospektif çalışmalara dayanılarak Streptococcus pneumoniae'nin bakteriyel pnömoni vakalarının %30-50'sinden sorumlu olduğu tahmin edilmektedir.
Akut otitis media (AOM) farklı etiyolojilerle yaygın bir çocukluk hastalığıdır. AOM'nin klinik evrelerinin en az %60-70'inden bakterilerin sorumlu olduğuna inanılmaktadır. Streptococcus pneumoniae ve tiplendirilemeyen Haemophilus influenzae (NTHi) bütün dünyada bakteriyel akut otitis medianın en yaygın nedenleridir.
5.2. Farmakokinetik özellikler
Aşılar için farmakokinetik özelliklerin değerlendirilmesi gerekmemektedir.
5.3. Klinik öncesi güvenlilik verileri
Güvenlilik farmakolojisi, tek ve tekrarlanan doz toksisitesinin geleneksel çalışmalara dayanarak, SYNFLORIX için temsili 11-valan aşı formülasyonu ile çalışmalar göstermiştir ki insanlar için hiçbir özel risk/tehlike içermemektedir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Sodyum klorür
Enjeksiyonluk su
Adsorbanlar için, bölüm 2'ye bakınız.
6.2. Geçimsizlikler
Bu tıbbi ürüne ait geçimlilik çalışmaları olmadığından diğer tıbbi ürünlerle karıştırılarak kullanılmamalıdır.
6.3. Raf ömrü
48 aydır.
6.4. Saklamaya yönelik özel tedbirler
2 ºC - 8 ºC arası sıcaklıklarda (buzdolabında) saklayınız. Dondurmayınız. Donmuş ürünü çözüp kullanmayınız.
Ambalajında, ışıktan koruyarak saklayınız.
6.5. Ambalajın niteliği ve içeriği
Piston tıpası (kauçuk butil) olan, kullanıma hazır enjektör içinde (Tip I cam) 0,5 mL
süspansiyon bulunan, iğneli, tekli, ve 10'lu ambalajlar halinde sunulmaktadır. Tüm ambalajlar piyasaya sunulmayabilir.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Depolama sırasında kullanıma hazır şırınga içinde berrak renksiz süpernatant ile birlikte ince beyaz çökelti gözlenebilir. Bu durum bozulma belirtisi değildir.
Uygulama öncesi, şırınga içeriği çalkalanmadan önce ve çalkalandıktan sonra herhangi bir partikül oluşumu ve/veya anormal fiziksel görüntü yönünden görsel olarak kontrol edilmelidir. Partikül oluşumu ve/veya anormal fiziksel görüntü gözlendiğinde aşı imha edilmelidir.
Aşının kullanmadan önce oda sıcaklığına ulaşması beklenmelidir. Aşı kullanılmadan önce iyice çalkalanmalıdır.
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj Atıklarının Kontrolü Yönetmeliğiâne uygun olarak imha edilmelidir.
Kullanıma hazır enjektör içindeki aşının uygulanmasına yönelik talimatlar
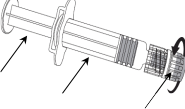
Enjektörün gövdesini bir elinizde tutup (pistonu tutmayınız) enjektör kapağını saat yönünün tersine çevirerek açınız.
Enjektör pistonu
Enjektör gövdesi
Enjektör Kapağı
 Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış.
Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
 Rahim Boyu ( Serviks ) Kanseri
Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden
sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir.
Rahim Boyu ( Serviks ) Kanseri
Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden
sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| SYNFLORIX | 8699522967155 | 1,399.63TL |
| VAXNEUVANCE | 8699636951590 | 2,213.28TL |
| Diğer Eşdeğer İlaçlar |
 |
Omurilik zedelenmeleri Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir. |
 |
Grip, Soğuk Algınlığı ve Öksürük Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |
 |
İnme İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına yol açar. |
İLAÇ GENEL BİLGİLERİ
Glaxo Smith Kline İlaçları San.Ve Tic.A.Ş
| Satış Fiyatı | 1399.63 TL [ 22 Apr 2024 ] |
| Önceki Satış Fiyatı | 1399.63 TL [ 15 Apr 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699522967155 |
| Etkin Madde | Streptokokus Pnomoni Polisakkaritleri Serotip 1 + Streptococcus Pneumoniae Polisakkaridi Serotip 4 |
| ATC Kodu | J07AL02 |
| Birim Miktar | 1+3 |
| Birim Cinsi | MCG |
| Ambalaj Miktarı | 1 |
| Enfeksiyona Karşı Kullanılan (Antienfektif) İlaçlar > Bakteriyel Aşılar > Konjuge Polisakkarit Aşılar |
| İthal ( ref. ülke : Belcika ) ve Beşeri bir ilaçdır. |