ROTARIX 1.5 ml oral süspansiyon içeren APLIKATOR Kısa Ürün Bilgisi
{ Canlı Zayıflatılmış Human Rotavirus Rix4414 Susu }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
ROTARIX 1,5 mL oral süspansiyon içeren tüp Rotavirüs aşısı, canlı
2. KALİTATİF VE KANTİTATİF BİLEŞİM
1 doz (1,5 mL) içeriği:
Etkin madde
İnsan rotavirus RIX4414 suşu (canlı zayıflatılmış)*. en az 10 CCID
*Vero hücrelerinde üretilmiştir.
Yardımcı maddeler
Sükroz 1,073 mg Sodyum 34 mg
Glikoz 10 µg
Fenilalanin 0,15 µg
Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
Oral süspansiyon
ROTARIX renksiz ve berrak sıvıdır.
Tüpü açmak üzere kapağı yerleştirin
Tüpü dik tutun.
Tüpü yanlarından tutun
Kapağın üst kısmının içinde, ortada küçük, sivri bir çıkıntı bulunmaktadır.
Kapağı başaşağı çevirin (180°).
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
ROTARIX, rotavirüs enfeksiyonu kaynaklı gastroenterit oluşumunu önlemek için 6-24 haftalık bebeklerin aktif bağışıklanmasında endikedir (bakınız bölüm 4.2, 4.4 ve 5.1).
ROTARIX kullanımı resmi tavsiyelere dayanmalıdır.
4.2. Pozoloji ve uygulama şekli
Pozoloji / uygulama sıklığı ve süresiAşılama programı 1,5 mL'lik iki dozdan oluşmaktadır.
İlk doz bebeklerde 6. haftadan itibaren uygulanabilir. İki doz arasında en az 4 hafta ara verilmelidir. Aşılama tercihen 16. haftadan önce yapılmalı , ancak 24. haftaya kadar mutlaka tamamlanmış olmalıdır.
ROTARIX, 27. gebelik haftasından itibaren olmak üzere preterm bebeklere aynı pozoloji ile uygulanır.
Klinik çalışmalarda, aşının nadiren tükürüldüğü ya da kusarak çıkarıldığı gözlenmiştir. Bu tür durumlarda, yerine yeni bir doz uygulanmamıştır. Fakat, eğer bebeğin aşı dozunun çoğunu tükürmesi ya da kusması gibi bir istenmeyen durum olursa, aynı aşı ziyaretinde tek doz yerine koyma (ikame) uygulamasıyapılabilir.
ROTARIX'in ilk dozunu alan bebeklerde, 2 doz aşılama programını ROTARIX ile tamamlanması önerilmektedir. İlk doz için ROTARIX uygulandıktan sonra ikinci doz için başka bir rotavirüs aşısının uygulanması veya tam tersi durum ile ilgili güvenlilik, immünojenisite veya etkililik verisi bulunmamaktadır.
Uygulama şekli:
ROTARIX sadece oral yolla kullanılır.
ROTARIX hiçbir koşulda enjekte edilmemelidir.
Bu tıbbi ürünün uygulanması ile ilgili talimatlar için bkz. bölüm 6.6.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek/Karaciğer yetmezliği:
Veri yoktur.
Pediyatrik popülasyon:
ROTARIX 6-24 haftalık bebeklerde kullanılabilir. Bunun dışında kullanılmamalıdır.
Geriyatrik popülasyon:
Yalnızca çocuklarda kullanılması gerektiğinden geçerli değildir.
4.3. Kontrendikasyonlar
ıEtkin madde
Daha önceden intususepsiyon hikayesi olanlar
İntususepsiyona eğilim oluşturabilecek gastrointestinal sistem konjenital malformasyonu olan tedavi edilmemiş kişiler (Örn: Meckel divertikülü)
Ciddi Kombine İmmün Yetmezlik (SCID) bozukluğu olanlar (bkz bölüm 4.8)
Akut ateşli hastalığı olanlarda ROTARIX uygulaması ertelenmelidir. Minör bir enfeksiyon bulunması, bağışıklama için bir kontrendikasyon değildir.
İshal veya kusma şikayeti olan kişilerde ROTARIX uygulaması ertelenmelidir.
4.4. Özel kullanım uyarıları ve önlemleri
Aşılama öncesi klinik muayene ve özellikle kontrendikasyonlara ilişkin tıbbi hikaye alınması gerekmektedir.
Gastrointestinal hastalığı veya büyüme geriliği olan bebeklede ROTARIX'in etkililiği ve güvenliliğine dair veri mevcut değildir. Bu durumda olan bebeklerde aşının uygulanmaması daha büyük bir riske neden olacak ise doktor onayı ile dikkatli bir şekilde ROTARIX uygulanmalıdır.
Oral canlı rotavirüs aşı uygulamasını takiben özellikle ilk 10 gün içerisinde intususepsiyon (bağırsağın bir bölümününtıkanmasıveyadüğümolması)görülebilmektedir. Bu nedenle
bebeklerde aşı uygulaması sonrası özellikle ilk 10 gün içerisinde karında şişlik, şiddetli karın ağrısı, uzun süreli kusma, dışkı yapamama, kanlı dışkı yapma, yüksek ateş gibi durumların oluşması halinde derhal doktora başvurulmalıdır.
İntususepsiyon eğilimi olan kişiler için kontrendikasyonlara bakınız.
Asemptomatik ve hafif derecede semptomatik HIV enfeksiyonunun ROTARIX'in etkililik veya güvenliliğini etkilemesi beklenmemektedir. Sınırlı sayıda asemptomatik ve hafif derecede semptomatik HIV pozitif bebekte yapılan bir klinik çalışma belirli bir güvenlilik problemi olmadığını göstermektedir. (bkz. bölüm 4.8).
ROTARIX aşısı, bir immünosupresif tedaviye in utero maruziyet de dahil olmak üzere bilinen veya şüpheli immün yetmezliği olan bebeklerde olası risk ve yararları dikkate alınarak uygulanmalıdır.
Aşı virüsünün dışkı ile atılması sürecinde, maksimum itrah aşılamadan sonra 7. gün civarında gözlenir. ELISA ile dışkıda saptanan viral antijen partikülleri ROTARIX liyofilize formülasyonunun ilk dozundan sonra %50, ikinci dozdan sonra %4 bulunmuştur. Bu dışkılar canlı aşı suşu varlığı için test edildiğinde, sadece %17 pozitif sonuç elde edilmiştir. İki kontrollü karşılaştırmalı çalışmada, ROTARIX sıvı formülasyon ile aşılama sonrası dışkı ile saçılma ile ROTARIX liyofilize formülasyon ile aşılama sonrası görülen dışkı ile saçılma benzerdir.
Atılan bu aşı virüsünün, aşılananların temas halinde olduğu seronegatif kişilere bulaştığı ancak herhangi bir klinik semptoma neden olmadığı vakalar gözlenmiştir.
ROTARIX, malignitesi olan veya immün sistemi baskılanmış veya immün sistemi baskılayıcı tedavi alan bireyler gibi immün yetersizliği olanlarla yakın temastaki kişilere dikkatle uygulanmalıdır.
Yeni aşılanmış kişiler ile temas halinde bulunanlar kişisel hijyene dikkat etmelidirler (Örn: çocukların bezini değiştirdikten sonra ellerini yıkamalıdır).
Preterm bebekler (gebeliğin 28. hafta ve öncesinde doğanlar) ve özellikle solunum sistemi gelişimi eksikliği hikayesi olanlarda primer bağışıklama serilerinin uygulanmasında potansiyel apne riskine karşı 48-72 saat solunum sisteminin izlenmesi gerekmektedir. Bu grup bebeklerde aşılamanın yararı yüksek olduğundan, aşılama kesilmemeli veya ertelenmemelidir.
Aşılananların hepsinde koruyucu immün cevap oluşmayabilir (bakınız bölüm 5.1).
Klinik çalışmalarda sirküle eden rotavirüs suşları dışındaki suşlara karşı ROTARIX'in koruyucu etkisi henüz bilinmemektedir. Etkililik verilerinin elde edildiği klinik çalışmalar Avrupa, Orta ve Güney Amerika ve Afrika'da yapılmıştır (bakınız bölüm 5.1).
Rotavirüs dışında diğer patojenlerin sebep olduğu gastroenterit vakalarında ROTARIX'in koruyucu etkisi yoktur.
Maruziyet sonrası profilaksi için ROTARIX kullanımına dair herhangi bir veri mevcut değildir.
ROTARIX hiçbir koşuldaenjekteedilmemelidir.
ve seri numarası mutlaka hasta dosyasına kaydedilmelidir.
Bu aşı yardımcı madde olarak sükroz ve glikoz içermektedir. Bu nedenle, fruktoz intoleransı, glikoz-galaktoz malabsorpsiyonu veya sükroz-izomaltaz yetersizliği gibi nadir kalıtsal problemleri olanlar bu aşıyı kullanmamalıdır.
Bu aşı her dozda 0,15 mikrogram fenilalanin içerir. Fenilalanin, fenilketonüri (FKU) hastaları için zararlı olabilir.
Bu aşı her dozda 34 mg sodyum içerir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
ROTARIX aşağıdaki monovalan veya kombine aşılarla birlikte uygulanabilir [hekzavalan aşılarda (DTPa-HBV-IPV/Hib) dahil]: difteri-tetanoz-tam hücreli boğmaca aşısı (DTPw), difteri-tetanoz-aselüler boğmaca aşısı (DTPa), Haemophilus influenzae tip b aşısı (Hib), inaktif polio aşısı (IPV), hepatit B aşısı (HBV), konjuge pnömokok aşısı ve meningokok serogrup C konjuge aşısı. Klinik çalışmalar uygulanan aşının immün cevabı ve güvenlilik profilinin etkilenmediğini göstermiştir.
ROTARIX ve oral polio aşısının (OPV) birlikte uygulanması, polio antijenlerinin immün cevabını etkilemez. OPV'nin birlikte uygulanmasının, rotavirüs aşısının immün cevabını hafif düşürmesine karşın, 4200'den fazla gönüllüye ROTARIX ile birlikte OPV uygulandığı bir klinik çalışmada şiddetli rotavirüs gastroenteritine karşı klinik korumanın sağlandığı gösterilmiştir.
Bebeklerin aşılama öncesi veya sonrası gıda veya sıvı tüketimine dair bir kısıtlama yoktur.
4.6. Gebelik ve laktasyon
Gebelik kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon) Çocuklarda kullanılması nedeniyle geçerli değildir. Doğurganlık çağındaki kadınlara uygulamak için geliştirilmemiştir.
Gebelik dönemi
Çocuklarda kullanılmakta olup, gebelik esnasında kullanımına dair veri mevcut değildir.
Laktasyon dönemi
Çocuklarda kullanılmakta olup, laktasyon esnasında kullanımına dair veri mevcut değildir.
Klinik araştırmalarda elde edilen kanıtlara dayanarak, emzirme, ROTARIX'in sağladığı rotavirüs gastroenteritine karşı koruma oranını düşürmez. Bu nedenle, aşılama programında emzirmeye devam edilebilir.
Üreme yeteneği / Fertilite
Çocuklarda kullanılmakta olup, üreme yeteneği/fertiliteye dair veri mevcut değildir. Üreme yeteneği ile ilgili çalışmalar yoktur.
4.7. Araç ve makine kullanımı üzerindeki etkiler
Çocuklarda kullanıldığı içingeçerlideğildir.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özetiAşağıda sunulmakta olan güvenlilik profili ROTARIX'in liyofilize veya likit formülasyonu ile gerçekleştirilen klinik çalışmalardan elde edilen verilere dayanmaktadır.
Toplam dört klinik çalışmada, yaklaşık 1900 bebeğe yaklaşık 3800 doz ROTARIX likit formülasyonu uygulanmıştır. Bu çalışmalar, likit formülasyonun güvenlilik profilinin liyofilize formülasyon ile karşılaştırılabilir olduğunu göstermiştir.
Toplam 23 klinik çalışmada, yaklaşık 51000 bebeğe yaklaşık 106000 doz ROTARIX (liyofilize veya likit formülasyon) uygulanmıştır.
ROTARIX'in tek başına uygulandığı (rutin pediyatrik aşıların uygulanması kademelendirilmiştir) üç plasebo kontrollü klinik çalışmada (Finlandiya, Hindistan ve Bangladeş), ROTARIX ve plasebo uygulanan grup arasında beklenen etkiler (aşılamadan 8 gün sonra toplanmıştır), ishal, kusma, iştah kaybı, ateş, iritabilite ve öksürük/burun akıntısı insidansı ve şiddetinde belirgin bir fark saptanmamıştır. İkinci dozda da bu etkilerin insidansı veya şiddetinde artış saptanmamıştır.
ROTARIX'in rutin pediyatrik aşılarla birlikte uygulandığı çalışmaların da dahil olduğu (bakınız bölüm 4.5) 17 plasebo kontrollü klinik çalışmanın havuzlanmış analizinde (Avrupa, Kuzey Amerika, Latin Amerika, Asya, Afrika) aşılama ile ilgili olabilecek aşağıdaki advers reaksiyonlar (aşılamadan 31 gün sonra toplanmıştır) tespit edilmiştir.
Sistem organ sınıfı ve sıklığa göre advers reaksiyonlar aşağıda listelenmiştir: Sıklıkları aşağıdaki şekilde sınıflandırılmıştır:
Çok yaygın (ï³1/10); yaygın (ï³1/100, <1/10); yaygın olmayan (ï³1/1.000, <1/100); seyrek (ï³1/10.000, <1/1.000), çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor)
Gastrointestinal hastalıklar
Yaygın: İshal,
Yaygın olmayan: Karın ağrısı, şişkinlik
Çok seyrek: İntususepsiyon (bakınız bölüm 4.4)
Deri ve deri altı doku hastalıkları Yaygın olmayan: Dermatit Çok seyrek: Ürtiker
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Yaygın: İritabilite
Pazarlama sonrası veriler:
Solunum, göğüs bozuklukları ve mediastinal hastalıklar
Bilinmiyor: 28 haftalık ve daha küçük prematüre bebeklerde apne (bkz. Bölüm 4.4).
Bilinmiyor: Hematokezya, Ciddi Kombine İmmün Yetmezlik (SCID) bozukluğu olan bebeklerde dışkı ile saçılma sonucu gastroenterit.
İntususepsiyon
Çeşitli ülkelerde gerçekleştirilen gözlemsel güvenlilik çalışmalarından elde edilen veriler rotavirüs aşılarının, çoğunlukla aşılamadan sonraki 7 gün içinde olmak üzere daha yüksek bir intususepsiyon riski taşıdığını göstermektedir. Bu ülkelerde yılda sırasıyla 25 ila 101/100.000 bebek (1 yaş altı) arka plan insidansı karşısında 100.000 bebekte 6'ya kadar ek olgu gözlenmiştir.
İkinci dozdan sonra daha düşük bir risk artışı yönünde sınırlı kanıt bulunmaktadır.
Daha uzun süreli takibe dayalı olarak rotavirüs aşılarının genel intususepsiyon insidansını etkileyip etkilemediği henüz bilinmemektedir (bkz. bölüm 4.4).
Diğer özel popülasyonlar
Preterm bebeklerde güvenlilik
Bir klinik çalışmada gebelik süresinin 27. ila 36. haftaları arasında olmak üzere 670 preterm bebeğe ROTARIX liyofilize formülasyon, 339 bebeğe ise plasebo uygulanmıştır. İlk doz doğumdan 6 hafta sonra uygulanmıştır. ROTARIX uygulananların %5.1'inde, plasebo alanların ise % 6.8'inde ciddi yan etkiler gözlenmiştir. Diğer yan etkiler ROTARIX ve plasebo alanlarda benzer oranlarda gözlenmiştir. Herhangi bir intususepsiyon vakası bildirilmemiştir.
İnsan Bağışıklık Yetmezliği Virüsü (HIV) ile enfekte bebeklerde güvenlilik
Bir klinik çalışmada, HIV ile enfekte 100 bebeğe ROTARIX liyofilize formülasyon veya plasebo uygulanmıştır. ROTARIX ve plasebo alanların güvenlilik profili benzerdir.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)âne bildirmeleri gerekmektedir. (www.titck.gov.tr;
e-posta: tufam@titck.gov.tr; tel: 0800 314 00 08; faks: 0312 218 35 99)
4.9. Doz aşımı ve tedavisi
Bazı doz aşımı olguları bildirilmiştir. Genel olarak bu olgularda bildirilen advers olay profili, önerilen ROTARIX dozunun uygulanmasından sonra gözlenen ile benzer olmuştur.
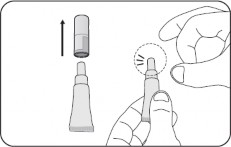
Tüpü açmak için
Bükmenize gerek yoktur. Kapağı aşağı doğru bastırarak zarı delin.
Ardından kapağı kaldırın.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Viral aşılar ATC kodu: J07BH01
Etki mekanizması
ROTARIX'in rotavirüs gastroenteritine karşı koruyucu immünolojik mekanizma tam olarak anlaşılamamıştır. ROTARIX aşılamasına karşı antikor cevapları ve rotavirüs gastroenteritine karşı koruma arasındaki ilişki kanıtlanmamıştır.
Liyofilize formülasyon için koruyucu etkililik
Klinik çalışmalarda, rotavirüsün en yaygın genotipleri olan G1P[8], G2Pï4ï, G3P[8], G4Pï8ï ve G9P[8]'in sebep olduğu gastroenterite karşı etkililik gösterilmiştir. Ayrıca, yaygın olmayan rotavirüs genotipleri G8P[4]'e (şiddetli gastroenterit) ve G12P[6]'e (herhangi bir gastroenterit) karşı etkililik gösterilmiştir. Bu suşlar tüm dünyada yaygın olarak bulunmaktadır.
Avrupa, Latin Amerika ve Afrika'da ROTARIX'in herhangi bir veya şiddetli rotavirüs gastroenteritine (RVGE) karşı koruyucu etkililiğini değerlendirmek için klinik çalışmalar yapılmıştır.
Gastroenteritin şiddeti, aşağıdaki iki farklı krittere göre tanımlanır:
ishal ve kusmanın şiddeti ve süresi, ateşin ve dehidratasyonun şiddeti ve tedavi gerekliliği göz önünde bulundurularak rotavirüs gastroenteritinin tam klinik tablosunu değerlendiren Vesikari 20 puan skalasına göre
Veya
5.2. Farmakokinetik özellikler
Aşılar için farmakokinetik özelliklerin değerlendirilmesi gerekmemektedir.
5.3. Klinik öncesi güvenlilik verileri
Tekrarlanan doz toksisitesine yönelik geleneksel çalışmaları baz alındığında, klinik dışı çalışmalarda insanlar için özel bir risk yoktur.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Sükroz
Di-sodyum adipat
Dulbecco Modifiye Eagle Besiyeri(DMEM) (fenilalanin, sodyum, glikoz ve diğer maddeleri içerir)
Steril su
6.2. Geçimsizlikler
Geçimlilik çalışmalarının olmaması durumunda, bu tıbbi ürün diğer tıbbi ürünlerle karıştırılmamalıdır.
6.3. Raf ömrü
36 aydır.
6.4. Saklamaya yönelik özel tedbirler
Aşı açıldıktan sonra hemen uygulanmalıdır.
Buzdolabında saklanmalıdır (2ï°C â 8ï°C). Dondurulmamalıdır. Aşı donmuş ise çözüp kullanmayınız.
Işıktan korumak için kendi ambalajında saklanmalıdır.
6.5. Ambalajın niteliği ve içeriği
Kapak (polipropilen) ve ağzı delinebilir zarla kapalı sıkıştırılabilir tüpte (polietilen) 1, 10 ve 25'lik ambalajlarda 1,5 mL oral süspansiyon
Tüm ambalajlar piyasaya sunulmayabilir.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Aşı kullanıma hazırdır (kullanıma hazırlama veya seyreltme gerektirmez). Aşı oral yolla, başka bir aşı veya çözelti ile karıştırılmadan uygulanmalıdır.
Aşı herhangi bir yabancı partikül içerip içermediğini kontrol için ve anormal fiziksel görünüm için görsel olarak incelenir. Eğer gözlenirse, aşı kullanılmamalıdır.
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğiâne uygun olarak imha edilmelidir.
Aşının uygulanmasına dair talimatlar:
A Rotarix'i vermeden önce yapmanız gerekenler
Anormal bir şey fark ederseniz aşıyı kullanmayın. |
Zar Tüp Kapak |
Son kullanma tarihini kontrol edin.
Tüpün hasar görmediğinden ve açık olmadığından emin olun.
Sıvının berrak ve renksiz olduğundan ve hiçbir partikül içermediğinden emin olun.
Bu aşı oral yolla â doğrudan tüpten verilir.
Kullanıma hazırdır â başka bir şeyle karıştırmanız gerekmez.
B Tüpü hazırlayın
1. Kapağı çıkarın
|
|
Kapağı saklayın â zarı delmek için bu kapağa ihtiyacınız olacak.
Tüpü dik tutun.
Tüpün üst kısmına sıvı tamamen uzaklaşana kadar hafifçe birkaç kez vurun.
Zarın hemen altından hafifçe vurarak tüpün en ince kısmından tüm sıvıyı uzaklaştırın.
 Artrit
Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında artrit tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur.
Artrit
Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında artrit tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
 İnme
İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama
ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına
yol açar.
İnme
İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama
ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına
yol açar. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| ROTARIX | 8699522967599 | 1,208.95TL |
| Diğer Eşdeğer İlaçlar |
 |
Parkinson Hastalığı Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
 |
Parkinson Hastalığı Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
 |
Rahim Boyu ( Serviks ) Kanseri Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir. |
İLAÇ GENEL BİLGİLERİ
Glaxo Smith Kline İlaçları San.Ve Tic.A.Ş
| Satış Fiyatı | 1208.95 TL [ 22 Apr 2024 ] |
| Önceki Satış Fiyatı | 1208.95 TL [ 15 Apr 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699522967599 |
| Etkin Madde | Canlı Zayıflatılmış Human Rotavirus Rix4414 Susu |
| ATC Kodu | J07BH01 |
| Birim Miktar | |
| Birim Cinsi | |
| Ambalaj Miktarı | 1 |
| Enfeksiyona Karşı Kullanılan (Antienfektif) İlaçlar > AŞI KOMBİNASYONLARI > Rota virus, live attenuated |
| İthal ( ref. ülke : Belcika ) ve Beşeri bir ilaçdır. |