RhoGAM Ultra-Filtered PLUS 300 g (1500 IU) IM Enjeksiyon için Çözelti Içeren Kullanıma Hazır Şırınga. Klinik Özellikler
{ }
4.1. Terapötik endikasyonlar
Babanın ve bebeğin Rho (D) (-) olduğunun kesinlikle bilindiği durumlar hariç olmak üzere; Rho (D) (-) kadına, Rho (D) (+) bebek doğumundan sonraki ilk 72 saat içinde uygulanır.
Babanın Rho (D) (-) olduğunun kesinlikle bilindiği durumlar hariç Rho (D) (-) gebelerde şüphelenilen ya da kanıtlanmış fetomaternal kanama, annenin geçirdiği karın travmaları, fetal invaziv işlemler (koryon villus biopsisi, amniosentez, fetal kan örneklemesi, fetal cerrahi vb.) eksternal sefalik versiyon, antepartum kanama, dış gebelik, düşük tehdidi ya da düşükler ve mol gebelikleri sonrasında kullanılır.
Antenatal proflaksi amacı ile 28-32. haftalar arası endikedir.
4.2. Pozoloji ve uygulama şekli
RhoGAM Ultra-Filtered PLUS sadece intramüsküler uygulama içindir.
Enjektör içeriği tamamen enjekte edilmelidir.
Tek kullanım içindir (Bakınız Bölüm 4.3, 4.4 ve 4.5).
RhoGAM Ultra-Filtered PLUS doğumu veya kırmızı kan hücrelerine maruziyeti izleyen 72 saat içinde uygulanmalıdır. 72 saatlik dönemden sonra verilen Rh0(D) İmmünglobulin (İnsan) etkinliği hakkında çok az bilgi bulunmaktadır. Pasif olarak kazanılmış olan anti-D düzeyinin korunması için ilk enjeksiyondan başlayarak her 12 haftada bir uygulanmalıdır.
Doğum öncesi uygulanan son dozdan sonraki 3 hafta içinde doğum gerçekleşmişse, doğum sonrası doz uygulanmayabilir, ancak 15 mLden fazla kırmızı kan hücrelerine maruziyeti belirlemek için fetomaternal kanama (FMK) testi yapılmalıdır.
Endikasyon | Doz | Notlar |
Doğum sonrası | ||
(Yeni doğan Rh-pozitif ise) Doğumu izleyen 72 saat içerisinde | 300 ug (1500 IU) | Hasta 15 mLden fazla kırmızı kan hücrelerine maruz kalmışsa ilave RhoGAM Ultra-Filtered PLUS dozları endikedir. Bu fetomaternal kanama için kalitatif ve kantitatif testlerin uygulanması ile belirlenebilir. |
Doğum öncesi Gebelerde aşağıdaki nedenlerle Rh-pozitif kırmızı kan hücrelerine maruziyet halinde 72 saat içinde uygulanır. | 300 ug | Hamileliğin erken dönemlerinde (26 ila 28.haftalardan önce) RhoGAM Ultra-Filtered PLUS uygulandığında, pasif olarak kazanılmış olan anti-D düzeyinin korunması için ilk enjeksiyondan başlayarak 12 haftalık aralıklarla uygulanmalıdır. |
Şüphelenilen veya kanıtlanmış fetamaternal kanama, abdominal travma ya da hamilelik ile ilgili girişimler (Amniosentez, koriyonik villus biyopsisi ve fetal kan örneklemesi, fetal cerrahi v.b.), eksternal sefalik versiyon antepartum kanama | (1500 IU) | |
Ektopik gebelik, mol gebelik | ||
Düşük tehdidi veya düşükler | ||
Doğum öncesi Proflaktik olarak hamileliğin 28 - 32. haftasında | 300 ug (1500 IU) | Doğum öncesi proflaksi endike olduğunda, yeni doğan bebek Rh pozitif ise annenin doğum sonrası dozu alması gerekir. |
Rh-uyumsuz kan veya kan ürünlerinin transfüzyonu | Rh-pozitif kırmızı kan hücrelerine bilinen veya şüpheli maruziyeti izleyen 72 saat içinde uygulanmalıdır. | |
2.5 - 15.0 mL Rh-pozitif kırmızı kan hücreleri | 300 ug (1500 IU) |
Hastanın, <15 mL Rh-pozitif kırmızı kan hücrelerine maruziyeti halinde ilave RhoGAM Ultra-Filtered PLUS dozlarının uygulanması endikedir. Maruz kalınan Rh-pozitif kırmızı kan hücrelerinin mLsi başına 20 ug RhoGAM Ultra- Filtered PLUS uygulanır.
Maruziyeti izleyen 3 gün içinde toplam doz uygulanmış olması koşulu ile çoklu dozlar aynı zamanda veya belirli aralıklarla uygulanabilir.
300 ug (1500 IU çoklu enjektörler)
1 > 15.0 mL Rh-pozitif kırmızı kan hücreleri
Uygulama şekli:
Her bir tek doz kullanıma hazır RhoGAM Ultra-Filtered PLUS enjektörü 300 ug (1500 IU)) Rh0(D) İmmünglobulin (İnsan) içermektedir. Bu doz, 15 mL üzerinde Rh pozitif kırmızı kan hücrelerinin söz konusu olduğu fetomaternal kanamaya (FMK) ait klinik ya da laboratuvar kanıtı olmadıkça, hamileliğin 13.haftası veya daha sonraki haftalarla ilişkili endikasyonlar için dozdur.
Çoklu Uygulamalar
Hamileliğin üçüncü üç aylık dönemi öncesinde görülmesi mümkün ancak pek muhtemel olmayan fakat sonraki dönemde ve çoğunlukla da doğum sırasında görülen bir olay olarak fetomaternal kanamanın 15 mLyi aşması halinde çoklu RhoGAM Ultra-Filtered PLUS doz uygulaması gerekli olabilir. Fetomaternal kanama riskinin arttığı bilinen veya şüphelenilen hastalar kalitatif ve kantitatif metotlarla açısından test edilmelidir. Etkinlik çalışmalarında, RhoGAM Ultra-Filtered PLUSın Rh-pozitif kırmızı kan hücrelerinin mLsi başına >20 ^g doz uygulandığında bütün deneklerde Rh immünizasyonunu baskıladığı gösterilmiştir.
Dolayısı ile tek doz RhoGAM Ultra-Filtered PLUS, <15 mL Rh-pozitif kırmızı kan hücrelerine maruziyet sonrası immün yanıtı baskılayacaktır. Ancak, klinik uygulamada maruziyet miktarını (transfüzyon hacmi veya fetomaternal kanama) belirlemede kullanılan laboratuvar test metotları kesin değildir. Bu nedenle fazla miktarda fetomaternal kanama veya kırmızı kan hücrelerine maruziyet şüphesi varsa ya da dokümante edilmişse Rh-pozitif kırmızı kan hücrelerinin mLsi başına 20 ugdan fazla RhoGAM Ultra-Filtered PLUS uygulaması düşünülmelidir. Maruziyeti izleyen 3 gün içinde toplam doz uygulanmış olması koşulu ile çoklu doz aynı anda veya aralıklı olarak uygulanabilir.
Uygulama sıklığı ve süresi
Yeterli anti-D düzeyinin korunması için RhoGAM Ultra-Filtered PLUS 12 haftalık aralıklarla uygulanmalıdır. Enjeksiyon için kesin zaman, ilk enjeksiyon uygulamasından başlayarak 12 haftalık aralıklara dayanır. Standart doğum öncesi dozdan (28 - 32. haftalarda) 12 hafta sonra doğum gerçekleşmemişse, doğum öncesi korumayı maksimize etmek için ikinci bir doz önerilir. Doğum öncesi uygulanan son dozdan sonraki 3 hafta içinde doğum gerçekleşmişse, doğum sonrası doz uygulanmayabilir. Ancak 15 mLden fazla kırmızı kan hücrelerine maruziyetini belirlemek için fetomaternal kanama testi yapılmalıdır.
Enjeksiyonu standart protokole göre uygulayınız.
Not: Enjeksiyon yaparken koruma düzeneğinin zamanından önce harekete geçmesini engellemek için, parmaklarınızı koruyucu içindeki pencereden enjektör gövdesine temas edecek şekilde yerleştirin
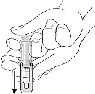
Koruma düzeneğini iğne üzerinden kaydırın.
Enjeksiyondan sonra serbest olan eliniz ile koruma düzeneğini iğne üzerine kaydırın. İşitilebilen klik sesi uygun hareketi gösterir.
Eller daima iğnenin arkasında tutulmalıdır.
Atıklar Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imha edilmelidir.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek - karaciğer yetmezliği: Veri bulunmamaktadır. Herhangi bir yan etki bildirimi yoktur.
4.3. Kontrendikasyonlar
İnsan immünglobulinlerine ve bileşenlerden birine karşı duyarlılığı olanlarda kontrendikedir.
Rh-pozitif bireylerde RhoGAM Ultra-Filtered PLUS uygulaması kontrendikedir.
Rh Kan tipi: RhoGAM Ultra-Filtered PLUS Rho(D) İmmünglobulin (insan), sadece Rh-
4.4. Özel kullanım uyarıları ve önlemleri
RhoGAM Ultra-Filtered PLUS insan plazmasından üretilmektedir ve virüsler, ve teorik olarak Creutzfeldt-Jakob Disease (CJD) ajanı gibi enfeksiyon ajanlarını bulaştırma riski taşıyabilirler. Böyle bir ürünün bir enfeksiyöz ajan bulaştırma riski, plazma donörlerinin belirli virüse önceden maruziyetini saptamak üzere taranması, plazmanın belirli virüs enfeksiyonlarının varlığına dair test edilmesi ve üretim prosesi sırasında patojen uzaklaştırma ve inaktivasyon tekniklerinin kullanılması ile azaltılmıştır. Bu önlemlere rağmen bu tip ürünler hala potansiyel olarak hastalık bulaştırabilirler.
Ayrıca bu tip ürünlerde bilinmeyen enfeksiyöz ajanların bulunma olasılığı da vardır. Bu ürün yolu ile bulaşma olasılığını düşündüren tüm enfeksiyonlar hekim tarafından Hemat İlaç Sanayi İth. ve İhr. Ştine bildirilmelidir. Hekim bu ürünün yarar ve risklerini hasta ile tartışmalıdır.
RhoGAM Ultra-Filtered PLUS yalnızca intramüsküler uygulama içindir, intravenöz uygulanmamalıdır.
Doğum sonrası kullanılması halinde ürün anneye uygulanır.
Yeni doğan bebeğe enjekte edilmez.
Hastalar, uygulamadan sonra en az 20 dakika gözlenmelidir.
Daha önceden insan immünglobulinine karşı şiddetli sistemik alerjik reaksiyonları olan hastalara dikkatle uygulanmalıdır.
RhoGAM Ultra-Filtered PLUS düşük miktarda IgA içerir. IgA eksikliği olan hastalarda potansiyel aşırı duyarlılık reaksiyon riski bulunmaktadır.
Rh-uyumsuz transfüzyon nedeniyle tedavi gören hastalar, hemolitik reaksiyonun belirtileri ve semptomlarına karşı klinik olarak ve laboratuvar testleri ile izlenmelidir.
RhoGAM Ultra-Filtered PLUS için plazma genel olarak Ortho-Clinical Diagnosticsin sahip olduğu ve işlettiği donör merkezinden sağlanır. Bütün donörler enfekte donörlerden kan kaynaklı patojenlerin bulaşma riskini azaltmak için geçmişe ait bilgileri ve laboratuvar testleri ile çok dikkatle taranmaktadırlar. Plazma donasyonlarının her biri test edilmiş ve hepatit B yüzey antijeni (HBsAg) ve Hepatit C antikoru (HCV) ve insan immün yetmezlik virüsü (HIV) 1 ve 2 antikoru yönünden non-reaktif bulunmuştur. Buna ek olarak, plazma HCV ve HIV-1 için FDA tarafından onaylı Nükleik Asit Testi (NAT) ile test edilir ve sonuçlar mutlaka negatif olmalıdır. Plazma ayrıca araştırma olarak NAT ile hepatit B (HBV) için test edilir ve non-reaktif bulunmalıdır. Bununla birlikte negatif sonucun önemi belirlenmemiştir. Plazma in proses NAT prosedürleri ile hepatit A virüsü (HAV) ve parvovirüs B19 (B19) için mini havuz formatında test edilmiştir. Üretim için sadece virüs taramasından geçen plazma kullanılır. B19 için uygulanan prosedür, bilinen virüs izolatlarının sekans dizilimlerine dayanarak üç genotipin hepsini tespit eder. B19 için üretim havuzundaki limiti 104IU/mLyi geçmeyecek şekilde ayarlanır.
Plazma fraksinasyonu, viral titreleri anlamlı derecede azalttığı gösterilen modifiye edilmiş soğuk alkol prosedürü ile gerçekleştirilir. Plazma fraksinasyonunu takiben, zarflı ve zarfsız virüsleri uzaklaştımak için gözenek büyüklüğü dağılımı 12-18 nanometre olan patentli Viresolve 180 ultrafiltrasyon membranın kullanıldığı büyüklük-dışlama (size-exclusion) mekanizması ile viral klirens basamağı virüsleri uzaklaştırır. Viral filtrasyondan sonra, filtre bütünlüğünü sağlamak için Viresolve 180 ultrafiltrasyon membranında kalite kontrol testleri (Corr Testi ve difüzyon testleri) gerçekleştirilir. Viral inaktivasyon basamağında, HCV, HIV ve Batı Nil Virüsü (WNV) gibi zarflı virüsleri inaktive etmek için Triton X-100 ve tri-n-bütil fosfat(TNBP) kullanılır.
Donör seçme prosesi, fraksinasyon prosesi, viral filtrasyon basamağı ve viral inaktivasyon prosesi, zarflı ve zarfsız virüslerin geçiş riskini azaltarak ürün güvenliliğini arttırır. Rh0(D) İmmünglobulini (İnsan) kas içi kullanım içindir ve soğuk alkol fraksinasyonu ile hazırlanır, hepatit ve diğer enfeksiyöz hastalıkları bulaştırdığı görülmemiştir. RhoGAM Ultra-Filtered PLUS ile enfeksiyöz hastalıkların bulaştığına dair belgelenmiş herhangi bir vaka bulunmamaktadır.
Laboratuvar etiketleme (spiking) çalışmaları, RhoGAM Ultra-Filtered PLUS üretim prosesinin kümülatif viral uzaklaştırma ve inaktivasyon kapasitesini şu şekilde göstermiştir:
Virüs | HIV | BVDV | PRV | PPV | EMC | WNV | HAV |
Lipid Zarflı | Evet | Evet | Evet | Hayır | Hayır | Evet | Evet |
Büyüklük (nm) | 80-120 | 40-70 | 120-200 | 18-24 | 25-30 | 40-60 | 27-32 |
Genom | SS-RNA | SS-RNA | DS-DNA | SS-DNA | SS-DNA | SS-RNA | SS-RNA |
Fraksinasyon | >7.98 | 7.29 | > 11.74 | 8.30 | Saptanmadı | Saptanmadı | Saptanmadı |
Viral Filtrasyon | > 5.60 | 5.40 | >6.20 | 3.30 | 4.16 | ND | >5.07 |
Viral İnaktivasyon | >4.28 | >4.90 | >5.58 | Uygulanmaz | Uygulanmaz | >7.05 | Uygulanmaz |
Toplam Viral İndirgeme | >17.86 | >17.59 | >23.52 | 11.60 | 4.16 | >7.05 | >5.07 |
Üniteler = log10 indirgeme
HIV: İnsan İmmün Yetmezlik Virüsü, HIV-1 ve 2 ile İnsan T-hücre Lenfotropik Virüs (HTLV) 1 ve 2 için model
BVDV: Bovin Viral Diarrhea Virus, Hepatit C Virüsü için model
PRV: Pseudorabies Virus, Herpes virsleri için model
PPV: Porcine Parvovirus, Parvovirus B19 için model
WNV: Batı Nil Virüsü
HAV: Hepatit A Virüsü
Rho(D) İmmünglobulininin (İnsan) güvenliliği Amerika Birleşik Devletlerinde kadın kan donörlerindeki viral göstergelerin ampirik çalışmasında gösterilmiştir. Bu çalışma yaklaşık % 55-60ının hamileliğe ilişkin endikasyon için Rho(D) İmmünglobulin (İnsan) aldığı Rh-negatif donörlerin Rho(D) İmmünglobulin (İnsan) almayan Rh pozitif kadın donörlerinki ile benzer yüksek prevalans ve insidans viral belirteç oranlarına sahip olduğunu göstermiştir.
RhoGAM Ultra-Filtered PLUS veya diğer Rho(D) İmmünglobulin (İnsan) ürünlerinin enjeksiyonundan sonra plazma veya serumdaki anti-Dnin geri kazanımı bireylere bağlı olarak oldukça değişkendir. Bir hastanın plazmasında anti-D tespiti, tayin yönteminin duyarlılığına ve enjeksiyon sonrasında toplanan numunenin zamanına bağlıdır. Şu anda, RhoGAM Ultra-Filtered PLUS enjeksiyonunu takiben dozun yeterliliğini ve etkinliğini saptamak için anti-D mevcudiyetinin test edilmesine yönelik bir gereklilik veya uygulama standardı bulunmamaktadır
Maternal serumda pasif olarak kazanılmış anti-D oluşumu, pozitif antikor tarama testine neden olabilir. Bu, sonraki doğum öncesi ve doğum sonrası proflaksiyi önlemez.
Doğum öncesinde annelerine Rho (D) immünglobulin (insan) verilen bazı bebekler, doğumda direkt antiglobülin (Coombs) testlerine zayıf pozitiftir.
Fetomaternal hemoraji annede yanlış kan tipi sonuçlarına yol açabilir. Gebeliğin sonuna doğru veya doğumdan sonra Rh-negatif annenin dolaşımında zayıf D (Du) için pozitif antiglobulin testine neden olabilecek düzeyde fetal Rh-pozitif kırmızı kan hücresi bulunabilir.
Bu bağlamda eğer hastanın Rh tipi açısından bir şüphe varsa RhoGAM Ultra-Filtered PLUS kullanılmamalıdır.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Rho(D) İmmünglobulin (İnsan) dahil immünglobulin preparatları kızamık, kabakulak ve suçiçeği gibi canlı aşıların etkisini azaltabilir. Canlı aşıların uygulaması genellikle immünglobulinin son dozundan sonra 12 haftaya kadar geciktirilmelidir. Eğer immünglobulin kullanımı canlı aşı uygulamasından sonraki 14 gün içinde yapılırsa, aşılamaya karşı immün yanıt engellenebilir.
4.6. Gebelik ve laktasyon
Genel Tavsiye
Gebelik kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Bu tıbbi ürün gebelikte kullanılır. RhoGAM Ultra-Filtered PLUS ile hayvanlarda üreme çalışmaları yapılmamıştır.
Mevcut kanıtlar Rho (D) immün globulin (insan)in fetuse zarar vermediğini veya alıcı annenin gelecekteki gebeliklerine ya da üreme kapasitesine etkisi bulunmadığım ortaya koymaktadır.
Gebelik dönemi
İyi yönetilmiş epidemiyolojik çalışmalar İnsan Anti-D immünoglobulininin gebelik üzerinde ya da fetusun/yeni doğan çocuğun sağlığı üzerinde advers etkileri olduğunu göstermemektedir.
RhoGAM Ultra-Filtered PLUS gebelik döneminde kullanılabilir.
Laktasyon dönemi
RhoGAM Ultra-Filtered PLUS anne sütü ile atılmamaktadır. RhoGAM Ultra-Filtered PLUS emzirme döneminde kullanılabilir.
Üreme yeteneği /Fertilite
4.7. Araç ve makine kullanımı üzerindeki etkiler
4.8. İstenmeyen etkiler
RhoGAM Ultra-Filtered PLUSın uygulamasından sonraki advers olaylar nadirdir.
RhoGAM Ultra-Filtered PLUS için yapılan klinik çalışmalarda ve ürünün pazara verilmesinden sonra hastalar tarafından bildirilen istenmeyen yan etkiler aşağıda verilmektedir.
RhoGAM Ultra-Filtered PLUS için istenmeyen etkilerin değerlendirilmesinde şu terimler ve sıklık dereceleri kullanılmıştır: Çok yaygın (>1/10), yaygın (>1/100 ila <1/10), yaygın olmayan (>1/1000 ila <1/100), seyrek (>1/10000 ila <1/1000); çok seyrek (<1/10000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Bağışıklık sistemi hastalıkları
Seyrek:
Hipersensitivite, dispne ve şok dahil anaflaktik reaksiyonlar
Sinir sistemi hastalıkları
Yaygın olmayan:
Başağrısı
Kardiyak hastalıklar
Seyrek:
Taşikardi
Vasküler hastalıklar
Seyrek:
Hipotansiyon
Gastrointestinal hastalıklar
Seyrek:
Bulantı, kusma
Deri ve derialtı doku hastalıkları
Yaygın olmayan:
Döküntü, eritem, kaşıntı, prurit
Kas-iskelet bozuklukları, bağ doku-ve kemik hastalıkları
Bilinmiyor:
Artralji
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıkları
Yaygın olmayan:
Ateş, halsizlik, üşüme
Bilinmiyor:
Uygulama yerinde: şişme, ağrı, eritem, sertleşme, sıcaklık, prurit, döküntü, kaşınma
Enjeksiyon yerinde lokal ağrı ve hassasiyet görülebilir, büyük dozları farklı yerlere enjekte ederek dağıtmak suretiyle bu önlenebilir.
RhoGAM Ultra-Filtered PLUS uygulaması ile ilgili olarak anaflaksi veya başka bir nedene bağlı ölüm olgusu rapor edilmemiştir.
Viral güvenlilik için 4.4e bakınız.
4.9. Doz aşımı ve tedavisi
Rh negatif bireylerde tekrar eden uygulamalar veya yükseltilmiş dozlar normal dozlardan daha şiddetli veya daha sık advers reaksiyonlara yol açmaz. Rh-uyumsuz transfüzyonlar için RhoGAM alan hastalar hemolitik reaksiyon riskinden dolayı klinik olarak ve laboratuvar testleri ile izlenmelidir.
4.9.
 Grip, Soğuk Algınlığı ve Öksürük
Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır.
Grip, Soğuk Algınlığı ve Öksürük
Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |
 Asperger Sendromu
Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde,
gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır.
Asperger Sendromu
Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde,
gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |
İLAÇ GENEL BİLGİLERİ
Hemat İlaç Sanayi İthalat ve İhracat Ltd. Şti.
| Satış Fiyatı | TL |
| Önceki Satış Fiyatı | |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | |
| İthal ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Diyabet Hastalığı Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |
 |
Aşırı Alkol Kullanımı, Alkolizm Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür. Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması gerekmez. |
 |
Omurilik zedelenmeleri Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir. |