REGINON 0.02 mg /0.075 mg 63 draje Kısa Ürün Bilgisi
{ Gestoden + Etinilestradiol }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
REGİNON 20 mcg/75 mcg kaplı tablet
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her kaplı tablet etkin madde olarak 75 mcg gestoden ve 20 mcg etinilestradiol içerir.
Yardımcı maddeler
Her bir kaplı tablet
Laktoz monohidrat (sığır kaynaklı) 36,865 mg
Şeker 19,631 mg içerir.
Yardımcı maddeler için 6.1'e bakınız
3. FARMASÖTİK FORMU
Kaplı tablet
Beyaz renkli, bikonveks, yuvarlak parlak kaplı tablet
Hafta: Kaplı tabletsiz dönemin yaklaşıyor olması nedeni ile güvenilirlikte azalma riski yüksektir. Yine de, kaplı tablet alımında ayarlamalar yapılarak kontraseptif korumada azalma önlenebilir. Eğer unutulan kaplı tabletten önceki 7 gün boyunca kaplı tabletler doğru olarak alındıysa, aşağıdaki iki seçenekten birinin uygulamasıyla ek bir kontraseptif yönteme gerek kalmaz.
Tromboz veya kan pıhtılaşması ilk belirtileri (örneğin, bacakta/bacaklarda olağan dışı ağrılar veya şişme, gözle görülür bir neden olmaksızın nefes alırken veya öksürürken bıçak gibi saplanan ağrılar). Göğüste ağrı veya sıkışma hissi
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Oral kontrasepsiyon (doğum kontrolü)
REGİNON reçete etme kararı, venöz tromboembolizmi (VTE) olan kadınlar başta olmak üzere, her kadının mevcut risk faktörleri ve REGİNON ile ortaya çıkan VTE riskinin diğer kombine hormonal kontraseptifler (KHK) ile karşılaştırması (bkz. bölüm 4.3 ve bölüm 4.4) dikkate alınarak verilmelidir.
4.2. Pozoloji ve uygulama şekli
Kombine oral kontraseptifler (KOK), doğru şekilde kullanıldıklarında yılda yaklaşık % 1 başarısızlık oranına sahiptir. İlaç unutulduğunda ya da yanlış kullanıldığında başarısızlık oranı artabilir.
Kaplı tabletler, paketin üstünde gösterildiği yönde, her gün yaklaşık aynı zamanda bir miktar suyla alınmalıdır. Birbirini izleyen 21 gün boyunca her gün bir kaplı tablet alınır. Her bir sonraki pakete 7 günlük, sıklıkla çekilme kanamasının izlendiği, kaplı tablet alınmayan dönemi takiben geçilir. Bu kanama genellikle son kaplı tabletin alınmasını takiben 2.-3. gün başlar ve bir sonraki pakete başlandığında kesilmemiş olabilir.
Uygulama şekli:
Oral kullanım içindir. REGİNON'a başlangıç
Bir önceki ay hormonal kontraseptif kullanımı yoksa: Kaplı tablet alımına kadının normal siklusunun ilk günü (kanamasının ilk günü) başlanmalıdır. Kaplı tabletlere 2. ile 5. günler arasında başlanması da kabul edilebilir, ancak bu durumda ilk siklus için kaplı tablet alınmaya başlanmasından itibaren 7 gün boyunca ilave olarak bir bariyer kontrasepsiyon yöntemi kullanılmalıdır.
Bir kombine hormonal kontraseptiften geçiş (kombine oral kontraseptif (KOK), vajinal halka, transdermal flaster): Tercihen önceki kombine oral kontraseptifın son aktif kaplı tabletini (hormon içeren son kaplı tablet) izleyen gün REGİNON alımına başlanmalıdır. En geç ise kaplı tabletsiz dönemi ya da hormon içermeyen kaplı tablet döneminin ertesi gününde başlanabilir. Vajinal halka ya da transdermal flaster kullanılması durumunda, kullanıcı döngü paketindeki son halkanın ya da flasterin çıkarıldığı gün ya da en geç bir sonraki uygulamanın yapılması gereken gün REGİNON'a başlamalıdır.
Yalnız progestagen içeren bir yöntemden (minipil, enjeksiyon, implant) ya da progesteron salımlı rahim içi sistemden (RİS) geçiş: Minipilden herhangi bir günde, (implant veya RİS'in çıkarıldığı gün, enjeksiyonda ise bir sonraki enjeksiyonun yapılması gereken gün) geçiş
yapılabilir. Ancak tüm bu koşullarda kaplı tablet alımının ilk 7 günü ek bir bariyer yöntemi kullanılması önerilir.
İlk trimestr düşüğünü takiben: Hemen başlanabilir. Ek kontraseptif önlemler alınmasına ihtiyaç duyulmaz.
Doğumu veya ikinci trimestr düşüğünü takiben: Emziren kadınlar için bkz. Gebelik ve laktasyon.
Emzirmeyen kadınların doğumu veya ikinci trimestr düşüğünü takiben: 21.-28. günlerde başlanması önerilir. Daha sonra başlandığı takdirde kaplı tablet alımının ilk 7 günü ek bir bariyer yöntemi kullanılmalıdır. Eğer o zamana kadar ilişki gerçekleştiyse, kombine oral kontraseptif kullanımı başlamadan önce gebelik ekarte edilmeli veya ilk menstruel kanama beklenmelidir.
Kaplı tablet alımı unutulduğunda: Eğer kullanıcı kaplı tabletini almakta, 12 saatten daha az geç kalmışsa kontraseptif koruyuculuk azalmaz. Hatırlanır hatırlanmaz kaplı tablet alınmalı ve sonraki kaplı tabletler de her zamanki gibi alınmaya devam edilmelidir.
Eğer 12 saatten daha fazla gecikme olmuşsa kontraseptif koruyuculuk azalmış olabilir. Bu durumda 2 temel kural uygulanır:
Kaplı tablet alımına hiç bir zaman 7 günden fazla ara verilmez.
4.3. Kontrendikasyonlar
KOK'lar aşağıda belirtilen durumlarda kullanılmamalıdır. KOK kullanırken aşağıdaki durumlardan herhangi birinin ilk kez görülmesi halinde kullanım derhal durdurulmalıdır.
Etkin ya da yardımcı maddelerden herhangi birine karşı aşırı duyarlılık
4.4. Özel kullanım uyarıları ve önlemleri
Uyarılar
Aşağıda belirtilen durum veya risk faktörlerinden herhangi biri varsa, REGİNON'un uygun olup olmadığı kadın ile tartışılmalıdır.
Bu durumlardan veya risk faktörlerinden herhangi birinin şiddetlenmesi veya ilk defa ortaya çıkması halinde, kadının REGİNON kullanımının sonlandırılmasının gerekli olup olmadığının belirlenmesi için doktoru ile iletişime geçmesi tavsiye edilmelidir.
Dolaşım bozuklukları VTE Riski
KHK kullanan kadınlarda VTE riski kullanmayanlara göre artar. Levonorgestrel, norgestimat veya noretisteron içeren ürünler en düşük VTE riski ile ilişkilendirilmiştir. REGİNON gibi diğer ürünlerde ise bu riskin iki katına kadar çıkabilir. En düşük VTE riskine sahip olduğu bilinenlerden farklı bir ürünün kullanılması kararı, ancak kadının REGİNON ile ilişkili VTE riskini, mevcut risk faktörlerinin bu riski nasıl etkilediğini ve VTE riskinin kullanımınım ilk yılında en yüksek olduğunu anladığından emin olduktan sonra alınmalıdır. Ayrıca KHK kullanımına 4 hafta veya daha uzun süre ara verildikten sonra tekrar başlandığında riskin arttığını gösteren bazı kanıtlar vardır.
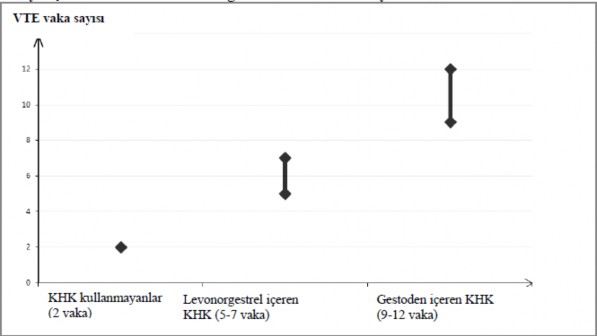
KHK kullanmayan ve gebe olmayan kadınlarda, 10.000 kişiden yaklaşık 2'si bir yıllık süre içinde VTE geliştirir. Bununla birlikte, herhangi bir kadında altta yatan risk faktörlerine bağlı olarak söz konusu risk çok daha yüksek olabilir (aşağı bakınız).
Gestoden içeren KHK kullanan 10.000 kadından 9 ila 12'sinin bir yıl içinde VTE geliştireceği tahmin edilmektedir; bu oran levonorgestrel içeren KHK kullanan kadınlarda 6 civarındadır.
Düşük dozlu KHK'ler ile bir yıldaki VTE sayısı gebelikte veya postpartum dönemde kadınlarda beklenen sayıdan düşüktür.
VTE, bu vakaların %1-2'sinde ölümcül olabilir.
Bir yıl içinde her 10.000 kadında görülen VTE vakası sayısı
Son derece nadir olarak, KHK kullanıcılarında diğer kan damarlarında (örn. hepatik, mesenter, böbrek veya retinal toplardamarlar ve atardamarlar) tromboz meydana geldiği rapor edilmiştir.
VTE risk faktörleri
Venöz tromboembolik komplikasyon riski KHK kullanıcılarında özellikle çoklu risk faktörleri olduğunda, ilave risk faktörleri olan kadınlarda ciddi ölçüde artabilir (bkz. Tablo: VTE Risk faktörleri).
Yüksek venöz tromboz riski oluşturan çoklu risk faktörleri mevcut olan kadında REGİNON kullanımı kontrendikedir (bkz. bölüm 4.3). Bir kadın birden fazla risk faktörüne sahipse risk artışı tüm faktörlerin ayrı ayrı toplamından fazla olabilir ve bu durumda toplam VTE riski dikkate alınmalıdır. Fayda ve risk dengesinin negatif olduğu düşünülüyorsa KHK reçete edilmemelidir (bkz. bölüm 4.3).
Tablo: VTE Risk faktörleri
Risk faktörü: | Açıklama |
Obezite (vücut kitle indeksi 30 kg/m'nin | Vücut kitle indeksi yükseldiğinde risk ciddi |
üstündeyse) | ölçüde artar. Diğer risk faktörleri mevcutsa özellikle dikkate alınmalıdır. |
Uzun süreli hareketsizlik, majör cerrahi müdahale, bacaklara ve pelvise cerrahi müdahale, nörocerrahi, veya majör travma
Not: 4 saatten fazla hava yolu seyahati dahil geçici hareketsizlik de özellikle diğer risk faktörleri olan kadınlarda VTE için bir risk faktörü olabilir. | Bu durumlarda ilacı kesmek (cerrahi müdahale durumunda en az 4 hafta) ve tamamen iyileştikten iki hafta sonrasına kadar devam etmemek önerilir. İstenmeyen gebeliği önlemek için başka bir kontrasepsiyon yöntemi kullanılmalıdır.
Önceden REGİNON kesilmemişse, antitrombotik tedavi düşünülmelidir. |
Pozitif aile geçmişi (Hiçbir ebeveyn ya da kardeşte erken yaşlarda (örn. 50 yaşından genç) VTE görülmemişse.) | Kalıtımsal bir eğilimden şüpheleniliyorsa, KHK kullanımından önce mutlaka bir uzmandan tavsiye alınmalıdır. |
VTE ile ilişkili diğer tıbbi durumlar | Kanser, sistemik lupus eritematoz, hemolitik üremik sendrom ve kronik inflamatuar bağırsak hastalıkları (Crohn hastalığı veya ülseratif kolit) ve orak hücre hastalığı. |
İlerleyen yaş | Özellikle 35 yaş üstü |
Variköz venlerin ve yüzeysel tromboflebitin venöz tromboembolideki olası rolü konusunda görüş birliği yoktur.
Gebelikte ve özellikle 6 haftalık puerperium periyodunda tromboemboli riskindeki artış dikkate alınmalıdır (bkz. bölüm 4.6).
VTE semptomları (Derin Ven Trombozu-DVT ve Pulmoner Emboli-PE)
Semptomlar olması halinde, kadınlara acil tıbbi yardım almaları ve sağlık çalışanlarını KHK aldıkları konusunda bilgilendirmeleri tavsiye edilmelidir.
DVT semptomları aşağıdakileri kapsayabilir:
bacakta/ayakta tek taraflı ya da bacaktaki bir damar boyunca şişme;
Elektif majör operasyondan (örn. abdominal, ortopedik), herhangi bir bacak ameliyatından, varisli damarlar veya uzun süreli hareketsizlik (örn. kazalar veya ameliyattan sonra) için tıbbi tedaviden altı hafta önce. Tam yürür hale geldikten sonra 2 hafta geçinceye kadar yeniden başlamayın. Acil cerrahi durumunda genellikle trombotik profilaksi endikedir, örn. subkutanöz heparin.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Enzim İndükleyicileri
Mikromozal enzimleri indükleyen ilaçlar (özellikle sitokrom P450 3A4) ile arasındaki etkileşimler seks hormonu klerensinde artışa neden olabilir, bu durum da ara kanamaya ve/veya kontraseptif başarısızlığa yol açabilirler.
Birkaç günlük tedavinin ardından enzim indüksiyonu gözlemlenebilir. En fazla enzim indüksiyonu genellikle birkaç hafta içinde görülür. Enzim indüksiyonu, ilaç tedavisinin kesilmesinin ardından 4 hafta kadar sürebilir.
Belirtilen ilaçlardan herhangi biri ile tedavi edilmekte olan kadınlar, KOK'a ek geçici bir bariyer yöntemi kullanmalı ya da başka bir kontrasepsiyon yöntemi seçmelidirler. İlaçlar ile birlikte kullanımları süresince ve tedavinin kesilmesini takiben 28 gün boyunca bariyer yöntemi kullanmalıdırlar. Eğer bariyer yöntemi kullanılan dönem KOK kutusundaki tabletlerin bitiminden sonra devam ediyorsa, bir sonraki kutuya ara vermeden devam edilmelidir. Bu durumda, ikinci paketin sonuna kadar çekilme kanaması beklenmemelidir. Hasta, ikinci paketin bitiminden sonraki tablet kullanılmayan dönemde çekilme kanaması yaşamazsa, sonraki pakete devam etmeden önce gebelik olasılığının elenmesi gerekir.
Enzim indükleyicilerle uzun süreli tedavi alan kadınlar için, başka bir kontrasepsiyon yöntemi kullanılmalıdır.
Aşağıdakilerin KOK'larla klinik olarak anlamlı etkileşimlerinin olduğu gösterilmiştir:
Antikonvülsanlar: barbitüratlar (fenobarbital dahil), primidon, fenitoin, karbamazepin, okskarbazepin, topiramat.
Antibiyotikler/antifungaller: griseofulvin, rifampisin.
Bitkisel ilaçlar: St John's wort (kantaron - Hypericum perforatum) Antiretroviral ajanlar: ritonavir, nelfinavir, nevirapin.
Not: Cinsiyet hormonlarının plazma konsantrasyonunu artırabilen başka antiretroviral ajanlar da vardır.
KOK klerensini azaltan maddeler (enzim inhibitörleri):
Azol antifungaller (örn. itrakonazol, vorikonazol, flukonazol), verapamil, makrolidler (örn. klaritromisin, eritromisin), diltiazem ve greyfurt suyu gibi kuvvetli ve orta düzeyde CYP3A4 inhibitörleri östrojen veya progesteron veya her ikisinin de plazma konsantrasyonunu artırabilir.
60 - 120 mg/gün etorikoksib dozlarının 0,035 mg etinilestradiol içeren KHK ile eş zamanlı olarak alındığı takdirde etinilestradiolün plazma konsantrasyonlarını sırasıyla 1,4 - 1,6 kat arttırdığı görülmüştür.
KOK'lerin diğer tıbbi ürünler üzerine etkisi:
Oral kontraseptifler diğer bazı ilaçların metabolizmasını etkileyebilir. Buna bağlı olarak plazma ve doku konsantrasyonları artabilir (örn. siklosporin, tizanidin, teofilin) ya da azalabilir (örn. lamotrigin).
Farmakodinamik etkileşimler
Ribavirinli veya ribavirin içermeyen; Ombitasvir, paritaprevir, ritonavir ve dasabuvirin, kombinasyonlarını içeren tıbbi ürünlerin birlikte uygulanması ALT seviyelerinde artma riskini yükseltebilir (bkz. bölüm 4.3 ve bölüm 4.4).
Bu nedenle, REGİNON kullanıcıları, bu kombinasyon ilaç rejimiyle tedaviye başlamadan önce alternatif bir kontrasepsiyon yöntemine (örneğin, sadece progestajenle kontrasepsiyon veya hormonal olmayan yöntemler) geçmelidir. REGİNON, bu kombinasyon ilaç rejimi ile tedavi tamamlandıktan 2 hafta sonra yeniden başlatılabilir.
Diğer etkileşim şekilleri:
Laboratuvar Testleri
Oral kontraseptiflerin kullanılması, örn. kortikosteroid bağlayıcı globulin ve lipid/lipoprotein fraksiyonları, karbonhidrat metabolizması parametreleri ve koagülasyon ve fibrinoliz parametreleri gibi karaciğer, tiroid, adrenal ve renal fonksiyonun biyokimyasal parametreleri dahil olmak üzere belirli laboratuvar testlerinin sonuçlarını etkileyebilir. Bu nedenle laboratuvar testleri istendiğinde, laboratuvar personeline oral kontraseptif kullanımı hakkında bilgi verilmelidir. Not: Olası etkileşmeleri belirlemek amacıyla eşzamanlı kullanılacak ilacın prospektüsüne (kullanma talimatına) başvurulmalıdır.
Özel popülasyonlara ilişkin ek bilgiler:
Özel popülasyonda etkileşim çalışması yapılmamıştır. Pediyatrik popülasyon:
Pediyatrik popülasyonda etkileşim çalışması yapılmamıştır.
4.6. Gebelik ve laktasyon
Genel tavsiyeGebelik kategorisi: X
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon) REGİNON doğum kontrolü amacıyla kullanılmaktadır. Kullanıldığı sürece fertiliteyi engeller.
Gebelik dönemi
REGİNON'un gebelikte kullanımı kontrendikedir. Gestoden ve etinilestradiol gebelik döneminde uygulandığı takdirde ciddi doğum kusurlarına yol açmaktadır.
REGİNON kullanımı sırasında gebelik meydana gelmesi durumunda kullanım durdurulmalıdır. Ancak, yaygın epidemiyolojik çalışmalar ne gebeliğinden önce kombine oral kontraseptif kullanmış olan kadınların çocuklarında doğumsal kusur riskinde herhangi
bir artışı ne de erken gebeliği süresince yanlışlıkla kombine oral kontraseptif kullanıldığında oluşan bir teratojenik etkiyi göstermemiştir.
REGİNON kullanımına yeniden başlarken postpartum dönemi sırasında artan VTE riski dikkate alınmalıdır (bkz. bölüm 4.2 ve bölüm 4.4.)
Laktasyon dönemi
REGİNON'un emzirme döneminde kullanılması üretilen süt hacminde azalmaya ve bileşiminde değişikliğe neden olabilir. Etkin maddelerin çok küçük bir miktarı sütle atılır. Bu miktar, çocuğu özellikle doğumdan sonraki ilk 6 hafta içinde etkiler. Emziren annelere, başka bir kontrasepsiyon yöntemi kullanmaları önerilebilir.
Üreme yeteneği/Fertilite
REGİNON bir KHK'dır. Kullanıldığı sürece fertiliteyi engeller.
4.7. Araç ve makine kullanımı üzerindeki etkiler
REGİNON'un araç ve makine kullanma becerileri üzerinde bilinen bir etkisi bulunmamaktadır.
4.8. İstenmeyen etkiler
REGİNON ile en yaygın olarak bildirilen advers reaksiyonlar mide bulantısı, abdominal ağrı, kilo artışı, baş ağrısı, depresif ruh hali, duygu durum bozukluğu, meme ağrısı, meme hassasiyetidir. Kullanıcıların ≥ %1'inde meydana gelir.
Ciddi advers reaksiyonlar ATE ve VTE'dir.
Pazarlama sonrası raporlanan advers reaksiyonlar Bağışıklık sistemi hastalıkları
Kalıtsal anjiyoödemin alevlenmesi
Sinir sistemi hastalıkları
Korenin alevlenmesi
Gastrointestinal hastalıklar
Ülseratif kolit
Hepatobiliyer hastalıklar
Karaciğer fonksiyon bozuklukları
Deri ve deri altı doku bozuklukları:
Kloazma
Üreme sistemi ve meme hastalıkları
Azalmış adet kanaması, lekelenme, ani kanama, çekilme kanaması yoksunluğu, tablet sonrası amenore
Advers reaksiyonlar, aşağıda sistem-organ sınıfı (MedDRA) ve sıklık derecesine göre listelenmektedir. Sıklık dereceleri şu şekilde tanımlanmaktadır; çok yaygın (>1/10), yaygın (>1/100, <1/10), yaygın olmayan (>1/1.000, <1/100), seyrek (>1/10.000 ila <1/1.000), çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Bağışıklık sistemi hastalıkları
Seyrek: Aşırı duyarlılık
Metabolizma ve beslenme hastalıkları
Yaygın olmayan: Sıvı tutulumu
Psikiyatrik hastalıklar
Yaygın: Depresif duygu durumu, duygu durum değişiklikleri Yaygın olmayan: Libido azalması
Seyrek: Libido artışı
Sinir sistemi hastalıkları Yaygın: Baş ağrısı Yaygın olmayan: Migren
Göz hastalıkları
Seyrek: Kontakt lens intoleransı
Gastrointestinal hastalıklar Yaygın: Bulantı, karın ağrısı Yaygın olmayan: Kusma, diyare
Vasküler hastalıkları
Seyrek: Venöz tromboembolizm (VTE), arteryel tromboembolizm (ATE)
Deri ve deri altı doku hastalıkları
Yaygın olmayan: Döküntü, ürtiker
Seyrek: Eritema nodozum, eritema multiforme
Üreme sistemi ve meme hastalıkları Yaygın: Meme ağrısı, meme hassasiyeti Yaygın olmayan: Memede hipertrofı Seyrek: Vajinal akıntı, memede akıntı
Araştırmalar
Yaygın: Kiloda artış Seyrek: Kilo kaybı
Seçilmiş advers reaksiyonların tanımı
KHK kullanan kadınlarda Özel kullanım uyarıları ve önlemleri bölümünde daha ayrıntılı olarak ele alınmış miyokard infarktüsü, inme, geçici iskemik ataklar, venöz tromboz ve pulmoner emboli dahil olmak üzere arteriyel ve venöz trombotik ve tromboembolik olaylarda artış riski gözlemlenmiştir. KOK kullanan kadınlarda bildirilen, âÖzel kullanım uyarıları ve önlemleriâ bölümünde bahsi geçen ciddi advers olaylar:
Venöz tromboembolik bozukluklar
4.9. Doz aşımı ve tedavisi
Doz aşımına bağlı bildirilen ciddi yan etki yoktur. Görülebilecek belirtiler, bulantı, kusma ve çekilme kanamasıdır. Çekilme kanaması, ilacı yanlışlıkla almaları halinde kız çocuklarında menarştan önce bile görülebilir. Antidotu yoktur ve tedavisi semptomatik olmalıdır.
Sarılık başlangıcı, hepatit, tüm vücutta kaşıntı
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Östrojenler ve progestojenler, fıks kombinasyonlar ATC kodu: G03AA10
Etki mekanizması
Bu östrojen-progestojen kombinasyonu, luteinizan hormonun orta döngü artışını bastırarak yumurtlamayı inhibe etmek, rahim ağzı mukusunu dehidrasyon yoluyla koyultarak sperm için bir bariyer oluşturmak ve endometriyumu implantasyona kapalı hale getirmek suretiyle etki gösterir.
Ruhsatlandırma sonrası güvenlilik çalışması (PASS) VTE tanısı sıklığının düşük östrojen dozlu (<50 μg etinilestradiol) KOK kullanıcılarında yılda 7 ila 10/10000 aralığında olduğu gösterilmiştir. En yeni veriler VTE tanısı sıklığının gebe olmayan KOK kullanmayan kişilerde yılda yaklaşık 4/10000, gebe kadınlarda ya da post partum süreçte ise 20 ila 30/10 000 olduğunu ileri sürmektedir.
KOK kullanımı ile ilişkili VTE riski östrojen bileşeninden kaynaklanır. KOK'ların progesteron bileşeni tarafından VTE riski üzerinde herhangi bir modüle etki ettiği halen tartışılmaktadır. Etinilestradiol/gestoden içeren KOK'ların levonorgestrel içeren KOK'lara kıyasla VTE risk artışını gösteren epidemiyolojik çalışmalar VTE riskinin hiç artmadığını veya 3 kata kadar arttırdığını gösteren farklı sonuçlar bildirmiştir.
KOK'lar gebelikten korumalarının yanı sıra, sahip oldukları bazı olumsuz özellikler dışında (Bkz. Özel kullanım uyarıları ve önlemleri, 4.8. İstenmeyen Etkiler) doğum kontrol yöntemi seçmede yönlendirici olabilecek ek yararlar sunabilmektedir. Sikluslar daha düzenli, kanamalar sıklıkla daha az ağrılı ve daha hafiftir. Kanamaların daha hafif olması demir yetmezliği görülme olasılığını azaltır. Bunların dışında, endometriyum ile ovaryum kanserlerinde azalma gösterilmiştir. Ayrıca, daha yüksek dozlu KOK'ların (0.,05 mg etinilestradiol), ovaryum kistlerinde, pelvik inflamatuvar hastalık, benign meme hastalığı ve ektopik gebelik görülme sıklıklarında azalma sağladığı gösterilmiştir. Bunların düşük doz KOK'lar için de geçerli olduğu henüz gösterilmemiştir.
5.2. Farmakokinetik özellikler
Genel ÖzelliklerGestoden Emilim:
Ağızdan alınan gestoden hızla ve tamamen emilir. Tek alımı takiben yaklaşık 1 saat sonra 4 ng/ml olan en yüksek plazma konsantrasyonlarına ulaşılır. Gestodenin mutlak biyoyararlanımı, uygulanan dozun %99'u olarak belirlenmiştir.
Dağılım:
Gestodenin belirgin dağılım hacmi 0,7 l/kg olarak belirlenmiştir. Gestoden serum albuminine ve seks hormonu bağlayıcı globuline (SHBG) bağlanır. Yaklaşık olarak % 50-70 oranında spesifik olarak SHBG'lere bağlanır ve total serum düzeylerinin yalnızca %l-2si serbest steroid halinde bulunur.
Bağıl dağılım (serbest, albümine bağlı, SHBG'ye bağlı) serumdaki SHBG konsantrasyonlarına bağlıdır. Bağlayıcı proteinin indüklenmesinin ardından, bağlanmamış ve albümine bağlı fraksiyonlar azalırken, SHBG'ye bağlı fraksiyon artar.
Biyotransformasvon:
Biyotransformasyon, steroid metabolizmasının bilinen yolaklarını takip eder. Bilinen farmakolojik olarak aktif metabolit bulunmamaktadır. Serumdan metabolik klerens oranı yaklaşık 0,8 ml/dak/kg olarak belirlenmiştir. Eliminasvon:
Gestoden serum düzeyleri iki fazda azalır. Terminal dispozisyon fazı 12-15 saatlik bir yanlanma ömrü ile karakterizedir. Gestoden, değişmemiş formda değil, yaklaşık 1 günlük bir yarılanma ömrü ile elimine edilen metabolitler olarak atılır. Gestoden metabolitleri yaklaşık 6: 4 olan idrar/safra oranında atılır.
Doğrusallık / doğrusal olmavan durum:
Günlük REGİNON uygulamasının tekrarlanmasının ardından, serumdaki gestoden konsantrasyonları 2,8 kat artmaktadır. Ortalama serum seviyeleri, tedavi döngüsünün ikinci yarısı boyunca ulaşılan kararlı durum koşullarında dört kat daha fazladır. Gestoden farmakokinetiği SHBG serum seviyelerinden etkilenir. REGİNON ile tedavi sırasında, ilk tedavi döngüsünde serum SHBG seviyelerinde üç katlık bir artış gözlemlenmiştir. Gestoden, SHBG'ye spesifik olarak bağlandığı için SHBG seviyelerindeki artışa neredeyse paralel olarak gestoden serum seviyelerinde artış oluşur. Üç tedavi döngüsünden sonra, döngü başına SHBG indüksiyonunun kapsamı artık değişmez. Etinilestradiol
Emilim:
Oral olarak alınan etinilestradiol hızla ve tamamen emilir. REGİNON'un alınmasının ardından 1,4 saat içinde 82 pg/ml'lik maksimum ilaç seviyesi konsantrasyonuna erişilir. Dağılım:
Etinilestradiol için yaklaşık 5 L/kg'lık görünür dağılım hacmi ve serumdan yaklaşık 5 ml/dak/kg'lik metabolik bir klerens hızı belirlenmiştir. Etinilestradiol, serum albüminine yüksek düzeyde bağlanır ancak spesifik olarak bağlanmaz. Yaklaşık %2'lik ilaç seviyeleri bağlanmamış olarak kalır. Biyotransformasvon:
Etinilestradiol, absorpsiyon ve ilk karaciğer geçişi sırasında metabolize olarak mutlak ve değişken oral biyoyararlanımı azalır. Eliminasvon:
Etinilestradiol serum seviyeleri, 1-2 saat ve yaklaşık 20 saatlik yarı ömür ile karakterize iki aşamada düşer. Analitik nedenlere bağlı olarak bu parametreler ancak daha yüksek dozların uygulanmasından sonra hesaplanabilir.
Değişmeyen ilaç atılmaz. Etinilestradiol metabolitleri, yaklaşık 1 günlük bir yarı ömürle 4:6 olan idrar/safra oranında atılır.
Doğrusallık / doğrusal olmavan durum:
Serum ve günlük alım terminal dispozisyon evresinin yarılanma ömrüne göre, kararlı durum serum seviyelerine 3-4 gün sonra ulaşılmakta olup, kararlı durum seviyeleri tekli bir doza kıyasla %30-40 daha yüksektir.
Laktasyon döneminde, günlük anne dozunun %0,02'si yenidoğana süt ile aktarılabilir.
Etinilestradiolün sistemik yararlanımı, diğer ilaçlarca her iki yönde etkilenebilir. Bununla birlikte, yüksek dozlarda C vitamini ile etkileşim yoktur. Etinilestradiol, sürekli kullanım sırasında SHBG ve CBG'nin (kortikoid bağlayıcı globülin) hepatik sentezini indükler. Ancak SHBG indüksiyonunun kapsamı, kimyasal yapıya ve eşzamanlı olarak uygulanan progestojenin dozuna göre değişir. REGİNON ile tedavi sırasında, serumdaki SHBG konsantrasyonları, 69 nmol/L'den başlayıp birinci döngüde 198 nmol/L'ye ve üçüncü döngüde 210 nmol/l'e yükselmiştir. Serum CBG konsantrasyonları 37 μg/ml'den başlayıp ilk döngüde 85 μg/ml'ye çıkmış ve bundan sonra sabit kalmıştır.
5.3. Klinik öncesi güvenlilik verileri
:Diğer kontraseptif steroidlerle olduğu gibi etinilestradiol ve gestoden kombinasyonu, sıçan karaciğerinde artan neoplastik nodül insidansı ile ilişkilidir. Bunun insanla ilişkisi
bilinmemektedir. Uzun süreli oral kontraseptif kullananlarda nadiren kötü huylu karaciğer tümörleri bildirilmiştir.
İlacı reçete edeni ilgilendirebilecek ve KÜB'ün diğer ilgili bölümlerine henüz dahil edilmemiş olan başka klinik öncesi güvenlik verisi mevcut değildir.
Kan basıncında önemli artış
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Laktoz monohidrat (sığır kaynaklı) Sodyum kalsiyum EDTAMısır nişastası P.V.P(K 30)
Magnezyum stearat Şeker
Talk
Montan glycol wax Kalsiyum karbonat Polietilen glikol 6000 Saf su
6.2. Geçimsizlikler
Geçerli değil.
6.3. Raf ömrü
36 ay
6.4. Saklamaya yönelik özel tedbirler
25°C altındaki oda sıcaklığında saklayınız.
6.5. Ambalajın niteliği ve içeriği
21 ve 63 kaplı tabletlik takvimli Al/PVC blister ambalaj
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller "Tıbbi Atıkların Kontrolü Yönetmeliği" ve "Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir.
 Belsoğukluğu, Chlamydia ve Frengi
Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki
yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve
boğazda enfeksyona sebep olabilir.
Belsoğukluğu, Chlamydia ve Frengi
Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki
yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve
boğazda enfeksyona sebep olabilir. |
 Rahim Boyu ( Serviks ) Kanseri
Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden
sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir.
Rahim Boyu ( Serviks ) Kanseri
Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden
sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| REGINON | 8699828120049 | 169.27TL |
| Diğer Eşdeğer İlaçlar |
 |
Kolon, Rektum yada Bağırsak Kanseri Bağırsak kanseri kolon veya rektumda (arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir şekilde tedavi edilir. |
 |
Dış Gebelik Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur. |
 |
Asperger Sendromu Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde, gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |
İLAÇ GENEL BİLGİLERİ
Koçak Farma İlaç ve Kimya Sanayi A.Ş.
| Satış Fiyatı | 395.17 TL [ 22 Sep 2023 ] |
| Önceki Satış Fiyatı | 395.17 TL [ 15 Sep 2023 ] |
| Original / Jenerik | Jenerik İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699828120056 |
| Etkin Madde | Gestoden + Etinilestradiol |
| ATC Kodu | G03AA10 |
| Birim Miktar | 0,02+0,075 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 63 |
| Ürogenital Sistem ve Cinsiyet Hormonları > Sistemik Hormonal Gebeliği Önleyici İlaçlar > Gestoden + etinilestradiol |
| Yerli ve Beşeri bir ilaçdır. |