REBIF 132 mcg/1.5 ml SC kullanım için enjeksiyonluk çözelti içeren COKLU doz kartuş (4 kartuş) Kısa Ürün Bilgisi
{ Interferon Beta 1a }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
REBİF 132 mikrogram/1.5 mL kartuşta enjeksiyonluk çözelti Steril
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her bir kullanıma hazır 1,5 mL çözelti içeren kartuş 132 mikrogram (36 MIU*) Interferon beta-1a** içerir.
Yardımcı maddeler
:Sodyum hidroksit/sodyum asetat. pH ayarı
Benzil alkol 7,5 mg
Yardımcı maddeler
:
* Milyon Internasyonel Ünite, mevcut uluslararası NIH standardına (GB-23-902-531) dayalı kalibre edilmiş olan firma içi interferon beta-1a standardına dayalı sitopatik etki (CPE) biyoassay ile ölçülmüştür.
** rekombinant DNA teknolojisi ile çin hamster yumurtalık hücrelerinde üretilmiştir.
3. FARMASÖTİK FORMU
Kartuşta enjeksiyonluk çözelti
3,7-4,1 pH ve 250 mOsm/l â 450 mOsm/L osmolaritesi olan berrak-opak çözelti.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
REBİF, alternatif teşhislerin elendiği ve klinik olarak kesinleşmiş yüksek oranda multipl skleroz geliştirme riskine sahip oldukları belirlenen aktif inflamatuvar süreçli klinik izole sendromlu hastaların tedavisinde endikedir (bakınız bölüm 5.1).
REBİF multipl sklerozlu ve son iki yıl içinde 2 ya da daha fazla atak geçirmiş hastaların tedavisinde endikedir (bakınız bölüm 5.1).
Relaps aktivitesi devam etmeyen Sekonder Progresif Multipl Sklerozlu hastalarda etkisi gösterilmemiştir (bakınız bölüm 5.1).
4.2. Pozoloji ve uygulama şekli
Tedavi bu hastalığın tedavisinde uzman bir hekim tarafından yürütülmelidir.
REBİF ile tedaviye başlayan hastalar için, REBİF 8,8 mikrogram ve REBİF 22 mikrogram tedavinin ilk ayı için hasta ihtiyacını karşılayan bir ambalajda mevcuttur.
Pozoloji/uygulama sıklığı ve süresi:
REBİF ile tedaviye ilk başlarken, istenmeyen etkisi olan taşiflaksiyi engellemek için hastalarda tedaviye subkutan olarak 8,8 mikrogram doz ile başlanması ve aşağıdaki tabloya göre, 4 hafta boyunca hedeflenen doza kadar dozun artırılması önerilir:
| Önerilen titrasyon (nihai dozun %'si) | REBİF 44 mikrogram için titrasyon dozu haftada 3 kez |
1-2 . haftalar | % 20 | 8,8 mikrogram |
3â4 . haftalar | % 50 | 22 mikrogram |
5. hafta ve sonrası | % 100 | 44 mikrogram |
İlk demiyelinizan olay
İlk demiyelinizan olay yaşayan hastalarda pozoloji, subkutan enjeksiyon yoluyla uygulanan haftada 3 kez 44 mikrogram REBİF'tir.
Relaps gösteren multipl skleroz
REBİF'in tavsiye edilen pozolojisi, subkütan enjeksiyon ile haftada 3 kez verilen 44 mikrogramdır. Yine, subkütan enjeksiyon ile haftada 3 kez verilen REBİF 22 mikrogram, tedaviyi yürüten uzman tarafından daha yüksek dozu tolere edemediği düşünülen hastalar için önerilir.
Uygulama şekli:
REBİF kartuşta subkütan enjeksiyonluk çözeltisi, multidoz kullanım için tasarlanmıştır ve hastanın ve/veya bakımından sorumlu kişinin yeterli eğitimi sonrası sadece RebiSmart elektronik enjeksiyon cihazı ile kullanılmalıdır.
Uygulama için, kullanma talimatında yer alan talimatları ve RebiSmart ile sağlanan kullanım kılavuzu takip edilmelidir.
REBİF uygulamasına eşlik eden grip benzeri semptomları azaltmak için, enjeksiyon öncesinde ve her bir enjeksiyondan sonra 24 saat boyunca antipiretik analjezik alınması tavsiye olunur.
Halen, hastaların ne kadar süreyle tedavi edilmesi gerektiği konusunda yeterli bilgi yoktur. Dört yıldan daha uzun süre devam eden REBİF tedavisinin etkililiği ve güvenliliğine dair bilgi yoktur. Hastaların REBİF ile tedavinin başlangıcından sonraki 4 yıllık dönemde en az her 2 yılda bir hekim tarafından değerlendirilmesi ve tedavi eden hekimin uzun süreli tedaviyi her hasta için bireysel olarak değerlendirmesi önerilir.
Özel popülasyonlara ilişkin ek bilgiler Böbrek/karaciğer yetmezliği:
Bu hastalara interferon beta-1a uygulaması sırasında dikkatli olunmalı ve hastalar yakından takip edilmelidirler.
Pediyatrik popülasyon:
REBİF'in etkililiği ve güvenliliği, 12-16 yaşlarındaki gençlerde kanıtlanmamıştır. Halihazırda mevcut güvenlilik verisi bölüm 4.8'de tanımlanmıştır fakat pozoloji üzerine hiçbir öneri yapılamaz.
REBİF'in etkililiği ve güvenliliği, 12 yaşın altındaki gençlerde kanıtlanmamıştır. Sadece çok sınırlı veri mevcuttur. REBİF bu yaş grubunda kullanılmamalıdır.
Geriyatrik popülasyon:
65 yaş grubu hastalar ile yeterince klinik çalışma yapılmamıştır ve bu yaş grubundakilerin genç hastalardan farklı yanıt verip vermediği bilinmemektedir.
4.3. Kontrendikasyonlar
Doğal ya da rekombinant interferon beta'ya, veya bölüm 6.1'de listelenen yardımcı maddelerin birine karşı aşırı duyarlılık
4.4. Özel kullanım uyarıları ve önlemleri
Genel tavsiyeler
Hastalar, interferon beta uygulamasında en sık karşılaşılan, grip benzeri sendrom semptomları dahil olmak üzere istenmeyen etkiler konusunda bilgilendirilmelidir (bakınız bölüm 4.8). Bu semptomlar genellikle tedavinin başlangıcında daha sık görülür ve tedavi sürdükçe sıklık ve şiddeti azalır.
Trombotik mikroanjiopati (TMA)
İnterferon beta içeren ilaçların kullanımı ile ölümcül vakaları da içeren trombotik trombositopenik purpura (TTP) ya da hemolitik üremik sendrom (HUS) olarak ortaya çıkan trombotik mikroanjiopati vakaları rapor edilmiştir. Vakalar, tedavi sırasındaki çeşitli zaman dilimlerinde rapor edilmiş olup, interferon beta tedavisine başladıktan haftalar sonra veya yıllar sonra ortaya çıkabilmektedir. Erken klinik bulgular, trombositopeniyi, yeni başlayan hipertansiyonu, ateşi, santral sinir sistemi semptomlarını (Örn. konfüzyon, parezi) ve bozulmuş böbrek fonksiyonunu içermektedir. TMA'yı hatırlatan laboratuvar bulguları, kan yaymasında azalmış platelet sayısı, hemoliz ve şistositlerin (eritrosit fragmantasyonu) sebep olduğu artmış serum laktat dehidrogenazı (LDH)'dır. Bu sebeple, TMA'nın klinik bulguları gözlemlenirse, kan platelet düzeyleri, serum LDH düzeyi, kan yayması ve böbrek fonksiyonları için ileri testlerin yapılması önerilir. Eğer TMA tanısı konulursa tedavinin (plazma değişimi düşünülerek) derhal uygulanması gerekmektedir ve REBİF tedavisinin hemen kesilmesi önerilmektedir.
Depresyon ve intihar eğilimi
REBİF, özellikle geçmişinde intihar düşüncesi olduğu bilinen, daha önce ya da o anda depresif bozukluğu bulunan hastalarda dikkatle uygulanmalıdır (bakınız bölüm 4.3). Depresyon ve intihar eğiliminin multipl sklerozlu hastalarda daha sık görüldüğü ve interferon kullanımı ile ilişkili olduğu bilinmektedir. REBİF ile tedavi edilen hastaların herhangi bir depresyon semptomunu ve/veya intihar eğilimini, tedavi eden hekime bildirmeleri istenmelidir. Depresyonlu hastalar REBİF ile tedavi edilirken yakından takip edilmeli ve uygun şekilde tedavi edilmelidirler. Gerektiğinde REBİF ile tedavinin kesilmesi düşünülmelidir (bakınız bölüm4.3ve4.8).
Nöbet bozuklukları
REBİF, epileptik nöbet hikayesi olanlarda, anti-epileptik tedavi alanlarda, özellikle epilepsileri anti-epileptiklerle kontrol edilemeyen hastalarda dikkatle uygulanmalıdır (bakınız bölüm 4.5 ve 4.8).
Kalp hastalığı
Anjina, konjestif kalp yetmezliği veya aritmi gibi kalp hastalığı olan hastalar interferon beta- 1a ile tedaviye başlarken klinik durumlarının bozulması açısından yakından takip edilmelidirler. Kardiyak problemleri olan hastalarda interferon beta-1a tedavisiyle ilgili olarak ortaya çıkan grip benzeri sendrom semptomları daha çok rahatsız edici olabilir.
Enjeksiyon yeri nekrozları
REBİF kullanan hastalarda enjeksiyon yerinde nekroz bildirilmiştir (bakınız bölüm 4.8). Enjeksiyon yerinde nekroz riskini en aza indirmek için hastalara:
Aseptik enjeksiyon tekniği kullanmaları
Her dozda enjeksiyon yerini değiştirmeleri önerilmelidir.
Özellikle enjeksiyon yeri reaksiyonları oluşmuşsa, ilacı hastanın kendisine uygulama işlemi belli aralıklarla gözden geçirilmelidir.
Eğer hastanın cildinde enjeksiyon yerinde şişlik ya da sıvı drenajının da eşlik ettiği herhangi bir açılma olursa hastaya REBİF uygulamasına devam etmeden önce hekimine danışması önerilmelidir. Eğer multipl lezyonlar oluşmuş ise iyileşene kadar REBİF tedavisine ara verilmelidir. Tek lezyonu olan hastalar, nekrozun çok yaygın olmaması durumunda tedaviye devam edebilirler.
Karaciğer bozukluğu
REBİF ile yapılan klinik çalışmalarda, hepatik transaminazların düzeylerinde (özellikle alanin aminotransferaz (ALT)) asemptomatik yükselmeler yaygındır ve hastaların %1-3'ünde hepatik transaminaz düzeylerinde normalin üst sınırının 5 katından fazla yükselmeler gelişmiştir. Klinik semptom olmaksızın, serum ALT seviyeleri tedaviye başlanmadan önce, tedavinin 1., 3., ve 6. aylarında ve bundan sonra da periyodik olarak izlenmelidir. ALT normalin üst sınırının 5 katından fazla yükselirse, enzim seviyeleri normale inene kadar REBİF dozunun azaltılması düşünülmelidir. Belirgin karaciğer hastalığı, aktif karaciğer hastalığı klinik bulgusu, alkolizm ya da artmış serum ALT (normalin üst sınırının 2,5 katından fazla) hikayesi olan hastalarda, REBİF'e dikkatlice başlanmalıdır. Sarılık ya da karaciğer bozukluğunun diğer klinik semptomları görülürse REBİF ile tedavi kesilmelidir.
REBİF, diğer interferon beta'lar gibi, akut karaciğer yetmezliğini de içeren şiddetli karaciğer hasarına yol açma potansiyeline sahiptir (bakınız bölüm 4.8). Şiddetli karaciğer hasarı oluşan vakaların çoğu tedavinin ilk 6 ayında oluşmuştur. Seyrek görülen semptomatik karaciğer fonksiyon bozukluğunun mekanizması bilinmemektedir. Özel bir risk faktörü gösterilmiş değildir.
Böbrek ve idrar yolu bozuklukları
Nefrotik sendrom
ve membranöz glomerülopati (MGN) dahil olmak üzere altta yatan nefropatilerin farklı olduğu nefrotik sendrom vakaları bildirilmiştir. Vakalar, tedavi sırasındaki çeşitli zaman dilimlerinde rapor edilmiş olup, interferon beta ile tedaviye başladıktan yıllar sonra ortaya çıkabilmektedir. Özellikle böbrek hastalığı riski yüksek olan hastalarda örn. ödem, proteinüri ve böbrek fonksiyonlarında bozulma gibi erken belirti ve semptomların periyodik olarak izlenmesi önerilmektedir. Nefrotik sendrom derhal tedavi edilmeli ve REBİF tedavisinin kesilmesi düşünülmelidir.
Laboratuvar anormallikleri
İnterferonların kullanımı sırasında laboratuvar bulguları bozulabilir. Bunların insidansı REBİF 44 mikrogram ile tedavide REBİF 22 mikrogram ile olandan biraz daha fazladır. Bu nedenle REBİF tedavisi sırasında multipl skleroz hastalarının takibinde normal olarak uygulanan laboratuvar testlerine ve karaciğer enzim takibine ek olarak, tam kan, lökosit sayımı, trombosit sayımı testlerinin düzenli aralıklarda (1., 3., ve 6. aylarda) ve daha sonra da klinik semptom olmaksızın düzenli aralıklarda yapılması önerilmektedir. Bu izlem REBİF 44 mikrograma başlandığında daha sık olmalıdır.
Tiroid bozuklukları
REBİF ile tedavi olan hastalarda bazen yeni ya da kötüleşen tiroid bozuklukları gelişebilir. Tiroid fonksiyon testleri başlangıçta ve eğer bozuksa tedavinin başlangıcını takiben her 6-12 ayda bir yapılması tavsiye edilir. Şayet testler başlangıçta normalse rutin testlere gerek duyulmaz, fakat tiroid bozukluğunun klinik bulguları görülürse yapılmalıdır (bakınız bölüm 4.8).
Şiddetli böbrek ya da karaciğer yetmezliği ve şiddetli kemik iliği supresyonu
![]()
Şiddetli renal ve hepatik yetmezliği olan ve ileri derecede kemik iliği supresyonu olan hastalara interferon beta-1a uygulaması sırasında dikkatli olunmalı ve hastalar yakından takip edilmelidirler.
Nötralizan antikorlar
İnterferon beta-1a'ya karşı serumda nötralizan antikorlar gelişebilir. Bu antikorların kesin insidansı halen tam olarak belirlenmemiştir. Klinik verilere göre REBİF 44 mikrogramın 24 ile 48 ay arası kullanımından sonra hastaların yaklaşık % 13-14'ünde interferon beta 1a için serum antikorları gelişebilir. Antikorların varlığı interferon beta-1a'ya farmakodinamik cevabı zayıflatabilir (beta-2 mikroglobulin ve neopterin). Antikorların klinik önemi tam kesinleşmemekle beraber, klinik ve MRI değişkenliklerinde azalan etki görülebilir. Hasta REBİF'le tedaviye yetersiz cevap veriyorsa ve nötralizan antikorları varsa, hekim tedaviye devam için fayda/risk oranını değerlendirmelidir.
Serum antikorlarını saptamak için kullanılan yöntemlerin çeşitliliği ve antikor pozitiflik tanımının farklılık göstermesi, farklı ürünler arasındaki antijenitenin karşılaştırılabilmesi olanağını sınırlar.
Multipl sklerozun diğer şekilleri
Sadece yatan multipl skleroz hastalarından elde edilen güvenlilik ve etkililik verileri sınırlıdır. REBİF primer ilerleyici MS'li hastalarda henüz araştırılmamıştır, bu hastalarda kullanılmamalıdır.
Sodyum içeriği
REBİF her dozunda 1 mmol (23 mg)'dan daha az sodyum ihtiva eder, yani esasında âsodyum içermezâ.
Benzil Alkol
REBİF 0,5 mL doz başına 2,5 mg benzil alkol içerir. Benzil alkol alerjik reaksiyonlara neden olabilir.
Solunum semptomları için 3 yaşından küçük hastaları izleyin.
Hamile veya emziren hastalara, zamanla birikip metabolik asidoza neden olabilecek yardımcı madde olan benzil alkolden kaynaklanan potansiyel risk konusunda tavsiyede bulunun. Zamanla birikip metabolik asidoza neden olabilecek yardımcı madde benzil alkolden kaynaklanan potansiyel risk nedeniyle hepatik veya renal bozukluğu olan hastalarda dikkatli kullanın.
Biyoteknolojik tıbbi ürünlerin takip edilebilirliğinin sağlanması için uygulanan ürünün ticari ismi ve seri numarası mutlaka hasta dosyasına kaydedilmelidir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
REBİF (İnterferon beta-1a) ile insanlarda ilaç etkileşimi çalışmaları yapılmamıştır.
İnterferonların insan ve hayvanlarda hepatik sitokrom P450 enzim aktivitesini azalttığı bildirilmiştir. Dar bir tedavi indeksine sahip ve atılımı büyük ölçüde hepatik sitokrom P450 sistemine bağlı olan ilaçlarla (örn. antiepileptikler ve bazı antidepresanlarla) REBİF kombine olarak kullanıldığında dikkatle uygulanmalıdır.
REBİF'in kortikosteroidler veya ACTH ile etkileşimi sistematik olarak çalışılmamıştır. Klinik çalışmalar multipl skleroz hastalarının relapslar sırasında REBİF ve kortikosteroidler veya ACTH alabileceklerini göstermektedir.
Özel popülasyonlara ilişkin ek bilgiler
Etkileşim çalışması yapılmamıştır.
Pediyatrik popülasyon:
Etkileşim çalışması yapılmamıştır.
4.6. Gebelik ve laktasyon
Gebelik kategorisi: B
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Fertil kadınlar uygun kontraseptif yöntemler uygulamalıdırlar. REBİF kullanırken gebe olan ya da gebeliği planlayan hastalara, potansiyel zararları bildirilmeli ve tedavinin kesilmesi düşünülmelidir (bakınız bölüm 5.3). Tedaviye başlamadan önce relaps oranı yüksek olan hastalarda, gebelik durumunda REBİF'in kesilmesini takiben şiddetli relaps riskinin, olası artan düşük riskine karşı değerlendirilmesi gereklidir.
Gebelik dönemi
Kayıtlardan ve pazarlama sonrası deneyimlerden elde edilen büyük miktarda veri (1.000'in üzerinde hamilelik sonucu), gebelik öncesi ya da gebeliğin ilk üç ayında interferon betaya maruz kalmanın ardından artan konjenital anomali riski olmadığını gösterir. Bununla birlikte, ilk trimesterde maruz kalma süresi belirsizdir. Çünkü, veriler hamilelik sırasında interferon beta kullanımının kontrendike olduğu dönemde toplanmıştır ve hamilelik tespit edildiğinde ve/ veya doğrulandığında tedavinin kesilmiş olması muhtemeldir. İkinci ve üçüncü trimesterde maruz kalma deneyimi çok sınırlıdır.
Hayvan verilerine göre (bkz. Bölüm 5.3), spontan düşük için muhtemel bir artış riski vardır. İnterferon betaya maruz kalan gebe kadınlarda spontan düşük olma riski, halihazırda mevcut olan verilere dayanarak yeterince değerlendirilememektedir. Ancak, veriler şu ana kadar artan bir risk önermemektedir.
Sınırlı sayıda (1.000'in üzerinde hamilelik sonucu) gebelikte maruz kalma olgularından gelen veriler, REBİF'in gebelik üzerinde ya da fetusun/yeni doğan çocuğun sağlığı üzerinde advers etkileri olduğunu göstermemektedir. Bugüne kadar herhangi önemli bir epidemiyolojik veri elde edilmemiştir. Hayvanlar üzerinde yapılan çalışmalar, gebelik /ve-veya/ embriyonal/fetal gelişim /ve-veya/ doğum /ve-veya/ doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (bkz. kısım 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.
İlacın kullanımına karar verirken, anne ve çocuk üzerindeki olası riski ve yararı dikkate alınmalıdır.
Laktasyon dönemi
İnterferon beta-1a'nın anne sütüne geçişiyle ilgili sınırlı bilgi, interferon betanın kimyasal/ fizyolojik özellikleri ile birlikte, insan sütüne geçen interferon beta-1a seviyelerinin ihmal edilebilir olduğunu göstermektedir. Emzirilen yenidoğan/ bebek üzerinde zararlı bir etki beklenmemektedir.
Hastanın interferon beta-1a tedavisine olan tıbbi ihtiyacı ile birlikte emzirmenin yararı ve potansiyel riski göz önünde bulundurulmalıdır.
Üreme yeteneği / Fertilite
Maymunlarda bir embriyo/fetal toksisite çalışmasında reprodüktif bozukluk oluşturduğuna ilişkin bir kanıt bulunmamıştır. Diğer alfa ve betalarla olan gözlemlere dayanarak düşük riskinde artış olması ihtimali göz ardı edilemez. İnterferon beta-1a'nın erkek fertilitesi üzerine etkileri konusunda herhangi bir bilgi yoktur.
4.7. Araç ve makine kullanımı üzerindeki etkiler
İnterferon kullanımına bağlı merkezi sinir sistemiyle ilgili advers etkiler (ör.sersemlik hali), hastaların sürücülük yapmalarını ve makine kullanmalarını etkileyebilir (bakınız bölüm 4.8). Bu hastalar dikkat gerektiren tehlikeli işler yapmamaları konusunda uyarılmalıdır.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti
tedavi ile sıklığı azalır. REBİF ile tedavi edilen hastaların yaklaşık %70'inde, tedavinin başlamasından sonraki ilk 6 ay içinde tipik interferon grip benzeri sendrom görülmesi beklenebilir. Ayrıca yaklaşık %30 hastada, daha çok hafif enflamasyon ve eritem olmak üzere enjeksiyon yeri reaksiyonu görülebilir. Karaciğer fonksiyonlarının laboratuvar değerlerinde asemptomatik artış ve lökosit sayısında azalma da sık görülmektedir.
İnterferon beta-1a ile gözlenen istenmeyen etkilerin çoğunluğu genellikle hafif ve geri dönüşlü olup, doz azaltılmasına iyi yanıt verir. Kalıcı veya şiddetli istenmeyen etkiler söz konusu olduğunda hekimin değerlendirmeleri çerçevesinde, REBİF'in dozu geçici olarak azaltılabilir ya da tedavi kesilebilir.
4.8. İstenmeyen etkiler
Sunulan istenmeyen etkiler, klinik çalışmaların yanı sıra pazarlama-sonrası bildirimlerden tespit edilmiştir (bir yıldız [*] pazarlama-sonrası gözetim esnasında tanımlanan istenmeyen etkileri gösterir). Aşağıdaki tanımlar bundan sonra kullanılan sıklık terminolojisi için geçerlidir.
Çok yaygın (≥ 1/10), yaygın (≥ 1/100 ila < 1/10), yaygın olmayan (≥ 1/1000 ila < 1/100), seyrek (≥ 1/10000 ila < 1/1000), çok seyrek (< 1/10000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Kan ve lenf sistemi hastalıkları
Çok yaygın: Nötropeni, lenfopeni, lökopeni, trombositopeni, anemi
Seyrek: Trombotik trombositopenik purpura/hemolitik üremik sendromu içeren trombotik mikroanjiyopati* (interferon beta ürünleri için sınıf etkisi, bakınız bölüm 4.4), pansitopeni* Bilinmiyor: Hemolitik anemi
Bağışıklık sistemi hastalıkları
Seyrek: Anafilaktik reaksiyonlar*
Endokrin hastalıklar
Yaygın olmayan: Çoğunlukla hipotiroidizm ya da hipertiroidizm olarak ortaya çıkan tiroid disfonksiyonu.
Psikiyatrik hastalıklar Yaygın: Depresyon, uykusuzluk Seyrek: İntihar girişimi*
Sinir sistemi hastalıkları
Çok yaygın: Baş ağrısı
Yaygın olmayan: Epileptik nöbetler *
Bilinmiyor: Multipl skleroz alevlenmelerini taklit eden geçici nörolojik semptomlar (yani hipoestezi, kas spazmı, parestezi, yürümede zorluk, muskuloskeletal katılık)*
Göz hastalıkları
Yaygın olmayan: Retinal vasküler hastalıklar (örn. retinopati, pamuksu lekeler ve retinal atardamarın veya toplardamarın tıkanması)*
Vasküler hastalıklar
Yaygın olmayan: Tromboembolikolaylar*
Solunum, göğüs bozuklukları ve mediastinal hastalıklar
Yaygın olmayan: Dispne*
Bilinmiyor: Pulmoner arteriyel hipertansiyon* (interferon beta ürünleri için sınıf etkisi, aşağıdaki pulmoner arteriyel hipertansiyon açıklamasına bakınız)
Gastrointestinal hastalıklar
Yaygın: Diyare, bulantı, kusma
Hepato-biliyer hastalıkları
Çok yaygın: Asemptomatik transaminaz artışı Yaygın: Ciddi transaminaz yükselmeleri
Yaygın olmayan: Sarılık ile veya sarılık olmaksızın hepatit*
Seyrek: Karaciğer yetmezliği*(ayrıca bakınız bölüm 4.4), otoimmun hepatit*
Deri ve deri altı doku hastalıkları
Yaygın: Kaşıntı, döküntü, eritematöz döküntü, makülo-papüler döküntü, alopesi* Yaygın olmayan: Ürtiker*
Seyrek: Quincke ödem (anjioödem)*, eritema multiforme*, eritema multiforme benzeri deri reaksiyonları*, Stevens-Johnson sendromu*
Kas-iskelet bozukluklar, bağ doku ve kemik hastalıkları
Yaygın: Miyalji, artralji
Seyrek: İlaca bağlı lupus eritematozus*
Böbrek ve idrar yolu hastalıkları
Seyrek: Nefrotik sendrom*, glomerüloskleroz* (bakınız bölüm 4.4)
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Çok yaygın: Enjeksiyon yerinde enflamasyon, enjeksiyon yeri reaksiyonu, grip benzeri semptomlar
Yaygın: Enjeksiyon yerinde ağrı, yorgunluk, sertlik, ateş
Yaygın olmayan: Enjeksiyon yerinde nekroz, enjeksiyon yerinde kitle, enjeksiyon yerinde apse, enjeksiyon yeri enfeksiyonları*, terlemede artış *
Seyrek: Enjeksiyon yerinde selülit*
Sıklığı bilinmiyor: Panikülit (enjeksiyon yerinde olmuştur)
Pediyatrik popülasyon
Resmi klinik çalışma ya da farmakokinetik çalışmalar çocuklarda ve gençlerde yapılmamıştır. Yine de sınırlı sayıda yayınlanmış veriler haftada 3 kez subkütan REBİF 22 mikrogram veya
44 mikrogram kullanan 12-16 yaşlarındaki gençlerde görülen güvenlilik profilinin erişkinlerde görülene benzer olduğunu göstermektedir.
İnterferon sınıf etkisi
İnterferonların uygulanması; anoreksi, baş dönmesi, anksiyete, aritmi, vazodilasyon ve çarpıntı, menoraji ve metroraji ile ilişkilendirilmiştir.
İnterferon beta ile tedavi sırasında artmış otoantikor oluşumu ortaya çıkabilir.
Pulmoner arteriyel hipertansiyon
İnterferon beta ürünleri ile pulmoner artiyel hipertansiyon (PAH) vakaları bildirilmiştir. Vakalar, interferon beta ile tedaviye başladıktan sonra birkaç yıla kadar olmak üzere çeşitli zaman noktalarında rapor edilmiştir.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
Doz aşımı durumunda, hasta gözlem amacıyla hastaneye yatırılmalı ve uygun destek tedavisi uygulanmalıdır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: İmmunostimülanlar, İnterferonlar ATC kodu: L03AB07
İnterferonlar immünomodulatör, antiviral ve antiproliferatif özelliklere sahip bir endojen glikoproteinler grubudur.
REBİF (interferon beta-1a) endojen insan interferon betası ile aynı aminoasit dizilişini paylaşır. Memeli hücrelerinde (Çin Hamsteri Yumurtalığı) üretilir ve bu nedenle doğal protein gibi glikozile olur.
Bildirilen farmakodinamik değişiklikler, dozun uygulama yoluna bakmaksızın, REBİF'in uygulanması ile ortaya çıkar. Tek doz sonrası, 2'5' OAS sentetazın serum ve intraselüler aktivitesi ve neopterin ile beta-2 mikroglobulinin serum konsantrasyonları 24 saat içerisinde artar ve 2 gün içerisinde de düşmeye başlar. İntramüsküler ve subkütan uygulamalar tamamiyla eşdeğer cevaplara yol açar. 4 doz için her 48 saatte bir tekrarlanan subkütan uygulamadan sonra, bu biyolojik tepkiler, tolerans gelişiminin hiçbir belirtisi olmadan, yüksek kalır.
Biyolojik yanıt göstergeleri (örn., 2'5' OAS aktivitesi, neopterin ve beta 2 mikroglobulin), sağlıklı gönüllülere ve multipl skleroz hastalarına subkütan uygulamanın ardından interferon beta 1a tarafından düşürülür. Tek bir subkütan enjeksiyonun ardından pik konsantrasyonlara kadarki zaman neopterin, beta 2 mikroglobulin ve 2'5' OAS için 24 ila 48 saat, MX1 için 12 saat ve OAS1 ve OAS2 gen ekspresyonları için 24 saat olmuştur. İlk ve altıncı uygulamanın ardından bu göstergeler için benzer yükseklikte ve zamanda pikler gözlenmiştir.
REBİF'in multipl sklerozdaki tam etki mekanizması halen araştırılmaktadır.
Multipl sklerozu düşündüren tek klinik olay
REBİF ile multipl skleroza bağlı demiyelinizasyonu düşündüren tek klinik olay yaşamış hastalarla iki yıllık kontrollü bir klinik çalışma yapılmıştır. Çalışmaya katılan hastalar, T2 ağırlıklı MR taramasında en az birinin ovoid veya periventriküler veya infratentoryel olan, en az 3 mm'lik büyüklükte en az iki tane klinik sessiz lezyona sahipti. Hastanın bulgu ve semptomlarını multipl skleroz'dan daha iyi açıklayabilecek diğer hastalıklar dışlanmıştı.
Hastalar, haftada üç kere REBİF 44 mikrogram, haftada bir kere REBİF 44 mikrogram ya da plasebo uygulanacak şekilde çift-kör olarak randomize edilmiştir. Kesin olarak multipl sklerozu doğrulayan ikinci bir klinik demiyelinizan olayda, hastalar ilk randomizasyona sadık kalınarak kör olarak açık etiketli olacak şekilde tavsiye edilen pozoloji olan haftada üç kere REBİF 44 mikrogram'a geçmişlerdir.
Haftada üç kere REBİF 44 mikrogram uygulamasının plaseboya göre etkililik sonuçları, aşağıda verilmektedir:
Parametre İstatistikleri | Tedavi | Plaseboya karşı haftada 3 kez REBİF 44 mikrogram Tedavi Karşılaştırması | |||
Plasebo (n=171) | REBİF 44 mikrogram haftada 3 kez (n=171) | Risk Azaltma | Cox'un orantılı risk oranı [%95 GA] | Log-Rank p-değeri | |
McDonald (2005) Dönüşümü | |||||
Olay sayısı | 144 | 106 |
%51 |
0,49[0,38;0,64] |
<0,001 |
KM tahmini | %85,8 | %62,5 | |||
Klinik Kesin MS'e (KKMS) Dönüşüm | |||||
Olay sayısı | 60 | 33 |
%52 |
0,48[0,31;0,73] |
<0,001 |
KM tahmini | %37,5 | %20,6 | |||
Çift Kör Periodda hasta başına yapılan görüntülemedeki ortalama CUA Lezyonları | |||||
En küçük kare ortalaması (SE) | 2,59 (0,30) | 0,50 (0,06) | %81 | 0,19[0,14;0,26]* | <0,001 |
CI: güven aralığı, CUA: birleştirilmiş benzersiz aktif
* En Küçük Kare Ortalama Oran [% 95 CI]
İlk taramada en az dokuz T2 hiperintense lezyon ve ilk taramadan en az 1 ay sonra alınan takip taramalarında en az bir yeni T2 ya da bir yeni Gd-tutan lezyon kabul etmek daha konservatif bir yaklaşım olmasına rağmen, şu an için yüksek riskli hastanın tanımı iyi yapılmış değildir. Her durumda, tedavi sadece yüksek risk olarak sınıflandırılan hastalar için düşünülmelidir.
Relaps-remisyon gösteren multipl skleroz
REBİF'in etkililiği ve güvenliliği haftada üç kez subkütan uygulanan, 11-44 mikrogram (3-12 milyon IU) arası dozlarda relaps-remisyon gösteren MS'li hastalarda değerlendirilmiştir.
Verilen dozda, REBİF 44 mikrogramın başlangıçta EDSS'si 0-5,0 olan ve önceki 2 yılda en
az 2 atak geçirmiş olan hastalarda klinik relapsların insidansını ve şiddetini (2 yılda yaklaşık
%30) azalttığı gösterilmiştir. 3 ay sonra kesinleşen, EDSS'deki en az bir puan artışı ile tanımlanan, özürlülüğü ilerleyen hastaların yüzdesi, % 39'dan (plasebo) % 27'ye (REBİF 44 mikrogram) azalmıştır. 2 yıl plasebo ile ve sonra 2 yıl daha ya REBİF 22 ya da REBİF 44 mikrogram ile tedavi edilmiş hasta grubuyla kıyaslandığında, 4 yıldan sonra ortalama alevlenme (atak) oranında azalma, REBİF 22 mikrogram ile tedavi edilen hastalarda %22, REBİF 44 mikrogram ile tedavi edilen hastalarda %29'dur.
Sekonder ilerleyici multipl skleroz
2 seneyi takiben klinik ilerleme bulgusu olan fakat 8 hafta boyunca relaps yaşamamış olan, sekonder ilerleyici multipl sklerozlu (EDSS 3-6,5) hastalara 3 yıllık çalışmada, REBİF özürlülüğün ilerlemesi üzerine belirgin bir etki göstermemiştir, ancak relaps oranı yaklaşık
%30 azalmıştır. Şayet hasta popülasyonu 2 alt gruba bölünürse (çalışmaya başlamadan 2 yıl önce relapslı olanlar ve relapssız olanlar olarak), relapssız olan hastalarda özürlülüğe etkisi yoktur, fakat relapslı hastalarda çalışmanın sonunda özürlülüğün ilerlemesi oranı %70'den (plasebo) %57'ye (REBİF 22 mikrogram ve 44 mikrogram sonuçları birlikte) azalmıştır. Hastaların alt gruplarında elde edilen bu sonuçlar dikkatle değerlendirilmelidir.
Primer ilerleyici multipl skleroz
REBİF henüz primer ilerleyici multipl sklerozlu hastalarda araştırılmamıştır, dolayısıyla bu hastalarda kullanılmamalıdır.
5.2. Farmakokinetik özellikler
Genel özellikler
Emilim: Sağlıklı gönüllülerde intravenöz uygulamadan sonra, interferon beta-1a serum düzeyleri dozla orantılı biçimde keskin bir multi eksponansiyel bir düşüş göstermiştir. Başlangıç yarılanma ömrü dakikalar seviyesinde ve terminal yarılanma ömrübir kaç saat düzeyindedir. Subkütan veya intramüsküler yollarla uygulandığında, interferon beta serum seviyeleri düşük kalır, ancak uygulamadan 12-24 saate kadar ölçülebilir düzeylerdedir. REBİF'in intramüsküler veya subkütan uygulamasında eşit derecede interferon beta maruziyetine neden olur.
Dağılım: REBİF'in 22 ve 44 mcg dozlarının tekrarlı subkütan enjeksiyonlarını takiben maksimum konsantrasyonlar tipik olarak 8 saat sonra gözlemlenmiştir, ancak bu yüksek derecede değişkendir.
Biyotransformasyon: İnterferon beta-1a esas olarak karaciğer ve böbreklerde metabolize olur ve atılır.
Eliminasyon: Sağlıklı gönüllülerde tekrarlı subkütanöz dozların ardından temel farmakokinetik parametreler (EAAve C) dozun 22 mcg'dan 44 mcg'a artması ile orantılı olarak artmıştır. Beklenen görünür yarı ömür 50 ila 60 saattir. Bu da çoklu dozlamın ardından gözlenen birikim ile uyumludur.
5.3. Klinik öncesi güvenlilik verileri
Geleneksel güvenlilik farmakolojisi, tekrarlanan doz toksisitesi, ve genotoksisite çalışmalarına dayanan klinikdışıverile rinsanlariçinözelbirtehlike ortaya koymamaktadır.
REBİF karsinojenisite açısından araştırılmamıştır.
Maymunlarda bir embriyo/fetal toksisite çalışmasında reprodüktif bozukluk oluşturduğuna ilişkin bir kanıt bulunmamıştır. Diğer alfa ve beta interferonların hayvan çalışmalarında artan düşük riski rapor edilmiştir. İnterferon beta-1a'nın erkek fertilitesi üzerine etkileri konusunda herhangi bir bilgi yoktur.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
D-Mannitol Poloksamer 188 L-metiyonin Benzil alkol Sodyum asetat
Asetik asit (pH ayarı için) Sodyum hidroksit (pH ayarı için) Enjeksiyonluk su
6.2. Geçimsizlikler
Geçerli değildir.
Raf-ömrü
18 ay
İlk enjeksiyondan sonra 28 gün içinde kullanın.
6.4. Saklamaya yönelik özel tedbirler
2-8ï°C'de buzdolabında saklanmalıdır. Dondurulmamalıdır. Işıktan korumak için kartuş orijinal ambalajında saklanmalıdır.
Kullanıma hazır Rebif kartuşu içeren RebiSmart cihazı buzdolabında cihaz saklama kabında saklanmalıdır.
Geçici olarak soğutucu mevcut olmadığında, REBİF hasta tarafından 14 güne kadar 1 kere için 25ï°C'nin altında saklanabilir, sonra buzdolabına geri koyulmalı ve son kullanma tarihinden önce kullanılmalıdır.
6.5. Ambalajın niteliği ve içeriği
1,5 mL enjeksiyonluk çözelti içeren piston tıpa (kauçuk) ve kıvrımlı kapak (aluminyum ve halobutil kauçuk) ile kartuş (Tip I cam). Paket 4 veya 12 kartuş içerir.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Önceden doldurulmuş kartuştaki enjeksiyonluk çözelti, Rebismart elektronik enjeksiyon cihazı ile kullanıma hazırdır.
Çoklu doz kullanımı içindir. Sadece, bozulma belirtisi olmayan ve içinde partikül bulunmayan, berrak ve opak solüsyon kullanılmalıdır.
Uygulama yolu ve metodu:
REBİF deri altı enjeksiyon için tasarlanmıştır.
İlk enjeksiyon uygun nitelikte bir sağlık çalışanının gözetimi altında yapılmalıdır. Yeterli eğitimi aldıktan sonra, kendiniz ya da aileden biri ya da bir arkadaşınız evde ilacı uygulamak için REBİF kartuşlarını cihazınız ile kullanabilirsiniz.
Kartuş RebiSmart elektronik enjeksiyon cihazı ile kullanılır.
Kullanım için talimatlar cihazınız ile sağlanır. Lütfen dikkatle takip ediniz.
REBİF kartuşlarının RebiSmart cihazı ile kullanımı hakkında kısa talimatlar aşağıda verilmiştir.
Başlamadan önce:
Ellerinizi su ve sabunla yıkayınız.
REBİF kartuşu blister ambalajından, arkasındaki plastik kapağı açarak çıkarınız.
Kartuşun RebiSmart cihazının içinde ya da ambalajında iken kazara donmuş olup olmadığını (sadece buzdolabın içinden çıkardıktan sonra) kontrol ediniz. Gözle görünür bozulma işareti ve parçacık olmayan, sadece berrak ve opak çözelti kullanılmalıdır.
Cihaza kartuşu yerleştirmek ve enjeksiyonu sağlamak için, cihazınız ile sağlanan kullanım talimatını takip ediniz.
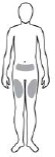
REBİF nereye enjekte edilir:
| NOT: Şişlik, beze veya ağrı hissettiğiniz bölgelere enjeksiyon uygulamayınız; böyle bir bulguda doktorunuzla veya hemşirenizle konuşunuz. |
Enjeksiyon yerini seçiniz. Doktorunuz size olası enjeksiyon yerlerini önerecektir (üst uyluklar ve alt karın uygun bölgeler arasındadır). Enjeksiyon yeri nekrozu riskini en aza indirmek amacıyla, aynı yere sıklıkla enjeksiyon yapılmaması için, enjeksiyon yerinizi düzenli olarak değiştirmeniz ve dikkatle takip etmeniz önerilir.
Enjeksiyon öncesi, enjeksiyon yerindeki deriyi temizlemek için alkollü bez kullanınız. Deriyi kurumaya bırakınız. Deride alkol kalmışsa acıma hissi duyabilirsiniz.
REBİF nasıl enjekte edilir:
 Gıda Alerjisi
Her yıl milyonlarca insan yiyeceklere alerji gösteriyor.
Gıda Alerjisi
Her yıl milyonlarca insan yiyeceklere alerji gösteriyor. |
 Doğum Sonrası Depresyonu
Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından
tecrübe edilen stresli bir durumdur.
Doğum Sonrası Depresyonu
Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından
tecrübe edilen stresli bir durumdur. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| REBIF | 8699777950360 | 13,536.30TL |
| Diğer Eşdeğer İlaçlar |
 |
Ruh ve Akıl Sağlığımızı Geliştirmek İyi akıl ve ruh sağlığı sahip olmaktan ziyade, yaptığınız şeylerdir. Akıl ve ruhsal olarak sağlıklı olmak için kendinize değer vermeli ve kendinizi kabul etmelisiniz. |
 |
Travma Sonrası Bunalımı Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir. |
 |
Kolon, Rektum yada Bağırsak Kanseri Bağırsak kanseri kolon veya rektumda (arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir şekilde tedavi edilir. |
İLAÇ GENEL BİLGİLERİ
Merck İlaç Ecza ve Kimya Ticaret AŞ
| Geri Ödeme Kodu | A17412 |
| Satış Fiyatı | 13536.3 TL [ 26 Apr 2024 ] |
| Önceki Satış Fiyatı | 13536.3 TL [ 22 Apr 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699777950360 |
| Etkin Madde | Interferon Beta 1a |
| ATC Kodu | L03AB07 |
| Birim Miktar | 132/1,5 |
| Birim Cinsi | MCG/ML |
| Ambalaj Miktarı | 4 |
| Antineoplastik ve İmmünomodülatör Ajanlar > İmmünostimülan İlaçlar > İnterferon Beta1a |
| İthal ( ref. ülke : Yunanistan ) ve Beşeri bir ilaçdır. |