LYMUNIR 100 mg 50 yumuşak kapsül Kısa Ürün Bilgisi
{ Siklosporin }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
LYMUNİR 100 mg yumuşak kapsül
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Her bir yumuşak kapsül;
Etkin madde
Siklosporin 100 mg
Yardımcı maddeler
Makrogolgliserol hidroksistearat⦠410 mg Susuz etanol 125 mg Yardımcı maddeler için bölüm 6.1'e bakınız.
3. FARMASÖTİK FORMU
Yumuşak kapsül.
Oblong, grimsi renkte opak yumuşak kapsüldür.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Transplantasyon endikasyonları Organ transplantasyonu
Böbrek, karaciğer, kalp, akciğer, kalp-akciğer birlikte veya pankreasın allojenik
transplantasyonlarında graft reddinin önlenmesinde.
Önceden diğer immünosupressif ilaçlarla tedavi görmüş hastalardaki organ reddinin tedavisinde.
Kemik iliği transplantasyonu
Kemik iliği transplantasyonundan sonra graft reddinin önlenmesinde. Graft-versus-host hastalığının (GVHD) önlenmesinde veya tedavisinde.
4.2. Pozoloji ve uygulama şekli
Oral uygulama için verilen doz aralıkları sadece kılavuz bilgi olarak verilmektedir. LYMUNİR'in günlük dozları mutlaka iki eşit doza bölünerek verilmelidir.
LYMUNİR'in gün içinde alındığı saat ve öğünle ilişki açısından istikrarlı bir planla uygulanması önerilmektedir.
LYMUNİR sadece immünosupresif tedavi ve/veya organ transplantasyonu deneyimi olan bir hekim tarafından ya da böyle bir hekim ile yakın işbirliği içerisinde reçete edilmelidir.
Kişiler arasında emilim ve atılım açısından önemi değişkenlikler ve farmakokinetik ilaç etkileşimleri olasılığı nedeniyle (bkz. Bölüm Diğer tıbbi ürünler ile etkileşimler) dozlar, klinik yanıta ve tolerabiliteye göre kişi bazında titre edilmelidir. Bu transplantasyon hastalarında, yüksek düzeylere bağlı advers etkilerden kaçınmak ve düşük düzeylere bağlı organ reddini önlemek üzere siklosporinin çukur serum düzeylerinin rutin olarak izlenmesi gerekmektedir (bkz. Bölüm Özel kullanım uyarıları ve önlemleri).
Transplantasyon harici endikasyonlar için tedavi edilen hastalarda, beklenmeyen tedavi başarısızlığı ya da relaps durumları haricinde siklosporinin kan düzeylerinin izlemi kısıtlı değere sahiptir; tedavi başarısızlığı ya da relaps durumlarında tedaviye uyumsuzluk, gastrointestinal emilimde bozulma ya da farmakokinetik etkileşimlerden kaynaklanabilecek
çok düşük düzeyler olasılığını tespit etme amacıyla izlem uygun olabilir (bkz. Bölüm Özel kullanım uyarıları ve önlemleri).
LYMUNİR ile tedavinin başlatılmasını takiben, farklı oral siklosporin formülasyonlarının farklı biyoyararlanımları nedeniyle hastalar, siklosporin kan konsantrasyonları, serum kreatinin düzeyleri ve kan basıncı uygun şekilde takip edilmeden başka bir oral siklosporin formülasyonuna transfer edilmemelidir.
Farklı oral siklosporin formülasyonları arasında biyoyararlanım açısından farklılıklar nedeniyle, reçete yazan hekimler, eczacılar ve hastaların, başka bir oral siklosporin formülasyonu ile değiştirilmesinin önerilmediğini anlamaları önemlidir; çünkü bu, siklosporin kan düzeylerinde değişikliklere yol açabilir.
Pozoloji / Uygulama sıklığı ve süresi:
Genel hedef popülasyon:
Transplantasyon
Organ transplantasyonu
LYMUNİR başlangıçta operasyondan önceki 12 saat içinde 10-15 mg/kg dozunda ikiye bölünerek verilmelidir. Bu doza post-operatif dönemde 1-2 hafta boyunca devam edilir. Daha sonra doz kan düzeylerine göre tedricen azaltılarak, ikiye bölünerek verilen 2-6 mg/kg/gün'lük idame dozuna ulaşılır. Siklosporinin serum çukur düzeyleri izlenerek ve böbrek fonksiyonlarına göre doz ayarlanmalıdır.
LYMUNİR diğer immünosupresanlarla birlikte verildiğinde (ör. kortikosteroidlerle birlikte veya üçlü ya da dörtlü ilaç tedavisi içinde yer aldığında), daha düşük dozlar (ör: başlangıç tedavisi ikiye bölünerek verilen 3-6 mg/kg) verilebilir.
Kemik iliği transplantasyonu
Başlangıç dozu, transplantasyondan önceki gün verilmelidir. Bu amaçla çoğu vakada i.v. infüzyon tercih edilir ve önerilen doz günde 3-5 mg/kg'dır. Bu doza, erken posttransplantasyon dönemi esnasında günlük dozu ikiye bölünerek verilen 12,5 mg/kg olan LYMUNİR idame tedavisine geçmeden önce, iki hafta kadar devam edilir. İdame tedavisi dozun transplantasyondan sonraki bir yıl içinde tedricen sıfıra doğru azalmasından önce, en az 3 ay (tercihen 6 ay) devam etmelidir. Başlangıçta LYMUNİR kullanılacaksa önerilen doz, transplantasyondan bir önceki gün başlamak üzere ikiye bölünerek verilen 12,5-15 mg/kg/gün'dür.
Absorbsiyonu azaltabilen gastrointestinal bozukluklarda siklosporinin daha yüksek dozları ya da i.v. tedavinin kullanımı gerekli olabilir.
Bazı hastalarda siklosporinin kesilmesinden sonra GVHD (graft-versus-host hastalığı) meydana gelir ancak, bu genellikle tedavinin tekrarına oldukça iyi cevap verir. Bu gibi
durumlarda, 10 ila 12,5 mg/kg'lık başlangıç oral yükleme dozu verilmeli, bunu takiben, önceden yeterli olduğu bulunmuş olan oral idame dozunun günlük uygulamaları yapılmalıdır. Hafif seyreden, kronik GVHD'nin tedavisinde düşük LYMUNİR dozları kullanılmalıdır.
4.3. Kontrendikasyonlar
LYMUNİR, siklosporine ya da yardımcı maddelerden herhangi birine karşı aşırı duyarlılığı olan hastalarda kullanılmamalıdır.
Hypericum perforatum (Sarı Kantaron) içeren ürünlerle kombinasyon (bkz. Bölüm Diğer tıbbi ürünler ile etkileşimler).
Çoklu ilaç dışa akış (eflü) taşıyıcısı P-glikoprotein veya organik anyon taşıyıcı proteinlerin (OATP) substratları olan ilaçlarla ve yüksek plazma konsantrasyonları ciddi ve/veya yaşamı tehdit edici olaylarla ilişkilendirilen bosentan, dabigatran eteksilat ve aliskiren gibi ilaçlarla kombinasyon (bkz. Bölüm Diğer tıbbi ürünler ile etkileşimler).
4.4. Özel kullanım uyarıları ve önlemleri
Tüm endikasyonlar:Tıbbi gözetim
LYMUNİR sadece, immünosupresif tedavide deneyimli ve laboratuvar güvenlik parametrelerinin kontrolü, düzenli tam fiziksel muayene ile kan basıncı ölçümleri de dahil olmak üzere yeterli takibi sağlayabilen hekimlerin gözetiminde kullanılmalıdır. İlacı kullanan transplantasyon hastaları yeterli donanım, eleman, laboratuar ve tıbbi destek kaynaklarına sahip merkezler tarafından gözetim altında bulundurulmalıdırlar. İdame tedavisinden sorumlu olan hekim, hastanın takibi için tam bir bilgiye sahip olmalıdır.
Lenfomalar ve diğer maligniteler
Diğer immünosupresanlarda olduğu gibi siklosporin lenfoma ve diğer malign olayların özellikle ciltte gelişme riskini artırır. Artan risk spesifik ilaçlardan ziyade immünosupresyonun derecesi ve süresine bağlı olarak ortaya çıkar. Bu nedenle, lenfoproliferatif bozukluklar ve solid organ tümörleriyle birlikte bazılarında ölüm olayları da bildirilen multipl immünosupresan (siklosporin dahil) içeren tedavi şekli dikkatle uygulanmalıdır. (bkz. Bölüm İstenmeyen etkiler).
Deri malignitesi açısından potansiyel risk dikkate alınarak LYMUNİR alan özellikle psöriatik ya da atopik dermatitli hastalar eş-zamanlı olarak aşırı ultraviyole B ışığına maruz kalmamaları ve güneşe maruziyet veya PUVA fotokemoterapiden sakınmaları.konusunda uyarılmalıdır.
Enfeksiyonlar
Diğer immünosupresanlarla olduğu gibi, siklosporin hastalarda oportunistik patojenlerle birlikte değişik bakteriyel, fungal, parazitik ve viral enfeksiyonların oluşmasına neden olur. Siklosporin alan hastalarda, başta BK virüsü nefropatisi (BKVN) olmak üzere Polyomavirüs
ile ilişkili nefropatiye (PVAN) ya da JC virüsü ile ilişki progresif multifokal lökoensefalopatiye (PML) yol açan latent Polyomavirüs enfeksiyonu aktivasyonları gözlenmiştir. Bu rahatsızlıklar sıklıkla yüksek total immünosupresif yük ile ilişkilidir ve renal fonksiyonunda ya da nörolojik semptomlarında bozulma olan immün sistemi baskılanmış hastaların ayırt edici tanısında göz önünde bulundurulmalıdır. Ciddi ve/veya ölümle sonuçlanan vakalar bildirilmiştir. Özellikle uzun süreli çoklu immünosupresif tedavi (siklosporin dahil) gören hastalarda etkin profilaktik ve terapötik stratejiler uygulanmalıdır (bkz. Bölüm İstenmeyen etkiler).
Renal toksisite
LYMUNİR tedavisi sırasında, sık ve potansiyel olarak ciddi bir komplikasyon olarak serum kreatinini ve üre düzeyinde artış meydana gelebilir. Bu fonksiyonel değişiklikler doza bağımlı ve geri dönüşlü olup, genellikle dozun azaltılmasına yanıt verir. Uzun süreli tedavi sırasında, bazı hastalarda böbrekte yapısal değişiklikler gelişebilir (örn., interstisyel fibrozis) ki bu, böbrek nakli hastalarında kronik retten kaynaklanan değişikliklerden ayırt edilmelidir (bkz. Bölüm İstenmeyen etkiler). Düşünülen endikasyon için renal fonksiyonu değerlendiren parametreler yerel kılavuzlara göre yakından izlenmelidir (bkz. Bölüm Pozoloji ve uygulama şekli ve Bölüm Farmakodinamik özellikler).
Hepatotoksisite
LYMUNİR aynı zamanda serum bilirubini ve karaciğer enzimlerinde doza bağımlı, geri dönüşlü artışlara neden olabilir (bkz. Bölüm İstenmeyen etkiler). Siklosporin ile tedavi edilen hastalarda kolestaz, sarılık, hepatit ve karaciğer yetmezliğini de içeren, spontan pazarlama sonrası hepatotoksisite ve karaciğer hasarı raporları alınmıştır. Çoğu rapor önemli ko-morbiditeler, altta yatan hastalıklar ve enfeksiyöz komplikasyonlar ve hepatotoksik potansiyeli olan, eşzamanlı kullanılan ilaçlar gibi diğer komplike edici faktörlere sahip hastaları içermiştir. Başlıca nakil hastaları olmak üzere bazı vakalarda, ölümcül sonuçlar bildirilmiştir (bkz. Bölüm İstenmeyen etkiler). Hepatik fonksiyonu değerlendiren parametrelerde yakın takip gereklidir. Anormal değerler dozda azaltmayı gerektirebilir (bkz. Bölüm Pozoloji ve uygulama şekli ve Bölüm Farmakodinamik özellikler).
Geriatrik popülasyon
Yaşlı hastalarda, böbrek fonksiyonları özel bir dikkatle takip edilmelidir.
Transplantasyon hastalarında siklosporin düzeylerinin izlemi
LYMUNİR transplantasyon hastalarında kullanıldığında, siklosporinin kan düzeylerinin izlemi, önemli bir güvenlilik önlemidir (bkz. Bölüm Pozoloji ve uygulama şekli).
Siklosporinin total kan değerlerini tayin için, ana ilacın ölçümüne elverişli spesifik monoklonal antikor (ana ilacın ölçümü) tercih edilmekle beraber, ana ilacı ölçen bir HPLC metodu da kullanılabilir. Eğer plazma veya serum kullanılırsa standart bir seperasyon protokolü (zaman ve sıcaklık) takip edilmelidir. Karaciğer transplantasyonlu hastaların başlangıçtaki takibinde yeterli immünosupresyon oluşturan dozajı belirlemek için, ya spesifik monoklonal antikorlar kullanılmalı ya da hem spesifik monoklonal antikorlar hem de non-spesifik monoklonal antikorlar kullanılarak paralel ölçümler yapılmalıdır.
Transplant hastaları dışındaki hastalarda siklosporin kan düzeylerinin ara sıra izlenmesi önerilir: örn., LYMUNİR, siklosporinin farmakokinetik özelliklerine etki edebilecek maddelerle bir arada uygulandığında ya da alışılmadık klinik yanıtlar söz konusu olduğunda (örn., etkisizlik veya böbrek fonksiyon bozukluğu gibi artmış ilaç intoleransı).
Kan, plazma veya serumdaki siklosporin konsantrasyonunun, hastanın klinik durumuna katkıda bulunan birçok faktörden sadece biri olduğu hatırlanmalıdır. Bu yüzden sonuçlar, sadece diğer klinik ve laboratuvar parametrelerinin çerçevesinde pozolojiye yol gösterici olarak değerlendirilmelidir (bkz. Bölüm Pozoloji ve uygulama şekli).
Hipertansiyon
LYMUNİR tedavisi esnasında düzenli kan basıncı kontrolleri gereklidir; eğer hipertansiyon gelişirse uygun antihipertansif tedaviye başlanmalıdır (bkz. Bölüm İstenmeyen etkiler). İsradipin gibi, siklosporinin farmakokinetiğine etki etmeyen bir antihipertansif ilaç tercih edilmelidir (bkz. Bölüm Diğer tıbbi ürünler ile etkileşimler).
Kan lipit değerlerinde yükselme
Siklosporinin kan lipid değerlerinde geri dönüşümlü artışa yol açtığı bildirildiğinden, tedavi öncesi ve tedavinin ilk ayı içerisinde lipid düzeylerinin takibi önerilir. Lipid değerlerinde artışa rastlanıldığında diyette yağ alımının kısıtlanması ve uygun görüldüğü takdirde, doz indirimi göz önüne alınmalıdır (bkz. Bölüm İstenmeyen etkiler).
Hiperpotasemi
Siklosporin özellikle renal fonksiyon bozukluğu olan hastalarda hiperpotasemi riskini artırır (bkz. Bölüm İstenmeyen etkiler). Siklosporinin potasyum tutucu diüretiklerle, anjiyotensin dönüştürücü enzim inhibitörleri, anjiyotensin II reseptör antagonistleri ve potasyum içeren ilaçlar ile birlikte kullanımında ve potasyumca zengin diyet uygulanan hastalarda dikkatli olmak gerekmektedir (bkz. Bölüm Diğer tıbbi ürünler ile etkileşimler). Bu gibi durumlarda potasyum düzeylerinin kontrol edilmesi tavsiye edilir.
Hipomagnezemi
Siklosporin magnezyum klerensini artırır. Bu da özellikle perioperatif dönemde semptomatik hipomagnezemiye yol açar (bkz. Bölüm İstenmeyen etkiler). Bu nedenle perioperatif dönemde özellikle nörolojik semptom/belirtilerin varlığında serum magnezyum düzeylerinin kontrol edilmesi tavsiye edilir. Eğer gerekli görülürse ilave magnezyum verilmelidir.
HiperürisemiHiperürisemili hastaların tedavisinde dikkatli olunmalıdır . (bkz. Bölüm İstenmeyen etkiler).
Canlı-zayıflatılmış aşılar
Siklosporin tedavisi sırasında yapılan aşılar; beklenenden daha az etkili olabilir; canlı- zayıflatılmış aşılardan kaçınılmalıdır (bkz. Bölüm Diğer tıbbi ürünler ile etkileşimler).
Etkileşimler
Siklosporin; CYP3A4 ve/veya P-glikoprotein inhibisyonu ya da indüksiyonu yoluyla siklosporin plazma konsantrasyonlarını önemli oranda artıran ya da azaltan ilaçlarla birlikte uygulandığında dikkatli olunmalıdır (bkz. Bölüm Diğer tıbbi ürünler ile etkileşimler).
Siklosporin düzeylerini artıran etkin maddelerle ya da nefrotoksik sinerji gösteren maddelerle bir arada siklosporin kullanımına başlanırken renal toksisite izlenmelidir (bkz. Bölüm Diğer tıbbi ürünler ile etkileşimler).
Siklosporin ve takrolimusun eşzamanlı kullanımından kaçınılmalıdır (bkz. Bölüm Diğer tıbbi ürünler ile etkileşimler).
Siklosporin; CYP3A4, çoklu ilaç dışa akış (eflü) taşıyıcısı P-glikoprotein ve organik anyon taşıyıcı proteinlerinin (OATP) inhibitörüdür ve bu enzim ve/veya taşıyıcının substratları olan, eşzamanlı uygulanan maddelerin plazma düzeylerini yükseltebilir. Siklosporin ile bu tür ilaçlar bir arada uygulanırken dikkatli olunmalıdır ya da eşzamanlı uygulamadan kaçınılmalıdır (bkz. Bölüm Diğer tıbbi ürünler ile etkileşimler). Siklosporin, HMG- CoA redüktaz inhibitörlerine (statinler) maruziyeti artırır.Siklosporin ile bir arada uygulandıklarında statinlerin dozajı düşürülmelidir ve etiketlerindeki öneriler doğrultusunda belirli statinler ile eşzamanlı uygulamadan kaçınılmalıdır. Miyopati belirti ve semptomları olan hastalarda ya da şiddetli böbrek hasarına yatkınlığa sebep olan rabdomiyolize sekonder böbrek yetmezliği gibi faktörleri olan hastalarda statin tedavisinin geçici olarak durdurulması gerekir (bkz. Bölüm Diğer tıbbi ürünler ile etkileşimler).
Siklosporin ile lerkanidipinin eşzamanlı uygulanmasının ardından lerkanidipinin EAA değeri üç kat artmış ve siklosporin EAA'sı yükselmiştir (%21). Bu nedenle siklosporin ile lerkanidipinin eşzamanlı kombinasyonundan kaçınılmalıdır. Lerkanidipinden üç saat sonra siklosporinuygulanması, lerkanidipin EAA değerinde herhangi bir değişiklik sağlamamış, fakat siklosporin EAA değeri %27 yükselmiştir. Dolayısıyla bu kombinasyon dikkatle, en az 3 saat aralıkla verilmelidir.
Etanol
LYMUNİR gebe veya emziren kadınlara, karaciğer hastalığı olanlara ya da epilepsi hastalarına, alkol bağımlısı hastalara verilirken veya bir çocuğa verilecekse etanol içeriği (bkz. Bölüm 2 Kalitatif ve kantitatif bileşim) göz önünde bulundurulmalıdır.
Bu tıbbi üründe hacmin %11,79 si kadar susuz etanol (alkol) vardır; örneğin, her dozda 125 mg'a kadar, her dozda 0,747 mL biraya eşdeğer, her dozda 1,79 mL şaraba eşdeğer gibi.
Alkol bağımlılığı olanlar için zararlı olabilir.
Hamile veya emziren kadınlar, çocuklar ve karaciğer hastalığı ya da epilepsi gibi yüksek risk grubundaki hastalarda dikkate alınmalıdır.
LYMUNİR polioksil hidrojene kastor yağı içermektedir. Bu bileşen bulantı ve diyareye neden olabilir.
Bu tıbbi ürün gliserol içermektedir. Ancak dozu nedeniyle herhangi bir uyarı gerekmemektedir.
Bu tıbbi ürün propilen glikol içermektedir. Ancak dozu nedeniyle herhangi bir uyarı gerekmemektedir.
Otoimmun hastalıklar endikasyonunda ilave uyarılar:
Renal fonksiyon yetmezliği olan hastalarda (belli derecede renal yetmezliği olan nefrotik sendromu olan hastalar hariç) kontrol edilemeyen hipertansiyon, kontrol edilemeyen enfeksiyonlar veya herhangi bir türde malignite durumunda siklosporin uygulanmamalıdır.
Tedaviye başlanmadan önce, en az iki eGFR (tahmini glomerüler filtrasyon hızı) ölçümü ile böbrek fonksiyonunun güvenilir bir başlangıç değerlendirmesi yapılmalıdır. Dozaj ayarlamasına olanak tanımak için tedavi boyunca böbrek fonksiyonu sık sık değerlendirilmelidir (bkz. Bölüm Pozoloji ve uygulama şekli).
Nefrotik sendrom tedavisi dışında, Otoimmun hastalıklar endikasyonunda 16 yaşın altındaki çocuklarda kullanılması önerilmemektedir. Nefrotik sendrom tedavisi dışında, LYMUNİR ile ilgili yeterli deneyim bulunmamaktadır.
Endojen uveitiste ilave uyarılar:
LYMUNİR, nörolojik behçet sendromu olan kişilerde dikkatle kullanılmalıdır. Behçet sendromu olan hastaların nörolojik durumu dikkatle izlenmelidir.
Endojen üveiti bulunan çocuklarda LYMUNİR kullanımıyla ilgili deneyim sınırlıdır.
Nefrotik sendromda ilave uyarılar:
Anormal bazal renal fonksiyonu olan hastalar, başlangıçta 2,5 mg/kg günlük dozla tedavi edilmeli ve çok dikkatli kontrol edilmelidir.
Bazı hastalarda renal fonksiyondaki değişikliklerin nefrotik sendromun kendisine bağlı olması yüzünden, LYMUNİR kaynaklı renal bozukluğun saptanması güç olabilir. Bu, bazı nadir vakalarda serum kreatininde yükselme olmadan, LYMUNİR kaynaklı yapısal böbrek değişikliklerinin görülmesini izah eder. LYMUNİR tedavisinin bir yıldan daha fazla uygulandığı steroid-bağımlı minimal değişiklik nefropatisi olan hastalarda renal biyopsi yapılması düşünülmelidir.
İmmünosupresanlarla tedavi edilen (siklosporin dahil) nefrotik sendromlu hastalarda nadiren malignitelerin (Hodgkin lenfoması dahil) meydana geldiği bildirilmiştir.
Romatoid artritte ilave uyarılar:
6 aylık tedaviden sonra, serum kreatinin hastalığın stabilitesine, aynı zamanda verilmekte olan ilaçlara ve eşlik eden hastalıklara bağlı olarak her 4-8 haftada bir ölçülmesi gereklidir. LYMUNİR dozu artırıldığında veya non-steroid antiinflamatuvar bir ilaçla birlikte tedaviye
başlandığında ya da bu ilaçta doz artırımına gidildiğinde daha sık ölçüm yapılmalıdır (bkz. Bölüm Diğer tıbbi ürünler ile etkileşimler).
LYMUNİR tedavisi esnasında gelişen hipertansiyon uygun antihipertansiflerle kontrol altına alınamazsa LYMUNİR'in kesilmesi gerekebilir (bkz. Bölüm Diğer tıbbi ürünler ile etkileşimler).
Diğer uzun süreli immünosupresif tedavilerde (siklosporin dahil) olduğu gibi lenfoproliferatif hastalıklar riskinin artışı dikkate alınmalıdır. Eğer LYMUNİR metotreksatla kombine olarak kullanılırsa, özel dikkat sarfedilmelidir (bkz. Bölüm Diğer tıbbi ürünler ile etkileşimler).
Psöriazis'de ilave uyarılar:
LYMUNİR tedavisi sırasında, uygun tedavi ile kontrol edilemeyen hipertansiyon geliştiğinde de, LYMUNİR'in kesilmesi tavsiye edilir (bkz. Bölüm Diğer tıbbi ürünler ile etkileşimler).
Yaşlı hastalar, ancak hastanın günlük aktivitelerini engelleyecek boyutta psöriazis varlığında tedavi edilmeli ve renal fonksiyonları özel bir dikkatle takip edilmelidir.
Psöriazisi bulunan çocuklarda LYMUNİR kullanımıyla ilgili deneyim sınırlıdır.
Konvansiyonel immünosupresif tedavidekiler gibi, siklosporin tedavisi altında olan psöriatik hastalarda da malignite gelişimi (özellikle ciltte) bildirilmiştir. Psöriazis için tipik olmayan fakat malign veya premalign olduğundan şüphelenilen deri lezyonlarında LYMUNİR tedavisine başlamadan önce biyopsi yapılmalıdır. Malign veya premalign cilt değişikliği olan hastalarda LYMUNİR uygulaması ancak bu lezyonların uygun tedavisinden sonra etkili tedavi için başka bir seçenek kalmadığı takdirde uygulanmalıdır.
Siklosporin tedavi edilen birkaç psöriatik hastada lenfoproliferatif bozukluklar meydana gelmiştir. Bunlar, ilacın kesilmesiyle ortadan kalkmıştır.
LYMUNİR almakta olan hastalar aynı zamanda ultraviyole B radyasyonu veya PUVA fotokemoterapisi almamalıdır.
Atopik dermatitte ilave uyarılar:
LYMUNİR tedavisi sırasında, uygun tedavi ile kontrol edilemeyen hipertansiyon geliştiğinde de, LYMUNİR'in kesilmesi tavsiye edilir (bkz. Bölüm İstenmeyen etkiler).
LYMUNİR ile atopik dermatitli çocuklardaki deneyimler henüz sınırlıdır.
Yaşlı hastalar, ancak hastanın günlük aktivitelerini engelleyecek boyutta atopik dermatit varlığında tedavi edilmeli ve renal fonksiyon özel bir dikkatle takip edilmelidir.
Benign lenfadenopati sıklıkla atopik dermatitin alevlenmesi ile birliktedir ve hastalıktaki genel iyileşmeyi takiben kendiliğinden düzelir. Siklosporin tedavisi ile ortaya çıkan lenfadenopati düzenli olarak takip edilmelidir. Hastalığın iyileşmesine rağmen devam eden adenopati durumunda lenfoma yokluğundan emin olmak amacıyla biyopsi yapılmalıdır.
LYMUNİR ile tedaviye başlamadan önce aktif herpes simplex enfeksiyonları tedavi edilmelidir. Ancak, tedavi sırasında gelişen bir enfeksiyon ciddi olmadığı sürece ilacın bırakılmasını gerektirmez.
Staphylococcus aureus'a bağlı deri enfeksiyonları, LYMUNİR tedavisi için mutlak bir kontrendikasyon oluşturmamakla beraber, uygun antibakteriyel ilaçlarla tedavi edilmelidir. Siklosporinin kan konsantrasyonlarını artırdığı bilinen (Bkz. Diğer tıbbi ürünler ile etkileşimler bölümü) eritromisin kullanımından kaçınılmalıdır veya eğer başka seçenek yoksa, siklosporinin kan düzeylerinin, renal fonksiyonların ve siklosporine bağlı yan etkilerin yakından izlenmesi önerilir.
LYMUNİR almakta olan hastalar aynı zamanda ultraviyole B radyasyonu veya PUVA fotokemoterapisi almamalıdır.
Modifiye siklosporin formülasyonları non-modifiye formülasyonlara göre daha yüksek biyoyararlanıma sahiptir. Bu nedenle modifiye bir formülasyondan non-modifiye bir formülasyona geçiş siklosporin kan düzeyinde düşmeye neden olacağından ancak doktor gözetiminde yapılmalıdır.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
İlaç etkileşimleri:
Siklosoprin ile etkileşime giren birçok ilaç arasından, etkileşimin kesin olarak ortaya konduğu ve klinik açıdan da önemi taşıyanlar aşağıda sıralanmıştır.
Çeşitli ajanların genellikle siklosporin metabolizmasında yer alan enzimlerin, özellikle CYP3A4'ün inhibisyonu ve indüksiyonu yoluyla plazmadaki ve tüm kandaki siklosporin düzeylerini yükselttiği ya da düşürdüğü bilinmektedir.
Siklosporin ayrıca çoklu ilaç dışa akış taşıyıcısı P-glikoprotein, CYP3A4 ve organik anyon taşıyıcı proteinlerin (OATP) inhibitörüdür ve bu enzim ve/veya taşıyıcıların substratları olan, eş zamanlı uygulanan ilaçların plazma düzeylerini yükseltebilir.
Siklosporinin biyoyararlanımını azalttığı ya da artırdığı bilinen tıbbi ürünler: Transplant hastalarında, özellikle eşzamanlı ilaca başlandığında ya da eşzamanlı ilaç kesildiğinde, siklosporin düzeylerin sık sık ölçülmesi ve gerekli siklosporin dozajında ayarlama yapılması gerekmektedir. Transplant hastaları dışındaki hastalarda kan düzeyi ile klinik etkililik arasındaki ilişki daha az yerleşiktir. Eğer siklosporin düzeylerini yükselttiği bilinen tıbbi
ürünler eşzamanlı veriliyorsa, böbrek fonksiyonun sık değerlendirmesi ve siklosporin ile ilişkili yan etkilerin dikkatli izlemi, kan düzeyi ölçümünden daha anlamlı olabilir.
Siklosporin düzeylerini azaltan etkileşimler:
Tüm CYP3A4 ve/veya P-glikoprotein indükleyicilerinin siklosporin düzeylerini azaltması beklenir. Siklosporin düzeylerini azaltan ilaçlara örnekler:
Barbitüratlar, karbamazepin, okskarbazepin, fenitoin; nafsillin, sulfadimidin i.v; rifampisin; oktreotid; probukol; orlistat, hypericum perforatum (St. John's wort); tiklodipin, sülfinpirazon, terbinafin, bosentan.
Siklosporin kan düzeylerinde azalma ve dolayısıyla etkide azalma riski nedeniyle Hypericum perforatum (Sarı kantaron) içeren ürünler, LYMUNİR ile eşzamanlı kullanılmamalıdır (bkz. Bölüm Kontrendikasyonlar).
Rifampisin, siklosporinin intestinal ve hepatik metabolizmasını indükler. Eşzamanlı uygulama sırasında siklosporindozlarının 3 ila 5 kat artırılması gerekebilir.
Oktreotid,siklosporinin oral emilimini azaltır ve siklosporin dozunda %50'lik artış veya intravenöz uygulamaya geçiş gerekli olabilir.
Siklosporin düzeylerini artıran etkileşimler:
Tüm CYP3A4 ve/veya P-glikoprotein indükleyicileri siklosporin düzeylerininde artışa yol açabilir. Siklosporin düzeylerini artıran ilaçlara örnekler:
Nikardipin, metoklopramid, oral kontraseptifler, metilprednizolon (yüksek doz), allopurinol, kolik asit ve türevleri, proteaz inhibitörleri, imatinib, kolşisin, nefazodon verilebilir.
Makrolid antibiyotikler: Eritromisin, siklosporin maruziyetini 4-7 kat artırabilir ki bu durum bazen nefrotoksisite ile sonuçlanabilir. Klaritromisinin, siklosporin maruziyetini iki katına çıkardığı bildirilmiştir. Azitromisin, siklosporin düzeyini yaklaşık %20 arttırır.
Azol antibiyotikler: Ketokonazol, flukonazol, itrakonazol ve vorikonazol, siklosporin maruziyetini iki kattan fazla artırabilir.
Verapamil, siklosporin kan konsantrasyonlarını 2-3 kat arttırır.
Telaprevir ile birlikte uygulama, siklosporinin doza normalize maruziyetinde (EAA) yaklaşık
4.64 kat artışa neden olmuştur.
Amiodaron, serum kreatininindeki artışla eşzamanlı olarak plazma siklosporin konsantrasyonunu arttırır. Çok uzun yarılanma ömrü (yaklaşık 50 gün) nedeniyle bu etkileşim, amiodaronun çekilmesini takiben uzun bir süre boyunca ortaya çıkabilir.
Danazolun siklosporin kan konsantrasyonlarını yaklaşık %50 arttırdığı bildirilmiştir.
Diltiazem (90 mg/gün dozunda), siklosporin plazma konsantrasyonlarını %50'ye kadar artırabilir.
İmatinib, siklosporin maruziyetini ve Cmaks değerini %20 oranında artırabilir. Diğer ilgili ilaç etkileşmeleri
İlaç ile yiyecek-içecek etkileşimi:
Greyfurt suyu ve greyfurtla birlikte kullanımının siklosporinin biyoyararlanımını artırdığı bildirilmiştir (bkz. Bölüm Pozoloji ve uygulama şekli).
Potansiyel nefrotoksisite artışına yol açan etkileşimler:
Nefrotoksik sinerji gösteren aminoglikozitler (gentamisin, tobramisin dahil), amfoterisin B, siprofloksasin, vankomisin, trimetoprim (+ sulfametoksazol); non-steroid antiinflamatuvar ilaçlar (diklofenak, naproksen, sulindak dahil), melfalan, histamin H2 reseptör antagonistleri (örn. simetidin, ranitidin), metotreksat siklosporinle birlikte kullanılırken dikkat edilmelidir (bkz. Bölüm Özel kullanım uyarıları ve önlemleri).
Başka ilaçlarla birlikte kullanımı, nefrotik sinerji ortaya çıkarabilir. Renal fonksiyonun (başlıca serum kreatinin) yakın monitörizasyonu yapılmalıdır. Eğer renal fonksiyonda anlamlı bir bozulma ortaya çıkarsa birlikte uygulanan ilacın dozu azaltılmalı veya alternatif bir tedavi uygulanmalıdır.
Nefrotoksisite potansiyelindeki artış ve CYP3A4 ve/veya P-glikoprotein aracılığıyla olan etkileşim nedeniyle siklosporinin, takrolimusla birlikte kullanılmasından sakınmak gerekir.
Diğer ilaçların düzeylerinde artışa neden olan etkileşimler:
Siklosporin, aynı zamanda, CYP3A4 enziminin ve birçok ilacın dışa yönelik taşıyıcısı olan P- glikoprotein inhibitörüdür ve organik anyon taşıyıcı proteinleri (OATP) ve birlikte uygulanan ve bu enzimin ve/veya taşıyıcının substratları olan ilaçların plazma düzeylerini artırabilir.
Siklosporin ayrıca digoksin, kolşisin, prednisolon, HMG-CoA redüktaz inhibitörleri (statinler) ve etopozidin klerensini azaltabilir.
Eğer siklosporinle birlikte digoksin, kolşisin veya HMG-CoA redüktaz inhibitörleri (statinler) kullanılırsa ilacın toksik etkilerini erken tespit edebilmek için yakın klinik takip yapılarak gerektiğinde doz azaltılmalı veya ilacın alımı kesilmelidir.
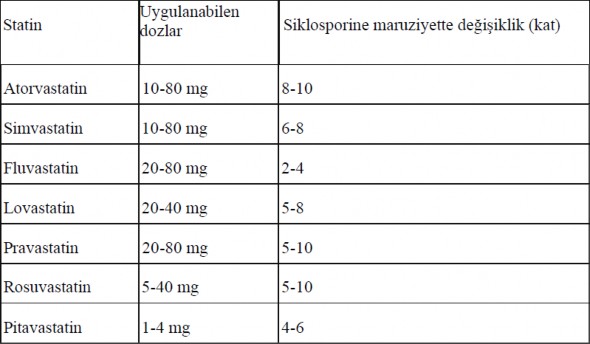
Bu statinler siklosporinle birlikte kullanılacaksa, söz konusu statinlerin dozajı, kısa ürün bilgisi (KÜB) önerileri uyarınca azaltılmalıdır. Siklosporin ile yaygın olarak kullanılan statinlerdeki maruziyet değişiklikleri Tablo 1'de özetlenmiştir. Miyopati belirtileri ve semptomları veren hastalarda veya rabdomiyoliz nedeniyle, böbrek yetmezliği dahil şiddetli böbrek hasarına zemin hazırlayan risk faktörleri mevcut olanlarda statin tedavisinin geçici olarak durdurulması veya statin tedavisinden vazgeçilmesi gerekebilir.
Tablo 1: Yaygın olarak kullanılan statinlerin siklosporin ile maruziyette değişiklikler
Siklosporin ile lerkanidipinin eşzamanlı uygulanmasında dikkatli olunmalıdır (bkz. Bölüm Özel kullanım uyarıları ve önlemleri).
Siklosporin ile bir P-gp substratı olan aliskirenin bir eşzamanlı uygulanması sonrasında aliskirenin Cmaks değeri yaklaşık 2.5 kat ve EAA değeri yaklaşık 5 kat yükselmiştir. Diğer yandan siklosporinin farmakokinetik profili önemli düzeyde değişmemiştir. Siklosporin ile aliskiren birlikte kullanımı önerilmemektedir (bkz. Bölüm Kontrendikasyonlar).
Siklosporinin P-gp inhibitör aktivitesi nedeniyle eşzamanlı dabigatran eteksilatın uygulaması önerilmemektedir (bkz. Bölüm Kontrendikasyonlar).
Nifedipinin siklosporin ile eşzamanlı olarak verilmesi, siklosporin tek başına verildiğinde gözlemlenenden daha yüksek bir gingival hiperplazi oranına neden olabilir.
Diklofenak ile siklosporinin birlikte kullanımının, olası sonuç olarak geri dönüşlü renal fonksiyon yetersizliği ile birlikte diklofenak biyoyararlanımında anlamlı bir artışla sonuçlandığı gözlenmiştir. Diklofenakın biyoyararlanımındaki artış büyük bir olasılıkla yüksek ilk-geçiş etkisinin azalması sonucu olmuştur. Düşük ilk geçiş etkisine sahip NSAİİ'ler (örn: asetilsalisilik asit) siklosporinle birlikte verildiğinde, biyoyararlanımda artış beklenmez.
Mikroemülsiyonluk, tam doz siklosporinin everolimus veya sirolimus ile birlikte kullanıldığı çalışmalarda serum kreatinin düzeylerinin yükseldiği görülmüştür. Siklosporin dozunun azaltılması, bu toksik etkiyi çoğu zaman ortadan kaldırır. Everolimus ve sirolimus, siklosporin
farmakokinetiği üzerinde yalnızca minör etkiye sahiptir. Birlikte siklosporin kullanılması, kandaki everolimus ve sirolimus düzeylerini anlamlı şekilde artırır.
Serum potasyumunda anlamlı artışa neden olabildikleri için potasyum tutucu ilaçlar (örn. potasyum tutucu diüretikler, anjiyotensin dönüştürücü enzim inhibitörleri, anjiyotensin II reseptör antagonistleri) ya da potasyum içeren ilaçlar ile birlikte siklosporin kullanılırken dikkatli olunmalıdır (bkz. Bölüm Özel kullanım uyarıları ve önlemleri).
Siklosporin, repaglinidin plazma konsantrasyonlarını ve bu bağlamda hipoglisemi riskini arttırabilir.
Sağlıklı gönüllülerde bosentan ve siklosporinin eşzamanlı uygulaması sonucunda bosentan maruziyetinde yaklaşık 2 katlık bir artış ve siklosporin maruziyetinde %35'lik düşüş meydana gelmiştir. Bosentan ve siklosporinin eşzamanlı uygulaması önerilmemektedir (bkz. Bölüm Kontrendikasyonlar).
Sağlıklı gönüllülerde ambrisentan ve siklosporinin çoklu doz uygulanması, ambrisentan maruziyetinde yaklaşık 2 katlık bir artışla sonuçlanırken siklosporin maruziyetinde marjinal bir artış olmuştur (yaklaşık %10).
Antrasiklin antibiyotikler (örn. doksorubisin, mitoksantron, daunorubisin) ile çok yüksek dozlarda siklosporinin bir arada uygulandığı onkoloji hastalarında antrasiklin antibiyotiklerin maruziyetinde önemli bir artış gözlenmiştir.
Siklosporin tedavisi sırasında aşılama daha az etkili olabilir ve canlı zayıflatılmış aşıların kullanılmasından kaçınılmalıdır.
Özel popülasyonlara ilişkin ek bilgiler
Özel popülasyonlara ilişkin hiçbir klinik etkileşim çalışması yürütülmemiştir.
Pediyatrik popülasyon
Pediyatrik popülasyona ilişkin hiçbir klinik etkileşim çalışması yürütülmemiştir.
4.6. Gebelik ve laktasyon
Gebelik kategorisi C'dir.
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeline sahip kadınlar için özel öneriler bulunmamaktadır.
Gebelik dönemi
Hayvan çalışmaları, sıçanlarda ve tavşanlarda üreme toksisitesi göstermiştir.
Gebe hastalarda LYMUNİR kullanımına dair makul düzeyde veri mevcuttur. Transplantasyon sonrasında siklosporin ve siklosporin içeren rejimler dahil olmak üzere immünosupresif tedavi uygulanan gebe kadınlar prematüre doğum (<37 hafta) riski altındadır.
Siklosporine in utero maruz kalan yaklaşık 7 yaşa kadar olan çocuklarda yapılan sınırlı sayıda çalışmalar bulunmaktadır. Bu çocuklarda renal fonksiyon ve kan basıncı normal bulunmuştur.
Ancak gebe kadınlarda kullanımla ilgili yeterli ve iyi kontrollü çalışmalar bulunmadığından, LYMUNİR annede beklenen yararın, fetüste beklenen risklerden fazla olduğu durumlar dışında kullanılmamalıdır.
Gebe kadınlarda ayrıca etanol içeriği de göz önünde bulundurulmalıdır (bkz. Bölüm Özel kullanım uyarıları ve önlemleri).
Laktasyon dönemi
Siklosporin anne sütüne geçer. Ayrıca, LYMUNİR formülasyonlarının etanol içeriği de göz önünde bulundurulmalıdır (bkz. Bölüm Özel kullanım uyarıları ve önlemleri). LYMUNİR'in terapötik dozları emziren kadınlara uygulandığı takdirde memedeki çocuk üzerinde etkiye neden olabilecek ölçüde atılmaktadır.
LYMUNİR ile tedavi görmekte olan anneler emzirmemelidir.
LYMUNİR'in emzirilen yenidoğanlarda/bebeklerde ciddi advers ilaç reaksiyonlarına neden olma potansiyeli nedeniyle, bu tıbbi ürünün anne için önemi de dikkate alınarak, emzirmeden mi kaçınılacağı yoksa bu tıbbi ürün kullanımından mı kaçınılacağı yönünde bir karar verilmelidir.
Üreme yeteneği/Fertilite
LYMUNİR'in insan fertilitesi üzerindeki etkisine dair sınırlı veri mevcuttur.
4.7. Araç ve makine kullanımı üzerindeki etkiler
LYMUNİR'in araç ve makine kullanma yeteneği üzerindeki etkisine ait bilgi bulunmamaktadır.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti
Klinik çalışmalarda gözlenmiş olan ve siklosporin uygulaması ile ilişkilendirilen başlıca advers reaksiyonlar arasında böbrek fonksiyonu bozukluğu, tremor, hirsutizm, hipertansiyon, diyare, anoreksi, bulantı ve kusma yer almaktadır.
Siklosporin tedavisiyle ilişkili birçok yan etki doza bağımlı olup doz azaltılmasına yanıt verir. Çoğu endikasyonda yan etkilerin ayrıntılı spektrumu aslında aynı olup yalnız insidans ve şiddetinde farklılıklar mevcuttur. Bu yüksek başlangıç dozlarının ve transplantasyondan sonra gereken uzun idame tedavisinin sonucu olarak transplant hastalarında yan etkiler diğer endikasyonlarda tedavi gören hastalara göre daha sık ve daha şiddetlidir.
İntravenöz uygulamadan sonra anafilaktoid reaksiyonlar gözlenmiştir (bkz. Bölüm Özel kullanım uyarıları ve önlemleri).
Enfeksiyonlar ve Enfestasyonlar
Siklosporin ve siklosporin içeren rejimler dahil olmak üzere immünosupresif tedavi uygulanan hastalarda enfeksiyon (viral, bakteriyel, fungal, parazitik) riski artmıştır (bkz. Bölüm Özel kullanım uyarıları ve önlemleri). Hem yaygın hem de lokalize enfeksiyonlar oluşabilir. Aynı zamanda, daha önceden var olan enfeksiyonlar da şiddetlenebilir ve Polyomavirüs enfeksiyonlarının reaktivasyonu Polyomavirüs ile ilişkili nefropatiye (PVAN) ya da JC virüsü ile ilişkili progresif multifokal lökoensefalopatiye (PML) neden olabilir. Ciddi ve/veya ölümle sonuçlanan vakalar bildirilmiştir.
Benign, malign ve hangi gruba girdiği belirlenmemiş neoplazmalar (kistler ve polipler dahil)
Siklosporin ve siklosporin içeren rejimler dahil olmak üzere immünosupresif tedavi uygulanan hastalarda lenfomaların veya lenfoproliferatif bozuklukların ve özellikle deride olmak üzere diğer malignitelerin gelişme riski artar. Malignitelerin sıklığı tedavinin yoğunluğuna ve süresine bağlı olarak artar (bkz. Bölüm Özel kullanım uyarıları ve önlemleri). Bazı maligniteler ölümcül olabilir.
Klinik çalışmalardan elde edilen advers ilaç reaksiyonları bilgisinin özeti:
Advers ilaç reaksiyonları, en sık görülen advers reaksiyon ilk sırada olacak şekilde sıklıklarına göre aşağıda sıralanmıştır. Her sıklık grubunda advers reaksiyonlar azalan ciddiyet derecesine göre sıralanmıştır.
Çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila <1/100); seyrek
≥1/10.000 ila <1/1000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Kan ve lenf sistemi hastalıkları
Yaygın: Lökopeni
Yaygın olmayan: Anemi, trombositopeni.
Seyrek: Mikro-anjiyopatik hemolitik anemi, hemolitik üremik sendrom. Bilinmiyor*: Trombotik mikroanjiyopati, trombotik trombositopenik purpura
Metabolizma ve beslenme hastalıkları
Çok yaygın: Hiperlipidemi.
Yaygın: Hiperglisemi, anoreksi, hiperürisemi, hiperkalemi ve hipomagnezemi.
Sinir sistemi hastalıkları
Çok yaygın: Tremor, baş ağrısı.
Yaygın: Parestezi, konvülsiyonlar
Yaygın olmayan: Posterior Reversibl Ensefalopati Sendromu (PRES) dahil ensefalopati, konvülsiyonlar, konfüzyon, dezoryantasyon, dış uyarıya cevap vermede azalma, ajitasyon, uykusuzluk, görsel rahatsızlıklar, kortikal körlük, koma, parezi, serebellar ataksi.
Seyrek: Motor polinöropati.
Çok seyrek: Benign kafa içi basınç artışına sekonder olası görme bozukluğuyla birlikte papilla ödemini de içeren optik disk ödemi.
Bilinmiyor*: Migren
Vasküler hastalıklar
Çok yaygın: Hipertansiyon (bkz. Bölüm Özel kullanım uyarıları ve önlemleri). Yaygın: Yüzde kızarma.
Gastrointestinal hastalıklar
Yaygın: Bulantı, kusma, karında rahatsızlık/ağrı, diyare, gingival hiperplazi, peptik ülser
Seyrek: Pankreatit.
Hepato-bilier hastalıklar
Yaygın: Karaciğer fonksiyon bozuklukları. (bkz. Bölüm Özel kullanım uyarıları ve önlemleri).
Bilinmiyor*: Kolestaz, sarılık, hepatit ve karaciğer yetmezliği gibi bazıları ölümle sonuçlanan karaciğer hasarı ve hepatotoksisite (bkz. Bölüm Özel kullanım uyarıları ve önlemleri)
Deri ve deri altı doku hastalıkları
Çok yaygın: Hirsutizm
Yaygın: Akne, hipertrikoz. Yaygın olmayan: Alerjik döküntü.
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları
Yaygın: Kas krampları, miyalji.
Seyrek: Kas zayıflığı ve miyopati.
Bilinmiyor*: Alt uzuvlarda ağrı.
Böbrek ve idrar yolu hastalıkları
Çok yaygın: Renal yetmezlik (bkz. Bölüm Özel kullanım uyarıları ve önlemleri).
Üreme sistemi ve meme hastalıkları
Seyrek: Menstrüel rahatsızlıklar, jinekomasti.
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Yaygın: Yorgunluk, ateş
Yaygın olmayan: Ödem, kiloda artış.
* Reel payda bulunmadığından ADR sıklığının bilinmediği, pazarlama sonrası deneyimden bildirilen advers olaylar.
Belirli advers ilaç reaksiyonlarının tanımı Hepatotoksisite ve karaciğer hasarı:
Siklosporin ile tedavi edilen hastalarda sarılık, hepatit ve karaciğer yetmezliği gibi karaciğer hasarı ve hepatotoksisiteye dair spontan pazarlama sonrası raporları olmuştur. Raporlardan çoğu önemli eşlik eden hastalıkları, altta yatan hastalıkları ya da enfeksiyöz komplikasyonları olan ya da hepatotoksik potansiyele sahip diğer ilaçların bir arada kullanımı gibi değerlendirmeye etki edecek faktörleri olan hastaları içermiştir. Başta transplantasyon hastaları olmak üzere bazı olgularda ölüm sonucu bildirilmiştir (bkz. Bölüm Özel kullanım uyarıları ve önlemleri).
Akut ve kronik nefrotoksisite:
Siklosporin ve siklosporin içeren rejimler dahil olmak üzere kalsinörin inhibitörleri (CNI'lar) ile tedavi görmekte olan hastalar, akut ve kronik nefrotoksisite açısından daha yüksek risk altındadır. Klinik çalışmalardan ve pazarlama sonrası koşullardan LYMUNİR kullanımı ile ilişkili raporlar gelmiştir. Bildirilen akut nefrotoksisite olguları arasında hiperkalemi, hipomagnezemi ve hiperürisemi gibi iyon hemostazı bozuklukları yer almış olup bunlar hastaların büyük kısmında tedavinin ilk ayında gelişmiştir. Kronik morfolojik değişiklikler bildiren olgular arteriolar hiyalinoz, tübüler atrofi ve interstisyel fibrozisi içermiştir (bkz. Bölüm Özel kullanım uyarıları ve önlemleri).
Alt uzuvlarda ağrı:
Siklosporin ile ilişkili olarak izole alt uzuvlarda ağrı vakaları bildirilmiştir. Alt uzuvlarda ağrı aynı zamanda Kalsinörin İnhibitörü İle İndüklenen Ağrı Sendromu (CIPS) kapsamında da not edilmiştir.
Pediatrik popülasyon:
Klinik çalışmalara 1 yaştan daha büyük çocuklar dahil edilmiştir ve standart siklosporin dozajı ile erişkinlere benzer bir güvenlilik profili söz konusu olmuştur.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e-posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99)
4.9. Doz aşımı ve tedavisi
Siklosporinin oral LDdeğeri farelerde 2,329 mg/kg, sıçanlarda 1,480 mg/kg ve tavşanlarda
>1,000 mg/kg'dır. i.v. LDdeğeri ise farelerde 148 mg/kg, sıçanlarda 104 mg/kg ve tavşanlarda 46 mg/kg'dır.
Semptomlar:
Akut siklosporin doz aşımı ile ilgili deneyimler sınırlıdır. 10 g'a kadar (yaklaşık 150 mg/kg) siklosporin oral dozları, kusma, uyku hali, baş ağrısı, taşikardi ve az sayıda hastada orta şiddette ve geri dönüşümlü böbrek fonksiyon bozukluğu gibi minör klinik sonuçlarla tolere edilmiştir. Bununla birlikte, prematüre yenidoğanlarda yanlışlıkla uygulanan parenteral doz aşımını takiben ciddi intoksikasyon semptomları bildirilmiştir.
Tedavi:
Tüm doz aşımı olgularında, genel destekleyici önlemler izlenmeli ve semptomatik tedavi uygulanmalıdır. Oral alımdan sonraki ilk birkaç saat içinde hastanın kusturulması ve gastrik lavaj yararlı olabilir. Siklosporin, büyük oranda diyalizle atılamaz ve karbon hemoperfüzyonu ile de iyi bir düzeyde temizlenmesi mümkün değildir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: İmmünosupresif ajanlar, kalsinörin inhibitörleri ATC kodu: L04A D01
Siklosporin (siklosporin A olarak da bilinmektedir) 11 aminoasitten oluşan bir siklik polipeptiddir. Hayvanlarda allojenik cilt, kalp, böbrek, pankreas, kemik iliği, ince barsak ya da akciğer transplantlarının ömrünü uzatan güçlü bir immunosupressif ajandır.
Çeşitli çalışmalar siklosporinin allograft immünite, geç kutanöz aşırı duyarlılık, deneysel allerjik ansefalomiyelit, Freund adjuvan artriti, graft-versus-host hastalığı (GVHD) gibi hücre- aracılı reaksiyonların gelişmesini ve T-hücresine bağımlı antikor oluşumunu inhibe ettiğini göstermektedir. Aynı zamanda hücre düzeyinde interleukin-2 (T-hücresi büyüme faktörü, TCGF) de dahil olmak üzere, lenfokin üretimini ve serbestlenmesini inhibe etmektedir. Siklosporinin hücre siklusunun Gya da Gfazlarında istirahat halindeki lenfositleri bloke ettiği görülür ve aktif T hücrelerinin antijen uyarımlı lenfokin salınımını inhibe eder.
Eldeki tüm veriler, siklosporinin spesifik olarak ve reversibl bir biçimde lenfositler üzerinde etkin olduğunu göstermektedir. Sitostatik ajanların aksine, siklosporin hemotopoiezisi deprese etmemekte ve fagosit hücrelerin işlevleri üzerinde de etkisi bulunmamaktadır.
Organ reddinin ve GVHD'nin önlenmesi ve tedavisi için siklosporin kullanımıyla, başarılı organ ve kemik iliği transplantasyonları yapılmıştır. Siklosporin, hem Hepatit C Virüsü (HCV) pozitif hem de HCV negatif olan karaciğer nakli yapılmış hastalarda başarılı bir şekilde
kullanılmaktadır. Siklosporin tedavisiyle, immünolojik mekanizmayla olduğu bilinen ya da değerlendirilebilen değişik olgularda da olumlu yanıtlar alındığı gösterilmiştir.
Pediatrik popülasyon: Siklosporinin steroide bağımlı nefrotik sendromda etkili olduğu bulunmuştur.
5.2. Farmakokinetik özellikler
Genel özellikler
Emilim
Oral uygulanmasından sonra siklosporinin doruk kan konsantrasyonlarına 1-2 saat içerisinde ulaşılmıştır. LYMUNİR uygulamasından sonra siklosporinin mutlak oral biyoyararlanımı %20- 50'dir. Siklosporin yüksek oranda yağ içeren bir öğün ile birlikte verildiğinde Eğri Altı Alan (EAA) ve Cmaks değerlerinde yaklaşık %13 ve %33'lük düşüş gözlenmiştir. Siklosporinin uygulanan dozu ile maruziyet (EAA) arasındaki ilişki, terapötik doz aralığında doğrusaldır. EAA ve Cmaks değerlerinde bireysel ve bireyler arası değişkenlik yaklaşık %10-20'dir.
Siklosporin oral alındıktan sonra, i.v. siklosporine göre siklosporinin gün boyunca ölçülen kan düzeyleri (EAA) uygulanan doz ile daha fazla paralellik, daha kararlı bir absorpsiyon profili, yiyeceklerden ve günlük ritimden daha az etkilenme gösterir. Bu özelliklerin birleşmesi sonucunda siklosporinin farmakokinetiğinde aynı hastada gözlenen değişkenlikler azalır ve çukur düzey (tedavi sırasında hasta ilacını almadan hemen önce ölçülen kan düzeyi) ile EAA(kan düzeyi-zaman eğrisinin altıda kalan alan) arasında daha iyi bir korelasyon sağlanır. Eklenen bu üstünlükler sonucunda, siklosporin uygulama zamanlarının ayarlanmasında yemek saatlerini dikkate almak gerekmez. Ayrıca, siklosporin gün boyunca ve idame tedavisi sırasındaki günler arasında daha kararlı kan düzeyleri sağlar.
Siklosporinin i.v. formundan oral siklosporine bire bir geçişte çukur kan düzeylerinin benzer olduğu ve böylece istenen terapötik çukur düzeyi sınırları içinde kalındığı gösterilmiştir. Diğer oral formları ile karşılaştırıldığında, siklosporin oral daha çabuk emilir (1-6 saat arasında pik kan konsantrasyonu elde edilir) (ortalama t1 saat daha kısalır ve ortalama C%59 artar) ve ortalama olarak %29 daha yüksek bir biyoyararlanım gösterir.
Dağılım
Siklosporin kan hacmi dışında 3,5 l/kg ortalama sanal dağılım hacmi ile yaygın bir şekilde dağılma gösterir. Kanda; plazmada %33-47, lenfositlerde %4-9, granülositlerde %5-12 ve eritrositlerde %41-58 oranlarında bulunur. Plazmada yaklaşık %90'ı proteinlere ve daha çok lipoproteinlere bağlı olarak bulunur.
Biyotransformasyon
Siklosporin, büyük oranda yaklaşık 15 kadar metabolitine dönüşür. Tek bir major metabolik yolu yoktur. Metabolizma karaciğerde sitokrom P450'ye bağımlı mono-oksijenaz sistemde (örn. CYP3A4) gerçekleşir ve ana metabolizma yolu molekülün değişik pozisyonlarında mono ve dihidroksilasyon ve N-demetilasyona uğrar. Sitokrom P450'ye bağımlı enzim sistemini
inhibe veya indüksiyona uğratacağı bilinen bileşiklerin siklosporin düzeylerini artıracağı veya azaltacağı gösterilmiştir. Bugüne kadar tanımlanan metabolitlerin ana bileşiğin bozulmamış peptid yapıları olduğu ve bazısının zayıf immünosupresif aktiviteye sahip olduğu (değişmemiş bileşiğin onda biri kadar) bulunmuştur.
Eliminasyon
Eliminasyonu esas olarak safra yolu ile olup, oral dozun yalnız %6'sı idrarla atılmakta ve bunun da ancak %0,1'i değişmemiş halde itrah olmaktadır.
Siklosporinin terminal safhadaki yarılanma ömrü uygulanan miktar tayini yöntemine ve ölçüm yapılan gruba göre yüksek değişkenlik gösterir. Terminal yarılanma ömrü 6,3 saatten (sağlıklı gönüllülerde) 20,4 saate (ağır karaciğer hastalarında) kadar değişir (bkz. Bölüm Pozoloji ve uygulama şekli ve Bölüm Özel kullanım uyarıları ve önlemleri). Böbrek nakli hastalarında eliminasyon yarılanma ömrünün, 4 ila 25 saat aralığında, yaklaşık 11 saat olduğu bulunmuştur.
Hastalardaki karakteristik özellikler
Böbrek yetmezliği:
Son dönem böbrek yetmezliği olan hastalar ile gerçekleştirilen bir çalışmada, sistemik klerensin, böbrekleri normal fonksiyon gösteren hastalardaki ortalama sistemik klerensin yaklaşık üçte ikisi olduğu belirlenmiştir. Uygulanan dozun %1'inden azı diyaliz ile uzaklaştırılmıştır.
Karaciğer yetmezliği:
Karaciğer bozukluğu olan hastalarda siklosporin maruziyetinde yaklaşık 2-3 kat artış gözlenebilir. Biyopsi ile kanıtlanmış sirozu olan şiddetli karaciğer hastalarıyla gerçekleştirilen bir çalışmada terminal yarılanma ömrünün 20,4 saat olduğu gözlenmiştir (aralık 10,8 ila 48,0 saat; aynı değer sağlıklı gönüllülerde 7,4 ila 11,0 saat).
Pediatrik popülasyon:
Siklosporin oral veya siklosporin i.v. verilen pediatrik hastalara dair farmakokinetik veriler çok sınırlıdır. 3-16 yaşındaki 15 renal transplant hastasında intravenöz siklosporin uygulamasından sonra siklosporinin tam kan klirensi 10,6±3.7 ml/dk/kg olmuştur (tayin: Cyclo-trac spesifik RIA). 2-16 yaşlarındaki 7 renal transplant hastası ile gerçekleştirilen bir çalışmada siklosporin klirensi 9,8 ila 15,5 ml/dk/kg aralığında olmuştur. 0,65-6 yaşlarındaki 9 karaciğer transplant hastasında klirens 9,3±5,4 ml/dk/kg bulunmuştur (tayin: HPLC). Erişkin transplant popülasyonları ile karşılaştırıldığında, pediatrik hastalarda oral uygulanan siklosporin ile intravenöz uygulanan siklosporin arasındaki biyoyararlanım farklılıklar, erişkinlerde gözlenenler ile aynıdır.
5.3. Klinik öncesi güvenlilik verileri
Siklosporin standart test sistemlerinde oral uygulama ile (sıçanlarda günlük 17 mg/kg'a kadar ve tavşanlarda günlük 30 mg/kg'a kadar) mutajenik ve teratojenik etki göstermemiştir. Toksik dozlarda (oral olarak sıçanlarda günlük 30 mg/kg ve tavşanlarda günlük 100 mg/kg) prenatal ve postnatal mortalitenin artmasıyla ve ilgili iskelet gerilikleri ile beraber düşük fetus ağırlığı gibi embriyotoksik ve fetotoksik etkileri belirlenmiştir.
Yayınlanmış iki araştırma çalışmasında, in utero siklosporine maruz kalan (subkutan olarak 10 mg/kg/gün) yaşı 35 haftaya kadar olan tavşanlarda azalan sayıda nefronlar, renal hipertrofi, sistemik hipertansiyon ve ilerleyen böbrek yetmezliği kanıtlanmıştır.
Siklosporini intravenöz olarak 12 mg/kg/gün (günde iki defa önerilen insan intravenöz dozu) alan gebe sıçanların ventriküler septal defekt insidansı yüksek olan fetüsleri olmuştur.
Bu bulgular diğer türlerde kanıtlanmamıştır ve insanlarla ilişkisi bilinmemektedir. Erkek ve dişi sıçanlarda yürütülen çalışmalarda fertilitede herhangi bir bozulma gösterilmemiştir.
Siklosporin bir dizi in vitro ve in vivo testte genotoksisite açısından test edilmiş ve klinik açıdan ilgili mutajenik potansiyel kanıtına rastlanmamıştır.
Erkek ve dişi fareler ve sıçanlarda karsinojenite çalışmaları yapılmıştır. Farelerde yapılan 78 haftalık bir çalışmada günlük 1, 4 ve 16 mg/kg dozlarda, dişilerde lenfositik lenfomalar için istatistiksel olarak anlamlı bir eğilimi olduğu kanıtlanmış ve orta dozda, erkeklerde hepatoselüler karsinomaların görülme oranı kontrol değerini aşmıştır. 24 aylık günlük 0,5, 2 ve 8 mg/kg dozlarında yapılan bir sıçan çalışmasında, düşük doz seviyesinde, pankreatik adacık adenomu kontrol hızını anlamlı olarak aşmıştır. Hepatoselüler karsinoma ve pankreatik adacık adenomu doza bağlı değildir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Susuz etanol
α-tokoferol rasemat Gliserol monolinoleat
Makrogolgliserol hidroksistearat Propilen glikol
Jelatin Kapsül Jelatin (sığır jelatini) Gliserin
Propilen glikol Saflaştırılmış su Siyah demir oksit
Titanyum dioksit
6.2. Geçimsizlikler
Yoktur.
6.3. Raf ömrü
24 ay
6.4. Saklamaya yönelik özel tedbirler
25ºC altındaki oda sıcaklığında saklanmalıdır.
LYMUNİR kapsüller kullanılana kadar blister paketinde tutulmalıdır. Bir blister açıldığında, karakteristik bir koku duyulmaktadır. Bu normal bir durum olup, kapsüle ilişkin herhangi bir sorunun varlığına işaret etmemektedir.
6.5. Ambalajın niteliği ve içeriği
Ürünümüz için primer ambalaj malzemesi olarak OPA/ALU/PVC Folyo ve Alüminyum Folyo'dan oluşan blister kullanılmıştır. Bir kutu içerisinde 50 adet kapsül içeren blister ambalajlarda kullanma talimatı ile birlikte sunulmaktadır.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj Atıklarının Kontrolü Yönetmeliğiâ'ne uygun olarak imha edilmelidir.
 HIV ve Aids
HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan
Virüsdür). Bu virüs AIDS hastalığına sebep olur.
HIV ve Aids
HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan
Virüsdür). Bu virüs AIDS hastalığına sebep olur. |
 Ağız Kanseri
Ağız kanserinin en yaygın türleri, dudak, dil, dişetidir. Nadiren
yanak içi veya damak bölgelerini de içine alır.
Ağız Kanseri
Ağız kanserinin en yaygın türleri, dudak, dil, dişetidir. Nadiren
yanak içi veya damak bölgelerini de içine alır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| DEPORES | 8699525610010 | 2,159.66TL |
| DROSPORIN | 8699580190038 | 1,236.62TL |
| EPOSTIN | 8699844611484 | 2,124.07TL |
| LYMUNIR | 8699525193773 | 1,107.89TL |
| OCURIN | 8699569610359 | 673.88TL |
| Diğer Eşdeğer İlaçlar |
 |
Artrit Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında artrit tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
 |
Artrit Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında artrit tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
 |
Lösemi Kan Kanseri Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür. |
İLAÇ GENEL BİLGİLERİ
Deva Holding A.Ş.
| Satış Fiyatı | 1107.89 TL [ 26 Apr 2024 ] |
| Önceki Satış Fiyatı | 1107.89 TL [ 22 Apr 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699525193773 |
| Etkin Madde | Siklosporin |
| ATC Kodu | L04AD01 |
| Birim Miktar | 100 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 50 |
| Antineoplastik ve İmmünomodülatör Ajanlar > İmmünsupresif Ajanlar > Siklosporin |
| Yerli ve Beşeri bir ilaçdır. |