IMNOVID 3 mg 21 sert kapsül Kısa Ürün Bilgisi
{ Pomalidomid }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
IMNOVID 3 mg sert kapsül
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Pomalidomid 3 mg
Yardımcı maddeler
Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
Sert kapsül
IMNOVID 3 mg sert kapsül: Opak koyu mavi kılıflı ve opak yeşil gövdeli, üzeri beyaz renkte âPOML 3 mgâ baskılı, büyüklüğü 1 olan, sert jelatin kapsül.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
IMNOVID, bortezomib ve deksametazon ile kombinasyon halinde, daha önce lenalidomid de dahil olmak üzere en az bir tedavi rejimi alan, bu tedavilere dirençli veya nüks eden multipl miyelomlu erişkin hastaların tedavisinde endikedir.
IMNOVID, deksametazonla kombinasyon halinde, aşağıda belirtilen koşulları taşıyan multipl miyelom tanılı yetişkin hastaların tedavisinde endikedir:
Otolog kök hücre nakline uygun olmayan hastalarda bortezomib ve lenalidomid dahil en az iki dizi tedavi sonrası nüks eden veya bu tedavilere dirençli hastalık varlığında endikedir.
4.2. Pozoloji ve uygulama şekli
Tedavi, multipl miyelom tedavisinde deneyimli bir hekimin denetiminde başlatılmalı ve izlenmelidir.
Klinik veya laboratuvar bulgularına göre doza devam edilebilir veya doz ayarlaması yapılabilir (bkz. Bölüm 4.4).
Pomalidomidin bortezomib ve dekzametazon ile kombinasyonu
Önerilen başlangıç dozu, tekrarlanan 21 günlük sikluslar halinde 1 ve 14. günler arası günde bir defa ağızdan 4 mg IMNOVID'dir.
Pomalidomid, Tablo 1'de gösterildiği gibi bortezomib ve deksametazon ile kombinasyon halinde uygulanır. Bortezomibin önerilen başlangıç dozu Tablo 1'de gösterilen günlerde günde bir kez intravenöz veya subkütan olarak 1,3 mg/m'dir. Önerilen deksametazon dozu, Tablo 1'de gösterilen günlerde günde bir kez oral olarak 20 mg'dır
Bortezomib ve deksametazon ile kombine edilen pomalidomid tedavisi, hastalığın ilerlemesi veya kabul edilemez toksisite oluşana kadar verilmelidir.
Tablo 1. Bortezomib ve deksametazon ile kombinasyon halinde IMNOVID için önerilen dozaj şeması
1-8. Sikluslar | Gün (21 günlük siklus) | ||||||||||||||||||||
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | |
Pomalidomid (4 mg) | ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠|
|
|
|
|
|
|
|
Bortezomib (1,3 mg/m) | ⢠|
|
| ⢠|
|
|
| ⢠|
|
| ⢠|
|
|
|
|
|
|
|
|
|
|
Deksametazon (20 mg) * | ⢠| ⢠|
| ⢠| ⢠|
|
| ⢠| ⢠|
| ⢠| ⢠|
|
|
|
|
|
|
|
|
|
| |||||||||||||||||||||
9. Siklus sonrası | Gün (21 günlük siklus) | ||||||||||||||||||||
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | |
Pomalidomid (4 mg) | ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠| ⢠|
|
|
|
|
|
|
|
Bortezomib (1,3 mg/m) | ⢠|
|
|
|
|
|
| ⢠|
|
|
|
|
|
|
|
|
|
|
|
|
|
Deksametazon (20 mg) * | ⢠| ⢠|
|
|
|
|
| ⢠| ⢠|
|
|
|
|
|
|
|
|
|
|
|
|
75 yaş üstü hastalar için, bkz. Özel popülasyonlara ilişkin ek bilgiler .
Pomalidomid doz ayarlaması veya ara verilmesi
Yeni bir pomalidomid siklusunu başlatmak için, nötrofil sayısının ≥1x10/L ve trombosit sayısının ≥50x 10/L olması gerekmektedir.
Advers reaksiyonlarla ilgili olarak pomalidomid tedavisine ara verilmesi veya dozunun azaltılması ile ilgili bilgiler, Tablo 2'de ve doz seviyeleri Tablo 3'de belirtilmiştir:
Tablo 2. Pomalidomidin doz ayarlaması için bilgiler
Toksisite | Doz ayarlaması |
Nötropeni Febril nötropenik ateş (ateş ≥38,5°C ve MNS <1x 10/L) |
Siklusun geri kalanı için pomalidomid tedavisine ara verilir, haftalık TKS** takibi yapılır. |
MNS* <0,5x10/L veya
| Pomalidomid tedavisine önceki dozdan bir seviye düşük doz ile tekrar başlanır. |
Pomalidomid tedavisine ara verilir. | |
| Pomalidomid tedavisine önceki dozdan bir seviye düşük doz ile tekrar başlanır. |
Trombositopeni |
Siklusun geri kalanı için pomalidomid tedavisine ara verilir, haftalık TKS** takibi yapılır. |
Pomalidomid tedavisine önceki dozdan bir seviye düşük doz ile tekrar başlanır. | |
Pomalidomid tedavisine ara verilir. | |
Pomalidomid tedavisine önceki dozdan bir seviye düşük doz ile tekrar başlanır. | |
Döküntü Döküntü = 2-3. derece |
Doz kesilmesi veya pomalidomid tedavisinin kesilmesi düşünülmelidir. |
Döküntü: 4. derece veya kabarma (anjiyoödem, anaflaktik reaksiyon, eksfolyatif veya büllöz döküntü veya Stevens-Johnson sendromu (SJS), Toksik Epidermal Nekroliz (TEN) veya eozinofili ve sistemik semptomlar (DRESS) ile ilaç reaksiyonu şüphesi varsa) | Tedaviyi kalıcı olarak durdurun (bkz. Bölüm 4.4). |
Diğer
Diğer ≥ 3. derece pomalidomidle ilgili advers reaksiyonlar | Siklusun geri kalanı için pomalidomid tedavisi durdurulur. Bir sonraki döngüde tedaviye önceki dozdan bir seviye düşük doz ile devam edilir (Dozlama başlamadan önce advers reaksiyonlar geçmeli ya da ≤2. dereceye dönmelidir). |
MNS ≥1x 10/L'ye döndüğünde
4.3. Kontrendikasyonlar
Gebelik,
4.4. Özel kullanım uyarıları ve önlemleri
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Diğer tıbbi ürünlere pomalidomidin etkisi
Pomalidomidin, P450 izoenzimlerinin substratları veya taşıyıcıları ile birlikte uygulanmasının, P450 izoenzim inhibisyonu veya indüksiyonu veya taşıyıcı inhibisyonuna bağlı klinik olarak anlamlı farmakokinetik ilaç-ilaç etkileşmelerine neden olması beklenmemektedir. Bu tür ilaç-ilaç etkileşim potansiyeli, pomalidomidin kombine oral kontraseptiflerin farmakokinetiği üzerine potansiyel etkisi dahil olmak üzere, klinik olarak değerlendirilmemiştir (bkz. Bölüm 4.4).
Diğer tıbbi ürünlerin pomalidomide etkisi
Pomalidomid, CYP1A2 ve CYP3A4/5 tarafından kısmi olarak metabolize edilir. Ayrıca P-glikoproteinin de bir substratıdır. Pomalidomidin güçlü CYP3A4/5 ve P-gp inhibitörü olan ketokonazol ile veya güçlü CYP3A4/5 indükleyicisi olan karbamazepin ile eşzamanlı uygulanmasının, pomalidomide maruziyet üzerinde klinik olarak anlamlı etkisi bulunmamaktadır. Güçlü CYP1A2 inhibitörü olan fluvoksaminin pomalidomid ile ketokonazol varlığında eşzamanlı olarak uygulanması, pomalidomid ve ketokonazole kıyasla, pomalidomide ortalama maruziyeti %90 güven aralığı ile [%91 ila %124] %107 oranında artırmıştır. Tek başına bir CYP1A2 inhibitörünün metabolizma değişikliklerine katkısını değerlendirmek üzere yapılan ikinci bir çalışmada, pomalidomid ile tek başına fluvoksaminin eşzamanlı olarak uygulanması pomalidomide ortalama maruziyeti, tek başına pomalidomide kıyasla %90 güven aralığı ile [%98 ila %157) %125 artırmıştır. Güçlü CYP1A2 inhibitörleri (örn., siprofloksasin, enoksasin ve fluvoksamin) pomalidomid ile eşzamanlı olarak uygulanırsa, pomalidomid dozu %50 azaltılmalıdır.
Pomalidomidin güçlü CYP1A2 inhibitörleri (örn., siprofloksasin, enoksasin ve fluvoksamin) ile eşzamanlı uygulanması halinde, hastalar advers reaksiyonlar açısından yakından takip edilmelidir.
Deksametazon
Multipl miyelom hastalarında 4 mg'a kadar olan çoklu pomalidomid dozlarıyla, 20 mg ila 40 mg arasında deksametazonun (CYP3A dahil çeşitli CYP enzimlerinin hafif ila orta derecede indükleyicisi) eşzamanlı olarak uygulanmasının, pomalidomidin tek başına uygulanmasına kıyasla, pomalidomidin farmakokinetiği üzerine herhangi bir etkisi olmamıştır.
Deksametazonun, varfarin üzerine olan etkisi bilinmemektedir. Tedavi sırasında varfarin konsantrasyonunun yakından takip edilmesi tavsiye edilir.
Özel popülasyonlara ilişkin ek bilgiler Pediyatrik popülasyon:
Multipl Miyelom endikasyonu için 0-17 yaş arası çocuklarda pomalidomidin uygun bir kullanımı yoktur.
IMNOVID ile kombine edilen ürünlerin diğer ilaçlar ile etkileşimleri hakkında ek bilgi için ilgili ilaçların güncel KÜB'ne bakınız.
4.6. Gebelik ve laktasyon
Gebelik Kategorisi: X
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeli olan kadınlar etkili doğum kontrol yöntemi kullanmalıdır. Pomalidomid insan semeninde bulunmaktadır. Önlem olarak pomalidomid kullanmakta olan tüm erkek hastalar, eşleri gebe ise ya da eşlerin çocuk doğurma potansiyelinin olması ve herhangi bir doğum kontrol yöntemi kullanmaması durumunda tedavi süresince, tedaviye ara verilmesi sırasında ve tedavi kesildikten sonra 7 gün süreyle prezervatif kullanmalıdır (bkz. Bölüm 4.3 ve 4.4).
Çocuk doğurma potansiyeli olan kadınlar tedaviye başlamadan 4 hafta önce ve süresince (ve tedavinin ardından 4 haftaya kadar) etkili doğum kontrolü uygulamak zorundadırlar (bkz. Bölüm 4.3 ve 4.4).
Pomalidomid gebelik boyunca ve gebeliği önlemek için tüm koşullara uyulmadıkça, çocuk doğurma potansiyeli olan kadınlarda kontrendikedir (bkz. Bölüm 4.3 ve 4.4).
Gebelik dönemi
IMNOVID gebelik döneminde kontrendikedir (bkz. Bölüm 4.3).
Pomalidomidin insanlarda teratojenik etkisi olması beklenmektedir.
Pomalidomid ile tedavi edilen kadınlarda gebelik ortaya çıkması halinde, tedavi durdurulmalıdır ve hasta değerlendirme ve tavsiye için teratoloji konusunda uzman veya deneyimli bir hekime sevk edilmelidir. Pomalidomid kullanmakta olan bir erkeğin eşinde gebelik ortaya çıkması halinde, erkeğin eşinin değerlendirme ve tavsiye için teratoloji konusunda uzman veya deneyimli bir hekime sevk edilmesi önerilir.
Laktasyon dönemi
Pomalidomidin insan sütüyle atılıp atılmadığı bilinmemektedir. Pomalidomid anneye uygulandıktan sonra, emziren sıçanların sütünde tespit edilmiştir. Anne sütü alan bebeklerde pomalidomide bağlı advers reaksiyon görülme olasılığı nedeniyle, çocuk için emzirmenin ve kadın için terapinin faydalarını dikkate alarak, emzirmenin mi yoksa tedavinin mi kesileceğine dair bir karar verilmelidir.
Üreme yeteneği/Fertilite
Pomalidomidin hayvanlarda fertiliteyi olumsuz olarak etkilediği ve hayvanlarda teratojenik olduğu gösterilmiştir. Gebe tavşanlara uygulandıktan sonra, pomalidomid plasentaya geçmiştir ve fetal kanda tespit edilmiştir (bkz. Bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
Pomalidomidin araç ve makine kullanma yeteneği üzerine hafif veya orta derecede bir etkisi bulunmaktadır.
Pomalidomid kullanımı ile yorgunluk, depresif bilinç düzeyi, konfüzyon ve baş dönmesi bildirilmiştir. Hastalar pomalidomid ile tedavi edilirken araç, makine kullanmamaları veya tehlikeli işler yapmamaları konusunda uyarılmalıdır.
4.8. İstenmeyen etkiler
Güvenlilik profili özeti
Pomalidomidin bortezomib ve dekzametazon ile kombinasyonu
En sık bildirilen kan ve lenf sistemi hastalıkları nötropeni (%46,8), trombositopeni (%36,7) ve anemidir (%28,4). En sık bildirilen advers reaksiyon periferik duyusal nöropatidir (%47,8). En sık bildirilen 3. veya 4. derece advers reaksiyonlar, nötropeni (%41,7), trombositopeni (%27,3) ve anemi (14,0) gibi kan ve lenf sistemi hastalıklarıdır. En sık bildirilen ciddi advers reaksiyon pnömonidir (%11,5). Bildirilen diğer ciddi advers reaksiyonlar arasında pireksi (%4,0), alt solunum yolu enfeksiyonu (%2,9), pulmoner emboli (%2,9), influenza (%2,9) ve akut böbrek hasarı (%2,9) yer almaktadır.
Pomalidomidin dekzametazon ile kombinasyonu
Klinik çalışmalarda en yaygın olarak bildirilen advers reaksiyonlar, anemi (%45,7), nötropeni (%45,3) ve trombositopeniyi (%27) içeren kan ve lenf sistemi hastalıkları; yorgunluk (%28,3), pireksi (%21) ve periferik ödemi (%13) içeren genel bozukluklar ve uygulama bölgesi ile ilişkili durumlar; pnömoniyi (%10,7) içeren enfeksiyonlar ve enfestasyonlar olmuştur. Periferik nöropati advers reaksiyonu hastaların %12,3'ünde ve venöz embolik veya trombotik (VTE) advers reaksiyonlar hastaların %3,3'ünde bildirilmiştir. En yaygın olarak bildirilen 3 veya 4. derece advers reaksiyonlar, nötropeni (%41,7), anemi (%27) ve trombositopeniyi (%20,7) içeren kan ve lenf sistemi hastalıkları; pnömoniyi (%9) içeren enfeksiyonlar ve enfestasyonlar; yorgunluk (%4,7), pireksi (%3) ve periferik ödemi (%1,3) içeren genel bozukluklar ve uygulama bölgesi ile ilişkili durumlar olmuştur. Bildirilen en yaygın ciddi advers reaksiyon pnömonidir (%9,3). Bildirilen diğer ciddi advers reaksiyonlar febril nötropeni (%4,0), nötropeni (%2,0), trombositopeni (%1,7) ve VTE advers reaksiyonlarıdır (%1,7).
Advers reaksiyonlar daha sık olarak pomalidomid ile tedavinin ilk 2 siklusu sırasında ortaya çıkma eğilimi göstermektedir.
Advers reaksiyonların tablolaştırılmış listesi
Pomalidomidin bortezomib ve dekzametazon ile kombinasyonu
CC-4047-MM-007 randomize çalışmasında, 278 hasta pomalidomid, bortezomib ve deksametazon (Pom+Btz+Dex kolu) almıştır. Dozlama bilgisi için bkz. Bölüm 4.2.
Pomalidomidin bortezomib ve deksametazon kombinasyonu ile tedavi edilen hastalarda gözlenen advers reaksiyonlar, sistem organ sınıfına (SOS) ve tüm advers reaksiyonların
sıklığına ve 3. veya 4. derece advers reaksiyonlara göre aşağıda Tablo 7'de listelenmiştir.
Her SOS ve sıklık gruplamasında, advers reaksiyonlar azalan ciddiyet sırasıyla sunulmaktadır. Sıklıklar şu şekilde tanımlanmaktadır: Çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1000 ila <1/100); seyrek (≥1/10.000 ila <1/1000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Tablo 7. Pomalidomidin bortezomib ve deksametazon ile kombinasyonu ile tedavi edilen hastalarda klinik çalışma MM-007'de bildirilen tüm advers reaksiyonlar
Sistem Organ Sınıfı/ Tercih Edilen Terim | Tüm Advers Reaksiyonlar/Sıklık | 3â4. Derece Advers Reaksiyonlar /Sıklık |
Enfeksiyonlar ve enfestasyonlar | Çok Yaygın: Pnömoni Bronşit Üst solunum yolu enfeksiyonu Viral üst solunum yolu enfeksiyonu | Çok Yaygın: Pnömoni |
| Yaygın: Sepsis Septik şok Clostridium difficile koliti Solunum yolu enfeksiyonu Alt solunum yolu enfeksiyonu Akciğer enfeksiyonu İnfluenza Bronşiyolit İdrar yolu enfeksiyonu | Yaygın: Sepsis Septik şok Clostridium difficile koliti Bronşit Üst solunum yolu enfeksiyonu Solunum yolu enfeksiyonu Alt solunum yolu enfeksiyonu Akciğer enfeksiyonu İnfluenza Bronşiyolit İdrar yolu enfeksiyonu |
İyi huylu ve kötü |
|
|
huylu neoplazmlar | Yaygın: | |
(Kist ve polipler | Bazal hücreli karsinom | |
dahil olmak üzere) |
| |
Kan ve lenf sistemi hastalıkları | Çok Yaygın: Nötropeni Trombositopeni Lökopeni Anemi | Çok Yaygın: Nötropeni Trombositopeni Anemi |
| Yaygın: Febril nötropeni Lenfopeni | Yaygın: Febril nötropeni Lökopeni Lenfopeni |
Sistem Organ | Tüm Advers Reaksiyonlar/Sıklık | 3â4. Derece Advers |
Sınıfı/ |
| Reaksiyonlar /Sıklık |
Tercih Edilen |
|
|
Terim |
|
|
Metabolizma ve beslenme hastalıkları | Çok Yaygın: Hipokalemi Hiperglisemi
Yaygın: Hipomagnezemi Hipokalsemi Hipofosfatemi Hiperkalemi Hiperkalsemi |
Yaygın: Hipokalemi Hiperglisemi Hipomagnezemi Hipokalsemi Hipofosfatemi Hiperkalemi Hiperkalsemi |
Psikiyatrik hastalıklar | Çok Yaygın: Uykusuzluk
Yaygın: Depresyon |
Yaygın: Depresyon Uykusuzluk |
Sinir sistemi hastalıkları | Çok Yaygın: Periferik duyusal nöropati Baş dönmesi Tremor
Yaygın: Senkop Periferik sensorimotor nöropati Parestezi Disguzi |
Yaygın: Senkop Periferik duyusal nöropati Periferik sensorimotor nöropati
Yaygın olmayan: Baş dönmesi Tremor |
Göz hastalıkları | Yaygın: Katarakt | Yaygın: Katarakt |
Kardiyak hastalıklar | Yaygın: Atriyal fibrilasyon | Yaygın: Atriyal fibrilasyon |
Vasküler hastalıklar | Yaygın: Derin ven trombozu Hipotansiyon Hipertansiyon | Yaygın: Hipotansiyon Hipertansiyon
Yaygın olmayan: Derin ven trombozu |
Solunum, göğüs bozuklukları ve mediastinal hastalıkları | Çok Yaygın: Dispne Öksürük
Yaygın: Pulmoner embolizm |
Yaygın: Pulmoner embolizm Dispne |
Sistem Organ Sınıfı/ Tercih Edilen Terim | Tüm Advers Reaksiyonlar/Sıklık | 3â4. Derece Advers Reaksiyonlar/Sıklık |
Gastrointestinal hastalıklar | Çok Yaygın: Diyare Kusma Bulantı Konstipasyon
Yaygın: Karın ağrısı Üst karın ağrısı Stomatit Ağız kuruluğu Abdominal distansiyon |
Yaygın: Diyare Kusma Karın ağrısı Konstipasyon
Yaygın olmayan: Üst karın ağrısı Stomatit Bulantı Abdominal distansiyon |
Deri ve deri altı doku hastalıkları | Yaygın: Deri döküntüsü | Yaygın: Deri döküntüsü |
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları | Çok Yaygın: Kas güçsüzlüğü Sırt ağrısı
Yaygın: Kemik ağrısı Kas spazmları |
Yaygın: Kas güçsüzlüğü Sırt ağrısı
Yaygın olmayan: Kemik ağrısı |
Böbrek ve idrar yolu hastalıkları | Yaygın: Akut böbrek yetmezliği Kronik böbrek yetmezliği Üriner retansiyon | Yaygın: Akut böbrek yetmezliği Kronik böbrek yetmezliği Üriner retansiyon |
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar | Çok Yaygın: Yorgunluk Pireksi Periferik ödem
Yaygın: Kalp dışı göğüs ağrısı Ödem |
Yaygın: Yorgunluk Pireksi Kalp dışı göğüs ağrısı Periferik ödem Ödem |
Araştırmalar | Yaygın: Alanin aminotransferaz artışı Kilo kaybı | Yaygın: Kilo kaybı
Yaygın olmayan: Alanin aminotransferaz artışı |
Yaralanma ve zehirlenme | Yaygın Düşme | Yaygın olmayan: Düşme |
Advers reaksiyonların tablolaştırılmış listesi
Pomalidomidin deksametazon ile kombinasyonu
CC-4047-MM-003 randomize çalışmasında, Relaps ve Refraktör Multipl Miyelomlu 302 hasta, haftalık olarak deksametazonun düşük dozu ile kombinasyon halinde her 28 günlük siklusun 21 günü boyunca günde bir kez 4 mg pomalidomide almıştır.
Pomalidomid ve deksametazon ile tedavi edilen hastalarda gözlenen advers reaksiyonlar, sistem organ sınıfına (SOS) ve tüm advers reaksiyonların sıklığına ve 3. veya 4. derece advers reaksiyonlara göre aşağıda Tablo 8'de listelenmiştir.
Advers reaksiyonların sıklıkları, CC-4047-MM-003 (n=302) çalışmasının pomalidomid artı deksametazon kolunda bildirilmiş olan sıklıklardır. Her SOS ve sıklık gruplamasında, advers reaksiyonlar azalan ciddiyet sırasıyla sunulmaktadır. Sıklıklar şu şekilde tanımlanmaktadır: Çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1000 ila <1/100); seyrek (≥1/10.000 ila <1/1000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Tablo 8. Pomalidomidin ve deksametazon ile kombinasyonu ile tedavi edilen hastalarda klinik çalışma MM-003'te bildirilen advers reaksiyonlar
Sistem Organ Sınıfı/ Tercih Edilen Terim | Tüm Advers Reaksiyonlar/Sıklık | 3â4. Derece Advers Reaksiyonlar /Sıklık |
Enfeksiyonlar ve enfestasyonlar | Çok Yaygın: Pnömoni (fırsatçı enfeksiyonlar dahil bakteriyel, viral ve mantar enfeksiyonları )
Yaygın: Nötropenik sepsis Bronkopnömoni Bronşit Solunum yolu enfeksiyonu Üst solunum yolu enfeksiyonu Nazofarenjit Herpes zoster |
Yaygın: Nötropenik sepsis Pnömoni (fırsatçı enfeksiyonlar dahil bakteriyel, viral ve mantar enfeksiyonları) Bronkopnömoni Solunum yolu enfeksiyonu Üst solunum yolu enfeksiyonu
Yaygın olmayan: Bronşit Herpes zoster |
İyi huylu ve kötü huylu neoplazmalar (Kist ve polipler dahil olmak üzere) |
Yaygın olmayan: Deride bazal hücreli karsinom Deride skuamöz hücreli karsinom |
Yaygın olmayan: Deride bazal hücreli karsinom Deride skuamöz hücreli karsinom |
Kan ve lenf sistemi hastalıkları | Çok Yaygın: Nötropeni Trombositopeni Lökopeni Anemi
Yaygın: Febril nötropeni | Çok Yaygın: Nötropeni Trombositopeni Anemi
Yaygın: Febril nötropeni Lökopeni |
Metabolizma ve beslenme hastalıkları | Çok Yaygın: İştah azalması
Yaygın: Hiperkalemi Hiponatremi |
Yaygın: Hiperkalemi Hiponatremi
Yaygın olmayan: İştah azalması |
Psikiyatrik hastalıklar | Yaygın: Konfüzyonel durum | Yaygın: Konfüzyonel durum |
Sinir sistemi hastalıkları | Yaygın: Bilinç düzeyinin baskılanması Periferik duyusal nöropati Baş dönmesi Tremor | Yaygın: Bilinç düzeyinin baskılanması
Yaygın olmayan: Periferik duyusal nöropati Baş dönmesi Tremor |
Kulak ve iç kulak hastalıkları | Yaygın: Vertigo | Yaygın: Vertigo |
Vasküler hastalıklar | Yaygın: Derin ven trombozu | Yaygın olmayan: Derin ven trombozu |
Solunum, göğüs bozuklukları ve mediastinal hastalıkları | Çok Yaygın: Dispne Öksürük
Yaygın: Pulmoner embolizm |
Yaygın: Dispne
Yaygın olmayan: Pulmoner embolizm Öksürük |
Sistem Organ Sınıfı/ Tercih Edilen Terim | Tüm Advers Reaksiyonlar/Sıklık | 3â4. Derece Advers Reaksiyonlar /Sıklık |
Gastrointestinal hastalıklar | Çok Yaygın: Diyare Bulantı Konstipasyon
Yaygın: Kusma Gastrointestinal kanama |
Yaygın: Diyare Kusma Konstipasyon
Yaygın olmayan: Bulantı Gastrointestinal kanama |
Hepatobiliyer hastalıklar | Yaygın olmayan: Hiperbilirubinemi | Yaygın olmayan: Hiperbilirubinemi |
Deri ve deri altı doku hastalıkları | Yaygın: Deri döküntüsü Prurit | Yaygın: Deri döküntüsü |
Kas-iskelet bozukluklar, bağ doku ve kemik hastalıkları | Çok Yaygın: Kemik ağrısı Kas spazmları |
Yaygın: Kemik ağrısı
Yaygın olmayan: Kas spazmları |
Böbrek ve idrar yolu hastalıkları | Yaygın: Böbrek yetmezliği Üriner retansiyon | Yaygın: Böbrek yetmezliği
Yaygın olmayan: Üriner retansiyon |
Üreme sistemi ve meme hastalıkları | Yaygın: Pelvik ağrı | Yaygın: Pelvik ağrı |
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar | Çok Yaygın: Yorgunluk Pireksi Periferik ödem |
Yaygın: Yorgunluk Pireksi Periferik ödem |
Araştırmalar | Yaygın: Nötrofil sayısında azalma Beyaz kan hücresi sayısında azalma Trombosit sayısında azalma Alanin aminotransferaz düzeylerinde artma | Yaygın: Nötrofil sayısında azalma Beyaz kan hücresi sayısında azalma Trombosit sayısında azalma Alanin aminotransferaz düzeylerinde artma |
Pazarlama sonrası advers reaksiyonların tablolaştırılmış listesi
Önemli klinik çalışmalardan elde edilen yukarıdaki advers reaksiyonlara ek olarak, aşağıda Tablo 9'de pazarlama sonrası araştırmalardan elde edilen advers reaksiyonlar yer almaktadır.
Mevcut kılavuza göre sıklıklar şu şekilde tanımlanmıştır: çok yaygın (≥ 1/10), yaygın (≥ 1/100 ila <1/10), yaygın olmayan (≥ 1 / 1.000 ila <1/100) ve bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Tablo 9. Pomalidomid ile tedavi edilen hastalarda pazarlama sonrası kullanımında bildirilen advers reaksiyonlar
Sistem Organ Sınıfı/ Tercih Edilen Terim | Tüm Advers Reaksiyonlar/Sıklık | 3â4. Derece Advers Reaksiyonlar/Sıklık |
Enfeksiyonlar ve enfestasyonlar | Bilinmiyor: Hepatit B reaktivasyonu | Bilinmiyor: Hepatit B reaktivasyonu |
Kan ve lenf sistemi hastalıkları | Yaygın: Pansitopeni | Yaygın: Pansitopeni |
Bağışıklık sistemi hastalıkları | Yaygın: Anjiyoödem Ürtiker | Yaygın olmayan: Anjiyoödem Ürtiker |
| Bilinmiyor: Anaflaktik reaksiyon | Bilinmiyor: Anaflaktik reaksiyon |
Endokrin hastalıkları | Yaygın olmayan: Hipotiroidizm |
|
Metabolizma ve beslenme hastalıkları | Yaygın: Hiperürisemi | Yaygın: Hiperürisemi |
| Yaygın olmayan: Tümör lizis sendromu | Yaygın olmayan: Tümör lizis sendromu |
Sinir sistemi hastalıkları | Yaygın: İntrakranial hemoraji | Yaygın olmayan: Serebrovasküler olay İntrakranial hemoraji |
| Yaygın olmayan Serebrovasküler olay |
|
Kardiyak hastalıklar | Yaygın: Kalp yetmezliği Atriyal fibrilasyon Miyokard enfarktüsü | Yaygın: Kalp yetmezliği Atriyal fibrilasyon |
|
| Yaygın olmayan: Miyokard enfarktüsü |
Solunum, göğüs | Yaygın: | Yaygın olmayan: |
bozuklukları ve | Epistaksis | Epistaksis |
mediastinal | İntersitisyel akciğer hastalığı | İntersitisyel akciğer hastalığı |
hastalıkları |
|
|
Hepatobiliyer hastalıklar | Yaygın olmayan: Hepatit |
|
Deri ve deri altı doku hastalıkları | Bilinmiyor: Eozinofili ve Sistemik Semptomlar ile Seyreden İlaç Reaksiyonları Toksik Epidermal Nekroliz Stevens-Johnson Sendromu | Bilinmiyor: Eozinofili ve Sistemik Semptomlar ile Seyreden İlaç Reaksiyonları Toksik Epidermal Nekroliz Stevens-Johnson Sendromu |
Araştırmalar | Yaygın: Kanda ürik asit artışı | Yaygın olmayan: Kanda ürik asit artışı |
Seçili advers reaksiyonların tanımı
Teratojenisite
Pomalidomid yapısal olarak talidomid ile benzerdir. Talidomid insanlarda teratojenik etkisi oluğu bilinen ve yaşamı tehdit edici ciddi doğumsal kusurlara neden olan etkin bir maddedir. Pomalidomidin, majör organogenez dönemi sırasında uygulandığında, sıçanlarda ve tavşanlarda teratojenik etki gösterdiği bulunmuştur. Eğer gebelik sırasında alınırsa, pomalidomidin insanlarda teratojenik bir etki göstermesi beklenir (bkz. Bölüm 4.4).
Nötropeni ve trombositopeni
Klinik çalışmalarda pomalidomid ile kombinasyon tedavisi alan hastaların %46,8'ine kadarında (%41,7'si 3. veya 4. derece) nötropeni ortaya çıkmıştır. Nötropeni, seyrek olarak ciddidir ve herhangi bir hastada pomalidomid kesilmesine neden olmamıştır.
Hastaların %3,2 ila %6,7'sinde febril nötropeni (FN) bildirilmiştir ve hastaların %1,8 ila % 4,0'ında ciddidir (bkz. Bölüm 4.2 ve 4.4).
Klinik çalışmalarda pomalidomid ile kombinasyon tedavisi alan hastalarda, hastaların %27,0 ila %36,7'sinde trombositopeni meydana gelmiştir. Trombositopeni hastaların %20,7'si ila 27,3'ünde 3. derece veya 4. derecedir, hastaların %0,4'ü ila %1.7'sinde ciddidir ve hastaların
%0,7'sinde pomalidomid tedavisinin durdurulmasına yol açmıştır (bkz. Bölüm 4.2 ve 4.4).
Nötropeni ve trombositopeni, pomalidomid ile tedavinin ilk 2 siklusunda daha sık ortaya çıkma eğilimindedir.
Enfeksiyon
Enfeksiyon en sık görülen hematolojik olmayan toksisitedir.
Klinik çalışmalarda pomalidomid ile kombinasyon tedavisi gören hastaların %55,0 ila
%80,2'sinde ( %24,0 ila %30,9'u 3 veya 4. derecedir) enfeksiyon meydana gelmiştir. Üst solunum yolu enfeksiyonu ve pnömoni en sık görülen enfeksiyonlardır. Ölümcül enfeksiyonlar (5. derece) hastaların % 2,7'si ila % 4,0'ında gerçekleşmiştir. Enfeksiyonlar, hastaların %2,0 ila %2,9'unda pomalidomid tedavisinin durdurulmasına yol açmıştır.
Tromboembolik olaylar
Klinik çalışmalardaki tüm hastalar için asetilsalisilik asit (ve yüksek riskli bireylerde diğer antikoagülanlar) ile profilaksi, zorunlu tutulmuştur. Antikoagülan tedavi (kontrendike olmadıkça) önerilmektedir (bkz. Bölüm 4.4).
Klinik çalışmalarda pomalidomid ile kombinasyon tedavisi gören hastaların %3,3 ila
%11,5'inde ( %1,3 ila 5,4'ü 3. veya 4. derecedir) venöz tromboembolik olaylar (VTE) meydana gelmiştir. Hastaların % 1,7 ila % 4,3'ünde VTE ciddi olarak rapor edilmiş, ölümcül reaksiyon bildirilmemiştir. Hastaların %1,8'ine kadarında VTE pomalidomid kesilmesi ile
ilişkiliydi.
Periferik nöropati
Pomalidomidin bortezomib ve deksametazon ile kombinasyon tedavisinde Randomizasyondan 14 gün öncesine kadar ağrı ve ≥2. derece periferik nöropatisi olan hastalar klinik çalışmalara dahil edilmemiştir. Periferik nöropati hastaların %55,4'ünde (%10,8'i 3. derece; %0,7'si 4. derece) meydana gelmiştir. Tedavi kollarında maruz kalma ayarlanmış oranları karşılaştırılabilirdir. Periferik nöropati yaşayan hastaların yaklaşık %30'unda başlangıçta nöropati öyküsü vardı. Periferik nöropati, hastaların sırasıyla yaklaşık %12,9'unda bortezomibin, hastaların %1,8'inde pomalidomid ve %2,2 â 8,9'unda deksametazonun kesilmesine yol açmıştır. Ayrıca bortezomib KÜB'ne bakınız.
Pomalidomidin deksametazon ile kombinasyon tedavisinde
Devam etmekte olan ≥2. derece periferik nöropatisi olan hastalar, klinik çalışmalara dahil edilmemiştir. Periferik nöropati, hastaların %12,3'ünde ortaya çıkmıştır (%1 3. veya 4. derece). Hiçbir periferik nöropati reaksiyonu ciddi olarak bildirilmemiştir ve periferik nöropati hastaların %0,3'ünde tedavinin kesilmesine yol açmıştır (bkz. Bölüm 4.4).
Hemoraji
Pomalidomid ile hemorajik bozukluklar özellikle risk faktörü taşıyan ve kanamaya eğilimi artıran tıbbi ürünleri eş zamanlı kullanan hastalarda bildirilmiştir. Hemorajik olaylar burun kanaması, intrakranial kanama ve gastrointestinal kanamaları içerir.
Alerjik reaksiyonlar ve ciddi deri reaksiyonları
Pomalidomid kullanımı ile anjioödem, anaflaktik reaksiyon ve Stevens-Johnson sendromu, toksik epidermal nekroliz ve DRESS'i içeren ciddi kutanöz reaksiyonlar bildirilmiştir. Lenalidomid veya talidomid tedavisi ile ilişkili şiddetli döküntü öyküsü olan hastalar pomalidomid kullanmamalıdır (bkz. bölüm 4.4).
Özel popülasyonlara ilişkin ek bilgiler:
IMNOVID ile kombine edilen ürünlerin özel popülasyonlarına ilişkin advers reaksiyonları için ilgili ilaçların güncel KÜB'ne bakınız.
Pediyatrik popülasyon:
Tekrarlayan veya ilerleyen beyin tümörleri olan pediyatrik hastalarda (4 ila 18 yaş arası) bildirilen advers reaksiyonlar, yetişkin hastalarda bilinen pomalidomid güvenlilik profiliyle uyumludur (bkz. Bölüm 5.1).
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
Sağlıklı gönüllülerde, pomalidomidin 50 mg'a kadar çıkan tek doz ve multipl miyelomlu hastalarda günde bir defa çoklu 10 mg dozlarında çalışma yapılmış olup doz aşımıyla ilişkili olarak ciddi advers reaksiyonlar bildirilmemiştir. Çalışmalarda, pomalidomidin hemodiyaliz ile uzaklaştırılabildiği bulunmuştur.
Doz aşımı durumunda, destek tedavisi tavsiye edilmektedir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: İmmünosupresanlar, diğer immünosupresanlar ATC kodu: L04AX06
Etki mekanizması
Pomalidomid direkt antimiyelom tümorisidal ve immünomodülatör aktiviteye sahiptir ve multipl miyelom tümör hücrelerinin çoğalmasında rol oynayan stromal hücre desteğini inhibe eder. Pomalidomid spesifik olarak hematopoietik tümör hücrelerinin proliferasyonunu inhibe eder ve apopitozisi indükler. Ek olarak, pomalidomid lenalidomide dirençli multipl miyelom hücre dizilerinin proliferasyonunu inhibe eder ve lenalidomide duyarlı ve lenalidomide dirençli hücre dizilerinin her ikisinde de tümör hücrelerinin apopitozisi indüklemede deksametazon ile sinerjistik etki gösterir. Pomalidomid T hücreleri ve Doğal Öldürücü (Natural Killer, NK) hücrelerinin düzenlediği bağışıklığı güçlendirir ve monositler tarafından pro-enflamatuvar sitokinlerin (örn., TNF-ï¡ ve IL-6) üretilmesini inhibe eder. Pomalidomid, endotel hücrelerinin göçü ve adhezyonunu engelleyerek, anjiyogenezi de inhibe eder.
Pomalidomid, deoksiribonükleik asit (DNA) hasar bağlayıcı protein 1 (DDB1), cullin 4(CUL4) ve cullins-1 regülatörünü (Roc1) içeren bir E3 ligaz kompleksinin bir parçası olan protein sereblonuna (CRBN) doğrudan bağlanır ve kompleks içinde CRBN'nin otomatik ubikütinasyonunu inhibe edebilir. E3 ubikütin ligazları, çeşitli substrat proteinlerinin poliubikütinasyonundan sorumludur ve pomalidomid tedavisi ile gözlenen pleyiotropik hücresel etkileri kısmen açıklayabilir.
Pomalidomid in vitro varlığında, substrat proteinleri Aiolos ve İkaros, ubikütinasyon ve daha sonra doğrudan sitotoksik ve immünomodülatör etkilere yol açan bozulma için hedeflenir. İn vivo olarak, pomalidomid tedavisi, nükseden lenalidomid-refrakter multipl miyelomlu hastalarda İkaros seviyelerinde azalmaya yol açmıştır.
Klinik etkililik ve güvenlilik
Pomalidomidin bortezomib ve deksametazon ile kombinasyon tedavisinde
Lenalidomid de dahil olmak üzere en az bir dizi tedavi almış ve son tedavide veya sonrasında hastalık progresyonu göstermiş daha önce tedavi edilen multipl miyelomlu erişkin hastalarda bortezomib ve düşük doz deksametazon (Pom+Btz+DD-Deks) ile kombinasyon halinde pomalidomidin etkililiği ve güvenliliği, Faz III çok merkezli, randomize, açık etiketli çalışmada (CC-4047-MM-007) bortezomib ve düşük doz deksametazon (Btz+DD-Dks) ile karşılaştırılmıştır. Çalışmaya toplam 559 hasta katılmıştır. 281 hasta Pom+Btz+DD-Deks kolunda ve 278 hasta Btz+DD-Deks kolunda randomize edilmiştir. Hastaların %54'ü erkektir ve genel nüfusun medyan yaşı 68'dir (min: 27 â maks: 89 yaş). Hastaların yaklaşık %70'i lenalidomid tedavisine cevap vermemiştir (Pom+Btz+DD-Deks'te %71,2, Btz+DD-Deks'te
%68,7). Hastaların yaklaşık %40'ı 1. relapstadır ve hastaların yaklaşık %73'ü önceki tedavi olarak bortezomib almıştır.
Pom+Btz+DD-deks kolundaki hastalara uygulanmıştır. Her 21 günlük siklusun 1 ila 14. günlerinde oral olarak 4 mg pomalidomid uygulanmıştır. Her iki çalışma kolundaki hastalara, 1 ila 8 siklusları için 21 günlük bir siklusun 1, 4, 8 ve 11. günlerinde ve 9 ve sonrası sikluslar için 21 günlük bir siklusun 1 ve 8. günlerinde bortezomib (1,3 mg/m/doz) uygulanmıştır. Her iki çalışma kolundaki hastalara 1 ila 8 arasındaki sikluslar için 21 günlük bir siklusun 1, 2, 4,
5, 8, 9, 11 ve 12. günlerinde ve 9. siklustan itibaren sonraki 21 günlük döngünün 1, 2, 8 ve 9 günlerinde düşük doz deksametazon (20 mg/gün [≤ 75 yaşında] veya 10 mg/gün [> 75 yaşında]) uygulanmıştır. Toksisiteyi yönetmek için gerektiğinde dozlar azaltılmış ve tedavi geçici olarak kesilmiş veya durdurulmuştur. (bkz. Bölüm 4.2).
Tedavi amaçlı popülasyon (ITT) için birincil etkililik sonlanım noktası, IMWG kriterlerine dayalı olarak Bağımsız Değerlendirme Kararlaştırma Kurulunun (IRAC) değerlendirmesine göre progresyonsuz sağkalım (Progression Free Survival - PFS)'dır. Ortalama 15,9 aylık takipten sonra, Pom+Btz+DD-deks kolunda medyan PFS süresi 11,20 aydır (%95 GA: 9,66; 13,73). Btz + DD-deks kolunda, medyan PFS süresi 7,1 aydır (%95 GA: 5,88; 8,48).
26 Ekim 2017 tarihli veri kesme tarihi kullanılarak genel etkililik veri özeti Tablo 10'da sunulmuştur. ITT popülasyonunda PFS için Kaplan-Meier eğrisi Şekil 1'de gösterilmektedir.
Tablo 10- Genel etkililik özeti
| Pom+Btz+DD-Deks (N = 281) | Btz+DD-Deks (N = 278) |
PFS (ay) |
| |
Medyan zaman (% 95 GA) | 11,20 (9,66; 13,73) | 7,10 (5,88; 8,48) |
HR (% 95 GA), P-değeri | 0,61 (0,49; 0,77); <0,0001 | |
ORR, n (%) | % 82,2 | % 50,0 |
sCR | 9 (3,2) | 2 (0,7) |
CR | 35 (12,5) | 9 (3,2) |
VGPR | 104 (37,0) | 40 (14,4) |
PR | 83 (29,5) | 88 (31,7) |
OR (95% GA) , P-değeri | 5,02 (3,35; 7,52); <0,001 | |
DoR (ay) |
| |
Medyan zaman (% 95 GA) | 13,7 (10,94 ; 18,10) | 10,94 (8,11 ; 14,78) |
HR (% 95 GA) | 0,76 (0,56; 1,02) | |
Btz = bortezomib; GA = Güven aralığı; CR = Tam yanıt; DoR = Yanıt süresi; HR = Tehlike oranı; DD-Deks = düşük doz deksametazon; OR = Olasılık oranı; ORR = Genel yanıt oranı; PFS = progresyonsuz sağkalım; POM = pomalidomid; PR = Kısmi yanıt; sCR = Kati tam yanıt VGPR = Çok iyi kısmi yanıt.
P-değeri sınıflandırılmamış log sıra testine dayanmaktadır.
P-değeri, yaş ile sınırlandırılmış (<=75'e karşı >75), antimiyelom tedavi rejimlerinin önceki sayısına (1'e karşı >1), ve gözlemde beta-2 mikroglobulin (< 3,5 mg/L'ye karşı ≥ 3,5 mg/L â
≤ 5,5 mg/L'ye karşı> 5,5 mg/L) ile CMH testine bağlıdır.
Pom+Btz+DD-deks kolunda medyan tedavi süresi 8,8 ay (12 tedavi siklusu) ve Btz+DD-deks kolunda 4,9 aydır (7 tedavi siklusu).
PFS avantajı, yalnızca bir önceki tedavi rejimini alan hastalarda daha belirgindir. Önceden bir
antimiyelom tedavisi alan hastalarda ortalama PFS süresi Pom+Btz+DD-deks kolunda 20,73 ay (% 95 GA: 15,11; 27,99) ve Btz+DD-deks kolunda 11,63 aydır (%95 GA: 7,52, 15,74).
Pom+Btz+DD-deks tedavisi ile %46 risk azalması gözlendi (HR = 0,54; %95 GA: 0,36;
0,82).
Şekil 1. IMWG Kriterlerine Dayalı olarak IRAC Değerlendirmesi ile Progresyonsuz Sağkalım (Sınıflandırılmış Log Sıra Testi) (ITT Popülasyonu)
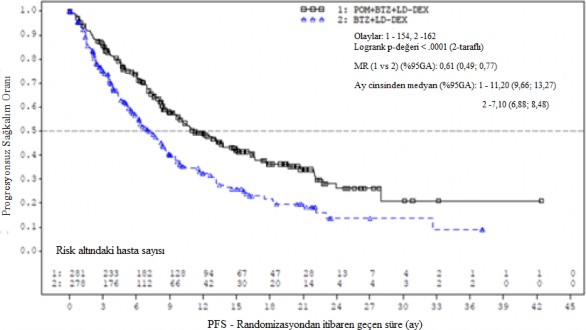
Veri kesim tarihi: 26 Ekim 2017
Genel sağkalım (OS) için 15 Eylül 2018 tarihli veri kesimi kullanılarak (26,2 aylık medyan takip süresi) yakın zamandaki ara analizine göre, Kaplan-Meier tahminleri ile medyan OS zamanı Pom+Btz+DDdeks kolu için 40,5 ay ve Btz +DDdeks kolu için 30,5 aydır (Genel olay oranı %43,3 ile birlikte HR = 0,91, % 95 GA: 0,70; 1,18,).
Pomalidomidin deksametazon ile kombinasyon tedavisinde
Pomalidomidin deksametazon ile kombinasyonunun etkililiği ve güvenliliği, lenalidomid ve bortezomib dahil olmak üzere, daha önce en az iki tedavi almış ve son tedavi altındayken hastalık progresyonu gösteren, nüks ve dirençli multipl miyelomu olan, yetişkin hastalarda pomalidomid ve düşük doz deksametazon tedavisinin (Pom + DD-Deks ) tek başına yüksek doz deksametazon (YD-Deks) ile karşılaştırıldığı çok merkezli, randomize, açık etiketli bir Faz III çalışmada (CC-4047-MM-003) değerlendirilmiştir. Çalışmaya toplam 455 hasta dahil edilmiştir: bunlardan 302 hasta Pom + DD-Deks koluna ve 153 hasta YD-Deks koluna alınmıştır. Hastaların çoğunluğu erkek (%59) ve beyazdır (%79); genel popülasyon için medyan yaş 64'tür (min, maks: 35, 87 yaş).
Pom + DD-Deks kolundaki hastalara 28 günlük her siklusun 1 ila 21. günlerinde oral yolla 4 mg pomalidomid verilmiştir. DD-Deks (40 mg) 28 günlük her bir siklusun 1, 8, 15 ve 22. günlerinde günde bir defa uygulanmıştır. YD-Deks kolu için, deksametazon (40 mg) 28 günlük (her bir) siklusun 1 ila 4, 9 ila 12 ve 17 ila 20. günleri arasında günde bir defa verilmiştir. 75 yaş üstü hastalara, 20 mg deksametazon dozu ile tedaviye başlanmıştır. Tedavi, hastalarda hastalık progresyonu gözlenene kadar devam ettirilmiştir.
Birincil etkililik sonlanım noktası Uluslararası Miyelom Çalışma Grubu (International Myeloma Working Group -IMWG) kriterlerine göre progresyonsuz sağkalım (Progression Free Survival - PFS)'dır. Tedavi amaçlı popülasyon (ITT) için, IMWG kriterlerine dayalı olarak Bağımsız Değerlendirme Kararlaştırma Kurulunun (IRAC) değerlendirmesinde medyan PFS süresi Pom + DD-Deks kolunda 15,7 hafta (%95 GA: 13,0; 20,1); tahmin edilen 26 haftalık olaysız sağkalım oranı %35,99 (± %3,46) olmuştur. YD-Deks kolunda medyan PFS süresi 8,0 hafta (%95 GA: 7,0; 9,0); tahmin edilen 26 haftalık olaysız sağkalım oranı
%12,15 (± %3,63) olmuştur.
Progresyonsuz sağkalım çeşitli alt gruplarda incelenmiştir: cinsiyet, ırk, Doğu Kooperatif Onkoloji Grubu (ECOG) performans durumu, sınıflara ayırma faktörleri (yaş, hastalık popülasyonu, daha önceki antimiyelom tedavileri [2, >2], seçilmiş prognostik anlamlılık parametreleri (başlangıç beta-2 mikroglobülin düzeyi, başlangıç albümin düzeyleri, başlangıç böbrek bozukluğu ve sitogenetik risk) ve daha önceki antimiyelom tedavilere maruziyet ve direnç. Değerlendirilen alt gruptan bağımsız olarak, PFS genel olarak her iki tedavi grubu için ITT popülasyonda gözlenen ile tutarlı bulunmuştur.
ITT popülasyonu için PFS Tablo 11'de özetlenmiştir. ITT popülasyonunda PFS için Kaplan- Meier eğrisi Şekil 2'de gösterilmektedir.
Tablo 11: IMWG Kriterlerine Dayalı olarak IRAC Değerlendirmesi ile Progresyonsuz Sağkalım (Sınıflandırılmış Log Sıra Testi) (ITT Popülasyonu)
| Pom + DD-Deks (N=302) | YD-Deks (N=153) |
Progresyonsuz Sağkalım (PFS), N | 302 (100,0) | 153 (100,0) |
Sansürlenmiş, n (%) | 138 (45,7) | 50 (32,7) |
Progresyon olan/Ölen, n (%) | 164 (54,3) | 103 (67,3) |
Progresyonsuz Sağkalım Süresi (hafta) | ||
Medyan | 15,7 | 8,0 |
Çift yönlü %95 GA | [13,0; 20,1] | [7,0; 9,0] |
Risk Oranı (Pom + DD-Deks: YD-Deks) Çift Yönlü %95 GA | 0,<45 [0,35;0,59] | |
Çift yönlü Log Sıra Testi P-değeri | <0,001 | |
Not: GA=Güven aralığı; IRAC=Bağımsız Değerlendirme Kararlaştırma Kurulu
P-değeri, yukarıdaki Cox modeli ile aynı sınıfta yer alan faktörler ile sınıflandırılmış log sıra testine dayanmaktadır.
Veri kesim tarihi: 07 Eylül 2012
Şekil 2: IMWG Kriterleri ile IRAC Yanıt Değerlendirmesine Dayalı Olarak Progresyonsuz Sağkalım (Sınıflandırılmış Log Sıra Testi) (ITT Popülasyonu)
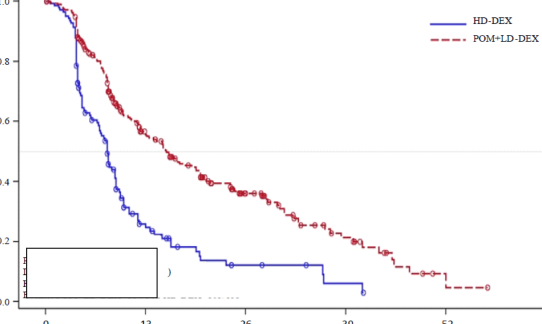
Veri kesim tarihi: 07 Eylül 2012
Genel sağkalım, çalışmanın temel ikincil sonlanım noktasıdır. Pom + DD-Deks kullanan hastaların toplam 226'sı (%74,8) ve YD-Deks kullanan hastaların 95'i (%62,1) veri kesim tarihinde (07 Eylül 2012) yaşamını sürdürmektedir. Pom+DD-Deks kolu için Kaplan-Meier tahminlerinden elde edilen medyan genel sağkalım süresine erişilememiştir, ancak en az 48 hafta olması beklenmektedir ki, bu da %95 güven aralığının alt sınırıdır. YD- Deks kolu için medyan genel sağkalım süresi 34 haftadır (%95 GA: 23,4; 39,9). 1 yıl içinde olaysız sağ kalım oranı Pom + DD-Deks kolu için %52,6 (± %5,72) ve YD-Deks kolu için %28,4 (± %7,51)'dür. Genel sağkalımda görülen fark iki tedavi kolu arasında istatistiksel olarak anlamlıdır (p <0.001).
ITT popülasyonu için genel sağkalım Tablo 12'de özetlenmiştir. ITT popülasyonunda genel sağkalım için Kaplan-Meier eğrisi Şekil 3'de gösterilmektedir.
PFS ve genel sağkalım sonlanım noktalarının sonuçlarına dayalı olarak, bu çalışma için oluşturulmuş olan Veri Takip Kurulu çalışmanın tamamlanmasını ve YD-Deks kolundaki hastaların Pom + DD-Deks koluna aktarılmasını önermiştir.
Tablo 12: Genel Sağkalım: ITT Popülasyonu
|
İstatistikler | Pom + DD-Deks (N=302) | YD-Deks (N=153) |
| N | 302 (100,0) | 153 (100,0) |
Sansürlenmiş | n (%) | 226 (74,8) | 95 (62,1) |
Ölen | n (%) | 76 (25,2) | 58 (37,9) |
Sağkalım Süresi (hafta) | Medyan | tahmin edilemez | 34,0 |
| Çift yönlü %95 GA | [48,1;tahmin edilemez] | [23,4; 39,9] |
Risk Oranı (Pom+DD-Deks :YD-Deks) [Çift Yönlü %95 GA] | 0,53 [0,37,0,74] | ||
Log Sıra Testi Çift Yönlü P-Değeri | <0.001 | ||
Not: GA=Güven aralığı
Medyan, Kaplan-Meier tahminine dayanmaktadır.
Medyan genel sağkalım süresi için %95 güven aralığı
Tedavi grupları ile ilişkili risk fonksiyonlarını karşılaştıran Cox orantısal risk modeline
dayalı olarak,
P-değeri sınıflandırılmamış log sıra testine dayanmaktadır. Veri kesim tarihi: 07 Eylül 2012
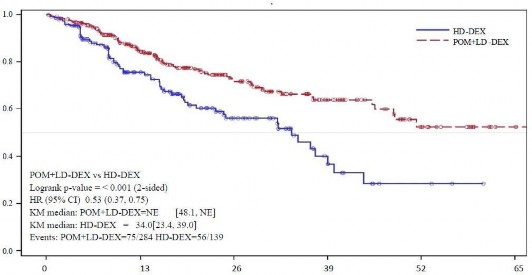
Şekil 3: Genel Sağkalım için Kaplan-Meier Eğrisi (ITT Popülasyonu)
Genel Sağkalım (hafta)
Veri kesim tarihi: 07 Eylül 2012
Pediyatrik popülasyon
Faz 1 tek kollu, açık etiketli, doz artırma çalışmasında, pediyatrik hastalarda pomalidomidin maksimum tolere edilen dozu (MTD) ve / veya önerilen Faz 2 dozu (RP2D), 28 günlük bir döngünün 1. gününden 21. gününe kadar, oral yolla 2.6 mg / m / gün olarak belirlenmiştir.
Tekrarlayan veya progresif yüksek dereceli glioma, medulloblastom, ependimoma veya merkezi sinir sisteminde (CNS) birincil yerleşimli diffüz intrinsik pontin glioması (DIPG) olan, pomalidomid ile tedavi edilen, 4 ila 18 yaşları arasındaki 52 pediyatrik hastada yürütülen Faz 2 çok merkezli, açık etiketli, paralel grup çalışmasında etkililiği ispat edilememiştir.
Faz 2 çalışmasında, yüksek dereceli glioma grubundaki (N = 19) iki hasta, protokol tarafından tanımlanan bir yanıta ulaşmış; bu hastalardan biri kısmi bir yanıt (PR) elde etmiş ve diğer hasta uzun süreli stabil durumda (SD) kalmıştır, bu da objektif bir yanıt (OR) ve %10,5'lik uzun süreli stabil durum (SD) oranıyla (%95GA: 1,3, 33,1) sonuçlanmıştır. Ependimoma grubundaki (N = 9) bir hasta uzun süreli bir stabil durum (SD) elde etmiş ve bu da OR ve
%11,1'lik uzun süreli stabil durum (SD) oranı (%95 CI: 0,3, 48,2) ile sonuçlanmıştır. Diffüz intrinsik pontin glioma (DIPG) grubundaki (N = 9) veya medulloblastoma grubundaki (N = 9) değerlendirilebilir hastaların hiçbirinde doğrulanmış OR veya uzun süreli stabil durum (SD) gözlenmemiştir. Bu Faz 2 çalışmasında değerlendirilen 4 paralel grubun hiçbiri, nesnel yanıt veya uzun süreli stabil durum oranının birincil son noktasını karşılamamıştır.
Pediyatrik hastalarda pomalidomidin genel güvenlilik profili, yetişkinlerdeki bilinen güvenlilik profili ile tutarlıdır. Farmakokinetik (PK) parametreler, Faz 1 ve Faz 2 çalışmalarının Entegre PK Analizinde değerlendirilmiş ve yetişkin hastalarda gözlemlenenlerden anlamlı bir fark olmadığı bulunmuştur (Bkz. Bölüm 5.2).
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: İmmünosupresanlar, diğer immünosupresanlar ATC kodu: L04AX06
Etki mekanizması
Pomalidomid direkt antimiyelom tümorisidal ve immünomodülatör aktiviteye sahiptir ve multipl miyelom tümör hücrelerinin çoğalmasında rol oynayan stromal hücre desteğini inhibe eder. Pomalidomid spesifik olarak hematopoietik tümör hücrelerinin proliferasyonunu inhibe eder ve apopitozisi indükler. Ek olarak, pomalidomid lenalidomide dirençli multipl miyelom hücre dizilerinin proliferasyonunu inhibe eder ve lenalidomide duyarlı ve lenalidomide dirençli hücre dizilerinin her ikisinde de tümör hücrelerinin apopitozisi indüklemede deksametazon ile sinerjistik etki gösterir. Pomalidomid T hücreleri ve Doğal Öldürücü (Natural Killer, NK) hücrelerinin düzenlediği bağışıklığı güçlendirir ve monositler tarafından pro-enflamatuvar sitokinlerin (örn., TNF-ï¡ ve IL-6) üretilmesini inhibe eder. Pomalidomid, endotel hücrelerinin göçü ve adhezyonunu engelleyerek, anjiyogenezi de inhibe eder.
Pomalidomid, deoksiribonükleik asit (DNA) hasar bağlayıcı protein 1 (DDB1), cullin 4(CUL4) ve cullins-1 regülatörünü (Roc1) içeren bir E3 ligaz kompleksinin bir parçası olan protein sereblonuna (CRBN) doğrudan bağlanır ve kompleks içinde CRBN'nin otomatik ubikütinasyonunu inhibe edebilir. E3 ubikütin ligazları, çeşitli substrat proteinlerinin poliubikütinasyonundan sorumludur ve pomalidomid tedavisi ile gözlenen pleyiotropik hücresel etkileri kısmen açıklayabilir.
Pomalidomid in vitro varlığında, substrat proteinleri Aiolos ve İkaros, ubikütinasyon ve daha sonra doğrudan sitotoksik ve immünomodülatör etkilere yol açan bozulma için hedeflenir. İn vivo olarak, pomalidomid tedavisi, nükseden lenalidomid-refrakter multipl miyelomlu hastalarda İkaros seviyelerinde azalmaya yol açmıştır.
Klinik etkililik ve güvenlilik
Pomalidomidin bortezomib ve deksametazon ile kombinasyon tedavisinde
Lenalidomid de dahil olmak üzere en az bir dizi tedavi almış ve son tedavide veya sonrasında hastalık progresyonu göstermiş daha önce tedavi edilen multipl miyelomlu erişkin hastalarda bortezomib ve düşük doz deksametazon (Pom+Btz+DD-Deks) ile kombinasyon halinde pomalidomidin etkililiği ve güvenliliği, Faz III çok merkezli, randomize, açık etiketli çalışmada (CC-4047-MM-007) bortezomib ve düşük doz deksametazon (Btz+DD-Dks) ile karşılaştırılmıştır. Çalışmaya toplam 559 hasta katılmıştır. 281 hasta Pom+Btz+DD-Deks kolunda ve 278 hasta Btz+DD-Deks kolunda randomize edilmiştir. Hastaların %54'ü erkektir ve genel nüfusun medyan yaşı 68'dir (min: 27 â maks: 89 yaş). Hastaların yaklaşık %70'i lenalidomid tedavisine cevap vermemiştir (Pom+Btz+DD-Deks'te %71,2, Btz+DD-Deks'te
%68,7). Hastaların yaklaşık %40'ı 1. relapstadır ve hastaların yaklaşık %73'ü önceki tedavi olarak bortezomib almıştır.
Pom+Btz+DD-deks kolundaki hastalara uygulanmıştır. Her 21 günlük siklusun 1 ila 14. günlerinde oral olarak 4 mg pomalidomid uygulanmıştır. Her iki çalışma kolundaki hastalara, 1 ila 8 siklusları için 21 günlük bir siklusun 1, 4, 8 ve 11. günlerinde ve 9 ve sonrası sikluslar için 21 günlük bir siklusun 1 ve 8. günlerinde bortezomib (1,3 mg/m/doz) uygulanmıştır. Her iki çalışma kolundaki hastalara 1 ila 8 arasındaki sikluslar için 21 günlük bir siklusun 1, 2, 4,
5, 8, 9, 11 ve 12. günlerinde ve 9. siklustan itibaren sonraki 21 günlük döngünün 1, 2, 8 ve 9 günlerinde düşük doz deksametazon (20 mg/gün [≤ 75 yaşında] veya 10 mg/gün [> 75 yaşında]) uygulanmıştır. Toksisiteyi yönetmek için gerektiğinde dozlar azaltılmış ve tedavi geçici olarak kesilmiş veya durdurulmuştur. (bkz. Bölüm 4.2).
Tedavi amaçlı popülasyon (ITT) için birincil etkililik sonlanım noktası, IMWG kriterlerine dayalı olarak Bağımsız Değerlendirme Kararlaştırma Kurulunun (IRAC) değerlendirmesine göre progresyonsuz sağkalım (Progression Free Survival - PFS)'dır. Ortalama 15,9 aylık takipten sonra, Pom+Btz+DD-deks kolunda medyan PFS süresi 11,20 aydır (%95 GA: 9,66; 13,73). Btz + DD-deks kolunda, medyan PFS süresi 7,1 aydır (%95 GA: 5,88; 8,48).
26 Ekim 2017 tarihli veri kesme tarihi kullanılarak genel etkililik veri özeti Tablo 10'da sunulmuştur. ITT popülasyonunda PFS için Kaplan-Meier eğrisi Şekil 1'de gösterilmektedir.
Tablo 10- Genel etkililik özeti
| Pom+Btz+DD-Deks (N = 281) | Btz+DD-Deks (N = 278) |
PFS (ay) |
| |
Medyan zaman (% 95 GA) | 11,20 (9,66; 13,73) | 7,10 (5,88; 8,48) |
HR (% 95 GA), P-değeri | 0,61 (0,49; 0,77); <0,0001 | |
ORR, n (%) | % 82,2 | % 50,0 |
sCR | 9 (3,2) | 2 (0,7) |
CR | 35 (12,5) | 9 (3,2) |
VGPR | 104 (37,0) | 40 (14,4) |
PR | 83 (29,5) | 88 (31,7) |
OR (95% GA) , P-değeri | 5,02 (3,35; 7,52); <0,001 | |
DoR (ay) |
| |
Medyan zaman (% 95 GA) | 13,7 (10,94 ; 18,10) | 10,94 (8,11 ; 14,78) |
HR (% 95 GA) | 0,76 (0,56; 1,02) | |
Btz = bortezomib; GA = Güven aralığı; CR = Tam yanıt; DoR = Yanıt süresi; HR = Tehlike oranı; DD-Deks = düşük doz deksametazon; OR = Olasılık oranı; ORR = Genel yanıt oranı; PFS = progresyonsuz sağkalım; POM = pomalidomid; PR = Kısmi yanıt; sCR = Kati tam yanıt VGPR = Çok iyi kısmi yanıt.
P-değeri sınıflandırılmamış log sıra testine dayanmaktadır.
P-değeri, yaş ile sınırlandırılmış (<=75'e karşı >75), antimiyelom tedavi rejimlerinin önceki sayısına (1'e karşı >1), ve gözlemde beta-2 mikroglobulin (< 3,5 mg/L'ye karşı ≥ 3,5 mg/L â
≤ 5,5 mg/L'ye karşı> 5,5 mg/L) ile CMH testine bağlıdır.
Pom+Btz+DD-deks kolunda medyan tedavi süresi 8,8 ay (12 tedavi siklusu) ve Btz+DD-deks kolunda 4,9 aydır (7 tedavi siklusu).
PFS avantajı, yalnızca bir önceki tedavi rejimini alan hastalarda daha belirgindir. Önceden bir
antimiyelom tedavisi alan hastalarda ortalama PFS süresi Pom+Btz+DD-deks kolunda 20,73 ay (% 95 GA: 15,11; 27,99) ve Btz+DD-deks kolunda 11,63 aydır (%95 GA: 7,52, 15,74).
Pom+Btz+DD-deks tedavisi ile %46 risk azalması gözlendi (HR = 0,54; %95 GA: 0,36;
0,82).
Şekil 1. IMWG Kriterlerine Dayalı olarak IRAC Değerlendirmesi ile Progresyonsuz Sağkalım (Sınıflandırılmış Log Sıra Testi) (ITT Popülasyonu)

Veri kesim tarihi: 26 Ekim 2017
Genel sağkalım (OS) için 15 Eylül 2018 tarihli veri kesimi kullanılarak (26,2 aylık medyan takip süresi) yakın zamandaki ara analizine göre, Kaplan-Meier tahminleri ile medyan OS zamanı Pom+Btz+DDdeks kolu için 40,5 ay ve Btz +DDdeks kolu için 30,5 aydır (Genel olay oranı %43,3 ile birlikte HR = 0,91, % 95 GA: 0,70; 1,18,).
Pomalidomidin deksametazon ile kombinasyon tedavisinde
Pomalidomidin deksametazon ile kombinasyonunun etkililiği ve güvenliliği, lenalidomid ve bortezomib dahil olmak üzere, daha önce en az iki tedavi almış ve son tedavi altındayken hastalık progresyonu gösteren, nüks ve dirençli multipl miyelomu olan, yetişkin hastalarda pomalidomid ve düşük doz deksametazon tedavisinin (Pom + DD-Deks ) tek başına yüksek doz deksametazon (YD-Deks) ile karşılaştırıldığı çok merkezli, randomize, açık etiketli bir Faz III çalışmada (CC-4047-MM-003) değerlendirilmiştir. Çalışmaya toplam 455 hasta dahil edilmiştir: bunlardan 302 hasta Pom + DD-Deks koluna ve 153 hasta YD-Deks koluna alınmıştır. Hastaların çoğunluğu erkek (%59) ve beyazdır (%79); genel popülasyon için medyan yaş 64'tür (min, maks: 35, 87 yaş).
Pom + DD-Deks kolundaki hastalara 28 günlük her siklusun 1 ila 21. günlerinde oral yolla 4 mg pomalidomid verilmiştir. DD-Deks (40 mg) 28 günlük her bir siklusun 1, 8, 15 ve 22. günlerinde günde bir defa uygulanmıştır. YD-Deks kolu için, deksametazon (40 mg) 28 günlük (her bir) siklusun 1 ila 4, 9 ila 12 ve 17 ila 20. günleri arasında günde bir defa verilmiştir. 75 yaş üstü hastalara, 20 mg deksametazon dozu ile tedaviye başlanmıştır. Tedavi, hastalarda hastalık progresyonu gözlenene kadar devam ettirilmiştir.
Birincil etkililik sonlanım noktası Uluslararası Miyelom Çalışma Grubu (International Myeloma Working Group -IMWG) kriterlerine göre progresyonsuz sağkalım (Progression Free Survival - PFS)'dır. Tedavi amaçlı popülasyon (ITT) için, IMWG kriterlerine dayalı olarak Bağımsız Değerlendirme Kararlaştırma Kurulunun (IRAC) değerlendirmesinde medyan PFS süresi Pom + DD-Deks kolunda 15,7 hafta (%95 GA: 13,0; 20,1); tahmin edilen 26 haftalık olaysız sağkalım oranı %35,99 (± %3,46) olmuştur. YD-Deks kolunda medyan PFS süresi 8,0 hafta (%95 GA: 7,0; 9,0); tahmin edilen 26 haftalık olaysız sağkalım oranı
%12,15 (± %3,63) olmuştur.
Progresyonsuz sağkalım çeşitli alt gruplarda incelenmiştir: cinsiyet, ırk, Doğu Kooperatif Onkoloji Grubu (ECOG) performans durumu, sınıflara ayırma faktörleri (yaş, hastalık popülasyonu, daha önceki antimiyelom tedavileri [2, >2], seçilmiş prognostik anlamlılık parametreleri (başlangıç beta-2 mikroglobülin düzeyi, başlangıç albümin düzeyleri, başlangıç böbrek bozukluğu ve sitogenetik risk) ve daha önceki antimiyelom tedavilere maruziyet ve direnç. Değerlendirilen alt gruptan bağımsız olarak, PFS genel olarak her iki tedavi grubu için ITT popülasyonda gözlenen ile tutarlı bulunmuştur.
ITT popülasyonu için PFS Tablo 11'de özetlenmiştir. ITT popülasyonunda PFS için Kaplan- Meier eğrisi Şekil 2'de gösterilmektedir.
Tablo 11: IMWG Kriterlerine Dayalı olarak IRAC Değerlendirmesi ile Progresyonsuz Sağkalım (Sınıflandırılmış Log Sıra Testi) (ITT Popülasyonu)
| Pom + DD-Deks (N=302) | YD-Deks (N=153) |
Progresyonsuz Sağkalım (PFS), N | 302 (100,0) | 153 (100,0) |
Sansürlenmiş, n (%) | 138 (45,7) | 50 (32,7) |
Progresyon olan/Ölen, n (%) | 164 (54,3) | 103 (67,3) |
Progresyonsuz Sağkalım Süresi (hafta) | ||
Medyan | 15,7 | 8,0 |
Çift yönlü %95 GA | [13,0; 20,1] | [7,0; 9,0] |
Risk Oranı (Pom + DD-Deks: YD-Deks) Çift Yönlü %95 GA | 0,<45 [0,35;0,59] | |
Çift yönlü Log Sıra Testi P-değeri | <0,001 | |
Not: GA=Güven aralığı; IRAC=Bağımsız Değerlendirme Kararlaştırma Kurulu
P-değeri, yukarıdaki Cox modeli ile aynı sınıfta yer alan faktörler ile sınıflandırılmış log sıra testine dayanmaktadır.
Veri kesim tarihi: 07 Eylül 2012
Şekil 2: IMWG Kriterleri ile IRAC Yanıt Değerlendirmesine Dayalı Olarak Progresyonsuz Sağkalım (Sınıflandırılmış Log Sıra Testi) (ITT Popülasyonu)

Veri kesim tarihi: 07 Eylül 2012
Genel sağkalım, çalışmanın temel ikincil sonlanım noktasıdır. Pom + DD-Deks kullanan hastaların toplam 226'sı (%74,8) ve YD-Deks kullanan hastaların 95'i (%62,1) veri kesim tarihinde (07 Eylül 2012) yaşamını sürdürmektedir. Pom+DD-Deks kolu için Kaplan-Meier tahminlerinden elde edilen medyan genel sağkalım süresine erişilememiştir, ancak en az 48 hafta olması beklenmektedir ki, bu da %95 güven aralığının alt sınırıdır. YD- Deks kolu için medyan genel sağkalım süresi 34 haftadır (%95 GA: 23,4; 39,9). 1 yıl içinde olaysız sağ kalım oranı Pom + DD-Deks kolu için %52,6 (± %5,72) ve YD-Deks kolu için %28,4 (± %7,51)'dür. Genel sağkalımda görülen fark iki tedavi kolu arasında istatistiksel olarak anlamlıdır (p <0.001).
ITT popülasyonu için genel sağkalım Tablo 12'de özetlenmiştir. ITT popülasyonunda genel sağkalım için Kaplan-Meier eğrisi Şekil 3'de gösterilmektedir.
PFS ve genel sağkalım sonlanım noktalarının sonuçlarına dayalı olarak, bu çalışma için oluşturulmuş olan Veri Takip Kurulu çalışmanın tamamlanmasını ve YD-Deks kolundaki hastaların Pom + DD-Deks koluna aktarılmasını önermiştir.
Tablo 12: Genel Sağkalım: ITT Popülasyonu
|
İstatistikler | Pom + DD-Deks (N=302) | YD-Deks (N=153) |
| N | 302 (100,0) | 153 (100,0) |
Sansürlenmiş | n (%) | 226 (74,8) | 95 (62,1) |
Ölen | n (%) | 76 (25,2) | 58 (37,9) |
Sağkalım Süresi (hafta) | Medyan | tahmin edilemez | 34,0 |
| Çift yönlü %95 GA | [48,1;tahmin edilemez] | [23,4; 39,9] |
Risk Oranı (Pom+DD-Deks :YD-Deks) [Çift Yönlü %95 GA] | 0,53 [0,37,0,74] | ||
Log Sıra Testi Çift Yönlü P-Değeri | <0.001 | ||
Not: GA=Güven aralığı
Medyan, Kaplan-Meier tahminine dayanmaktadır.
Medyan genel sağkalım süresi için %95 güven aralığı
Tedavi grupları ile ilişkili risk fonksiyonlarını karşılaştıran Cox orantısal risk modeline
dayalı olarak,
P-değeri sınıflandırılmamış log sıra testine dayanmaktadır. Veri kesim tarihi: 07 Eylül 2012

Şekil 3: Genel Sağkalım için Kaplan-Meier Eğrisi (ITT Popülasyonu)
Genel Sağkalım (hafta)
Veri kesim tarihi: 07 Eylül 2012
Pediyatrik popülasyon
Faz 1 tek kollu, açık etiketli, doz artırma çalışmasında, pediyatrik hastalarda pomalidomidin maksimum tolere edilen dozu (MTD) ve / veya önerilen Faz 2 dozu (RP2D), 28 günlük bir döngünün 1. gününden 21. gününe kadar, oral yolla 2.6 mg / m / gün olarak belirlenmiştir.
Tekrarlayan veya progresif yüksek dereceli glioma, medulloblastom, ependimoma veya merkezi sinir sisteminde (CNS) birincil yerleşimli diffüz intrinsik pontin glioması (DIPG) olan, pomalidomid ile tedavi edilen, 4 ila 18 yaşları arasındaki 52 pediyatrik hastada yürütülen Faz 2 çok merkezli, açık etiketli, paralel grup çalışmasında etkililiği ispat edilememiştir.
Faz 2 çalışmasında, yüksek dereceli glioma grubundaki (N = 19) iki hasta, protokol tarafından tanımlanan bir yanıta ulaşmış; bu hastalardan biri kısmi bir yanıt (PR) elde etmiş ve diğer hasta uzun süreli stabil durumda (SD) kalmıştır, bu da objektif bir yanıt (OR) ve %10,5'lik uzun süreli stabil durum (SD) oranıyla (%95GA: 1,3, 33,1) sonuçlanmıştır. Ependimoma grubundaki (N = 9) bir hasta uzun süreli bir stabil durum (SD) elde etmiş ve bu da OR ve
%11,1'lik uzun süreli stabil durum (SD) oranı (%95 CI: 0,3, 48,2) ile sonuçlanmıştır. Diffüz intrinsik pontin glioma (DIPG) grubundaki (N = 9) veya medulloblastoma grubundaki (N = 9) değerlendirilebilir hastaların hiçbirinde doğrulanmış OR veya uzun süreli stabil durum (SD) gözlenmemiştir. Bu Faz 2 çalışmasında değerlendirilen 4 paralel grubun hiçbiri, nesnel yanıt veya uzun süreli stabil durum oranının birincil son noktasını karşılamamıştır.
Pediyatrik hastalarda pomalidomidin genel güvenlilik profili, yetişkinlerdeki bilinen güvenlilik profili ile tutarlıdır. Farmakokinetik (PK) parametreler, Faz 1 ve Faz 2 çalışmalarının Entegre PK Analizinde değerlendirilmiş ve yetişkin hastalarda gözlemlenenlerden anlamlı bir fark olmadığı bulunmuştur (Bkz. Bölüm 5.2).
5.2. Farmakokinetik özellikler
Genel ÖzelliklerEmilim
Pomalidomid, maksimum plazma konsantrasyonuna (C) doz uygulamasından sonraki
2 ila 3 saat içerisinde ulaşacak şekilde, tek oral doz olarak uygulamayı takiben en az
%73 oranında emilir. Pomalidomidin sistemik maruziyeti (EAA) yaklaşık olarak doğrusal ve dozla orantılı bir şekilde artar. Çoklu dozları takiben, EAA'da pomalidomid %27 ila %31 arası bir birikim oranına sahiptir.
Yüksek yağlı ve yüksek kalorili öğünle birlikte uygulanması ortalama plazma C'ını yaklaşık %27'ye kadar azaltarak emilim hızını yavaşlatır, ancak ortalama EAA'da %8'lik bir azalmayla genel emilim miktarı üzerinde minimal bir etkiye sahiptir. Pomalidomid yemeklerle birlikte veya yemeklerden ayrı olarak alınabilir.
Dağılım
Pomalidomid kararlı durumda 62 ve 138 L arasında bir ortalama sanal dağılım hacmine (Vd/F) sahiptir. Pomalidomid, günde bir defa 2 mg dozunda 4 gün boyunca uygulandıktan sonra, doz sonrası 4. saatte (yaklaşık olarak T) sağlıklı bireylerin semenine, plazma düzeyinin %67'si kadar bir konsantrasyonda dağılır. İn vitro pomalidomid enantiyomerlerinin insan plazmasındaki proteinlere bağlanma oranı %12 ila %44 arasında değişmektedir ve konsantrasyona bağımlı değildir.
Biyotransformasyon
Pomalidomid, tek bir oral doz [C]-pomalidomid (2 mg) uygulanmış sağlıklı bireylerde in vivo ortamda dolaşımdaki majör bileşendir (yaklaşık olarak plazma radyoaktivitesinin %70'i). Ana veya plazma toplam radyoaktivitesine göre >%10 oranında herhangi bir metabolit bulunmamıştır.
Atılan radyoaktivitenin baskın metabolik yolları, sonraki glukuronidasyon ile hidroksilasyon veya hidrolizdir. İn vitro, CYP1A2 ve CYP3A4 pomalidomidin CYP-aracılı hidroksilasyonunda yer alan birincil enzimler olarak belirlenirken, CYP2C19 ve CYP2D6'nın küçük ek katkılarının olduğu saptanmıştır. Pomalidomid aynı zamanda in vitro bir P- glikoprotein substratıdır. Pomalidomidin güçlü CYP3A4/5 ve P-gp inhibitörü ketokonazol ile veya güçlü CYP3A4/5 indükleyicisi karbamazepin ile eşzamanlı uygulanmasının, pomalidomid maruziyeti üzerine klinik olarak anlamlı bir etkisi olmamıştır. Güçlü CYP1A2 inhibitörü fluvoksaminin ketokonazol varlığında pomalidomid ile birlikte uygulanması pomalidomid ile ketokonazole kıyasla pomalidomide ortalama maruziyeti %90 güven aralığı ile [%91 ila %124] %107'ye kadar artırmıştır. Tek başına bir CYP1A2 inhibitörünün metabolizma değişikliklerine etkisini değerlendirmek üzere yapılan ikinci bir çalışmada, pomalidomid ile tek başına fluvoksaminin eşzamanlı olarak uygulanması pomalidomide ortalama maruziyeti, tek başına pomalidomide kıyasla %90 güven aralığı ile [%98 ila %157)
%125 artırmıştır. Güçlü CYP1A2 inhibitörleri (örn., siprofloksasin, enoksasin ve fluvoksamin) pomalidomid ile eşzamanlı olarak uygulanırsa, pomalidomid dozu %50 azaltılmalıdır. CYP1A2 izoformunun tütün ile indüklendiği göz önünde bulundurularak, sigara içenlere pomalidomid uygulamasının, pomalidomidin sigara içmeyenlerdeki maruziyeti ile karşılaştırıldığında maruziyet ile ilgili olarak klinik etkisi olmamıştır.
İn vitro verilere dayalı olarak pomalidomid sitokrom P-450 izoenzimlerinin bir inhibitörü veya indükleyicisi değildir ve çalışılmış herhangi bir ilaç taşıyıcısını inhibe etmemiştir. Pomalidomid bu yolakların substratları ile eşzamanlı uygulandığında, klinik olarak anlamlı ilaç-ilaç etkileşmeleri beklenmez.
Eliminasyon
Pomalidomid, sağlıklı gönüllülerde yaklaşık 9,5 saatlik ve multipl miyelomu olan hastalarda yaklaşık 7,5 saatlik medyan plazma yarılanma ömrü ile elimine edilir. Pomalidomid, yaklaşık 7-10 L/s'lik ortalama toplam vücut klerensine (CL/F) sahiptir.
Sağlıklı bireylere tek doz oral [C]-pomalidomid (2 mg) uygulanmasını takiben radyoaktif dozun %73 ve %15'i sırasıyla idrar ve feçes ile atılırken, uygulanan radyoaktif karbon dozunun %2 ve %8'i idrar ve feçeste pomalidomid şeklinde atılmıştır.
Pomalidomid atılmadan önce büyük ölçüde metabolize edilir, ortaya çıkan metabolitler başlıca idrarla atılır. İdrardaki baskın 3 metabolit (hidroliz veya hidroksilasyon ve ardından glukuronidasyon ile oluşan), idrara geçen dozun sırasıyla yaklaşık %23, %17 ve %12'sini oluşturur.
CYP-bağımlı metabolitler, toplam atılan radyoaktivitenin yaklaşık %43'ünü oluştururken, CYP-bağımlı-olmayan hidrolitik metabolitler %25'ini ve değişmeden atılan pomalidomid de
%10'unu oluşturur (%2 idrarla ve %8 feçes ile).
Popülasyon Farmakokinetikleri
İki kompartmanlı bir modelin kullanıldığı popülasyon farmakokinetik analizine göre, sağlıklı gönüllüler ve MM hastaları benzer görünür klerense (CL/F) ve sanal santral dağılım hacmine (V/F) sahiptir. Pomalidomid periferik dokularda sağlıklı gönüllülerdekine göre 3,7 kat daha
yüksek sanal periferik dağılım klerensi (Q/F) ve 8 kat daha yüksek sanal periferik dağılım hacmi (V/F) olacak şekilde tümörler tarafından daha yüksek oranda alınmıştır.
Hastalardaki karakteristik özellikler
Böbrek yetmezliği
Bu popülasyonda yapılan farmakokinetik analizler böbrek yetmezliği olan hastalarda (kreatinin klerensi veya hesaplanmış glomerüler filtrasyon hızı [eGFR] ile tanımlanan) pomalidomid farmakokinetik parametrelerinin normal böbrek fonksiyonuna (CrCl ≥60 mL/dakika) sahip hastalarla önemli düzeyde farklılık göstermediği görülmüştür. Pomalidomide ortalama normalize EAA maruziyeti, normal böbrek fonksiyonuna sahip hastalara kıyasla orta şiddette böbrek yetmezliği olan hastalarda (eGFR ≥30 ila ≤45 mL/dakika/1,73 m) %90 güven aralığı ile [%77,4 ila %120,6] %98,2'dir. Pomalidomide ortalama normalize EAA maruziyeti normal böbrek fonksiyonuna sahip hastalara kıyasla diyaliz gerektirmeyen ciddi böbrek yetmezliği olan hastalarda (CrCl <30 mL/dakika veya eGFR <30 mL/dakika/1,73 m) %90 güven aralığı ile [%79,7 ila %127,0] %100,2'dir. Pomalidomide ortalama normalize EAA maruziyeti normal böbrek fonksiyonuna sahip hastalara kıyasla diyaliz gerektiren ciddi böbrek yetmezliği olan hastalarda (CrCl <30 mL/dakika, diyaliz gerektiren) %90 güven aralığı ile [%7,5 ila %70,0] %35,8 artmıştır. Bu böbrek yetmezliği gruplarının her birinde pomalidomide maruziyette ortalama değişiklikler doz ayarlaması gerektirecek bir boyutta değildir.
Karaciğer yetmezliği
Farmakokinetik parametreler sağlıklı gönüllülere kıyasla karaciğer yetmezliği olan hastalarda (Child-Pugh kriterleri ile tanımlanan) çok hafif düzeyde değişiklik göstermiştir. Pomalidomide ortalama maruziyet sağlıklı gönüllülere kıyasla hafif düzeyde karaciğer yetmezliği olan hastalarda %90 güven aralığı ile [%9 ila %110] %51 artmıştır. Pomalidomide ortalama maruziyet sağlıklı gönüllülere kıyasla orta düzeyde karaciğer yetmezliği olan hastalarda %90 güven aralığı ile [%13 ila %119] %58 artmıştır. Pomalidomide maruziyet sağlıklı gönüllülere kıyasla ağır karaciğer yetmezliği olan hastalarda %90 güven aralığı ile [%24 ila %138] %72 artmıştır. Bu yetmezlik gruplarının her birinde pomalidomide maruziyetteki ortalama artışlar doz şeması veya doz ayarlaması gerektirecek boyutta değildir (bkz. Bölüm 4.2).
Pediyatrik popülasyon
Nükseden veya progresif primer beyin tümörü olan çocuklarda ve genç erişkinlerde tek bir oral pomalidomid dozunu takiben, ortalama Tdeğeri dozdan 2 ila 4 saat sonrasıdır ve 74,8 (%59,4), 79,2 (%51.7) ve 104 (%18,3) ng/mL geometrik ortalama C(%CV) değerleri sırasıyla 1,9, 2,6 ve 3,4 mg/m doz seviyelerine karşılık gelmektedir. EAAve EAA, düşük 2 dozda yaklaşık 700 ila 800 saat·ng/mL aralığında ve yüksek dozda yaklaşık 1200 saat·ng/mL aralığında toplam maruziyetle benzer eğilimleri izlemiştir. Tahmini yarı ömürleri, yaklaşık 5 ila 7 saat aralığındadır.
MTD'de yaşa ve steroid kullanımına göre tabakalaşmaya atfedilebilecek net bir eğilim yoktur. Genel olarak veriler, EAA'nın pomalidomid dozundaki artışla neredeyse orantılı olarak arttığını, C'taki artışın ise genellikle orantılı olandan daha az olduğunu göstermektedir.
1.9 mg/m/gün ila 3.4 mg/m/gün oral uygulama doz seviyelerini takiben pomalidomidin farmakokinetiği, tekrarlayan veya progresif pediyatrik beyin tümörlerinde bir Faz 1 ve Faz 2 çalışmasının entegre bir analizinde 4 ila 20 yaş arası 70 hastada belirlenmiştir. Pomalidomid konsantrasyon-zaman profilleri, birinci dereceden absorpsiyonlu ve eliminasyonlu tek bölmeli bir PK modeli ile uygun bir şekilde tanımlanmıştır. Pomalidomid, orta derecede değişkenlikle
doğrusal ve zamanla değişmeyen bir farmakokinetik (PK) sergilemiştir. CL/F, Vc/F, Ka, pomalidomidin gecikme süresinin tipik değerleri sırasıyla 3.94 L/saat, 43.0 L, 1.45 saat ve
0.454 saattir. Pomalidomidin terminal eliminasyon yarı ömrü 7.33 saattir. Vücut yüzey alanı (BSA) dışında, yaş ve cinsiyet dahil olmak üzere test edilen ortak değişkenlerin hiçbiri pomalidomid farmakokinetiği (PK) üzerinde etkiye sahip değildir. BSA, pomalidomid CL/F ve Vc/F'nin istatistiksel olarak anlamlı bir ortak değişkeni olarak tanımlanmış olmasına rağmen, BSA'nın maruziyet parametreleri üzerindeki etkisi klinik olarak anlamlı kabul edilmemiştir.
Genel olarak, çocuklar ve yetişkin hastalar arasında pomalidomid farmakokinetiği (PK) açısından önemli bir fark yoktur.
Geriyatrik hastalarda:
Sağlıklı gönüllülerde ve multipl miyelomlu hastalarda yapılan farmakokinetik analizlerde, hasta yaşının (19-83 yaş) pomalidomidin oral klerensi üzerinde anlamlı bir etkisi olmadığı gözlenmiştir. Klinik çalışmalarda, pomalidomid kullanan yaşlı (>65 yaş) hastalarda doz ayarlaması gerekmemiştir (bkz. Bölüm 4.2).
5.3. Klinik öncesi güvenlilik verileri
Tekrarlanan doz toksisite çalışmaları
Sıçanlarda, pomalidomid 50, 250 ve 1000 mg/kg/gün dozunda 6 ay süreyle kronik olarak uygulandığında iyi tolere edilmiştir. 1000 mg/kg/güne kadar herhangi bir advers bulgu tespit edilmemiştir (4 mg klinik doza göre 175 kat maruziyet).
Pomalidomid, maymunlarda, 9 ay kadar süreyle tekrarlanan doz çalışmalarında incelenmiştir. Bu çalışmalarda maymunlar, pomalidomidin etkilerine sıçanlardan daha yüksek duyarlılık göstermiştir. Maymunlarda gözlenen başlıca toksisiteler, hematopoietik/lenforetiküler sistemle ilişkilendirilmiştir. Maymunlarda 0,05, 0,1 ve 1 mg/kg/gün dozları ile yapılan 9 aylık çalışmada, 1 mg/kg/gün dozunda 6 hayvanda morbidite ve erken ötenazi bildirilmiştir ve bu pomalidomide yüksek maruziyetteki (4 mg klinik doza göre 15 kat maruziyet oranı) immünosupresif etkilere (stafilokok enfeksiyonu, azalmış periferik kan lenfositleri, kalın bağırsakta kronik enflamasyon, histolojik lenfoid azalması ve kemik iliğinde hiposellülerite) bağlanmıştır. 4 maymunun erken ötenazisine neden olan bu immünosüpresif etkiler kötü sağlık koşulları (sulu dışkı, iştahsızlık, besin alımının azalması ve kilo kaybı) yüzündendir; bu hayvanların histopatolojik incelemeleri, kalın bağırsaklarda kronik enflamasyon ve ince bağırsaklarda villöz atrofi olduğunu göstermiştir. Stafilokok enfeksiyonu 4 maymunda görülmüştür; bu hayvanlardan 3'ü antibiyotik tedavisine yanıt vermiştir ve 1 hayvan tedavi edilmeden ölmüştür. Ayrıca, akut miyelojenöz lösemi ile uyumlu bulgular bir maymunun ötenazisine yol açmıştır; bu hayvanda gözlenen klinik gözlemler ve klinik patoloji ve/veya kemik iliği değişiklikleri immünosupresyon ile tutarlı olmuştur. ALP ve GGT düzeyindeki yükselmeler ile ilişkili minimum veya hafif safra kanalı proliferasyonu da 1 mg/kg/gün dozunda gözlenmiştir. İyileşen hayvanlar değerlendirildiğinde, 1 mg/kg/gün grubundaki 1 hayvanda görülen intrahepatik safra kanallarının proliferasyonu haricindeki, tüm tedaviyle ilişkili bulguların dozun kesilmesinden 8 hafta sonrasında geriye döndüğü görülmüştür. Advers Etkinin Gözlenmediği En Düşük Doz 0,1 mg/kg/gün olmuştur (4 mg klinik doza göre 0,5 kat maruziyet oranı).
Genotoksisite/karsinojenisite
Pomalidomid, bakteri ve memeli mutasyon deneylerinde, mutajenik olarak bildirilmemiştir ve insan periferik kan lenfositlerinde kromozomal sapmaları veya 2000 mg/kg/güne kadar olan dozların uygulandığı sıçanların kemik iliklerinde polikromatik eritrositlerde
mikroçekirdek oluşmasını indüklememiştir. Karsinojenisite çalışmaları gerçekleştirilmemiştir.
Fertilite ve erken embriyonik gelişim
Sıçanlardaki fertilite ve erken embriyonik gelişim çalışmasında, pomalidomid erkek ve dişi sıçanlara 25, 250 ve 1000 mg/kg/gün dozlarında uygulanmıştır. Gebeliğin 13. günündeki uterus muayenesinde ortalama canlı embriyo sayısında azalma ve tüm doz düzeylerinde implantasyon sonrası canlı embriyo kayıplarında artma görülmüştür. Bu nedenle, bu gözlenen etkiler için Advers Etkinin Gözlenmediği En Düşük Doz <25 mg/kg/gündür (Bu test edilen en düşük dozda EAA39.960 ng.s/mL (nanogram*saat/mililitre) ve maruziyet oranı 4 mg klinik doza göre 99 kattır). Bu çalışmada tedavi edilen erkekler, tedavi edilmemiş dişilerle çiftleştirildiklerinde, tüm uterus parametreleri kontroller ile benzer olmuştur. Bu sonuçlara dayalı olarak, gözlenen etkiler dişilerin tedavi edilmelerine bağlanmıştır.
Embriyo-fetal gelişim
Pomalidomidin, sıçanlar ve tavşanlara majör organogenez sırasında uygulandığında teratojenik olduğu bulunmuştur. Sıçan embriyofetal gelişim toksisite çalışmasında, idrar torbasının yokluğu, tiroit bezinin yokluğu ve lumbal ve torasik vertebral unsurların (merkezi ve/veya nöral kemerler) birleşmesi ve yanlış dizilmesi şeklindeki malformasyonlar tüm doz düzeylerinde (25, 250 ve 1000 mg/kg/gün) gözlenmiştir.
Bu çalışmada herhangi bir maternal toksisite gözlenmemiştir. Bu nedenle, maternal Advers Etkinin Gözlenmediği En Düşük Doz 1000 mg/kg/gün ve gelişimsel toksisite için Advers Etkinin Gözlenmediği En Düşük Doz <25 mg/kg/gündür (EAAGebeliğin 17. gününde test edilen bu en düşük dozda 34.340 ng.s/mL ve maruziyet oranı 4 mg klinik doza göre 85 kattır). Pomalidomid, tavşanlara 10 ila 250 mg/kg arasında değişen dozlarla uygulandığında, embriyo-fetal malformasyonlar meydana getirmiştir. Tüm dozlarda özellikle 250 mg/kg/gün dozunda kardiyak anomalilerde artma görülmüştür. 100 ve 250 mg/kg/gün dozlarında, implantasyon sonrası kayıplarda hafif artışlar ve fetal vücut ağırlığında hafif azalmalar meydana gelmiştir. 250 mg/kg/gün dozunda, fetal malformasyonlar ekstremite anomalilerini (bükük ve/veya dönmüş ön- ve/veya arka-bacaklar, eklenmemiş veya eksik parmaklar) ve eşlik eden iskelet malformasyonlarını (kemikleşmemiş metakarpal, yanlış dizilmiş falanks ve metakarpal, eksik parmak, kemikleşmemiş falanks ve kısa kemikleşmemiş veya bükülmüş tibia); beyinde orta derecede lateral ventrikül genişlemesini; sağ subklavyen arterin anormal yerleşmesini; akciğerlerde orta lobun olmamasını; düşük-yerleşimli böbreği; değişmiş karaciğer morfolojisini; eksik veya kemikleşmemiş pelvisi; fazladan torasik kaburgalar için artmış bir ortalamayı ve kemikleşmiş tarsallar için azalmış bir ortalamayı içermektedir. 100 ve 250 mg/kg/gün dozlarında maternal vücut kilo alımında hafif azalma, trigliseridlerde belirgin azalma ve mutlak ve göreceli dalak ağırlıklarında belirgin azalma gözlenmiştir. Maternal Advers Etkinin Gözlenmediği En Düşük Doz 10 mg/kg/gün ve gelişimsel Advers Etkinin Gözlenmediği En Düşük Doz <10 mg/kg/gündür (EAAGebeliğin 19. gününde bu test edilen en düşük dozda 418 ng.s/mL olmuştur ve bu da 4 mg klinik dozdan elde edilen ile benzerdir).
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Mannitol (E421) Prejelatinize nişasta Sodyum stearil fumarat
Jelatin (sığırdan elde edilmiştir) Titanyum dioksit (E171) İndigo karmin (E132)
Sarı demir oksit (E172)
Beyaz mürekkep [Şellak, Titanyum dioksit (E171), Simetikon, Propilen glikol (E1520) ve Amonyum hidroksit (E527)]
6.2. Geçimsizlikler
Yeterli veri yoktur.
6.3. Raf ömrü
48 ay
6.4. Saklamaya yönelik özel tedbirler
25°C'nin altındaki oda sıcaklığında saklayınız.
6.5. Ambalajın niteliği ve içeriği
21 kapsül içeren ambalajda kapsüller Polivinil klorür (PVC)/poliklorotrifloroetilen (PCTFE) blisterlerde, bastırarak açılan alüminyum folyo içerisinde paketlenmiştir.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kapsüller açılmamalı veya ezilmemelidir. Pomalidomid tozu cilt ile temas ederse, cilt hemen ve iyice sabun ve su ile yıkanmalıdır. Pomalidomid mukoz membranlarla temas ederse bol su ile yıkanmalıdır.
Sağlık uzmanları ve bakıcılar, blister veya kapsülü tutarken tek kullanımlık eldivenler giymelidir. Eldivenler cildin maruz kalmasını önlemek için işi bittikten sonra dikkatlice çıkarılmalı, sızdırmaz plastik polietilen torbaya konulmalı ve bölgesel gerekliliklere uygun olarak atılmalıdır. Daha sonra eller su ve sabunla iyice yıkanmalıdır. Hamile olan veya hamile olabileceğinden şüphelenen kadınlar, blister veya kapsülü tutmamalıdır (bkz. Bölüm 4.4).
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj Atıklarının Kontrolü Yönetmelikâlerine uygun olarak imha edilmelidir.
 Diyabet Hastalığı
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır.
Diyabet Hastalığı
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |
 Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir.
Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| POMALEM | 8699525159731 | 80,770.45TL |
| Diğer Eşdeğer İlaçlar |
 |
Sırt Ağrısı Sırt ağrısı birden bire ortaya çıkıp şiddetli (akut) olabilir veya zamanla gelişip daha uzun süreli sorunlara (kronik) neden olabilir. |
 |
Lösemi Kan Kanseri Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür. |
 |
Yüksek Tansiyon Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon atardamarlarınızdaki kanın basıncıdır. |
İLAÇ GENEL BİLGİLERİ
Er-Kim İlaç Sanayi ve Tic. A.Ş.
| Geri Ödeme Kodu | A16941 |
| Satış Fiyatı | 87754.6 TL [ 26 Apr 2024 ] |
| Önceki Satış Fiyatı | 87754.6 TL [ 22 Apr 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699538154884 |
| Etkin Madde | Pomalidomid |
| ATC Kodu | L04AX06 |
| Birim Miktar | 3 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 21 |
| Antineoplastik ve İmmünomodülatör Ajanlar > İmmünsupresif Ajanlar |
| İthal ( ref. ülke : Isvicre ) ve Beşeri bir ilaçdır. |