GLINIUM PLUS 85 MCG7 43 mcg inhilasyon tozu sert kapsül Kısa Ürün Bilgisi
{ Indakaterol Maleat + Glikopironyum Bromur }
Kapsüllerin küçük parçaçıklara ayrılmasını nasıl önlerim?
Cihazın yanındaki kırmızı kulakçıklıklara (düğmelere) bastığınızda (5.basamak), kapsüller kırılabilir ve nefes alırken ağzınıza ya da boğazınıza küçük parçalar kaçabilir. Bunu aşağıdakileri uygulayarak önleyebilirsiniz:
Kırmızı kulakcıklara (düğmelere) yalnızca bir kere basarak.
Kapsülleri kullanmadan önce orjinal ambalajında tutarak.
Kapsülleri 25 oC'nin altındaki oda sıcaklığında saklayarak.
Kapsülleri nemden koruyarak.
Kapsül parçacıkları zararlı mıdır?
Hayır. Kapsül, zararlı olmayan yenilebilir nitelikte jelatinden yapılmıştır. Ağzınıza ya da boğazınıza kaçan jelatin parçacıkları yutulabilir.
Kapsül bölmesinde sıkışan kapsülü nasıl çıkartacağım? İnhalasyon cihazını açın, baş aşağı çevirin ve yavaşça dibine vurun.
4.1. Terapötik endikasyonlar
GLİNİUM PLUS, kronik obstrüktif akciğer hastalığı (KOAH) olan yetişkin hastalarda semptomları hafifletmek için bir idame bronkodilatör tedavisi olarak endikedir.
4.2. Pozoloji ve uygulama şekli
Önerilen doz, bir kapsül içeriğinin günde bir kez, GLİNİUM PLUS inhaler kullanılarak solunmasıdır.
GLİNİUM PLUS'ın her gün aynı saatte uygulanması önerilir. Bir doz kaçırılırsa, aynı gün mümkün olan en kısa sürede alınmalıdır. Hastalara günde birden fazla doz almamaları konusunda bilgilendirilmelidir.
Uygulama şekli:
Sadece inhalasyon yoluyla kullanım içindir. Kapsüller yutulmamalıdır.
Kapsüller sadece GLİNİUM PLUS inhaleri kullanılarak uygulanmalıdır (bkz. Bölüm 6.6). Her
yeni reçete ile birlikte verilen inhaler kullanılmalıdır.
Hastalar beşerî tıbbi ürünün doğru şekilde nasıl uygulanacağı konusunda bilgilendirilmelidir. Solunumda iyileşme yaşamamış olan hastalara, beşerî tıbbi ürünü solumak yerine yutup yutmadıkları sorulmalıdır.
Beşerî tıbbi ürünü uygulamadan önce, kullanma talimatları için bölüm 6.6'ya bakınız.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek yetmezliği
GLİNİUM PLUS, hafif ila orta derecede böbrek yetmezliği olan hastalarda önerilen dozda kullanılabilir. Şiddetli böbrek yetmezliği veya diyaliz gerektiren son dönem böbrek yetmezliği olan hastalarda, yalnızca beklenen fayda, potansiyel riskten daha önemli ise kullanılmalıdır (bkz. Bölüm 4.4 ve 5.2).
Karaciğer yetmezliği
GLİNİUM PLUS, hafif ve orta şiddette karaciğer yetmezliği olan hastalarda önerilen dozda kullanılabilir. Şiddetli karaciğer yetmezliği olan hastalarda GLİNİUM PLUS kullanımına ilişkin veri yoktur, bu nedenle bu hastalarda temkinli olunmalıdır (bkz. Bölüm 5.2).
Pediyatrik popülasyon
GLİNİUM PLUS'ın pediatrik popülasyonda (18 yaş altı) KOAH endikasyonuyla ilgili bir kullanımı yoktur. GLİNİUM PLUS'ın çocuklarda güvenliği ve etkinliği belirlenmemiştir. Mevcut veri bulunmamaktadır.
Geriyatrik popülasyon
GLİNİUM PLUS yaşlı hastalarda (75 yaş ve üstü) önerilen dozda kullanılabilir.
4.3. Kontrendikasyonlar
İndakaterol maleat, glikopironyum bromür ve/veya ürün içeriğindeki yabancı maddelerden herhangi maddelerden birine (bkz. Bölüm 6.1) karşı bilinen aşırı duyarlılık halinde GLİNİUM PLUS kontrendikedir.
4.4. Özel kullanım uyarıları ve önlemleri
GLİNİUM PLUS, diğer uzun etkili beta-adrenerjik agonistler veya uzun etkili muskarinik antagonistler olan GLİNİUM PLUS bileşenlerinin ait olduğu farmakoterapötik grupları içeren beşerî tıbbi ürünlerle birlikte uygulanmamalıdır (bkz. Bölüm 4.5).
Astım
GLİNİUM PLUS, bu endikasyonda veri olmaması nedeniyle, astım tedavisinde kullanılmamalıdır. Uzun etkili beta2-adrenerjik agonistler, astım tedavisi için kullanıldığında astımla ilişkiliölümler de dahil olmak üzere, astıma bağlı ciddi advers olay riskini artırabilir.
Akut kullanım için değildir
GLİNİUM PLUS, akut bronkospazm ataklarının tedavisi için endike değildir.
Aşırı duyarlılık
GLİNİUM PLUS'ın aktif maddeleri olan indakaterol veya glikopironyum uygulamasından
sonra aniden ortaya çıkan aşırı duyarlılık reaksiyonları bildirilmiştir. Alerjik reaksiyonları
düşündüren belirtiler, özellikle anjiyoödem (nefes alma veya yutmada güçlük, dil, dudak ve yüzün şişmesi) ürtiker veya deri döküntüsü ortaya çıkarsa, tedavi derhal kesilmeli ve alternatif tedavi başlatılmalıdır.
Paradoksal bronkospazm
GLİNİUM PLUS uygulaması yaşamı tehdit edebilecek paradoksal bronkospazm ile sonuçlanabilir. Böyle bir durum oluşursa, tedavi derhal kesilmeli ve alternatif tedavi uygulanmalıdır.
![]()
![]()
Glikopironyum ile ilgili antikolinerjik etkiler
Dar açılı glokom
Dar açılı glokomu olan hastalara dair veri yoktur, bu nedenle bu hastalarda GLİNİUM PLUS dikkatli kullanılmalıdır.
Hastalar akut dar açılı glokom belirtileri ve semptomları hakkında bilgilendirilmeli ve bu belirti veya semptomlardan herhangi biri gelişirse GLİNİUM PLUS kullanmayı bırakmaları konusunda bilgilendirilmelidir.
Üriner retansiyon
Üriner retansiyonu olan hastalara dair veri yoktur, bu nedenle bu hastalarda GLİNİUM PLUS dikkatli kullanılmalıdır.
Şiddetli böbrek yetmezliği olan hastalar
Hafif ve orta derecede böbrek yetmezliği olan hastalarda, 1,4 kata kadar olan toplam sistem glikopironyum maruziyetinde (EAAson), şiddetli ve son dönem böbrek yetmezliği olan hastalarda 2,2 kata kadar olan toplam sistem glikopironyum maruziyetinde (EAAson) ılımlı ortalama artış görülmüştür. Diyaliz gerektiren son dönem böbrek yetmezliği olanlar da dahil olmak üzere, şiddetli böbrek yetmezliği olan hastalarda (tahmini glomerüler filtrasyon hızı 30 ml/dak /1,73 m2'nin altında), İndakaterol/Glikopironyum, sadece beklenen fayda potansiyel riskten daha önemli ise kullanılmalıdır (bkz. Bölüm 5.2). Bu hastalar potansiyel advers reaksiyonlar açısından yakından izlenmelidir.
Kardiyovasküler etkiler
GLİNİUM PLUS, kardiyovasküler bozuklukları (koroner arter hastalık, akut miyokard enfarktüsü, kardiyak aritmiler, hipertansiyon) olan hastalarda dikkatle kullanılmalıdır.
Beta-adrenerjik agonistler, bazı hastalarda nabız, kan basıncı ve/veya semptomlardaki artışlarla ölçülen, klinik olarak anlamlı bir kardiyovasküler etki üretebilir. Bu beşerî tıbbi ürünle bu tür etkilerin ortaya çıkması durumunda, tedavinin kesilmesi gerekebilir. Ek olarak, beta-adrenerjik agonistlerin, her ne kadar bu gözlemlerin klinik önemi bilinmese de, T dalgasının düzleşmesi, QT aralığının uzaması ve ST segment depresyonu gibi elektrokardiyografik (EKG) değişiklikler ürettikleri bildirilmiştir. Bu nedenle, QT aralığında bilinen veya şüphelenilen uzaması olan hastalarda veya QT aralığını etkileyen beşerî tıbbi ürünlerle tedavi edilen hastalarda uzun etkili beta2-adrenerjik agonistler, dikkatle kullanılmalıdır.
Stabil olmayan iskemik kalp hastalığı, sol ventrikül yetmezliği, miyokard enfarktüsü öyküsü, aritmi (kronik stabil atriyal fibrilasyon hariç), uzun QT sendromu öyküsü olan veya QTc
(Fridericia yöntemi) uzamış (> 450 ms) hastalar klinik çalışmalarda çalışma dışı bırakılmıştır, dolayısıyla bu hasta gruplarında deneyim yoktur. Bu hasta gruplarında GLİNİUM PLUS dikkatli kullanılmalıdır.
Hipokalemi
Beta-adrenerjik agonistler, bazı hastalarda olumsuz kardiyovasküler etkilere sebep olma potansiyeline sahip, beligin hipokalemiye sebep olabilir. Serum potasyumundaki azalma genellikle geçicidir, takviye gerektirmez. Şiddetli KOAH hastalarında, hipokalemi hipoksi ve eşlik eden tedavi ile şiddetlenebilir, bu da kardiyak aritmilere duyarlılığı artırabilir (bkz. Bölüm 4.5).
GLİNİUM PLUS'ın önerilen terapötik dozunda yapılan klinik çalışmalarında, hipokaleminin klinik olarak anlamlı etkileri gözlenmemiştir (bkz. Bölüm 5.1).
![]()
Hiperglisemi
Yüksek dozda beta-adrenerjik agonistlerin solunması, plazma glikozunda artışlara neden olabilir. Diyabetik hastalarda GLİNİUM PLUS ile tedaviye başlandıktan sonra plazma glikozu daha yakından izlenmelidir.
Uzun süreli klinik çalışmalar sırasında, önerilen dozda GLİNİUM PLUS kullanan daha fazla hasta, plaseboya (%2,7) kıyasla, kan şekerinde klinik olarak kayda değer değişiklikler (%4,9) yaşamıştır. GLİNİUM PLUS, diyabetes mellitus'un iyi kontrol edilmediği hastalarda araştırılmamıştır, bu nedenle bu tür hastalarda dikkatli ve uygun izleme önerilmektedir.
Genel rahatsızlıklar
GLİNİUM PLUS, konvulsif rahatsızlıkları veya tirotoksikozu olan hastalarda ve beta- adrenerjikagonistlere alışılmadık derecede duyarlı olan hastalarda dikkatle kullanılmalıdır.
Yardımcı maddeler
Bu beşerî tıbbi ürün laktoz içerir. Galaktoz intoleransı, toplam laktaz yetmezliği veya glikoz- galaktoz malabsorpsiyonu gibi nadir kalıtsal problemleri olan hastalar bu beşerî tıbbi ürünü kullanmamalıdır.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Her ikisi de etkin madde olan ve kararlı durum şartları altında oral yolla uygulanan inhale indakaterol ve glikopironyumun birlikte uygulanması, her iki etkin maddenin de farmakokinetiğini etkilememiştir.
GLİNİUM PLUS ile spesifik bir etkileşim çalışması yapılmamıştır. Etkileşim potansiyeli hakkında bilgi, iki etkin maddenin her birinin potansiyeline dayanmaktadır.
Aşağıdakilerle birlikte kullanımı önerilmemektedir
Beta-adrenerjik blokerler
Beta-adrenerjik blokerler, beta-adrenerjik agonistlerin etkisini zayıflatabilir veya antagonize edebilir. Bu nedenle, GLİNİUM PLUS, kullanımları için zorlayıcı nedenler olmadıkça, beta- adrenerjik blokerlerle (göz damlaları dahil) birlikte verilmemelidir. Gerektiğinde, kardiyoselektif beta-adrenerjik blokerler tercih edilmeli, ancak dikkatle uygulanmalıdır.
Antikolinerjikler
GLİNİUM PLUS'ın antikolinerjikiçerendiğerbeşerîtıbbiürünlerle birlikte uygulanması
Sempatomimetikler
Diğer sempatomimetiklerin (tek başına veya kombinasyon terapisinin bir parçası olarak) birlikte uygulanması, indakaterolün advers etkilerini güçlendirebilir (bkz. Bölüm 4.4).
Aşağıdakilerle birlikte kullanımda dikkat edilmesi gerekmektedir
Hipokalemi tedavisi
Eşlik eden ve metilksantin türevleri, steroidler veya potasyum tutucu olmayan diüretiklerle yapılan hipokalemik tedavi, beta-adrenerjik agonistlerin olası hipokalemik etkisini güçlendirebilir, bu nedenle dikkatli kullanılmalıdır (bkz. Bölüm 4.4).
Aşağıdakilerle birlikte kullanımında dikkate alınması gerekenler
Metabolik ve taşıyıcı tabanlı etkileşimler
İndakaterol klerensi, CYP3A4 ve P-glikoproteinin (P-gp) önemli katkı maddelerinin inhibisyonu, indakaterolün sistemik maruziyetini iki katına kadar çıkarır. Maruziyetin büyüklüğündeki etkileşimlere bağlı artış, önerilen maksimum indakaterol dozunun iki katına kadar olan dozlarda bir yıla kadar klinik çalışmalarda indakaterol ile yapılan güvenlilik deneyimi göz önüne alındığında, herhangi bir güvenlilik endişesi yaratmaz.
Simetidin veya diğer organik katyon taşıyıcı inhibitörler
Sağlıklı gönüllülerde yapılan bir klinik çalışmada, glikopironyumun renal atılımına katkıda bulunduğu düşünülen organik katyon taşınmasının bir inhibitörü olan simetidin, glikopironyuma toplam maruz kalmayı (EAA) %22 oranında arttırmış ve renal klerensi %23 oranında azaltmıştır. Bu değişikliklerin büyüklüğüne bağlı olarak, glikopironyum, simetidin veya organik katyon taşıyıcının diğer inhibitörleri ile birlikte uygulandığında, klinik olarak anlamlı ilaç etkileşimi beklenmez.
4.6. Gebelik ve laktasyon
Genel Tavsiye:Gebelik Kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon):
Çocuk doğurma potansiyeli bulunan kadınlarda ve doğum kontrolü (kontrasepsiyon) uygulayanlarda kullanımına ilişkin herhangi bir veri yoktur.
![]()
Gebelik dönemi:
Hamile kadınlarda GLİNİUM PLUS kullanımıyla ilgili mevcut veri bulunmamaktadır. Hayvan çalışmaları, klinik olarak anlamlı maruziyetlerde üreme toksisitesi ile ilgili doğrudan veya dolaylı zararlı etkiler olduğunu göstermemektedir (bkz. Bölüm 5.3).
İndakaterol, uterus düz kasında gevşetici bir etki nedeniyle doğumu engelleyebilir. Bu nedenle, GLİNİUM PLUS sadece hasta için beklenen fayda, fetusun potansiyel riski için gerekçe oluşturuyorsa, hamilelik sırasında kullanılmalıdır.
Laktasyon dönemi:
İndakaterol, glikopironyum ve metabolitlerinin anne sütüne geçip geçmediği bilinmemektedir. Mevcut farmakokinetik/toksikolojik veriler, indakaterol, glikopironyum ve metabolitlerinin emziren sıçanların sütüyle atılımını göstermiştir. GLİNİUM PLUS'ın emziren kadınlar tarafından kullanılması, ancak anne için beklenen faydanın, bebek için olası herhangi bir riskten daha fazla olması durumundadüşünülmelidir(bkz.Bölüm5.3).
Üreme yeteneği /Fertilite
Üreme çalışmaları ve hayvanlardaki diğer veriler, hem erkeklerde hem de kadınlarda doğurganlıkla ilgili bir endişeye işaret etmemektedir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
GLİNİUM PLUS'ın araç ve makine kullanma yeteneği üzerinde hiçbir etkisi yoktur. Bununla birlikte, baş dönmesini de içeren sersemlik hali ortaya çıkması, araç ve makine kullanma yeteneğini etkileyebilir (bkz.Bölüm 4.8).
4.8. İstenmeyen etkiler
Güvenlilik profilinin sunumu, GLİNİUM PLUS ve etkin maddelerin her biriyle ilgili deneyime dayanmaktadır.
Güvenlilik profilinin özeti
İndakaterol / Glikopironyum ile güvenlilik deneyimi, 15 aya kadar önerilen terapötik dozda maruziyetten oluşmaktaydı.
İndakaterol / Glikopironyum, her bir bileşene benzer advers reaksiyonlar göstermiştir. indakaterol ve glikopironyum içerdiğinden, bu bileşenlerin her biriyle ilişkili advers reaksiyonların türü ve şiddeti, kombinasyonda beklenebilir.
Güvenlilik profili, kombinasyonun her bir bileşeni ile ilişkili tipik antikolinerjik ve beta- adrenerjik semptomlarla karakterizedir. Beşeri tıbbi ürünle ilgili diğer en yaygın advers reaksiyonlar (İndakaterol / Glikopironyum için hastaların en az %3'ü ve ayrıca plasebodan daha büyük) öksürük, nazofarenjit ve baş ağrısı idi.
Advers reaksiyonların tablo halinde özeti
Klinik çalışmalar sırasında ve pazarlama sonrası kaynaklardan tespit edilen advers reaksiyonlar MedDRA sistem organ sınıfı tarafından listelenmiştir (Tablo 1). Advers reaksiyonlar, her sistem organ sınıfı içinde, en sık görülen reaksiyonlar önce olmak üzere, sıklığa göre sıralanır. Her bir sıklık grubunda, advers reaksiyonlar azalan ciddiyet sırasına göre sunulmaktadır. Ek olarak, her advers reaksiyon için karşılık gelen sıklık sınıflandırması aşağıdaki düzene dayanmaktadır: çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila <1/100); seyrek (≥1/10.000, <1/1.000); çok seyrek (<1/10.000); bilinmiyor (eldeki verilerden hareketle belirlenemiyor).
Tablo 1 Advers reaksiyonlar
Advers reaksiyonlar | Sıklık sınıflandırması |
Enfeksiyonlar ve enfestasyonlar | |
Üst solunum yolu enfeksiyonu | Çok yaygın |
Nazofarenjit | Yaygın |
İdrar yolu enfeksiyonu | Yaygın |
Sinüzit | Yaygın |
Rinit | Yaygın |
Bağışıklık sistemi hastalıkları | |
Aşırı duyarlılık | Yaygın |
Anjioödem | Yaygın olmayan |
Metabolizma ve beslenme hastalıkları | |
Hiperglisemi ve diabetes mellitus | Yaygın |
Psikolojik hastalıklar | |
İnsomnia | Yaygın olmayan |
Sinir sistemi hastalıkları | |
Baş dönmesini de içeren sersemlik hali | Yaygın |
Baş ağrısı | Yaygın |
Parastezi | Seyrek |
Göz hastalıkları | |
Glokom | Yaygın olmayan |
Kardiyak hastalıklar | |
İskemik kalp hastalığı | Yaygın olmayan |
Atriyal fibrilasyon | Yaygın olmayan |
Taşikardi | Yaygın olmayan |
Çarpıntı | Yaygın olmayan |
Solunum, göğüs hastalıkları ve mediyastinal hastalıklar | |
Öksürük | Yaygın |
Boğaz tahrişi dahil olmak üzere orofaringeal ağrı | Yaygın |
Paradoksal bronkospazm | Yaygın olmayan |
Disfoni | Yaygın olmayan |
Epistaksis | Yaygınolmayan |
Gastrointestinal hastalıklar |
|
Dispepsi | Yaygın |
Diş çürüğü | Yaygın |
Gastroenterit | Yaygın olmayan |
Ağız kuruluğu | Yaygın olmayan |
Deri ve deri altı doku hastalıkları |
|
Kaşıntı/döküntü | Yaygın olmayan |
Kas-iskelet sistemi hastalıkları, bağ dokusu ve kemik hastalıkları |
|
Kas-iskelet sistemi ağrısı | Yaygın olmayan |
Kas spazmı | Yaygın olmayan |
Miyalji | Yaygın olmayan |
Ekstremitede ağrı | Yaygın olmayan |
Böbrek ve idrar yolu hastalıkları |
|
Mesane tıkanıklığı ve üriner retansiyon | Yaygın |
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar |
|
Yüksek ateş | Yaygın |
Göğüs ağrısı | Yaygın |
Periferik ödem | Yaygın olmayan |
Yorgunluk | Yaygın olmayan |
Seçilen advers reaksiyonların tanımı
Öksürük yaygın, ancak genellikle hafif şiddette.
![]()
Şüpheli advers reaksiyonlarınraporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem
taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; eposta;tufam@titck.gov.tr;tel:0 800 314 00 08; faks:0 312 218 35 99)
4.9. Doz aşımı ve tedavisi
GLİNİUM PLUS ile klinik olarak anlamlı doz aşımı hakkında bilgi yoktur.
Aşırı doz, taşikardi, titreme, çarpıntı, baş ağrısı, bulantı, kusma, uyuşukluk, ventriküler aritmiler, metabolik asidoz, hipokalemi ve hiperglisemi gibi beta-adrenerjik uyarıcıların tipik etkilerinin abartılı olarak ortaya çıkmasına yol açabilir veya artmış intraoküler basınç (ağrı, görme bozuklukları veya gözün kızarmasına neden olur), obstipasyon veya işeme zorlukları gibi antikoinerjik etkileri indükleyebilir. Destekleyici ve semptomatik tedavi endikedir. Ciddi vakalarda hastalar hastaneye yatırılmalıdır. Beta-adrenerjik etkilerin tedavisi için kardiyoselektif beta blokerlerin kullanımı düşünülebilir, ancak beta-adrenerjik blokerlerin kullanımı bronkospazmı provoke edebileceğinden, yalnızca doktor gözetimi altında, çok dikkatli şekilde kullanılmalıdır.
Eğer kırmızı kulakçıklar (düğmeler) sıkışırsa ne yapmalıyım?
Kulakçıkları (düğmeleri) yavaşça kanatçıkların yardımıyla ilk konumuna geri çekin.
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Obstrüktif havayolu hastalıkları için ilaçlar, antikolinerjiklerle kombinasyon halinde adrenerjikler,
ATC kodu: R03AL04
Etki mekanizması
İndakaterol/Glikopironyum
İndakaterol ve glikopironyum birlikte uygulandığında, düz kas gevşemesini sağlamak için farklı reseptörleri ve yolları hedefleyen farklı etki biçimleri nedeniyle, ek etkililik sağlarlar. Merkeziye karşı periferik hava yollarındaki beta-adrenoseptörlerin ve M3-reseptörlerinin diferansiyel yoğunluğu nedeniyle, beta-agonistleri periferik hava yollarının gevşetilmesinde daha etkili olmalıdır, ancak bir antikolinerjik bileşik merkezi hava yollarında daha etkili olabilir. Bu nedenle, insan akciğerinin hem periferik hem de merkezi solunum yollarında bronkodilasyon için beta-adrenerjik agonist ve muskarinik antagonistin bir kombinasyonu faydalı olabilir.
Indakaterol
İndakaterol, günde bir kez uygulama için uzun etkili bir beta-adrenerjik agonisttir. İndakaterol de dahil olmak üzere beta-adrenoseptör agonistlerinin farmakolojik etkileri, en azından kısmen, adenosin trifosfatın (ATP) siklik-3 ', 5'-adenosin monofosfata (siklik AMP) dönüşümünü katalize eden enzim olan intraselüler adenil siklazın stimülasyonuna dayandırılabilir. Artmış siklik AMP seviyeleri bronşiyal düz kasın gevşemesine neden olur. In vitro çalışmalar, indakaterolün beta-reseptörlerinde betave beta-reseptörlerine kıyasla kat kat daha fazla agonist aktiviteye sahip olduğunu göstermiştir.
Solunduğunda, indakaterol lokal olarak akciğerde bronkodilatör olarak hareket eder. İndakaterol, nanomolar potansiyeliolaninsanbeta2-adrenerjik reseptöründe kısmi bir
agonisttir.
Her ne kadar beta-adrenerjik reseptörler bronşiyal düz kasta ve beta-adrenerjik reseptörler insan kalbinde baskın reseptörler olsa da, kalpte toplam adrenerjik reseptörlerin %10 ila
%50'sini oluşturan beta-adrenerjik reseptörler de vardır. Kalpteki varlığı, oldukça seçici beta- adrenerjik agonistlerin bile kardiyak etkilere sahip olma olasılığını artırır.
Glikopironyum
Glikopirronyum, KOAH'ın günde bir kez idame bronkodilatör tedavisi için inhale uzun etkili muskarinik reseptör antagonistidir (antikolinerjik). Parasempatik sinirler, solunum yollarındaki ana bronkokonstriktif sinir yoludur ve kolinerjik ton, KOAH'ta hava akışı tıkanıklığının önemli geri dönüşümlü bileşenidir. Glikopironyum, asetilkolinin hava yolu düz kas hücreleri üzerindeki bronkokonstriktör etkisini bloke eder, böylece hava yollarını genişletir.
Glikopironyum bromür, yüksek duyarlılıklı bir muskarinik reseptör antagonistidir. İnsan M2 reseptöründen fazla M3 reseptörleri için 4 kattan fazla seçicilik, radyoligand bağlanma çalışmaları kullanılarak gösterilmiştir.
Farmakodinamik etkiler
İndakaterol ve glikopironyum kombinasyonu, dozlamadan sonraki 5 dakika içinde hızlı bir etki başlangıcı göstermiştir. Etki, 24 saatlik doz aralığı boyunca sabit kalır.
24 saatlik seri FEVölçümlerinden elde edilen ortalama bronkodilatör etki, 26 haftalık tedaviden sonra 320 ml idi. Etki, tek başına indakaterol, glikopironyum veya tiotropiyum ile karşılaştırıldığında, İndakaterol/Glikopironyum için anlamlı olarak daha yüksekti (her karşılaştırma için 110 ml'lik fark).
Plasebo veya monoterapi bileşenleriyle karşılaştırıldığında, İndakaterol/Glikopironyum etkisi ile ilgili zaman içinde taşifilaksiye dair kanıt yoktu.
Kalp atış hızı üzerindeki etkiler
Sağlıklı gönüllülerdeki kalp atış hızı etkileri, her biri İndakaterol/Glikopironyum 'un önerilen terapötik dozundan 4 kat fazla olan dozların birer saat aralıklarla dört sefer uygulanmasının ardından, plasebo, indakaterol, glikopironyum ve salmeterolün etkileriyle kıyaslanarak araştırıldı.
Plaseboya kıyasla en büyük zaman uyumlu kalp atış hızı artışı +5,69 bpm (% 90 CI [2,71, 8,66]), en büyük azalma -2,51 bpm (% 90 CI [-5,48, 0,47]) idi. Genel olarak zaman içindeki kalp atış hızı üzerindeki etkisi, İndakaterol/Glikopironyum'un tutarlı bir farmakodinamik etkisini göstermedi.
Supraoterapötik doz düzeylerinde KOAH hastalarında kalp atış hızı araştırıldı. İndakaterol/Glikopironyum 'un 24 saat boyunca ortalama kalp atış hızı ve 30 dakika, 4 saat ve 24 saat sonra değerlendirilen kalp atış hızı üzerinde hiçbir ilgili etkisi olmamıştır.
QT aralığı
İndakaterol/Glikopironyum bileşenlerinin klinik doz seviyelerinde QT uzama potansiyeline sahip olduğu bilinmemektedir. Yüksek doz inhale indakaterol (önerilen maksimum terapötik dozun iki katına kadar) ile sağlıklı gönüllülerde yapılan bir kapsamlı QT (TQT) çalışması, QT aralığı üzerinde klinik olarak anlamlı bir etki göstermemiştir. Benzer şekilde, yapılan bir TQT
çalışmasında, glikopironyum için, önerilen terapötik dozun 8 katının solunmasının ardından QT uzaması gözlenmemiştir.
İndakaterol/Glikopironyum 'un QTc aralığı üzerindeki etkileri, sağlıklı gönüllülerde, İndakaterol/Glikopironyum 'un önerilen terapötik dozunun 4 katı fazlasının birer saat aralıklarla dört defada inhalasyonundan sonra araştırıldı. Plaseboya karşı en büyük zaman uyumlu fark 4,62 ms (% 90 CI 0,40, 8,85 ms), en büyük zaman uyumlu azalma -2,71 ms (% 90 CI -6,97, 1,54 ms) idi ve bu da İndakaterol/Glikopironyum 'un, QT aralığı üzerine, bileşenlerinin özelliklerinden beklendiği gibi, ilgili bir etkisinin olmadığını gösterdi.
KOAH hastalarında, 116 mikrogram/86 mikrogram ve 464 mikrogram/86 mikrogram arasındaki İndakaterol/Glikopironyum supraoterapötik dozları, QTcF'li hastaların başlangıç değerine göre 30 ms ve 60 ms arasında daha yüksek bir oran gösterdi (plasebo için %16,0 ila
%21,6 ve 1,9 arasında değişiyor), ancak başlangıç değerden >60 ms QTcF artışı yoktu. Ayrıca 464 mikrogram/86 mikrogramlık en yüksek doz İndakaterol/Glikopironyum seviyesi, daha yüksek oranda mutlak QTcF değerleri > 450 ms (plasebo için %12,2'ye karşı % 5,7) gösterdi.
Serum potasyum ve kan şekeri
Sağlıklı gönüllülerde, tavsiye edilen terapötik İndakaterol/Glikopironyum dozunun 4 katının uygulanmasından sonra, serum potasyum üzerindeki etki çok küçüktü (plaseboya kıyasla maksimum fark â0,14 mmol/l). Kan şekeri üzerindeki maksimum etki 0,67 mmol/ l idi.
Klinik etkililik ve güvenlilik
İndakaterol/Glikopironyum klinik Faz III geliştirme programı, 8.000'den fazla hastanın kaydolduğu altı çalışmayı içermiştir: 1) 26 haftalık plasebo ve aktif kontrollü (günde bir kez indakaterol, günde bir kez glikopironyum, günde bir kez açık etiketli tiotropiyum); 2) 26 haftalık aktif kontrollü (flutikazon/salmeterol günde iki kez) çalışma; 3) 64 haftalık aktif kontrollü (günde bir kez glikopironyum, günde bir kez açık etiketli tiotropiyum) çalışma; 4) 52 haftalık plasebo kontrollü bir çalışma; 5) 3 haftalık plasebo ve aktif kontrollü (günde bir kez tiotropiyum) egzersiz tolerans çalışması; ve 6) 52 haftalık aktif kontrollü (günde iki kez flutikazon/salmeterol) çalışma.
Bu çalışmaların dördünde, orta ila şiddetli KOAH klinik tanısı olan hastalar çalışmaya alındı. 64 haftalık çalışmaya, bir önceki yıl ≥1 orta veya şiddetli KOAH alevlenmesi öyküsü olan şiddetli ila çok şiddetli KOAH tanısı almış hastalar dahil edildi. 52 haftalık aktif kontrollü çalışmada, bir önceki yılda ≥1 orta veya şiddetli KOAH alevlenmesi öyküsü olan orta ila çok şiddetli KOAH'lı hastalar çalışmaya alındı.
Akciğer fonksiyonu üzerindeki etkiler
İndakaterol/Glikopironyum, bir dizi klinik çalışmada akciğer fonksiyonunda (bir saniyede zorlanan ekspiratuar hacim ile ölçülen şekliyle, FEV) klinik olarak anlamlı iyileşmeler gösterdi. Faz III çalışmalarında, ilk dozdan sonraki 5 dakika içinde bronkodilatör etkileri görüldü ve bu etki ilk dozdan itibaren 24 saatlik dozlama aralığı boyunca korundu. Bronkodilatör etkisinde zamanla zayıflama gözlenmedi.
Etkinin büyüklüğü, referans değerde hava akışı sınırlamasının geri çevrilebilirlik derecesine bağlıydı (kısa etkili muskarinik antagonist bronkodilatör ve kısa etkili beta2-agonist
bronkodilatörün uygulanmasıyla test edilmiştir): Başlangıçta en düşük düzelebilirlik derecesine sahip hastalar (<%5), genellikle başlangıçta düzelebilirlik derecesi daha yüksek olan hastalardan (≥%5) daha düşük bronkodilatör yanıtı göstermiştir. 26 haftada (primer sonlanım noktası) İndakaterol/Glikopironyum, en düşük düzelebilirlik dereceli (<%5) (p = 0,053) en düşük FEV'i 80 ml arttırmıştır (İndakaterol/Glikopironyum n = 82; plasebo n = 42) ve başlangıçta düzelebilirlik derecesi (≥%5) plaseboya kıyasla (p <0,001) daha yüksek olan hastalarda 220 ml arttırmıştır (İndakaterol/Glikopironyum n = 392, plasebo n = 190).
En düşük ve en yüksek FEV1:
İndakaterol/Glikopironyum, 26 haftalık primer sonlanım noktasında (p <0,001) plaseboya kıyasla doz sonrası en düşük FEV'i 200 ml arttırdı ve her monoterapi bileşeni tedavi kolu (indakaterol ve glikopironyum) ile tiotropiyum tedavi koluna kıyasla, aşağıdaki tabloda gösterildiği gibi, istatistiksel olarak anlamlı artışlar gösterdi.
Doz sonrası en düşük FEV1 (en küçük ortalama kareler), 1. Gün ve 26. hafta (primer sonlanım noktası)
Tedavi farkı | 1. Gün | 26. Hafta |
İndakaterol/Glikopironyum â plasebo | 190 ml (p<0,001) | 200 ml (p<0,001) |
İndakaterol/Glikopironyum â indakaterol | 80 ml (p<0,001) | 70 ml (p<0,001) |
İndakaterol/Glikopironyum â glikopironyum | 80 ml (p<0,001) | 90 ml (p<0,001) |
İndakaterol/Glikopironyum â tiotropiyum | 80 ml (p<0,001) | 80 ml (p<0,001) |
Ortalama doz öncesi FEV(çalışma ilacı sabah dozundan 45 ve 15 dakika önce alınan değerlerin ortalaması), 26. haftada flutikazon/salmeterol (en küçük kareler [LS]ortalama tedavi farkı 100 ml, p <0,001) ile karşılaştırıldığında, 52. haftada plasebo (LS ortalama tedavi farkı 189 ml, p <0,001) ile karşılaştırıldığında ve 64. haftaya kadar yapılan tüm vizitlerde glikopironyum (LS ortalama tedavi farkı 70-80 ml, p <0,001) ve tiotropiyum (LS ortalama tedavi farkı 60-80 ml, p <0,001) ile karşılaştırıldığında İndakaterol/Glikopironyum lehine istatistiksel olarak anlamlıydı. 52 haftalık aktif kontrollü çalışmada, flutikazon/salmeterol (LS ortalama tedavi farkı 62-86 ml, p <0,001) ile karşılaştırıldığında, 52. haftaya kadar olan tüm vizitlerde ortalama doz öncesi FEV, İndakaterol/Glikopironyum lehine istatistiksel olarak anlamlıydı. 26. haftada İndakaterol/Glikopironyum, dozdan sonraki ilk 4 saatte plasebo ile karşılaştırıldığında, FEVen yüksek değerinde istatistiksel olarak anlamlı iyileşme gösterdi (LS ortalama tedavi farkı 330 ml) (p <0,001).
FEV1 EAA:
İndakaterol/Glikopironyum, 26 haftada flutikazon/salmeterol ile karşılaştırıldığında, doz sonrası FEVEAA'yi (primer sonlanım noktası) 140 ml arttırdı (p <0,001).
Semptomatik sonuçlar
Nefes darlığı:
İndakaterol/Glikopironyum, Geçiş Dispne İndeksi (TDI) ile değerlendirilen nefes darlığını istatistiksel olarak önemli ölçüde azalttı; plasebo (LS ortalama tedavi farkı 1,09, p <0,001),
tiotropiyum (LS ortalama tedavi farkı 0,51, p = 0,007) ve flutikazon/salmeterol (LS ortalama tedavi farkı 0,76, p = 0,003) ile karşılaştırıldığında 26. haftadaki TDI odak skorunda istatistiksel olarak anlamlı bir iyileşme gösterdi. İndakaterol ve glikopironyumdaki iyileşmeler sırasıyla 0,26 ve 0,21 idi.
İndakaterol/Glikopironyum alan hastaların istatistiksel olarak anlamlı derecede yüksek bir yüzdesi, 26. haftada TDI odak skorunda plaseboya kıyasla 1 puan veya daha fazla iyileşme ile yanıt verdi (sırasıyla %68,1 ve %57,5, p = 0,004). Hastaların daha yüksek bir oranı, 26. haftada İndakaterol/Glikopironyum ile tiotropiyum (%68,1 İndakaterol/Glikopironyum 'a karşı %59,2 tiotropiyum, p = 0,016) ve flutikazon/salmeterol (%65,1 İndakaterol/Glikopironyum 'a karşı %55,5 flutikazon/salmeterol, p = 0,088) ile karşılaştırıldığında klinik olarak anlamlı yanıt sergilemiştir.
Sağlıkla ilişkili yaşam kalitesi:
İndakaterol/Glikopironyum, ayrıca plasebo (LS ortalama tedavi farkı -3,01, p = 0,002) ve tiotropiyum (LS ortalama tedavi farkı -2,13, p = 0,009) ile karşılaştırıldığında 26 haftada SGRQ toplam skorunda bir azalma ve indakaterol ve glikopironuma karşı sırasıyla -1,09 ve - 1,18 azalmalar ile belirtildiği gibi, St. George Solunum Anketi (SGRQ) kullanılarak ölçülen sağlıkla ilişkili yaşam kalitesi üzerinde istatistiksel olarak anlamlı bir etki göstermiştir. 64. haftada, tiotropiyum ile karşılaştırıldığında azalma istatistiksel olarak anlamlıydı (LS ortalama tedavi farkı -2,69, p <0,001). 52. haftada flutikazon/salmeterol ile karşılaştırıldığında azalma istatistiksel olarak anlamlıydı (LS ortalama tedavi farkı -1,3, p = 0,003).
İndakaterol/Glikopironyum alan hastaların daha yüksek bir yüzdesi, 26. haftada plasebo (sırasıyla %63,7 ve %56,6, p = 0,088) ve tiotropiyum ile karşılaştırıldığında (% 63,7 İndakaterol/Glikopironyum karşı %56,4 tiotropiyum, p = 0,047), 64. haftada glikopironyum ve tiotropiyum ile karşılaştırıldığında (sırasıyla %57,8 İndakaterol/Glikopironyum, %51,8 glikopironyum, p = 0,055; % 50,8 tiotropiyum, p = 0,051), 52. haftada flutikazon/salmeterol ile karşılaştırıldığında (% 49,2 İndakaterol/Glikopironyum, % 43,7 flutikazon/salmeterol, olasılık oranı: 1,30, p <0,001) SGRQ skorunda (başlangıçtan en az 4 birim azalma olarak tanımlanmıştır) klinik olarak anlamlı bir iyileşme ile cevap vermiştir.
Günlük aktiviteler
İndakaterol/Glikopironyum, 26 hafta boyunca "olağan günlük aktivitelerin gerçekleştirilebildiği günlerâ yüzdesinde, tiotropiyum karşısında istatistiksel olarak üstün bir iyileşme gösterdi (LS ortalama tedavi farkı %8,45, p <0,001). 64. haftada, İndakaterol/Glikopironyum glikopironyum karşısında sayısal iyileşme (LS ortalama tedavi farkı %1,95; p = 0,175) ve tiotropiyum karşısında istatistiksel iyileşme (LS ortalama tedavi farkı %4,96; p = 0,001) gösterdi.
KOAH alevlenmeleri
İndakaterol/Glikopironyum (n=729), glikopironyum (n=739) ve tiotropiyumun (n=737) karşılaştırıldığı 64 haftalık çalışmada, İndakaterol/Glikopironyum, orta veya şiddetli KOAH alevlenmelerinin yıllık oranını glikopironyum ile karşılaştırıldığında %12 oranında (p = 0,038) ve tiotropiyum ile karşılaştırıldığında %10 oranında (p = 0,096) düşürdü. Orta veya şiddetli KOAH alevlenmesi/hasta-yıl sayısı, İndakaterol/Glikopironyum için 0,94 (812 vaka), glikopironyum için 1,07 (900 vaka) ve tiotropyum için 1,06 (898 vaka) idi İndakaterol/Glikopironyum ayrıca, tüm KOAH alevlenmelerinin (hafif, orta veya şiddetli) yıllık oranını glikopironyum (p = 0.001) ile karşılaştırıldığında %15 ve tiotropiyum ile
karşılaştırıldığında %14 oranında istatistiksel olarak anlamlı ölçüde azaltmıştır (p = 0,002). Tüm KOAH alevlenmelerinin/hasta-yıl sayısı İndakaterol/Glikopironyum için 3,34 (2.893 vaka), glikopironyum için 3,92 (3.294 vaka) ve tiotropyum için 3,89 (3.301 vaka) idi.
İndakaterol/Glikopironyum (n = 1.675) ve flutikazon/salmeterolun (n = 1.679) karşılaştırıldığı
52 haftalık çalışmada, İndakaterol/Glikopironyum, eşit etkililik primer çalışma hedefini, flutikazon/salmeterol ile karşılaştırdığında, tüm KOAH alevlenmeleri (hafif, orta veya şiddetli) oranında karşılamıştır. Tüm KOAH alevlenmelerinin/hasta-yıl sayısı İndakaterol / Glikopironyum için 3,59 (4.531 vaka) ve flutikazon/salmeterol için 4,03 (4.969 vaka) idi. İndakaterol/Glikopironyum ayrıca alevlenmelerin yıllık oranında %11 azaltma sağlayarak, flutikazon/salmeterol'e karşı üstünlük gösterdi (p = 0,003).
Flutikazon/salmeterol ile karşılaştırıldığında, İndakaterol/Glikopironyum hem orta hem de şiddetli alevlenmelerin yıllık oranını %17 (p <0,001) ve şiddetli alevlenmelerin yıllık oranını (hastaneye yatmayı gerektiren) %13 (istatistiksel olarak anlamlı değil, p = 0,231) azalttı. Orta veya şiddetli KOAH alevlenmesi/hasta-yıl sayısı İndakaterol/Glikopironyum için 0,98 (1.265 vaka) ve flutikazon/salmeterol için 1,19 (1.452 vaka) idi. İndakaterol/Glikopironyum, alevlenme riskinde %22 azalma (p <0,001) ile ilk orta şiddetli alevlenmeye kadar olan süreyi uzattı ve alevlenme riskinde %19 azalma ile ilk şiddetli alevlenmeye kadar olan süreyi uzattı (p = 0,046).
İndakaterol/Glikopironyum kolunda pnömoni insidansı %3,2 idi ve bu oran flutikazon/salmeterol kolunda %4,8 idi (p = 0,017). İlk pnömoniye kadar geçen süre, flutikazon/salmeterol ile karşılaştırıldığında, İndakaterol/Glikopironyum ile uzatıldı (p = 0,013).
İndakaterol/Glikopironyum (n = 258) ve flutikazon/salmeterol'ü (n = 264) 26 hafta boyunca karşılaştıran başka bir çalışmada, orta veya şiddetli KOAH alevlenmesi/hasta-yıl sayısı sırasıyla 0,15'e karşı 0,18 (22 vakaya karşı 18 vaka) idi (p = 0,512) ve tüm KOAH alevlenmesi/hasta-yıl sayısı (hafif, orta veya şiddetli) sırasıyla 0,72'ye karşı 0,94 (86 vakaya karşı 113 vaka) idi (p = 0,098).
Kurtarma ilaç tedavisi kullanımı
26 hafta boyunca, İndakaterol/Glikopironyum, kurtarma ilacı (salbutamol) kullanımını plaseboya kıyasla günde 0,96 puf (p <0,001), tiotropiyuma kıyasla günde 0,54 puf (p <0,001) ve flutikazon/salmeterola kıyasla günde 0,39 puf (p = 0,019) olarak, istatistiksel olarak anlamlı derecede azaltmıştır. 64 hafta boyunca bu azalma, tiotropiyum ile karşılaştırıldığında günde 0,76 puf (p <0,001) idi. 52 hafta boyunca, İndakaterol/Glikopironyum kurtarma ilacı kullanımını, flutikazon/salmeterol ile karşılaştırıldığında günde 0,25 puf azalttı (p <0,001).
Egzersiz toleransı
Sabahları alınan İndakaterol/Glikopironyum, dinamik hiperinflasyonu azalttı ve ilk dozdan itibaren sürdürülebilen egzersiz süresini iyileştirdi. Tedavinin ilk gününde, egzersiz altındaki inspiratuar kapasite plaseboya kıyasla anlamlı derecede iyileşti (LS ortalama tedavi farkı 250 ml, p <0,001). Üç haftalık tedaviden sonra, İndakaterol/Glikopironyum ile inspiratuar kapasitedeki iyileşme plaseboya kıyasla daha da büyüktü (LS ortalama tedavi farkı 320 ml, p
<0,001) ve egzersiz dayanıklılığı süresi plaseboya kıyasla arttı (LS ortalama tedavi farkı 59,5 saniye, p = 0,006).
Pediyatrik popülasyon
Avrupa İlaç Ajansı, kronik obstrüktif akciğer hastalığında (KOAH) pediyatrik popülasyonun tüm alt kümelerinde İndakaterol/Glikopironyum ile yapılan çalışmaların sonuçlarını gönderme
zorunluluğundan vazgeçmiştir (pediatrik kullanım hakkında bilgi için bölüm 4.2'ye bakınız).
5.2. Farmakokinetik özellikler
Genel özellikler:Emilim
İndakaterol/Glikopironyum
İndakaterol/Glikopironyum solunduktan sonra, indakaterol ve glikopironyumun pik plazma konsantrasyonlarına ulaşmak için ortalama süre sırasıyla yaklaşık 15 dakika ve 5 dakikadır.
In vitro performans verilerine dayanarak, akciğere verilen indakaterol dozunun İndakaterol/Glikopironyum ve indakaterol monoterapi ürünü için benzer olması beklenir. İndakaterol/Glikopironyum inhalasyonundan sonra indakaterole kararlı durum maruziyeti, indakaterol monoterapi ürünü inhalasyonundan sonra sistemik maruziyete benzer veya biraz daha düşüktü.
İndakaterol/Glikopironyum inhalasyonunun ardından indakaterolün mutlak biyoyararlanımının
, verilen dozun %61 ila 85'i arasında olduğu ve glikopironyumun, verilen dozun yaklaşık
%47'si arasında olduğu hesaplanmıştır.
İndakaterol/Glikopironyum inhalasyonundan sonra glikopironuma kararlı durum maruziyeti, glikopironyum monoterapi ürünü inhalasyonundan sonraki sistemik maruziyete benzerdi.
İndakaterol
İndakaterolün kararlı durum konsantrasyonlarına, günde bir kez uygulandıktan sonraki 12 ila 15 gün içinde ulaşılmıştır. İndakaterol, yani EAA'nın 1. güne kıyasla 14. günde veya 15. günde 24 saatlik dozlama aralığı boyunca ortalama birikme oranı, 60 mikrogram ile 480 mikrogram (verilen doz) aralığındaki günde bir kez solunan dozlar için 2,9 ila 3,8 arasındaydı.
Glikopironyum
KOAH'lı hastalarda, tedavinin başlamasından sonraki bir hafta içinde glikopironyum farmakokinetik kararlı durumuna ulaşıldı. Önerilen günde-bir kez uygulanan dozlama rejiminde glikopironyumun kararlı durum ortalama en yüksek ve en düşük plazma konsantrasyonları sırasıyla 166 pikogram/ml ve 8 pikogram/ml idi. Glikopironyuma (24 saatlik dozlama aralığı boyunca EAA) kararlı durum maruziyeti, ilk dozdan sonra yaklaşık 1,4 ila 1,7 kat daha yüksekti.
Dağılım
İndakaterol
İntravenöz infüzyondan sonra terminal eliminasyon fazı sırasında indakaterolün dağılım hacmi, geniş bir dağılımı gösterir şekilde 2.557 litredir. In vitro insan serumu ve plazma proteinlerine bağlanma yaklaşık %95 idi.
Glikopironyum
İntravenöz dozlamadan sonra, glikopironyumun kararlı durum dağılım hacmi 83 litredir ve
terminal fazdaki dağılım hacmi 376 litredir. İnhalasyondan sonra terminal fazdaki görünür dağılım hacmi neredeyse 20 kat daha büyüktü, bu da inhalasyondan sonra daha yavaş eliminasyonu yansıtır. Glikopironyumun in vitro insan plazma proteinlerine bağlanması, 1 ila 10 nanogram/ml konsantrasyonlarda %38 ila %41 idi.
Biyotransformasyon
İndakaterol
Bir insan ADME (emilim, dağılım, metabolizma, atılım) çalışmasında radyoaktif etiketli indakaterolün oral uygulamasından sonra, değişmemiş indakaterol ana bileşendir ve 24 saat içinde serumda toplam ilaçla ilgili EAA'nın yaklaşık üçte birini oluşturur. Hidroksillenmiş bir türev, serumdaki en önemli metabolittir. İndakaterol ve hidroksile indakaterolün fenolik O- glukuronidleri, daha da belirgin metabolitlerdir. Hidroksillenmiş türevin bir diastereomeri, indakaterolün N-glukuronidi ve C- ve N-dealkilatlı ürünler, ayrıca tanımlanan metabolitlerdir.
In vitro UGT1A1 izoformu, indakaterolün metabolik klerensine önemli bir katkıda bulunur. Bununla birlikte, farklı UGT1A1 genotiplerine sahip popülasyonlarda yapılan bir klinik çalışmada gösterildiği gibi, indakaterole sistemik maruziyet UGT1A1-genotipinden önemli ölçüde etkilenmemektedir.
Rekombinant CYP1A1, CYP2D6 ve CYP3A4 ile inkübasyonlarda oksidatif metabolitler bulunmuştur. CYP3A4'ün, indakaterolün hidroksilasyonundan sorumlu baskın izoenzim olduğu sonucuna varılmıştır. In vitro araştırmalar ayrıca indakaterolün, P-gp atım pompası için düşük afiniteli bir substrat olduğunu göstermiştir.
Glikopironyum
In vitro metabolizma çalışmaları, hayvanlar ve insanlar arasında glikopironyum bromür için tutarlı metabolik yollar göstermiştir. Çeşitli mono- ve bis-hidroksillenmiş metabolitlerle sonuçlanan hidroksilasyon ve karboksilik asit türevi (M9) oluşumuyla sonuçlanan direkt hidroliz görülmüştür. İnhale edilen glikopironyum bromürün yutulmuş dozu ile in vivo olarak M9 oluşmuştur. Glikopironyumun glukuronid ve/veya sülfat konjugatları, tekrarlanan inhalasyondan sonra insan idrarında bulunmuştur ve verilen dozun yaklaşık %3'ünü oluşturmaktadır.
Çoklu CYP izoenzimleri, glikopironyumun oksidatif biyotransformasyonuna katkıda bulunur. Glikopironyum metabolizmasının inhibisyonu veya indüklenmesi, etkin maddeye sistemik maruziyette ilgili bir değişikliğe yol açmaz.
In vitro inhibisyon çalışmaları, glikopironyum bromürün CYP1A2, CYP2A6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 veya CYP3A4/5, MDR1, MRP2 veya MXR atım
taşıyıcılarını ve OCT1 veya OCT2 alım taşıyıcılarını inhibe etmek için uygun bir kapasiteye sahip olmadığını göstermiştir. In vitro enzim indüksiyon çalışmaları, test edilen sitokrom P450 izoenzimlerinden herhangi biri veya UGT1A1 ve MDR1 ve MRP2 taşıyıcıları için glikopironyum bromür ile klinik olarak anlamlı bir indüksiyon göstermedi.
Eliminasyon
İndakaterol
Klinik çalışmalarda, idrar yoluyla değişmeden atılan indakaterol miktarı genellikle verilen
dozun %2,5'inden daha düşük olmuştur. İndakaterolün renal klerensi ortalama olarak 0,46 ila
1,2 litre/saat arasındadır. 23,3 litre/saat'lik indakaterolün serum klerensiyle karşılaştırıldığında, renal klerensin sistemik olarak mevcut indakaterolün ortadan kaldırılmasında küçük bir rol oynadığı (sistemik klerensin yaklaşık %2 ila 5'i) açıktır.
Bir insan ADME çalışmasında, oral yoldan verilen indakaterol, esas olarak değişmemiş ana madde (dozun %54'ü) ve daha az ölçüde hidroksillenmiş indakaterol metabolitleri (dozun
%23'ü) olarak insan dışkısıyla atılmaktadır.
İndakaterol serum konsantrasyonları, ortalama terminal yarı ömrü 45,5 ila 126 saat arasında değişen çok fazlı bir şekilde azalmıştır. Tekrarlanan dozlamadan sonra indakaterol birikiminden hesaplanan etkili yarılanma ömrü, yaklaşık 12-15 günlük gözlemlenen zaman- kararlı durum ile tutarlı olarak 40 ila 52 saat arasında değişmiştir.
Glikopironyum
[3H] etiketli glikopironyum bromürün intravenöz uygulamasından sonra, 48 saat içinde ortalama idrar yoluyla radyoaktivite atılımı dozun %85'ini oluşturmuştur. Dozun %5'lik bir kısmı da safrada bulunmuştur.
Ana ilacın renal eliminasyonu, sistemik olarak mevcut glikopironyumun toplam klerensinin yaklaşık %60 ila 70'ini oluştururken, böbrek dışı klerens yaklaşık %30 ila 40'tır. Biliyer klerens renal olmayan klerense katkıda bulunur, ancak renal olmayan klerensin çoğunun metabolizmaya bağlı olduğu düşünülmektedir.
İnhalasyonu takiben glikopironyumun ortalama renal klerensi 17,4 ila 24,4 litre/saat aralığındaydı. Aktif tübüler sekresyon, glikopironyumun renal eliminasyonuna katkıda bulunur. Verilen dozun %23'üne kadarı idrarda ana ilaç olarak bulunmuştur.
Glikopironyum plazma konsantrasyonları çok fazlı bir şekilde azaldı. Ortalama terminal eliminasyon yarılanma ömrü, inhalasyondan sonra (33-57 saat) intravenöz (6,2 saat) ve oral (2,8 saat) uygulamadan çok daha uzundu. Eliminasyon paterni, inhalasyondan sürekli akciğer emilimi ve/veya glikopironyumun sistemik dolaşıma 24 saat sonra ve sonrasında aktarılmasını düşündürmektedir.
Doğrusallık/ Doğrusal Olmayan Durum:
İndakaterol
İndakaterole sistemik maruziyet, dozla orantılı bir şekilde, artan (verilen) dozla (120 mikrogram ila 480 mikrogram) artmıştır.
Glikopironyum
KOAH hastalarında, hem sistemik maruziyet hem de glikopironyumun farmakokinetik kararlı durumda toplam üriner atılımı, 44 ila 176 mikrogram (verilen) doz aralığında dozla orantılı olarak artmıştır.
Özel popülasyonlar
İndakaterol/Glikopironyum
KOAH'lı hastalarda İndakaterol/Glikopironyumso lunduktan
sonra elde edilen verilerin
popülasyon farmakokinetik analizi, yaş, cinsiyet ve (yağsız vücut) ağırlığının indakaterol ve
glikopironyumun sistemik maruziyeti üzerinde anlamlı bir etkisi olmadığını göstermiştir. Yağsız vücut ağırlığı (kilonun ve boyun bir fonksiyonudur) orta değişken olarak tanımlanmıştır. Sistemik maruziyet ile yağsız vücut ağırlığı (veya vücut ağırlığı) arasında negatif bir korelasyon gözlenmiştir; bununla birlikte, değişikliğin büyüklüğü veya yağsız vücut ağırlığının tahmini hassasiyeti nedeniyle doz ayarlaması önerilmemiştir.
Sigara içme durumu ve başlangıç FEV'in, İndakaterol/Glikopironyum inhalasyonundan sonra indakaterol ve glikopironyumun sistemik maruziyeti üzerinde belirgin bir etkisi olmamıştır.
İndakaterol
Bir popülasyon farmakokinetik analizi, yaşın (88 yaşına kadar yetişkinler), cinsiyet, ağırlık (32-168 kg) veya ırkın indakaterol farmakokinetiği üzerinde klinik olarak anlamlı bir etkisi olmadığını göstermiştir. Bu, popülasyondaki etnik alt gruplar arasında herhangi bir fark ortaya çıkmamıştır.
Glikopironyum
KOAH'lı hastalardaki verilerin popülasyon farmakokinetik analizi, vücut ağırlığını ve yaşı, sistemik maruziyette hastalar arası değişkenliğe katkıda bulunan faktörler olarak tanımlamıştır. Önerilen dozda glikopironyum tüm yaş ve vücut ağırlığı gruplarında güvenle kullanılabilir.
Cinsiyet, sigara içme durumu ve başlangıç FEV'in sistemik maruziyet üzerinde belirgin bir etkisi olmamıştır.
Karaciğer yetmezliği olan hastalar İndakaterol/Glikopironyum :
Monoterapi bileşenlerinin klinik farmakokinetik özelliklerine dayanarak, İndakaterol/Glikopironyum hafif ve orta şiddette karaciğer yetmezliği olan hastalarda önerilen dozda kullanılabilir. Şiddetli karaciğer yetmezliği olan hastalar için mevcut veri bulunmamaktadır.
İndakaterol:
Hafif ve orta şiddette karaciğer yetmezliği olan hastalar, indakaterolün Cveya EAA'sında anlamlı bir değişiklik göstermemiştir veya protein bağlanması, hafif ve orta şiddette karaciğer yetmezliği olan denekler ile bunların sağlıklı kontrolleri arasında farklılık göstermemiştir. Şiddetli karaciğer yetmezliği olan kişilerde çalışma yapılmamıştır.
Glikopironyum:
Karaciğer yetmezliği olan hastalarda klinik çalışmalar yapılmamıştır. Glikopironyum ağırlıklı olarak renal atılım ile sistemik dolaşımdan temizlenir. Glikopironyumun hepatik metabolizmasının bozulmasının, klinik olarak anlamlı bir sistemik maruziyet artışı ile sonuçlandığı düşünülmemektedir.
Böbrek yetmezliği olan hastalar İndakaterol/Glikopironyum:
Monoterapi bileşenlerinin klinik farmakokinetik özelliklerine dayanarak, İndakaterol/Glikopironyum hafif ila orta derecede böbrek yetmezliği olan hastalarda önerilen dozda kullanılabilir. Şiddetli böbrek yetmezliği veya diyaliz gerektiren son dönem böbrek yetmezliği olan hastalarda,İndakaterol/Glikopironyumsadece beklenen fayda potansiyel
riskten önemli ise kullanılmalıdır.
İndakaterol:
İdrar yolunun indakaterol maleatın toplam vücut eliminasyonuna çok düşük katkısı nedeniyle, böbrek yetmezliği olan hastalarda bir çalışma yapılmamıştır.
Glikopironyum:
Böbrek yetmezliğinin sistemik glikopironyum bromür maruziyeti üzerinde etkisi vardır. Hafif ve orta derecede böbrek yetmezliği olanlarda toplam sistemik maruziyet (EAA) orta dereceli ortalama 1,4 kata kadar, şiddetli böbrek yetmezliği ve son dönem böbrek yetmezliği olanlarda ise 2,2 kata kadar artmıştır. Hafif ve orta derecede böbrek yetmezliği olan KOAH hastalarında (tahmini glomerüler filtrasyon hızı, eGFR ≥30 ml/dak/1,73 m2) glikopironyum bromür önerilen dozda kullanılabilir.
Etnik köken
İndakaterol/Glikopironyum:
Japon ve Kafkas denekler arasında her iki bileşik için toplam sistemik maruziyette (EAA) önemli bir fark yoktur. Diğer etnik kökenler veya ırklar için mevcut farmakokinetik veriler yetersizdir.
İndakaterol:
Etnik alt gruplar arasında fark tespit edilmemiştir. Siyah popülasyon için sınırlı tedavi deneyimi mevcuttur.
Glikopironyum:
Japon ve Kafkas denekler arasında toplam sistemik maruziyet (EAA) arasında büyük fark yoktur. Diğer etnik kökenler veya ırklar için mevcut farmakokinetik veriler yetersizdir.
5.3. Klinik öncesi güvenlilik verileri
Dozu gerçekten alıp almadığımı nasıl bileceğim?
İnhalasyon cihazınızın içerisinden nefes aldığınızda bir vızıldama sesi duyacaksınız.
Ağzınızda laktozdan kaynaklanan 'şeker tadı' hissedeceksiniz. Boğazınızın arka kısmında toz hissedebilirsiniz. Bu normaldir.
Doz alındığında kapsül boşalmış olacaktır.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Laktoz monohidrat (inek sütü kaynaklıdır)
6.2. Geçimsizlikler
Geçerli değildir.
6.3. Raf ömrü
24 ay
Her paketteki inhaler, bu paketteki tüm kapsüller kullanıldıktan sonra atılmalıdır.
6.4. Saklamaya yönelik özel tedbirler
25 °Caltında oda sıcaklığında saklayınız.
Kapsüller, nemden korumak için daima orijinal ambalajında saklanmalı ve sadece kullanımdan hemen önce çıkarılmalıdır.
6.5. Ambalajın niteliği ve içeriği
Kutuda, GLİNİUM PLUS İnhalasyon Tozu Sert Kapsül desikant kapaklı HDPE şişe 30 kapsül
+ 1 adet inhalasyon cihazı.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller, âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğiâ ne uygun olarak imha edilmelidir.
GLİNİUM PLUS uygulaması esnasında aşağıdaki talimatlara uyulmalıdır:
Kapsülleri yutmayınız. Kapsüller yalnızca kutunun içerisinde yer alan inhalasyon cihazı ile birlikte kullanılmalıdır. Bu cihaz, özel olarak GLİNİUM PLUS kapsülleri ile birlikte kullanılmak üzere tasarlanmıştır.
Kapsüllerin içerisindeki toz yalnızca teneffüs edilerek (nefes yoluyla) kullanılacaktır.
Kapsülleri kullanmadan hemen önce paketinden çıkarınız. kapsüllerin ıslanmaması için parmaklarınızın kuru olduğundan emin olunuz.
İlacınızı kullandıktan sonra ağzınızı su ile iyice çalkalayınız ve çalkaladıktan sonra ağzınızdaki suyu tükürünüz. Bunu yapmak, ağzınızda mantar enfeksiyonu (pamukçuk) gelişmesi riskini azaltır.
Kapsülleri inhalasyon cihazı dışında başka bir cihaz ile kullanmayınız.
GLİNİUM PLUS'ı her gün aynı saatlerde kullanmanız ilacınızı ne zaman kullanacağınızı hatırlamanıza yardımcı olacaktır.
GLİNİUM PLUS'ı doktorunuzun talimatına göre, düzenli olarak kullanmanız önemlidir. Astım belirtileriniz olmasa bile GLİNİUM PLUS'ı kullanmaya devam etmelisiniz çünkü bu astım nöbetlerinin oluşmamasına yardımcı olur.
Eğer ne kadar süre GLİNİUM PLUS kullanacağınız hakkında sorularınız varsa, doktorunuza ya da eczacınıza danışınız.
Hastaların jelatin kapsülün parçalanabileceğini ve küçük jelatin parçalarının inhalasyondan sonra ağız veya boğaz bölgesine ulaşabileceğini bilmesi önemlidir.
Hastaya jelatinin zararsız olduğu, ağızda yumuşayacağı ve yutulabildiği söylenmelidir. Kapsülü bir defadan fazla delmemek suretiyle parçalanma olasılığı asgari düzeye indirilebilir.
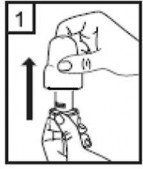
|
1-Kapağı çekip çıkarınız. |
|
2-Kapsül bölmesini açınız.
İnhalerin tabanını sıkıca tutup, açmak için ağızlığı üzerinde yer alan ok işareti yönünde döndürünüz. |
|
3-Parmaklarınızın tamamen kuru olduğundan emin olunuz. Ambalajından bir kapsül çıkarınız ve bu kapsülü cihazın tabanındaki kapsül bölmesine yatık olarak yerleştiriniz. Kapsülleri, kullanımdan hemen önce ambalajından çıkarmanız önemlidir.
ÖNEMLİ: Kapsülü ağızlığın içerisine yerleştirmeyiniz! |
|
4-Ağızlığı âklikâ sesi duyana kadar geri çevirerek kapalı duruma getiriniz. |
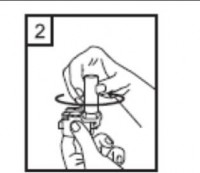
| 5-Tozu kapsülden serbestlemek için: Not: Kapsül bu aşamada parçalanabilir ve küçük jelatin parçacıkları ağzınıza ya da boğazınıza gelebilir. Fakat jelatin yenebilir nitelikte olduğu için zararlı değildir. |
|
6-Nefesinizi olabildiğince dışarıya veriniz. |
| 7-İlacı derin bir şekilde hava yollarınıza çekmek için: Not: Kapsülün, kapsül bölmesinin üzerindeki alanda dönmesine bağlı olarak bir vızıldama sesi duymalısınız. Eğer bu vızıldama sesini duymazsanız, kapsül bölmesini açınız ve kapsülün, kapsül bölmesinde sıkışıp sıkışmadığını kontrol ediniz. Daha sonra 7. basamağı tekrarlayınız. Kapsülü sıkıştığı yerden kurtarmak için düğmelere tekrar BASMAYINIZ. |
8- Cihazın içerisinden nefes aldıktan sonra, nefesinizi olabildiğince tutunuz ve cihazı ağzınızdan çıkarınız. Sonra burnunuzdan nefes veriniz. Kapsül bölmesini açınız ve kapsülde toz kalıp kalmadığını kontrol ediniz. Eğer kalmış ise 6, 7 ve 8 no' lu işlemleri tekrarlayınız. | |
çıkarınız. doktorunuzun önerisi doğrultusunda aynı işlemleri diğer kapsüller için de | |
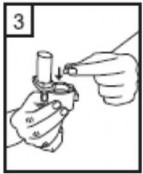
Cihazı ağızlık yukarı doğru bakacak şekilde dik olarak tutunuz.
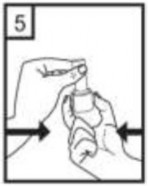
Kenarlardaki iki kulakçığa (düğmelere) aynı anda ve sadece bir kez sıkıca basarak kapsülü deliniz.
Ağızlığı ağzınıza yerleştiriniz ve başınızı hafifçe geriye doğru eğiniz.
Dudaklarınızla ağızlığın etrafını sıkıca sarınız.
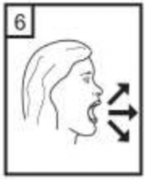
Hızlı, duraksamadan ve alabildiğiniz kadar derin bir nefes alınız.
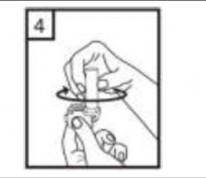
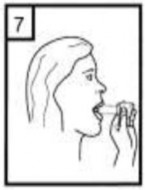
10- İçeride kalan tozları temizlemek için kuru bir kağıt mendil ya da fırça kullanınız. Not: İnhalasyon cihazını temizlemek için SU KULLANMAYINIZ.
Önce ağızlığı, ardından kapağı kapatınız.
tekrarlayınız.
İlacınızı kullandıktan sonra ağzınızı su ile iyice çalkalayınız ve çalkaladıktan sonra ağzınızdaki suyu tükürünüz. Bunu yapmak, ağzınızda mantar enfeksiyonu (pamukçuk) gelişmesi riskini azaltır.
Uygulamaya ilişkin sorular ve cevapları
Kapsüllerin küçük parçaçıklara ayrılmasını nasıl önlerim?
Cihazın yanındaki kırmızı kulakçıklıklara (düğmelere) bastığınızda (5.basamak), kapsüller kırılabilir ve nefes alırken ağzınıza ya da boğazınıza küçük parçalar kaçabilir. Bunu aşağıdakileri uygulayarak önleyebilirsiniz:
Kırmızı kulakcıklara (düğmelere) yalnızca bir kere basarak.
Kapsülleri kullanmadan önce orjinal ambalajında tutarak.
Kapsülleri 25 oC'nin altındaki oda sıcaklığında saklayarak.
Kapsülleri nemden koruyarak.
İnhalasyon cihazının içerisindeki tozu nasıl temizlerim?
Kuru bir kâğıt mendil ya da yumuşak bir fırça kullanınız.
İnhalasyon cihazını asla yıkamamanız gerektiğini unutmamalısınız.
 Dış Gebelik
Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep
olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan
bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur.
Dış Gebelik
Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep
olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan
bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur. |
 Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir.
Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| COSEBLAR | 8699525558992 | 553.26TL |
| GLINIUM | 8681428551514 | 553.26TL |
| INKARANTO | 8681428551484 | |
| Diğer Eşdeğer İlaçlar |
 |
Kolon, Rektum yada Bağırsak Kanseri Bağırsak kanseri kolon veya rektumda (arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir şekilde tedavi edilir. |
 |
Travma Sonrası Bunalımı Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir. |
 |
Astım Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
İLAÇ GENEL BİLGİLERİ
Sandoz İlaç San. ve Tic. A.Ş.
| Satış Fiyatı | 553.26 TL [ 26 Apr 2024 ] |
| Önceki Satış Fiyatı | 553.26 TL [ 22 Apr 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8681428551514 |
| Etkin Madde | Indakaterol Maleat + Glikopironyum Bromur |
| ATC Kodu | R03AL04 |
| Birim Miktar | 85+43 |
| Birim Cinsi | MCG |
| Ambalaj Miktarı | 30 |
| Solunum Sistemi > Adrenerjikler (İnhalan) |
| Yerli ve Beşeri bir ilaçdır. |