GIOTRIF 30 mg 28 film kaplı tablet Kısa Ürün Bilgisi
{ Afatinib }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
GIOTRIF 30 mg film kaplı tablet
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her film kaplı tablet 30 mg afatinibe eşdeğer 44,34 mg afatinib dimaleat içerir.
Yardımcı maddeler
Her film kaplı tablet 176 mg inek sütünden elde edilmiş laktoz (monohidratı şeklinde) içerir.
Yardımcı maddeler için 6.1.'e bakınız.
3. FARMASÖTİK FORMU
Film kaplı tablet.
Tabletler koyu mavi renkli, yuvarlak, bikonveks ve eğimli kenarlıdır. Bir yüzünde âT30â diğer yüzeyinde âBoehringer Ingelheimâ firma sembolü basılıdır.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
GIOTRIF, küçük hücreli dışı lokal ileri veya metastatik akciğer kanserinin tedavisinde birinci basamak ve bir basamak kemoterapi sonu progresyon gösteren hastalardan ikinci basamak tedavisinde Epidermal Growth Factor Reseptörü ( EGFR) gen ekson 19 delesyonu ve/veya ekson 21 (L858R) mutasyonu, akredite bir laboratuvarda gösterilmiş olguların tedavisinde progresyona kadar kullanımı endikedir (Bu grup hastalar daha önce bu hedeflere yönelik tirozin kinaz inhibitörleri (TKİ) kullanmamış olmalıdırlar).
4.2. Pozoloji ve uygulama şekli
GIOTRIF tedavisi, antikanser tedavileri uygulama konusunda deneyimli bir doktor tarafından başlatılmalı ve takip edilmelidir.
GIOTRIF tedavisine başlamadan önce EGFR mutasyonlarının durumu belirlenmelidir (Bkz. Bölüm 4.4).
Pozoloji, uygulama sıklığı ve süresi:
Önerilen doz, günde bir kez 40 mg'dır.
GIOTRIF tedavisine hastalığın progresyonuna kadar veya hastanın ilacı tolere edememesi durumu ortaya çıkıncaya kadar devam edilmelidir (Aşağıda Tablo 1'e bakınız).
Advers reaksiyonlara göre dozun uyarlanması
Semptomatik advers ilaç reaksiyonları (Örneğin, şiddetli/inatçı diyare veya cilt ile ilişkili advers reaksiyonlar) Tablo 1'de özetlendiği gibi, tedaviye ara verilmesi ve dozun azaltılmasıyla veya GIOTRIF tedavisine son verilmesiyle başarılı bir şekilde kontrol edilebilir (Bkz. Bölüm 4.4 ve 4.8).
Tablo 1: Advers reaksiyonlara göre doz uyarlama bilgisi
CTCAEAdvers reaksiyonlar | Önerilen GIOTRIF dozu | |
Evre 1 veya Evre 2 | Ara verme yok | Doz uyarlaması yok |
Evre 2 (uzamış veya tolere edilemeyen) veya Evre ≥3 | Evre 0/1'e kadar tedaviye ara ver | 10 mg'lık basamaklarla dozu azaltarak yeniden başla |
diyarede artmış bağırsak hareketleri kesilinceye kadar devam edilmelidir.
Eğer hastada akut olarak solunum semptomları gelişirse veya var olan semptomlar kötüye giderse, İnterstisyel Akciğer Hastalığı (ILD) düşünülmelidir. Bu durumda değerlendirilme devam ederken, GIOTRIF tedavisine ara verilmelidir. Eğer ILD tanısı konursa, GIOTRIF kesilmeli ve gerektiği şekilde uygun bir tedavi başlatılmalıdır (Bkz. Bölüm 4.4).
P-glikoprotein (P-gp) inhibitörlerinin kullanımı:
Eğer P-gp inhibitörlerinin kullanılması gerekirse, bu ilaçların dozlaması zamana yayılarak yapılmalıdır (yani, P-gp inhibitörünün dozları, GIOTRIF dozu zamanından mümkün olduğu kadar farklı zamanlarda alınmalıdır). Yani, günde 2 kez alınması gereken P-gp inhibitörleri için GIOTRIF dozu ile arasında 6 saat, günde bir kez kullanılması gereken P-gp inhibitörleri için ise GIOTRIF dozu ile arasında 12 saat bulunması tercih edilmelidir (Bkz. Bölüm 4.5).
Dozun unutulması:
Eğer bir dozun alınması unutulursa, aynı gün içinde olmak şartıyla, hasta hatırlar hatırlamaz alınmalıdır. Ancak bir sonraki dozun alınmasına 8 saat veya daha az bir süre kalmışsa unutulan doz atlanmalıdır.
Uygulama şekli:
GIOTRIF, yiyeceklerle birlikte alınmamalıdır. İlacın alınmasından en az 3 saat öncesinden başlayarak ilacın alınmasından en az 1 saat sonrasına kadar herhangi bir yiyecek tüketilmemelidir (Bkz. Bölüm 4.5 ve 5.2).
GIOTRIF oral kullanım içindir. Tabletler bir miktar su ile bütün olarak yutulmalıdır. Eğer tabletlerin bütün olarak yutulması mümkün değilse, GIOTRIF tabletler yaklaşık 100 ml karbonat içermeyen içme suyunda dağıtılabilir. Başka bir sıvı kullanılmamalıdır. Tablet kırılmadan suyun içine atılmalı ve ara sıra karıştırarak yaklaşık 15 dakika boyunca tabletin çok küçük parçacıklara ayrılması beklenmelidir. Bu dispers sıvı bekletilmeden içilmelidir. Bardağa tekrar 100 ml su konup karıştırıldıktan sonra bu su da içilmelidir. İçinde ilacın dağıldığı bu sıvı, gastrik tüp aracılığı ile de uygulanabilir.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek yetmezliği:
Orta veya şiddetli böbrek yetmezliği olan hastalarda afatinib maruziyetinin arttığı bulunmuştur (Bkz. Bölüm 5.2). Hafif (eGFR 60-89 ml/dk/1,73m), orta dereceli (eGFR 30-59 ml/dk/1,73m) veya şiddetli (eGFR 15-29 ml/dk/1,73m) renal bozukluğu olan hastalarda başlangıç dozunda bir uyarlama yapmaya gerek yoktur. Şiddetli renal yetmezliği (eGFR 15- 29 ml/dk/1,73m) olan hastaların izlenmesi ve tolere edilemeyen durumlarda GIOTRIF dozunun uyarlanması gerekir.
eGFR değeri <15 ml/dk/1,73m olan veya diyalize giren hastalarda GIOTRIF tedavisi önerilmez.
Karaciğer yetmezliği:
Hafif (Child Pugh A) veya orta dereceli (Child Pugh B) karaciğer yetmezliği olan hastalarda afatinib maruziyetinde anlamlı bir değişiklik olmaz (Bkz. Bölüm 5.2). Hafif veya orta dereceli karaciğer bozukluğu olan hastalarda başlangıç dozunda bir ayarlama yapılmasına gerek yoktur. GIOTRIF, şiddetli karaciğer yetmezliği olan hastalarda (Child Pugh C) çalışılmamıştır. Bu popülasyonda GIOTRIF tedavisi önerilmez (Bkz. Bölüm 4.4).
Pediyatrik popülasyon:
Pediyatrik popülasyonda, küçük hücre dışı akciğer kanseri (KHDAK) endikasyonu için
GIOTRIF'in uygulanabilir bir kullanımı yoktur.
Çocukların veya adolesanların GIOTRIF ile tedavisi, başka rahatsızlıkları olan pediyatrik hastalarda yürütülen klinik çalışma tarafından desteklenmemiştir (bkz. bölüm 5.1 ve 5.2). Güvenlik ve etkililik belirlenmemiştir.
Bu nedenle, çocukların ve adolesanların GIOTRIF ile tedavi edilmesi önerilmez.
Geriyatrik popülasyon:
Yaşla ilişkili bir doz ayarlaması gerekli değildir.
4.3. Kontrendikasyonlar
Afatinibe veya 6.1 bölümünde listelenen yardımcı maddelerden herhangi birine karşı hipersensitivite olması halinde kontrendikedir.
4.4. Özel kullanım uyarıları ve önlemleri
EGFR mutasyon durumunun değerlendirilmesi
Bir hastanın EGFR mutasyon durumunun değerlendirilmesinde, hatalı negatif veya hatalı pozitif sonuçlardan kaçınmak üzere, tam anlamı ile valide ve sağlam bir metodun seçilmesi önemlidir.
Diyare
GIOTRIF tedavisi sırasında diyare (şiddetli diyare dahil) bildirilmiştir (Bkz. Bölüm 4.8). Diyare, renal yetmezlik ile birlikte olan veya olmayan dehidratasyona yol açabilir ve seyrek olarak ölümle sonuçlanabilir. Diyare, genellikle tedavinin ilk iki haftasında ortaya çıkar. Evre 3 diyare en sık olarak tedavinin ilk 6 haftası içinde görülür.
Diyarenin proaktif kontrolü, yeterli hidrasyon sağlanmasıyla birlikte antidiyareik ilaçların kullanılmasını kapsar ve özellikle tedavinin ilk 6 haftası içinde uygulanması önemlidir.
Proaktif diyare kontrolü, diyarenin ilk belirtileri ile birlikte başlatılmalıdır. Antidiyareik ilaçlar (örneğin, loperamid) kullanılmalı ve eğer gerekli ise doz, onaylı en yüksek önerilen doza kadar yükseltilmelidir. Antidiyareik ilaçlar hastanın elinin altında hazır bulundurulmalı ve böylece diyarenin ilk belirtileri ortaya çıkar çıkmaz kullanılmaya başlanması sağlanmalıdır. Antidiyareik ilaç kullanımına, bağırsak hareketlerindeki artış 12 saat boyunca ortadan kalkıncaya kadar devam edilmelidir.
Şiddetli diyaresi olan hastalarda GIOTRIF tedavisinin bir süre durdurulması, dozunun azaltılması veya tamamen kesilmesi gerekebilir (Bkz. Bölüm 4.2). Dehidrate hale gelen hastalara intravenöz sıvı ve elektrolit verilmesi gerekebilir.
Cilt ile ilişkili advers olaylar
GIOTRIF ile tedavi edilen hastalarda döküntü/akne bildirilmiştir (Bkz. Bölüm 4.8). Genellikle, döküntü hafif veya orta derecede eritamatöz ve akneiform döküntüler şeklindedir, güneşe maruz kalan yerlerde ortaya çıkabilir veya daha kötüye gidebilir. Güneşe maruz kalan hastalara koruyucu giyecekler ve güneşten korunma ürünlerini kullanmaları önerilebilir. Dermatolojik reaksiyonlara erken dönemde müdahale edilmesi (emoliyentler, antibiyotikler gibi) GIOTRIF tedavisinin devamlı olmasını kolaylaştırabilir. Cilt lezyonları şiddetli olan hastalarda tedavinin bir süre durdurulması, dozun azaltılması (Bkz. Bölüm 4.2), ek tedavi girişimleri ve bu tür dermatolojik etkilerin tedavisi konusunda deneyimli bir uzmana başvurulması gerekebilir.
Stevens-Johnson sendromunu ve toksik epidermal nekrolizi düşündüren seyrek vakalar da dahil olmak üzere, büllöz, blister tarzında ve eksfoliyatif cilt durumları bildirilmiştir. Eğer hastada şiddetli büllöz, blister şeklinde veya eksfoliyatif durumlar ortaya çıkarsa, GIOTRIF tedavisi bir süre için durdurulmalı veya tamamen kesilmelidir (Bkz. Bölüm 4.8).
Kadınlar, düşük vücut ağırlığı olanlar ve altta yatan böbrek yetmezliği
Kadın hastalarda, vücut ağırlığı düşük olanlarda ve altta yatan böbrek bozukluğu bulunan kişilerde afatinib maruziyetinin daha yüksek olduğu gözlenmiştir (Bkz. Bölüm 5.2). Bu durum, özellikle diyare, döküntü/akne ve stomatit gibi advers reaksiyonların gelişme riskinin artmasına yol açabilir. Bu risk faktörlerini taşıyan hastaların yakından gözlenmesi önerilir.
İnterstisyel Akciğer Hastalığı (ILD)
KHDAK tedavisi için GIOTRIF kullanan hastalarda, fataliteler de dahil olmak üzere, interstisyel akciğer hastalığı veya bu hastalık benzeri advers reaksiyonlar (akciğer infiltrasyonu, pnömoni, akut respiratuvar distres sendromu, alerjik alveolit gibi) bildirilmiştir. Tüm klinik çalışmalarda, GIOTRIF ile tedavi edilen hastaların %0,7'sinde ILD benzeri advers reaksiyonlar bildirilmiştir (CTCAE Evre ≥3 ILD-benzeri advers reaksiyon yaşayan %0,5 oranındaki hastalar dahil). ILD öyküsü olan hastalar çalışmalara dahil edilmemiştir.
Akut solunum semptomları gelişen ve/veya pulmoner semptomları açıklanamayan şekilde kötüleşen (dispne, öksürük, ateş) tüm hastalar, interstisyel akciğer hastalığını elimine etmek için dikkatle değerlendirilmelidir. Bu semptomların değerlendirilmesi sürecinde GIOTRIF tedavisine ara verilmelidir. Eğer ILD tanısı konursa, GIOTRIF tamamen kesilmeli ve uygun bir tedavi gerekli şekilde başlatılmalıdır (Bkz. Bölüm 4.2).
Şiddetli karaciğer yetmezliği
GIOTRIF tedavisi sırasında, hastaların %1'inden daha azında, fataliteler dahil karaciğer yetmezliği bildirilmiştir. Bu hastalarda, katkıda bulunan faktörler arasında, önceden var olan karaciğer hastalığı ve/veya altta yatan malignansinin progresyonu ile ilişkili komorbiditeler bulunur. Mevcut karaciğer hastalığı olanlarda periyodik olarak karaciğer fonksiyon testlerinin yapılması önerilir. Pivotal çalışmalarda, karaciğer testleri başlangıçta normal değerlerde olan
ve 40 mg/gün dozla tedavi edilen hastaların %2,4'nde (LUX-Lung 3) ve %1,6'sında (LUX- Lung 8) Evre 3 alanin aminotransferaz (ALT) ve aspartat aminotransferaz (AST) artışları gözlenmiştir. LUX-Lung 3'te, başlangıç karaciğer testleri normal olmayan hastalarda Evre 3 ALT/AST artışı yaklaşık 3,5 kat daha yüksektir. LUX-Lung 8'de, başlangıç karaciğer testleri normal olmayan hastalarda, Evre 3 ALT/AST artışı olmamıştır (Bkz. Bölüm 4.8). Karaciğer fonksiyonları kötüleşen hastalarda dozun kesilmesi gerekebilir (Bkz. Bölüm 4.2). GIOTRIF tedavisi sırasında şiddetli karaciğer yetmezliği gelişen hastalarda tedavi tamamen kesilmelidir.
Gastrointestinal perforasyon
Tüm randomize kontrollü klinik çalışmalarda hastaların % 0,2'sinde GIOTRIF tedavisi sırasında ölümler de dahil olmak üzere gastrointestinal perforasyon bildirilmiştir. Vakaların çoğunda gastrointestinal perforasyon, kortikosteroidler, NSAII'ler veya anti-anjiyojenik ajanlar gibi birlikte kullanılan ilaçlar, altta yatan gastrointestinal ülserasyon öyküsü, altta yatan divertiküler hastalık, yaş, veya perforasyon bölgesinde bağırsak metastazları dahil olmak üzere bilinen diğer risk faktörleriyle ilişkili bulunmuştur. GIOTRIF alırken gastrointestinal perforasyon gelişen hastalarda tedavi kalıcı olarak kesilmelidir.
Keratit
Akut veya kötüye giden göz inflamasyonu, lakrimasyon, ışığa duyarlılık, bulanık görme, gözde ağrı ve/veya kırmızı göz gibi semptomlar derhal bir oftalmoloji uzmanına başvurmayı gerektirir. Eğer bir ülseratif keratit tanısı doğrulanırsa, GIOTRIF tedavisi bir süre için durdurulmalı veya tamamen kesilmelidir. Keratit tanısı konduğunda tedaviye devam etmenin sağlayacağı yarar ile karşılaşılacak zararlar dikkatle gözden geçirilmelidir. Bu ilaç, keratit, ülseratif keratit veya şiddetli göz kuruluğu öyküsü olan hastalarda dikkatli kullanılmalıdır. Kontakt lens kullanımı da keratit ve ülserasyon için bir risk faktörüdür (Bkz. Bölüm 4.8).
Sol ventrikül fonksiyonu
Sol ventrikül disfonksiyonu HER2 inhibisyonu ile ilişkilendirilmiştir. Mevcut klinik çalışma verileri, GIOTRIF'in kardiyak kontraktilite üzerinde bir advers etkisi olduğunu düşündürmemektedir. Bununla birlikte, bu ilaç, sol ventrikül ejeksiyon fraksiyonu (LVEF) anormal olan hastalarda veya önemli kardiyak öyküsü olan hastalarda çalışılmamıştır. Kardiyak risk faktörleri ve LVEF'i etkileyebilen koşulları olan hastalarda, başlangıçta ve GIOTRIF tedavisi sırasında, LVEF'nin değerlendirmesini de kapsayan bir kardiyak izlem göz önüne alınmalıdır. Tedavi sırasında ilgili kardiyak belirti/semptomlar gelişen hastalarda LVEF değerlendirmesini de kapsayan kardiyak izlem düşünülmelidir.
Ejeksiyon fraksiyonu kabul edilen normalin alt limitinden daha düşük hastalarda, kardiyak konsültasyon ile birlikte tedavinin bir süre durdurulması veya tamamen kesilmesi düşünülmelidir.
P-glikoprotein (P-gp) etkileşmeleri
Güçlü P-gp indükleyicilerle eş zamanlı tedavi, afatinib maruziyetini azaltabilir (Bkz. Bölüm
4.5).
Laktoz
GIOTRIF laktoz içerir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktaz yetmezliği ya da glukoz galaktoz malabsorbsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
İlaç transport sistemleri ile etkileşimler
P-gp ve meme kanseri direnç proteini (BCRP)inhibitörlerinin afatinib üzerindeki etkileri
İn vitro çalışmalar afatinibin bir P-gp ve BCRP substratı olduğunu göstermiştir. Tek doz 20 mg GIOTRIF uygulanmasından 1 saat önce güçlü bir P-gp ve BCRP inhibitörü olan ritonavir verildiğinde (3 gün süre ile günde iki kez 200 mg), afatinib maruziyeti %48 (eğri altında kalan alan (EAA)) ve %39 (maksimum plazma konsantrasyonu (C)) oranında artmıştır. Bunun aksine, ritonavir 40 mg GIOTRIF ile eş zamanlı olarak veya 6 saat sonra uygulandığında, afatinibin rölatif biyoyararlanımı sırası ile, %119 (EAA) ve %104 (C) ile %111 (EAA) ve %105 (C) olmuştur. Bu nedenle, güçlü P-gp inhibitörleri (ritonavir, siklosporin A, ketokonazol, itrakonazol, eritromisin, verapamil, kinidin, takrolimus, nelfinavir, sakinavir ve amiodaron dahil ama bunlarla sınırlı olmamak üzere) kullanılırken, bunların doz zamanları ile GIOTRIF kullanım zamanları arasında, tercihen 6 veya 12 saatlik aralıklar olmalıdır (Bkz. Bölüm 4.2).
P-gp indükleyicilerinin afatinib üzerindeki etkileri
Güçlü bir P-gp indükleyicisi olan rifampisin ile yapılan ön tedavi (7 gün süre ile günde bir kez 600 mg), tek doz 40 mg GIOTRIF uygulanmasından sonra plazma afatinib maruziyetini %34 (EAA) ve %22 (C) oranında azaltmıştır. Güçlü P-gp indükleyicileri (rifampisin, karbamazepin, fenitoin, fenobarbital veya St. John's Wort (Hypericum perforatum) dahil, ancak bunlarla sınırlı olmamak üzere) afatinibe maruziyeti azaltabilir (Bkz. Bölüm 4.4).
Afatinibin P-gp substratları üzerindeki etkileri
İn vitro verilere göre afatinib, P-gp'nin orta derecede bir inhibitörüdür. Bununla birlikte, klinik verilere dayanarak, GIOTRIF'in diğer P-gp substratlarının plazma konsantrasyonlarını değiştirmesi muhtemel görülmemektedir.
Meme kanseri direnç proteini (BCRP) ile etkileşmeler
In vitro çalışmalar, afatinibin bir BCRP substratı ve inhibitörü olduğunu göstermiştir. Afatinib, oral olarak alınan BCRP substratlarının (rosuvastatin ve sülfasalazin dahil, ancak bunlarla sınırlı olmamak üzere) biyoyararlanımını arttırabilir.
Yiyeceklerin afatinib üzerine etkisi
GIOTRIF ile birlikte çok yağlı yiyeceklerin tüketilmesi afatinib maruziyetinde yaklaşık olarak, C'ta %50 ve EAAdeğerinde %39 oranında olmak üzere, anlamlı azalma ile sonuçlanmıştır. Bu ilaç yiyeceklerle birlikte kullanılmamalıdır (Bkz. Bölüm 4.2 ve 5.2).
Özel popülasyonlara ilişkin ek bilgiler Böbrek yetmezliği:
İlaç-ilaç etkileşimi potansiyelinin arttığını gösteren bir veri bulunmamaktadır.
Karaciğer yetmezliği:
İlaç-ilaç etkileşimi potansiyelinin arttığını gösteren bir veri bulunmamaktadır.
Pediyatrik popülasyon:
Pediyatrik popülasyonda, KHDAK endikasyonu için GIOTRIF'in uygulanabilir bir kullanımı yoktur. İlaç ilaç etkileşimi ile ilgili veri bulunmamaktadır.
Geriyatrik popülasyon:
İlaç-ilaç etkileşimini potansiyelinin arttığını gösteren bir veri bulunmamaktadır.
4.6. Gebelik ve laktasyon
Genel tavsiye:
Gebelik kategorisi: D
Çocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (Kontrasepsiyon)
Bir önlem olarak, çocuk doğurma potansiyeli olan kadınların GIOTRIF tedavisi sırasında gebe kalmaktan kaçınmaları önerilir. Tedavi sırasında ve son dozun alınmasından sonra en az 1 ay süreyle yeterli kontraseptif yöntemler kullanılmalıdır.
Gebelik dönemi
Afatinibin gebelik ve/veya fetus/yeni doğan üzerinde zararlı farmakolojik etkileri bulunmaktadır.
GIOTRIF, gerekli olmadıkça, gebelik döneminde kullanılmamalıdır.
Mekanizma açısından, EGFR'i hedef alan tüm ilaçların fetüse zarar verme potansiyeli vardır. Afatinib ile yapılan hayvan çalışmaları, üreme toksisitesi ile ilgili olarak, direkt veya indirekt zararlı bir etki göstermemiştir (Bkz. Bölüm 5.3). Hayvan çalışmalarında, maternal letal doz düzeylerine kadar (maternal letal doz düzeyi dahil), hiçbir teratojenite belirtisi görülmemiştir. Advers değişiklikler, sadece toksik doz düzeylerinde görülmüştür. Bununla birlikte hayvanlardaki sistemik maruziyet, hastalarda gözlenen benzer aralıkta veya bu düzeylerin altında elde edilmiştir (Bkz. Bölüm 5.3).
Gebe kadınlarda GIOTRIF kullanımı ile ilgili bilgi yoktur veya çok sınırlı bilgi mevcuttur. Bu nedenle, insanlardaki risk bilinmemektedir. Gebelik sırasında kullanılırsa veya GIOTRIF ile tedavi sırasında veya sonrasında gebe kalınırsa, hasta, fetüs üzerindeki potansiyel tehlikelerle ilgili olarak bilgilendirilmelidir.
Laktasyon dönemi
Hayvanlardaki mevcut farmakokinetik veriler afatinibin süte geçtiğini göstermiştir (Bkz. Bölüm 5.3). Buna dayanarak, afatinibin insanlarda da süte geçmesi olasıdır. Emzirilen bebeğin karşılaşacağı risk göz ardı edilemez. Annelere bu ilacı kullanırken emzirmemeleri gerektiği söylenmelidir.
Üreme yeteneği/ Fertilite
İnsanlarda afatinib ile fertilite çalışmaları yürütülmemiştir. Mevcut klinik dışı toksikoloji verileri daha yüksek dozlarda üreme organları üzerinde etki göstermiştir. Bu nedenle bu ilacın insan fertilitesi üzerindeki advers etkileri göz ardı edilemez.
4.7. Araç ve makine kullanımı üzerindeki etkiler
GIOTRIF'in araç ve makine kullanımı üzerinde minör bir etkisi vardır. Bazı hastalarda tedavi sırasında oküler advers reaksiyonlar (konjonktivit, göz kuruluğu, keratit) bildirilmiştir (Bkz. Bölüm 4.8). Bu durumlar hastaların araç ve makine kullanma yeteneğini etkileyebilir.
4.8. İstenmeyen etkiler
Güvenlilik profili özeti:
Advers reaksiyon tipleri, genellikle, afatinibin EGFR inhibisyonu etkisi ile ilişkilidir. Tüm advers reaksiyonların bir özeti Tablo 2'de gösterilmiştir. En sık görülen advers reaksiyonlar, diyare ve cilt ile ilişkili advers olaylar (Bkz. Bölüm 4.4) ve stomatit ile paronişidir (Bkz. Tablo 3, 4 ve 5). Genel olarak dozun düşürülmesi (Bkz. Bölüm 4.2), yaygın görülen advers etkilerin sıklığının düşmesini sağlamıştır.
Günde bir kez 40 mg GIOTRIF ile tedavi edilen hastalarda, ortaya çıkan advers reaksiyonlar nedeniyle, LUX-lung 3 çalışmasında hastaların %57'sinde ve LUX-Lung 8 çalışmasında hastaların %25'nde dozun azaltılması gerekli olmuştur. Diyare ve döküntü/akne şeklindeki advers reaksiyonlara bağlı olarak sırasıyla, LUX-lung 3 çalışmasında hastaların % 1,3'ünde ve %0'ında, LUX-Lung 8 çalışmasında ise hastaların %3,8 ve %2'sinde tedavinin kesilmesi gerekmiştir.
Afatinib ile tedavi edilen hastaların %0,7'sinde ILD benzeri advers reaksiyonlar bildirilmiştir. Stevens-Johnson sendromunu ve toksik epidermal nekrolizi düşündüren seyrek vakaları da kapsayan, büllöz, blisterli ve eksfolyatif cilt durumları bildirilmiştir. Ancak bu vakalarda potansiyel alternatif etiyolojiler bulunmaktadır (Bkz. Bölüm 4.4).
Advers etkilerin tablolu listesi:
Tablo 2'de, monoterapi şeklinde 40 mg veya 50 mg günlük dozlarda GIOTRIF kullanan hastalarda yürütülen tüm KHDAK çalışmalarında ve pazarlama sonrası deneyimlerde bildirilen advers reaksiyonların sıklıkları özetlenmiştir.
Advers reaksiyon sıklıkları şu şekilde tanımlanır: çok yaygın (≥ 1/10); yaygın (≥ 1/100 ila < 1/10); yaygın olmayan (≥ 1/1.000 ila < 1/100); seyrek (≥ 1/10.000 ila < 1/1.000); çok seyrek (< 1/10.000).
Her bir sıklık grubundaki advers etkiler ciddiyetteki azalmaya doğru sıralanarak sunulmuştur.
Tablo 2: Advers etkilerin sıklık sınıflarına göre özeti
Vücut sistemi | Çok yaygın (>1/10) | Yaygın (>1/100-<1/10) | Yaygın olmayan (>1/1,000 -< 1/100) | Seyrek ≥1/10,000- <1/1,000 |
Enfeksiyonlar ve enfestasyonlar | Paronişi | Sistit |
|
|
Metabolizma ve beslenme hastalıkları | İştahta azalma | Dehidratasyon Hipokalemi |
|
|
Sinir sistemi hastalıkları |
| Disguzi |
|
|
Göz hastalıkları |
| Konjonktivit Göz kuruluğu | Keratit |
|
Solunum, göğüs | Epistaksis | Rinore | İnterstisyel |
|
bozuklukları ve |
|
| akciğer | |
mediastinal |
|
| hastalığı | |
hastalıkları |
|
|
| |
Gastrointestinal | Diyare | Dispepsi | Pankreatit |
|
hastalıklar | Stomatit | Keilit | Gastrointestinal | |
| Bulantı |
| perforasyon | |
| Kusma |
|
| |
Hepatobilier hastalıklar |
| Alanin aminotransferaz düzeyinde yükselme |
|
|
| Aspartat aminotransferaz |
|
| düzeyinde yükselme |
|
|
Deri ve deri altı doku hastalıkları | Döküntü Akneiform dermatit Prurit Cilt kuruluğu | Palmar-plantar eritrodisestezi sendromu Tırnak bozuklukları |
| Stevens-Johnson sendromu Toksik epidermal nekroliz |
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları |
| Kas spazmları |
|
|
Böbrek ve idrar yolu hastalıkları |
| Renal bozukluk/ Renal yetmezlik |
|
|
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıkları |
| Ateş |
|
|
Araştırmalar |
| Kilo kaybı |
|
|
Seçilmiş advers reaksiyonların açıklaması
LUX-Lung 3 ve LUX-Lung 7 çalışmalarında GIOTRIF tedavisi alan hastaların en az %10'nda ortaya çıkan çok yaygın advers reaksiyonlar, Ulusal Kanser Enstitüsü-Yaygın Toksisite Kriterleri (National Cancer Institute-Common Toxicity Criteria - NCI-CTC) Evrelerine göre Tablo 3 ve 4'te özetlenmiştir.
Tablo 3: LUX-Lung 3 çalışmasındaki çok yaygın advers reaksiyonlar
| GIOTRIF (40 mg/gün) N=229 | Pemetreksed/ Sisplatin N=111 | ||||
NCI-CTC Evre | Herhangi bir evre | 3 | 4 | Herhangi bir evre | 3 | 4 |
MedDRA Tercih Edilen Terim | % | % | % | % | % | % |
Enfeksiyonlar ve enfestasyonlar | ||||||
Paronişi | 57,6 | 11,4 | 0 | 0 | 0 | 0 |
Metabolizma ve beslenme hastalıkları | ||||||
İştahta azalma | 20,5 | 3,1 | 0 | 53,2 | 2,7 | 0 |
Solunum, göğüs bozuklukları ve mediastinal hastalıkları | ||||||
Epistaksis | 13,1 | 0 | 0 | 0,9 | 0,9 | 0 |
Gastrointestinal hastalıklar | ||||||
Diyare | 95,2 | 14,4 | 0 | 15,3 | 0 | 0 |
Stomatit Keilit | 69,9 12,2 | 8,3 0 | 0,4 0 | 13,5 0,9 | 0,9 0 | 0 0 |
Deri ve deri altı doku hastalıkları | ||||||
Döküntü | 70,3 | 14 | 0 | 6,3 | 0 | 0 |
Akneiform dermatit | 34,9 | 2,6 | 0 | 0 | 0 | 0 |
Cilt kuruluğu | 29,7 | 0,4 | 0 | 1,8 | 0 | 0 |
Prurit | 19,2 | 0,4 | 0 | 0,9 | 0 | 0 |
Araştırmalar | ||||||
Kilo kaybı | 10,5 | 0 | 0 | 9 | 0 | 0 |
Tablo 4: LUX-Lung 7 çalışmasındaki çok yaygın advers etkiler
| GIOTRIF (40 mg/gün) N=160 | Gefitinib N=159 | ||||
NCI-CTC Evre | Herhangi bir evre | 3 | 4 | Herhangi bir evre | 3 | 4 |
MedDRA Tercih Edilen Terim | % | % | % | % | % | % |
Enfeksiyonlar ve enfestasyonlar | ||||||
Paronişi | 57,5 | 1,9 | 0 | 17 | 0,6 | 0 |
Sistit | 11,3 | 1,3 | 0 | 7,5 | 1,3 | 0,6 |
Metabolizma ve beslenme hastalıkları | ||||||
İştahta azalma | 27,5 | 1,3 | 0 | 24,5 | 1,9 | 0 |
Hipokalemi | 10,6 | 2,5 | 1,3 | 5,7 | 1,3 | 0 |
Solunum, göğüs bozuklukları ve mediastinal hastalıkları | ||||||
Rinore | 19,4 | 0 | 0 | 7,5 | 0 | 0 |
Epistaksis | 18,1 | 0 | 0 | 8,8 | 0 | 0 |
Gastrointestinal hastalıklar | ||||||
Diyare | 90,6 | 13,8 | 0,6 | 64,2 | 3,1 | 0 |
Stomatit | 64,4 | 4,4 | 0 | 27 | 0 | 0 |
Bulantı | 25,6 | 1,3 | 0 | 27,7 | 1,3 | 0 |
Kusma | 19,4 | 0,6 | 0 | 13,8 | 2,5 | 0 |
Dispepsi | 10 | 0 | 0 | 8,2 | 0 | 0 |
Hepato-bilier hastalıkları | ||||||
Alanin aminotransferaz değerinde yükselme | 11,3 | 0 | 0 | 27,7 | 8,8 | 0,6 |
Deri ve deri altı doku hastalıkları | ||||||
Döküntü | 80 | 7,5 | 0 | 67,9 | 3,1 | 0 |
Cilt kuruluğu | 32,5 | 0 | 0 | 39,6 | 0 | 0 |
Prurit | 25,6 | 0 | 0 | 25,2 | 0 | 0 |
Akneiform dermatit | 23,8 | 1,9 | 0 | 32,1 | 0,6 | 0 |
Genel bozukluklar ve uygulama yerine ilişkin hastalıkları | ||||||
Ateş | 13,8 | 0 | 0 | 6,3 | 0 | 0 |
Araştırmalar | ||||||
Kilo kaybı | 10 | 0,6 | 0 | 5,7 | 0,6 | 0 |
Karaciğer fonksiyon testlerinde anormallik
GIOTRIF 40 mg alan hastalarda karaciğer fonksiyon testlerinde anormallikler (ALT ve AST değerlerinde yükselmeler dahil) gözlenmiştir. Bu yükselmeler, genellikle geçicidir ve tedavinin kesilmesine yol açmaz. Evre 2 (normalin üst sınırının [ULN]> 2.5-5 katı) ALT yükselmeleri, bu ilaçla tedavi edilen hastaların <%8'nde ortaya çıkmıştır. Evre 3 (ULN'nin
>5-20 katı) yükselmeler ise, GIOTRIF tedavisi alan hastaların <%4'ünde gözlenmiştir (Bkz.
Bölüm 4.4).
Seçilmiş advers reaksiyonların açıklaması
LUX-Lung 8 çalışmasında GIOTRIF tedavisi alan hastaların en az %10'nda ortaya çıkan çok yaygın advers reaksiyonlar, Ulusal Kanser Enstitüsü-Yaygın Toksisite Kriterleri (National Cancer Institute-Common Toxicity Criteria - NCI-CTC) Evrelerine göre Tablo 5'te özetlenmiştir.
Tablo 5: LUX-Lung 8 çalışmasındaki çok yaygın advers reaksiyonlar*
| GIOTRIF (40 mg/gün) N=392 | Erlotinib
N=395 | ||||
NCI-CTC Evre | Herhangi bir evre | 3 | 4 | Herhang i bir evre | 3 | 4 |
MedDRA Tercih Edilen Terim | % | % | % | % | % | % |
Enfeksiyonlar ve enfestasyonlar | ||||||
Paronişi | 11 | 0,5 | 0 | 5,1 | 0,3 | 0 |
Metabolizma ve beslenme hastalıkları | ||||||
İştahta azalma | 24,7 | 3,1 | 0 | 26,1 | 2 | 0 |
Gastrointestinal hastalıklar | ||||||
Diyare | 74,7 | 9,9 | 0,8 | 41,3 | 3 | 0,3 |
Stomatit Bulantı | 30,1 20,7 | 4,1 1,5 | 0 0 | 10,6 16,2 | 0,5 1 | 0 0,3 |
Deri ve deri altı doku hastalıkları | ||||||
Döküntü | 60,7 | 5,4 | 0 | 56,7 | 8,1 | 0 |
Akneiform dermatit | 14 | 1,3 | 0 | 18 | 2,5 | 0 |
Karaciğer fonksiyon testlerinde anormallik
GIOTRIF 40 alan hastalarda karaciğer fonksiyon testlerinde anormallikler (ALT ve AST değerlerinde yükselmeler dahil) gözlenmiştir. Bu yükselmeler, genellikle geçicidir ve tedavinin kesilmesine yol açmaz. Evre 2 ALT yükselmeleri, bu ilaçla tedavi edilen hastaların
%1'nde ortaya çıkmıştır. Evre 3 yükselmeler ise, GIOTRIF tedavisi alan hastaların %0,8'inde gözlenmiştir (Bkz. Bölüm 4.4).
Şüpheli advers reaksiyonların raporlanması:
Ruhsatlandırma sonrası süpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın risk/yarar dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr;
e-posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks:0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
Semptomlar
Afatinibin en yüksek dozları sınırlı sayıdaki hastada yürütülen Faz I klinik çalışmalarda uygulanmıştır. Bu dozlar 3 gün süre ile günde 1 kez verilen 160 mg ve 2 hafta süre ile günde bir kez verilen 100 mg'dır.
Bu dozlarda gözlenen advers reaksiyonlar başlıca, dermatolojik (döküntü/akne) ve gastrointestinal (özellikle diyare) olaylardır. Her biri 360 mg aşırı doz afatinib alan (başka ilaçlarla birlikte alınmış) 2 sağlıklı adolesanda görülen advers olaylar, bulantı, kusma, asteni, baş dönmesi, baş ağrısı, abdominal ağrı ve amilaz düzeylerinde yükselme (<1,5 kat ULN) şeklinde ortaya çıkmıştır. Her iki vakada da advers olaylar tamamen düzelmiştir.
Tedavi
GIOTRIF doz aşımı için özel bir antidot yoktur. Doz aşımından şüphe edildiği durumlarda GIOTRIF kullanımı durdurulmalı ve destekleyici tedavi başlanmalıdır.
Endike olduğu durumlarda emilmeyen afatinibin atılması için kusturma veya gastrik lavaj uygulanabilir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
ATC kodu : L01EB03
Farmakoterapötik grup : Antineoplastik ajanlar, protein kinaz inhibitörleri
Etki mekanizması:
Afatinib, potent ve selektif bir geri dönüşümsüz Erb B Ailesi blokörüdür. Afatinib, kovalent olarak bağlanır ve ErbB ailesi üyeleri olan EGFR (Erb B1), HER2 (ErbB2), ErbB3 ve ErbB4 tarafından oluşturulan tüm homodimer ve heterodimerlerin sinyallerini geri dönüşümsüz şekilde bloke eder.
Farmakodinamik etkiler:
Reseptör mutasyonları tarafından tetiklenen aberant ErbB sinyali ve/veya amplifikasyonu ve/veya reseptör ligand overekspresyonu, malignant fenotipe katkıda bulunur. EGFR'de mutasyon, akciğer kanserinin farklı bir moleküler alt tipini tanımlar.
ErbB yolağının deregülasyonu ile oluşturulan klinik dışı hastalık modellerinde afatinib, tek ajan olarak, ErbB reseptör sinyallerini etkili olarak bloke ederek tümör büyümesinin inhibisyonunu veya tümörün regresyonunu sağlar. Sık görülen aktive edici EGFR mutasyonları (Del 19, L858R) ve daha az görülen ekson 18'de (G719X) ve ekson 21'deki (L861Q) bazı EGFR mutasyonları ile seyreden KHDAK tümörlerinin afatinibe özellikle
duyarlı olduğu, klinik dışı ve klinik çalışmalarda gösterilmiştir. Ekson 20'de mutasyon eklenmesi ile seyreden KHDAK tümörlerinde sınırlı klinik dışı ve/veya klinik aktivite gözlenmiştir.
Sekonder T790M mutasyonunun edinilmesi, afatinibe karşı kazanılmış direncin majör mekanizmasıdır ve T790M içeren allellerin gen dozları, in vitro direncin derecesi ile koreledir. Afatinib ile progresyon gösteren hastaların tümörlerinin yaklaşık %50'sinde T790M mutasyonu bulunmuştur. Bu durumda T790M hedefli EGFR TKI'ler bir sonraki tedavi seçeneği olarak düşünülebilir. Afatinibe karşı diğer potansiyel direnç mekanizmaları klinik öncesinde düşünülmüş ve MET geni amplifikasyonları klinik olarak gözlenmiştir.
Klinik etkililik ve güvenlilik
EGFR mutasyonları olan küçük hücreli dışı akciğer kanseri hastalarında GIOTRIF LUX-Lung 3
İlk seçenek tedavilerde, EGFR mutasyonları pozitif olan lokal olarak ileri evre veya metastatik KHDAK (evre IIIB veya IV) hastalarında GIOTRIF'in etkililiği ve güvenliliği global, randomize, çok merkezli, açık bir çalışmada değerlendirilmiştir. Hastalar, polimeraz zincir
reaksiyonuna (PCR) dayanan bir metot kullanılarak (TheraScreen : EGFR29 Mutation Kit,
Qiagen Manchester Ltd) 29 farklı EGFR mutasyonu açısından taranmıştır. Hastalar, günde bir kez 40 mg GIOTRIF veya 6 küre kadar pemetrexed/sisplatin almak üzere randomize edilmiştir (2:1). Randomize edilen hastaların %65'i kadındır, medyan yaş 61 yıldır ve referans ECOG performans durumu 0 (%39) veya 1 (%61) olmuştur. Hastaların %26'sı beyaz ve %72'si asyalıdır. Hastaların %89'nda sık görülen EGFR mutasyonları mevcuttur (Del 19 veya L858R).
Primer sonlanım noktası, bağımsız bir gözden geçirme ile tespit edilen progresyonsuz sağkalım süresidir (PFS). İkincil sonlanım noktaları arasında, genel sağkalım süresi ve objektif yanıt oranı bulunmaktadır. Analiz zamanında (14 Kasım 2013), afatinib kolundaki 176 hasta (%76,5) ve kemoterapi kolundaki 70 hasta (%60.9), PFS analizine katkıda bulunan bir olay yani, bağımsız merkezi bir gözden geçirme ile tespit edilen hastalık progresyonu veya ölüm yaşamıştır. Etkililik sonuçları, Şekil 1 ve Tablo 6 ve 7'de sunulmuştur.
LUX-Lung 6
Evre IIIB veya IV EGFR mutasyonları pozitif, lokal olarak ileri veya metastatik akciğer adenokarsinoması olan Asyalı hastalarda GIOTRIF'in etkililiği ve güvenliliği, randomize, çok merkezli, açık bir çalışmada değerlendirilmiştir. LUX-Lung 3'e benzer şekilde, daha önce
tedavi edilmemiş KHDAK hastaları, TheraScreen : EGFR29 Mutation Kit (Qiagen
Manchester Ltd) kullanılarak EGFR mutasyonları açısından taranmıştır. Randomize edilen hastalardan %65'i kadındır, medyan yaş 58 yıldır ve tüm hastalar Asya ırkına mensuptur. Yaygın görülen EGFR mutasyonu olan hastalar çalışma popülasyonunun %89'na karşılık gelmektedir.
Primer sonlanım noktası, bağımsız merkezi bir gözden geçirme ile tespit edilen progresyonsuz sağkalım süresidir, ikincil sonlanım noktaları arasında ise, genel sağkalım (OS) ve objektif yanıt oranı (ORR) bulunur.
Her iki çalışma da, kemoterapi ile karşılaştırıldığında GIOTRIF ile tedavi edilen EGFR mutasyonları pozitif hastalarda, progresyonsuz sağkalım süresinde anlamlı iyileşmeler göstermiştir. Etkililik sonuçları Şekil 1 (LUX-Lung 3) ve Tablo 6 ve 7'de (LUX-Lung 3 ve 6)
özetlenmiştir. Tablo 7, yaygın görülen iki EGFR mutasyonu (Del19 ve L858R) olan hasta alt gruplarındaki sonlanımları göstermektedir.
Şekil 1: LUX-Lung 3 çalışmasında tedavi grubuna göre bağımsız olarak gözden geçirilen âprogresyonsuz sağkalım süresiâ (PFS)â yönünden Kaplan-Meier eğrisi (Genel popülasyon)
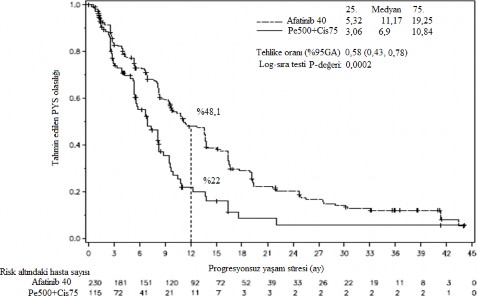
Tablo 6: GIOTRIF'e karşılık pemetreksed/sisplatin (LUX-Lung 3) ve GIOTRIF'e karşılık gemsitabin/sisplatin (LUX-Lung 6) etkililik sonuçları (Bağımsız gözden geçirme)
| LUX-Lung 3 | LUX-Lung 6 | ||
| GIOTRIF
(N=230) | Pemetreksed/ Sisplatin (N=115) | GIOTRIF
(N=242) | Gemsitabin/Sisplatin
(N=122) |
Progresyonsuz sağkalım Ay (medyan) | 11, 2 | 6,9 | 11 | 5,6 |
Tehlike oranı (HR) (%95 GA) | 0,58 (0,43-0,78) | 0,28 (0,2-0,39) | ||
p-değeri | 0,0002 | ï¼0,0001 | ||
1 yıllık PFS oranı | %48,1 | %22 | %46,7 | %2,1 |
Objektif yanıt oranı (CR+PR) | %56,5 | %22,6 | %67,8 | %23 |
Odds Oranı (OR) (%95 GA) | 4,8 (2,89-8,08) | 7,57 (4,52-12,68) | ||
p-değeri | ï¼0,0001 | ï¼0,0001 | ||
Genel sağkalım (OS) Ay (medyan) | 28,2 | 28,2 | 23,1 | 23,5 |
Tehlike oranı (HR) (%95 GA) | 0,88 (0,66-1,17) | 0,93 (0,72-1,22) | ||
p-değeri | 0,385 | 0,6137 | ||
![]()
Tablo 7: Önceden tanımlanmış EGFR mutasyon alt gruplarında (Del-19 ve L858R) GIOTRIF'e karşılık pemetreksed/sisplatin (LUX-Lung 3) ve GIOTRIF'e karşılık gemsitabin/sisplatin (LUX-Lung 6) PFS ve OS etkililik sonuçları (Bağımsız inceleme)
| LUX-Lung 3 | LUX-Lung 6 | ||
Del19 | GIOTRIF
(N=112) | Pemetreksed/ Sisplatin (N=57) | GIOTRIF
(N=124) | Gemsitabin/Sisplatin
(N=62) |
Progresyonsuz sağkalım Ay (medyan) |
13,8 |
5,6 |
13,1 |
5,6 |
Tehlike oranı (HR) (%95 GA) | 0,26 (0,17-0,42) | 0,20 (0,13-0,33) | ||
p-değeri | ï¼0,0001 | ï¼0,0001 | ||
Genel sağkalım (OS) Ay (medyan) | 33,3 | 21,1 | 31,4 | 18,4 |
Tehlike oranı (HR) (%95 GA) | 0,54 (0,36-0,79) | 0,64 (0,44-0,94) | ||
p-değeri | 0,0015 | 0,0229 | ||
L858R | GIOTRIF
(N=91) | Pemetreksed/ Sisplatin (N=47) | GIOTRIF
(N=92) | Gemsitabin/Sisplatin
(N=46) |
Progresyonsuz sağkalım Ay (medyan) |
10,8 |
8,1 |
9,6 |
5,6 |
Tehlike oranı (HR) (%95 GA) | 0,75 (0,48-1,19) | 0,31 (0,19-0,52) | ||
p-değeri | 0,2191 | ï¼0,0001 | ||
Genel sağkalım (OS) Ay (medyan) | 27,6 | 40,3 | 19,6 | 24,3 |
Tehlike oranı (HR) (%95 GA) | 1,30 (0,8-2,11) | 1,22 (0,81-1,83) | ||
p-değeri | 0,2919 | 0,3432 | ||
![]()
GIOTRIF ve kemoterapi için, yaygın görülen mutasyonların (kombine Del 19, ve L858R) önceden tanımlanan alt gruplarında medyan PFS, sırası ile, LUX-Lung 3 çalışmasında, 13.6 aya karşılık 6.9 ay (HR 0,48; %95 GA 0,35-0,66; p<0,0001; N=307) ve LUX-Lung 6
çalışmasında, 11aya karşılık 5,6 aydır (HR 0,24 %95 GA 0,17-0,35; p<0,0001; N=324)
PFS açısından yararlara, hastalıkla ilişkili semptomlardaki iyileşme ve kötüleşmeye kadar geçen zamanda gecikme de eşlik eder (Bkz. Tablo 8). Genel yaşam kalitesi, global sağlık durumu, fiziksel, rol, kognitif, sosyal ve emosyonel fonksiyonların zaman içindeki ortalama skorları GIOTRIF ile anlamlı olarak daha iyi bulunmuştur.
Tablo 8: LUX-Lung 3 ve LUX-Lung 6 çalışmalarında (EORTC QLQ-C30 & QLQ-LC13)
GIOTRIF'e karşılık kemoterapi için semptomlarla ilgili sonuçlar
| LUX-Lung 3 | ||
| Öksürük | Dispne | Ağrı |
İyileşme gösteren | %67'e karşılık %60; | %65'e karşılık %50; | % 60'a karşılık %48; |
hastalar % | p=0,2133 | p=0,0078 | p=0,0427 |
Kötüye gitme zamanında medyan gecikme (ay) | 27'e karşılık 8 HR 0,6; p=0,0062 | 10,4'e karşılık 2,9 HR 0,68; p=0,0129 | 4,2 'ye karşılık 3,1 HR 0,83; p=0,1882 |
| LUX-Lung 6 | ||
| Öksürük | Dispne | Ağrı |
İyileşme gösteren hastalar % | %76'ya karşılık %55; p=0,0003 | %71'e karşılık %48; pï¼0,0001 | % 65'e karşılık %47; p=0,0017 |
Kötüye gitme zamanında medyan gecikme (ay) | 31,1'e karşılık 10,3 HR 0,46; p=0,0001 | 7,7'e karşılık 1,7 HR 0,53; pï¼0,0001 | 6,9'a karşılık 3,4 HR 0,7; p=0,022 |
LUX-Lung 2
LUX-Lung 2, tek kollu bir Faz II çalışmasıdır. Önceden 129 EGFR-TKI tedavisi almamış, EGFR mutasyonları taşıyan Evre IIIB veya Evre IV 129 akciğer adenokarsinoma hastasında yürütülmüştür. Hastalar ilk seçenek (N=61) veya ikinci seçenek (N=68) (yani önceden yapılmış olan 1 kemoterapi rejiminin başarısız olmasından sonra) tedaviye kabul edilmiştir. İlk seçenek tedavisindeki 61 hastada, bağımsız gözden geçirmeye göre doğrulanmış ORR
%65,6 ve DCR %86,9 olmuştur. Bağımsız gözden geçirme ile medyan PFS değeri 12 ay olmuştur. Önceden kemoterapi almış grupta da etkililik benzer şekilde yüksektir (N=68; ORR
%57,4; bağımsız gözden geçirme ile belirlenen medyan PFS 8 ay). Güncelleştirilmiş medyan OS, birinci ve ikinci seçenek tedavi için sırası ile 31,7 ay ve 23,6 aydır.
LUX-Lung 7
LUX-Lung 7, EGFR mutasyonları olan lokal ileri veya metastatik akciğer adenokarsinoma (Evre IIIB veya IV) hastalarında, ilk seçenek olarak, GIOTRIF'in etkililiğini ve güvenliliğini araştıran, randomize, global, açık, bir Faz IIb çalışmasıdır. Hastalar, TheraScreen: EGFR RGQ PCR Kit (Qiagen Manchester Ltd) kullanılarak aktive edici EGFR mutasyonlarının (Del 19 ve/veya L858R) mevcudiyeti açısından taranmıştır. Hastalar (N=319), günde bir kez oral 40 mg GIOTRIF (N=160) veya günde bir kez oral 250 mg geftinib tedavisine (N=159) randomize edilmiştir (1:1). Randomizasyon EGFR mutasyon durumuna göre (Del 19; L858R) ve beyin metastazının varlığına göre (var; yok) tabakalandırılmıştır.
Randomize edilen hastaların %62'si kadındır, medyan yaş 63 yıldır, hastaların %16'sında beyin metastazı vardır, başlangıçtaki ECOG performans durumu 0 (%31) veya 1'dir (%69),
%57'si Asya ırkından ve %43'ü Asya dışı ırklardandır. EGFR mutasyonu olan bir tümör numunesine sahip hastalar, ekson 19 delesyon (%58) veya ekson 21 L858R substitüsyon olarak (%42) sınıflandırılmıştır.
Ko-primer sonlanım noktaları, bağımsız gözden geçirme ile PFS'yi ve OS'yi içerir. Sekonder sonlanım noktaları ORR ve DCR'yi içerir. GIOTRIF, gefitinib ile karşılaştırıldığında, EGFR mutasyonu pozitif olan hastalarda, PFS ve ORR'yi anlamlı olarak iyileştirmiştir. Etkililik sonuçları Tablo 9'da özetlenmiştir.
Tablo 9: Ağustos 2015 tarihli primer analizlere dayanarak, GIOTRIF'e karşılık geftinib için (LUX-Lung 7) etkililik sonuçları
| GIOTRIF
(N=160) | Gefitinib
(n=159) | Tehlike oranı/ Odds oranı (%95 GA) p-değeri |
Medyan PFS (ay), | 11 | 10,9 | HR 0,73 |
Genel çalışma popülasyonu |
|
| (0,57-0,95) |
|
|
| 0,0165 |
18 ay PFS oranı | %27 | %15 |
|
24 ay PFS oranı | %18 | %8 |
|
Medyan OS (ay), Genel çalışma popülasyonu
18. ayda hayatta 24. ayda hayatta | 27,9
%71 %61 | 24,5
%67 %51 | HR 0,86 (0,66, 1,12) 0,2580 |
Objektif yanıt oranı (CR+PR) | %70 | %56 | OR 1,87 (1,12, 2,99) 0,0083 |
Rate-ORR) için p-değeri tabakalandırılmış lojistik regresyona dayanır.
DEL 19 mutasyonları ve L858R mutasyonları olan hastalar için PFS tehlike oranı, afatinibe karşılık geftinib için sırası ile 0,76 (%95 GA [0,55, 1,06]; p=0,1071) ve 0,71 (%95 GA [0,47,
1,06]; p=0,0856) olmuştur.
Daha önce EGFR TKI tedavisi almamış, tümörlerinde yaygın olmayan EGFR mutasyonları bulunan hastalarda GIOTRIF'in etkililiğinin analizi (LUX-Lung-2, LUX-Lung-3 ve LUX- Lung-6)
GIOTRIF'le yapılmış, prospektif tümör genotiplemesi olan üç klinik çalışmada (Faz III çalışmalar olan LUX-Lung-3 ve LUX-Lung-6 ile tek kollu Faz II çalışması LUX-Lung-2) yaygın olmayan EGFR mutasyonları bulunan (Del 19 ve L8858R mutasyonları dışında kalan mutasyonlar olarak tanımlanmıştır) ve daha önce TKI tedavisi almamış toplam 75 ileri evre (Evre IIIb-IV) akciğer adenokarsinoma hastasına ait verilerle bir analiz yapılmıştır. Hastalar oral yoldan günde bir kez, GIOTRIF 40 mg (her 3 çalışmada) veya 50 mg (LUX-Lung-2) ile tedavi edilmiştir.
G719X (N=18), L861Q (N=16) veya S768I substitusyon mutasyonu (N08) barındıran tümörleri olan hastalarda doğrulanmış ORR sırası ile %72,2, %56,3 ve %75'tir ve medyan yanıt süresi sırası ile 13,2 ay, 12,9 ay ve 26,3 aydır.
Ekson 20 insersiyonu bulunan tümörlere sahip hastalarda (N=23), doğrulanmış ORR %8,7 ve medyan yanıt süresi 7,1 aydır. De-novo T790M mutasyonu barındıran tümörlere sahip hastalarda (N=14) doğrulanmış ORR %14,3 ve medyan yanıt süresi 8,3 aydır.
Skuamöz histolojiye sahip KHDAK hastalarında GIOTRIF
Skuamoz histolojiye sahip, ileri evre KHDAK hastalarında ikinci seçenek tedavi olarak GIOTRIF'in etkililiği ve güvenliliği randomize, açık, global bir Faz III çalışmasında (LUX- Lung 8) değerlendirilmiştir. İlk seçenek tedavisi olarak en az 4 kür platin bazlı tedavi alan hastalar, daha sonra, progresyon görülünceye kadar, 1:1 oranında, günde 40 mg GIOTRIF veya 150 mg erlotinib tedavisine randomize edilmiştir. Randomizasyon ırka göre tabakalandırılmıştır (Doğu Asyalılara karşılık Doğu Asyalı olmayanlar). Primer sonlanım noktası progresyonsuz sağkalım süresidir (PFS). OS sekonder kilit sonlanım noktasıdır. Diğer sekonder sonlanım noktaları arasında, ORR, DCR, tümör boyutunda değişiklik ve sağlıkla ilişkili yaşam kalitesi bulunur. Randomize edilen 795 hastanın çoğunluğu erkek (%84) ve beyaz ırktandır (%73), halen sigara içmektedir veya geçmişte içmiştir (%95), başlangıçtaki ECOG performans durumu 1 (%67) ve ECOG 0'dır (%33).
Erlotinib ile karşılaştırıldığında, ikinci seçenek tedavi olarak GIOTRIF, skuamoz KHDAK
hastalarında PFS ve OS'i anlamlı olarak iyileştirmiştir. Tüm randomize edilen hastaları
kapsayan OS değerlerinin primer analizi sırasındaki etkililik sonuçları, Şekil 2 ve Tablo 10'da
özetlenmiştir.
Tablo 10: LUX-Lung 8 çalışmasında tüm randomize edilen hastalara ait, OS primer analizine dayanan, etkililik sonuçları (GIOTRIF'e karşılık erlotinib)
| GIOTRIF
(n=398) | Erlotinib
(n=397) | Tehlike oranı/ Odds oranı (%95 GA) | p-değeri |
PFS |
|
|
|
|
Ay (medyan) | 2,63 | 1,94 | HR 0.81 (0,69,0,96) | 0,0103 |
OS |
|
|
|
|
Ay (medyan) |
|
| HR 0.81 | 0,0077 |
| 7,92 | 6,77 | (0,69,0,95) |
|
12. ayda |
|
|
|
|
hayatta 18. ayda hayatta | %36,4 %22 | %28,2 %14,4 |
|
|
Objektif yanıt oranı (CR+PR) | %5,5 | %2,8 | OR 2,06 (0,98,4,32) | 0,0551 |
Yanıt süresi Ay (medyan) | 7,29 | 3,71 |
|
|
Genel sağkalım tehlike oranı, 65 yaşın altındaki hastalarda 0,68 (%95 GA 0,55, 0,85) ve 65
yaş ve üstündeki hastalarda 0,95 (%95 GA 0,76-1,19) bulunmuştur.
Şekil 2: LUX-lung 8 çalışmasında, tedavi gruplarına göre, OS için Kaplan-Meier eğrisi
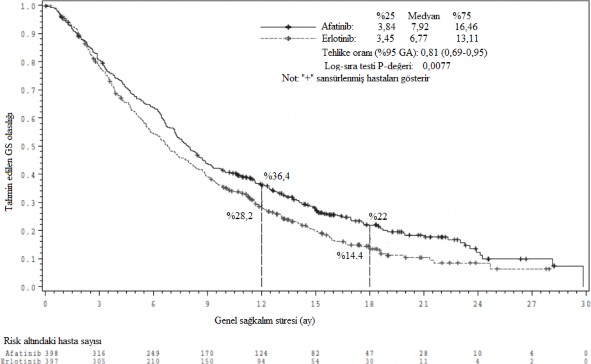
GS: Genel sağkalım
GA: Güven aralığı
PFS açısından yararlara, hastalık ile ilişkili semptomlarda iyileşme ve kötüye gitme zamanında gecikme eşlik etmiştir (Bkz. Tablo 11).
Tablo 11: LUX-Lung 8 çalışmasında (EORTC QOL-C30 & QLQ-LC13) semptom sonlanımları (GIOTRIF'e karşılık erlotinib)
| Öksürük | Dispne | Ağrı |
İyileşen hasta yüzdesi | %43'e karşılık %35 P=0,0294 | %51'e karşılık %44 P=0,0605 | %40'a karşılık %39 P=0.7752 |
Kötüye gitme zamanında gecikme (ay) | 4,5'e karşılık 3,7 HR 0,89; p=0,2562 | 2,6'a karşılık 1,9 HR 0,79; p=0,0078 | 2,5'e karşılık 2,4 HR 0,99; p=0,869 |
aDeğerler, GIOTRIF'e karşılık erlotinib için verilmiştir, p değeri, lojistik regresyona dayanır
EGFR-negatif tümörlerdeki etkililiği tespit edilmemiştir. Pediyatrik popülasyon:
Avrupa İlaç Ajansı, KHDAK endikasyonu için, tüm pediyatrik popülasyon alt gruplarında
GIOTRIF ile yapılan çalışmaların sonuçlarını sunma zorunluluğunu kaldırmıştır (Bkz. Bölüm 4.2 Pediyatrik popülasyon). Ancak başka rahatsızlıklara sahip pediatrik hastalarda pediyatrik çalışma yürütülmüştür.
Faz I/II açık etiketli, doz artırımlı, çok merkezli bir çalışmada, tekrarlayan/dirençli nöroektodermal tümörleri, rabdomiyosarkomu ve/veya tümör histolojisinden bağımsız bilinen ErbB yolu deregülasyonu ile diğer katı tümörleri olan 2 ila 18 yaş arasındaki pediyatrik hastalarda GIOTRIF'in güvenliliği ve etkililiği değerlendirilmiştir. Araştırmanın doz bulma bölümünde toplam 17 hasta tedavi edilmiştir. Denemenin maksimum tolere edilen doz (MTD) genişletme bölümünde, ErbB yolu deregülasyonu için biyobelirteçler tarafından seçilen 39 hasta, 18 mg/m²/gün dozunda GIOTRIF almıştır. Bu genişletme bölümünde, refrakter yüksek dereceli gliomalı (HGG) 6 hasta, diffüz intrinsik pontin gliomalı (DIPG) 4 hasta, ependimomlu
8 hasta ve diğer histolojileri olan 20 hasta olmak üzere 38 hastada objektif yanıt gözlenmemiştir. CLIP2-EGFR gen füzyonlu beynin nöral-glial tümörü olan bir hastada doğrulanmış bir kısmi yanıt vardır (pediyatrik kullanım hakkında bilgi için bkz. bölüm 4.2). Pediyatrik hastalarda GIOTRIF'in advers reaksiyon profili, yetişkinlerde görülen güvenlik profili ile tutarlıdır.
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
GIOTRIF'in oral uygulanmasından sonra afatinibin Cdeğeri, dozdan sonra yaklaşık olarak 2-5 saat sonra gözlenmiştir. Cve EAAdeğerleri, 20 mg-50 mg GIOTRIF doz aralığı içinde orantısal olan değerlerden biraz daha fazla artmıştır. Afatinibin sistemik maruziyeti, yüksek oranda yağlı bir yemekten sonra uygulandığı zaman, açlıktaki uygulanmasına göre,
%50 (C) ve %39 (EAA) oranında azalmıştır. Çeşitli tümör tiplerinde yapılan klinik çalışmalardan elde edilen popülasyon farmakokinetik verilerine dayanarak, yiyeceklerin GIOTRIF alımından önceki 3 saat içinde veya alındıktan sonra 1 saat içinde tüketilmesi
halinde, EAAdeğerinde ortalama %26 oranında azalma gözlenmiştir. Bu nedenle, GIOTRIF alımından önceki en az 3 saat içinde ve 1 saat sonrasına kadar yiyecek tüketilmemelidir (Bkz. Bölüm 4.2 ve 4.5).
Dağılım:
Afatinibin insan plazma proteinlerine in vitro bağlanma oranı yaklaşık %95'tir. Afatinib proteinlere hem kovalent olmayan (geleneksel protein bağlanması) ve hem de kovalent bağlarla bağlanır.
Biyotransformasyon:
İn vivo koşullarda afatinib için enzim katalizli metabolik reaksiyonların rolü ihmal edilebilir düzeydedir. Proteinlere kovalent bağlanma ürünleri afatinibin dolaşımdaki majör metabolitleridir.
Eliminasyon:
İnsanlarda afatinibin primer atılımı feçes yoluyladır. 15 mg oral afatinib çözeltisinin uygulanmasından sonra, dozun %85,4'ü feçeste ve %4,3'ü idrarda bulunur. Bu miktarın
%88'i ana madde afatinibdir. Afatinibin efektif yarılanma ömrü yaklaşık 37 saattir. Afatinibin kararlı durum plazma konsantrasyonlarına, afatinibin çoklu dozda uygulanmasından sonra 8 gün içinde ulaşılır ve 2,77 kat (EAA) ve 2,11 kat (C) birikim ile sonuçlanır. Afatinib ile 6 aydan daha uzun süre tedavi edilen hastalardaki terminal yarılanma ömrü 344 saat olarak tahmin edilmektedir.
Hastalardaki karakteristik özellikler
Renal yetmezlik:
Tek doz afatinibin %5'nden daha azı böbrekler yoluyla atılır. Tek doz 40 mg GIOTRIF uygulaması sağlıklı gönüllülere karşı renal bozukluğu olan gönüllülerle karşılaştırılmıştır. Maruziyet oranı, orta derecede renal yetmezliği (n=8; Renal Hastalıkta Diyet Modifikasyonu formülüne [MDRD] göre eGFR 30-59 ml/dk/1,73m) olan gönüllülerde, sağlıklı kontrollere göre %101 (C) ve %122 (EAA) olmuştur. Maruziyet oranı, şiddetli renal yetmezliği (n= 8; MDRD formülüne göre eGFR 15-29 ml/dk/1,73m) olan gönüllülerde, sağlıklı kontrollere göre %122 (C) ve %150 (EAA) olmuştur. Bu çalışmaya ve çeşitli tümör tiplerinde yapılan klinik çalışmalardan elde edilen verilerin popülasyon farmakokinetik analizlerine dayanarak, hafif (eGFR 60-89 ml/dk/1,73m) , orta (eGFR 30-59 ml/dk/1,73m) veya şiddetli (eGFR 15-29 ml/dk/1,73m) renal yetmezliği olan hastalarda başlangıç dozunda bir ayarlama yapılması gerekli değildir, ancak şiddetli renal yetmezliği olan hastalar izlenmelidir (Bkz. Aşağıda bulunan âÖzel popülasyonlarda popülasyon farmakinetik analizleriâ ve Bölüm 4.2). GIOTRIF eGFR değeri<15 ml/dk/1,73m olan veya diyalize giren hastalarda çalışılmamıştır.
Hepatik yetmezlik:
Afatinib asıl olarak safra/feçes yolu ile atılır. Hafif (Child Pough A) veya orta (Child Pough B) derecede hepatik yetmezliği olan hastalarla sağlıklı gönüllüler karşılaştırıldığında, tek doz 50 mg GIOTRIF uygulanması sonrasında benzer maruziyetler bulunmuştur. Bu sonuçlar, çeşitli tümör tiplerinde yapılan klinik çalışmalardan elde edilen popülasyon farmakokinetik verileri ile uyumludur (Bkz. Aşağıda, âÖzel popülasyonlarda yapılan popülasyon farmakokinetik analizleriâ). Hafif ve orta derecede hepatik yetmezliği olan hastalarda başlangıç dozunda bir ayarlama yapılmasının gerekli olmadığı düşünülmektedir (Bkz. 4.2). Afatinib farmakokinetiği şiddetli hepatik yetmezliği (Child Pough C) olan hastalarda çalışılmamıştır (Bkz. Bölüm 4.4).
Özel popülasyonlarda yapılan popülasyon farmakokinetik analizleri
GIOTRIF monoterapisi alan 927 kanser hastasında (764'i KHDAK hastası) bir popülasyon farmakokinetik analizi yapılmıştır. Test edilen ve aşağıda verilen kovaryatların hiç birisi için başlangıç dozunda bir uyarlama gerekli görülmemiştir.
Yaş:
Afatinib farmakokinetiği üzerinde yaşın anlamlı bir etkisi gözlenmemiştir (28-87 yaş aralığında).
Vücut ağırlığı
62 kg. ağırlığındaki bir hastaya göre (genel hasta popülasyonundaki medyan vücut ağırlığı), 42 kg. ağırlığındaki bir hasta için plazma maruziyeti (EAA-) %26 oranında artmış [(2,5 yüzdelik) ve 95 kg. ağırlığındaki bir hasta için ise %22 oranında azalmıştır (97,5. yüzdelik).
Cinsiyet
Kadın hastalarda plazma maruziyeti ((EAA, vücut ağırlığına göre düzeltilmiş) erkek
hastalarla karşılaştırıldığında %15 oranında daha yüksektir.
Irk
Asyalı, beyaz ve siyah ırk gruplarını kapsayan popülasyon farmakokinetik analizlerine dayanarak ırkın afatinib farmakokinetiği üzerinde herhangi bir etkisi olmamıştır. Siyah ırk grupları ile ilgili veriler sınırlıdır.
Renal yetmezlik
Kreatinin klerensinin düşmesi (CrCL, Cockcroft Gault ile hesaplanmıştır) ile afatinib maruziyeti orta derecede artmıştır. Yani, CrCL değeri 79 ml/dk olan bir hasta (analiz edilen genel hasta popülasyonundaki medyan CrCL) ile karşılaştırıldığında, CrCL değeri 60 ml/dk veya 30 ml/dk olan bir hastada afatinibe maruziyet (EAA), sırası ile %13 ve %42 oranlarında artmış ve CrCL değeri 90 ml/dk veya 120 ml/dk olan bir hastada ise sırası ile %6 ve %20 oranında azalmıştır.
Hepatik yetmezlik
Normal sınırlar dışında bulunan karaciğer testleri ile tanımlanan hafif ve orta derecede karaciğer yetmezliği olan hastalar, afatinib maruziyetinde anlamlı değişikliklerle ilişkili bulunmamıştır. Orta ve şiddetli derecede karaciğer yetmezliği olan hastalarla ilgili veriler sınırlıdır.
Hastalardaki diğer özellikler/intrinsik faktörler
Afatinib maruziyeti üzerinde anlamlı etki yapan diğer özellikler/ intrinsik faktörler şunlardı: ECOG performans skoru, laktat dehidrogenaz düzeyleri, alkalen fosfataz düzeyleri ve total protein. Bu kovaryatların bireysel etki boyutları klinik olarak anlamlı kabul edilmemiştir. Sigara içme öyküsü, alkol tüketimi (sınırlı veri) veya karaciğer metastazları, afatinib farmakokinetiği üzerinde anlamlı bir etki göstermemiştir.
Pediyatrik popülasyon
18 mg/m afatinib uygulamasından sonra, 2 ila 18 yaş arasındaki pediyatrik hastalarda kararlı durum maruziyeti (EAA ve C), 40-50 mg afatinib verilen yetişkinlerde gözlenen ile karşılaştırılabilirdir.(ayrıca Bkz. Bölüm 4.2. Pediyatrik popülasyon).
İlaç - ilaç etkileşimleri ile ilgili diğer bilgiler
İlaç alımı taşıyıcı sistemleri ile etkileşim
İn vitro veriler, afatinib ile OATP1B1, OATP1B3, OATP2B1, OAT1, OAT3, OCT1, OCT2 ve OCT3 taşıyıcıların inhibisyonuna bağlı ilaç-ilaç etkileşimlerinin olası olmadığını göstermiştir.
Sitokrom P450 (CYP) enzimleri ile etkileşimler
İnsanlarda, enzimlerin katalizlediği metabolik reaksiyonların afatinib metabolizmasında ihmal edilebilir rolleri olduğu bulunmuştur. Afatinib dozunun yaklaşık %2'si FMO3 ile metabolize olmuştur ve CYP3A4-bağımlı N-demetilasyon kantitatif olarak tespit edilemeyecek kadar düşüktür. Afatinib, CYP enzimlerinin inhibitörü veya indükleyicisi değildir. Bu nedenle, GIOTRIF'in, CYP enzimleri ile düzenlenen veya metabolize edilen diğer ilaçlarla etkileşmesi beklenmez.
UDP-glukuronoziltransferaz1A1 (UGTIA1) inhibisyonunun afatinib üzerindeki etkisi
İn vitro veriler, afatinib ile UGT1A1 inhibisyonuna bağlı ilaç-ilaç etkileşmesinin olası olmadığını göstermiştir.
5.3. Klinik öncesi güvenlilik verileri
Farelere ve sıçanlara tek doz oral uygulanması, afatinibin potansiyel akut toksisitesinin düşük olduğunu göstermiştir. Oral tekrarlı doz çalışmalarında sıçanlarda 26 haftaya kadar veya mini domuzlarda 52 haftaya kadar uygulamalarda ana etkiler, ciltte (sıçanlarda dermal değişiklikler, epitelyal atrofi ve follikülit), gastrointestinal kanalda (sıçanlarda ve mini domuzlarda diyare, midede erozyonlar, epitelyal atrofi) ve böbrekler üzerinde (sıçanlarda papiller nekroz) tanımlanmıştır. Bulgulara bağlı olarak, bu değişiklikler, klinik olarak geçerli düzeylerin altındaki, klinik olarak geçerli düzeylerdeki veya klinik düzeylerin üzerindeki maruziyetlerde ortaya çıkmıştır. Ek olarak, her iki türde de, farmakodinamik etkilerin sonucu olarak çeşitli organlarda epitel atrofisi gözlenmiştir.
Üreme toksisitesi
Etki mekanizmasına dayanarak, GIOTRIF dahil EGFR'i hedef alan tüm ilaçların fötal hasara yol açma potansiyeli vardır. Afatinib ile yapılan embriyo-fötal gelişim çalışmaları, teratojenite ile ilgili bir belirti göstermemiştir. İlişkili total sistemik maruziyet (EAA), hastalardaki düzeylerle karşılaştırıldığında, ya hafif oranda yüksek (sıçanlarda 2,2 kat) veya düşüktür (tavşanlarda 0,3 kat).
Laktasyonun 11. gününde, sıçanlara oral olarak verilen radyoaktif işaretli afatinib anne sütünde atılmıştır.
Dişi ve erkek sıçanlarda maksimum tolere edilen dozlara kadar ilaç verilmesiyle yapılan bir fertilite çalışmasında, fertilite üzerinde anlamlı bir etki gözlenmemiştir. Erkek ve dişi sıçanlarda total sistemik maruziyet (EAA), hastalarda gözlenen ile ya aynı düzeyde ya da daha düşüktür (sırası ile, 1,3 kat ve 0,51 kat).
Sıçanlarda maksimum tolere edilen dozlara kadar yapılan bir çalışmada, pre/post natal gelişim üzerinde anlamlı bir etki ortaya çıkmamıştır. Dişi sıçanlarda en yüksek total sistemik maruziyet (EAA), hastalarda gözlenen düzeylere göre daha düşüktür (0,23 kat).
Fototoksisite
Bir in vitro 3T3 testi, afatinibin fototoksisite potansiyeli olabileceğini göstermiştir.
Karsinojenite
GIOTRIF ile karsinojenite çalışmaları yürütülmemiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Tablet çekirdeği
Laktoz monohidrat (inek sütünden elde edilmiş) Mikrokristalize selüloz (E460)
Kolloidal anhidr silika (E551) Krospovidon tip A Magnezyum stearat (E470b)
Film kaplama Hipromelloz (E464) Makrogol 400
Titanyum dioksit (E171) Talk (E553b)
Polisorbat 80 (E433)
İndigo karmin aluminyum lake % 11-14
6.2. Geçimsizlikler
Geçerli değildir.
6.3. Raf ömrü
36 ay
6.4. Saklamaya yönelik özel tedbirler
25ºC'nin altındaki oda sıcaklığında saklayınız. Nemden ve ışıktan korumak için orijinal ambalajında saklayınız.
6.5. Ambalajın niteliği ve içeriği
PVC/PVDC perfore birim doz blister. Her blister, nem çekici saşe ile birlikte, kapatılmış alüminyum torba içinde ambalajlanır ve 7x1 film kaplı tablet içerir. 28 film kaplı tablet içeren ambalaj halinde piyasaya sunulur.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Özel bir gereklilik yoktur.
Kullanılmamış olan ürün ya da atık materyaller, âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj Atıklarının Kontrolü Yönetmeliğiâne uygun olarak imha edilmelidir.
 Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir.
Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir. |
 Ruh ve Akıl Sağlığımızı Geliştirmek
İyi akıl ve ruh sağlığı sahip olmaktan ziyade, yaptığınız şeylerdir. Akıl ve
ruhsal olarak sağlıklı olmak için kendinize değer vermeli ve kendinizi kabul
etmelisiniz.
Ruh ve Akıl Sağlığımızı Geliştirmek
İyi akıl ve ruh sağlığı sahip olmaktan ziyade, yaptığınız şeylerdir. Akıl ve
ruhsal olarak sağlıklı olmak için kendinize değer vermeli ve kendinizi kabul
etmelisiniz. |
 |
Kalp Krizi Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
 |
Artrit Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında artrit tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
 |
Asperger Sendromu Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde, gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |
İLAÇ GENEL BİLGİLERİ
Boehringer Ingelheim İlaç Tic. A.Ş.
| Geri Ödeme Kodu | A16642 |
| Satış Fiyatı | 34966.18 TL [ 26 Apr 2024 ] |
| Önceki Satış Fiyatı | 34966.18 TL [ 22 Apr 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699693090065 |
| Etkin Madde | Afatinib |
| ATC Kodu | L01EB03 |
| Birim Miktar | 30 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 28 |
| Antineoplastik ve İmmünomodülatör Ajanlar |
| İthal ( ref. ülke : Yunanistan ) ve Beşeri bir ilaçdır. |