GAZYVA 1000 mg IV konsantre infüzyon çöz. içeren flakon Kısa Ürün Bilgisi
{ Obinutuzumab }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
GAZYVA 1000 mg/40 ml IV infüzyonluk konsantre çözelti Steril
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her bir 40 mL konsantre flakon, seyreltilmeden önce 25 mg/mL olan konsantrasyona karşılık gelen 1000 mg obinutuzumab içerir.
Obinutuzumab, parenteral B-Ly1 fare antikorunun hümanizasyonu yoluyla elde edilen ve Çin Hamsteri Over hücre hattında rekombinant DNA teknolojisiyle üretilen, IgG1 alt sınıfının Tip II hümanize anti-CD20 monoklonal antikorudur.
Yardımcı maddeler
Yardımcı maddeler için bölüm 6.1'e bakınız.
3. FARMASÖTİK FORMU
İnfüzyonluk konsantre çözelti içeren flakon Berrak, renksiz ile hafif kahverengimsi sıvı
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Kronik Lenfositik Lösemi (KLL):
GAZYVA, Kronik Lenfositik Lösemi (KLL) endikasyonunun;
70 yaş ve üzerinde olup CIRS > 6 olan ve/veya kreatinin klerensi 30-69 ml/dk olan hastalarda klorambusil ile kombine olarak ilk seri tedavisinde endikedir.
4.2. Pozoloji ve uygulama şekli
GAZYVA, uzman bir hekimin yakın gözetimi altında ve tüm resüsitasyon araçlarının hazır bulunduğu bir ortamda uygulanmalıdır.
Pozoloji/Uygulama sıklığı ve süresi:
Tümör Lizis Sendromu (TLS) için profilaksi ve premedikasyon
Tümör yükü yüksek ve/veya dolaşımda lenfosit sayısı yüksek (>25 x 10/L) olan ve/veya renal yetmezliği (KrKl <70 mL/dk) bulunan hastalar, TLS riski altında kabul edilir ve profilaksi almalıdır. Profilaksi, standart uygulama doğrultusunda GAZYVA infüzyonuna başlamadan (bkz. Bölüm 4.4) 12-24 saat önce, yeterli hidrasyon ve ürikostatikler (örn. allopurinol) ya da ürat oksidaz (örn. rasburikaz) gibi alternatif uygun bir tedaviyi içermelidir. Hastalar, gerekli görüldüğünde bir sonraki her infüzyondan önce yeniden profilaksi almaya devam etmelidirler.
İnfüzyonla İlişkili Reaksiyonlar (IRR'ler) için profilaksi ve premedikasyon
İnfüzyonla ilişkili reaksiyonları azaltmaya yönelik premedikasyon, Tablo 1'de açıklanmıştır (ayrıca bkz. Bölüm 4.4). Kortikosteroid premedikasyonu, KLL hastaları için birinci döngü sırasında zorunludur, FL hastaları için de tavsiye edilir (bkz. Tablo 1). Sonraki infüzyonlar için premedikasyon ve diğer premedikasyon, aşağıda açıklandığı şekilde verilmelidir.
İntravenöz GAZYVA infüzyonları sırasında bir IRR belirtisi olan hipotansiyon meydana gelebilir. Bu nedenle, her GAZYVA infüzyonundan 12 saat önce, infüzyon süresince ve uygulamayı takiben bir saat süreyle antihipertansif tedavilere ara verilmesi düşünülmelidir (bkz. Bölüm 4.4).
Tablo 1. KLL ve FL hastalarında infüzyonla ilişkili reaksiyonların riskini azaltmak için GAZYVA infüzyonundan önce uygulanması gereken premedikasyon (bkz. Bölüm 4.4)
Tedavi Döngüsü Günü | Premedikasyon gereken hastalar | Premedikasyon | Uygulama |
Döngü 1: KLL ve FL için 1. Gün |
Tüm hastalar | İntravenöz kortikosteroid (KLL için zorunludur, FL için tavsiye edilmektedir) | GAZYVA infüzyonundan en az 1 saat önce tamamlanmalı |
Oral analjezik/antipiretik | GAZYVA infüzyonundan en az 30 dakika önce | ||
Antihistaminik | |||
Döngü 1: |
Tüm hastalar | İntravenöz kortikosteroid (zorunludur) | GAZYVA infüzyonundan en az 1 saat önce tamamlanmalı |
Oral analjezik/antipiretik |
|
Yalnızca KLL hastaları için 2. Gün |
| Antihistaminik | GAZYVA infüzyonundan en az 30 dakika önce |
KLL ve FL için takip eden tüm infüzyonlar | Önceki infüzyon sırasında infüzyon reaksiyonu olmayan hastalar | Oral analjezik/antipiretik | GAZYVA infüzyonundan en az 30 dakika önce |
Önceki infüzyonla infüzyon reaksiyonu (Evre 1 veya 2) olan hastalar | Oral analjezik/antipiretik Antihistaminik | ||
Önceki infüzyonda Evre 3 infüzyon reaksiyonu olan hastalar VEYA Bir sonraki tedaviden önce lenfosit sayısı >25 x10 /L olan hastalar |
İntravenöz kortikosteroid | GAZYVA infüzyonundan en az 1 saat önce tamamlanmalı | |
Oral analjezik/antipiretik Antihistaminik | GAZYVA infüzyonundan en az 30 dakika önce |
Doz
Kronik lenfositik lösemi (KLL, klorambusil ile kombinasyon şeklinde)
KLL hastaları için klorambusil ile kombinasyon şeklinde önerilen GAZYVA dozu Tablo 2'de gösterilmektedir.
Döngü 1
Klorambusil ile kombinasyon şeklinde önerilen GAZYVA dozu, 28 günlük ilk tedavi döngüsünün 1. ile 2. günlerinde (veya 1. günün devamında), 8. gününde ve 15. gününde
uygulanan 1000 mg'dır.
1 ve 2. günlerdeki infüzyonlar için iki infüzyon torbası (1. gün için 100 mg ve 2. gün için 900 mg) hazırlanacaktır. İlk torba infüzyon hızında değişiklik veya hiçbir kesinti olmaksızın tamamlandığı takdirde, infüzyon süresince uygun zaman, koşullar ve tıbbi gözetim sağlandığı sürece ikinci torba aynı gün uygulanabilir (dozun geciktirilmesine ve tekrar premedikasyona gerek yoktur). İlk 100 mg sırasında infüzyon hızında herhangi bir değişiklik veya kesinti meydana gelmesi halinde ikinci torba ertesi gün verilmelidir.
Döngü 2 - 6
Klorambusil ile kombinasyon şeklinde önerilen GAZYVA dozu, her bir döngünün 1. gününde uygulanan 1000 mg'dır.
Tablo 2. KLL hastalarında her biri 28 gün süren 6 tedavi döngüsü boyunca uygulanması gereken GAZYVA dozu
Siklus | Tedavi günü | GAZYVA Dozu |
Döngü 1 | 1. Gün | 100 mg |
2. Gün (veya 1. günün devamında) | 900 mg | |
8. Gün | 1000 mg | |
15. Gün | 1000 mg | |
Döngü 2-6 | 1. Gün | 1000 mg |
Uygulama sıklığı ve süresi
Her biri 28 gün süren altı tedavi döngüsü.
Geciktirilen veya atlanan dozlar
GAZYVA'nın planlanmış bir dozu atlanırsa, mümkün olan en kısa sürede uygulanmalıdır; planlanmış olan bir sonraki doza kadar beklemeyiniz. GAZYVA için planlanmış tedavi aralığı dozlar arasında korunmalıdır.
Foliküler lenfoma (FL)
GAZYVA'nın FL hastaları için önerilen kemoterapi ile kombinasyon şeklinde önerilen dozu Tablo 3'te gösterilmiştir.
Daha önce tedavi edilmemiş foliküler lenfoma hastaları İndüksiyon (kemoterapi ile kombinasyon şeklinde)
GAZYVA kemoterapi ile aşağıdaki şekilde uygulanmalıdır:
Bendamustin ile kombinasyon şeklinde 28 günlük 6 döngü ya da,
Siklofosfamid, doksorubisin, vinkristin, prednizolon (CHOP) ile kombinasyon halinde 21 günlük 6 döngü, ardından yalnızca GAZYVA ile 2 ilave döngü ya da,
Siklofosfamid, vinkristin ve prednizon / prednizolon / metilprednizolon (CVP) ile
kombinasyon halinde 21 günlük 8 döngü.
İdame
Kemoterapi (CHOP veya CVP veya bendamustin) ile kombinasyon halinde GAZYVA indüksiyon tedavisinde tam ya da kısmi başarı sağlayan hastalar, idame tedavisi olarak 1000 mg GAZYVA'yı 2 yıl süreyle her 2 ayda bir veya hastalık progresyonuna kadar (hangisi daha önce gerçekleşirse) tek ajan (monoterapi) şeklinde almaya devam etmelidirler.
Rituximab ile birlikte kemoterapi uygulanmış foliküler lenfoma olgularında yanıtsızlık veya 6 ay içerisinde nüks gelişmesi durumunda
İndüksiyon (bendamustin ile kombinasyon şeklinde)
GAZYVA, bendamustin ile kombinasyon şeklinde 28 günlük 6 döngü şeklinde uygulanmalıdır.
İdame
Bendamustin ile kombinasyon şeklindeki GAZYVA ile indüksiyon tedavisine (örn. ilk 6 tedavi döngüsü) tam veya kısmi yanıt veren veya hastalıkları stabil olan hastalar, tek ajan olarak GAZYVA'yı 1000 mg'lık dozda iki yıl süreyle her 2 ayda bir veya hastalık progresyonuna kadar (hangisi daha önce gerçekleşirse) idame tedavisi olarak almaya devam etmelidir.
Tablo 3. Foliküler Lenfoma: İndüksiyon tedavisi sırasında uygulanacak GAZYVA dozu
Siklus | Tedavi Günü | GAZYVA Dozu |
Döngü1 | 1. Gün | 1000 mg |
8. Gün | 1000 mg | |
15. Gün | 1000 mg | |
Döngü2 â 6 yada 2-8 | 1. Gün | 1000 mg |
İdame | 2 yıl süreyle her 2 ayda bir veya hastalık progresyonuna kadar (hangisi daha önce gerçekleşirse) | 1000 mg |
Tedavinin süresi
Yaklaşık 6 ay süren indüksiyon tedavisi (bendamustin ile kombine edildiğinde her biri 28 gün süren 6 GAZYVA tedavi döngüsü ya da CHOP veya CVP ile kombine edildiğinde her biri 21 gün süren 8 GAZYVA tedavi döngüsü) ve iki yıl süreyle her iki ayda bir veya hastalık progresyonuna kadar (hangisi daha önce gerçekleşirse) uygulanacak idame tedavisini içermektedir.
Geciktirilen veya atlanan dozlar
Planlanan GAZYVA dozu atlandığı takdirde mümkün olan en kısa sürede verilmelidir; doz atlanmamalıdır ya da planlanan bir sonraki doza kadar beklenmemelidir. Eğer Döngü1, 8. gün ya da Döngü1, 15. günden önce toksisite meydana gelirse, bu dozlar toksisite sorunu çözüldükten sonra verilmelidir. Bu tür örneklerde, sonraki ziyaretlerin tümü ve Döngü2'nin başlangıcı, Döngü1'deki gecikmeye uyumlu olmak için değiştirilecektir.
İdame sırasında, takip eden dozlara ait orijinal dozlama planı sürdürülmelidir.
Tedavi sırasındaki doz değişiklikleri (tüm endikasyonlar)
GAZYVA dozunun azaltılması önerilmemektedir.
Semptomatik advers olayların (infüzyon reaksiyonları dahil) yönetimi için aşağıdaki paragrafa bakınız (İnfüzyonla İlişkili Reaksiyonların Yönetimi veya Bölüm 4.4).
Uygulama şekli
GAZYVA intravenöz kullanım içindir. Seyreltildikten sonra özel bir yolla intravenöz infüzyon şeklinde uygulanmalıdır (bkz. Bölüm 6.6). GAZYVA infüzyonları, IV puşe veya bolus şeklinde uygulanmamalıdır.
Uygulamadan önce GAZYVA'nın seyreltilmesine ilişkin talimatlar için bkz. Bölüm 6.6. İnfüzyon hızına ilişkin talimatlar Tablo 4-6'da gösterilmektedir.
Kronik lenfositik lösemi (KLL)
Tablo 4. Kronik Lenfositik Lösemi: İnfüzyon reaksiyonları/aşırı duyarlılık olmadığı durumda standart infüzyon hızı ve önceki infüzyonla meydana gelmiş bir IRR olması durumunda tavsiyeler
Siklus |
Tedavi Günü | İnfüzyon hızı Hastanın tolere ettiği durumda, infüzyon hızı arttırılabilir. İnfüzyon sırasında meydana gelen IRR'lerin yönetimi için âIRR'lerin Yönetimiâ kısmına bakınız. |
| 1. Gün (100 mg) | 4 saat boyunca 25 mg/saat hızında uygulayınız. İnfüzyon hızını arttırmayınız. |
Döngü1 |
2. Gün (veya 1. günün devamı) (900 mg) | Önceki infüzyon sırasında IRR meydana gelmemişse 50 mg/saat hızında uygulayınız. İnfüzyon hızı, maksimum hız 400 mg/saat olacak şekilde 30 dakikada bir 50 mg/saat artışlarıyla yükseltilebilir. Eğer bir hasta bir önceki infüzyonda bir IRR deneyimlemişse, 25 mg / saat hızda uygulamaya başlayınız. İnfüzyon hızı, maksimum hız 400 mg/saat olacak şekilde 30 dakikada bir 50 mg/saat artışlarıyla yükseltilebilir. |
| 8. Gün (1000 mg) | Son infüzyon hızının 100 mg/saat veya üzerinde olduğu önceki infüzyon sırasında IRR meydana gelmemişse, infüzyonlar 100 mg/saat hızında başlatılabilir ve maksimum 400 mg/saat olacak şekilde 30 dakikada bir 100 mg/saat artışlarıyla yükseltilebilir. |
15. Gün (1000 mg) | ||
Döngü2-6 | 1. Gün (1000 mg) | |
|
| Eğer bir hasta 50 mg/saat hızındaki önceki infüzyonunda bir IRR deneyimlemişse, infüzyon hızı, maksimum hız 400 mg/saat olacak şekilde 30 dakikada bir 50 mg/saat artışlarıyla yükseltilebilir. |
Foliküler Lenfoma (FL)
GAZYVA 1. Döngüde standart infüzyon hızında uygulanmalıdır (bkz. Tablo 5). 1. Döngü sırasında Derece ≥3 infüzyonla ilişkili reaksiyonlar (IRR'ler) yaşamayan hastalarda, GAZYVA 2. Döngüden itibaren kısa (yaklaşık 90 dakika) süreli infüzyon (SDI) olarak uygulanabilir (bkz. Tablo 6).
Tablo 5. Foliküler Lenfoma: Standart infüzyon hızı ve önceki infüzyonla meydana gelmiş bir IRR olması durumunda tavsiyeler
Siklus |
Tedavi Günü | İnfüzyon hızı Hastanın tolere ettiği durumda, infüzyon hızı arttırılabilir. İnfüzyon sırasında meydana gelen IRR'lerin yönetimi için âIRR'lerin Yönetimiâ kısmına bakınız. |
Döngü1 |
1. Gün (1000 mg) | Saatte 50 mg olarak uygulayınız. İnfüzyon hızı, maksimum hız 400 mg/saat olacak şekilde 30 dakikada bir 50 mg/saat artışlarla kademeli olarak yükseltilebilir. |
8. Gün (1000 mg) | Son infüzyon hızının 100 mg/saat veya üzerinde olduğu önceki infüzyon sırasında infüzyonla ilişkili reaksiyon meydana gelmemişse veya daha önceki infüzyonda Evre 1 IRR görülmüşse, infüzyonlar 100 mg/saat hızında başlatılabilir ve maksimum 400 mg/saat olacak şekilde 30 dakikada bir 100 mg/saat artışlarla yükseltilebilir.
Eğer hasta önceki infüzyonda Evre 2 veya daha yüksek bir IRR deneyimlemişse, 50 mg/saat hızında uygulayınız. İnfüzyon hızı, maksimum hız 400 mg/saat olacak şekilde 30 dakikada bir 50 mg/saat artışlarla kademeli olarak yükseltilebilir. | |
15. Gün (1000 mg) | ||
Döngü2â6 ya da 2-8 |
1. Gün (1000 mg) | |
İdame | 2 yıl süreyle her 2 ayda bir veya hastalık progresyonuna kadar (hangisi daha önce gerçekleşirse) |
Tablo 6. Foliküler lenfoma: Kısa süreli infüzyon hızı ve önceki infüzyonda IRR oluşması durumunda öneriler
Siklus | Tedavi Günü | İnfüzyon hızı İnfüzyon sırasında meydana gelen IRR'lerin yönetimi için âIRR'lerin Yönetimiâ kısmına bakınız. |
Döngü2â6 ya da 2-8 | 1. Gün (1000 mg) | Döngü 1 sırasında Derece ≥3 IRR oluşmadıysa: 30 dakika boyunca 100 mg/saat, ardından yaklaşık 60 dakika boyunca 900 mg/saat.
Devam eden semptomlarla Derece 1-2 IRR veya önceki SDI infüzyonu sırasında Derece 3 IRR meydana geldiyse, bir sonraki obinutuzumab infüzyonunu standart hızda uygulayın (bkz. Tablo 5). |
İdame | 2 yıl süreyle her 2 ayda bir veya hastalık progresyonuna kadar (hangisi daha önce gerçekleşirse) |
İnfüzyonla İlişkili Reaksiyonların Yönetimi (tüm endikasyonlar)
İnfüzyon reaksiyonlarının yönetimi; aşağıda belirtildiği gibi GAZYVA tedavisinin geçici olarak kesilmesini, infüzyon hızının azaltılmasını veya tedavinin sonlandırılmasını gerektirebilir (ayrıca bkz. Bölüm 4.4).
Evre 4 (yaşamsal tehlike): İnfüzyon durdurulmalı ve tedavi kalıcı olarak sonlandırılmalıdır.
Evre 3 (şiddetli): İnfüzyon geçici olarak durdurulmalı ve semptomlar tedavi edilmelidir. Semptomlar kaybolduktan sonra, önceki hızın (infüzyonla ilişkili reaksiyon oluştuğu sırada kullanılan hızın) en fazla yarısı hızında infüzyon yeniden başlatılabilir ve hastada IRR semptomları oluşmuyorsa, tedavi dozu için uygun artışlarda ve aralıklardaki infüzyon hızı artışına devam edilebilir (bkz. Tablo 4 ve 5). Dozu 2 günde uygulanan KLL hastaları için, 1. günde (Döngü1) infüzyon hızı, 1 saat sonra yeniden 25 mg/sa olarak yükseltilebilir, ancak daha fazla artırılamaz. Hastada ikinci defa Evre 3 IRR meydana geldiği takdirde infüzyon durdurulmalı ve tedavi kalıcı olarak kesilmelidir.
Evre 1-2 (hafif ile orta): İnfüzyon hızı azaltılmalı ve semptomlar tedavi edilmelidir. Semptomlar kaybolduktan sonra, infüzyona devam edilebilir ve hastada IRR semptomları oluşmuyorsa, infüzyon hızının artışı tedavi dozu için uygun artışlarla ve aralıklarla sürdürülebilir (bkz. Tablo 4 ve 5). Dozu 2 güne bölünerek uygulanan KLL hastaları için,
1. gün (Döngü1) infüzyon hızı, 1 saat sonra yeniden 25 mg/sa olarak yükseltilebilir, ancak daha fazla artırılamaz.
SDI sırasında meydana gelen İnfüzyonla İlişkili Reaksiyonların Yönetimi
Derece 4 (hayatı tehdit eden): İnfüzyon durdurulmalı ve tedavi kalıcı olarak kesilmelidir.
Derece 3 (şiddetli): İnfüzyon geçici olarak durdurulmalı ve semptomlar tedavi edilmelidir. Semptomlar düzeldikten sonra, infüzyon önceki hızın yarısından (IRR'nin meydana geldiği sırada kullanılan hız) ve 400 mg/saat'ten fazla olmayacak şekilde yeniden başlatılabilir.
İnfüzyona devam edildikten sonra hasta ikinci bir Derece 3 IRR yaşarsa, infüzyon durdurulmalı ve tedavi kalıcı olarak kesilmelidir. Hasta infüzyonu başka Derece 3 IRR olmadan tamamlayabiliyorsa, bir sonraki infüzyon standart hızdan daha yüksek olmayan bir hızda verilmelidir.
Derece 1-2 (hafif ila orta): İnfüzyon hızı azaltılmalı ve semptomlar tedavi edilmelidir. Semptomlar düzeldikten sonra infüzyona devam edilebilir ve hasta herhangi bir IRR semptomu yaşamazsa, infüzyon hızı artışı tedavi dozuna uygun artışlarla ve aralıklarla devam edebilir (bkz. Tablo 5-6).
Özel popülasyonlara ilişkin ek bilgiler Böbrek yetmezliği
Hafif ile orta şiddette böbrek yetmezliği (kreatinin klerensi [KrKl] >30-89 mL/dakika) olan hastalarda doz ayarlaması gerekli değildir (bkz. Bölüm 5.2). Şiddetli böbrek yetmezliği (kreatinin klerensi < 30 mL/dakika) olan hastalarda GAZYVA'nın güvenliliği ve etkililiği belirlenmemiştir.
Karaciğer yetmezliği
Karaciğer fonksiyonu bozulmuş hastalarda GAZYVA'nın güvenliliği ve etkililiği belirlenmemiştir. Spesifik doz önerileri yapılamamaktadır.
Pediyatrik popülasyon
Çocuklarda ve 18 yaşın altındaki adolesanlarda GAZYVA'nın güvenliliği ve etkililiği belirlenmemiştir. Veri bulunmamaktadır. Güvenlilik ve etkililiğe ilişkin very eksikliği nedeniyle çocuklarda ve 18 yaşın altındaki adolesanlarda GAZYVA'nın kullanılması tavsiye edilmemektedir.
Geriyatrik popülasyon
Yaşlı hastalarda doz ayarlaması gerekli değildir (bkz. Bölüm 5.2).
4.3. Kontrendikasyonlar
Etkin madde
4.4. Özel kullanım uyarıları ve önlemleri
Daha önce tedavi uygulanmış foliküler lenfomalı hastalarda bir alt grup analizine dayanarak, FLIPI düşük riskli (0-1) hastalardaki etkililik verileri şu anda yetersizdir (bkz. Bölüm 5.1). Bu hastalar için bir tedavi belirlerken, GAZYVA ile birlikte kemoterapi uygulamasının genel güvenlilik profili ve hastaya özgü durumu dikkatle değerlendirilmelidir.

UYARILAR
İnfüzyonla ilişkili reaksiyonlar (IRR)
GAZYVA alan hastalarda en sık gözlenen advers ilaç reaksiyonları (AİR'ler), ağırlıklı olarak ilk 1000 mg'nin infüzyonu sırasında meydana gelen IRR'ler olmuştur. Hastaların büyük bölümünde IRR'ler, hafif ile orta şiddette olmuş ve ilk infüzyonun yavaşlatılmasıyla veya geçici olarak durdurulmasıyla kontrol altına alınabilmiştir ancak semptomatik tedavi gerektiren şiddetli ve yaşamsal tehlike teşkil eden IRR'ler de bildirilmiştir.
Evre 4 infüzyon reaksiyonu için infüzyon durdurulmalı ve süresiz olarak sonlandırılmalıdır. Evre 3 infüzyon ilişkili reaksiyonlar için infüzyon geçici olarak kesilmeli ve semptomların tedavisi için uygun ilaç uygulanmalıdır.
Aşağıdaki durumlarda, hastalara başka GAZYVA infüzyonu verilmemelidir:
Akut hayatı tehdit eden solunum semptomları,
Evre 4 (hayatı tehdit eden) infüzyon reaksiyonları veya
Evre 3 (uzun süreli/tekrarlayan) infüzyon reaksiyonlarının ikinci kez oluşması (ilk infüzyonun sürdürülmesinin ardından veya takip eden infüzyon sırasında).
Tümör Lizis Sendromu (TLS)
GAZYVA ile TLS bildirilmiştir. Risk altında olduğu düşünülen tüm hastalar, tedavinin ilk günlerinde, özellikle böbrek fonksiyonları, potasyum ve ürik asit düzeyleri açısından dikkatle izlenmelidir. Standart uygulamaya yönelik tüm ek kılavuzlar takip edilmelidir. TLS'nin tedavisi için elektrolit anormallikleri düzeltilmeli, böbrek fonksiyonu ve sıvı dengesi izlenmeli ve gerektiğinde diyaliz dahil, destekleyici bakım uygulanmalıdır.
Progresif Multifokal Lökoensefalopati (PML)
GAZYVA ile tedavi uygulanan hastalarda PML vakaları bildirilmiştir (bkz. Bölüm 4.4 & Bölüm 4.8).
Hepatit B Virüs (HBV) Reaktivasyonu
GAZYVA da dahil olmak üzere Anti-CD20 antikorlarıyla tedavi edilen hastalarda bazı durumlarda fulminan hepatit, hepatik yetmezlik ve ölümle sonuçlanan HBV reaktivasyonu meydana gelebilir (bkz. Bölüm 4.8). GAZYVA ile tedaviye başlanmadan önce tüm hastalarda Hepatit B virüs taraması yapılmalıdır. Aktif hepatit B hastalığı olan hastalar GAZYVA ile tedavi edilmemelidir.
İnfüzyonla ilişkili reaksiyonlar (IRR)
GAZYVA alan hastalarda en sık gözlenen advers ilaç reaksiyonları (AİR'ler), ağırlıklı olarak ilk 1000 mg'nin infüzyonu sırasında meydana gelen IRR'ler olmuştur. İnfüzyonla ilişkili reaksiyonlar, aynı zamanda GAZYVA ile tedavi edilen hastalarda da bildirilen sitokin salıverilmesi sendromuyla da ilişkili olabilir. IRR'lerin önlenmesi için Bölüm 4.2'de açıklanan önlemlerin (yeterli kortikosteroid, oral analjezik/anti-histaminik, ilk infüzyon sabahında antihipertansif ilacın atlanması ve 2 gün süreyle verilen 1. Döngü1. gün dozu) birlikte uygulandığı KLL hastalarında tüm Evre'lerdeki IRR'lerde azalma gözlenmiştir. Evre 3-4 IRR oranları (görece az sayıda hastayı temel alan), hafifletici önlemler alınmadan önce ve alındıktan sonra benzerdir. IRR'lerin azaltılmasına yönelik hafifletici önlemler izlenmelidir (bkz. Bölüm 4.2). İnfüzyona bağlı semptomların insidansı ve şiddeti, ilk 1000 mg'nin infüzyonunu takiben önemli ölçüde azalmış ve hastaların birçoğunda, takip eden GAZYVA infüzyonları sırasında IRR meydana gelmemiştir (bkz. Bölüm 4.8).
Hastaların büyük bölümünde IRR'ler, endikasyondan bağımsız olarak hafif ile orta şiddette olmuş ve ilk infüzyonun yavaşlatılmasıyla veya geçici olarak durdurulmasıyla kontrol altına alınabilmiştir ancak semptomatik tedavi gerektiren şiddetli ve yaşamsal tehlike teşkil eden IRR'ler de bildirilmiştir. IRR'ler immünoglobülin E (IgE) aracılı alerjik reaksiyonlardan (örn. anafilaksi) klinik olarak ayırt edilemeyebilir. Tümör yükü yüksek ve/veya KLL'de dolaşımdaki lenfosit sayısı yüksek (>25 x 10/L) olan hastalar şiddetli IRR'ler açısından yüksek risk altında olabilir. Renal yetmezliği bulunan hastalar (KrKl <50 mL/dk) ve hem Kümülatif Hastalık Derecelendirme Ölçeği (CIRS) >6 hem de KrKl <70 mL/dk olan hastalar, şiddetli IRR'ler de dahil olmak üzere daha yüksek IRR riski altındadır (bkz. Bölüm 4.8). IRR'lerin yönetimi için âPozoloji ve uygulama şekliâ kısmına bakınız.
Aşağıdaki durumlarda, hastalara başka GAZYVA infüzyonu verilmemelidir:
Akut hayatı tehdit eden solunum semptomları,
Evre 4 (hayatı tehdit eden) infüzyon reaksiyonları veya
Evre 3 (uzun süreli/tekrarlayan) infüzyon reaksiyonlarının ikinci kez oluşması (ilk infüzyonun sürdürülmesinin ardından veya takip eden infüzyon sırasında).
Önceden kardiyak veya pulmoner hastalıkları bulunan hastalar, infüzyon boyunca ve infüzyon sonrası dönemde dikkatle izlenmelidir. GAZYVA intravenöz infüzyonları sırasında hipotansiyon oluşabilir. Bu nedenle, her GAZYVA infüzyonundan önce 12 saat boyunca ve infüzyon sırasında ve uygulamanın ardından ilk saat boyunca antihipertansif tedavilerin durdurulması düşünülmelidir. Hipertansif kriz açısından akut risk altındaki hastalar,
antihipertansif ilaçlarının durdurulmasına ilişkin yararlar ve riskler açısından değerlendirilmelidir.
Anafilaksi dahil aşırı duyarlılık reaksiyonları
GAZYVA ile tedavi uygulanan hastalarda ani (örn. anafilaksi) ve gecikmeli (örn. serum bulantısı) aşırı duyarlılık reaksiyonları bildirilmiştir. Aşırı duyarlılığın IRR'lerden ayırt edilmesi güç olabilir. Aşırı duyarlılık belirtileri önceki maruziyetten sonra ve çok nadiren ilk infüzyonla ortaya çıkabilir. İnfüzyon sırasında veya sonrasında aşırı duyarlılık reaksiyonundan şüpheleniliyorsa, infüzyon durdurulmalı ve tedavi süresiz olarak sonlandırılmalıdır. Obinutuzumaba karşı bilinen aşırı duyarlılığı olan hastalara tedavi uygulanmamalıdır (bkz. Bölüm 4.3).
Tümör lizis sendromu (TLS)
GAZYVA ile TLS bildirilmiştir. TLS açısından risk altında olduğu düşünülen hastalara (örn. tümör yükü yüksek olan ve/veya dolaşımdaki lenfosit sayısı yüksek olan [>25 x 10/L] ve/veya böbrek yetmezliği [KrKl <70 mL/dk] olan hastalara), profilaksi uygulanmalıdır. Profilakside, standart uygulama doğrultusunda GAZYVA infüzyonundan 12-24 saat önce başlatılmak üzere yeterli hidrasyon sağlanarak ve ürikostatiklerin (örn. allopurinol) veya ürat oksidat (örn. rasburikaz) gibi uygun bir alternatif tedavi uygulanmalıdır (bkz. Bölüm 4.2). Risk altında olduğu düşünülen tüm hastalar, tedavinin ilk günlerinde, özellikle böbrek fonksiyonları, potasyum ve ürik asit düzeyleri açısından dikkatle izlenmelidir. Standart uygulamaya yönelik tüm ek kılavuzlar takip edilmelidir. TLS'nin tedavisi için elektrolit anormallikleri düzeltilmeli, böbrek fonksiyonu ve sıvı dengesi izlenmeli ve gerektiğinde diyaliz dahil, destekleyici bakım uygulanmalıdır.
Nötropeni
GAZYVA tedavisi sırasında febril nötropeni dahil şiddetli ve yaşamı tehdit eden nötropeni bildirilmiştir. Nötropeni oluşan hastalar, bu durum ortadan kalkana kadar düzenli laboratuvar testleriyle yakından izlenmelidir. Tedavi gerektiğinde, yerel kılavuzlara uygun şekilde uygulanmalı ve granülosit koloni uyarıcı faktörlerin (G-CSF) uygulanması düşünülmelidir. Eş zamanlı enfeksiyon belirtileri, uygun şekilde tedavi edilmelidir. Şiddetli veya yaşamı tehdit eden nötropeni vakalarında dozun geciktirilmesi düşünülmelidir. Şiddetli ve 1 haftadan uzun süren nötropenisi olan hastalara Evre 1 veya 2 düzelme sağlanıncaya kadar tedavi süresince antimikrobiyal profilaksi verilmesi şiddetle önerilir. Antiviral ve antifungal profilaksi de düşünülmelidir (bkz. Bölüm 4.2). Geç başlangıçlı nötropeni (tedavinin sonlanmasından 28 gün sonra oluşan) veya uzun süreli nötropeni de (tedavinin tamamlandıktan/sonlandırıldıktan sonra 28 günden fazla süren) bildirilmiştir. Renal yetmezliği (KrKl < 50 mL/dk) olan hastalar, daha yüksek nötropeni riski altındadır (bkz. Bölüm 4.8).
Trombositopeni
GAZYVA tedavisi sırasında akut trombositopeni (infüzyondan sonra 24 saat içinde oluşan) dahil, şiddetli ve yaşamı tehdit eden trombositopeni gözlenmiştir. Renal yetmezliği (KrKl < 50 mL/dk) olan hastalar daha yüksek trombositopeni riski altındadır (bkz. Bölüm 4.8). GAZYVA ile tedavi edilen hastalarda Döngü1'de ölümle sonuçlanan hemoraji vakaları da bildirilmiştir. Trombositopeni ve hemoraji vakaları arasında kesin bir ilişki kurulmamıştır.
Hastalar, özellikle de birinci döngü sırasında trombositopeni için yakından izlenmeli, durum ortadan kalkıncaya kadar laboratuvar testleri yapılmalı ve şiddetli, yaşamı tehdit eden
trombositopeni durumunda dozun geciktirilmesi düşünülmelidir. Kurumsal uygulamaya göre kan ürünlerinin transfüzyonu (yani trombosit transfüzyonu), tedavi uygulayan hekimin kararına bağlıdır. Özellikle birinci döngü sırasında platelet inhibitörleri ve antikoagülanlar gibi trombositopeni ile ilişkili olayları kötüleştirme olasılığı bulunan herhangi bir eşzamanlı terapinin kullanımı da göz önünde bulundurulmalıdır.
Dissemine intravasküler koagülasyon (yaygın damar içi pıhtılaşma) dahil pıhtılaşma bozuklukları
Ölümcül olayları içeren dissemine intravasküler koagülasyon (DİK), klinik çalışmalarda ve GAZYVA alan hastalarda pazarlama sonrası gözetimde rapor edilmiştir. Vakaların çoğu, trombositlerde ve laboratuvar pıhtılaşma parametrelerinde subklinik (asemptomatik) değişiklikler ile ilk infüzyondan sonraki 1-2 gün içinde meydana gelen ve genellikle bir ila iki hafta içinde ortaya çıkan spontan iyileşme ile ilacın kesilmesini veya özel müdahale gerektirmeyen, belirgin olmayan DİK içermiştir. Bazı vakalarda, olaylar IRR'ler ve/veya TLS ile ilişkilendirilmiştir. DİK için hiçbir spesifik temel risk faktörü tanımlanmamıştır. Belirgin olmayan DİK olduğundan şüphelenilen hastalar, trombositler ve belirgin DİK belirti ve semptomları için klinik gözlem dahil olmak üzere pıhtılaşma parametreleri ile yakından izlenmelidir. Belirgin DİK şüphesinin ilk başlangıcında GAZYVA kesilmeli ve uygun tedavi başlatılmalıdır.
Önceden var olan kalp hastalıklarının kötüleşmesi
Altta yatan kalp hastalığı olan hastalarda, GAZYVA tedavisi uygulandığında atriyal fibrilasyon ve taşiaritmi gibi aritmiler, angina pektoris, akut koroner sendrom, miyokard infarktüsü ve kalp yetmezliği oluşmuştur (bkz. Bölüm 4.8). Bu olaylar infüzyonla ilişkili reaksiyonun bir parçası olabilir ve ölüme yol açabilir. Bu nedenle kalp hastalığı öyküsü olan hastalar yakından izlenmelidir. Ayrıca bu hastalar, potansiyel aşırı sıvı yüklenmesini önlemek için dikkatli şekilde hidrate edilmelidir.
Enfeksiyonlar
GAZYVA, aktif enfeksiyon varlığında uygulanmamalıdır ve tekrarlayan veya kronik enfeksiyon öyküsü olan hastalarda GAZYVA kullanılması düşünülüyorsa dikkatli olunmalıdır. GAZYVA tedavisi sırasında ve tedavinin tamamlanması ardından ciddi bakteriyel, fungal ve yeni veya reaktif viral enfeksiyonlar oluşabilir. Ölümle sonuçlanan enfeksiyonlar bildirilmiştir.
CIRS >6 ve KrKl <70 mL/dk olan hastalar, şiddetli enfeksiyonlar da dahil olmak üzere daha yüksek enfeksiyon riski altındadır (bkz. Bölüm 4.8). Takip dahil, foliküler lenfoma çalışmalarının her fazında yüksek enfeksiyon insidansı görülmüştür. Takip fazı sırasında indüksiyon fazında GAZYVA ile birlikte bendamustin tedavisi alan hastalarda Evre 3-5 enfeksiyonları daha fazla görülmüştür.
Hepatit B virüs (HBV) reaktivasyonu
GAZYVA da dahil olmak üzere Anti-CD20 antikorlarıyla tedavi edilen hastalarda bazı durumlarda fulminan hepatit, hepatik yetmezlik ve ölümle sonuçlanan HBV reaktivasyonu meydana gelebilir (bkz. Bölüm 4.8). GAZYVA ile tedaviye başlanmadan önce tüm hastalarda Hepatit B virüs taraması yapılmalıdır.
Tarama, en azından hepatit B yüzey antijen (HBsAg) durumu ve hepatit B çekirdek antikor (HBcAb) durumunu içermelidir. Bunlar, yerel kılavuzlara uygun olarak diğer uygun
belirteçlerle tamamlanabilir. Aktif hepatit B hastalığı olan hastalar GAZYVA ile tedavi edilmemelidir. Pozitif hepatit B serolojisi olan hastalar, tedaviye başlanmadan önce bir karaciğer hastalıkları uzmanıyla görüşmeli ve hepatit reaktivasyonunu önlemek amacıyla yerel tıbbi standartlara uyularak izlenmeli ve kontrol altında tutulmalıdır.
Progresif multifokal lökoensefalopati (PML)
GAZYVA ile tedavi uygulanan hastalarda PML vakaları bildirilmiştir (bkz. Bölüm 4.8). Yeni başlamış veya önceden var olan nörolojik belirtiler görülen hastalarda PML tanısı dikkate alınmalıdır. PML semptomları spesifik değildir ve beynin etkilenen bölgesine göre farklılık gösterebilir. Kortikospinal kanal bulguları olan motor semptomlar (örn. kas zayıflığı, paraliz ve duyusal bozukluklar), duyusal anormallikler, serebellar semptomlar ve görme alanı defektleri yaygındır. âKortikalâ kabul edilen bazı belirtiler/semptomlar (örn. afazi veya görsel-uzaysal disoryantasyon) oluşabilir. PML'nin değerlendirilmesi bir nörolog ile konsültasyonu, beyin manyetik rezonans görüntülemeyi (MRG) ve lomber ponksiyonu (John Cunningham viral DNA için beyin omurilik sıvısı testi) içerir fakat bunlarla sınırlı değildir. GAZYVA tedavisi, olası PML incelemesi sırasında durdurulmalıdır ve PML'nin doğrulanması halinde süresiz olarak sonlandırılmalıdır. Ayrıca eş zamanlı kemoterapinin veya immünosupresif tedavinin sonlandırılması veya azaltılması dikkate alınmalıdır. Hasta, PML'nin değerlendirilmesi ve tedavisi için bir nörologa sevk edilmelidir.
İmmünizasyon
GAZYVA tedavisi ardından canlı veya atenüe viral aşılarla immünizasyonun güvenliliği incelenmemiştir ve tedavi sırasında ve B-hücre geri kazanımı sağlanana kadar canlı virüs aşılarıyla aşılama önerilmemektedir.
Anne karnında obinutuzumab maruziyeti ve bebeklerin canlı virüs aşılarıyla aşılanması
Gebelik sırasında GAZYVA'ya maruz kalan annelerin bebeklerinde B hücre deplesyonu meydana gelme potansiyelinden dolayı bebekler B hücre deplesyonu açısından izlenmeli ve canlı virüs aşılarıyla aşılamalar, bebeğin B hücre sayısının geri kazanımı sağlanana kadar ertelenmelidir (bkz. Bölüm 4.6). Aşının güvenliliği ve zamanlaması için bebeğin hekimiyle görüşülmelidir (bkz. Bölüm 4.6).
Biyolojik tıbbi ürünlerin izlenebilirliğini arttırmak için uygulanan ürünün ticari adı ve seri numarası hastanın dosyasına açık şekilde kaydedilmelidir (veya belirtilmelidir).
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Bendamustin, CHOP (siklofosfamit, doksorubisin, vinkristin ve prednizolon), FC (fludarabin, siklofosfamit) ve klorambusil ile birlikte GAZYVA kullanımı için sınırlı sayıda ilaç etkileşim alt çalışması yapılmasına karşın, resmi ilaç etkileşim çalışmaları gerçekleştirilmemiştir.
Diğer eşzamanlı kullanılan tıbbi ürünlerle etkileşim riski göz ardı edilemez. Farmakokinetik etkileşimler
Obinutuzumab, sitokrom P450 (CYP450), üridin difosfat glukuroniltransferaz (UGT) enzimleri ve P-glikoprotein gibi taşıyıcıların substratı, inhibitörü veya indükleyicisi değildir. Bu nedenle, bu enzim sistemleri tarafından metabolize edildiği bilinen tıbbi ürünlerle farmakokinetik etkileşim beklenmemektedir.
GAZYVA'nın bendamustin, FC, klorambusil veya CHOP'nin tekli bileşenleriyle eşzamanlı kullanımı, bu ilaçların farmakokinetiği üzerinde hiçbir etki göstermemiştir. Ayrıca bendamustin, FC, klorambusil veya CHOP'un, GAZYVA'nın farmakokinetiği üzerine belirgin bir etkisi olmamıştır.
Farmakodinamik etkileşimler:
Obinutuzumabın immunosupresif etkisinden dolayı, tedavi sırasında ve B hücresi geri kazanımına kadar canlı virüs aşıları ile aşılanma tavsiye edilmemektedir (bkz. Bölüm 4.4).
Obinutuzumabın klorambusil veya bendamustin ile kombinasyonu, nötropeniyi arttırabilir (bkz. Bölüm 4.4).
Özel popülasyonlara ilişkin ek bilgiler Herhangi bir etkileşim çalışması yapılmamıştır. Pediyatrik popülasyon
Herhangi bir etkileşim çalışması yapılmamıştır.
4.6. Gebelik ve laktasyon
Gebelik kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeli bulunan kadınlar, GAZYVA tedavisi sırasında ve tedavi bitiminden sonraki 18 ay boyunca etkili bir doğum kontrol yöntemi kullanmalıdır.
Gebelik dönemi
Hayvanlar üzerinde yapılan çalışmalar, gebelik ve â veya embriyonal / fetal gelişim ve â veya doğum ve â veya doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (bkz. Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. GAZYVA gerekli olmadıkça; olası yararı, potansiyel riski aşmadığı sürece, gebelik döneminde kullanılmamalıdır.
Sinomolgus maymunlarda yapılan bir üreme çalışması, embriyofetal toksisite veya teratojenik etkilere ilişkin kanıt göstermemiş, ancak yavrularda B lenfositlerin tam deplesyonuyla sonuçlanmıştır.
B-hücre sayıları yavrularda normal düzeylere dönmüş ve immünolojik fonksiyon doğumdan sonra 6 ay içinde geri kazanılmıştır. Yavrulardaki serum obinutuzumab konsantrasyonları, annelerde doğumdan sonra 28. gündeki konsantrasyonlarla aynıdır. Aynı gün içerisinde sütte bulunan konsantrasyonlar çok düşük olup, obinutuzumabın plasentaya geçtiğine işaret etmektedir (bkz. Bölüm 5.3). Gebe kadınlarda obinutuzumab kullanımına ilişkin veri yoktur.
Gebelik sırasında maruz kalma durumunda bebeklerde ürünün farmakolojik özelliklerinden ötürü B hücre deplesyonu beklenebilir. Gebelik sırasında GAZYVA'ya maruz kalan annelerin
bebeklerinde canlı aşılarla aşılamanın, bebeğin B hücre düzeyleri normal aralığa ulaşıncaya kadar ertelenmesi düşünülmelidir (bkz. Bölüm 4.4).
Laktasyon dönemi
Hayvanlar üzerinde yapılan çalışmalar, obinutuzumabın anne sütüne geçtiğini göstermiştir (bkz. Bölüm 5.3).
İnsan immunoglobülin G'nin (IgG) anne sütüne geçmesi ve emilim potansiyelinin ve bebeğe zararının bilinmemesi nedeniyle, kadınlara GAZYVA tedavisi sırasında ve son GAZYVA dozundan sonra 18 ay boyunca emzirmemeleri önerilmelidir.
Üreme yeteneği / Fertilite
Hayvanlarda GAZYVA'nın fertilite üzerindeki etkisini değerlendirmek için spesifik çalışmalar yapılmamıştır. Sinomolgus maymunlarında yapılan tekrarlı doz toksisite çalışmalarında erkek ve dişi üreme organları üzerinde advers etki gözlenmemiştir (bkz. Bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
GAZYVA'nın, araç ve makine kullanımı üzerinde etkisi yoktur veya göz ardı edilebilir. İlk GAZYVA infüzyonunda IRR'ler çok yaygındır ve infüzyona bağlı semptomlarla karşılaşan hastalara, semptomlar ortadan kalkana kadar araç veya makine kullanmamaları önerilmelidir.
4.8. İstenmeyen etkiler
Güvenlilik Profilinin Özeti
Bu bölümde açıklanan advers ilaç reaksiyonları (AİR'ler) üç pivotal klinik çalışmada FL dahil indolent Hodgkin dışı lenfomaya (iNHL) yönelik indüksiyon, idame ve takip esnasında ve KLL'ye yönelik tedavi ve takip esnasında tespit edilmiştir:
BO21004/CLL11 (N=781): Daha önce tedavi edilmemiş KLL'si olan hastalar
BO21223/GALLIUM (N=1390): Daha önce tedavi edilmemiş iNHL'si olan hastalar (hastaların %86'sında FL olduğu görülmüştür)
GAO4753g/GADOLIN (N=409): Rituximab veya rituximab içeren bir rejimle tedavi esnasında veya tedaviden sonraki 6 ayda yanıt vermeyen veya progresyon gösteren iNHL'li hastalar (çalışmadaki hastaların %81'i FL hastasıydı).
Bu çalışmalarda GAZYVA KLL için klorambusil ile kombinasyon halinde ve iNHL için bendamustin, CHOP veya CVP ile kombinasyon halinde ve ardından uygulanan GAZYVA idame tedavisi olarak incelenmiştir. BO21223/GALLIUM and GAO4753g/GADOLIN çalışmalarına FL dahil iNHL'si olan hastalar alınmıştır. Dolayısıyla, en kapsamlı güvenlilik bilgisini sağlamak üzere bütün çalışma popülasyonu (iNHL popülasyonu) üzerinde aşağıda belirtilen AİR'lere yönelik analiz gerçekleştirilmiştir.
Tablo 7'de pivotal çalışmalarda (BO21004/CLL11, BO21223/GALLIUM, GAO4753g/GADOLIN) aşağıdakiler üzerinde yapılan en az bir pivotal çalışmadaki ilgili karşılaştırma kollarına kıyasla daha yüksek insidansta (≥%2 oranında fark) gerçekleşen AİR'ler özetlenmiştir:
Tek başına klorambusil veya rituximab + klorambusil alanlara kıyasla GAZYVA + klorambusil alan KLL'li hastalar (çalışma BO21004/CLL11)
Daha önce tedavi uygulanmamış iNHL hastalarında GAZYVA + kemoterapi (bendamustin, CHOP, CVP) uygulanmasını takiben yanıt alınan hastalarda GAZYVA idamesinin uygulanmasına karşı rituximab + kemoterapi ve sonrasında yanıt alınan hastalarda rituximab idamesinin uygulanması (çalışma BO21223/GALLIUM)
Tek başına bendamustine kıyasla GAZYVA + bendamustin ve ardından bazı hastalara olmak üzere GAZYVA idame tedavisi uygulanan, rituximab veya rituximab içeren bir rejimle tedavi esnasında veya tedaviden sonraki 6 ayda yanıt vermeyen veya progresyon gösteren iNHL hastaları (çalışma GAO4753g/GADOLIN)
Tablo 7'de sunulan sıklıklar (bütün dereceler ve 3-5. Derece) üç çalışmanın herhangi birinde ilgili AİR için bildirilen en yüksek sıklıklardır.
Sıklıklar şöyle tanımlanmıştır; çok yaygın (≥1/10), yaygın (≥1/100 ila <1/10), yaygın olmayan (≥1/1.000 ila <1/100), seyrek (≥1/10.000 ila <1/1.000) ve çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Her sıklık gruplaması arasındaki advers reaksiyonlar, azalan ciddiyet sırasına göre sunulmuştur.
Tablo 7. GAZYVA + kemoterapi* alan hastalarda yüksek insidansla ( karşılaştırma koluna karşın ≥%2 fark) bildirilen AİR'lerin özeti *
Sıklık | Tüm Evreler GAZYVA + kemoterapi* (KLL, iNHL)'yi takiben GAZYVA idamesi (iNHL) | Evre 3-5â GAZYVA + kemoterapi* (KLL, iNHL)'yi takiben GAZYVA idamesi (iNHL) |
Enfeksiyonlar ve enfestasyonlar | ||
Çok yaygın | Üst solunum yolu enfeksiyonu, sinüzit, idrar yolu enfeksiyonu, pnömoni, herpes zoster, nazofarenjit |
|
Yaygın | Oral herpes, rinit, farenjit, akciğer enfeksiyonu, grip, | İdrar yolu enfeksiyonu, pnömoni, akciğer enfeksiyonu, üst solunum yolu enfeksiyonu, sinüzit, herpes zoster |
Yaygın olmayan |
| Nazofarenjit, rinit, grip, oral herpes |
(Kist ve polipler de dahil olmak üzere) iyi huylu ve kötü huylu neoplazmalar | ||
Yaygın | Yassı hücreli cilt kanseri, Bazal hücreli kanser | Yassı hücreli cilt kanseri, bazal hücreli kanser |
Kan ve lenf sistemi hastalıkları | ||
Çok yaygın | Nötropeni, trombositopeni, anemi, lökopeni | Nötropeni, trombositopeni |
Yaygın | Febril nörtopeni | Anemi, lökopeni, Febril nötropeni |
Yaygın olmayan | Dissemine intravasküler koagülasyon |
|
Metabolizma ve beslenme hastalıkları | ||
Yaygın | Tümör lizis sendromu, hiperürisemi, hipokalemi | Tümör lizis sendromu, hipokalemi |
Yaygın olmayan |
| Hiperürisemi |
Psikiyatrik hastalıklar | ||
Çok yaygın | Uykusuzluk |
|
Yaygın | Depresyon, anksiyete |
|
Yaygın olmayan |
| Uykusuzluk, depresyon, anksiyete |
Sinir sistemi hastalıkları | ||
Çok yaygın | Baş ağrısı |
|
Yaygın olmayan |
| Baş ağrısı |
Kardiyak hastalıkları | ||
Yaygın | Atriyal fibrilasyon | Atriyal fibrilasyon |
|
|
|
Vasküler hastalıkları | ||
Yaygın | Hipertansiyon | Hipertansiyon |
Solunum, göğüs bozuklukları ve mediastinal hastalıklar | ||
Çok yaygın | Öksürük |
|
Yaygın | Burun tıkanıklığı, rinore, orofarenjial ağrı |
|
Yaygın olmayan |
| Öksürük, orofarenjial ağrı |
Gastrointestinal hastalıkları | ||
Çok yaygın | Diyare, jonstipasyon |
|
Yaygın | Hazımsızlık, hemoroid | Diyare |
Yaygın olmayan |
| Konstipasyon, hemoroid |
Deri ve deri altı doku hastalıkları | ||
Çok yaygın | Alopesi, kaşıntı |
|
Yaygın | Egzema |
|
Yaygın olmayan |
| Kaşıntı |
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları | ||
Çok yaygın | Artralji, sırt ağrısı, ekstremitelerde ağrı |
|
Yaygın | Kas-iskelet göğüs ağrısı, kemik ağrısı | Ekstremitelerde ağrı |
Yaygın olmayan |
| Artralji, sırt ağrısı, kas-iskelet göğüs ağrısı, kemik ağrısı |
Böbrek ve idrar yolu hastalıkları | ||
Yaygın | Disüri, idrar tutamama |
|
Yaygın olmayan |
| Disüri, idrar tutamama |
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıkları | ||
Çok yaygın | Pireksi, asteni, yorgunluk |
|
Yaygın | Göğüs ağrısı | Pireksi, asteni, yorgunluk |
Yaygın olmayan |
| Göğüs ağrısı |
Araştırmalar | ||
Yaygın | Beyaz kan hücre sayısında azalma, nötrofil sayısında azalma, kilo artışı | Beyaz kan hücre sayısında azalma, nötrofil sayısında azalma |
Yaralanma ve zehirlenme | ||
Çok yaygın | İnfüzyonla ilişkili reaksiyonlar | İnfüzyonla ilişkili reaksiyonlar |
# Daha yüksek insidanslı (tedavi kolları arasında ≥%2'lik fark). Sadece çalışmalarda en çok görülen sıklıklar rapor edilmiştir (BO21004/daha önce tedavi edilmemiş KLL, BO21223/daha önce tedavi edilmemiş ilerlemiş iNHL ve GAO4753g/rituximab refrakter iNHL)
## GAZYVA alan hastalarda klinik çalışmalarda ve pazarlama sonrası gözetimde ölümcül olaylar dahil dissemine intravasküler koagülasyon (DİK) bildirilmiştir (bkz. Bölüm 4.4).
â Tedavi kolları arasında ≥%2'lik farkla Evre 5 advers reaksiyonları görülmemiştir.
*Kemoterapi: KLL'de Klorambusil; bendamustin, CHOP, FL dahil iNHL'de CVP
§ GAZYVA kolunda (BO21223) en az %2'den daha yüksek insidansla idame tedavisinde de görülmüştür.
Çalışma GAO4753g/GADOLIN'de bendamustin kolundaki hastalara sadece 6 aylık indüksiyon tedavisi uygulanırken, indüksiyon periyodunun ardından GAZYVA ile birlikte bendamustin kolundaki hastalar GAZYVA idame tedavisine devam etmiştir.
Çalışma GAO4753g/GADOLIN'de idame periyodunda meydana gelen en yaygın advers reaksiyonlar öksürük (%20), nötropeni (%13) üst solunum yolu enfeksiyonları (%12), sinüzit (%10), diyare (%10), bronşit (%10), bulantı (%9), yorgunluk(%9), IRR'ler (%8), , idrar yolu
enfeksiyonları (%7), nazofarenjit (%7), pireksi (%7), artralji (%6), kusma (%6), döküntü
(%6), pnömoni (%5), dispne (%5) ve ekstremitelerde ağrıdır(%5). En yaygın 3-5. Derece advers reaksiyonlar nötropeni (%10), febril nötropeni (%2), anemi, trombositopeni, pnömoni, sepsis, üst solunum yolu enfeksiyonu ve idrar yolu enfeksiyonudur (tümü %1 oranında).
FL hastalarındaki advers reaksiyon profili, her iki çalışmadaki genel iNHL popülasyonu ile tutarlı olmuştur.
Seçilmiş advers reaksiyonların tanımı
Aşağıdaki bölümlerde açıklanan insidanslardan iNHL ile ilgili olanlar, her 2 pivot çalışmada (BO21223/GALLIUM, GAO4753g/GADOLIN) raporlanan en yüksek insidanslı AİR'lerdir.
MO40597 çalışması, daha önce tedavi görmemiş FL hastalarında Döngü 2'den itibaren kısa süreli infüzyonların (yaklaşık 90 dakika) güvenlik profilini karakterize etmek için tasarlanmıştır.
İnfüzyonla ilişkili reaksiyonlar (IRR'ler)
İnfüzyonla ilişkili reaksiyonla ilişkilendirilen ve en sık bildirilen (≥%5) semptomlar, bulantı, halsizlik, titreme, hipotansiyon, pireksi, kusma, dispne, göğüs ağrısı, kızarma, hipertansiyon, baş ağrısı, taşikardi, baş dönmesi ve diyaredir. Bronkospazm, larinks ve boğaz iritasyonu, hırıltı, larinks ödemi ve atriyal fibrilasyon gibi solunum ve kardiyak semptomlar da bildirilmiştir (bkz. Bölüm 4.4).
Kronik Lenfositik Lösemi
IRR'lerin insidansı, rituximab + klorambusil koluna kıyasla GAZYVA + klorambusil kolunda daha yüksek olmuştur. İlk 1000 mg GAZYVA infüzyonuyla birlikte %66 IRR insidansı meydana gelmiştir (hastaların %20'sinde Evre 3-4 IRR meydana gelmiş). Genel olarak hastaların %7'si, GAZYVA'nın kesilmesiyle sonuçlanan bir IRR ile karşılaşmıştır. Sonraki infüzyonlarda karşılaşılan IRR insidansı, ikinci 1000 mg dozda %3, ardından ise %1'dir. 1. Döngünün ilk 1000 mg infüzyonlarından sonra Evre 3-5 IRR bildirilmemiştir.
Bölüm 4.2'de açıklanan şekilde infüzyonla ilişkili reaksiyonların engellenmesi için kombine şekilde önlemlerin alındığı hastalarda tüm Evrelerdeki infüzyonla ilişkili reaksiyonlarda azalma gözlenmiştir. Evre 3-4 IRR'lerin (görece daha az sayıda hastada meydana gelen) oranları, azaltıcı önlemler uygulanmadan önce ve uygulandıktan sonra benzer olmuştur.
Foliküler Lenfoma dahil Indolent Non-Hodgkin Lenfoma
Hastaların %12'sinde Evre 3-4 AİR'ler görülmüştür. 1. Döngüde AİR'lerin genel insidansı, karşılaştırma koluna kıyasla GAZYVA + kemoterapi alan hastalarda daha yüksek olmuştur. GAZYVA + kemoterapi alan hastalarda 1. Günde AİR insidansı en yüksek olmuş ve izleyen infüzyonlarda kademeli olarak azalmıştır. Bu azalma trendi tek başına GAZYVA ile idame sırasında devam etmiştir. 1. Döngü dışında izleyen infüzyonlarda AİR'lerin insidansı GAZYVA ve ilgili karşılaştırma kolları arasında karşılaştırılabilir olmuştur. Genel olarak, hastaların %4'ünde GAZYVA tedavisinin kesilmesini gerektiren infüzyonla ilişkili reaksiyonlar görülmüştür.
Foliküler Lenfomalı Hastalarda Kısa Süreli İnfüzyon
SDI'nin güvenliğini değerlendiren MO40597 çalışmasında, BO21223 çalışmasındaki Döngü 2'de standart infüzyondan sonra IRR yaşayan oran ile karşılaştırıldığında hastaların daha büyük bir kısmı Döngü 2'de herhangi bir derece IRR yaşamıştır (sırasıyla 10/99 [%10,1] ve 23/529 [%4,3]; araştırmacı tarafından çalışma tedavisinin herhangi bir bileşenine atfedilen IRR'ler). MO40597'de Döngü 2'de SDI'den sonra hiçbir hastada Derece ï³3 IRR yaşamamıştır; 3/529 (%0,6), BO21223 çalışmasında 2. Döngüde Derece ï³3 IRR yaşanmıştır. Her iki çalışmada da IRR semptomları ve bulguları benzerdir.
MO40597/GAZELLE Çalışmasında gözlemlenen infüzyonla ilgili reaksiyonlar Tablo 8'de özetlenmiştir.
Tablo 8, Çalışma MO40597/GAZELLE Kısa Süreli İnfüzyon: Döngüye Göre İnfüzyonla İlgili Reaksiyonlar (Güvenlik Değerlendirilebilir Popülasyon)
| ||||||||||||
|
|
|
|
|
| |||||||
|
|
|
|
|
|
|
|
|
|
| ||
C=döngü; CTCAE = Olumsuz Olaylar için Ortak Terminoloji Kriterleri; IRR=infüzyonla ilgili reaksiyon İnfüzyonla ilgili reaksiyon, araştırmacı tarafından tedavinin herhangi bir bileşeniyle ilgili olduğuna karar verilen, çalışma tedavisi infüzyonunun bitiminden sonraki 24 saat içinde veya sırasında meydana gelen herhangi bir olay olarak tanımlanır.
Nötropeni ve enfeksiyonlar
4.9. Doz aşımı ve tedavisi
İnsan klinik çalışmalarında doz aşımı ile ilgili deneyim bulunmamaktadır. GAZYVA ile yapılan klinik çalışmalarda, infüzyon başına 50 mg'den 2.000 mg'ye (dahil) kadar dozlar uygulanmıştır. Bu çalışmalarda bildirilen advers reaksiyonların insidansı ve yoğunluğu doza bağımlı görünmemektedir.
Doz aşımı oluşan hastalarda infüzyon derhal kesilmeli veya azaltılmalı ve yakın gözetim uygulanmalıdır. Hastalarda B-hücre deplesyonu sırasında kan hücre sayısının düzenli izlenmesi gerektiğine ve enfeksiyon riskinde artış olduğuna dikkat edilmelidir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ajanlar, monoklonal antikorlar ATC kodu: L01FA03
Etki mekanizması
Obinutuzumab, IgG1 izotipinin rekombinant monoklonal hümanize ve gliko işlenmiş Tip II anti-CD20 antikorudur. Hematopoietik kök hücrelerin, pro-B hücrelerin, normal plazma hücrelerinin veya diğer normal dokuların değil fakat spesifik olarak, malign olmayan ve malign pre-B ve olgun B lenfositlerin yüzeyindeki CD20 transmembran antijenin ekstraselüler
kulpunu hedef alır. Obinutuzumabın Fc kısmının gliko işlenmesi, gliko işlenmemiş antikorlara kıyasla doğal katil (NK) hücreler, makrofajlar ve monositler gibi immün efektör hücreler üzerindeki FcγRIII reseptörler için daha yüksek afinite sağlar.
Klinik dışı çalışmalarda obinutuzumab doğrudan hücre ölümüne yol açmakta ve FcγRIII pozitif immün efektör hücrelerin katılması yoluyla antikora bağımlı hücresel sitotoksisiteyi (ADCC) ve antikora bağımlı hücresel fagositozu (ADCP) düzenlemektedir. Buna ek olarak, obinutuzumab düşük derecede kompleman bağımlı sitotoksisiteyi (CDC) düzenlemektedir. Hayvan modellerinde obinutuzumab, potent B hücre deplesyonunu ve antitümör etkililiği düzenler. Tip I antikorlara kıyasla, Tip II antikor olan obinutuzumab, eşdeğer dozda CDC'de eş zamanlı bir azalmayla birlikte doğrudan hücre ölümünün indüklenmesinde artışla karakterize edilir. Gliko işlenmemiş antikorlara kıyasla, gliko işlenmiş bir antikor olarak obinutuzumab, eşdeğer bir dozda yüksek antikora bağımlı hücresel sitotoksisite (ADCC) ve fagositoz (ADCP) ile karakterize edilir. Obinutuzumab hayvan modellerinde potent B-hücre deplesyonu ve antitümör etkililiğe aracılık eder.
KLL'li hastalarda yapılan pivotal klinik çalışmada (BO21004/CLL11), GAZYVA uygulanmasıyla değerlendirilebilen hastaların %91'inde (40/44) tedavi dönemi sonunda B hücre deplesyonu (CD19+ B hücre sayısının <0,07 x 10/L olması şeklinde tanımlanmıştır) olmuş ve deplesyon, ilk 6 aylık takip boyunca devam etmiştir. B hücrelerin geri kazanımı, progresif hastalık olmaksızın hastaların %35'inde (14/40) ve progresif hastalık varlığında hastaların %13'ünde (5/40) takip döneminin 12-18 ayında gözlenmiştir.
iNHL'li hastalarda yapılan pivotal klinik çalışmada (GAO4753/GADOLIN), GAZYVA uygulaması ile değerlendirilebilen hastaların %97'sinde (171/176) tedavi dönemi sonunda B hücre deplesyonu olmuş ve %97'sinde (61/63) son dozu takiben 6 aydan fazla deplesyon devam etmiştir. B hücrelerinin geri kazanımı, tedaviye tepkileri ölçülebilir hastaların %11'inde (5/46) takip döneminin 12-18 ayında gözlenmiştir.
Klinik etkililik ve güvenlilik
- Kronik Lenfositik Lösemi
Komorbiditeleri bulunan daha önce tedavi uygulanmamış kronik lenfositik lösemili hastalarda rituximab + klorambusil (RClb) veya tek başına klorambusile (Clb) karşı GAZYVA + klorambusilin (GClb) etkililiğini ve güvenliliğini inceleyen uluslararası, çok merkezli, açık etiketli, randomize, iki aşamalı, üç kollu bir Faz III klinik çalışma gerçekleştirilmiştir.
Katılımdan önce hastalarda CD20+ KLL ve eş zamanlı mevcut tıbbi durumlara ilişkin aşağıdaki ölçütlerden birinin veya ikisinin bulunduğunun belgelenmesi gerekmiştir; 6'dan yüksek komorbidite skoru (CIRS) veya böbrek fonksiyonunda azalma (KrKl <70 mL/dakika). Karaciğer fonksiyonu (Ulusal Kanser Enstitüsü â Evre 3 karaciğer fonksiyon testleri için Ortak Terminoloji Kriterleri (>2 haftalık AST, ALT > 5 x NÜS; bilirubin > 3 x NÜS) ve renal fonksiyonu (KrKl < 30 mL/dk) yetersiz olan hastalar çalışma dışı bırakılmıştır. CIRS tanımına göre göz, kulak, burun, boğaz ve larenks organ sistemi dışında bir veya daha fazla bireysel organ/sistem yetmezlik skoru 4 olarak değerlendirilen hastalar, çalışma dışı bırakılmıştır.
Toplam 781 hasta, GAZYVA + klorambusil, rituximab + klorambusil veya tek başına klorambusil almak üzere 2:2:1 oranında randomize edilmiştir. Evre 1a'da 356 hasta üzerinde GAZYVA + klorambusil ile tek başına klorambusil, Evre 2'de ise 663 hasta üzerinde GAZYVA
+ klorambusil ile rituximab + klorambusil karşılaştırılmıştır.
Hastaların büyük bölümünde GAZYVA, ilk tedavi döngüsünün 1. günü, 8. günü ve 15. günü uygulanan 1.000 mg başlangıç dozu şeklinde intravenöz yolla verilmiştir. Hastalarda infüzyonla ilişkili reaksiyonların oranını azaltmak için bir düzenleme yapılmış ve 140 hasta, ilk GAZYVA dozunu 1. gün [100 mg] ve 2. gün [900 mg] bölünmüş olarak almıştır (bkz. bölüm 4.2 ve 4.4). Sonraki her tedavi döngüsünde (Döngü2 ile 6), hastalar GAZYVA 1.000 mg dozunu yalnızca 1. günde almıştır. Klorambusil, tüm tedavi döngülerinin (1 ile 6) 1. günü ve 15. günü oral yolla 0,5 mg/kg vücut ağırlığı şeklinde verilmiştir.
Demografik veriler ve başlangıç özellikleri, tedavi grupları arasında iyi dengelenmiştir. Hastaların büyük bölümü beyaz (%95) ve erkektir (%61). Hastaların %44'ü 75 yaş veya üzeri olmak üzere, medyan yaş 73'tür. Başlangıçta hastaların %22'sinde Binet Evre A, %42'sinde Binet Evre B ve %36'sında Binet Evre C mevcuttur.
Medyan komorbidite skoru 8'dir ve katılan hastaların %76'sında komorbidite skoru 6'dan yüksek olmuştur. Medyan tahmini KrKl 62 mL/dakika olmuş ve tüm hastaların %66'sında KrKl <70 mL/dakika bulunmuştur. Katılan hastaların yüzde kırk ikisinde hem <70 mL/dakika KrKl, hem de >6 komorbidite skoru belirlenmiştir. Hastaların yüzde otuz dördü yalnızca komorbidite skoru üzerine çalışmaya katılırken, hastaların %23'ü yalnızca bozulmuş böbrek fonksiyonuyla katılmıştır.
En sık bildirilen eş zamanlı tıbbi hastalıklar (%30 veya daha yüksek kesim değeri kullanılarak), MedDRA vücut sistemlerinde: Vasküler hastalıklar (%73), kardiyak hastalıklar (%46), gastrointestinal hastalıklar (%38), metabolizma ve beslenme hastalıkları (%40), böbrek ve idrar hastalıkları (%38), kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları (%33) olmuştur.
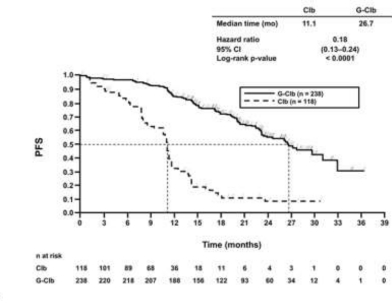
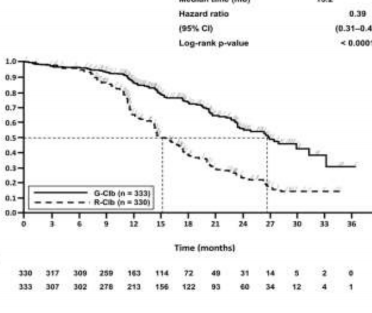
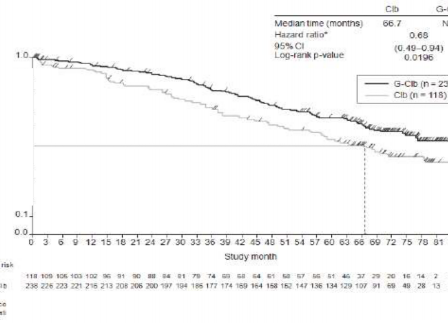
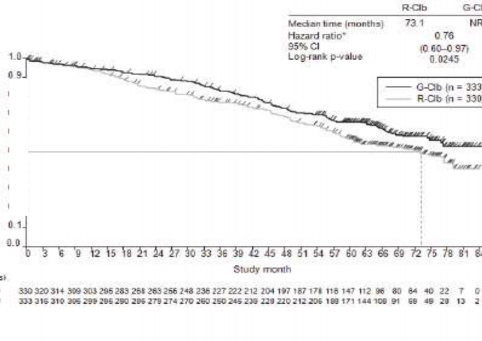
Daha önce tedavi edilmemiş KLL hastalarındaki etkililik verileri Tablo 9'da özetlenmektedir. Progresyonsuz sağkalım (PFS) ve Genel sağkalım (OS) için Kaplan-Meier eğrileri Şekil 1- 4'te verilmektedir.
Tablo 9. BO21004/CLL11 çalışmasından etkililik özeti
| Evre 1a | Evre 2 | ||
| klorambusil N=118 | GAZYVA + klorambusil N= 238 | Rituximab + klorambusil N= 330 | GAZYVA + klorambusil N= 333 |
| 22,8 aylık medyan gözlem süresi | 18,7 aylık medyan gözlem süresi | ||
Birincil sonlanım noktası | ||||
Araştırmacı tarafından değerlendirilen PFS (PFS-IRC)a |
|
| ||
Olay meydana gelen hasta sayısı (%) | 96 (%81,4) | 93 (%39,1) | 199 (%60,3) | 104 (%31,2) |
Medyan PFS süresi (ay) | 11,1 | 26,7 | 15,2 | 26,7 |
Tehlike oranı (%95 GA) | 0,18 [0,13; 0,24] | 0,39 [0,31; 0,49] | ||
p-değeri(Log-sıra testi, tabakalandırılmış ) | <0,0001 | <0,0001 | ||
Kilit ikincil sonlanım noktaları | ||||
IRC-tarafından değerlendirilen PFS (PFS-IRC)a |
|
| ||
Olay meydana gelen hasta sayısı (%) | 90 (%76,3) | 89 (%37,4) | 183 (%55,5) | 103 (%30,9) |
Medyan PFS süresi (ay) | 11,2 | 27,2 | 14,9 | 26,7 |
Tehlike oranı (%95 GA) | 0,19 [0,14; 0,27] | 0,42 [0,33; 0,54] | ||
p-değeri(Log-sıra testi, tabakalandırılmış ) | <0,0001 | <0,0001 | ||
Tedavi bitimindeki yanıt oranı |
|
| ||
Analize dahil edilen hasta sayısı | 118 | 238 | 329 | 333 |
Yanıt verenler (%) | 37 (%31,4) | 184 (%77,3) | 214 (%65,0) | 261 (%78,4) |
Yanıt vermeyenler (%) | 81 (%68,6) | 54 (%22,7) | 115 (%35,0) | 72 (%21,6) |
Yanıt oranındaki fark,(%95 GA) | 45,95 [35,6; 56,3] | 13,33 [6,4; 20,3] | ||
p-değeri (Ki-kare Testi) | <0,0001 | 0,0001 | ||
Tam yanıt verenlerin sayısı (%) | 0 (%0,0) | 53 (%22,3) | 23 (%7,0) | 69 (%20,7) |
Tedavi bitiminde moleküler remisyon |
|
| ||
Analize dahil edilen hasta sayısı | 90 | 168 | 244 | 239 |
MRD negatif (%) | 0 (%0) | 45 (%26,8) | 6 (%2,5) | 61 (%25,5) |
MRD pozitiff (%) | 90 (%100) | 123 (%73,2) | 238 (%97,5) | 178 (%74,5) |
MRD oranındaki farklar, (%95 GA) | 26,79 [19,5; 34,1] | 23,06 [17,0; 29,1] | ||
Olaysız Sağkalım |
|
| ||
Olay meydana gelen hasta sayısı (%) | 103 (%87,3) | 104 (%43,7) | 208 (%63,0) | 118 (%35,4) |
Olaya kadar geçen medyan süre (ay) | 10,8 | 26,1 | 14,3 | 26,1 |
Tehlike oranı (%95 GA) | 0,19 [0,14; 0,25] | 0,43 [0,34; 0,54] | ||
p-değeri (Log-sıra testi, tabakalandırılmış) | <0,0001 | <0,0001 | ||
Yeni anti lösemi tedavisine kadar geçen süre |
|
| ||
Olay meydana gelen hasta sayısı (%) | 65 (%55,1) | 51 (%21,4) | 86(%26,1) | 55(%16,5) |
Olaya kadar geçen medyan süre (ay) | 14,8 | NR | 30,8 | NR |
Tehlike oranı (%95 GA) | 0,24 [0,16; 0,35] | 0,59 [0,42;0,82] | ||
p-değeri(Log-sıra testi,tabakalandırılmış) | <0.0001 | <0,0018 | ||
Genel sağkalım |
|
| ||
Olay meydana gelen hasta sayısı (%) | 57 (%48,3) | 93 (%39,1) | 147 (%44,5) | 121 (%36,3) |
Olaya kadar geçen medyan süre (ay) | 66,7 | NR | 73,1 | NR |
Tehlike oranı (%95 GA) | 0,68 [0,49; 0,94] | 0,76 [0,60; 0,97] | ||
p-değeri(Log-sıra testi, tabakalandırılmış) | 0,0196 | 0,0245 | ||
Alt grup analizleri
PFS alt grup analizinin bulguları (yani cinsiyet, yaş, Binet evresi, KrKl, CIRS skoru, beta2- mikroglobülin, IGVH durumu, kromozom anormallikleri, başlangıçtaki lenfosit sayısı), genel tedavi amaçlı popülasyonda görülen bulgularla tutarlı olmuştur. Hastalık progresyonu veya ölüm riski, 17p delesyonlu hasta alt grubu dışındaki tüm hastalarda RClb kolu ve Clb koluna kıyasla GClb kolunda azalmıştır. 17p delesyonlu küçük hasta alt grubunda Clb'ye (HR=0,42, p=0,0892) kıyasla yalnızca bir pozitif trend gözlenmiş, RClb'ye kıyasla yarar gözlenmemiştir. Alt gruplar için hastalık progresyon veya ölüm riskindeki azalma GClb'ye karşı Clb için %92 ile %58, GClb'ye karşı RClb için ise %72 ile %29 arasındadır.
Risk altındaki hasta sayısı
Zaman (ay)
Şekil 1. KLL'li hastalarda araştırmacı tarafından değerlendirilen Evre 1a progresyonsuz sağkalımın Kaplan-Meier eğrisi (BO21004/CLL11 çalışması)
Şekil 2. KLL'li hastalarda Evre 1a'ya ait genel sağkalımın Kaplan-Meier eğrisi (BO21004/CLL11 çalışması)
Zaman (ay)
Risk altındaki hasta sayısı
Risk altındaki hasta sayısı
Şekil 3. KLL'li hastalarda araştırmacı tarafından değerlendirilen Evre 2 progresyonsuz sağkalımın Kaplan-Meier eğrisi (BO21004/CLL11 çalışması)
Şekil 4. KLL'li hastalarda Evre 1a'ya ait genel sağkalımın Kaplan-Meier eğrisi (BO21004/CLL11 çalışması)
Risk altındaki hasta sayısı
Zaman (ay)
Yaşam kalitesi
Tedavi dönemi sırasında yapılan QLQC30 ve QLQ-CLL-16 anketlerinde, alt ölçeklerden herhangi birinde anlamlı bir farklılık gözlenmemiştir. Takip sırasında veriler, özellikle tek başına klorambusil kolu için sınırlıdır. Bununla birlikte, bugüne kadar takip sırasında yaşam kalitesi açısından belirgin bir farklılık saptanmamıştır.
Sağlıkla ilişkili yaşam kalitesi değerlendirmeleri, tedavi dönemi boyunca özellikle yorgunluk açısından istatistiksel olarak anlamlı bir fark göstermemektedir; bu durum klorambusil rejimine GAZYVA eklenmesinin hastalarda yorgunluğu arttırmadığını öne sürmektedir.
- Foliküler Lenfoma
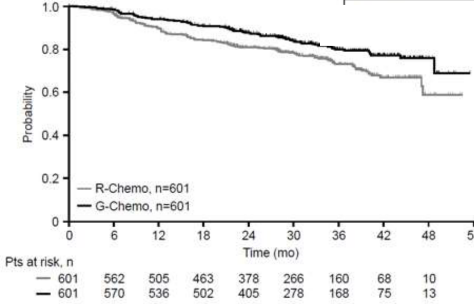
Daha önce tedavi edilmemiş foliküler lenfoma (BO21223/GALLIUM):
Faz III, açık etiketli, çok merkezli, randomize bir klinik çalışmada (BO21223/GALLIUM), daha önce tedavi görmemiş Derece 1-3a ilerlemiş (evre II bulky hastalık, evre III/IV) FL olan 1202 hasta değerlendirilmiştir. FL Derece 3b olan hastalar çalışma dışı bırakılmıştır. Hastalar, kemoterapi (bendamustin, CHOP veya CVP) ile kombinasyon halinde GAZYVA (n=601 hasta) veya rituximab (n=601 hasta) ve ardından tam veya kısmi yanıt elde edilen hastalarda GAZYVA veya rituksimab idamesi almak üzere 1:1 olacak şekilde randomize edilmiştir.
GAZYVA, 1. Döngünün ve takip eden döngülerin 1., 8. ve 15. günlerinde 1.000 mg'lık doz olarak intravenöz infüzyon yoluyla verilmiştir. Toplamda, altı döngü GAZYVA (her 28 günde bir), altı döngü bendamustin ile kombinasyon halinde ve altı döngü CHOP veya sekiz döngü CVP ile birlikte toplam sekiz döngü GAZYVA (her 21 günde bir) verilmiştir. GAZYVA kemoterapiden önce uygulanmıştır. Bendamustin, GAZYVA ile kombinasyon halinde verildiğinde 90 mg/m/gün'de tüm tedavi döngüleri için (Döngü1-6) 1. ve 2. Günlerde intravenöz olarak verilmiştir. Standart CHOP ve CVP dozu verilmiştir. Döngü6-8'i takiben, kemoterapi ile kombinasyon halinde, yanıt veren hastalar, hastalık progresyonuna kadar veya 2 yıla kadar her 2 ayda bir GAZYVA idame tedavisi almıştır.
Hasta popülasyonunun demografik verileri ve temel özellikleri, tedavi kolları arasında iyi dengelenmiştir; medyan yaş 59, %81 beyaz, %53 kadın, %79 FLIPI skoru ≥2 ve %7 Evre II (bulky), %35 Evre III ve %57 Evre IV hastalık, %44 bulky hastalığı (>7 cm), %34'ünün başlangıçta en az bir B semptomu vardı ve %97'sinin başlangıçta ECOG performans durumu 0-1 idi. Hastaların %57'si bendamustin, %33'ü CHOP ve %10'u CVP kemoterapisi almıştır.
Önceden tedavi edilmemiş FL hastalarına yönelik etkinlik sonuçları Tablo 10'da özetlenmiştir. Progresyonsuz sağkalım (PFS) için Kaplan-Meier eğrileri Şekil 5'te gösterilmiştir.
Tablo 10: BO21223/GALLIUM çalışmasından daha önce tedavi edilmemiş FL hastalarına ait etkililiğin özeti
| Rituximab idame | Gazyva idame tedavisinin |
tedavisinin takip ettiği | takip ettiği | |
Rituximab + Kemoterapi | Gazyva + Kemoterapi | |
N=601 | N=601 | |
| Medyan gözlem süresi: 34 ay | Medyan gözlem süresi: 35 ay |
Birincil sonlanım noktası |
| |
IRC tarafından değerlendirilen PFS (PFS-IRC) |
| |
Olayla karşılaşan hasta sayısı (%) | 144 (24%) | 101 (16.8%) |
HR (%95 GA) | 0.66 [0.51, 0.85] | |
p-değeri (Log-Rank tabakalandırılmış*) | testi, |
0.0012 |
3 yıllık PFS tahmini | 73.3 | 80 |
[%95 GA] | [68.8, 77.2] | [75.9, 83.6] |
Kilit sonlanım noktası |
| |
IRC tarafından değerlendirilen PFS (PFS-IRC) |
| |
Olayla karşılaşan hasta sayısı (%) | 125 (20.8%) | 93 (15.5%) |
HR (%95 GA) | 0.71 [0.54, 0.93] | |
p-değeri (Log-Rank tabakalandırılmış*) | testi, |
0.0138 |
Bir sonraki anti-lenfoma tedavisine kadar geçen süre |
| |
Olayla karşılaşan hasta sayısı (%) | 111 (18.5%) | 80 (13.3%) |
HR (%95 GA) | 0.68 [0.51, 0.91] | |
p-değeri (Log-Rank tabakalandırılmış*) | testi, |
0.0094 |
Genel sağkalım |
| |
Olayla karşılaşan hasta sayısı (%) | 46 (7.7%) | 35 (5.8%) |
HR (%95 GA) | 0.75 [0.49, 1.17] | |
p-değeri (Log-Rank tabakalandırılmış*) | testi, |
0.21 |
İndüksiyon Sonundaki Genel Yanıt Oranı** IR tarafından değerlemdirilen, CT) |
| |
Yanıt verenler (%) (TY, KY) | 522 (86.9%) | 532 (88.5%) |
Yanıt oranındaki fark (%) [%95 GA] |
1.7% [-2.1%, 5.5%] | |
p değeri Haenszel testi) | (Cochran-Mantel- |
0.33 |
Tam Yanıt (TY) | 143 (23.8%) | 117 (19.5%) |
Kısmi Yanıt (KY) | 379 (63.1%) | 415 (69.1%) |
IRC: Bağımsız İnceleme Komitesi; PFS: progresyonsuz sağkalım; HR: Tehlike Oranı; GA: Güven Aralığı
* Tabakalandırma faktörleri kemoterapi rejimi, foliküler lenfoma için FLIPI risk grubu, coğrafi bölge idi.
§ Bu etkinlik ara analizindeki önem düzeyi: 0.012
¶ Veriler Henüz Olgun Değil. Analiz sırasında medyana ulaşılamadı
# çokluk için ayarlanmadı
**Değiştirilmiş Cheson 2007 kriterlerine göre değerlendirilmiştir
â¡ İndüksiyonun Sonu = indüksiyon fazının sonu, monoterapi idamesini içermez
HR, 0.66; %95 GA, 0.51
0.85; p=0.0012
Şekil 5 Daha önce tedavi edilmemiş FL hastalarında IRC tarafından değerlendirilen progresyonsuz sağkalım Kaplan-Meier eğrisi (Çalışma BO21223/GALLIUM)
Alt grup analizlerinin sonuçları
Alt grup analizlerinin sonuçları (çokluk için ayarlanmamış) genel olarak FL popülasyonunda görülen sonuçlarla tutarlıdır ve genel sonucun sağlamlığını desteklemektedir. Değerlendirilen alt gruplar, başlangıçta IPI, FLIPI, Bulky Hastalığı, B Semptomları, Ann Arbor Aşaması ve başlangıçta ECOG'u içermekteydi. FLIPI skoru 0-1 (düşük risk) olan hastalarda, GAZYVA + kemoterapi ve rituximab + kemoterapi arasında fark gözlenmemektedir (IRC-değerli PFS HR
1.17 (%95CI 0.63;2.19, 40 PFS olayı). Bu alt grup %21'den (253/1202) oluşmaktadır ve PFS olaylarının %16.3'ünü (40/245) yaşamıştır. Ek olarak, kemoterapi rejimleri (bendamustin, CHOP ve CVP) genelinde PFS'nin keşif amaçlı alt grup analizleri, GAZYVA artı kemoterapi popülasyonunda görülen sonuçlarla tutarlıydı. Kemoterapi alt grubuna göre gözlemlenen HR'ler aşağıdaki gibidir; CHOP (n = 398): HR 0,77 (%95 GA: 0,50, 1,20), CVP (n = 118):
HR 0,63 (%95 GA: 0,32, 1,21) ve bendamustin (n = 686): HR 0,61 (95) %CI: 0.43, 0.86).
Hasta Bildirimli Sonlanımlar
Tedavi ve takip aşamaları sırasında toplanan FACT-Lym anketine dayanarak, her iki tedavi kolundaki hastalar, Lenfoma alt ölçeğinde başlangıca göre ï³ 3 puanlık bir artış, ï³ 6 puanlık bir artış ile tanımlanan lenfoma ile ilgili semptomlarda klinik olarak anlamlı iyileşmeler yaşanmıştır. FACT Lym TOI'deki başlangıca göre ve FACT Lym Total skorunda başlangıca göre ï³ 7 puanlık bir artış. EQ-5D fayda puanları başlangıçta, tedavi ve takip sırasında benzerdi. HRQOL veya sağlık durumu ölçümlerinde kollar arasında anlamlı bir fark görülmemiştir.
Açık etiket tasarımı nedeniyle, hasta tarafından bildirilen sonuçlar dikkatle yorumlanmalıdır.
Rituximab veya rituximab içeren tedavi rejimi alan foliküler lenfoma hastalarında tedavi sırasında veya 6 ay sonrasına kadar yanıtsızlık veya nüks gelişmesi durumunda (GAO4753g/GADOLIN):
Faz III, açık etiketli, çok merkezli, randomize bir klinik çalışmada (GAO4753g (GADOLIN)), tedavi sırasında yanıt vermeyen veya (indüksiyon veya idame tedavisinin bir parçası olarak rituximab monoterapisi de dahil olmak üzere) son rituximab ya da rituximab içeren bir rejimin son dozunu takiben hastalığı ilerleyen 396 iNHL hastası değerlendirilmiştir. Hastalar, her biri 28 gün süreli 6 döngü şeklinde tek başına bendamustin (B) (n = 202) veya bendamustin ile kombinasyon olarak GAZYVA (G+B) (n = 194= almak üzere 1:1 randomize edilmiştir. Hastalığı ilerlemeyen G+B kolundaki hastalar (yani, indüksiyon bitiminde tam yanıt (CR), kısmi yanıt (PR) veren veya hastalığı stabil seyreden (SD)) hastalar, iki yıl süreyle her iki ayda bir veya (hangisi daha önce ise) hastalık progresyonuna kadar GAZYVA ile idame tedavisi almaya devam etmiştir. Hastalar, bölge, iNHL alttipi (foliküler versus non-foliküler), rituximab-refrakter tip (rituximab monoterapisinden veya kemoterapiyle kombinasyon şeklinde rituximab tedavisinden önce olmak üzere) ve önceki tedavilerin sayısı (≤2'ye karşı
>2) doğrultusunda tabakalandırılmıştır.
Demografik veriler ve başlangıç karakteristikleri iyi dengelenmiştir (medyan yaş 63 yıldır; çoğunluk beyaz ırka mensuptur [%88] ve erkektir [%58]). Hastaların çoğunluğunda foliküler lenfoma (%81) vardır. İlk tanıdan bu yana geçen medyan süre 3 yıldır ve önceki tedavilerin medyan sayısı 2'dir (aralık: 1 ila 10); hastaların %44'ü daha önce 1 kez, %34'ü ise 2 tedavi almıştır.
GAZYVA, Döngü1'in 1, 8 ve 15. ve Döngü2-6'nın 1. Gününde ve hastalık progresyonu meydana gelmeyen hastalara, iki yıl süreyle her iki ayda bir (ya da hangisi daha önce ise) hastalık progresyonuna kadar 1.000 mg kesin dozda intravenöz infüzyon olarak verilmiştir. Bendamustin, tüm tedavi döngülerinin (Döngü1-6) 1 ve 2. Günlerinde, GAZYVA ile kombinasyon şeklinde 90 mg/m/gün, tek başına verildiğinde ise 120 mg/m/gün olarak intravenöz yolla verilmiştir. B kolundaki hastaların %66,7'sine karşılık G+ B ile tedavi edilen hastaların %79,4'ü altı tedavi döngüsünün tamamını almıştır.
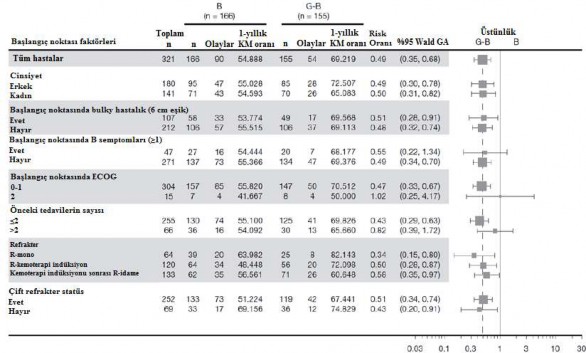
Bağımsız İnceleme Komitesine (IRC) dayalı primer analiz değerlendirmesi, tek başına bendamustin alan hastalarla karşılaştırıldığında G+B ve onu takiben GAZYVA idame tedavisi alan iNHL hastalarında hastalık progresyon (PD) veya ölüm riskinde, %45 oranında istatistiksel olarak önemli ve klinik olarak anlamlı bir azalmayı göstermiştir. iNHL popülasyonunda görülen hastalık progresyonu veya ölüm riskindeki azalma foliküler lenfoma hastalarının alt grubundan etkilenmiştir.
GAO4753g çalışmasında yer alan hastaların çoğunluğunda (%81,1) FL mevcuttur. FL popülasyonundaki primer analiz etkililik sonuçları Tablo 11 ve Şekil 6 ve 8'de gösterilmektedir. Hastaların %11,6'sında marjinal zon lenfoma (MZL) ve %7,1'inde küçük lenfositik lenfoma (SLL) mevcuttu. FL olmayan popülasyonda IRC ile değerlendirilen PFS için HR 0,94 (% 95 GA: 0,49, 1,90)' dür. MZL ve SLL alt popülasyonlarındaki etkililiği konusunda kesin bir sonuç çıkarılamamıştır.
Final analizde, B kolundaki FL hastaları için ortalama gözlem süresi 45,9 ay (aralık: 0-100,9 ay) ve G + B kolundaki hastalar için 57,3 ay (aralık: 0,4-97,6 ay) idi, bu da birincil analizden bu yana sırasıyla B ve G + B kollarında ek 25,6 ay ve 35,2 ay ortalama takibi temsil etmektedir. IRC değerlendirmeleri devam etmediği için nihai analizde sadece Araştırmacı (IRC) tarafından değerlendirilen sonlanım noktaları rapor edilmiştir. Genel olarak, araştırmacı tarafından değerlendirilen etkililik sonuçları, birincil analizde gözlemlenenlerle tutarlıdır.
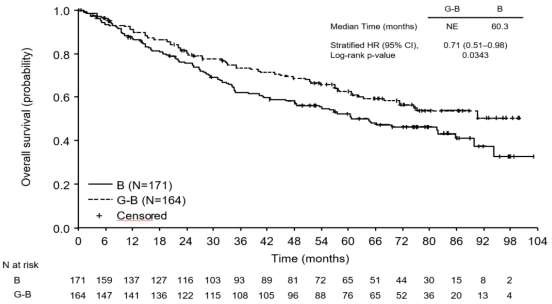
FL'li hastalarda genel sağkalım (OS) daha uzun takip doğrultusunda istikrarlıdır (bkz. Şekil 7); ölüm riski için HR 0,71 (% 95 GA: 0,51, 0,98)'dir.
Tablo 11: GAO4753g/GADOLIN çalışmasından FL hastalarına ait primer etkililik analizi özeti
| Bendamustin N=166 | Gazyva idame tedavisinin takip ettiği Gazyva + Bendamustin N= 155 |
| Medyan gözlem süresi: 20 ay | Medyan gözlem süresi: 22 ay |
FL popülasyonundaki birincil sonlanım noktası |
| |
IRC tarafından değerlendirilen PFS (PFS-IRC) |
| |
Olayla karşılaşan hasta sayısı (%) | 90 (54,2%) | 54 (34,8%) |
Medyan PFS süresi (ay) (%95 GA) | 13,8 (11,4, 16,2) | NR (22,5,-) |
HR (%95 GA) | 0,48 (0,34, 0,68) | |
p-değeri (Log-Rank testi, tabakalandırılmış*) | <0,0001 | |
İkincil Sonlanım Noktaları |
| |
Araştırmacı tarafından değerlendirilen PFS (PFS-IRC) |
| |
Olayla karşılaşan hasta sayısı (%) | 102 (61,4%) | 62 (40,0%) |
Medyan PFS süresi (ay) (%95 GA) | 13,7 (11,0, 15,5) | 29,2 (17,5,-) |
HR (%95 GA) | 0,48 (0,35, 0,67) | |
p-değeri (Log-Rank testi, tabakalandırılmış*) | <0,0001 | |
En İyi Genel Yanıt (BOR) (IRC-tarafından değerlendirilen) |
| |
Analize dahil edilen hasta sayısı | 161 | 153 |
Yanıt verenler (%) (CR/PR) | 124 (77,0%) | 122 (79,7%) |
Yanıt oranı farkı (%95 GA) | 2,72 (-6,74, 12,18) | |
p-değeri (Cochran-Mantel-Haenszel test,) | 0,6142 | |
Tam Yanıt Verenler (%) | 31 (19,3%) | 24 (15,7%) |
Kısmi Yanıt Verenler (%) | 93 (57,8%) | 98 (64,1%) |
Stabil Hastalık (%) | 18 (11,2%) | 13 (8,5%) |
Yanıt süresi (IRC tarafından değerlendirilen) |
| |
Analize dahil edilen hasta sayısı | 127 | 122 |
Olaylı hasta sayısı (%) | 74 (58,3%) | 36 (29,5%) |
Medyan DOR süresi (ay) (%95 GA) | 11,9 (8,8, 13,6) | NR (25,4,-) |
HR (%95 GA) | 0,36 (0,24, 0,54) | |
Genel sağkalım (henüz olgunlaşmamış) |
| |
Olaylı hasta sayısı (%) | 36 (21,7%) | 25 (16.1%) |
Olaya kadar geçen medyan süre (ay) | NR | NR |
HR (%95 GA) | 0,71 (0,43, 1,19) | |
p-değeri (Log-Rank testi, tabakalandırılmış*) | 0,1976 | |
IRC: Bağımsız İnceleme Komitesi; PFS: progresyonsuz sağkalım; HR: Hazard Oranı; GA: Güven Aralığı, NR
= Ulaşılamadı
*Analize yönelik tabakalandırma faktörleri refrakter tip (rituximab monoterapisi vs. rituximab + kemoterapi) ve önceki tedaviler idi (≤ 2 vs ≥2). Foliküler versus non-foliküler de çalışmaya yönelik bit tabakalandırma faktörü olmasına karşın, foliküler lenfoma hastalarının altgrup analizi için geçerli değildir.
§ Tedavi başlangıcından itibaren 12 ay içerisindeki en iyi yanıt
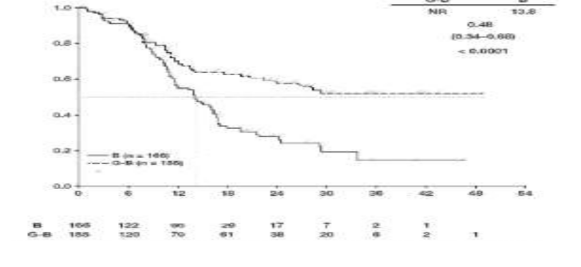
95% GA
Şekil 6: Foliküler lenfoma hastalarında IRC ile değerlendirilen progresyonsuz sağkalıma ait Kaplan-Meier eğrisi (GAO4753g/GADOLIN çalışması)
Şekil 7: Foliküler lenfoma hastalarında genel sağkalıma ait final analizinin Kaplan- Meier eğrisi (GAO4753g/GADOLIN çalışması)
Alt grup analizlerinin sonuçları
Altgrup analizlerinin sonuçları genel olarak FL popülasyonunda görülen sonuçlarla uyumludur ve genel sonucun sağlamlığını desteklemektedir.
Şekil 8: Foliküler lenfomada hasta altgrubuna göre IRC tarafından değerlendirilen PFS* (GAO4753g/GADOLIN çalışması)
Kısa Süreli İnfüzyon Çalışması MO40597 (GAZELLE)
CHOP, CVP veya bendamustin kemoterapisi ile kombinasyon halinde uygulanan obinutuzumab'ın kısa (yaklaşık 90 dakika) süreli infüzyonunun (SDI) güvenliği, daha önce tedavi edilmemiş ilerlemiş foliküler lenfoması olan 113 hastada çok merkezli, açık etiketli, tek kollu bir çalışmada değerlendirilmiştir (Çalışma MO40597/GAZELLE).
Hastalar, ilk obinutuzumab kürünü, Döngü 1'in 1, 8 ve 15'inci günlerinde standart infüzyon hızında almıştır. İlk döngü sırasında herhangi bir Derece ≥3 IRR yaşamayan hastalar, Döngü 2'den itibaren SDI almıştır.
Çalışmanın birincil sonlanım noktası, 2. Döngü sırasında SDI ile ilişkili Derece ≥3 IRR yaşayan ve Derece ≥3 IRR yaşamadan 1. Döngü sırasında standart infüzyon hızında daha önce 3 obinutuzumab uygulaması almış olan hastaların oranıdır.
2. Döngüde SDI alan hastalar arasında Derece ≥3 IRR gözlenmemiştir. 2. Döngüden sonra sadece bir hastada 3. Aşama IRR yaşanmıştır (5. Döngüde hipertansiyon) (bkz. Bölüm 4.8 İstenmeyen Etkiler).
Hasta Bildirimli Sonlanımlar
Tedavi sırasında ve takip dönemlerinde yapılan FACT-Lym anketi ve EQ-5D indeks ölçeğine göre, sağlıkla ilgili yaşam kalitesi pivot çalışma sırasında genel olarak sürdürülmüş olup, kollar arasında anlamlı fark bulunmamıştır. Bununla birlikte, FL hastalarında bendamustine GAZYVA eklenmesi, xFACT-Lym TOI skoru ile ölçülen sağlıkla ilgili yaşam kalitesinde düşüşe kadar geçen süreyi 2,2 ay uzatmıştır (benda ve G+B için sırasıyla medyan 5,6'ya karşı 7,8 ay HR= 0,83; %95 GA: 0,60, 1,13).
İmmünojenisite
İmmünojenisite tayin bulguları; tayin duyarlılığı ve özgüllüğü, tayin metodolojisi, tayinin dolaşımdaki GAZYVA/antikor miktarları açısından gücü, numunelerin kullanımı, numune toplama zamanı, eş zamanlı ilaçlar ve altta yatan hastalıklar dahil birçok faktöre yüksek düzeyde bağımlıdır. Bu nedenlerle, GAZYVA'ya karşı antikorların insidansının diğer ürünlere karşı antikorların insidansıyla karşılaştırılması yanıltıcı olabilir.
BO21004/CLL11 pivot çalışmasında yer alan hastalar, GAZYVA'ya yönelik anti-terapötik antikorlar (ATA) için birden fazla zaman noktasında test edilmiştir. GAZYVA ile tedavi edilen hastalar arasından randomize fazdaki 140 hastadan 8'i ile başlangıç fazındaki 6 hastadan 2'sinin 12 aylık takip sırasındaki ATA testleri pozitif olarak sonuçlanmıştır. Bu hastalardan hiçbiri, ATA ile ilişkili olduğu düşünülen anafilaktik veya aşırı duyarlılık reaksiyonlarıyla karşılaşmadığı gibi, klinik yanıt da etkilenmemiştir.
GAO4753g/GADOLIN çalışmasında tedavi gören iNHL hastalarında başlangıç referansı sonrasında HAHA (İnsan Anti-İnsan Antikoru) gözlenmemiştir. HAHA'nın klinik anlamlılığı bilinmiyor olmasına rağmen HAHA ve klinik süreç arasındaki potansiyel bağlantı gözardı edilmemelidir.
Pediyatrik popülasyon
Pediyatrik kullanım ile ilgili bilgiler için bkz. Bölüm 4.2.
5.2. Farmakokinetik özellikler
Genel Özellikler
Faz I, Faz II ve Faz III çalışmalarda obinutuzumabı tek başına ya da kemoterapiyle kombinasyon halinde alan 469 iNHL, 342 KLL ve 130 DBBHL (Diffüz Büyük B Hücreli Lenfoma) hastasında farmakokinetik verileri analiz etmek için bir popülasyon farmakokinetik (PK) modeli geliştirilmiştir.
Emilim:
Obinutuzumab intravenöz uygulanır, bu nedenle emilim geçerli değildir. Diğer uygulama şekilleriyle çalışma yapılmamıştır. Popülasyon PK modeline göre; Döngü6, 1. gün infüzyonunun ardından KLL hastalarında tahmini medyan C değeri 465,7 mcg/mL ve EAA(Ï) değeri 8961 mcg.gün/mL, iNHL hastalarında tahmini medyan Cdeğeri 539,3 mcg/mL ve EAA(Ï) değeri 10956 mcg.gün/mL olmuştur.
Dağılım:
İntravenöz uygulama ardından santral kompartımanın dağılım hacmi (KLL hastalarında 2,98 L, iNHL hastalarında 2,97 L) serum hacmine yaklaşır ve bu da, dağılımın büyük oranda plazma ve interstisiyel sıvı ile sınırlı olduğunu göstermektedir.
Biyotransformasyon:
Obinutuzumabın metabolizması doğrudan incelenmemiştir. Antikorlar büyük oranda katabolizmayla temizlenmektedir.
Eliminasyon:
Obinutuzumab klerensi, KLL hastalarında yaklaşık 0,11 L/gün ve iNHL hastalarında yaklaşık 0,08 L/gün olup, medyan eliminasyon tdeğeri KLL hastalarında 26,4 gün ve iNHL hastalarında 36,8 gün olmuştur. Obinutuzumab eliminasyonu, biri doğrusal klerens yolağı ve biri zamanın fonksiyonu olarak değişen doğrusal olmayan klerens yolağı şeklinde klerensi tanımlayan iki paralel yolak içerir. Tedavi başlangıcında doğrusal olmayan zamanla değişen klerens yolağı baskındır ve bu nedenle majör klerens yolağını oluşturur. Tedavi devam ettikçe, bu yolağın etkisi azalır ve doğrusal klerens yolağı belirginleşir. Bu durum hedef aracılı ilaç dağılımını (TMDD) gösterir; CD20 hücrelerinin başlangıçta bol miktarda bulunması obinutuzumabın dolaşımdan hızla çıkarılmasına neden olur. Bununla birlikte, CD20 hücrelerin büyük bölümü obinutuzumaba bağlandığında hedef aracılı ilaç dağılımının farmakokinetik üzerindeki etkisi en aza indirgenir.
Farmakokinetik/farmakodinamik ilişki(ler)
Popülasyon farmakokinetik analizinde, cinsiyetin hastalar arasındaki değişkenliğin bir kısmını açıklayan bir kovaryat olduğu belirlenmiş, erkeklerde kararlı durum klerensi (CLss) %22 daha yüksek ve dağılım hacmi (Vd) %19 daha fazla bulunmuştur. Bununla birlikte, popülasyon analizinin bulguları maruziyetteki farklılıkların anlamlı olmadığını ortaya koymuş (6. Döngüde KLL hastalarında tahmini medyan EAA ve C sırasıyla, kadınlarda 11282 mcg.gün/mL ve 578,9 mcg/mL ve erkeklerde 8451 mcg.gün/mL ve 432,5 mcg/mL'dir; iNHL hastalarında ise tahmini medyan EAA ve C sırasıyla, kadınlarda 13172 mcg.gün/mL ve 635,7 mcg/mL ve erkeklerde 9769 mcg.gün/mL ve 481,3 mcg/mL'dir), ve bu durum cinsiyet temelinde doz ayarlamasının gerekli olmadığını göstermiştir.
Hastalardaki karakteristik özellikler
Geriyatrik popülasyon
Obinutuzumabın popülasyon farmakokinetik analizi, yaşın obinutuzumab farmakokinetiğini etkilemediğini göstermiştir. <65 yaşındaki (n=375), 65-75 yaşlarındaki (n=265) ve >75 yaşındaki (n=171) hastalar arasında obinutuzumabın farmakokinetik özelliklerinde anlamlı farklılık gözlenmemiştir.
Pediyatrik popülasyon
Pediyatrik hastalarda obinutuzumabın farmakokinetiğini inceleyen çalışmalar yapılmamıştır. Böbrek yetmezliği
Obinutuzumabın popülasyon farmakokinetik analizi, kreatinin klerensinin obinutuzumab farmakokinetiğini etkilemediğini göstermiştir.
Hafif (kreatinin klerensi KrKl 50-89 mL/dakika, n=464) veya orta düzeyde (KrKl 30-49 mL/dakika, n=106) böbrek bozukluğu olan hastalarda obinutuzumabın farmakokinetik özellikleri, böbrek fonksiyonu normal (KrKl ≥90 mL/dakika, n=383) hastalardakine benzer bulunmuştur. Şiddetli böbrek bozukluğu olan (KrKl 15-29 mL/dakika) hastalarda farmakokinetik veriler sınırlıdır (n=8), bu nedenle doz önerisi yapılamamaktadır.
Karaciğer yetmezliği
Karaciğer bozukluğu olan hastalarda formal farmakokinetik çalışma yapılmamıştır.
5.3. Klinik öncesi güvenlilik verileri
Obinutuzumabın karsinojenik potansiyelini belirlemek üzere çalışma yapılmamıştır.
Obinutuzumabın fertilite üzerindeki etkisini değerlendirmek için hayvanlarda spesifik çalışmalar yapılmamıştır. Sinomolgus maymunlarda yapılan tekrarlı doz toksisitesi çalışmalarında obinutuzumab erkek ve dişi üreme organları üzerinde advers etki göstermemiştir.
Gebe sinomolgus maymunlarda geliştirilmiş pre ve postnatal gelişim (ePPND) toksisitesi çalışmasında teratojenik etkilere dair kanıt bulunmamıştır. Bununla birlikte, çiftleşme sonrası
20. günden doğuma kadar 25 ve 50 mg/kg dozlarda (C ve EAA temelinde klinik maruziyetin 2-5 katı) uygulanan haftalık intravenöz obinutuzumab dozları, bebek maymunlarda tam B hücre deplesyonuna yol açmıştır. Doğumdan sonra 28. günde yavruların ilaca maruziyeti, obinutuzumabın kan plasenta bariyerini geçebildiğini göstermektedir. Doğum sonrası 28. günde yavru serumundaki konsantrasyonlar, maternal serumdaki konsantrasyon aralığında olurken, aynı günde sütteki konsantrasyonlar daha düşük bulunmuştur (karşılık gelen maternal serum düzeylerinin %0,5'inden daha düşük); bu durum yavrularda ilaca maruziyetin rahim içinde oluştuğunu göstermektedir. Doğumdan sonra 6 ay içinde B hücre sayıları normal düzeylere dönmüş ve immünolojik fonksiyon geri kazanılmıştır.
Sinomolgus maymunlarda yapılan, haftalık 5, 25 ve 50 mg/kg dozlarda obinutuzumabın (kararlı durumda Cve EAA'ya dayalı olarak klinik maruziyetin 0,7-6 katı) uygulandığı 26 haftalık bir çalışmada, aşırı duyarlılık reaksiyonları kaydedilmiştir ve bu reaksiyonlar sinomolgus maymunlarda hümanize antikorun yabancı kabul edilmesine bağlanmıştır. Bulgular, akut anafilaktik ve anafilaktoid reaksiyonları ve arterit/periarterit, glomerülonefrit ve serozal/adventisiyal inflamasyon gibi immün kompleks aracılı aşırı duyarlılık reaksiyonları ile tutarlı şekilde sistemik inflamasyonun ve infiltratların prevalansında bir artışı içermektedir. Bu reaksiyonlar, doz uygulama ve iyileşme fazları sırasında obinutuzumab ile tedavi edilen 36 hayvanın 6'sında tedavinin planlı olmaksızın sonlandırılmasına yol açmıştır; bu değişimler kısmen geri döndürülebilir olmuştur. İnsanlarda obinutuzumab ile nedensel ilişkili renal toksisite gözlenmemiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
L-histidin
L-histidin hidroklorür monohidrat Trehaloz dihidrat
Poloksamer 188 Enjeksiyonluk Su
6.2. Geçimsizlikler
Bu tıbbi ürün, bölüm 6.6'da belirtilenlerin dışında hiçbir tıbbi ürünle karıştırılmamalıdır.
6.3. Raf ömrü
Açılmamış flakon
36 ay Seyreltildikten sonra
Seyreltildikten sonra, % 0,9'luk (9 mg/mL) sodyum klorür enjeksiyonluk çözeltisinde 0,4 mg/mL ile 20 mg/mL arasındaki konsantrasyonda 2°C - 8°C arasındaki sıcaklıkta 24 saat boyunca ve bunu takiben 30°C'nin altındaki sıcaklıkta (infüzyon süresi de dahil olmak üzere) 48 saat boyunca kimyasal ve fiziksel stabilite kanıtlanmıştır.
Mikrobiyolojik açıdan bakıldığında, hazırlanan infüzyon çözeltisi derhal kullanılmalıdır. Derhal kullanılmadığı takdirde kullanım sırasındaki saklama süreleri ve kullanım öncesindeki koşullar kullanıcının sorumluluğundadır ve normalde, seyreltme işlemi kontrollü ve valide edilmiş aseptik şartlarda yapılmadıkça, saklama süresi 2°C-8°C'de 24 saati geçmemelidir.
GAZYVA antimikrobiyal koruyucular içermemektedir. Bu nedenle, infüzyonluk çözeltinin hazırlanması sırasında mikrobiyolojik açıdan tehlikeye girmemesi için dikkatli olunmalıdır.
6.4. Saklamaya yönelik özel tedbirler
Flakonlar 2°C-8°C'de buzdolabında saklanmalıdır. Dondurulmamalıdır. Flakon, ışıktan korunmak için kutusunda saklanmalıdır.
Tıbbi ürünün seyreltildikten sonraki saklama koşulları için bkz. Bölüm 6.3.
6.5. Ambalajın niteliği ve içeriği
Tıpalı (bütil kauçuk) 50 mL (berrak Tip I cam) flakon içerisinde 40 mL konsantre. Ambalaj boyutu 1 flakondur.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Seyreltme için talimatlar
GAZYVA, bir sağlık mesleği mensubu tarafından aseptik teknik kullanılarak hazırlanmalıdır. Flakonun çalkalanmaması gerekir. GAZYVA'yı hazırlamak için steril bir iğne ve şırınga kullanılmalıdır.
KLL Döngü 2 â 6 için:
Flakondan 40 mL konsantreyi çekin ve 9 mg/mL (%0,9) sodyum klorür enjeksiyon çözeltisi içeren polivinil klorür (PVC) veya PVC olmayan poliolefin infüzyon torbalarında seyreltin.
Sadece KLL â Döngü 1
İki infüzyon torbası arasında 1.000 mg başlangıç dozu için ayrım yapabilmek açısından, Döngü1, 1. güne ait 100 mg doz ve Döngü1, 1. güne ya da 2. güne ait 900 mg dozun (devam dozu) ayırt edilmesi için farklı boyda torbaların kullanılması önerilmektedir. 2 infüzyon torbası hazırlamak için flakondan 40 mL konsantreyi çekiniz ve 4 mL'yi 9 mg/mL (%0,9) sodyum klorür enjeksiyon çözeltisi içeren 100 mL'lik PVC veya PVC olmayan poliolefin infüzyon torbasında, kalan 36 mL'yi ise 9 mg/mL (%0,9) sodyum klorür enjeksiyon çözeltisi içeren 250 mL'lik PVC veya PVC olmayan poliolefin torba içerisinde seyreltiniz. Her infüzyon torbasını açıkça etiketleyiniz.
İnfüzyon torbalarının saklama koşulları için bkz. Bölüm 6.3.
Uygulanacak GAZYVA Dozu | Gerekli GAZYVA Konsantresi Miktarı | PVC veya PVC olmayan poliolefin infüzyon torbasının boyutu |
100 mg | 4 mL | 100 mL |
900 mg | 36 mL | 250 mL |
1000 mg | 40 mL | 250 mL |
Glikoz (%5) çözeltisi gibi diğer seyrelticiler kullanılmamalıdır (bkz. Bölüm 6.2).
Torba, çözeltiyi karıştırmak üzere, aşırı köpürmeyi önlemek için hafif şekilde altüst edilmelidir. Seyreltilmiş ürün çalkalanmamalı veya dondurulmamalıdır.
Parenteral tıbbi ürünler, uygulanmadan önce partiküller ve renk değişikliği açısından görsel olarak incelenmelidir.
GAZYVA'nın sodyum klorür 9 mg/mL (0,9%) enjeksiyonluk çözeltiyle seyreltilmesini takiben 0,4 ile 20,0 mg/mL konsantrasyon aralıklarında GAZYVA ile;
PVC, polietilen (PE), polipropilen veya poliolefin torbalar
 Tiroid Kanseri
En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur.
Tiroid Kanseri
En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur. |
 Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış.
Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
 |
Sırt Ağrısı Sırt ağrısı birden bire ortaya çıkıp şiddetli (akut) olabilir veya zamanla gelişip daha uzun süreli sorunlara (kronik) neden olabilir. |
 |
Artrit Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında artrit tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
 |
HIV ve Aids HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan Virüsdür). Bu virüs AIDS hastalığına sebep olur. |
İLAÇ GENEL BİLGİLERİ
Roche Müstahzarları Sanayi A.Ş.
| Geri Ödeme Kodu | A17126 |
| Satış Fiyatı | 47202.89 TL [ 26 Apr 2024 ] |
| Önceki Satış Fiyatı | 47202.89 TL [ 22 Apr 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699505762630 |
| Etkin Madde | Obinutuzumab |
| ATC Kodu | L01XC15 |
| Birim Miktar | 1000 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 1 |
| Antineoplastik ve İmmünomodülatör Ajanlar > Diğer Kanser İlaçları |
| İthal ( ref. ülke : Isvicre ) ve Beşeri bir ilaçdır. |