FASTAIR 100 mcg/6 mcg inhilasyon tozu sert kapsül (120 kapsül) Kısa Ürün Bilgisi
{ Beklometazon Dipropiyonat + Formoterol Fumarat }
Kapsüllerin küçük parçaçıklara ayrılmasını nasıl önlerim?
Cihazın yanındaki kırmızı kulakçıklıklara (düğmelere) bastığınızda (5.basamak), kapsüller kırılabilir ve nefes alırken ağzınıza ya da boğazınıza küçük parçalar kaçabilir. Bunu aşağıdakileri uygulayarak önleyebilirsiniz:
Kulakcıklara (düğmelere) yalnızca bir kere basarak.
Kapsülleri kullanmadan önce orjinal ambalajında tutarak.
Kapsülleri 25C altındaki oda sıcaklığında saklayarak.
Kapsülleri nemden koruyarak.
Kapsül parçacıkları zararlı mıdır?
Kapsül bölmesinde sıkışan kapsülü nasıl çıkartacağım?
İnhalasyon cihazını açın, baş aşağı çevirin ve yavaşça dibine vurun.
4.1. Terapötik endikasyonlar
Uzun etkili beta2-agonisti+inhale kortikosteroid kombinasyonları ile tedavilerde olduğu üzere FASTAİR, astım semptomlarının düzeltilmesi ve kontrol altına alınması amacıyla kullanılır. Astım hastalığının basamaklı tedavisinde 3. basamaktan itibaren verilir. Orta ve ağır KOAH olgularında semptomları ve atak sıklığını azaltır.
4.2. Pozoloji ve uygulama şekli
Pozoloji:FASTAİR inhalasyon yoluyla kullanım içindir.
FASTAİR astımın başlangıç tedavisi yönetimine yönelik değildir. FASTAİR'ın içerdiği bileşenlerin dozları farklı olduğu için ilaç, hastalığın şiddetine göre ayarlanmalıdır. Bu yalnızca fiks doz kombinasyon ilaçları ile tedaviye başlandığı zaman değil aynı zamanda, doz ayarlamasının yapıldığı durumda da dikkate alınmalıdır. Eğer bir hastada kombinasyon inhalerde mevcut olan kombinasyon dozlarından daha farklı bir doz kombinasyonu gerekirse, farklı inhalerlerdeki uygun beta2-agonist ve/veya kortikosteroid dozları reçete edilmelidir.
FASTAİR içerisindeki beklometazon dipropiyonat mikronize edilmiş partikül boyutu dağılımı ile tanımlanmaktadır ve bu mikronize edilmiş partikül boyutu dağılımına sahip olmayan beklometazon dipropiyonata göre daha güçlü etki göstermektedir. Bu nedenle, FASTAİR için günlük uygulanan beklometazon dipropiyonat miktarı, mikronize edilmemiş beklometazon dipropiyonatın günlük toplam miktarından düşük olmalıdır.
Uygulama sıklığı ve süresi:
Astım tedavisinde FASTAİR;
18 yaştan itibaren yetişkinler ve yaşlılarda;
Astım belirtilerini düzeltmek ve kontrol altına almak amacı ile âolağan dozâ uygulaması;
Astım semptomlarının şiddetine göre olağan doz günde iki kez bir kapsüldür (sabah 1, akşam 1 inhalasyon) . Maksimum günlük doz 4 kapsüldür.
4.3. Kontrendikasyonlar
Beklometazon dipropiyonat, formoterol fumarat dihidrat ve/veya ürün içeriğindeki herhangi maddelerden birine karşı bilinen aşırı duyarlılık halinde FASTAİR kontrendikedir.
4.4. Özel kullanım uyarıları ve önlemleri
FASTAİR üçüncü derece atriyoventriküler bloğu ve taşikardilerde (hızlanmış ve/veya düzensiz kalp atımı), idiyopatik subvalvüler aort stenozu, hipertrofik obstrüktif kardiyomiyopati, ağır kalp hastalığı, özellikle miyokard infarktüsü, koroner kalp hastalığı, konjestif kalp yetmezliği, tıkayıcı damar hastalıkları, özellikle arteriyoskleroz, arteriyel hipertansiyon ve anevrizmayı içeren kardiyak aritmilerde, hipertiroidizm, özellikle tirotoksikoz, hastalarında dikkatle kullanılmalıdır. Bilinen veya şüpheli konjenital veya ilaca bağlı QTc aralığı (QTc > 0.44 saniye) uzamış hastaların tedavisi esnasında dikkatli olunmalıdır. FASTAİR taşikardik aritmisi bulunan hastalarda (hızlanmış ve/veya düzensiz kalp atımı) yalnızca özel önlemler alınarak (örn. hasta monitorizasyonu) kullanılabilir. Formoterol'ün kendisi de QTc aralığını uzatabilir.
FASTAİR diabet, tirotoksikoz, feokromositoma ve tedavi edilmemiş hipokalemi hastalarında dikkatle kullanılmalıdır.
Ciddi hipokalemi, potansiyel olarak beta2-agonisti tedavisinden ileri gelebilir. Hipokalemi şiddeti hipoksi ile artabileceğinden ağır astımda bu duruma özel olarak dikkat edilmesi tavsiye edilir. Hipokaleminin şiddeti; hipokalemiyi indükleyen ksantin türevleri, steroidler ve diüretikler gibidiğer ilaçlarla yapılan eşzamanlı tedavi ile de artabilir (Bkz. Bölüm 4.5). Birden fazla sayıdaâkurtarıcıâ bronkodilatörün tüketilebildiği stabil olmayan astımda da dikkatli olunması tavsiyeedilir. Bu gibi durumlarda hastanın serum potasyum düzeyleri düzenli olarak izlenmelidir.
Yüksek dozda formoterol inhalasyonu kan şekeri düzeyinde artışa neden olabilir. Bu nedenle diyabetiklerde bu parametre yakından izlenmelidir.
Halojenli anestezikler ile anestezi planlandığında, kardiyak aritmi riski nedeniyle anestezi başlamadan en az 12 saat öncesinde FASTAİR kullanılmadığından emin olmak gereklidir.
Kortikosteroid içeren tüm inhale ilaçlar gibi FASTAİR'da aktif veya latent pulmoner tüberkülozu olan ve solunum yollarında fungal ve viral enfeksiyonları olan hastalarda dikkatli olarak uygulanmalıdır.
Tedavi sonlandırılacaksa, tedavi dozunun tedrici olarak azaltılarak sonlandırılması tavsiye edilir.
Tedavi ani olarak sonlandırılmamalıdır.
Astım tedavisi, basamaklı bir tedavi programını takip etmelidir ve belli aralıklarla hastanın tedaviye verdiği yanıt, akciğer fonksiyon testleri ile klinik açıdan değerlendirilmelidir.
Hasta tedaviyi etkisiz buluyorsa tıbbi olarak dikkat gösterilmelidir. Kısa etkili rahatlatıcı etkili bronkodilatörlerin kullanımındaki artış, hastalığın kötüleştiğini gösterir ve astım tedavisinin yeniden değerlendirilmesini gerektirir. Astım kontrolündeki ani ve artan seyirdeki kötüleşme potansiyel olarak yaşamı tehdit edicidir ve tedavi modifikasyonu için hasta acil tıbbi değerlendirmeden geçmelidir. Oral ya da inhale kortikosteroid tedavisine ihtiyacın artması durumunda dikkat gösterilmelidir veya enfeksiyon şüphesi var ise antibiyotik tedavisi başlanmalıdır.
Alevlenme durumunda veya belirgin şekilde kötüleşmiş akut astım atakları var olan hastalarda FASTAİR ile tedaviye başlanmamalıdır. FASTAİR ile yapılan tedavi esnasında astımla ilişkili ciddi advers olaylar ve alevlenmeler ortaya çıkabilir. Hastalardan tedaviye devam etmeleri ancak FASTAİR başlandıktan sonra astım semptomları hala kontrol edilemiyor veya kötüleşiyorsa doktora başvurmaları istenmelidir.
Diğer inhalasyon tedavilerinde olduğu gibi, doz alımı sonrasında hırıltılı solunum, öksürük ve nefes darlığında ani bir artışla beraber paradoksal bronkospazm gelişebilir. Bu durumda, hızlı etkili bir inhale bronkodilatör uygulanmalıdır. FASTAİR alımı hemen kesilmeli, hasta değerlendirilmeli ve gerekirse alternatif bir tedaviye başlanmalıdır.
FASTAİR, astımın başlangıç tedavisi için uygun değildir.
Akut astım ataklarının tedavisi için hastaların FASTAİR'ı ve/veya hızlı etkili bronkodilatörlerini sürekli yanlarında bulundurmaları önerilir.
Hastalara, asemptomatik oldukları durumda dahi reçete edildiği şekilde düzenli olarak FASTAİR kullanmaları gerektiği hatırlatılmalıdır. Astım semptomlarına karşılık FASTAİR'ın semptom giderici dozları alınmalıdır; fakat bu dozlar, örneğin egzersizden önce, düzenli profilaktik kullanım amaçlı değildir. Bu tür bir amaç için, başka bir hızlı etkili bronkodilatör düşünülmelidir. Astım semptomları kontrol altına alındığında, FASTAİR dozu kademeli olarak azaltılmalıdır. Tedavide alt basamaklara doğru inildikçe hastaların düzenli olarak control edilmeleri önem kazanır. Bu dönemde FASTAİR'ın en düşük etkin dozu kullanılmalıdır (bkz. Bölüm 4.2).
İnhale kortikosteroidler, özellikle uzun süreli ve yüksek dozlarda reçete edildiklerinde sistemik etkiler oluşturabilirler. Bu etkilerin görülme olasılığı oral kortikosteroidlere nazaran inhale kortikosteroidler ile çok daha düşüktür. Olası sistemik etkiler şunlardır: Cushing sendromu, adrenal supresyon, kemik mineral yoğunluğunda azalma, çocuk ve ergenlerde büyüme geriliği, katarakt ve glokom ve daha seyrek olarak fizikomotor hiperaktivitesi, uyku bozukluğu, anksiyete, depresyon veya saldırganlık (özellikle çocuklarda) da içeren çeşitli psikolojik ve davranışsal etkiler. Bu nedenle, tedavi altındaki hastanın düzenli olarak kontrolü ve inhale kortikosteroid dozunun, astımın etkin olarak kontrolünün sağlandığı en düşük doza düşürülmesi önemlidir.
İnhale kortikosteroidler ile yüksek dozlarda uzun süreli tedavi, adrenal supresyon ve akut adrenal krize neden olabilir. Önerilenden yüksek doz beklometazon dipropiyonat inhale eden
18 yaşından küçük çocuklar risk altında olabilirler. Akut adrenal krizi tetikleyebilecek potansiyel durumlar travma,ameliyat,ciddienfeksiyonvedozun hızla azaltılmasıdır. Oluşan
eya
![]()
baş ağrısı, bulantı, kusma, hipotansiyon, bilinç düzeyinde azalma, hipoglisemi ve/v
konvülsiyonları içerebilir. Stres ve elektif cerrahi sırasında ilave sistemik kortikosteroid verilmesi düşünülmelidir.
Özellikle daha önceki sistemik steroid tedavisi nedeni ile adrenal fonksiyonun bozulmuş olduğu düşünülüyorsa, bu grup hastalar FASTAİR tedavisine geçirilirken dikkatli olunmalıdır.
Oral kortikosteroidlerden inhale steroidlere geçen hastalar oldukça uzun bir zaman adrenal rezerv eksikliği riski altında kalırlar. Geçmişte, yüksek doz acil kortikosteroid tedavisi gerekli olmuş hastalar da risk altında olabilirler. Bu bozukluk olasılığı strese neden olabilecek acil ve elektif durumlarda daima akılda bulundurulmalıdır ve uygun kortikosteroid tedavisi uygulanmalıdır. Adrenal bozukluğunun derecesi elektif işlemlerden önce uzman tavsiyesini gerektirebilir.
Uzun etkili beta agonist preparatlarına bağlı olarak nadiren, ciddi ve bazen ölümcül olabilen astım ile ilgili solunum problemleri meydana gelebilir.
Sistemik ve topikal kortikosteroid kullanımına bağlı görme bozuklukları bildirilebilir. Eğer hastada bulanık görme veya diğer görme bozuklukları meydana gelirse hasta; katarakt, glokom veya sistemik ve topikal kortikosteroid kullanımdan sonra bildirilen santral seröz korioretinopati(SSKR) gibi nadir hastalıkları da içerebilen olası nedenleri değerlendirmek üzere bir göz doktoruna yönlendirilmelidir.
Orofarengeal kandida enfeksiyonu riskini en aza indirmek için reçete edilen dozu kullandıktan sonra hastaların ağızlarını su ile çalkalamaları önerilmelidir.
FASTAİR astım hastalığının başlangıç tedavisi için önerilemez.
Uzun etkili beta agonistler astım semptom kontrolünü sağlayan en kısa süre boyunca kullanılmalı ve astım kontrolüne ulaştığında eğer mümkünse kullanımları durdurulmalıdır. Sonrasında hastaların kontrol edici bir tedaviyle idamesi sağlanmalıdır.
Hastalar alevlenme dönemlerinde ise ya da önemli ölçüde veya akut olarak kötüye giden astım
şikayetleri varsa, uzun etkili beta agonistlerle tedaviye başlanmamalıdır.
KOAH hastalarında pnömoni
Kortikosteroid içeren inhale ilaçları alan KOAH hastalarında, hastaneye yatış gerektiren pnömoni dahil, pnömoni insidansında artış gözlemlenmiştir. Artan steroid dozu ile pnömoni riskinde artış kanıtları bulunmaktadır, ancak bu durum çalışmaların tamamında kesin olarak gösterilmemiştir.
Kortikosteroid içeren inhale ilaçlar arasında pnömoni riskinin büyüklüğü konusunda sınıf içi farklılık bakımından kesin klinik kanıt bulunmamaktadır.
Hekimler, KOAH hastalarında olası pnömoni gelişimine karşı, enfeksiyonların klinik özellikleri ile KOAH semptomlarının alevlenme durumunun karışması ihtimali dolayısıyla dikkatli olmalıdır.
KOAH hastalarındaki pnömoni risk faktörleri arasında; sigara içilmesi, ileri yaş, düşük vücut kitle indeksi ve ağır KOAH bulunmaktadır.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Farmakokinetik etkileşimler
Beklometazon dipropiyonat, sitokrom P-450 sisteminin katkısı olmaksızın esteraz enzimleri aracılığı ile hızla metabolize olarak aktif metaboliti olan beklometazon monopropiyonata dönüşür. Beklometazon diğer bazı kortikosteroidlere göre CYP3Ametabolizmasına daha az bağımlıdır vegenel olarak etkileşimler olası değildir; ancak güçlü CYP3A inhibitörlerinin (örneğin ritonavir,kobisistat) birlikte kullanımı ile sistemik etkilerin olma ihtimali göz ardı edilemez ve bu nedenlebu tür ajanlar kullanılması durumunda dikkatli olunması ve hastanın uygun bir şekilde gözlemlenmesi önerilir.
Farmakodinamik etkileşimler
Astımlı hastalarda beta-bloker (göz damlaları da dahil) tedavisinden kaçınılmalıdır. Beta- blokerler zorunlu nedenler ile uygulanacak olursa, formoterolün etkisi azalır ya da ortadan kalkar. Diğer yandan beta-adrenerjik ilaçların eş zamanlı kullanımının olası ilave etkileri olabilir, bu nedenle formoterol ile eş zamanlı olarak teofilin ya da diğer beta-adrenerjik ilaçların reçetelenmesi dikkat gerektirir.
Kinidin, disopramid, prokainamid, fenotiyazinler, antihistaminikler, mono amino oksidaz inhibitörleri ve trisiklik antidepresanlar QTc-aralığını uzatarak ventriküler aritmi riskini artırabilirler.
Ayrıca, L-Dopa, L-tiroksin, oksitosin ve alkol, beta sempatomimetiklere karşı kardiyak tolerans azalabilir.
Furazolidon ve prokarbazin gibi benzer özellikler gösteren mono amino oksidaz inhibitörleri ile eş zamanlı tedavi hipertansif reaksiyonları başlatabilir.
Halojenli hidrokarbonlar ile eş zamanlı anestezi alan hastalarda aritmi riski artabilir.
Ksantin türevleri, steroidler veya diüretikler ile eş zamanlı tedavi beta agonistlerinin olası hipokalemik etkilerini güçlendirebilir (bakınız bölüm 4.4). Dijital glikozidleri ile tedavi edilen hastalarda hipokalemi, aritmiye olan yatkınlığı arttırabilir
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek/Karaciğer yetmezliği halinde FASTAİR kullanımına ilişkin veri bulunmamaktadır.
Pediyatrik popülasyon:
18 yaşın altındaki astım ve KOAH hastalarında FASTAİR ile yapılmış etkileşim çalışması bulanmamaktadır.
4.6. Gebelik ve laktasyon
Gebelik kategorisi C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon): FASTAİR'ın çocuk doğurma potansiyeli olan kadınlarda ve doğum kontrolünde kullanımına ilişkin yeterli veri bulunmamaktadır.
Gebelik dönemi
FASTAİR'ın gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir.
edir
Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermekt
(bakınız bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.
Kortikosteroidlerin gebe hayvanlara yüksek dozda uygulanmasının yarık damak ve rahim içi büyüme geriliği gibi fetal gelişme anomalilerine neden olduğu bilinmektedir. Beta-2- sempatomimetik ajanların tokolitik etkileri de doğumu etkileyebilir.
Beta-sempatomimetik ajanların tokolitik etkisinden dolayı doğumun yaklaşmasında gerekli önlemler alınmalıdır. Başka bir yerleşik alternatif (daha güvenli) tedavi bulunmadıkça formoterol gebelik süresince ve özellikle gebeliğin sonlarında ya da doğum esnasında kullanılmamalıdır. FASTAİR gebelik sırasında ancak beklenen yararlar potansiyel risklerden fazla olduğunda kullanılmalıdır.
Laktasyon dönemi
İnsanlarda laktasyon döneminde FASTAİR kullanımına ilişkin yeterli klinik veri mevcut değildir. Hayvan deneylerinde veri elde edilememiş olmasına karşın, beklometazon dipropiyonatın anne sütüne geçtiği varsayılabilir. Ancak, doğrudan inhalasyon için kullanılan dozlarda anne sütünde anlamlı düzeylere ulaşılması çok olası değildir. Formoterol'ün anne sütüne geçip geçmediğinin bilinmemesine karşın, hayvanların sütünde saptanmıştır. FASTAİR'ın emziren kadınlara uygulanması yalnızca beklenen faydalar potansiyel risklerden fazla ise düşünülmelidir. Çocuk için emzirmenin ve anne için tedavinin faydası dikkate alınarak, emzirmenin veya FASTAİR ile tedavinin kesilip kesilmemesi konusunda bir karar verilmelidir.
Üreme yeteneği / Fertilite
İnsanlarda hiçbir veri bulunmamaktadır. Sıçanlardaki üreme çalışmaları (0.2, 2.0 ve 20 mg/kg/gün) ile doza bağımlı etkiler gözlemlenmiştir. Erkek doğurganlığında hiç etki görülmezken dişi hayvanlarda fetal gelişme üzerine advers etkilerin görülmediği seviye (NOAEL) 2 mg/kg/gündür. Daha yüksek dozlarda (20 mg/kg/gün), FASTAİR doğumda güçlüğe neden olmuş ve maternal (implantasyon oranında azalma, plasenta ağırlığında azalma) ve fetal toksisite (kemikleşme bozuklukları, kiloda azalma) bulgularına neden olmuştur.
4.7. Araç ve makine kullanımı üzerindeki etkiler
FASTAİR'ın araç ve makine kullanma yeteneği üzerinde etkisi yoktur veya ihmal edilebilir düzeydedir.
4.8. İstenmeyen etkiler
FASTAİR, beklometazon dipropiyonat ve formoterol fumarat dihidrat içerdiği için, her bir bileşik ile ilişkili türden ve şiddette advers reaksiyonların olması beklenir. Her iki bileşiğin birlikte uygulanmasını takiben ek advers etki artışı gözlemlenmemiştir Sabit kombinasyon olarak uygulanan beklometazon dipropiyonat ve formoterol fumarat ile ilişkili istenmeyen etkiler aşağıda verilmiştir ve sistematik olarak organ sınıfına göre ve sıklığa göre gösterilmiştir.
Klinik çalışmalardan elde edilen istenmeyen etki görülme oranları şu şekilde tanımlanmıştır: Çok yaygın (≥1/10); yaygın (≥1/100 ve <1/10); yaygın olmayan (≥1/1,000 ila <1/100); seyrek (≥1/10,000 ila <1/1,000); çok seyrek (≤1/10,000); bilinmiyor (mevcut verilerden tahmin edilemiyor).
Plasebo insidansları dikkate alınmamıştır.
Enfeksiyonlar ve enfestasyonlar
Yaygın : Farenjit, oral kandidiyazis, KOAH hastalarında pnömoni,
![]()
Yaygın olmayan :Grip, oral mantar enfeksiyonu, farengeal ve özofagal kandidiyazis,
vulvovajinal kandidiyazis, gastroenterit, sinüzit, rinit
Kan ve lenf sistemi hastalıkları
Yaygın olmayan : Granülositopeni
Çok seyrek : Trombositopeni
Bağışıklık sistemi hastalıkları
Yaygın olmayan : Alerjik dermatit
Çok seyrek :Eritem, dudaklar, yüz, göz ve farenks ödemini içeren hipersensitivite reaksiyonları
Endokrin bozukluklar
Çok seyrek : Adrenal supresyon
Metabolizma ve beslenme hastalıkları
Yaygın olmayan : Hipokalemi, hiperglisemi, hipertrigliseridemi
Psikiyatrik hastalıklar
Yaygın olmayan : Yerinde duramama
Bilinmiyor :Psikomotor hiperaktivite, uyku bozuklukları, anksiyete, depresyon, saldırganlık, davranış değişiklikleri (genellikle çocuklarda)
Sinir sistemi hastalıkları
Yaygın : Baş ağrısı
Yaygın olmayan : Tremor, baş dönmesi
Göz hastalıkları
Çok seyrek : Glokom, katarakt
Bilinmiyor : Görmede bulanıklık
Kulak ve iç kulak hastalıkları
Yaygın olmayan : Otosalpenjit
Kardiyak hastalıklar
Yaygın olmayan : Çarpıntılar; EKG'de QTc aralığı uzaması; EKG değişiklikleri, taşikardi, taşiaritmi, atriyal fibrilasyon, sinüs bradikardisi, miyokardiyal iskemi
Seyrek : Ventriküler ekstrasistoller, anjina pektoris
Vasküler hastalıklar
Yaygın olmayan : Hiperemi; sıcak basması
Solunum, göğüs bozuklukları ve mediastinal hastalıklar
Yaygın : Disfoni
Yaygın olmayan : Öksürük, prodüktif öksürük, boğazda tahriş, astım krizi Seyrek : Paradoksal bronkospazm
Çok seyrek : Dispne, astımın şiddetlenmesi
![]()
Gastrointestinal hastalıkları
Yaygın olmayan : İshal, ağız kuruluğu, dispepsi, disfaji, dudaklarda yanma hissi,
![]()
bulantı, tat alma bozukluğu
Deri ve deri altı doku hastalıkları
Yaygın olmayan : Kaşıntı, döküntü, hiperhidroz, ürtiker Seyrek : Anjiyoödem
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları
Yaygın olmayan : Kas krampı, miyalji
Çok seyrek : Çocuk ve adolesanlarda büyüme geriliği
Böbrek ve idrar yolu hastalıkları
Seyrek : Nefrit
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Yaygın olmayan : Yorgunluk, sinirlilik
Çok seyrek : Periferik ödem
Araştırmalar
Yaygın olmayan : Elektrokardiyogramda QT uzaması, kortizol içermeyen idrarda azalma, azalmış kan kortizolü, artmış kan potasyumu, artmış kan glukozu, zayıf r- dalga ilerlemeli elektrokardiyogram, C-reaktif proteinde artış, trombosit sayısında artma, serbest yağ asidinde artma, kan insülininde artış, kan keton cisimlerinde artış
Seyrek : Kan basıncında artma, kan basıncında azalma
Çok seyrek : Kemik yoğunluğunda azalma
Diğer inhalasyon tedavilerinde de görüldüğü gibi paradoksal bronkospazm oluşabilir. Formoterol ile tipik olarak ilişkili gözlemlenen advers olaylar şunlardır: hipokalemi, baş ağrısı, tremor, çarpıntılar, öksürük, kas krampları ve QTc aralığı uzaması, angina pektoris, miyokardiyal iskemi.
Beklometazon ile tipik olarak ilişkili gözlemlenen advers olaylar şunlardır: oral mantar enfeksiyonları, oral kandidiaz, disfoni, boğazda tahriş, nazofarenjit, sinirlilik, kortizol içermeyen idrarda azalma, azalmış kan kortizolü, artmış kan glukozu.
İnhale kortikosteroidlerin (örn., beklometazon dipropiyonat) sistemik etkileri özellikle uzun süreli olarak yüksek dozda uygulandığında ortaya çıkabilir. Bu etkiler şunlardır: Cushing Sendromu, Cushingoid belirtiler, adrenal baskılanma, kemik mineral yoğunluğunda azalma, çocuklarda ve ergenlerde büyüme geriliği, glokom ve katarakt (bakınız bölüm 4.4)
Aşırı duyarlılık reaksiyonları arasında döküntü, ürtiker şeklinde kaşıntı, eritem, göz, yüz, dudaklarda ve boğazda ödem vardır.
FASTAİR'ın terapötik dozlarıyla elde edilen klinik deneyimlerde gözlenmeyen ancak genellikle formoterol gibi uzun etkili beta2-agonistinin uygulanmasıyla ilişkilendirilen ilave advers reaksiyonlar; palpitasyon, atriyal fibrilasyon, ventriküler ekstrasistol, taşiaritmi, potansiyel olarak ciddi hipokalemi ve artmış/azalmış kan basıncıdır. İnhale formoterol tedavisi esnasında bazen uykusuzluk, baş dönmesi, huzursuzluk ve anksiyete bildirilmiştir. Formoterol kas kramplarını, miyaljiyi de artırabilir.
Döküntü, ürtiker, pruritus ve eritem; göz, yüz, dudak ve boğazda ödem (anjiyoödem) dahil aşırı duyarlılık reaksiyonları bildirilmiştir.
Diğer inhaler tedavilerde olduğu gibi doz alımı sonrasında hırıltılı solunum, öksürük ve nefes
darlığında ani bir artışla beraber paradoksal bronkospazm oluşabilir (ayrıca bkz. Bölüm 4.4).
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek/Karaciğer yetmezliği halinde FASTAİR kullanımına ilişkin veri bulunmamaktadır.
Pediyatrik popülasyon:
18 yaş altındaki astım ve KOAH hastalarında FASTAİR kullanılmamalıdır.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; eposta;tufam@titck.gov.tr;tel:0 800 314 00 08; faks:0 312 218 35 99)
4.9. Doz aşımı ve tedavisi
Peş peşe 12 kümülatif uygulamaya kadar inhale sabit kombinasyon (beklometazon dipropiyonat 100 mcg ve formoterol 6 mcg) dozları (toplam 1200 mikrogram beklometazon dipropiyonat ve 72 mikrogram formoterol) astımlı hastalarda incelenmiştir. Kümülatif tedavi, vital bulgularda anormal bir etki göstermemiştir ve ciddi veya şiddetli advers olaylar da gözlemlenmemiştir
Aşırı formoterol dozları beta-2-adrenerjik agonistler için tipik olan etkilere yol açabilir: bulantı, kusma, baş ağrısı, tremor, uyku hali, çarpıntılar, taşikardi, ventrikül aritmileri, QTc aralığının uzaması, metabolik asidoz, hipokalemi, hiperglisemi.
Formoterol ile doz aşımı durumunda, destekleyici ve semptomatik tedavi endikedir. Ciddi vakalar hastaneye yatırılmalıdır. Kardiyoselektif beta-adrenerjik blokörlerin kullanılması düşünülebilir ancak çok dikkatli olarak uygulanmalıdır, çünkü beta-adrenerjik blokör kullanımı bronkospazma yol açabilir. Hastanın serum potasyumu izlenmelidir.
Önerilenden fazla akut beklometazon dipropiyonat dozları inhalasyonu, adrenal fonksiyonun geçici olarak baskılanmasına neden olabilir. Bu acil önlem gerektirmez, çünkü, plazma kortizol ölçümleri ile doğrulandığı üzere, baskılanma birkaç gün içinde ortadan kalkar. Bu hastalarda tedavi, astımı kontrol etmeye yetecek dozlarda sürdürülmelidir.
Kronik alımlı fazla beklometazon dipropiyonat dozları inhalasyonu: Bölüm 4.4: adrenal baskılanma riskine bakınız. Adrenal rezervinin monitorizasyonu gerekli olabilir.
Eğer kırmızı kulakçıklar (düğmeler) sıkışırsa ne yapmalıyım?
Kulakçıkları (düğmeleri) yavaşça kanatçıkların yardımıyla ilk konumuna geri çekin.
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Obstrüktif solunum yolu hastalıklarında kullanılan ilaçlar, Kortikosteroidler ya da diğer ilaçlarla kombine adrenerjikler â Antikolinerjikler hariç ATC Kodu: R03AK08
Etki mekanizması ve farmakodinamik etkiler:
FASTAİR beklometazon dipropiyonat ve formoterol içermektedir; bunların farklı etki mekanizmaları vardır ve astım alevlenmelerini azaltmak bakımından sinerjistik etki gösterirler. Bu iki maddenin etki mekanizması aşağıda incelenmiştir.
Beklometazon dipropiyonat
İnhalasyon yolu ile önerilen dozlarda verilen beklometazon dipropiyonatın akciğerlerde
alevlenmelerinde azalma sağlamakla birlikte sistemik uygulanan kortikosteroidlere nazaran
daha az advers etkiye neden olur.
Formoterol
Formoterol selektif bir beta-adrenerjik agonisttir ve reversibl solunum yolu obstrüksiyonu olan hastalarda bronş düz kaslarının gevşemesini sağlar. Bronş genişletici etkisi hızla, inhalasyondan 1-3 dakika sonra etkisini gösterir ve tek bir dozun etki süresi 12 saattir.
FASTAİR'ın idame tedavide klinik etkinliği
Yetişkinlerde yapılan klinik çalışmalarda beklometazon dipropiyonata, formoterol eklenmesi astım belirtilerini ve akciğer fonksiyonunu iyileştirmiş ve alevlenmeleri azaltmıştır.
FASTAİR'ın akciğer fonksiyonu üzerindeki etkilerinin incelendiği 24 haftalık bir çalışmada, FASTAİR en az birbirinden ayrı olarak verilen beklometazon dipropiyonat ve formoterol ile eşdeğer etki göstermiş ve tedavi etkinliği tek başına beklometazon dipropiyonat'tan daha fazla olmuştur.
FASTAİR'ın idame ve rahatlatıcı tedavide klinik etkinliği
1701 astım hastasının dahil edildiği 48 haftalık paralel grup çalışmasında; astımı kontrol altında olmayan orta veya ağır astımlı yetişkin hastalarda sabit kombinasyon (beklometazon dipropiyonat 100 mcg ve formoterol 6 mcg) idame dozu (günde iki kez bir inhalasyon) ve rahatlatıcı (günde toplam 8 kapsül'e kadar) tedavi olarak uygulaması, idame uygulaması (günde iki kez bir inhalasyon) artı ihtiyaç duyulduğunda salbutamol kullanımı ile karşılaştırılmıştır. Sonuçlar şunu göstermektedir; idame ve rahatlatıcı tedavi olarak uygulanan sabit kombinasyon (beklometazon dipropiyonat 100 mcg ve formoterol 6 mcg), idame artı ihtiyaç duyulduğunda salbutamol kullanan gruba göre (ITT ve PP popülasyonlarını her ikisi için p<0.001) ilk ciddi alevlenme süresini belirgin şekilde uzatmıştır. İdame ve rahatlatıcı tedavi grubunda ciddi astım alevlenmelerinin oranı, salbutamol grubuna kıyasla (hasta/yıl başına) belirgin şekilde azalmıştır (sırasıyla 0,1476 ve 0,2239 istatistiksel olarak belirgin düşüş: p<0.001). Sabit kombinasyon (beklometazon dipropiyonat 100 mcg ve formoterol 6 mcg) idame ve rahatlatıcı tedavi grubundaki hastalar astım kontrolünde klinik olarak anlamlı başarı kaydetmişlerdir. Rahatlatıcı tedavinin ortalama inhalasyon sayısı ve rahatlatıcı tedavi uygulanan hasta sayısı her iki grupta da benzer şekilde azalmıştır.
Not: ciddi alevlenmeler, hastaneye yatış ile sonuçlanan astımda kötüleşme veya acil tedavi veya sistemik steroid ihtiyacında 3 günden fazla artış olarak tanımlanmıştır.
Diğer bir klinik çalışmada, astımlı hastalarda metakolin ile bronkokonstriksiyon geliştirilmiş ve FASTAİR'ın tek doz ile (100/6 mcg) bronkodilatasyon sağlanması, salbutamol 200 mcg ile karşılaştırılmıştır. FASTAİR tek doz ile, salbutamol ile benzer şekilde hızlı bronkodilatasyon ve dispne de hızlı iyileşme sağlamıştır.
5.2. Farmakokinetik özellikler
Genel özelliklerSabit kombinasyon ilacı FASTAİR'ın sistemik etkileri, içeriğindeki aktif maddeler olan beklometazon dipropiyonat ve formoterol'ün sistemik etkileri ile klinik çalışmada karşılaştırılmıştır.
Beklometazon dipropiyonat için, ana aktif metabolit olan beklometazon- 17- monopropiyonat (B-17-MP) AUC'si ve maksimum plazma konsantrasyonu sabit kombinasyon uygulandıktan sonra daha düşük olmuştur, fakat emilim hızı tek başına uygulanan beklometazon'a göre daha hızlıdır.
est
kombinasyona göre biraz daha yüksek bulunmuştur.
Beklometazon dipropiyonat ve formoterol arasında farmakokinetik veya farmakodinamik etkileşim gözlemlenmemiştir.
Beklometazon dipropiyonat
Glukokortikoid reseptörlerine bağlanma afinitesi zayıf bir ön ilaç olan beklometazon dipropiyonat, esteraz enzimleriyle aktif metabolit olan beklometazon-17-monopropiyonata hidrolize olur. Beklometazon-17-monopropiyonat, ön ilaç olan beklometazon dipropiyonata göre daha güçlü bir topikal anti-inflamatuvar etkinliğe sahiptir.
Emilim
İnhale edilen beklometazon dipropiyonat akciğerlerden hızla emilir; emilimden önce beklometazon dipropiyonat büyük oranda aktif metaboliti B-17-MP'ye dönüşür. B-17 MP'nin sistemik biyoyararlılığı akciğer (%36) ve yutulan dozun gastrointestinal emilimi ile ortaya çıkar. Yutulan beklometazon dipropiyonat'ın biyoyararlılığı ihmal edilebilir düzeydedir, ancak, sistemik dolaşım öncesinde B-17-MP'ye dönüşüm emilimin %41'inin B-17-MP olarak gerçekleşmesini sağlar. Yutulan dozun artışı ile birlikte sistemik etkide yaklaşık olarak lineer bir artış vardır. İnhalasyon sonrasındaki mutlak biyoyararlılık değişmemiş beklometazon dipropiyonat ve B-17-MP için sırası ile nominal dozun %2 ve %62'si kadar olmuştur.
Dağılım
İntravenöz dozdan sonra, beklometazon dipropiyonat ve B-17-MP dağılımı yüksek plazma klerensi ile karakterizedir (sırasıyla 150 ve 120 L/saat) ve sabit durumda beklometazon dipropiyonat için dağılım hacmi az (20L) B-17-MP için doku dağılımı daha fazladır (424L).
Plazma proteinine bağlanma orta derecede yüksektir.
Biyotransformasyon
Beklometazon dipropiyonat sistemik dolaşımda çoğu dokuda bulunan esteraz enzimleri aracılığı ile metabolize olur ve sistemik dolaşımdan çok hızlı temizlenir. Metabolizmanın ana ürünü aktif metabolittir (B-17-MP). Beklometazon-21-monopropiyonat (B-21-MP) ve beklometazon (BOH) gibi minör metabolitler de oluşur fakat bunlar sistemik maruziyete çok az katkıda bulunur.
Eliminasyon
Beklometazon dipropiyonatın başlıca atılım şekli polar metabolitler şeklinde feçesle atılımdır. Beklometazon dipropiyonat ve metabolitlerinin idrarla atılımı önemsiz miktardadır. Beklometazon dipropiyonat ve beklometazon-17-monopropiyonat için terminal eliminasyon yarılanma ömrü sırasıyla 0,5 ve 2,7 saattir.
Hastalardaki karakteristik özellikler
Renal veya hepatik bozukluğu olan hastalarda beklometazon dipropiyonatın farmakokinetikleri çalışılmamıştır; ancak beklometazon dipropiyonat bağırsak sıvısında, serum, akciğerler ve karaciğerde bulunan esteraz enzimleri ile çok hızlı metabolize olarak, daha polar ürünler olan B-21-MP, B-17-MP ve BOH haline dönüştüğü için karaciğer yetersizliğinin beklometazon dipropiyonat farmakokinetik ve güvenlik profilini değiştirmesi beklenmemektedir.
Formoterol Emilim
İnhalasyondan sonra formoterol hem akciğerden hem de gastrointestinal yoldan emilmektedir. Ölçülü doz inhalatör (MDI) ile oral uygulamadan sonra yutulan inhale dozun fraksiyonu % 60 ile % 90 arasında bulunabilir. Yutulan dozun en az % 65'lik bir kısmı gastrointestinal sistemde emilir. Değişmemiş ilaç zirve plazma konsantrasyonuna oral uygulamadan 0.5 saat-1 saat sonra ulaşır.
Dağılım
Formoterol'ün plazma proteinlerine bağlanma oranı %61-64'tür ve %34'ü albümine bağlanır. Terapötik dozlarda ulaşılan konsantrasyon aralığında bağlanmada doygunluk gerçekleşmez. Oral uygulamadan sonra saptanan eliminasyon yarılanma ömrü 2-3 saattir. Formoterol emilimi 12-96 mikrogram inhale formoterol fumarat aralığı boyunca lineerdir.
Biyotransformasyon
Formoterol yaygın biçimde metabolize olur ve öne çıkan metabolik yol fenolik hidroksil grubundaki doğrudan konjugasyondur. Glukoronik asit konjugatı inaktiftir. İkinci majör yol fenolik 2'-hidroksil grubunda demetilasyon ve bunu izleyen konjugasyondur. Sitokrom P-450 izoenzimleri CYP2D6, CYP2C19, CYP2C9, formoterol demetilasyonuna katılırlar. Karaciğer, primer metabolizma bölgesi olarak görülmektedir. Formoterol terapötik geçerli konsantrasyonlarda CYP-450 enzimlerini inhibe etmez.
Eliminasyon
Formoterolün idrardan kümülatif atılımı bir KTI (kuru toz inhaler)'den tek inhalasyon sonrasında 12-96 μg doz aralığında lineer artış göstermiştir. Sırası ile ortalama, %8 ve %25 oranındaki doz değişmeden ve total formoterol olarak atılmıştır.
12 sağlıklı olguda tek bir 120 μg doz inhalasyonunu takiben ölçülen plazma konsantrasyonlarına dayanılarak, ortalama terminal eliminasyon yarılanma ömrünün 10 saat olduğu belirlenmiştir. (R,R) ve (S,S) enantiomerleri idrarda atılan değişmemiş ilacın sırasıyla yaklaşık %40 ve %60'ını temsil etmektedir. İki enantiomerin oranı araştırılan doz aralığında sabit kalmıştır ve yinelenen dozlardan sonra bir enantiomerin diğerine nispetle daha fazla biriktiğine ilişkin kanıt bulunamamıştır.
Oral uygulamadan sonra (40-80 μg) dozun %6-%10'a varan oranı sağlıklı olgularda idrarda değişmemiş ilaç olarak bulunmuştur ve %8'e varan oranı ise glukuronid olarak bulunmuştur. Oral formoterol dozunun toplam %67'si idrarla (başlıca metabolitleri şeklinde) ve kalanı feçesle atılır. Formoterolün renal klirensi 150 ml/dakika'dir.
Hastalardaki karakteristik özellikler
Karaciğer/böbrek yetersizliği: Formoterolün farmakokinetiği karaciğer ve böbrek yetersizliği olan hastalarda araştırılmamıştır.
Irk, cinsiyet: Eliminasyon ve biyotransformasyon özelliklerine bakılarak hastanın etnik orijininin ve cinsiyetinin farmakokinetik parametreler üzerine bir etkisi olmayacağı beklenir.
5.3. Klinik öncesi güvenlilik verileri
Dozu gerçekten alıp almadığımı nasıl bileceğim?
İnhalasyon cihazınızın içerisinden nefes aldığınızda bir vızıldama sesi duyacaksınız.
Ağzınızda laktozdan kaynaklanan 'şeker tadı' hissedeceksiniz. Boğazınızın arka kısmında toz hissedebilirsiniz. Bu normaldir.
Doz alındığında kapsül boşalmış olacaktır.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Laktoz (inek sütü kaynaklıdır)
6.2. Geçimsizlikler
Bilinen bir geçimsizliği yoktur.
6.3. Raf ömrü
24 ay
6.4. Saklamaya yönelik özel tedbirler
25°C altında oda sıcaklığında saklayınız. Nemden koruyunuz.
6.5. Ambalajın niteliği ve içeriği
Kutuda, FASTAİR İnhalasyon İçin Toz İçeren Kapsül desikant kapaklı HDPE şişe 120 kapsül
+ 1 adet inhalasyon cihazı.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller, âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğiâ ne uygun olarak imha edilmelidir.
FASTAİR uygulaması esnasında aşağıdaki talimatlara uyulmalıdır:
![]()
üzere tasarlanmıştır.
Kapsüllerin içerisindeki toz yalnızca teneffüs edilerek (nefes yoluyla) kullanılacaktır.
Kapsülleri kullanmadan hemen önce folyo paketinden çıkarınız. kapsüllerin ıslanmaması için parmaklarınızın kuru olduğundan emin olunuz.
İlacınızı kullandıktan sonra ağzınızı su ile iyice çalkalayınız ve çalkaladıktan sonra ağzınızdaki suyu tükürünüz. Bunu yapmak, ağzınızda mantar enfeksiyonu (pamukçuk) gelişmesi riskini azaltır.
Kapsülleri inhalasyon cihazı dışında başka bir cihaz ile kullanmayınız.
FASTAİR'ı her gün aynı saatlerde kullanmanız ilacınızı ne zaman kullanacağınızı hatırlamanıza yardımcı olacaktır.
FASTAİR'ı doktorunuzun talimatına göre, düzenli olarak kullanmanız önemlidir. Astım belirtileriniz olmasa bile FASTAİR'ı kullanmaya devam etmelisiniz çünkü bu astım nöbetlerinin oluşmamasına yardımcı olur.
Eğer ne kadar süre FASTAİR kullanacağınız hakkında sorularınız varsa, doktorunuza ya da eczacınıza danışınız.
Hastaların jelatin kapsülün parçalanabileceğini ve küçük jelatin parçalarının inhalasyondan sonra ağız veya boğaz bölgesine ulaşabileceğini bilmesi önemlidir.
Hastaya jelatinin zararsız olduğu, ağızda yumuşayacağı ve yutulabildiği söylenmelidir. Kapsülü bir defadan fazla delmemek suretiyle parçalanma olasılığı asgari düzeye indirilebilir.
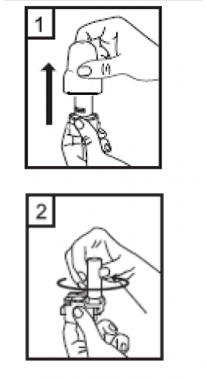
|
1-Kapağı çekip çıkarınız. |
|
2-Kapsül bölmesini açınız.
İnhalerin tabanını sıkıca tutup, açmak için ağızlığı üzerinde yer alan ok işareti yönünde döndürünüz. |
|
3-Parmaklarınızın tamamen kuru olduğundan emin olunuz. Ambalajından bir kapsül çıkarınız ve bu kapsülü cihazın tabanındaki kapsül bölmesine yatık olarak yerleştiriniz. Kapsülleri, kullanımdan hemen önce ambalajından çıkarmanız önemlidir.
ÖNEMLİ: Kapsülü ağızlığın içerisine yerleştirmeyiniz! |
|
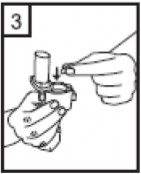
4-Ağızlığı âklikâ sesi duyana kadar geri çevirerek kapalı duruma getiriniz. |
| 5-Tozu kapsülden serbestlemek için: şekilde dik olarak tutunuz. Not: Kapsül bu aşamada parçalanabilir ve küçük jelatin parçacıkları ağzınıza ya da boğazınıza gelebilir. Fakat jelatin yenebilir nitelikte olduğu için zararlı değildir. |
|
6-Nefesinizi olabildiğince dışarıya veriniz. |
Cihazı ağızlık yukarı doğru bakacak
Kenarlardaki iki kulakçığa (düğmelere) aynı anda ve sadece bir kez sıkıca basarak kapsülü deliniz.
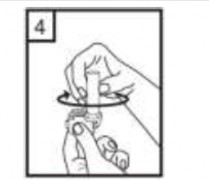
| 7-İlacı derin bir şekilde hava yollarınıza çekmek için: Not: Kapsülün, kapsül bölmesinin üzerindeki alanda dönmesine bağlı olarak bir vızıldama sesi duymalısınız. Eğer bu vızıldama sesini duymazsanız, kapsül bölmesini açınız ve kapsülün, kapsül bölmesinde sıkışıp sıkışmadığını kontrol ediniz. Daha sonra 7. basamağı tekrarlayınız. Kapsülü sıkıştığı yerden kurtarmak için düğmelere tekrar BASMAYINIZ. |
8- Cihazın içerisinden nefes aldıktan sonra, nefesinizi olabildiğince tutunuz ve cihazı ağzınızdan çıkarınız. Sonra burnunuzdan nefes veriniz. Kapsül bölmesini açınız ve kapsülde toz kalıp kalmadığını kontrol ediniz. Eğer kalmış ise 6, 7 ve 8 no' lu işlemleri tekrarlayınız. | |
9- Tüm tozu kullandıktan sonra kapsül bölmesini açınız (Bkz. basamak 2). Boş kapsülü çıkarınız. doktorunuzun önerisi doğrultusunda aynı işlemleri diğer kapsüller için de tekrarlayınız. | |
10- İçeride kalan tozları temizlemek için kuru bir kağıt mendil ya da fırça kullanınız. Not: İnhalasyon cihazını temizlemek için SU KULLANMAYINIZ. Önce ağızlığı, ardından kapağı kapatınız. | |
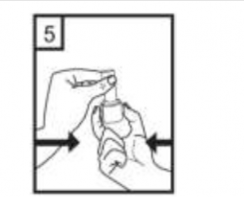
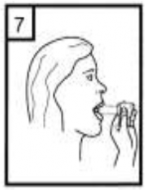
Ağızlığı ağzınıza yerleştiriniz ve başınızı hafifçe geriye doğru eğiniz.
Dudaklarınızla ağızlığın etrafını sıkıca sarınız.
Hızlı, duraksamadan ve alabildiğiniz kadar derin bir nefes alınız.
İlacınızı kullandıktan sonra ağzınızı su ile iyice çalkalayınız ve çalkaladıktan sonra ağzınızdaki suyu tükürünüz. Bunu yapmak, ağzınızda mantar enfeksiyonu (pamukçuk) gelişmesi riskini azaltır.
Uygulamaya ilişkin sorular ve cevapları
Kapsüllerin küçük parçaçıklara ayrılmasını nasıl önlerim?
Cihazın yanındaki kırmızı kulakçıklıklara (düğmelere) bastığınızda (5.basamak), kapsüller kırılabilir ve nefes alırken ağzınıza ya da boğazınıza küçük parçalar kaçabilir. Bunu aşağıdakileri uygulayarak önleyebilirsiniz:
Kulakcıklara (düğmelere) yalnızca bir kere basarak.
Kapsülleri kullanmadan önce orjinal ambalajında tutarak.
Kapsülleri 25C altındaki oda sıcaklığında saklayarak.
Kapsülleri nemden koruyarak.
İnhalasyon cihazının içerisindeki tozu nasıl temizlerim?
Kuru bir kâğıt mendil ya da yumuşak bir fırça kullanınız.
İnhalasyon cihazını asla yıkamamanız gerektiğini unutmamalısınız.
 Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir.
Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir. |
 Yüksek Tansiyon
Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon
atardamarlarınızdaki kanın basıncıdır.
Yüksek Tansiyon
Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon
atardamarlarınızdaki kanın basıncıdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| FASTAIR | 8680865270255 | 517.21TL |
| FORBEFIX | 8680741520306 | 431.22TL |
| FOREBEC | 8699525558930 | 472.19TL |
| FOSHAL | 8680865270118 | 517.21TL |
| FOSTER | 8699822520371 | |
| Diğer Eşdeğer İlaçlar |
 |
Grip, Soğuk Algınlığı ve Öksürük Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |
 |
Astım Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
 |
Grip, Soğuk Algınlığı ve Öksürük Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |
İLAÇ GENEL BİLGİLERİ
Arımed İlaç San.Ve Tic.A.Ş
| Satış Fiyatı | 517.21 TL [ 26 Apr 2024 ] |
| Önceki Satış Fiyatı | 517.21 TL [ 22 Apr 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8680865270255 |
| Etkin Madde | Beklometazon Dipropiyonat + Formoterol Fumarat |
| ATC Kodu | R03AK08 |
| Birim Miktar | 100+6 |
| Birim Cinsi | MCG |
| Ambalaj Miktarı | 120 |
| Solunum Sistemi > Adrenerjikler (İnhalan) |
| Yerli ve Beşeri bir ilaçdır. |