FASLODEX 250 mg/5 ml enjeksiyonluk çözelti Kısa Ürün Bilgisi
{ Fulvestrant }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
FASLODEX 250 mg/5 mL enjeksiyonluk çözelti Steril
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her bir kullanıma hazır enjektör 5 mL çözeltide etkin madde olarak 250 mg fulvestrant içerir.
Yardımcı maddeler
(her 5 mL'de):Etanol %96 500 mg
Benzil alkol 500 mg
Benzil benzoat 750 mg Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
Enjeksiyonluk çözelti
Berrak, renksiz ila sarı renkte, viskoz çözelti
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
FASLODEX;
Hormon-reseptörü pozitif, HER2-negatif olan;
Daha önce endokrin tedavi almamış, lokal ileri veya metastatik postmenopozal meme kanserinde,
4.2. Pozoloji ve uygulama şekli
Erişkin yaştaki kadınlar (yaşlılar dahil): Önerilen doz ayda bir kez iki 5 ml'lik enjeksiyon olarak, her iki kalçaya intramüsküler enjeksiyonla uygulanan toplam 500 mg ve bir defaya mahsus olarak ilk dozdan iki hafta sonra verilen ilave bir 500 mg dozdur.
FASLODEX bir CDK 4/6 inhibitörü ile kombinasyon halinde kullanılacak olduğunda lütfen ilgili CDK 4/6 inhibitörüne ait Kısa Ürün Bilgisi'ne de başvurun.
Pre/perimenopozal kadınlar FASLODEX + CDK 4/6 inhibitörü kombinasyonu ile tedaviye başlamadan önce ve söz konusu tedavi boyunca yerel klinik uygulamaya uygun şekilde LHRH agonistleriyle tedavi edilmelidir.
Uygulama şekli:
FASLODEX, her bir kalçaya (gluteal bölgeye) bir enjeksiyon olmak üzere ardışık iki 5 ml enjeksiyon şeklinde intramusküler olarak yavaşça (1-2 dk/enjeksiyon) uygulanır.
Dorsogluteal bölgeye FASLODEX enjekte edilirken, altta yatan siyatik sinirin yakınlığı nedeni ile dikkatli olunmalıdır.
Detaylı kullanma talimatı için (Bkz. Bölüm 6.6). Özel popülasyonlara ilişkin ek bilgiler Böbrek yetmezliği:
Hafif ile orta derecede böbrek yetmezliği (kreatinin klirensi ≥ 30 ml/dakika) olan hastalarda doz ayarlaması önerilmez. Şiddetli böbrek yetmezliği (kreatinin klirensi <30 ml/dakika) olan hastalardaki etkinlik ve güvenlilik değerlendirilmemiştir, bu nedenle bu hastalarda dikkatle kullanılmalıdır (Bkz. Bölüm 4.4).
Karaciğer yetmezliği:
Hafif ile orta derecede karaciğer yetmezliği olan hastalarda doz ayarlaması önerilmez. Ancak fulvestrant maruziyeti artabileceğinden, FASLODEX bu hastalarda dikkatle kullanılmalıdır. Ciddi derecede karaciğer yetmezliği olan hastalardaki etkinlik ve güvenlilik değerlendirilmemiştir (Bkz. Bölüm 4.3, 4.4 ve 5.2).
Pediatrik popülasyon:
0-18 yaş arası çocuk ve adolesanlarda etkililik ve güvenlilik değerlendirilmemiştir. Mevcut veriler Bölüm 5.1 ve 5.2'de verilmekte olup, pozoloji bölümünde herhangi bir öneri yapılamamaktadır.
Geriyatrik popülasyon:
Bu yaş grubu hastalarda normal erişkin doz tavsiyelerine uyulur.
4.3. Kontrendikasyonlar
FASLODEX, aşağıdaki durumlarda kontrendikedir:
Fulvestrant veya Bölüm 6.1'de listelenen yardımcı maddelerden herhangi birine karşı aşırı duyarlılığı olduğu bilinen hastalarda,
4.4. Özel kullanım uyarıları ve önlemleri
FASLODEX hafif ve orta şiddette karaciğer yetmezliği olan hastalarda dikkatli kullanılmalıdır (Bkz. Bölüm 4.2, Bölüm 4.3 ve Bölüm 5.2).
FASLODEX ileri derecede böbrek yetmezliği (kreatinin klerensi dakikada 30 mL'den düşük) olan hastalarda dikkatle kullanılmalıdır.
İntramüsküler uygulama yolu nedeniyle FASLODEX, kanama diyatezi veya trombositopenisi olan ya da antikoagülan tedavisi alan hastalarda dikkatle kullanılmalıdır.
Meme kanseri ilerlemiş kadınlarda tromboembolik vakalar yaygın olarak gözlenmekte olup, bu vakalar FASLODEX ile yapılan klinik çalışmalarda da gözlenmiştir (Bkz. Bölüm 4.8). Bu durum risk taşıyan hastalara FASLODEX'i reçete ederken göz önünde bulundurulmalıdır.
Siyatik ağrısı, nöralji, nöropatik ağrı ve periferik nöropati dahil enjeksiyon bölgesi ile ilgili olaylar FASLODEX enjeksiyonu ile bildirilmiştir. Dorsogluteal bölgeye FASLODEX enjekte edilirken, altta yatan siyatik sinirin yakınlığı nedeni ile dikkatli olunmalıdır (Bkz. Bölüm 4.2 ve 4.8).
Fulvestrantın kemikler üzerine etkileri hakkında uzun süreli veri mevcut değildir. Fulvestrantın etki mekanizması nedeniyle potansiyel bir osteoporoz riski söz konusudur.
FASLODEX'in (monoterapi olarak veya bir CDK 4/6 inhibitörüyle (palbosiklib) kombinasyon halinde) etkililiği ve güvenliliği kritik viseral hastalığa sahip kişilerde araştırılmamıştır.
FASLODEX, CDK 4/6 inhibitörü (palbosiklib) ile kombine edilecek olduğunda lütfen ilgili CDK 4/6 inhibitörüne ait Kısa Ürün Bilgisine de başvurun.
Östradiol antikor analizleriyle etkileşim
Fulvestrant ve östradiolün yapısal benzerliği nedeniyle fulvestrant, antikor bazlı östradiol analizleriyle etkileşebilir ve östradiol düzeylerinde hatalı yüksekliğe sebep olabilir.
Pediatrik popülasyon
Güvenlilik ve etkililiğin bu yaş grubunda değerlendirilmemiş olması nedeniyle FASLODEX'in 18 yaş altı çocuklarda ve adolesanlarda kullanılması önerilmemektedir (Bkz. Bölüm 5.1).
FASLODEX'te hacmin %10'u kadar etanol (alkol) vardır (örneğin, her enjektörde 500 mg'a kadar, her enjeksiyonda 10 mL biraya eşdeğer, her enjeksiyonda 4 mL şaraba eşdeğer gibi). Alkol bağımlılığı olanlar için zararlı olabilir. Karaciğer hastalığı ya da epilepsi gibi yüksek risk grubundaki hastalar için dikkate alınmalıdır.
FASLODEX, her enjeksiyonda 1 ml'sinde 100 mg'a eşdeğer 500 mg benzil alkol (90 mg/kg/gün'den daha az) içermektedir. Benzil alkol, alerjik reaksiyonlara sebep olabilir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Fulvestrantın midazolamla (CYP3A4 substratı) birlikte kullanıldığı klinik bir etkileşim çalışmasında fulvestrantın CYP3A4'ü inhibe etmediği gösterilmiştir. Rifampisin (CYP3A4 indükleyicisi) ve ketokonazol (CYP3A4 inhibitörü) ile yapılan klinik etkileşim çalışmalarında fulvestrant klerensinde klinik olarak anlamlı bir değişiklik gösterilmemiştir. Bu nedenle fulvestrant ile CYP3A4 inhibitörlerini veya indükleyicilerini eşzamanlı kullanan hastalarda doz ayarlaması gerekli değildir.
Özel popülasyonlara ilişkin ek bilgiler:
Herhangi bir çalışma yapılmamıştır.
Pediyatrik popülasyon:
Herhangi bir çalışma yapılmamıştır.
4.6. Gebelik ve laktasyon
Gebelik Kategorisi: D
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon) FASLODEX'in gebelik ve/veya fetüs/yenidoğan üzerinde zararlı farmakolojik etkileri bulunmaktadır. Çocuk doğurma potansiyeli bulunan kadınlar FASLODEX ile tedavi görürken ve aldığı son dozdan sonraki 2 yıl süresince etkili bir doğum kontrol yöntemi kullanmalıdır.
Gebelik dönemi
FASLODEX gebelik döneminde kontrendikedir (Bkz. Bölüm 4.3). Fulvestrantın sıçan ve tavşanda tek doz intramüsküler uygulama sonrasında plasentayı geçtiği gösterilmiştir. Hayvanlar üzerinde yapılan araştırmalar fetal anomali ve ölüm (Bkz. Bölüm 5.3) insidansında artış da dahil olmak üzere, üreme toksisitesinin bulunduğunu göstermiştir. Hasta, FASLODEX kullanırken gebelik oluşması durumunda, fetüs üzerindeki potansiyel zarar ve potansiyel düşük riski hakkında bilgilendirilmelidir.
Laktasyon dönemi
FASLODEX ile tedavi sırasında emzirme kesilmelidir. Fulvestrantın insan sütüyle atılıp atılmadığı bilinmemektedir. Fulvestrant emzirme dönemindeki sıçanlarda sütle atılmıştır. Emzirilen bebeklerde fulvestranttan kaynaklanabilecek ciddi istenmeyen reaksiyon potansiyeli dikkate alındığında FASLODEX emzirme döneminde kontrendikedir (Bkz. Bölüm 4.3).
Üreme yeteneği/Fertilite
FASLODEX'in insanlarda fertilite üzerindeki etkileri çalışılmamıştır.
4.7. Araç ve makine kullanımı üzerindeki etkiler
FASLODEX'in, hastaların araç veya makine kullanma yeteneği üzerinde etkisi yoktur veya etki ihmal edilebilir düzeydedir. Ancak, FASLODEX tedavisi sırasında yaygın olarak asteni bildirildiğinden, araç veya makine kullanırken bu istenmeyen reaksiyonun görüldüğü hastalara dikkatli olmaları önerilmelidir.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti
Monoterapi
Bu bölüm klinik çalışmalar, pazarlama sonrası çalışmalar veya spontan raporlardan alınan tüm istenmeyen reaksiyonlara dayalı bilgiler sunmaktadır. Fulvestrant monoterapisi toplu veri setinde, enjeksiyon bölgesi reaksiyonları, asteni, bulantı ve hepatik enzimlerde (ALT, AST, ALP) artış en sık bildirilen istenmeyen ilaç reaksiyonlarıdır.
Advers ilaç reaksiyonlarına (AİR'ler) ilişkin aşağıdaki sıklık kategorileri Faslodex 500 mg ile Faslodex 250 mg'nin karşılaştırıldığı çalışmaların [CONFIRM (Çalışma D6997C00002), FINDER 1 (Çalışma D6997C00004), FINDER 2 (Çalışma D6997C00006) ve NEWEST
(Çalışma D6997C00003) çalışmaları] toplu güvenlilik analizlerindeki Faslodex 500 mg tedavi grubu veya tek başına Faslodex 500 mg ile anastrozol 1 mg'nin karşılaştırılığı FALCON (Çalışma D699BC00001) çalışmasına dayanarak hesaplanmıştır. Sıklıklar birleştirilmiş güvenlilik analizi ile FALCON arasında farklılık sergilediği takdirde en yüksek sıklık sunulmaktadır. Aşağıda yer alan sıklıklar, araştırmacının nedenselliğe ilişkin değerlendirmesinden bağımsız şekilde, bildirilmiş olan tüm advers ilaç reaksiyonlarını temel almıştır. Toplu veri setinde (yukarıda bahsi geçen çalışmalar + FALCON dahil) fulvestrant 500 mg tedavisinin medyan süresi 6,5 ay olarak hesaplanmıştır.
Aşağıda listelenen istenmeyen ilaç reaksiyonları sıklıklarına ve Sistem Organ Sınıfına (SOS) göre sınıflandırılmıştır.
Şu terimler ve sıklık dereceleri kullanılmıştır:
Çok yaygın (â¥1/10); yaygın (â¥1/100 ila <1/10); yaygın olmayan (â¥1/1000 ila <1/100); seyrek (â¥1/10.000 ila <1/1000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Her bir sıklık grubu içinde istenmeyen ilaç reaksiyonları azalan ciddiyet sırasıyla listelenmiştir.
FASLODEX Monoterapisi Uygulanan Hastalarda Bildirilen Advers İlaç Reaksiyonları
Enfeksiyonlar ve enfestasyonlar
Yaygın: İdrar yolu enfeksiyonları
Kan ve lenf sistemi hastalıkları
Yaygın: Trombosit sayısında azalma
Bağışıklık sistemi hastalıkları
Çok yaygın: Aşırı duyarlılık reaksiyonları Yaygın olmayan: Anaflaktik reaksiyonlar
Metabolizma ve beslenme hastalıkları
Yaygın: Anoreksi
Sinir sistemi hastalıkları
Yaygın: Baş ağrısı
Vasküler hastalıklar
Çok yaygın: Sıcak basması Yaygın: Venöz tromboembolizm
Gastrointestinal hastalıklar
Çok yaygın: Bulantı Yaygın: Kusma, diyare
Hepato-bilier hastalıklar
Çok yaygın: Yüksek karaciğer enzimleri (ALT, AST, ALP) Yaygın: Bilirubin seviyelerinde artış
Yaygın olmayan: Karaciğer yetmezliği, hepatit, gamma-GT'de yükselme
Deri ve deri altı dokusu hastalıkları
Çok yaygın: Deri döküntüsü
Kas-iskelet bozuklukları, bağ dokusu ve kemik hastalıkları
Çok yaygın: Eklem ve musküloskeletal ağrı Yaygın: Sırt ağrısı
Üreme sistemi ve meme hastalıkları
Yaygın: Vajinal hemoraji
Yaygın olmayan: Vajinal moniliyazis, lökore
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Çok yaygın: Asteni, enjeksiyon bölgesi reaksiyonları Yaygın: Periferik nöropati, siyatik
Yaygın olmayan: Enjeksiyon bölgesinde hemoraji, enjeksiyon bölgesinde hematom nöralji
Seçilmiş olan advers reaksiyonların tanımı
Aşağıda yer alan tanımlamalar Faz 3 FALCON Çalışması'nda sırasıyla en az bir (1) doz fulvestrant almış olan 228 hastayı ve en az bir (1) doz anastrozol almış olan 232 hastayı içeren güvenlilik analizi setine dayanmaktadır.
Eklem ağrısı ve musküloskeletal ağrı
FALCON Çalışması'nda eklem ağrısına ve musküloskeletal ağrıya ilişkin bir advers reaksiyon bildiren hastaların sayısı fulvestrant ve anastrozol kollarında sırasıyla 65 (%31,2) ve 48'di (%24,1). Faslodex kolundaki 65 hastanın %40'ı (26/65) tedavinin ilk ayı içinde, %66,2'si ise (43/65) tedavinin ilk 3 ayı içinde eklem ağrısı ve musküloskeletal ağrı bildirmiştir. Hastaların hiçbiri CTCAE Derece â¥3 veya dozun azaltılmasını, duraklatılmasını gerektiren olay bildirmemiştir veya bu advers reaksiyonlar nedeniyle tedaviyi bırakmamıştır.
Palbosiklib ile uygulanan kombinasyon tedavisi
Palbosiklible kombinasyon halinde kullanılan fulvestrantın genel güvenlilik profili, randomize PALOMA3 çalışmasındaki HR-pozitif, HER2-negatif ilerlemiş veya metastatik meme kanserli 517 hastadan elde edilmiş olan verileri temel almaktadır (Bkz. Bölüm 5.1). Palbosiklible kombinasyon halinde fulvestrant alan hastalarda tüm derecelerden bildirilen en
yaygın (â¥%20) advers reaksiyonlar nötropeni, lökopeni, enfeksiyonlar, bitkinlik, bulantı, anemi, stomatit, diyare, trombositopeni ve kusma olmuştur. En yaygın (â¥%2) Derece â¥3 advers reaksiyonlar nötropeni, lökopeni, enfeksiyonlar, anemi, AST artışı, trombositopeni ve bitkinlik olmuştur.
Tablo 1'de PALOMA3'te bildirilmiş olan advers reaksiyonlar verilmektedir.
Fulvestranta maruziyetin medyan süresi fulvestrant + palbosiklib kolunda 11,2 ay, fulvestrant
+ plasebo kolunda ise 4,8 ay olarak belirlenmiştir. Fulvestrant + palbosiklib kolunda palbosiklibe maruziyetin medyan süresi 10,8 ay olarak belirlenmiştir.
Tablo 1 PALOMA3 Çalışması'nı (N=517) temel alan advers reaksiyonlar
Sistem Organ Sınıfı Sıklık Tercih Edilen Terim | Faslodex + Palbosiklib (N=345) | Faslodex + plasebo (N=172) | ||
Tüm Dereceler n (%) | Derece ⥠3 n (%) | Tüm Dereceler n (%) | Derece ⥠3 n (%) | |
Enfeksiyonlar ve enfestasyonlar | ||||
Çok yaygın |
|
|
|
|
Enfeksiyonlar | 188 (54,5) | 19 (5,5) | 60 (34,9) | 6 (3,5) |
Kan ve lenf sistemi bozuklukları | ||||
Çok yaygın |
|
|
|
|
Nötropeni | 290 (84,1) | 240 (69,6) | 6 (3,5) | 0 |
Lökopeni | 207 (60,0) | 132 (38,3) | 9 (5,2) | 1 (0,6) |
Anemi | 109 (31,6) | 15 (4,3) | 24 (14,0) | 4 (2,3) |
Trombositopeni | 88 (25,5) | 10 (2,9) | 0 | 0 |
Yaygın olmayan |
|
|
|
|
Febril nötropeni | 3 (0,9) | 3 (0,9) | 0 | 0 |
Metabolizma ve beslenme bozuklukları | ||||
Çok yaygın |
|
|
|
|
İştahsızlık | 60 (17,4) | 4 (1,2) | 18 (10,5) | 1 (0,6) |
Sinir sistemi bozuklukları | ||||
Yaygın |
|
|
|
|
Disguzi | 27 (7,8) | 0 | 6 (3,5) | 0 |
Göz bozuklukları | ||||
Yaygın |
|
|
|
|
Lakrimasyonda artış | 25 (7,2) | 0 | 2 (1,2) | 0 |
Bulanık görme | 24 (7,0) | 0 | 3 (1,7) | 0 |
Gözde kuruluk | 15 (4,3) | 0 | 3 (1,7) | 0 |
Solunum, torasik ve mediastinal bozukluklar | ||||
Yaygın |
|
|
|
|
Epistaksis | 25 (7,2) | 0 | 4 (2,3) | 0 |
Gastrointestinal bozukluklar | ||||
Çok yaygın |
|
|
|
|
Sistem Organ Sınıfı Sıklık Tercih Edilen Terim | Faslodex + Palbosiklib (N=345) | Faslodex + plasebo (N=172) | ||
Tüm Dereceler n (%) | Derece ⥠3 n (%) | Tüm Dereceler n (%) | Derece ⥠3 n (%) | |
Bulantı | 124 (35,9) | 2 (0,6) | 53 (30,8) | 1 (0,6) |
Stomatit | 104 (30,1) | 3 (0,9) | 24 (14,0) | 0 |
Diyare | 94 (27,2) | 0 | 35 (20,3) | 2 (1,2) |
Kusma | 75 (21,7) | 2 (0,6) | 28 (16,3) | 1 (0,6) |
Deri ve deri altı doku bozuklukları | ||||
Çok yaygın |
|
|
|
|
Alopesi | 67 (19,4) | UD | 11 (6,4) | UD |
Döküntü | 63 (18,3) | 3 (0,9) | 10 (5,8) | 0 |
Yaygın |
|
|
|
|
Deride kuruluk | 28 (8,1) | 0 | 3 (1,7) | 0 |
Genel bozukluklar ve uygulama yeri rahatsızlıkları | ||||
Çok yaygın |
|
|
|
|
Bitkinlik | 152 (44,1) | 9 (2,6) | 54 (31,4) | 2 (1,2) |
Ateş | 47 (13,6) | 1 (0,3) | 10 (5,8) | 0 |
Yaygın |
|
|
|
|
Asteni | 27 (7,8) | 1 (0,3) | 13 (7,6) | 2 (1,2) |
Araştırmalar | ||||
Yaygın |
|
|
|
|
AST artışı | 40 (11,6) | 11 (3,2) | 13 (7,6) | 4 (2,3) |
ALT artışı | 30 (8,7) | 7 (2,0) | 10 (5,8) | 1 (0,6) |
ALT=alanin aminotransferaz; AST=aspartat aminotransferaz; N/n=hasta sayısı; UD: Uygulanabilir Değil
Seçilen yan etkilerin açıklaması Nötropeni
PALOMA3 Çalışması'nda palbosiklible kombinasyon halinde fulvestrant alan hastaların 290'ında (%84,1) herhangi bir derecede nötropeni bildirilirken 200 hastada (%58,0) 3. Derece nötropeni, 40 hastada (%11,6) ise 4. Derece nötropeni bildirilmiştir. Fulvestrant + plasebo kolunda (n=172), herhangi bir derecede nötropeni 6 (%3,5) hastada bildirilmiştir. Fulvestrant
+ plasebo kolunda 3. ve 4. Derece nötropeni bildirimi yapılmamıştır.
Palbosiklible kombinasyon halinde fulvestrant alan hastalarda herhangi bir derecede nötropeninin görüldüğü ilk episoda kadar geçen medyan sürenin 15 gün (aralık: 13-512 gün), Derece â¥3 nötropeninin medyan süresinin ise 16 gün olduğu belirlenmiştir. Palbosiklible kombinasyon halinde fulvestrant alan hastaların 3'ünde (%0,9) febril nötropeni bildirilmiştir.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
İnsanlarda FASLODEX ile izole doz aşımı bildirimleri mevcuttur. Doz aşımı meydana geldiği takdirde semptomatik destekleyici tedavi önerilir. Hayvan çalışmaları, yüksek dozda fulvestrant ile belirgin olan antiöstrojenik aktiviteye doğrudan veya dolaylı olarak ilişkili başka etkilerin olmadığını göstermektedir (Bkz. Bölüm 5.3).
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ve immünomodülatör ajanlar, endokrin tedavi, hormon antagonistleri ve ilgili ajanlar, anti-östrojenler
ATC kodu: L02BA03
Etki mekanizması:
Fulvestrant, östradiol ile benzer bir afiniteye sahip kompetitif bir östrojen reseptör (ÖR) antagonistidir. Fulvestrant, östrojenlerin tropik etkisini, kendisi kısmi agonist (östrojen- benzeri) aktivite göstermeksizin bloke eder. Etki mekanizması östrojen reseptör proteininin down-regülasyonuna yol açmak şeklindedir.
Primer meme kanserli postmenopozal kadınlarda yapılan klinik çalışmalar, fulvestrantın ÖR - pozitif tümörlerde plaseboya kıyasla ÖR proteinini anlamlı bir şekilde azalttığını göstermiştir. Ayrıca, intrinsik östrojen agonist ile etkilerinin olmamasından kaynaklanan progesteron reseptörü ekspresyonunda anlamlı bir azalma olmuştur. Ayrıca postmenapozal neoadjuvan tedavide tümörlerde fulvestrant 500 mg'ın ÖR proteinini ve proliferasyon belirleyici Ki67'yi 250 mg'dan çok daha iyi derecede azalttığını göstermiştir.
İlerlemiş meme kanseri üzerindeki klinik güvenlilik ve etkililik:
Monoterapi
İlerlemiş meme kanseri olan ve hastalığın, adjuvan tedavi sırasında veya sonrasında nüksettiği ya da ilerlemiş meme kanseri nedeniyle uygulanan endokrin tedavinin ardından ilerlediği toplam 736 postmenapozal kadın üzerinde yapılan bir Faz 3 klinik çalışması tamamlanmıştır. Çalışma, hastalığı nüksetmiş veya anti-östrojen tedavi (AE altgrup) ile ilerlemiş 423 hasta ve hastalığı nüksetmiş veya aromataz inhibitör terapi ile (AI altgrup) ilerlemiş 313 hasta ile yapılmıştır. Bu çalışmada FASLODEX 500mg(n=362) ile FASLODEX 250 mg(n=374)'ın etkililik ve güvenliliği karşılaştırılmıştır. Primer sonlanım noktası progresyonsuz sağ kalım,
ikincil etki noktaları objektif yanıt oranı (OYO) dahil, klinik yarar oranı (KYO) ve genel sağkalımdır (GS). Etki sonuçları için CONFIRM Çalışması tablo 2'de özetlenmiştir.
Tablo 2: CONFIRM Çalışması sonuçları
Değişken | Tip: çalışma karşılaştırması | Faslodex 500 mg (N=362) | Faslodex 250 mg (N=374) | Gruplar arası karşılaştırma (Faslodex 500mg / Faslodex 250mg) | ||
|
|
|
| Risk oranı | %95 GA | p-değeri |
Progresyonsuz sağkalım | Kaplan-Meier risk oranı |
|
|
|
|
|
Tüm hastalar |
| 6,5 | 5,5 | 0,80 | 0,68,0,94 | 0,006 |
AE altgrup (n=423) | 8,6 | 5,8 | 0,76 | 0,62,0,94 | 0,013 | |
AI alt grup (n=313) | 5,4 | 4,1 | 0,85 | 0,67,1,08 | 0,195 | |
GS | Kaplan-Meier risk oranı |
|
|
|
|
|
Tüm hastalar |
| 26,4 | 22,3 | 0,81 | 0,69,0,96 | 0,016 |
AE altgrup (n=423) | 30,6 | 23,9 | 0,79 | 0,63,0,99 | 0,038 | |
AI alt grup (n=313) | 24,1 | 20,8 | 0,86 | 0,67,1,11 | 0,241 | |
Değişken | Tip: çalışma karşılaştırması | Faslodex 500 mg (N=362) | Faslodex 250 mg (N=374) | Gruplar arası karşılaştırma (Faslodex 500mg / Faslodex 250mg) | ||
|
|
|
| Fark % | %95 GA |
|
OYO | % hasta OY ile; % fark |
|
|
|
|
|
Tüm hastalar |
| 13,8 | 14,6 | -0,8 | -5,8, 6,3 |
|
AE altgrup (n=296) | 18,1 | 19,1 | -1,0 | -8,2, 9,3 |
| |
AI alt grup (n=205) | 7,3 | 8,3 | -1,0 | -5,5, 9,8 |
| |
KYO | % hasta KY ile |
|
|
|
|
|
Tüm hastalar |
| 45,6 | 39,6 | 6,0 | -1,1, 13,3 |
|
AE altgrup (n=423) | 52,4 | 45,1 | 7,3 | -2,2, 16,6 |
| |
AI alt grup (n=313) | 36,2 | 32,3 | 3,9 | -6,1, 15,2 |
| |
Faslodex hastalığı nüksetmiş veya anti-östrojen tedavi ile ilerlemiş hastalarda endikedir. AI alt grup sonuçlarının etkisi bulunmamaktadır.
5.2. Farmakokinetik özellikler
Genel özellikler
Emilim:
FASLODEX'in uzun etkili intramüsküler enjeksiyonunu takiben, fulvestrant yavaşça absorbe olur ve doruk plazma konsantrasyonlarına (C) yaklaşık 5 gün sonra erişilir. FASLODEX
500 mg uygulanması, doz verilmesinden 1 ay içerisinde kararlı durum veya ona yakın maruziyet düzeylerine erişir (sırasıyla ortalama çapraz validasyon [CV]): EAA 475 (33,4%) ng.gün/ml, C25,1 ( 35,3%) ng/ml, C16,3 (25,9%) ng/ml]. Kararlı durumda fulvestrant plazma konsantrasyonları doruk ve çukur konsantrasyonlar arasında yaklaşık 3 kat farkla nispeten dar bir aralıkta korunur.
Dağılım:
Fulvestrant vücutta yaygın olarak ve hızla dağılır. Kararlı durumdaki sanal dağılım hacminin (Vd) yüksek olması (yaklaşık 3 ila 5 L/kg), bu bileşiğin dağılımının büyük ölçüde ekstravasküler olduğunu göstermektedir. Fulvestrantın plazma proteinlerine bağlanma oranı yüksektir (%99). Çok düşük yoğunluklu lipoprotein (VLDL), düşük yoğunluklu (LDL) ve yüksek yoğunluklu lipoprotein (HDL) fraksiyonları fulvestrantın bağlandığı başlıca proteinlerdir. Proteinlere kompetitif olarak bağlanmayla ilgili herhangi bir etkileşim çalışması yürütülmemiştir. Cinsiyet hormonu bağlayan globülinin rolü belirlenmemiştir.
Biyotransformasyon:
Fulvestrantın metabolizması tam anlamıyla değerlendirilmemiştir, ancak endojen steroidlerinkine benzer birkaç olası biyotransformasyon yolunu kapsamaktadır (17-keton, sulfon, 3-sulfat, 3- ve 17-glukuronat metabolitleri dahil). Tanımlanmış olan metabolitleri, antiöstrojenik olarak ya daha az aktiftir veya fulvestranta benzer aktivite göstermiştir. İnsan karaciğer preparatlarında ve rekombinant insan enzimleriyle yapılan çalışmalar CYP3A4'ün, fulvestrant oksidasyonunda rol alan tek sitokrom P450 izoformu olduğunu göstermiştir ama sitokrom P450 enzim sisteminin kullanılmadığı metabolik yollar, in vivo olarak daha baskın gözükmektedir. In vitro veriler, fulvestrantın CYP450 izoenzimlerini inhibe etmediği yönündedir.
Eliminasyon:
Fulvestrant başlıca metabolize formda elimine edilir. Majör atılım yolu feçes olup, %1'den azı idrarla atılmaktadır. Fulvestrant 11 ± 1,7 mL/dak/kg değerinde yüksek bir klerense sahip olup, bu durum yüksek hepatik atılım oranına işaret etmektedir. İntramüsküler uygulamadan sonraki terminal yarılanma ömrü (t) absorpsiyon hızı ile yönetilir ve 50 gün olarak tahmin edilmektedir.
Doğrusallık/Doğrusal olmayan durum:
İntramüsküler uygulama sonrası, 50 mg ila 500 mg doz aralığında maruziyet yaklaşık olarak doz ile orantılıdır.
Hastalardaki karakteristik özellikler
Faz 3 çalışmalardan elde edilen verilere ilişkin bir popülasyon farmakokinetiği analizinde fulvestrantın farmakokinetik profilinde yaş (33 ila 89 yıl aralığı), vücut ağırlığı (40-127 kg) veya ırk açısından herhangi bir farklılık tespit edilmemiştir.
Böbrek yetmezliği:
Hafif ile orta derecede böbrek fonksiyon yetmezliği, fulvestrantın farmakokinetiğini klinik olarak anlamlı derecede etkilememiştir.
Karaciğer yetmezliği:
Fulvestrantın farmakokinetiği hafif ila orta derecede karaciğer yetmezliği olan (Child-Pugh sınıf A ve B) kadınlarda yürütülen bir tek doz klinik çalışmasında değerlendirilmiştir. Yüksek doz olarak daha kısa süreli intramüsküler enjeksiyon formülasyonu kullanılmıştır. Sağlıklı gönüllülerle kıyaslandığında karaciğer yetmezliği olan kadınların EAA'larında yaklaşık 2,5 kat artış olmuştur. FASLODEX uygulanan hastalarda, maruziyette bu boyuttaki bir artışın iyi tolere edilmesi beklenmektedir. İleri derecede karaciğer yetmezliği (Child-Pugh sınıf C) olan kadınlar değerlendirilmemiştir.
Pediyatrik popülasyon:
Fulvestrantın farmakokinetiği McCune Albright Sendromu ile ilişkili olarak İlerleyici Erken Gelişmiş Puberte bulunan 30 kız çocuğunda yürütülen bir klinik çalışmada değerlendirilmiştir (Bkz. Bölüm 5.1). Pediyatrik hastaların yaşları 1 ila 8 arasında değişmiş ve aylık olarak 4 mg/kg intramüsküler fulvestrant dozu almışlardır. Geometrik ortalama (standart sapma) sabit durum vadi konsantrasyonu (C, ss) ve AUCss sırasıyla 4,2 (0,9) ng/mL ve 3680 (1020) ng*sa/mL bulunmuştur. Elde edilen veriler sınırlı olsa da fulvestrantın çocuklardaki sabit- durum vadi konsantrasyonları erişkinlerle uyumlu gibi görünmektedir.
5.3. Klinik öncesi güvenlilik verileri
Fulvestrantın akut toksisitesi düşüktür.
FASLODEX ve diğer fulvestrant formülasyonları, hayvan türleri üzerinde yapılan çalışmalarda iyi tolere edilmiştir. Enjeksiyon bölgesinde miyozit ve granülom dahil lokal reaksiyonlar taşıyıcıya bağlanmış; ancak tavşanlarda miyozitin şiddeti, kontrol olarak uygulanan serum fizyolojiğe kıyasla fulvestrant ile artmıştır. Sıçanlarda ve köpeklerde fulvestrantın çok dozlu intramüsküler uygulamaları ile yapılan toksisite çalışmalarında özellikle dişi üreme sisteminde; ancak aynı zamanda her iki cinsiyetin hormonlara duyarlı diğer organlarında görülen etkilerin çoğundan, fulvestrantın antiöstrojenik aktivitesi sorumlu bulunmuştur. Kronik (12 ay) dozlama sonrası bazı köpeklerde farklı dokularında artrit görülmüştür.
Köpekler üzerinde yapılan çalışmalarda oral ve intravenöz uygulamayı takiben kardiyovasküler sistem üzerinde etkiler (EKG'de S-T segmentinin hafifçe yükselmesi [oral] ve bir köpekte sinüs arresti [intravenöz]) görülmüştür. Bunlar, hastalardakinden daha yüksek maruz kalma düzeylerinde ortaya çıkmış (C>15) ve klinik dozda insan güvenliği için sınırlı önem arz etmektedir.
Fulvestrant genotoksik potansiyel göstermemiştir.
Klinik doza yakın dozlarda kullanılan fulvestrant, üreme ve embriyo/fetal gelişim üzerinde, antiöstrojenik aktivitesi ile tutarlı etkiler göstermiştir. Sıçanlarda dişi fertilitesinde ve embriyonik sağkalımda geri dönüşümlü bir azalma, distosi ve tarsal fleksür dahil fetal anomalilerin insidansında artış gözlenmiştir. Fulvestrant verilen tavşanlarda gebelik sona ermiştir. Plasenta ağırlığı ve implantasyon sonrası fetüs kaybında artış görülmüştür.
Tavşanlarda fetal varyasyonların insidansı artmıştır (pelvik kemerde ters dönme ve 27 presakral vertebra).
Sıçanlarda yapılan iki yıllık onkojenisite çalışması (FASLODEX'in intramüsküler uygulanması), yüksek dozlarda, 10 mg/sıçan/15 gün, dişi sıçanların overlerindeki iyi huylu granüloza hücreli tümör insidansında ve erkek sıçanların testis Leydig hücre tümörleri insidansında artış göstermiştir. İki yıllık bir fare onkojenisite çalışmasında (günlük oral uygulama), 150 ve 500 mg/kg/gün dozlarda over seks kord tümörü (hem benin hem de malin) insidansında artış görülmüştür. Bu bulguların etkisizlik seviyesinde, sistemik maruziyet seviyeleri (EAA); sıçanlarda, insanlarda beklenen maruziyetten dişilerde 1,5 kat ve erkeklerde 0,8 kat fazla ve farelerde insanlara oranla, hem dişi hem de erkekte beklenen maruziyet seviyelerinden yaklaşık 0,8 kat fazladır. Bu gibi tümörlerin indüksiyonu, siklüsü olan hayvanlarda antiöstrojenlerin neden olduğu gonadotropin seviyelerindeki farmakoloji ilişkili endokrin geribildirim değişiklikleri ile tutarlıdır. Bu nedenle bu bulguların ilerlemiş meme kanseri olan postmenopozal kadınlarda, fulvestrant kullanımı ile ilişkili olduğu düşünülmemektedir.
Çevresel Risk Değerlendirmesi (ERA)
Çevresel risk değerlendirmesi çalışmaları fulvestrantın akuatik ortam açısından advers etkilere neden olma potansiyeline sahip olabileceğini göstermiştir (Bkz. Bölüm 6.6).
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Etanol %96 Benzil alkolBenzil benzoat Rafine Hintyağı
6.2. Geçimsizlikler
Geçimlilik çalışmaları yapılmadığından, bu tıbbi ürün başka tıbbi ürünler ile karıştırılmamalıdır.
6.3. Raf ömrü
48 ay
6.4. Saklamaya yönelik özel tedbirler
2ºC-8ºC arasında (buzdolabında) saklayınız. Dondurmayınız. Donmuş ürünleri çözüp kullanmayınız.
Işıktan korumak için kullanıma hazır enjektörü orijinal ambalajında saklayınız.
6.5. Ambalajın niteliği ve içeriği
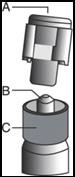
Her biri 5 ml FASLODEX enjeksiyonluk çözelti içeren, emniyetli kapağa sahip bir veya iki adet berrak nötral cam (Tip 1) enjektör.
Enjektörler, polistirenden yapılmış piston çubukları ve her biri enjektöre iliştirilecek iki güvenli iğne (Safety-Glideâ¢) bir tepsi içinde sunulmaktadır.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
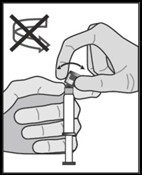
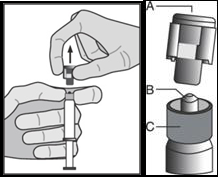
Uygulama talimatı
Enjeksiyonu, yüksek hacimli intramusküler enjeksiyonlar için yerel kılavuzlarda belirtildiği şekilde uygulayın.
Not: Cilt altı siyatik sinirin yakınlığı nedeniyle FASLODEX'in dorsogluteal enjeksiyon bölgesine uygulanması halinde dikkatli olunmalıdır (Bkz. Bölüm 4.4).
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj Atıklarının Kontrolü Yönetmelikâlerine uygun olarak imha edilmelidir.
Kullanma Talimatı
âKullanım şekli ve dozuâ bölümüne bakınız.
Uyarı â Kullanım öncesinde güvenli iğneyi (BD SafetyGlide Koruyucu Hipodermik İğne) otoklavlamayın. Kullanım ve imha sırasında eller daima iğnenin arkasında durmalıdır.
Her iki enjektör için:
| Şekil 1
Şekil 2
Şekil 3 |
Cam enjektör gövdesini, tepsiden alın ve hasar görüp görmediğini kontrol edin.
 Diyabet Hastalığı
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır.
Diyabet Hastalığı
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |
 HIV ve Aids
HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan
Virüsdür). Bu virüs AIDS hastalığına sebep olur.
HIV ve Aids
HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan
Virüsdür). Bu virüs AIDS hastalığına sebep olur. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| FUXRAN | 8681428951321 | 5,100.13TL |
| ULVEST | 8699638755776 | 3,680.31TL |
| Diğer Eşdeğer İlaçlar |
 |
Dış Gebelik Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur. |
 |
Sırt Ağrısı Sırt ağrısı birden bire ortaya çıkıp şiddetli (akut) olabilir veya zamanla gelişip daha uzun süreli sorunlara (kronik) neden olabilir. |
 |
Kolon, Rektum yada Bağırsak Kanseri Bağırsak kanseri kolon veya rektumda (arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir şekilde tedavi edilir. |
İLAÇ GENEL BİLGİLERİ
AstraZeneca Türkiye İlaç Sanayi ve Ticaret Ltd.Şti.
| Satış Fiyatı | TL |
| Önceki Satış Fiyatı | |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699786950023 |
| Etkin Madde | Fulvestrant |
| ATC Kodu | L02BA03 |
| Birim Miktar | 250+5 |
| Birim Cinsi | MG/ML |
| Ambalaj Miktarı | 1 |
| Antineoplastik ve İmmünomodülatör Ajanlar > Hormon Antagonistleri > Fulvestrant |
| İthal ( ref. ülke : Fransa ) ve Beşeri bir ilaçdır. |