CRINONE %8 jel Kısa Ürün Bilgisi
{ Progesteron }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
CRINONE %8 vajinal jel
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her vajinal aplikatör etkin madde olarak 90 mg progesteron (%8 ağırlık/ağırlık) içerir.
Yardımcı maddeler
0,9 mg sorbik asitDiğer yardımcı maddeler için bölüm 6.1'e bakınız.
3. FARMASÖTİK FORMU
Beyaz polietilen vajinal aplikatör içerisinde beyaz ile beyazımsı vajinal jel
Kalın uç
Göğüste veya genital organlarda bilinen veya şüphelenilen progesteron-duyarlı malignansi.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Luteal faz yetmezliğine bağlı infertilite
4.2. Pozoloji ve uygulama şekli
Pozoloji/ uygulama sıklığı ve süresi:CRINONE ile intravajinal tedavi, spesifik endikasyona ve her hastanın terapötik cevabına göre ayarlanmalıdır. En düşük etkin doz uygulanmalıdır.
CRINONE'un, endometriyumda sekretuvar bir transformasyonu endüklemek üzere vajinal yoldan uygulanması ancak endometriyum endojen veya eksojen estrojen ile yeterli ölçüde hazırlanmışsa endikedir. Bu gibi vakalarda, gebelik meydana gelmemişse CRINONE tedavisinin kesilmesinden sonraki 3-7 gün içinde kesilme kanaması meydana gelir.
CRINONE, intravajinal olarak uygulanır. CRINONE her gün aynı saatte uygulanmalıdır. Bir CRINONE dozu unutulduğunda hatırlar hatırlamaz, o doz hemen uygulanmalı ve önceki programa göre uygulamaya devam edilmelidir. Önerilen günlük dozdan fazlası uygulanmamalıdır.
Luteal faz yetmezliğine bağlı infertilite tedavisi:
Dokümante edilmiş ovülasyonun ardından veya isteğe bağlı olarak, siklusun 18 ila 21. gününden başlayarak her gün bir uygulama (1.125 g % 8 jel).
İnvitro fertilizasyon (IVF) sırasında kullanım:
Laboratuvar testleri ile gebelik gösterilmişse, 30 gün boyunca, günlük Crinone %8 Jel uygulaması sürdürülmelidir.
Uygulama şekli:
Doktorunuz başka bir öneride bulunmadı ise günde tek doz, sabahları kullanımı önerilir.
Kullandıktan sonra yatarak istirahate gerek yoktur. Aksine günlük aktiviteler ilacın dağılımını olumlu etkileyeceğinden vajinada birikim ihtimali azalacaktır.
Vajinal kullanım için özel tasarlanmış aplikatörü ile dokuya zarar vermeden uygulanır.
CRINONE'u kendinize uygulamadan önce, lütfen aşağıdaki talimatları dikkatlice okuyunuz: Aplikatörünüzün görünüşü:
Hava bölmesi
Kalın ucun düz tarafı
İnce uç
4.3. Kontrendikasyonlar
CRINONE formülasyonunun bileşenlerinden herhangi birine karşı bilinen hassasiyet.
Akut porfiri
4.4. Özel kullanım uyarıları ve önlemleri
CRINONE ile trombotik bozukluklar bildirilmemiştir. Bununla birlikte, bazı araştırmalarda, hormon replasman tedavisine bağlı olarak tromboflebit ve/veya tromboembolik bozukluklarda bir artış riski bildirilmiştir. Hormon replasman tedavisi sırasında hekim, trombotik bozukluklar (tromboflebit, retinal tromboz, serebral embolizm ve pulmoner embolizm dahil) olasılığına karşı dikkatli olmalı ve bunların erken belirtilerine karşı hazır bulunmalıdır. Bunlardan herhangi birinin meydana gelmesi veya şüphelenilmesi halinde hormon replasman tedavisi hemen kesilmelidir. Trombotik bozukluklara ilişkin risk faktörü taşıyan hastalar dikkatle gözlenmelidir.
Tromboembolizm riski estrojenler ile bağlantılı olmasına rağmen, progestinler ile bir bağlantı halen tartışmalıdır. Bu nedenle, kişisel veya aile öyküsü gibi tromboembolik olaylar için genel kabul görmüş risk faktörleri olan kadınlarda, Crinone tedavisi mevcut riski daha da artırabilir. Bu kadınlarda, Crinone uygulamasının yararlarının risklere karşı değerlendirilmesi gerekir. Ancak gebeliğin kendisinin de tromboembolik olay riski taşıdığı unutulmamalıdır.
Tedavi öncesi ve sırasında periyodik muayenelerde tıbbi anamnez ve fiziki muayenede özellikle göğüsler ve pelvik organlar üzerinde durulmalı ve bir Papanicolaou smear (simir) alınmalıdır.
CRINONE ciddi karaciğer yetmezliği olan hastalarda dikkatle kullanılmalıdır.
Bütün düzensiz vajinal kanama vakalarında olduğu gibi ara kanama vakalarında işlevsel olmayan nedenler düşünülmelidir. Tanı konmamış vajinal kanama durumlarında, uygun diyagnostik incelemeler yapılmalıdır.
Crinone düşük tehditlerinde endike değildir. Düşük durumunda tedavi durdurulmalıdır. Progestojenler bir ölçüde sıvı tutulmasına neden olabilecekleri için bu faktörden etkilenebilecek epilepsi, astım, migren ve kalp veya böbrek fonksiyon bozukluğu gibi hastalıkları olan kadınların dikkatle gözlem altında tutulması gerekir.
Depresyon geçmişi olan hastalar dikkatle gözlenmeli ve depresyon ciddi bir ölçüde tekrar ortaya çıkarsa CRINONE kesilmelidir.
Azalan glukoz toleransı, estrojen-progestin kombine ilaçları kullanan hastalarda az sayıda görülmüştür. Bu düşüşün mekanizması bilinmemektedir. Bu nedenle, diyabetik hastalar progestin tedavisi alırken dikkatli bir şekilde izlenmelidir.
Progestojenlerle tedavi, postmenopozal semptomların ortaya çıkışını maskeleyebilir. Progestojenlerin endometriyum gibi organların yapısında ve patolojisindeki etkisi nedeniyle
ilgili numuneler verilen patologlara, progestojen tedavisi uygulandığı söylenmelidir.
Progestojenler önceden mevcut porfiriya belirtilerini kötüleştirebilir. Bu nedenle, bu gibi hastalarda CRINONE kullanılması önerilmez.
Yardımcı madde olarak kullanılan sorbik asit lokal deri reaksiyonlarına (kontak dermatit gibi) ya da vajinal irritasyona sebebiyet olabilir.
Mutajenez ve Karsinojenez: Doğal progesteronun karsinojenik ve mutajenik potansiyeli tespit edilmemiştir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Diğer ilaçlarla hiç bir etkileşimi bildirilmemesine rağmen, CRINONE'un diğer intravajinal preparatlarla birlikte kullanılması önerilmemektedir. Eğer aynı anda başka bir antivajinal tedavi kullanılacaksa, uygulamadan en az 6 saat önce ya da sonra olmalıdır. Kullanımdan birkaç gün sonra bile, olası jel birikiminden ötürü, vajinal boşalma gibi küçük beyaz globüller görülebilir. Hastaya vajinal yolla antifungal bir tedavi uygulanıyorsa oral tedaviye geçilmesi önerilir.
CYP3A4 indükleyiciler ile oral progesteronlar arasında serum progesteron seviyelerinin düşmesi ile sonuçlanan etkileşime ait bulgu olmasına rağmen CYP3A4 indükleyiciler ile tekrarlayan CRINONE vaginal jel uygulaması sonucunda progesteron seviyelerinde anlamlı değişiklik beklenmemektedir.
Laboratuvar testleri etkileşimleri: CRINONE'un laboratuvar testleri üzerinde herhangi bir etkisinin olup olmadığı bilinmemektedir.
Özel popülasyonlara ilişkin ek bilgiler Pediyatrik popülasyon
CRINONE çocuklarda kullanıma yönelik değildir.
Geriyatrik popülasyon
CRINONE yaşlılarda kullanıma yönelik değildir.
4.6. Gebelik ve laktasyon
:Gebelikte kullanım kategorisi: B
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon):
Geçerli değildir.
Gebelik Dönemi
Korpus luteum eksikliğinde, CRINONE gebeliğin ilk haftasında kullanılabilir. Sınırlı sayıda maruz kalmış gebelik verileri, CRINONE'nun gebelik veya fetus / yeni doğan çocuk sağlığı üzerine herhangi bir advers etki göstermemiştir. Bugüne kadar ilgili başka herhangi bir epidemiyolojik veri mevcut değildir. Hayvanlar üzerinde yapılan çalışmalar embriyonal/fetal gelişim ile ilgili olarak doğrudan ya da dolaylı zararlı etkiler olduğunu göstermemektedir (Bkz. Bölüm 5.3).
Gebe kadınlara reçete edilirken dikkatli olunmalıdır.
CRINONE kullanımı, tekrarlayan düşük veya düşük tehlikesinde endike değildir.
Laktasyon Dönemi
Progestojenler, bu ilaçları alan annelerin sütünde tespit edildikleri için laktasyonda kullanımları önerilmemelidir.
Üreme yeteneği / fertilite
CRINONE infertilitede kullanım için endikedir (bkz. bölüm 4.1).
4.7. Araç ve makine kullanımı üzerindeki etkiler
i
CRINONE'un araç ve makine kullanma yeteneği üzerine etkisi yoktur.
4.8. İstenmeyen etkiler
CRINONE genellikle iyi tolere edilmektedir. Klinik araştırmalarda, CRINONE tedavisi sırasında aşağıdaki advers etkiler bildirilmiştir:
İstenmeyen etkiler herbir sıklık grubu içinde, azalan ciddiyetine göre sunulmaktadır.
Çok yaygın (≥1/10); yaygın (≥1/100 ila ≤1/10); yaygın olmayan (≥1/1.000 ila ≤1/100); seyrek (≥1/10.000 ila ≤1/1.000); çok seyrek (≤1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
İyi huylu ve kötü huylu neoplazmalar | |
Çok seyrek: | İyi huylu kist |
Kan ve lenf sistemi hastalıkları | |
Yaygın olmayan: | Purpura, anemi |
Bağışıklık sistemi hastalıkları Yaygın: İdrar yolu enfeksiyonu | |
Yaygın olmayan: | Enfeksiyon, farenjit, sinüzit, üst solunum yolu enfeksiyonları |
Metabolizma ve beslenme hastalıkları | |
Yaygın olmayan: | Susuzluk, ağız kuruluğu, terlemede artış |
Sinir sistemi hastalıkları | |
Çok yaygın: | Baş ağrısı, depresyon, ruhsal durumda değişkenlik, sinirlilik, somnolans |
Yaygın: | Unutkanlık, baş dönmesi |
Yaygın olmayan: | Migren, tremor, insomnia, iritabilite |
Göz hastalıkları |
|
Yaygın olmayan: | Göz kuruluğu, konjonktivit |
Kardiyak hastalıklar | |
Yaygın olmayan: | Baygınlık |
Solunum, göğüs hastalıkları ve mediastinal hastalıklar | |
Yaygın olmayan: | Astım, nefes darlığı, göğüslerin büyümesi, hiperventilasyon, rinit |
Gastrointestinal hastalıklar | |
Yaygın: | Kusma, kabızlık, diyare, şişkinlik, mide bulantısı |
Yaygın olmayan: | Dispepsi, geğirti, diş ağrısı, mide ağrısı |
Deri ve deri altı doku hastalıkları | |
Yaygın: Genital prüritis, genital moniliazis | |
Yaygın olmayan: | Döküntü, deride renk değişikliği, deri bozuklukları, ürtiker, kepeklenme, akne |
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları | |
Yaygın: | Artralji, bacaklarda kramp, bacak ve eklem ağrısı |
Çok seyrek: | Miyalji |
Böbrek ve idrar yolu hastalıkları | |
Yaygın: | Disparöni, noktüri, sistit |
Yaygın olmayan: | Disüri, sık idrara çıkma, lökore |
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar | |
Çok yaygın: | Yorgunluk, perineal ağrı, memelerde şişkinlik/hassasiyet |
Yaygın: | Sırt ağrısı, karın ağrısı, vajinal akıntı, vajinal sekresyonda artma, alerji, cinsel arzunun azalması, vajinal kuruluk |
Yaygın olmayan: | Alerjik reaksiyon, iştah azalması, asteni, ödem, yüz ödemi, sıcak basması, ateş, su tutulması, vajinal kanama/lekelenme, premenstürel sendrom, dismenore, laktasyon, grip benzeri semptomlar |
Pazarlama sonrası raporlar
Pazarlama sonrasında tespit edilen advers reaksiyonlarda sıklık bilinmemektedir (mevcut verilerle tahmin edilememektedir).
Ayrıca, intermenstrüel kanama (lekelenme), vajinal irritasyon, genellikle deride kaşıntı gibi kendini gösteren aşırı hassasiyet reaksiyonları ve diğer hafif uygulama yeri reaksiyonları pazarlama sonrası rapor edilmiştir.
Yukarıdaki bütün olaylarla CRINONE tedavisinin ilişkisi bilinmemektedir. Çoğu istenmeyen etki hafif ve geçicidir ve CRINONE tedavisinin sürdürülmesi ile ortadan kalkmaktadır.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovilijans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
CRINONE ile ilgili hiç bir doz aşımı raporu alınmamıştır. Progesteronun, vajinal epitelyumdan konsantrasyona bağımlı, sınırlı hızdaki absorpsiyonu ile formülasyonun kontrollü salınım özellikleri nedeniyle, bu üründe akut doz aşımı olası değildir.
Bununla birlikte doz aşımı durumunda CRINONE'un kesilmesi ve hastanın semptomatik olarak tedavi edilmesi gerekir.
Kapak
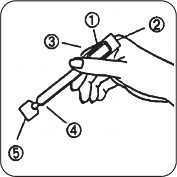
Aplikatörünüzün kullanıma hazırlanışı:
Tromboflebit, tromboembolik bozukluklar, serebral apopleksi veya bu bozukluklara ilişkin hikayesi olan hastalar.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Ürogenital sistem ve cinsiyet hormonları, cinsiyet hormonları ve genital sistem modülatörleri, progestogenler, pregnen (4) türevleri, progesteron
ATC kodu: G03DA04
Progesteron, estrojenle uyarılmış endometriyumun, döllenmiş yumurtayı kabul edebilir sekretuvar endometriyum haline dönüşmesinde ve daha sonra embriyonun gelişiminin ilk aşamalarında emplantasyonun sürdürülmesinde önemli bir rol oynar. Corpus luteum, doğal progestojen olan progesteronun primer kaynağıdır; plasenta, gebeliğin sürdürülmesini sağlamak üzere progesteron salgılamayı sürdürür. Progesteron, memenin glandüler oluşumlarını stimüle eder, servikal mukusu kalınlaştırır ve vücut sıcaklığını yükseltir. Aldosteron salgısında bir artışa yol açacak şekilde mineralo kortikoidlerin sodyum tutma etkilerini antagonize eder.
Menopozdan sonra ovarian estradiol salgısının kaybı; uyku bozukluğu ve aşırı terleme, ürogenital atrofi, disparoni ve üriner inkontinans ile birlikte sıcak basmalarına neden olan termoregülasyon instabilitesi ile sonuçlanabilir. Estrojen replasman tedavisi, menopoz devresindeki kadında estradiol eksikliğine bağlı birçok semptomu giderir.
Progestojenlerin, estrojen replasman tedavisiyle birlikte devresel kullanımı, estrojenlerin, endometriyumun sekretuvar dönüşümüne neden olan uyarıyı önler ve progesteronun kesilmesi, endometrial tabakanın parçalanarak atılmasına ve vajinal kanamaya neden olur. Progestojen tedavisi, endometrial kanser riskinde bir azalmayla sonuçlanır.
Estrojen replasman tedavisine oral bir progestojenin eklenmesi, estrojen tedavisinin lipidler üzerindeki faydalı etkilerini azaltabilir. Bu nedenle, bu değişiklikleri en aza indirmek için progestojen seçimi önemli olabilir. Doğal progesteron, HDL-C veya alt-fraksiyonlarını etkilememektedir.
İntravajinal olarak uygulanan progesteron, estrojenin rahim arterlerinde endüklediği vasküler direnç azalmasını sadece minimal ölçüde tersine dönüştürmektedir.
Disfonksiyonel rahim kanaması veya sekonder amenoreye neden olabilecek hormon dengesizliği, eksojen progesteron ile düzeltilebilir.
5.2. Farmakokinetik özellikler
Emilim: Progesteron vajinal jel, vajinal mukozaya bağlanan ve en az üç gün uzatılmış progesteron salınımı sağlayan bir polikarbofil uygulama sisteminden oluşmaktadır.
Ortalama yarı ömrü (t½) (25-50 saat), CRINONE'un farmakokinetiğinin, CRINONE'dan progesteron absorpsiyonunun nispeten yavaş olduğunu yansıtmaktadır.
Dağılım: Vajinal uygulama ile, transvajinal yoldan uterusa öncelikli dağılım ve karaciğerde ilk- geçiş metabolizasyonu aşamasının olmaması sonucunda, ilacın etki bölgesi olan uterus dokularında progesteronun yüksek biyoyararlanımına yol açabilir (âUterusda İlk Geçiş Etkisiâ).
Biyotransformasyon: Progesteron esas olarak karaciğerde metabolize olur.
Eliminasyon: Progesteron hem safra yolu ile (%10), hem de renal (%50-60) yolla atılır. Progesteronun en önemli üriner metaboliti, 5Ã-pregnan-3ï¡-20ï¡-diol glukuroniddir.
5.3. Klinik öncesi güvenlilik verileri
Tavşanlarda CRINONE'un deri değil, göz tahriş edici etkisi saptanmıştır.
5 gün süreyle günde 2 ml % 8 jel uygulama sonrası tavşanlarda orta derecede vajinal irritasyon oluşmuştur.
Hayvanlarda yürütülen teratojenisite/embriyotoksisite çalışmaları doğal progesteron tedavisinden sonra konjenital bozukluk riski olduğunu göstermemiştir
Atlanmış düşük
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Gliserin,
Hafif sıvı parafin,
Hidrojene hurma yağı gliseridi, Karbopol 974P,
Sorbik asit, Polikarbofil Sodyum hidroksit Saf su
6.2. Geçimsizlikler
Bilinen kontraseptif aletlerle geçimsizliği bulunmadı.
Raf-ömrü
36 ay.
6.4. Saklamaya yönelik özel tedbirler
25ï°C'nin altındaki oda sıcaklıklarında ve ambalajında saklayınız.
6.5. Ambalajın niteliği ve içeriği
İntravajinal uygulama için dizayn edilmiş, tek kullanımlık, bir parça, ucu bükülebilir beyaz polietilen aplikatör.
Her bir aplikatör 1.45 g jel içerir ve 1.125 g jel taşır. Her biri sarılmış ve kağıt / aluminyum / polietilen folyo ile kapatılmıştır.
Her bir CRINONE %8 vajinal jel ambalajı 15 aplikatör içerir.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller "Tıbbi Ürünlerin Kontrolü Yönetmeliği" ve "Ambalaj Atıklarının Kontrolü Yönetmeliği"ne uygun olarak imha edilmelidir.
 HIV ve Aids
HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan
Virüsdür). Bu virüs AIDS hastalığına sebep olur.
HIV ve Aids
HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan
Virüsdür). Bu virüs AIDS hastalığına sebep olur. |
 Depresyonu Anlamak
Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel
olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur?
Depresyonu Anlamak
Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel
olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur? |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| CYCLOGEST | 8699708900280 | |
| FERGIPRO | 8699844772345 | |
| LUTINIS | 8697621100435 | 743.54TL |
| PROGESTAN | 8699828190189 | 185.39TL |
| PROGYNEX | 8699828340041 | |
| Diğer Eşdeğer İlaçlar |
 |
Depresyonu Anlamak Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur? |
 |
Diyabet Hastalığı Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |
 |
Rahim Boyu ( Serviks ) Kanseri Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir. |
İLAÇ GENEL BİLGİLERİ
Merck İlaç Ecza ve Kimya Ticaret AŞ
| Geri Ödeme Kodu | A02046 |
| Satış Fiyatı | 699.59 TL [ 26 Apr 2024 ] |
| Önceki Satış Fiyatı | 699.59 TL [ 22 Apr 2024 ] |
| Original / Jenerik | Jenerik İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699777342035 |
| Etkin Madde | Progesteron |
| ATC Kodu | G03DA04 |
| Birim Miktar | |
| Birim Cinsi | |
| Ambalaj Miktarı | 1 |
| Ürogenital Sistem ve Cinsiyet Hormonları > PROGESTERONLAR > Progesteron |
| İthal ( ref. ülke : Yunanistan ) ve Beşeri bir ilaçdır. |