CERVARIX 0.5 ml IM enjeksiyon için süspansiyon içeren kullanıma hazır 1 enjektör Farmasötik Özellikler
{ Hpv Tip 6l1 Protein + Hpv Tip 18l1 Protein }
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Sodyum klorür
Sodyum dihidrojen fosfat dihidrat Enjeksiyonluk su
AS04 adjuvanı içeriğinde:
3-O-desasil-4' â monofosforil lipid A (MPL)
Alüminyum hidrokside adsorbe edilmiş, hidrate (Al (OH))
6.2. Geçimsizlikler
Bu tıbbi ürüne ait geçimlilik çalışmaları olmadığından diğer tıbbi ürünlerle karıştırılarak kullanılmamalıdır.
6.3. Raf ömrü
48 aydır.
CERVARIX buzdolabından çıkartıldıktan sonra mümkün olan en kısa sürede uygulanmalıdır. Bununla birlikte, üretilen stabilite verileri CERVARIX'in buzdolabının dışında 8°C ile 25°C arasındaki sıcaklıklarda üç güne kadar ya da 25°C ile 37°C derece arasındaki sıcaklıklarda bir güne kadar saklanması halinde stabil kaldığını ve aşının uygulanabileceğini göstermektedir. Bu koşullarda belirtilen sürelerin aşılması halinde aşı kullanılmamalıdır. Bu aşının bu parametreler dışında saklanmış olması halinde firmamız ile irtibata geçiniz.
6.4. Saklamaya yönelik özel tedbirler
2ºC - 8ºC arası sıcaklıklarda (buzdolabında) saklayınız. Dondurmayınız. Donmuş ürünü çözüp kullanmayınız. Ambalajında, ışıktan koruyarak saklayınız.
6.5. Ambalajın niteliği ve içeriği
Kutuda; bütil kauçuk tıpalı 1,25 ml'lik tek dozluk ambalajlarda kullanıma hazır 1 adet cam
enjektör+iğne
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Depolama sırasında kullanıma hazır şırınga içinde berrak renksiz süpernatant ile birlikte ince beyaz çökelti gözlenebilir. Bu durum bozulma belirtisi değildir.
Uygulama öncesi, şırınga içeriği çalkalanmadan önce ve çalkalandıktan sonra herhangi bir partikül oluşumu ve/veya anormal fiziksel görüntü yönünden görsel olarak kontrol edilmelidir.
Herhangi birinin varlığı gözlendiğinde aşı imha edilmelidir. Aşı kullanılmadan önce iyice çalkalanmalıdır.
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve
âAmbalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğiâne uygun olarak imha edilmelidir. Kullanıma hazır enjektör içindeki aşının uygulanmasına yönelik talimatlar
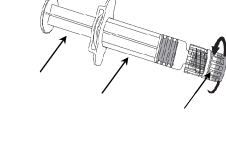
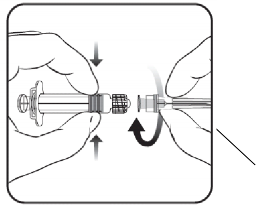
Enjektörün gövdesini bir elinizde tutup (pistonu tutmayınız) enjektör kapağını saat yönünün tersine çevirerek açınız.
Enjektör pistonu
19
Enjektör gövdesi
Enjektör Kapağı
İğne kılıfı
 Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir.
Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir. |
 Artrit
Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında artrit tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur.
Artrit
Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında artrit tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
 |
Şizofrenlik Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler hakkında bilgi verecektir. |
 |
HIV ve Aids HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan Virüsdür). Bu virüs AIDS hastalığına sebep olur. |
 |
Deri Kanseri Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör. |
İLAÇ GENEL BİLGİLERİ
Glaxo Smith Kline İlaçları San.Ve Tic.A.Ş
| Satış Fiyatı | 2756.16 TL [ 2 Feb 2026 ] |
| Önceki Satış Fiyatı | 2756.16 TL [ 26 Jan 2026 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699522967544 |
| Etkin Madde | Hpv Tip 6l1 Protein + Hpv Tip 18l1 Protein |
| İthal ( ref. ülke : Fransa ) ve Beşeri bir ilaçdır. |