AUGMENTIN BID 200/28 oral süspansiyon haz. için kuru toz 100 ml Kısa Ürün Bilgisi
{ Amoksisilin + Klavulanik Asit }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
AUGMENTİN BID 200 mg+28 mg/5 mL oral süspansiyon hazırlamak için kuru toz
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her 5 mL'de:
Amoksisilin (229,58 mg amoksisilin trihidrat olarak) 200 mg
*Klavulanik asit (33,95 mg potasyum klavulanat olarak). 28,5 mg
*üretiminde inek sütünden elde edilen hammadde kullanılmaktadır.
Yardımcı maddeler
Her 5 mL'de: Aspartam 12,50 mg
Portakal esansı (610271E) 15,00 mg
Portakal esansı (9/027108). 11,25 mg
Ahududu esansı 22,50 mg
Golden şurup esansı (052927/Ap0551). 23,75 mg
Yardımcı maddeler için Bölüm 6.1'e bakınız.
3. FARMASÖTİK FORMU
Süspansiyon hazırlamak için kuru toz.
Beyaz-kirli beyaz serbest akışlı toz içeren berrak cam şişe.
Sulandırıldığında karakteristik kokuya sahip beyaz-kirli beyaz bir süspansiyon oluşur. Bekledikçe yavaşça beyaz bir çökelti oluşturan beyaz-kirli beyaz bir süspansiyon meydana gelir.
Emniyet bandını çıkarınız.
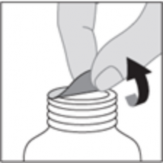
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
AUGMENTİN, lokal resmi antibiyotik reçeteleme kılavuzları ve duyarlılık verilerine uygun olarak kullanılmalıdır.
AUGMENTİN, aşağıdaki sistemlerde amoksisiline dirençli beta laktamaz üreten suşların neden olduğundan şüphelenilen bakteriyel enfeksiyonların kısa süreli tedavisinde endikedir. Diğer durumlarda sadece amoksisilin düşünülmelidir.
Üst Solunum Yolu Enfeksiyonları (KBB dahil): Tekrarlayan tonsillit, akut bakteriyel sinüzit, akut otitis media.
4.2. Pozoloji ve uygulama şekli
Dozlar, her bir bileşen olarak belirtilen dozlar dışında, amoksisilin/klavulanik asit içeriğine göre tanımlanır.
Bir enfeksiyonu tedavi etmek için seçilen AUGMENTİN dozu için aşağıdaki maddeler dikkate alınmalıdır:
Beklenen patojenler ve bu patojenlerin antibakteriyel ajanlara karşı olası duyarlılıkları (bkz. Bölüm 4.4)
4.3. Kontrendikasyonlar
Etkin madde
AUGMENTİN, diğer beta-laktam ajanlara karşı (örn. sefalosporin, karbapenem veya monobaktam) aşırı duyarlılık hikayesi (örn. anafilaksi) olanlarda kontrendikedir.
Geçmişinde AUGMENTİN'e bağlı sarılık/karaciğer fonksiyon bozukluğu hikayesi olan hastalarda kontrendikedir (bkz. Bölüm 4.8).
4.4. Özel kullanım uyarıları ve önlemleri
AUGMENTİN ile tedaviye başlanmadan önce geçmişinde penisilin, sefalosporin veya diğer beta laktam ajanlara karşı aşırı duyarlılık hikayesi varlığı dikkatlice sorgulanmalıdır (bkz. Bölüm 4.3 ve 4.8).
Penisilin tedavisi alan hastalarda ciddi ve bazen öldürücü aşırı duyarlılık reaksiyonları (anafilaktoid ve şiddetli kutanöz advers reaksiyonlar dahil) bildirilmiştir. Bu reaksiyonların, geçmişinde penisiline karşı aşırı duyarlılık hikayesi olan ve atopik bireylerde görülmesi daha olasıdır. Bir alerjik reaksiyon meydana gelirse AUGMENTİN tedavisi sonlandırılmalı ve uygun alternatif bir tedaviye başlanmalıdır.
Bir enfeksiyonun amoksisiline duyarlı organizma/organizmalara bağlı olduğu kanıtlanırsa, resmi kılavuzlara göre amoksisilin/klavulanik asitten amoksisiline geçiş göz önünde bulundurulmalıdır.
AUGMENTİN'in bu formu, klavulanik asit inhibisyonuna duyarlı beta laktamazların aracılık etmediği beta laktam ajanlara dirençli, olası patojenlerin yüksek riski söz konusu ise kullanıma uygun değildir. Bu form, penisiline dirençli S. pneumoniae tedavisinde kullanılmamalıdır.
Böbrek fonksiyonunda bozukluk olan veya yüksek dozlar alan hastalarda konvülsiyonlar görülebilir (bkz. Bölüm 4.8).
Amoksisilin kullanımını takiben görülen kızamık benzeri döküntü enfeksiyöz mononükleoz ile ilişkili olabileceğinden, eğer enfeksiyöz mononükleoza ilişkin bir şüphe var ise AUGMENTİN tedavisinden kaçınılmalıdır.
Amoksisilin ile eş zamanlı olarak allopurinol kullanılması alerjik cilt reaksiyonu olasılığını arttırabilir.
Uzun süreli kullanım zamanla duyarlı olmayan organizmaların aşırı çoğalmasına neden olabilir.
Tedavinin başında püstüllerle birlikte ateşli bir genel eritemin oluşması akut jeneralize eksantematöz püstülozun (AGEP) bir semptomu olabilir (bkz. Bölüm 4.8). Bu reaksiyon AUGMENTİN tedavisinin sonlandırılmasını gerektirir ve daha sonraki amoksisilin kullanımını kontrendike hale getirir.
Amoksisilin/klavulanik asit karaciğer fonksiyon bozukluğu bulgusu olan hastalarda dikkatle kullanılmalıdır (bkz. Bölüm 4.2, 4.3 ve 4.8).
Karaciğer olayları daha çok erkeklerde ve yaşlı hastalarda bildirilmiştir ve uzun süreli tedaviyle ilişkili olabilir. Bu olaylar çocuklarda nadiren bildirilmiştir. Tüm popülasyonlarda belirti ve semptomlar, genellikle tedavi sırasında ya da tedaviden kısa süre sonra ortaya çıkar ancak bazı vakalarda tedavinin kesilmesinin ardından birkaç haftaya kadar belirgin hale gelmeyebilir. Bunlar genellikle geri dönüşlüdür. Hepatik olaylar ciddi olabilir ve son derece nadir koşullarda ölümler bildirilmiştir. Bunlar hemen her zaman altta yatan ciddi hastalığı olanlarda ya da eş zamanlı olarak karaciğer üzerinde etkili olma potansiyeli bilinen ilaçları kullananlarda meydana gelmiştir (bkz. Bölüm 4.8).
Amoksisilin dahil neredeyse tüm antibakteriyel ajanlarla, antibiyotiğe bağlı kolit bildirilmiştir ve şiddeti hafiften yaşamı tehdit edici boyuta kadar değişebilir (bkz. Bölüm 4.8). Bu nedenle, herhangi bir antibiyotik tedavisi sırasında veya sonrasında ishal olan hastalarda bu teşhisin değerlendirilmesi önemlidir. Antibiyotiğe bağlı kolit gözlendiğinde, amoksisilin/klavulanik asit tedavisi derhal kesilmeli, bir doktor tarafından değerlendirilmeli ve uygun tedavi başlatılmalıdır. Bu durumda anti-peristaltik ilaçlar kontrendikedir.
Uzun süreli tedavi sırasında renal, hepatik ve hematopoetik fonksiyon dahil, organ sistem fonksiyonlarında periyodik değerlendirme tavsiye edilir.
AUGMENTİN ve oral antikoagülan kullanan bazı hastalarda seyrek olarak protrombin zamanında uzama (INR değerinde yükselme) bildirilmiştir. Antikoagülanlar ile birlikte reçete edildiğinde uygun şekilde izlenmesi gereklidir. İstenilen antikoagülasyon düzeyini sürdürebilmek için oral antikoagülasyon dozunda ayarlama yapılması gerekebilir (bkz. Bölüm 4.5 ve 4.8).
Böbrek bozukluğu olan hastalarda doz, böbrek bozukluğunun derecesine uygun şekilde ayarlanmalıdır (bkz. Bölüm 4.2).
Azalmış idrar çıkışı olan hastalarda, özellikle parenteral tedavide, çok seyrek olarak kristalüri görülmüştür. Yüksek doz amoksisilin tedavisi sırasında, amoksisilin kristalüri olasılığını azaltmak için, uygun miktarda sıvı alınması ve idrar miktarının düzenlenmesi tavsiye edilebilir. Mesane kateterleri olan hastalarda düzenli olarak açıklık kontrolü yapılmalıdır (bkz. Bölüm 4.9).
Amoksisilinle tedavi sırasında idrarda glukozun arandığı testler yapıldığında, enzimatik glukoz oksidaz yöntemleri kullanılmalıdır çünkü enzimatik olmayan yöntemlerde yalancı pozitif sonuçlar görülebilir.
Amoksisilin/klavulanik asit alan ve daha sonra Aspergillus enfeksiyonunun bulunmadığı saptanan hastalarda Bio-Rad Laboratuarları Platelia Aspergillus EIA testi kullanıldığında pozitif test sonuçları bildirilmiştir. Bio-Rad Laboratuarları Platelia Aspergillus EIA testi ile Aspergillus-
dışı polisakkaridler ve polifuranozlar arasında çapraz reaksiyonlar bildirilmiştir. Bu nedenle amoksisilin/klavulanik asit alan hastalardaki pozitif test sonuçları dikkatli yorumlanmalı ve başka tanı yöntemleriyle doğrulanmalıdır.
Yardımcı maddeler
Bu tıbbi ürün, 5 mL'de 12,5 mg aspartam içerir ve bu fenilalanin için bir kaynaktır. Bu nedenle, fenilketonürili hastalarda dikkatli kullanılmalıdır. 12 haftadan küçük bebeklerde aspartam kullanımını değerlendirme için klinik veriler ve klinik olmayan veriler mevcut değildir.
Bu tıbbi ürünün formülasyonunda yer alan tatlandırıcılar maltodekstrin (glukoz) ve benzil alkol (0,00124 mg/ml) içerir. Nadir glukoz-galaktoz malabsorpsiyon hastalığı olan hastaların bu ilacı kullanmamaları gerekir. Benzil alkol, alerjik reaksiyonlara neden olabilir. Benzil alkolün intravenöz uygulaması, yeni doğanlarda ciddi yan etkiler ve ölümle ilişkilendirilmiştir (nefes darlığı sendromu). Toksisitenin oluşabileceği minimum benzil alkol miktarı bilinmemektedir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Oral antikoagülanlar:
Oral antikoagülanlar ve penisilin antibiyotikleri aralarında herhangi bir etkileşim raporlanmadan pratikte yaygın olarak kullanılmıştır. Buna karşın, literatürde, asenokumarol veya varfarin kullanan ve bir kür amoksisilin tedavisi verilen hastalarda uluslararası normalleştirilmiş oran (INR) değerinde yükselme görülen vakalar bildirilmiştir. Eğer birlikte kullanılması gerekli ise, amoksisilin kullanımının başlatılması veya bırakılması sürecinde protrombin zamanı veya INR değeri dikkatle takip edilmelidir. Ayrıca, oral antikoagülanların dozunda ayarlamalar gerekebilir (bkz. Bölüm 4.4 ve 4.8).
Metotreksat:
Penisilinler metotreksatın atılımını azaltabilir ve bu durum toksisitede potansiyel bir artışa neden olur.
Probenesid:
Probenesid ile birlikte kullanımı önerilmemektedir. Probenesid, amoksisilinin renal tübüler sekresyonunu azaltır. Probenesidin AUGMENTİN ile birlikte kullanımı amoksisilinin kan seviyelerinin artışına ve kanda bulunma süresinin uzamasına neden olabilirken, bu durum klavulanik asit için görülmez.
Mikofenolat mofetil:
Mikofenolat mofetil alan hastalarda, oral amoksisilin ve klavulanik asit başlatılmasını takiben aktif metabolit mikofenolik asidin doz öncesi konsantrasyonunda yaklaşık %50'lik bir azalma bildirilmiştir. Doz öncesi düzeydeki değişim, genel metabolit mikofenolik asit maruziyetindeki değişimleri doğru şekilde temsil etmeyebilir. Bu nedenle, mikofenolat mofetil dozunda bir değişiklik, graft fonksiyon bozukluğuna ilişkin klinik kanıt yokluğunda normalde gerekli olmamalıdır. Bununla birlikte, kombinasyon sırasında ve antibiyotik tedavisinden kısa süre sonra yakın klinik takip yürütülmelidir.
Allopurinol:
Amoksisilin tedavisi sırasında allopurinol kullanımı alerjik cilt reaksiyonları olasılığını artırabilir. Allopurinol ve AUGMENTİN'in birlikte kullanımına ait veri bulunmamaktadır.
Oral kontraseptifler:
Diğer antibiyotiklerde de olduğu gibi AUGMENTİN, bağırsak florasını etkileyebilir. Bu durum östrojen reabsorpsiyonunun azalmasına yol açar ve kombine oral kontraseptiflerin etkililiğini azaltır.
Özel popülasyonlara ilişkin ek bilgiler:
Veri bulunmamaktadır.
Pediyatrik popülasyon:
Yukarıda verilen bilgiler pediyatrik popülasyon için geçerlidir.
4.6. Gebelik ve laktasyon
Gebelik Kategorisi: B
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Diğer antibiyotiklerde de olduğu gibi AUGMENTİN, bağırsak florasını etkileyebilir. Bu durum östrojen reabsorpsiyonunun azalmasına yol açar ve kombine oral kontraseptiflerin etkililiğini azaltır. Bu nedenle tedavi süresince alternatif, etkili ve güvenilir bir doğum kontrol yöntemi uygulanmalıdır.
Gebelik dönemi
Hayvanlar üzerinde yapılan çalışmalar, gebelik/embriyonal/fetal gelişim/doğum ya da doğum sonrası gelişim ile ilgili olarak doğrudan ya da dolaylı zararlı etkiler olduğunu göstermemektedir (bkz. Bölüm 5.3).
Gebe kadınlara verilirken tedbirli olunmalıdır.
İnsanlarda gebelik sırasında amoksisilin/klavulanik asit kullanımına ilişkin kısıtlı veriler, artmış konjenital malformasyonlar riskine işaret etmemektedir.
Preterm, prematüre fetal membran yırtılması (pPROM) olan kadınlarda yapılan bir çalışmada, AUGMENTİN'in profilaktik kullanımının yeni doğanlarda nekroze enterokolit riskinin artması ile ilişkili olabileceği bildirilmiştir. Doktor tarafından gerekli görülmedikçe gebelik esnasında kullanılmamalıdır.
Laktasyon dönemi
AUGMENTİN'in iki etkin maddesi de anne sütüne geçer (klavulanik asitin anne sütü alan süt çocukları üzerindeki etkisi ile ilgili herhangi bir bilgi yoktur). Dolayısıyla, anne sütüyle beslenen süt çocuklarında ishal ve mukoz mebranlarda mantar enfeksiyonu olasılığı vardır. Bu nedenle emzirmenin kesilmesi gerekebilir. Sensitizasyon olasılığı göz önüne alınmalıdır. Emzirme döneminde amoksisilin/klavulanik asit, sadece tedaviyi uygulayan hekimin fayda/risk değerlendirmesinden sonra kullanılmalıdır.
Üreme yeteneği/Fertilite
Oral ve parenteral yolla verildiği hayvanlar (fare ve sıçanlar) üzerinde yapılan reprodüktif çalışmalarda AUGMENTİN teratojenik etki göstermemiştir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
AUGMENTİN'in araç ve makine kullanımı üzerindeki etkileriyle ilgili bir çalışma yapılmamıştır. Buna karşın, araç ve makine kullanımını etkileyebilecek istenmeyen etkiler (örneğin; alerjik reaksiyonlar, sersemlik hali, konvülsiyonlar) oluşabilir (bkz. Bölüm 4.8).
4.8. İstenmeyen etkiler
En çok bildirilen advers ilaç reaksiyonları ishal, bulantı ve kusmadır.
AUGMENTİN ile yapılan klinik çalışmalardan ve pazarlama sonrası gözetimden elde edilen ve MedDRA sistem organ sınıfına göre ayrılan advers ilaç reaksiyonları aşağıda listelenmektedir.
İstenmeyen etkilerin meydana gelme sıklıklarına göre sınıflandırılması için aşağıdaki terminolojiler kullanılmıştır:
Çok yaygın (≥1/10); yaygın (â¥1/100 ila <1/10); yaygın olmayan (â¥1/1.000 ila <1/100); seyrek (â¥1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Enfeksiyonlar ve enfestasyonlar
Yaygın: Mukokutanöz kandidiyazis
Bilinmiyor: Duyarlı olmayan organizmaların aşırı çoğalması
Kan ve lenf sistemi hastalıkları
Seyrek: Geri dönüşümlü lökopeni (nötropeni dahil), trombositopeni
Bilinmiyor: Geri dönüşümlü agranülositoz, hemolitik anemi, kanama ve protrombin zamanında uzama
Bağışıklık sistemi hastalıkları
Bilinmiyor: Anjiyonörotik ödem, anafilaksi, serum hastalığı benzeri sendrom, aşırı duyarlılık vasküliti
Sinir sistemi hastalıkları
Yaygın olmayan: Baş ağrısı ve baş dönmesi
Bilinmiyor: Geri dönüşümlü hiperaktivite, konvülsiyonlar aseptik menenjit
Gastrointestinal hastalıkları
Yaygın: Diyare, bulantı, kusma
Yaygın olmayan: Sindirim güçlüğü Bilinmiyor: Antibiyotiğe bağlı kolit
Siyah tüylü dil (dildeki papillaların belirginleşip siyah renk alması) Diş rengi değişikliği
Hepato-bilier hastalıkları
Yaygın olmayan: AST ve/veya ALT değerlerinde yükselme Bilinmiyor: Hepatit ve kolestatik sarılık
Deri ve derialtı doku hastalıkları
Yaygın olmayan: Deride döküntü, kaşıntı, ürtiker Seyrek: Eritema multiforme
Bilinmiyor: Stevens-Johnson sendromu, toksik epidermal nekrolizis, bülloz döküntülü dermatit, akut generalize ekzantemöz püstüller (AGEP),
eozinofili ve sistemik semptomların eşlik ettiği ilaç reaksiyonu (DRESS)
Böbrek ve idrar hastalıkları
Bilinmiyor: İnterstisyel nefrit, kristalüri
Şüpheli advers reaksiyonların raporlanması:
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
Aşağıda gösterildiği şekilde su ekleyiniz.
AUGMENTİN süspansiyonlarda sulandırma çizgisi, şişenin etrafını çevreleyen şeffaf bir girinti şeklinde gösterilmiştir. Sulandırma çizgisi (şeffaf girinti) 70 mL ve 100 mL şişelerde farklı seviyelerde bulunmaktadır.
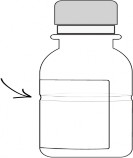
Sulandırma Çizgisi
Sulandırma Çizgisi
70 mL 100 mL
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
:
Farmakoterapötik grup: Beta-laktamaz inhibitörlerini de içeren penisilin kombinasyonları ATC kodu: J01CR02
Etki mekanizması:
Amoksisilin bakteriyel hücre çeperinin integral yapısal bir bileşeni olan bakteriyel peptidoglikan biyosentetik yolağında bir ya da daha fazla enzimi (sıklıkla penisilin bağlayan proteinler, PBP'ler olarak adlandırılan) inhibe eden yarı sentetik bir penisilindir (beta-laktam antibiyotik). Peptidoglikan sentezinin inhibisyonu hücre çeperinin zayıflamasına yol açar ki bunu genellikle hücre lizisi ve ölümü takip eder.
Amoksisilin, dirençli bakteriler tarafından üretilen beta-laktamazlar tarafından parçalanmaya duyarlı olduğundan tek başına amoksisilin aktivitesinin spektrumu bu enzimleri üreten organizmaları içermez.
Klavulanik asit yapısal olarak penisilinlerle ilişkili bir beta-laktamdır. Bazı beta-laktamaz enzimlerini inaktive ederek amoksisilinin inaktivasyonunu önler. Tek başına klavulanik asit klinik açıdan faydalı antibakteriyel etki göstermez.
Farmakokinetik/Farmakodinamik ilişki:
Minimum inhibisyon konsantrasyonu üzerindeki zamanın (T>MİK) amoksisilinin etkililiğinin majör belirleyici faktörü olduğu düşünülmektedir.
Direnç mekanizmaları:
Amoksisilin/klavulanik aside karşı direncin iki ana mekanizması şunlardır:
Kendileri klavulanik asit tarafından inhibe edilmeyen bakteriyel beta-laktamazlar ile inaktivasyon (B, C, D sınıfları dahil)
5.2. Farmakokinetik özellikler
:
Genel özellikler:
Emilim:
AUGMENTİN'in her iki bileşeni, hem amoksisilin hem de klavulanik asit, fizyolojik pH'da sulu çözeltilerde tamamen dissosiye olurlar. İki bileşen de oral uygulama sonrası hızla ve iyi absorbe olur. Oral uygulamanın ardından amoksisilin ve klavulanik asidin biyoyararlanımı yaklaşık
%70'tir. Her iki bileşenin plazma profilleri benzerdir ve her bir durumda doruk plazma konsantrasyonuna (T) yaklaşık 1 saatte ulaşırlar.
Aç karnına günde iki kez 875 mg/125 mg amoksisilin/klavulanik asit tablet verilen bir grup sağlıklı gönüllü üzerinde yapılan bir çalışmanın farmakokinetik sonuçları aşağıda verilmektedir:
Ortalama (±SS) farmakokinetik parametreler | |||||
Uygulanan etkin madde(ler) | Doz | C | T* | EAA | T |
(mg) | (µg/mL) | (sa) | (µg.sa/mL) | (sa) | |
Amoksisilin | |||||
AMK/KA 875 mg/125 mg | 875 | 11,64 ±2,78 | 1,50 (1,0-2,5) | 53,52 ±12,31 | 1,19 ±0,21 |
Klavulanik asit | |||||
AMK/KA 875 mg/125 mg | 125 | 2,18 ±0,99 | 1,25 (1,0-2) | 10,16 ±3,04 | 0,96 ±0,12 |
AMK: Amoksisilin, KA: Klavulanik asit *Medyan (aralık) | |||||
Amoksisilin/klavulanik asit ile elde edilen amoksisilin ve klavulanik asit serum konsantrasyonları, amoksisilin ve klavulanik asidin tek başlarına oral yolla verilişi ile elde edilen konsantrasyonlarla benzerlik göstermektedir.
Dağılım:
Toplam plazma klavulanik asitinin yaklaşık %25 ve toplam plazma amoksisilinin yaklaşık %18 kadarı proteine bağlanır. Görünürdeki dağılım hacmi amoksisilinde yaklaşık 0,3-0,4 l/kg ve klavulanik asitte yaklaşık 0,2/ l/kg dolayındadır.
İntravenöz uygulamadan sonra safra kesesinde, abdominal dokularda, deride, yağda, kas dokularında, sinoviyal ve peritoneal sıvılarda, safra ve iltihapta hem amoksisilin hem de klavulanik asit bulunmuştur. Amoksisilinin beyin omurilik sıvısına dağılımı yeterli değildir.
Hayvan çalışmalarında, bileşenlerden herhangi biri için ilaçtan kaynaklanan materyallerle önemli doku tutulumuna ilişkin kanıt yoktur. Penisilinlerin çoğu gibi amoksisilin de anne sütünde saptanabilir. Anne sütünde eser miktarda klavulanik asit de saptanabilmektedir (bkz. Bölüm 4.6).
Hem amoksisilin hem de klavulanik asitin plasenta bariyerini geçtiği gösterilmiştir (bkz. Bölüm 4.6).
Biyotransformasyon:
Amoksisilin başlangıç dozunun %10-25'i oranına eşdeğer miktarlarda inaktif penisiloik asit şeklinde kısmen idrarla atılır. Klavulanik asit insanda büyük oranda metabolize olur, idrar ve feçes içinde ve karbondioksit şeklinde hava ile atılır.
Eliminasyon:
Amoksisilinin başlıca eliminasyon yolu böbreklerdir. Buna karşılık, klavulanik asit hem renal hem de renal olmayan mekanizmalarla atılır.
Amoksisilin/klavulanik asidin sağlıklı kişilerde ortalama eliminasyon yarılanma ömrü yaklaşık bir saat ve ortalama total klerens yaklaşık 25 l/saattir. 250 mg/125 mg ya da 500 mg/125 mg'lık tek bir AUGMENTİN tabletinin uygulanmasından sonraki ilk 6 saatte amoksisilinin yaklaşık
%60-70'i ve klavulanik asidin yaklaşık %40-65'i idrarla değişikliğe uğramadan atılır. Çeşitli çalışmalarda, 24 saatlik bir dönemde amoksisilinin idrarla atılım miktarının %50-85 ve klavulanik asidin %27-60 arasında olduğu bulunmuştur. Klavulanik asitte, ilacın en büyük miktarı uygulamadan sonraki ilk 2 saatte atılmaktadır.
Eş zamanlı probenesid kullanımı, amoksisilin atılmasını geciktirmekle birlikte klavulanik asitin böbreklerden atılmasını geciktirmez (bkz. Bölüm 4.5).
Hastalardaki karakteristik özellikler
Böbrek yetmezliği:
Böbrek işlevinin azalmasıyla doğru orantılı olarak amoksisilin/klavulanik asidin total serum klerensi de azalır. İlaç klerensindeki azalma, amoksisilinin daha büyük bir bölümünün böbrek yoluyla atılması nedeniyle, amoksisilinde klavulanik asitten daha belirgindir. Bu nedenle, böbrek yetmezliğinde dozlar amoksisilinin fazla birikmesini önlerken, yeterli klavulanik asit düzeylerinin sürdürülmesini sağlamalıdır (bkz. Bölüm 4.2).
Karaciğer yetmezliği:
Karaciğer yetmezliği bulunan hastalarda doz dikkatle belirlenmeli ve karaciğer işlevleri düzenli aralıklarla izlenmelidir.
Yaş:
Amoksisilinin eliminasyon yarılanma ömrü yaklaşık 3 aylıktan 2 yaşına kadar olan çocuklarda, daha büyük çocuklarda ve yetişkinlerde aynıdır. Preterm doğanlar da dahil olmak üzere yaşamın ilk haftasındaki çok küçük çocuklarda uygulama zaman aralığı, renal eliminasyon yolunun olgunlaşmamış olması nedeniyle, günde iki kez uygulamayı geçmemelidir. Yaşlı hastalarda böbrek işlevlerinde azalma olasılığı daha fazla olduğundan, doz seçiminde dikkatli olunmalıdır ve böbrek işlevinin izlenmesi yararlı olabilir.
Cinsiyet:
Sağlıklı erkek ve kadınlara oral yoldan amoksisilin/klavulanik asit uygulanmasından sonra cinsiyetin amoksisilin ya da klavulanik asidin farmakokinetikleri üzerinde önemli bir etkisi görülmemiştir.
Doğrusallık/Doğrusal olmayan durum:
Amoksisilin, terapötik doz aralığında doğrusal farmakokinetiğe sahiptir.
5.3. Klinik öncesi güvenlilik verileri
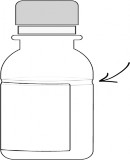
Şişe üzerinde sulandırma çizgisinin yaklaşık 2/3'üne denk gelecek kadar su ekleyiniz ve şişeyi iyice çalkalayınız (süspansiyon hazırlamak için önceden kaynatılmış ve soğutulmuş su tercih edilmelidir).
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Ksantan sakızı Aspartam
Süksinik asit Kolloidal silika
Hidroksipropilmetilselüloz
Portakal esansı (61027E) (üretiminde kunduz koku bezi kullanılmaktadır) Portakal esansı (9/027108) (üretiminde kunduz koku bezi kullanılmaktadır) Ahududu esansı
Golden şurup esansı (052927/Ap0551) Silikon dioksit
6.2. Geçimsizlikler
Bilinen bir geçimsizliği bulunmamaktadır.
6.3. Raf ömrü
24 ay
6.4. Saklamaya yönelik özel tedbirler
Sulandırılmamış toz 25ï°C altındaki oda sıcaklığında ve kuru bir yerde saklanmalıdır. Sulandırılan süspansiyon buzdolabı içinde (2â8 ï°C) saklanmalı ve 7 gün içinde kullanılmalıdır.
Buzluğa koyulmamalıdır.
6.5. Ambalajın niteliği ve içeriği
Kutuda, polipropilen yapıda, dış kısmı opak beyaz renkli, yanal tırtıklı, iç kısmı şeffaf renkli, şeffaf kısımda şişe ağzına yapışacak alüminyum folyo içeren çocuk emniyetli kapaklı; sulandırma çizgisi içeren tip III berrak cam şişede; üzerinde 0,5 mL, 1,25 mL, 2,5 mL, 5 mL'lik işaretli çizgiler bulunan 5 mL'lik kaşık ile birlikte.
Sulandırıldığında 70 mLve 100 mL süspansiyon elde edilir. Sulandırıldığında kirli beyaz renkte bir süspansiyon oluşur.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğiâne uygun olarak imha edilmelidir.
Son kullanma tarihi geçmiş veya kullanılmayan ilaçları çöpe atmayınız! Çevre ve Şehircilik Bakanlığı'nca belirlenen toplama sistemine veriniz.
AUGMENTİN süspansiyonun hazırlanması:
Şişenin kapağını açınız. Şişenin ağzında yer alan emniyet bandının bozulmamış olduğundan emin olunuz. Şişenin kapağını kapatınız.
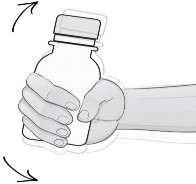
Tüm toz serbestçe akana kadar şişeyi sallayınız.
İlk sulandırılışta tam bir dağılma sağlamak için 5 dakika dinlendiriniz.
 Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir.
Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
 Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir.
Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| AMOKLAVIN | 8699525092472 | 92.01TL |
| AMOKLAVİN | 8699525093196 | |
| AMOKSILAV | 8699516079628 | |
| AUGMENTIN | 8699522275724 | |
| AUGMENTIN-BID | 8699522285754 | 104.17TL |
| Diğer Eşdeğer İlaçlar |
 |
Deri Kanseri Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör. |
 |
Ruh ve Akıl Sağlığımızı Geliştirmek İyi akıl ve ruh sağlığı sahip olmaktan ziyade, yaptığınız şeylerdir. Akıl ve ruhsal olarak sağlıklı olmak için kendinize değer vermeli ve kendinizi kabul etmelisiniz. |
 |
İnme İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına yol açar. |
İLAÇ GENEL BİLGİLERİ
Glaxo Smith Kline İlaçları San.Ve Tic.A.Ş
| Geri Ödeme Kodu | A01030 |
| Satış Fiyatı | 92.01 TL [ 26 Apr 2024 ] |
| Önceki Satış Fiyatı | 92.01 TL [ 22 Apr 2024 ] |
| Original / Jenerik | Jenerik İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699522285822 |
| Etkin Madde | Amoksisilin + Klavulanik Asit |
| ATC Kodu | J01CR02 |
| Birim Miktar | 200+28,5 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 100 |
| Enfeksiyona Karşı Kullanılan (Antienfektif) İlaçlar > Penisilinler > Amoksisilin ve Klavulanik Asit |
| Yerli ve Beşeri bir ilaçdır. |