ARCAPTA 150 mcg 30 inhaler kapsül Kısa Ürün Bilgisi
{ Indakaterol Maleat }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
ARCAPTA 150 mcg İnhaler Kapsül
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
İndakaterol maleat 194 µg (150 mikrogram indakaterole eşdeğer)
Cihazdan serbestlenen doz (Neohaler cihazının ağız parçasından çıkan doz) 120 mikrogram indakateroldür.
Yardımcı maddeler
Laktoz monohidrat (sığır kaynaklı) 24,8 mg Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
İnhaler kapsül
İçerisinde beyaz toz bulunan, sarımsı transparan renksiz sert jelatin kapsüllerin başlık kısmındaki siyah bir çizgi, no: 3 boyutundaki gövdesindeki siyah çizginin üst kısmında siyah renkte ürün kodu âIDL 150â basılıdır.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
ARCAPTA, kronik obstrüktif akciğer hastalığı (KOAH) olan yetişkin hastalardaki hava yolu obstrüksiyonunun idame (sürekli) tedavisinde endikedir.
4.2. Pozoloji ve uygulama şekli
Önerilen doz, NEOHALER inhalasyon cihazı kullanılarak bir adet 150 mikrogramlık kapsül içeriğinin günde bir kere inhalasyonudur. Doz, sadece tıbbi tavsiye üzerine artırılmalıdır.
Günde bir kez, 1 adet 300 mikrogramın NEOHALER cihazı ile inhalasyonunun, özellikle şiddetli KOAH'ı olan hastalarda nefes darlığı açısından ilave klinik yarar sağladığı gösterilmiştir. Gerektiğinde maksimum doz olan günde 300 mikrograma çıkılabilir.
Uygulama şekli:
ARCAPTA kapsülleri sadece NEOHALER inhalasyon cihazı kullanılarak oral inhalasyon yolu ile uygulanmalıdır. ARCAPTA kapsülleri yutulmamalıdır. ARCAPTA kapsülleri her zaman blister ambalajında saklanmalı ve KULLANMADAN HEMEN ÖNCE blisterden çıkarılmalıdır.
ARCAPTA, her gün aynı saatte uygulanmalıdır. Eğer bir doz kaçırılırsa, sonraki doz ertesi gün her zamanki saatinde alınmalıdır.
Her ürün ambalajı bir adet NEOHALER cihazı içermektedir. Kutu içerisindeki kapsüller bittikten sonra inhalasyon cihazı atılır.
Ürünün doğru olarak nasıl uygulanacağı hastalara gösterilmelidir. Solunumunda düzelme olmayan hastalara ilacı inhale etmek yerine yutup yutmadığı sorulmalıdır.
Uygulama öncesinde tıbbi ürünün kullanımına ilişkin talimatlar için Bölüm 6.6'ya bakınız.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek yetmezliği:
Böbrek yetmezliği olan hastalarda doz ayarlamasına gerek bulunmamaktadır (bkz. Bölüm 5.2).
Karaciğer yetmezliği:
Hafif ila orta şiddette karaciğer yetmezliği olan hastalarda doz ayarlaması gerekli değildir. Şiddetli karaciğer yetmezliği olan hastalarda ARCAPTA kullanımı ile ilgili veri mevcut değildir (bkz. Bölüm 5.2).
Pediyatrik popülasyon: ARCAPTA, 18 yaşın altındaki hastalarda kullanılmamalıdır.
Geriyatrik popülasyon: Maksimum plazma konsantrasyonu ve genel sistemik maruziyet yaşla birlikte artmaktadır; ancak yaşlı hastalarda doz ayarlamasına gerek bulunmamaktadır (bkz. Bölüm 5.2).
4.3. Kontrendikasyonlar
İndakaterol ya da yardımcı maddelerden herhangi birine karşı aşırı duyarlılıkta kontrendikedir.
4.4. Özel kullanım uyarıları ve önlemleri
Astım:
ARCAPTA, astımda kullanılmamalıdır, çünkü astımda ARCAPTA ile ilgili uzun dönem sonuç verileri yoktur.
Uzun etkili beta2-adrenerjik agonistler, astım tedavisinde kullanıldığında, astım ile bağlantılı ölümler de dahil olmak üzere astım ile ilişkili ciddi advers olaylar riskini artırabilir.
Uzun etkili beta agonist preparatlarına bağlı olarak nadiren, ciddi ve bazen ölümcül olabilen astım ile ilgili solunum problemleri meydana gelebilir.
ARCAPTA astım hastalığının tedavisi için önerilmez.
İnhale kortikosteroidlere ek olarak uzun etkili beta agonist kullanan pediyatikpediyatrik ve adölesan hastalarda, her iki ilaca uyumu garanti altına almak için, hem inhale kortikosteroid hem de uzun etkili beta agonist içeren bir kombinasyon preparatı kullanılması önerilir.
Aşırı duyarlılık:
ARCAPTA uygulamasından sonra ani aşırı duyarlılık reaksiyonları bildirilmiştir. Eğer alerjik reaksiyonlara işaret eden (özellikle, nefes ya da yutkunma güçlüğü, dil, dudaklar ve yüzde
şişme, ürtiker, deri döküntüsü) belirtiler meydana gelirse, ARCAPTA kullanımı hemen bırakılmalı ve alternatif bir tedavi başlatılmalıdır.
Paradoksal bronkospazm:
Diğer inhalasyon tedavilerinde olduğu gibi ARCAPTA uygulaması da yaşamı tehdit edebilen paradoksal bronkospazm ile sonuçlanabilir. Paradoksal bronkospazm oluşursa, ARCAPTA hemen kesilmeli ve alternatif tedavi başlanmalıdır.
Hastalığın kötüleşmesi:
ARCAPTA, akut bronkospazm epizotlarının tedavisi için (yani kurtarıcı tedavi olarak) endike değildir. ARCAPTA tedavisi sırasında KOAH'ta (Kronik Obstrüktif Akciğer Hastalığı) kötüleşme görülürse, hastanın ve KOAH tedavi rejiminin tekrar değerlendirilmesi gereklidir. ARCAPTA günlük dozunun, 300 mikrogramlık maksimum dozun üzerine çıkarılması uygun değildir.
Sistemik etkiler:
Önerilen dozlarda ARCAPTA uygulamasından sonra kardiyovasküler sistem üzerinde klinik olarak anlamlı herhangi bir etki genellikle gözlenmemesine rağmen diğer beta-adrenerjik agonistlerde olduğu gibi ARCAPTA kardiyovasküler bozukluğu (koroner arter hastalığı, akut miyokard infarktüsü, kardiyak aritmiler ve hipertansiyon), konvülsif bozukluğu veya tirotoksikozisi olan hastalarda ve beta-adrenerjik agonistlere beklenmedik şekilde yanıt veren hastalarda dikkatle kullanılmalıdır.
Diğer inhale beta2-adrenerjik ilaçlarla olduğu gibi ARCAPTA, tavsiye edilenden daha yüksek dozda ve sıklıkta kullanılmmalıdır.
ARCAPTA, diğer uzun etkili beta-adrenerjik agonistlerle ya da uzun etkili beta-adrenerjik agonistleri içeren bir tedavi ile birlikte kullanılmamalıdır.
Kardiyovasküler etkiler:
ARCAPTA, diğer beta-adrenerjik agonistler gibi, bazı hastalarda, nabız, kan basıncı ve/veya semptomlarda artışla ölçülen klinik olarak anlamlı kardiyovasküler etki oluşturabilir. Bu tür etkiler oluşursa tedavinin kesilmesi gerekebilir. Ayrıca, beta-adrenerjik agonistlerin EKG değişiklikleri (T dalgasında düzleşme, QT aralığında uzama ve ST segment depresyonu) oluşturduğu bildirilmiştir. Bu bulguların klinik önemi bilinmemektedir. Bu yüzden ARCAPTA gibi uzun etkili beta2-adrenerjik agonistler (LABA) veya LABA içeren Arcapta gibi ürünler, QT aralığında uzama görülen ya da şüphelenilen veya QT aralığını etkileyen ilaçlarla tedavi edilen hastalarda dikkatli kullanılmalıdır.
Hipokalemi:
Beta-adrenerjik agonistler, bazı hastalarda kardiyovasküler advers etkiler oluşturma potansiyeli olan anlamlı hipokalemi oluşturabilir. Serum potasyum düzeyinde düşüş genellikle geçicidir ve takviye gerektirmez. Şiddetli KOAH'lı hastalarda hipokalemi; hipoksi ve eş zamanlı olarak kullanılan tedavilerle (bkz. Bölüm 4.5.) artabilir ve bu da kardiyak aritmilere karşı duyarlılığı artırabilir.
Hiperglisemi:
Beta-adrenerjik agonistlerin yüksek dozlarda inhalasyonu, plazma glukozunda artışlara yol açabilir. ARCAPTA tedavisinin başlatılmasını takiben plazma glukozu diyabetik hastalarda daha yakından takip edilmelidir.
Klinik çalışmalar sırasında kan glukozundaki klinik açıdan anlamlı değişiklikler, önerilen dozlarda ARCAPTA uygulandığı grupta plaseboya göre %1-2 daha sık gözlenmiştir. ARCAPTA, diyabeti iyi kontrol altında olmayan hastalarda araştırılmamıştır.
ARCAPTA, laktoz monohidrat içerir. Nadir kalıtımsal galaktoz intoleransı, toplam laktaz eksikliği ya da glukoz-galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Sempatomimetik ajanlar:
Diğer sempatomimetik ajanların eş zamanlı uygulanması (tek başına veya kombinasyon tedavisinin bir parçası olarak) ARCAPTA'nın istenmeyen etkilerini güçlendirebilir.
ARCAPTA, diğer uzun etkili beta-adrenerjik agonistler ya da uzun etkili beta-adrenerjik agonistler içeren tıbbi ürünlerle birlikte kullanılmamalıdır.
Hipokalemik tedavi:
Metilksantin türevleri (örn. teofilin), steroidler (örn. prednizolon) veya potasyum tutucu olmayan diüretikler ile eş zamanlı hipokalemik tedavi, beta-adrenerjik agonistlerin olası hipokalemik etkisini güçlendirebilir, bu nedenle dikkatli kullanılmalıdır (bkz. Bölüm 4.4).
Beta-adrenerjik blokörler:
Beta-adrenerjik blokörler ve beta-adrenerjik agonistler, birlikte uygulandıklarında birbirlerinin etkisini zayıflatabilir veya antagonize edebilir. Bu nedenle, kullanılmaları zorunlu olmadığı sürece indakaterol, beta-adrenerjik blokörlerle (göz damlaları dahil) birlikte kullanılmamalıdır. Gerekli olduğu durumlarda kardiyoselektif beta-adrenerjik blokörler tercih edilmeli, ancak bunlar dikkatle uygulanmalıdır.
Metabolik ve taşıyıcı bazlı etkileşimler:
İndakaterol klirensinde temel rolü olan CYP3A4 ve P-glikoproteinin inhibisyonu, sistemik indakaterol maruziyetini iki kata kadar artırmaktadır. ARCAPTA'nın önerilen maksimum terapötik dozların 2 katına kadar olan dozlarda, 1 yıla kadar süreyle kullanıldığı klinik çalışmalarda tedavi konusunda elde edilen güvenlilik deneyimi göz önüne alındığında, ilaç etkileşimlerine bağlı olarak maruziyet büyüklüğünün artışı herhangi bir güvenlilik endişesi oluşturmamaktadır.
İndakaterolün eş zamanlı kullanılan ilaçlarla etkileşime neden olduğu gösterilmemiştir. İn vitro araştırmalar indakaterolün, klinik uygulamada elde edilen sistemik maruziyet düzeylerinde, ilaçlarla metabolik etkileşimlere neden olma potansiyelinin ihmal edilebilir düzeyde olduğunu göstermiştir.
4.6. Gebelik ve laktasyon
Gebelik kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Çocuk sahibi olma potansiyeline sahip kadınlar için özel öneriler bulunmamaktadır.
Gebelik dönemi
Hayvanlar üzerinde yapılan calışmalar, gebelik /ve-veya/ embriyonal/fetal gelişim /ve-veya/ doğum /ve-veya/ doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (bkz. Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.
ARCAPTA, gerekli olmadıkça gebelik döneminde kullanılmamalıdır.
Indakaterolün gebe kadınlarda kullanımına ilişkin veri mevcut değildir. Hayvanlar üzerinde yapılan çalışmalar, klinik olarak ilgili maruziyetlerde üreme toksisitesi açısından doğrudan veya dolaylı zararlı etkiler göstermemektedir (bkz. Bölüm 5.3). Diğer beta-adrenerjik agonistler gibi, indakaterol de rahim düz kası üzerindeki gevşetici etkisi nedeniyle doğumu engelleyebilir. ARCAPTA gebelik sırasında ancak beklenen yararlar potansiyel risklerden fazlaysa kullanılmalıdır.
Laktasyon dönemi
İndakaterol/metabolitlerin insan sütüne geçip geçmediği bilinmemektedir. Hayvanlardan elde edilen farmakokinetik/toksikolojik veriler indakaterol/metabolitlerin süte geçtiğini göstermektedir. Emzirilen çocuk için risk göz ardı edilemez. Emzirmenin çocuk için ve tedavinin anne için yararları göz önüne alınarak emzirmenin ya da ARCAPTA tedavisinin bırakılması kararı verilmelidir.
Üreme yeteneği/Fertilite:
Sıçanlarda gebelik oranlarında düşme gözlenmiştir. Yine de, önerilen maksimum dozda inhalasyonu takiben, indakaterolün insanlarda üreme ya da fertilite performansını etkilemesinin pek olası olmadığı düşünülmektedir (bkz. bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
ARCAPTA'nın araç ve makine kullanımı üzerine hiçbir etkisi yoktur ya da ihmal edilebilir bir etkisi vardır.
4.8. İstenmeyen etkiler
Önerilen dozlarda gözlenen en yaygın advers reaksiyonlar; nazofarenjit (%14,3), öksürük (%8,2), üst solunum yolu enfeksiyonu (%14,2), baş ağrısı (% 3,7) ve kas spazmlarıdır (%3,5). Bunların büyük kısmı hafif ya da orta şiddettedir ve tedavinin devam ettirilmesi durumunda sıklıkları azalmaktadır.
KOAH hastalarında önerilen dozlarda ARCAPTA'nın advers ilaç reaksiyonu profili, beta- adrenerjik stimülasyonunun klinik olarak anlamlı olmayan sistemik etkilerini göstermektedir. Ortalama kalp atım hızı değişiklikleri dakikada birden daha az olmuştur; taşikardi nadir olarak gözlenmiştir ve plasebo grubuna benzer oranda bildirilmiştir. Plasebo ile karşılaştırıldığında, QTF aralıklarında anlamlı uzamalar saptanmamıştır. Dikkate değer QTF aralığı [yani >450 ms (erkekler) ve >470 ms (kadınlar)] ve hipokalemi bildirimleri plasebo ile benzer bulunmuştur. Kan şekerinde maksimum değişikliklerin ortalaması, ARCAPTA ve plasebo gruplarında benzer bulunmuştur.
ARCAPTA, Faz III klinik gelişim programı, orta ila şiddetli KOAH klinik tanısı olan hastaları içermiştir. 4.764 hasta, bir yıla kadar önerilen maksimum dozun iki katına kadar olan dozlarda indakaterole maruz kalmıştır. Bu hastalardan 2.611'i günde bir kez 150 mikrogram indakaterol tedavisindeyken 1.157'si günde bir kez 300 mikrogram indakaterol tedavisi
görmüştür. Hastaların yaklaşık olarak %41'i ağır KOAH olup ortalama yaşları 64'tür, %48'i 65 yaşın üzerindedir ve çoğunluğu (%80) beyaz ırka mensuptur.
Aşağıdaki advers ilaç reaksiyonları, KOAH güvenlilik veritabanında MedDRA sistem organ sınıfına göre sıralanmıştır. Advers reaksiyonlar her bir sistem organ sınıfı içinde aşağıdaki kategoriler altında azalan sıklık sırasına göre dizilmiştir (CIOMS III): Çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila <1/100); seyrek (≥1/10.000 ila
<1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
![]()
Advers reaksiyonlar Sıklık kategorisi
![]()
Enfeksiyonlar ve enfestasyonlar
Nazofarenjit Yaygın
Üst solunum yolu enfeksiyonu Yaygın
Sinüzit Yaygın
Bağışıklık sistemi hastalıkları
Aşırı duyarlılık Yaygın olmayan
Metabolizma ve beslenme hastalıkları
Diyabet ve hiperglisemi Yaygın olmayan
Sinir sistemi hastalıkları
Baş ağrısı Yaygın
Baş dönmesi Yaygın
Parestezi Yaygın olmayan
Kardiyak hastalıklar
İskemik kalp hastalığı Yaygın olmayan
Palpitasyonlar Yaygın olmayan
Atriyal fibrilasyon Yaygın olmayan
Taşikardi Yaygın olmayan
Solunum, göğüs bozuklukları ve mediastinal hastalıkları
Öksürük Yaygın
Gırtlak irritasyonu içeren orofaringal ağrı Yaygın
Rinore Yaygın
Paradoksal bronkospazm Yaygın olmayan
Deri ve deri altı doku hastalıkları
Kaşıntı/döküntü Yaygın olmayan
Kas-iskelet bozuklukları, bağ dokusu ve kemik hastalıkları
Kas spazmı Yaygın
Kas-iskelet ağrısı Yaygın olmayan
Miyalji Yaygın olmayan
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıkları
Göğüs ağrısı Yaygın
Periferal ödem Yaygın
![]()
Günde bir kez 600 mikrogram dozunda ARCAPTA'nın güvenlilik profili genel olarak önerilen dozlarınkine benzer bulunmuştur. Ek bir advers reaksiyon tremor olmuştur (yaygın).
Seçilmiş advers ilaç reaksiyonları tanımı:
Faz III klinik çalışmalarda, sağlık mesleği mensupları, klinik vizitlerde, ortalama olarak hastaların %17-20'sinde, genellikle inhalasyonu takiben 15 saniye içinde ortaya çıkan ve tipik olarak 5 saniye süren sporadik öksürük (sigara içerenlerde yaklaşık 10 saniye) olduğunu gözlemlemişlerdir. Bu öksürük, erkeklerle karşılaştırıldığında kadınlarda ve sigarayı bırakmış olanlarla karşılaştırıldığında halen sigara kullanmakta olanlarda daha yüksek sıklıkta gözlenmiştir. İnhalasyondan sonra ortaya çıkan bu öksürük, genel olarak iyi tolere edilmiştir ve önerilen dozlarda hiçbir hastanın çalışmalardan ayrılmasına yol açmamıştır (öksürük KOAH'ta gözlenen bir semptomdur ve hastaların %8,2'sinde öksürük bir advers olay olarak bildirilmiştir). İnhalasyon sonrası ortaya çıkan öksürüğün, bronkospazm, alevlenmeler, hastalığın kötüleşmesi veya etkililik kaybı ile ilişkili olduğunu gösteren bulgu yoktur.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99)
4.9. Doz aşımı ve tedavisi
KOAH hastalarında, önerilen maksimum terapötik dozun 10 katı olan tek dozlar, nabızda, sistolik kan basıncında ve QTaralığında orta derece bir artışla ilişkilendirilmiştir.
İndakaterol ile doz aşımının, beta-adrenerjik uyarıcılar için tipik olan abartılı etkilere (yani taşikardi, titreme, çarpıntılar, baş ağrısı, bulantı, kusma, baş dönmesi, ventriküler aritmiler, metabolik asidoz, hipokalemi ve hiperglisemi) yol açma olasılığı yüksektir.
Destekleyici ve semptomatik tedavi endikedir. Ciddi vakalarda hastalar hastaneye yatırılmalıdır. Kardiyoselektif beta-blokör kullanımı düşünülebilir, ancak beta-adrenerjik blokörler bronkospazmı uyarabildiğinden, bunlar doktor gözetiminde çok dikkatli bir şekilde uygulanmalıdır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Obstrüktif solunum yolu hastalıklarında kullanılan ilaçlar, selektif beta-2-adrenoreseptör agonistleri
ATC kodu: R03AC18
Etki Mekanizması:
İndakaterol gibi beta-adrenoseptör agonistlerinin farmakolojik etkileri, en azından kısmen, intraselüler adenil siklazın (adenozin trifosfatın (ATP) siklik-3', 5'-adenozin monofosfata (siklik monofosfat) dönüşmesini katalize eden enzim) stimülasyonuna bağlanabilir. Yüksek siklik AMP düzeyleri, bronşiyal düz kasta gevşemeye neden olur. İn vitro çalışmalar, uzun etkili bir beta-adrenerjik agonist olan indakaterolün betareseptörlerdeki agonist aktivitesinin, beta-reseptörlerindekinden 24 kattan daha fazla ve beta-reseptörlerdekinden 20 kattan daha fazla olduğunu göstermiştir.
İnhale edildiğinde indakaterol akciğerlerde lokal olarak bronkodilatör etki gösterir. İndakaterol, insan beta-adrenerjik reseptör düzeyinde nanomolar potensi olan bir kısmi agonisttir. İzole insan bronşunda indakaterolün etkisi hızlı başlar ve etki süresi uzundur.
Beta-reseptörlerin, bronş düz kasında, beta-reseptörlerin insan kalbinde hakim olan adrenerjik reseptörler olmasına rağmen, insan kalbindeki toplam adrenerjik reseptörlerin
%10-50'sini beta-adrenerjik reseptörleroluşturur. Kalpteki beta-adrenerjik reseptörlerin kesin fonksiyonu bilinmemektedir; fakat bunların varlığı yüksek düzeyde seçici beta- adrenerjik agonistlerin bile kardiyak etkilerinin olma olasılığını artırmaktadır.
Farmakodinamik Etkiler:
Bir dizi klinik farmakodinami ve etkililik çalışmasında, günde bir kere 150 ve 300 mikrogram dozlarda uygulanan ARCAPTA, akciğer fonksiyonunda (birinci saniyedeki zorlu ekspiratuar hacim, FEVölçümlerine göre) tutarlı bir şekilde 24 saati aşan klinik açıdan anlamlı düzelme sağlamıştır. İnhalasyondan sonra etkisi, beş dakika içinde hızlı bir şekilde ortaya çıkar ve başlangıca göre FEV'de 110-160 ml artış meydana gelir. Bu, hızlı etkili beta-agonist salbutamol 200 mg'ın etkisine benzemektedir; ayrıca salmeterol/flutikazon 50/500 mikrogram ile karşılaştırıldığında etkisi, istatistiksel olarak anlamlı oranda daha hızlıdır. Kararlı durumda başlangıca göre FEV'deki azami düzelmelerin ortalaması 250-330 ml'dir.
Bronkodilatör etkinin doz uygulama saatine (sabah veya akşam) bağlı olmadığı saptanmıştır.
ARCAPTA'nın akciğer hiperinflasyonunu azalttığı gösterilmiştir; bu durum plasebo ile karşılaştırıldığında egzersiz sırasında ve dinlenirken inspiratuar kapasitenin artmasına yol açar.
Kardiyak elektrofizyoloji üzerindeki etkiler:
404 sağlıklı gönüllüye 2 hafta süre ile indakaterolün çoklu dozlarının (günde bir kere 150, 300 veya 600 mikrogram) uygulandığı çift-kör, plasebo ve aktif (moksifloksasin) kontrollü bir çalışmada, QTF (milisaniye) aralığındaki maksimum ortalama (%90 güven aralıkları) uzamaların 150, 300 ve 600 mikrogram için sırası ile 2,66 (0,55, 4,77), 2,98 (1,02, 4,93) ve
3,34 (0,86, 5,82) olduğu gösterilmiştir. Değerlendirilen doz aralığında konsantrasyon-delta QTilişkisine dair bulgu saptanmamıştır.
KOAH'ı olan 605 hasta üzerinde yapılan 26 haftalık, çift kör, plasebo kontrollü bir faz III çalışmada gösterildiği üzere, başlangıçta ve 26 haftalık tedavi döneminde 3 kereye kadar yapılan 24 saatlik monitorizasyona göre önerilen dozlarda ARCAPTA ile plasebo ya da
tiotropium ile tedavi edilmiş hastalar arasında aritmik olayların gelişimi açısından klinik olarak anlamlı bir fark gözlenmemiştir.
Klinik etkililik ve güvenlik:
Klinik geliştirme programı, KOAH klinik tanısı konulmuş hastalarda yürütülen bir tane 12 haftalık, iki tane altı aylık (bunlardan bir tanesi güvenlilik ve tolerabilitenin değerlendirilmesi için bir yıla uzatılmıştır) ve bir tane bir yıllık randomize kontrollü çalışmayı kapsamaktadır. Bu çalışmalar akciğer fonksiyonu ölçümlerini ve dispne, alevlenmeler ve sağlıkla bağlantılı yaşam kalitesi gibi sağlık sonuçlarını kapsamaktadır.
Akciğer fonksiyonu:
ARCAPTA günde bir kere 150 mikrogram ve 300 mikrogram dozlarda uygulandığında akciğer fonksiyonunda klinik açıdan anlamlı iyileşmelere neden olmuştur. 12-haftalık primer sonlanım noktasında (24-saatlik 'through' FEV-doz öncesi-) 150 mikrogram dozu plasebo ile karşılaştırıldığında 130-180 ml artışa (p<0.001) ve günde iki kere 50 mikrogram salmeterol ile karşılaştırıldığında 60 ml artışa yol açmıştır (p<0.001). 300 mikrogram dozu plasebo ile karşılaştırıldığında 170-180 ml artışa (p<0.001) ve günde iki kere 12 mikrogram formoterol ile karşılaştırıldığında 100 ml artışa (p<0.001) yol açmıştır. Her iki doz da günde bir kere uygulanan açık etiketli 18 mikrogram tiotropium ile karşılaştırıldığında 40-50 ml artışa neden olmuştur (150 mikrogram, p = 0.004; 300 mikrogram, p = 0.01). ARCAPTA'nın 24 saatlik bronkodilatör etkisi ilk dozdan itibaren bir yıl boyunca korunmuş ve etkililik kaybına (taşifilaksi) dair kanıta rastlanmamıştır.
Semptomatik yararlar:
Her iki doz da dispne ve sağlık durumu açısından (sırasıyla Tranzisyonel Dispne İndeksi [TDI] ve St. George Solunum Anketi [SGRQ] ile yapılan değerlendirmelere göre) semptomların rahatlatılmasında plaseboya göre istatistiksel olarak anlamlı düzelmeler sağlamıştır. Yanıt büyüklüğü genellikle aktif karşılaştırma grupları ile gözlenenden daha yüksektir (Tablo 2). Ayrıca, ARCAPTA ile tedavi edilmiş hastalar kurtarma ilacına anlamlı oranda daha az gereksinim duymuş, plasebo ile karşılaştırıldığında bu hastalarda kurtarma ilacına gereksinim duyulmayan günlerin sayısı daha fazla olmuş ve gündüz semptomlarının gözlenmediği günlerin yüzdesinde anlamlı bir artış meydana gelmiştir.
6 aydan daha uzun süreli tedavilerin birleştirilmiş etkililik analizi, KOAH alevlenmesi oranının plasebodan istatistiksel olarak anlamlı oranda daha düşük olduğunu göstermiştir. Plaseboya göre yapılan tedavi karşılaştırmasında sırasıyla 150 mikrogram ve 300 mikrogram için 0,68 (%95 GA [0,47, 0,98]; p-değeri 0,036) ve 0,74'lük (%95 GA[0,56, 0,96]; p-değeri
0,026) oranları bulunmuştur.
Afrika kökenli kişilerde tedavi deneyimi sınırlıdır.
Tablo 2 6 aylık tedavi sonucunda semptomlardaki rahatlama
Tedavi dozu (mikrogram) | Günde bir kere 150 İndakaterol | Günde bir kere 300 İndakaterol | Günde bir kere 18 Tiotropium | Günde iki kere 50 Salmeterol | Günde iki kere 12 Formoterol | Plasebo |
MCID'ye | 57 | 71 | 57 | 54 |
| 45 |
ulaşmış | 62 | 59 |
|
| 54 | 47 |
hastaların |
|
|
|
|
| 41 |
yüzdesi |
|
|
|
|
|
|
TDI |
|
|
|
|
|
|
MCID'ye | 53 | 53 | 47 | 49 | 51 | 38 |
ulaşmış | 58 | 55 |
|
|
| 46 |
hastaların |
|
|
|
|
| 40 |
yüzdesi |
|
|
|
|
|
|
SGRQ |
|
|
|
|
|
|
Başlangıca | 1,3 | 1,6 | 1,0 | 1,2 | n/e | 0,3 |
göre gün | 1,5 |
|
|
|
| 0,4 |
başına |
|
|
|
|
|
|
kullanılan |
|
|
|
|
|
|
kurtarma |
|
|
|
|
|
|
ilacı sayısında |
|
|
|
|
|
|
azalma |
|
|
|
|
|
|
Kurtarma | 60 | 58 | 46 | 55 | n/e | 42 |
ilacı | 57 |
|
|
|
| 42 |
kullanılmayan |
|
|
|
|
|
|
günlerin |
|
|
|
|
|
|
yüzdesi |
|
|
|
|
|
|
Çalışma tasarımında belirtilen ilaçlar kullanılmıştır: : indakaterol 150 mikrogram, salmeterol ve plasebo; : indakaterol 150 ve 300 mikrogram, Tiotropium ve plasebo; : indakaterol 300 mikrogram, Formoterol ve plasebo
n/e = altıncı ayda değerlendirilmedi.
5.2. Farmakokinetik özellikler
Genel özelliklerİndakaterol, R-konfigürasyona sahip bir kiral moleküldür.
Farmakokinetik veriler, sağlıklı gönüllüler ve KOAH hastaları üzerinde yapılan bir dizi klinik çalışmadan elde edilmiştir.
Emilim:
İndakaterolün doruk serum konsantrasyonuna ulaşması için medyan süre, tek dozdan veya tekrarlanan inhale dozlardan sonra yaklaşık olarak 15 dakika olarak saptanmıştır. Artan dozla birlikte indakaterole sistemik maruziyet, dozla orantılı bir şekilde artmıştır (150 mikrogram ila 600 mikrogram). İnhale dozdan sonra indakaterolün mutlak biyoyararlanımı ortalama %43
- 45 olmuştur. Sistemik maruziyet, akciğer emilimi ve bağırsak emiliminin bileşimine bağlıdır; sistemik maruziyetin yaklaşık %75'i akciğer emiliminden ve yaklaşık %25'i bağırsak emiliminden olmuştur.
5
İndakaterol serum konsantrasyonları, günde bir kere uygulanan tekrarlı dozlarla artış göstermiştir. Kararlı duruma 12-14 günde ulaşılmıştır. İndakaterolün ortalama birikim oranı (yani, 1. günle karşılaştırıldığında 14. günde 24 saatlik dozlama aralığı için EAA), 150 mikrogram ile 600 mikrogram arasında günde bir kere uygulanan inhale dozlar için 2,9 ila 3,85 arasında bulunmuştur.
Dağılım:
İntravenöz infüzyondan sonra, terminal eliminasyon fazı sırasında indakaterolün dağılım hacmi 2557 L olarak yaygın bir dağılıma işaret etmektedir. İn vitro olarak insan serum ve plazma proteinlerine bağlanma sırasıyla %94,1-95,3 ve %95,1-96,2 olarak saptanmıştır.
Biyotransformasyon:
İnsanda gerçekleştirilen bir ADME (emilim, dağılım, metabolizma, atılım) çalışmasında radyoaktif element ile işaretlenmiş indakaterolün oral uygulamasından sonra değişmemiş indakaterolün serumdaki temel bileşen olduğu belirlenmiştir; bu bileşen 24 saatlik toplam EAA'nin yaklaşık olarak üçte birini oluşturur. Hidroksile bir türev, serumdaki en belirgin metabolittir. Hidroksile indakaterol ve indakaterolün fenolik O-glukuronidleri de diğer belirgin metabolitlerdir. Hidroksile türevin diastereomeri, indakaterolün bir N-glukuronidi ve C- ve N- dealkile ürünler, belirlenen diğer metabolitler olmuştur.
İn vitro araştırmalar, UGT1A1'in indakaterolü fenolik O-glukuronide metabolize eden tek UGT izoformu olduğunu göstermiştir. Rekombinant CYP1A1, CYP2D6 ve CYP3A4 ile birlikte inkübasyonda oksidatif metabolitler saptanmıştır. CYP3A4'ün indakaterolün hidroksillenmesinden sorumlu olan başlıca izoenzim olduğu sonucuna varılmıştır. İn vitro araştırmalar, indakaterolün âefflux' pompası P-gp için düşük afiniteli bir substrat olduğunu göstermiştir.
Eliminasyon:
![]()
İdrar örneklerinin de toplandığı klinik çalışmalarda, idrar yoluyla değişmeden atılan indakaterol miktarı, genellikle dozun %2'sinden az olmuştur. İndakaterolün böbrek klerensi ortalama olarak 0,46 ile 1,20 litre/saat arasındadır. İndakaterolün 23,3 litre/saat'lik serum klerensi ile karşılaştırıldığında, böbrek klerensinin, sistemik olarak mevcut indakaterolün atılmasında önemsiz bir rol oynadığı açık olarak görülmektedir (sistemik klerensin %2-5'i).
İndakaterolün oral yoldan verildiği bir insan ADME çalışmasında, dışkıyla atılımın, idrarla atılımdan daha belirgin olduğu bulunmuştur. İndakaterol, insanlarda dışkıyla büyük oranda değişmeden ana ilaç şeklinde (dozun %54'ü) ve daha az oranda hidroksile indakaterol metabolitleri şeklinde atılmıştır (dozun %23'ü). Dışkıda dozun ≥%90'ı toplandığı için kütle dengesi tam olmuştur.
Tekrarlı dozlardan sonra indakaterol birikiminden hesaplanan efektif yarı ömür 40 ila 52 saat arasında değişmektedir (yaklaşık olarak 12-14 gün olan kararlı hale kadar geçen süre ile uyumludur).
Doğrusallık/Doğrusal Olmayan Durum:
İndakaterol serum konsantrasyonu, multifazik bir şekilde düşmektedir (ortalama terminal yarı ömrü 45,5 ile 126 saat arasında değişmektedir).
Hastalardaki karakteristik özellikler
Karaciğer yetmezliği:
Hafif ila orta şiddette karaciğer yetmezliği olan hastalarda indakaterolün Cya da EAA'sinde anlamlı değişiklikler gözlenmemiştir; ayrıca hafif ila orta şiddette karaciğer yetmezliği olan gönüllüler ve sağlıklı gönüllüler arasında protein bağlama oranları açısından da fark yoktur. Şiddetli karaciğer yetmezliği olan hastalarda çalışma yapılmamıştır (bkz. bölüm 4.2.).
Böbrek yetmezliği:
Toplam vücut eliminasyonunda idrar yolunun çok düşük bir katkısı olduğundan, böbrek yetmezliği olan hastalarda bir çalışma yapılmamıştır.
Pediyatrik popülasyon:
ARCAPTA'nın 18 yaşın altındaki hastalarda kullanılması önerilmemektedir.
Geriyatrik popülasyon:
Maksimum plazma konsantrasyonu ve genel sistemik maruziyet yaşla birlikte artmaktadır (bkz.Bölüm 4.2.). Ancak yaşlı hastalarda doz ayarlamasına gerek bulunmamaktadır.
Yaş, cinsiyet, kilo, ırk:
Yapılan bir popülasyon farmakokinetiği analizinde, yaşın (88 yaşına kadar yetişkinler), cinsiyetin, kilonun (32-168 kg) ya da ırkın indakaterol farmakokinetiği üzerinde klinik açıdan anlamlı bir etki meydana getirmediği gösterilmiştir. Elde edilen bulgular bu popülasyonda etnik alt gruplar arasında herhangi bir farka işaret etmemiştir.
5.3. Klinik öncesi güvenlilik verileri
Köpeklerde yapılan çalışmalarda, indakaterolün kardiyovasküler sistem üzerindeki beta- agonistik özelliklerine bağlanan etkileri taşikardi, aritmiler ve miyokard lezyonlarını kapsamaktadır. Kemirgenlerde, burun boşluğu ve larinkste hafif düzeyde tahriş gözlenmiştir. Tüm bu bulgular insanlarda beklenenin yeterince üzerinde olan maruziyetlerde meydana gelmiştir.
Bir sıçan fertilitesi çalışmasında indakaterol genel üreme performansını etkilememiş olsa da, gelişim ve gelişim sonrası dönemde olan sıçanlar üzerinde yapılan ve ARCAPTA ile tedavi edilen insanlardakinden 14 kat daha yüksek maruziyetin kullanıldığı bir çalışmada gebe Fdölünün sayısında bir azalma gözlenmiştir. İndakaterol sıçanlarda ya da tavşanlarda embriyotoksik ya da teratojenik değildir.
Genotoksisite çalışmalarında, mutajenik ya da klastojenik potansiyel gözlenmemiştir. İndakaterolün karsinojenisitesi, sıçanlarda 2 yıllık bir sıçan çalışmasında ve 6 aylık transgenik fare çalışmasında değerlendirilmiştir. Sıçanlarda iyi huylu over leyomiyomu ve over düz kasında fokal hiperplazi insidanslarında artışların, diğer beta-adrenerjik agonistler için bildirilen benzer bulgularla tutarlı olduğu görülmüştür. Farelerde karsinojenisite kanıtına rastlanmamıştır. Bu çalışmalarda advers etkilerin gözlenmediği düzeylerde sıçanlarda ve farelerde meydana gelen sistemik maruziyetler (EAA), günde bir kere 300 mikrogram dozda ARCAPTA ile tedavi edilmiş olan insanlarda gözlenen değerlerden sırasıyla en az 7 ve 49 kat daha yüksek olmuştur.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Kapsül dolumu:
Laktoz monohidrat (sığır kaynaklı)
Boş kapsül kabuğu: Jelatin (sığır kaynaklı) Siyah baskı mürekkebi
Baskı mürekkebi: Şellak (E904)
Siyah demir oksit (E172) N-bütil alkol
Saf su
Propilen glikol (E1520) Susuz etanol
İzopropil alkol
Güçlü amonyak çözeltisi
6.2. Geçimsizlikler
Geçerli değil.
6.3. Raf ömrü
30 ay
6.4. Saklamaya yönelik özel tedbirler
tedbirler30ºC'nin altındaki oda sıcaklığında ve ambalajında saklayınız. Nemden koruyunuz. ARCAPTA kapsüllerini nemden korumak için blister içinde saklanmalı ve yalnızca kullanımdan hemen önce çıkarılmalıdır.
6.5. Ambalajın niteliği ve içeriği
Her biri 10'ar kapsül içeren PA/Alu/PVC - Alu blisterler (şekillendirici folyo: PA/Alu/PVC, kapatıcı folyo: Alüminyum) ve her kutuda bulunan bir adet NEOHALER inhalasyon cihazı
NEOHALER bir tekli doz inhalasyon cihazıdır. İnhalasyon cihazının gövdesi ve kapağı, akrilonitril bütadien stiren, basma düğmeleri metil metakrilat akrilonitril bütadien stirenden yapılmıştır. İğneler ve yaylar paslanmaz çelikten imal edilmiştir.
30 kapsüllük ambalaj: Her biri 10'ar kapsül içeren 3 blister ve 1 inhaler (NEOHALER)
2 kutuluk (60 kapsül) çoklu ambalaj: Her biri 30 kapsül + 1 inhaler (NEOHALER) içeren iki kutu
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj Atıklarının Kontrolü Yönetmeliğiâne uygun olarak imha edilmelidir.
Her bir ARCAPTA kutusu içeriğinde inhalasyon kapsüllerine ek olarak bir inhalasyon cihazı
(NEOHALER) yer almaktadır. Kutu içeriği bittiğinde inhalasyon cihazı da atılmalıdır. Kullanıma ilişkin talimatlar:
ARCAPTA 150 mcg İnhaler Kapsülü kullanmadan önce lütfen Kullanma Talimatlarının tamamını okuyun.
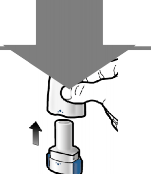
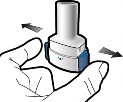
Takın
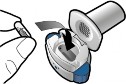
1 | Delin ve bırakın
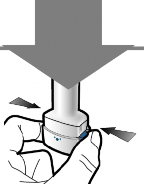
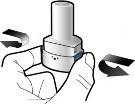
2 | Derin nefes alın
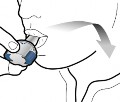
3 | Kapsülün boş olup olmadığını kontrol edin
Kontrol edin |
|
|
|
|
Adım 1a: Kapağı çekerek çıkarın | Adım 2a: Kapsülü bir kez delin İnhaleri dik tutun. Her iki yan düğmeye aynı anda sıkıca basarak kapsülü delin. | Adım 3a: Tamamen nefes verin İnhalerin içine doğru üflemeyin. | Kapsülün boş olup olmadığını kontrol edin Kapsülde toz kalıp kalmadığını görmek için inhaleri açın. |
| Kapsül delindiğinde bir ses duymanız gerekir. Kapsülü yalnızca bir kez delin. |
|
Kapsülde toz kalmışsa:
Toz kalmış Boş |
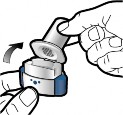
Adım 1b: İnhaleri açın |
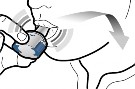
Adım 2b: Yan düğmeleri serbest bırakın | Adım 3b: İlacı derin bir nefesle içinize çekin İnhaleri resimde gösterildiği gibi tutun. Ağızlığı ağzınıza yerleştirin ve dudaklarınızı etrafına sıkıca kapatın. Yan düğmelere basmayın. |
|
İnhaleri kapatın.
 Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış.
Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
 Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir.
Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| INBROXA | 869525558954 | |
| ONBREZ | 8699504550405 | |
| Diğer Eşdeğer İlaçlar |
 |
Mide Kanseri Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir. |
 |
Dış Gebelik Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur. |
 |
Yüksek Tansiyon Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon atardamarlarınızdaki kanın basıncıdır. |
İLAÇ GENEL BİLGİLERİ
Farmanova Sağlık Hizmetleri Ltd. Şti
| Geri Ödeme Kodu | A14957 |
| Satış Fiyatı | 323.1 TL [ 22 Apr 2024 ] |
| Önceki Satış Fiyatı | 323.1 TL [ 15 Apr 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699074550126 |
| Etkin Madde | Indakaterol Maleat |
| ATC Kodu | R03AC18 |
| Birim Miktar | 150 |
| Birim Cinsi | MCG |
| Ambalaj Miktarı | 30 |
| Solunum Sistemi > Adrenerjikler (İnhalan) > Indacaterol |
| İthal ( ref. ülke : Yunanistan ) ve Beşeri bir ilaçdır. |