AFINITOR 10 mg 30 tablet Kısa Ürün Bilgisi
{ Everolimus }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
AFINITOR 10 mg tablet
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Everolimus 10 mg
Yardımcı maddeler
Laktoz monohidrat 9,8 mg
Susuz laktoz 287,5 mg Yardımcı maddeler için bölüm 6.1'e bakınız.
3. FARMASÖTİK FORMU
Tablet
Beyaz ila sarımsı, yaklaşık 15,1 mm uzunluğunda ve 6,0 mm genişliğinde, kenarı eğimli, çentiksiz uzun tabletlerdir. Tabletlerin bir yüzünde âUHEâ, diğer yüzünde âNVRâ yazılıdır.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
AFINITOR,
Hastalığı VEGF (Vasküler Endotelyal Büyüme Faktörü) hedefli tedavi sırasında veya sonrasında progresyon gösteren metastatik renal hücreli karsinomu (RHK) olan hastaların tedavisinde,
4.2. Pozoloji ve uygulama şekli
Pozoloji:AFINITOR tedavisi yalnızca, kanser tedavisi konusunda deneyim sahibi doktorlar tarafından başlatılmalı ve devam ettirilmelidir.
Erişkinlerde önerilen doz günde bir defa 10 mg'dır. Doz ayarlamaları:
Advers reaksiyonlar: Şiddetli ve/veya tolere edilemeyen şüpheli advers reaksiyonların görülmesi durumunda AFINITOR dozu azaltılması ve/veya AFINITOR tedavisine geçici ara verilmesi gerekebilir. Derece 1 advers reaksiyonlar için genellikle doz ayarlaması gerekli değildir. Eğer doz azaltılması gerekliyse, günlük 5 mg doz önerilir ve günlük doz olarak 5 mg'ın altına düşülmemesi gerekmektedir. (bkz. Bölüm 4.4). En düşük doz gücünün altında doz gereksinimlerinde gün aşırı uygulama düşünülebilir.
AFINITOR tedavisi sırasında, yan etkilerin yönetimi amacıyla doz düşürülmesi, tedaviye ara verilmesi veya durdurulması ile ilgili öneriler Tablo 1'de belirtilmektedir. Genel öneriler de verilmiştir. Hekim dozlama planına karar verirken her hasta için bireysel yarar/risk değerlendirmesini göz önünde bulundurmalıdır.
Tablo 1. Yan etkilerin yönetimi konusunda doz değişikliği önerileri
Advers etki | Şiddeti | AFINITOR Doz ayarlama |
Bulaşıcı olmayan pnömoni | Derece 2 | Semptomlar Derece ≤1 düzeyine iyileşme olana kadar tedaviye ara vermek düşünülebilir. AFINITOR tedavisine günde 5mg kullanım ile tekrar başlanır. Eğer 4 hafta içinde iyileşme görülmezse tedavi sonlandırılır. |
Derece 3 | Semptomlar Derece â¤1 düzeyine iyileşme olana kadar tedaviye ara vermek düşünülebilir. AFINITOR tedavisine günde 5mg kullanım ile tekrar başlanması düşünülebilir. Eğer Derece 3 toksisite tekrar görülürse, tedavinin kesilmesi düşünülebilir. | |
Derece 4 | AFINITOR tedavisi sonlandırılır. | |
Stomatit | Derece 2 | Derece â¤1 düzeyine iyileşme olana dek tedavi geçici olarak durdurulur. AFINITOR tedavisine aynı dozda devam edilir. Eğer Derece 2 stomatit tekrar görülürse Derece â¤1 düzeyine iyileşme olana dek tedavi geçici olarak durdurulur. AFINITOR tedavisine günde 5mg kullanım ile tekrar başlanır. |
| Derece 3 | Derece â¤1 düzeyine iyileşme olana kadar tedavi geçici olarak durdurulur. AFINITOR tedavisine günde 5mg kullanım ile tekrar başlanır. |
Derece 4 | AFINITOR tedavisi sonlandırılır. | |
Diğer hematolojik olmayan toksisiteler (metabolik olaylar hariç) | Derece 2 | Toksisite tolere edilebilirse doz ayarlamasına gerek yoktur. Eğer toksisite tolere edilemeyecek seviyeye gelirse, Derece â¤1 düzeyine iyileşme olana kadar AFINITOR tedavisi geçici olarak kesilir. AFINITOR tedavisine aynı dozda tekrar başlanır. Eğer Derece 2 toksisite tekrar ederse, Derece â¤1 düzeyine iyileşme olana kadar AFINITOR tedavisi kesilir. AFINITOR tedavisine günde 5mg kullanım ile tekrar başlanır. |
Derece 3 | Derece â¤1 düzeyine iyileşme olana kadar doz geçici olarak durdurulur. AFINITOR tedavisine günde 5mg kullanım ile tekrar başlanması düşünülebilir. Eğer Derece 3 toksisite tekrar görülürse, tedavinin kesilmesi düşünülebilir. | |
Derece 4 | AFINITOR tedavisi sonlandırılır. | |
Metabolik olaylar (ör. Hiperglisemi, dislipidemi) | Derece 2 | Doz ayarlaması gerekli değildir. |
Derece 3 | Tedavi geçici olarak durdurulur. AFINITOR tedavisine günde 5mg kullanım ile tekrar başlanır. | |
Derece 4 | AFINITOR tedavisi sonlandırılır. | |
Trombositopeni | Derece 2 (<75, ≥50x10/L) | Derece â¤1 (â¥75x10/L) düzeyine iyileşme olana kadar doz geçici olarak durdurulur. AFINITOR tedavisine aynı dozda devam edilir. |
Derece 3&4 (<50x10/L) | Derece â¤1 (â¥75x10/L) düzeyine iyileşme olana kadar doz geçici olarak durdurulur. AFINITOR tedavisine günde 5mg kullanım ile tekrar başlanır. | |
Nötropeni | Derece 2 | Doz ayarlaması gerekli değildir. |
| (â¥1x10/L) |
|
Derece 3 (<1, â¥0,5x10/L) | Derece â¤2 (â¥1x10/L) düzeyine iyileşme olana kadar AFINITOR tedavisi kesilir. AFINITOR tedavisine aynı dozda tekrar başlanır. | |
Derece 4 (<0,5x10/L) | Derece â¤2 (â¥1x10/L) düzeyine iyileşme olana kadar AFINITOR tedavisi kesilir. AFINITOR tedavisine günde 5mg kullanım ile tekrar başlanır. | |
Febril nötropeni | Derece 3 | Derece â¤2 (â¥1,25x10/L) düzeyine iyileşme olana kadar ve ateş geçinceye kadar AFINITOR tedavisi kesilir. AFINITOR tedavisine günde 5mg kullanım ile tekrar başlanır. |
Derece 4 | AFINITOR tedavisi sonlandırılır. | |
Uygulama sıklığı ve süresi:
Tedavi klinik yarar gözlendiği sürece ya da kabul edilemez bir toksisite meydana gelene kadar devam ettirilmelidir.
Uygulama şekli:
AFINITOR tablet bir bardak su ile yutulmalıdır. Tabletler ısırılmamalı ya da parçalanmamalıdır.
Tabletleri yutamayan hastalar için AFINITOR tablet(ler) içmeden hemen önce bir bardak suda (yaklaşık 30 mL içeren) yavaşça karıştırarak çözülmelidir. Bardak aynı hacimdeki suyla çalkalanmalı ve bu su tüm dozun tamamen yutulmasını sağlamak üzere içilmelidir.
AFINITOR, ya sürekli olarak açlık durumunda ya da sürekli olarak yemeklerle birlikte oral yoldan günde bir kere ve her gün aynı saatte uygulanmalıdır.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek yetmezliği:
Doz ayarlaması gerekli değildir (bkz. Bölüm 5).
Karaciğer yetmezliği:
Hafif şiddette karaciğer yetmezliği olan hastalar için (Child-Pugh A); önerilen doz günde 7,5 mg'dır.
4.3. Kontrendikasyonlar
AFINITOR, etkin madde (everolimus), diğer rapamisin türevleri ya da yardımcı maddelerden herhangi birine karşı bilinen aşırı duyarlılığı olan hastalarda kontrendikedir.
4.4. Özel kullanım uyarıları ve önlemleri
Bulaşıcı olmayan pnömoni
Bulaşıcı olmayan pnömoni, AFINITOR da dahil olmak üzere rapamisin türevlerinin bilinen bir sınıf etkisidir. Bulaşıcı olmayan pnömoni (interstisyel akciğer hastalığı da dahil), AFINITOR kullanan hastalarda sıklıkla tanımlanmıştır (bkz. Bölüm 4.8). Bazı vakalar şiddetli olup, nadir durumlarda ölümcül bir sonuç gözlenmiştir. Hipoksi, plevral efüzyon, öksürük ya da dispne gibi spesifik olmayan akciğer belirti ya da semptomları olan ya da uygun tetkiklerle
bulaşıcı, neoplastik ya da diğer tıbbi olmayan nedenlerin olasılık dışı bırakıldığı hastalarda bulaşıcı olmayan pnömoni tanısı düşünülmelidir. Enfeksiyöz olmayan pnömoninin ayırt edici tanısında pneumocystis jirovecii (carinii) pnömonisi (PJP/PCP) gibi fırsatçı enfeksiyonlar ekarte edilmelidir (bkz. Bölüm 4.4 â aşağıdaki Enfeksiyonlar başlığı). Hastalara yeni ya da kötüleşen akciğer semptomlarını acilen bildirmeleri söylenmelidir.
Bulaşıcı olmayan pnömoniye işaret eden radyolojik değişikliklerin geliştiği ve birkaç semptomun gözlendiği ya da herhangi bir semptomun gözlenmediği hastalar doz ayarlaması yapmadan AFINITOR tedavisine devam edebilirler. Eğer semptomlar orta (derece 2) ya da şiddetliyse (derece 3) klinik semptomlarda iyileşme sağlanana kadar kortikosteroid tedavisi uygulanabilir.
Enfeksiyöz olmayan pnömoninin tedavisi için kortikosteroidlere gereksinim duyan hastalarda PJP/PCP için profilaksi düşünülebilir.
Enfeksiyonlar
AFINITOR'un immünosüpresif özellikleri olduğundan, hastaları bakteriyel, fungal, viral veya protozoal enfeksiyona fırsatçı patojenlerin neden olduğu enfeksiyonlar da dahil daha yatkın hale getirebilir (bkz. Bölüm 4.8). AFINITOR tedavisi uygulanan hastalarda, pnömoni, diğer bakteriyel enfeksiyonlar ve invazif fungal enfeksiyonlar aspergilozis ya da kandidiyazis, veya PJP/PCP ve Hepatit B virüsünün reaktivasyonu da dahil olan viral enfeksiyonlar gibi lokalize ve sistemik enfeksiyonlar gözlenmiştir. Bu enfeksiyonların bazıları şiddetlidir (örn. sepsis, solunum veya karaciğer yetmezliğine neden olmaktadır) ve nadiren ölüme yol açabilmektedir.
Doktorlar ve hastalar, AFINITOR tedavisi ile artan enfeksiyon riskinin bilincinde olmalıdır. Önceden var olan enfeksiyonlar uygun şekilde tedavi edilmeli ve AFINITOR ile tedaviye başlamadan önce tamamen iyileşmiş olmalıdır. AFINITOR kullanılırken enfeksiyon semptom ve belirtilerine karşı tetikte olunuz; enfeksiyon teşhisi konulursa, derhal uygun tedaviyi başlatınız ve AFINITOR'a ara vermeyi veya kesmeyi değerlendiriniz.
İnvazif sistemik mantar enfeksiyonu teşhisi konulursa, AFINITOR tedavisi derhal ve bir daha başlanmamak üzere kesilmeli ve hasta uygun antifungal tedavi ile tedavi edilmelidir.
Everolimus kullanmış olan hastalarda bazıları ölümle sonuçlanan PJP/PCP olguları bildirilmiştir. Bu olgular, kortikosteroidlerin veya bağışıklık sistemini baskılayıcı diğer ajanların eşzamanlı kullanımı ile ilişkili olabilir.
Kortikosteroidlerin veya bağışıklık sistemini baskılayıcı diğer ajanların eşzamanlı kullanımı gerekli olduğunda söz konusu durum için profilaksi göz önünde bulundurulmalıdır.
Aşırı duyarlılık reaksiyonları
Everolimus kullanımında, anafilaksi, dispne, yüzde ve boyunda ani kızarıklık, göğüs ağrısı veya anjiyoödem (örn. solunum fonksiyon bozukluğu ile veya solunum fonksiyon bozukluğu olmaksızın hava yollarının veya dilin şişmesi) içeren ancak bunlarla sınırlı olmayan semptomlarla kendini gösteren aşırı duyarlılık reaksiyonları gözlenmiştir (bkz. Bölüm 4.3).
Anjiyotensin dönüştürücü enzim (ADE) inhibitörlerinin eşzamanlı kullanımı
Eşzamanlı olarak ADE inhibitörü (örn. ramipril) tedavisi alan hastalar anjiyoödem açısından artmış risk altında olabilirler (örn., solunum bozukluğunun eşlik ettiği veya etmediği, solunum yollarında veya dilde şişme) (bkz. Bölüm 4.5).
Stomatit
AFINITOR ile tedavi edilen hastalarda ağız ülserleri ve oral mukozit de dahil olmak üzere stomatit, en sık bildirilen advers reaksiyondur (bkz. Bölüm 4.8). Stomatit çoğunlukla
tedavinin ilk 8 haftasında oluşur. AFINITOR artı eksemestan ile tedavi edilen postmenopozal meme kanseri hastalarında yapılan tek kollu bir çalışma, ilk 8 hafta tedavisi sırasında gargara halinde verilen alkolsüz kortikosteroid oral çözeltisinin stomatit insidansını ve ciddiyetini azaltabileceğini göstermektedir. (bkz. Bölüm 5.1). Bu nedenle, stomatit tedavisi, gargara olarak alkolsüz kortikosteroid oral çözeltisi gibi profilaktik ve / veya topikal tedavilerin terapötik kullanımını içerebilir. Bununla birlikte, durumu şiddetlendirdiği için alkol, hidrojen peroksit, iyot ve kekik türevleri içeren ürünlerden kaçınılmalıdır. Özellikle steroid bazlı medikal ürünlerle tedavi edilen hastalarda mantar enfeksiyonunun izlenmesi ve tedavisi önerilmektedir. Fungal enfeksiyon tanısı konulmadıkça antifungal ajanlar kullanılmamalıdır. (bkz. Bölüm 4.5).
Böbrek yetmezliği olayları
AFINITOR ile tedavi edilen hastalarda, bazıları ölümle sonuçlanan böbrek yetmezliği vakaları (akut böbrek yetmezliği dahil) gözlenmiştir (bkz. Bölüm 4.8). Özellikle hastalarda böbrek fonksiyonlarını daha da bozabilecek ek risk faktörlerinin bulunduğu durumlar başta olmak üzere, böbrek fonksiyonu izlenmelidir.
Laboratuvar testleri
Böbrek fonksiyonu
AFINITOR kullanan hastalarda serum kreatinin düzeyinde genellikle hafif şiddette yükselme ve proteinüri bildirilmiştir (bkz. Bölüm 4.8). AFINITOR tedavisi başlatılmadan önce ya da başlatıldıktan sonra düzenli olarak, kan üre azotu (BUN), idrarda protein ya da serum kreatinin düzeyi ölçümleri de dahil olmak üzere böbrek fonksiyonunun takibi önerilmektedir.
Kan glukozu
AFINITOR kullanan hastalarda hiperglisemi bildirilmiştir (bkz. Bölüm 4.8). AFINITOR tedavisi başlatılmadan önce ya da başlatıldıktan sonra düzenli olarak açlık serum glukoz düzeyinin takip edilmesi önerilmektedir. AFINITOR, hiperglisemiye sebep olabilecek başka ilaçlarla beraber kullanıldığında özellikle takip edilmelidir. AFINITOR tedavisi başlatılmadan önce optimal glisemik kontrol sağlanmalıdır.
Kan lipidleri
AFINITOR alan hastalarda dislipidemi (hiperkolesterolemi ve hipertrigliseridemiyi içeren) bildirilmiştir. AFINITOR ile tedaviye başlamadan önce ve daha sonra periyodik olarak kan kolesterolü ve trigliseridlerinin takibi ve uygun ilaçlarla tedavi önerilir.
Hematolojik parametreler
AFINITOR kullanan hastalarda hemoglobin, lenfosit, nötrofil ve trombosit düzeylerinde azalma bildirilmiştir (bkz. Bölüm 4.8). AFINITOR tedavisi başlatılmadan önce ya da başlatıldıktan sonra düzenli olarak tam kan sayımı takibi önerilmektedir.
Fonksiyonel karsinoid tümörler
Randomize, çift kör, çok merkezli bir klinik çalışmada, fonksiyonel karsinoid tümörlü hastalarda AFINITOR ile depo oktreotid ve plasebo ile depo oktreotid karşılaştırması yapılmıştır. Çalışmada, primer etkililik sonlanım noktası (progresyonsuz sağkalım [PFS]) karşılanmamış ve genel sağkalım ara analizi sayısal olarak plasebo ve depo oktreotid kolu lehine sonuçlanmıştır. Bu nedenle, fonksiyonel karsinoid tümörü olan hastalarda AFINITOR güvenlilik ve etkililiği kanıtlanmamıştır.
Gastrointestinal veya akciğer kökenli nöroendokrin tümörlerin prognostik faktörleri
Fonksiyonel olmayan gastrointestinal veya akciğer nöroendokrin tümörleri olan ve iyi prognostik başlangıç faktörleri, örneğin primer tümör yeri ileum ve kromogranin A değerleri normal olan veya kemik tutulumu olmayan, olan hastalarda bireysel yarar/risk değerlendirilmesi AFINITOR tedavisine başlamadan önce yapılmalıdır. Primer tümörü ileumda olan alt grup hastalarda PFS yararına dair kısıtlı bulgu rapor edilmiştir (bkz. Bölüm 5.1).
İlaç-ilaç etkileşimleri
CYP3A4 inhibitörleri ve indükleyicileri ve/veya çoklu ilaç akış pompası P-glikoproteinin (PgP) ile eşzamanlı uygulamadan kaçınılmalıdır. (bkz. Bölüm 4.5).
Orta derecede güçlü CYP3A4 ve/veya PgP inhibitörleri ile eş zamanlı uygulamada dikkatli olunmalıdır. Eğer orta derecede güçlü CYP3A4 ve/veya PgP inhibitörü veya indükleyicisi ile eşzamanlı uygulama yapılması gerekiyorsa, hastanın klinik durumu yakından izlenmelidir. Öngörülen EAA değerine dayalı olarak AFINITOR dozunda ayarlanma gerekebilir.
Güçlü CYP3A4/PgP inhibitörleri ile eşzamanlı tedavi, everolimusun plazma konsantrasyonlarında önemli artışa neden olur (bkz. Bölüm 4.5). Bu durumda doz önerilerinde bulunabilmek için henüz yeterli veri mevcut değildir. Bu nedenle AFINITOR ile kuvvetli CYP3A4 inhibitörlerinin eşzamanlı kullanımı önerilmemektedir.
AFINITOR, ilaç etkileşimleri potansiyeli nedeniyle, dar terapötik indekse sahip oral yoldan uygulanan CYP3A4 substratları ile kombinasyon halinde alınırken dikkatli olunmalıdır. Eğer AFINITOR, dar bir terapötik indekse sahip oral yoldan uygulanan CYP3A4 substratları (örneğin, pimozid, terfenadin, astemizol, sisaprid, kinidin veya ergot alkaloid türevleri) ile birlikte alınıyorsa hasta, oral yoldan uygulanan CYP3A4 substratının ürün bilgisinde tarif edilen istenmeyen etkiler açısından takip edilmelidir (bkz. Bölüm 4.5).
Karaciğer yetmezliği
Everolimusa maruziyet, hafif şiddette (Child-Pugh A), orta şiddette (Child-Pugh B) ve şiddetli (Child-Pugh C) karaciğer bozukluğu olan hastalarda artış göstermiştir (bkz. Bölüm 5.2).
Potansiyel yarar riskten ağır basmadıkça, şiddetli karaciğer bozukluğu (Child-Pugh C) olan hastalarda everolimusun kullanılması önerilmemektedir (bkz. Bölüm 4.2 ve Bölüm 5.2).
Karaciğer yetmezliği olan hastalarda yan etkilerin yönetimi için doz ayarlanmasını destekleyecek klinik güvenliliği ya da etkililiğine ait veriler henüz bulunmamaktadır.
Aşılar
AFINITOR ile tedavi sırasında canlı aşıların kullanımından kaçınılmalıdır (bkz. bölüm 4.5). Yara iyileşmesi komplikasyonları
Bozulmuş yara iyileşmesi, AFINITOR dahil rapamisin türevlerinin bir sınıf etkisidir. Bu nedenle perioperatif dönemde AFINITOR kullanımında dikkatli olunmalıdır.
Radyasyon tedavisi komplikasyonları
Everolimus radyasyon tedavisi sırasında ya da hemen sonrasında alındığında, ölümle sonuçlanan vakalar dahil olmak üzere ciddi ve şiddetli radyasyon reaksiyonları (örneğin, radyasyon özofajiti, radyasyon pnömoniti ve radyasyon kaynaklı deri yaralanması) bildirilmiştir. Bu nedenle everolimus alan hastalarda radyasyon tedavisi ile yakın bir zamansal ilişki içinde olan radyasyon toksisitesi kuvvetlenmesine dikkat edilmelidir.
Buna ek olarak, geçmişte radyasyon tedavisi görmüş, everolimus alan hastalarda radyasyon hatırlama sendromu (RRS â radiation recall sydrome) bildirilmiştir. RRS durumunda everolimusa ara verilmesi ya da everolimusun durdurulması düşünülmelidir.
Laktoz:
Bu tıbbi ürün 148,65 mg laktoz içerir. Nadir kalıtımsal galaktoz intoleransı, toplam laktaz yetmezliği ya da glukoz-galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Everolimus CYP3A4'ün bir substratı ve çoklu ilaç atım pompası P-glikoproteinin (PgP) orta düzeyde bir substratı ve inhibitörüdür. Everolimusun emilimi ve takip eden eliminasyonu, CYP3A4 ve/veya PgP'yi etkileyen ürünlerden etkilenebilir. İn vitro koşullarda everolimus, CYP3A4'ün kompetitif inhibitörü ve CYP2D6'nın karma inhibitörüdür.
Seçilmiş CYP3A4 ve PgP inhibitörleri ve indükleyicileriyle ile bilinen ve teorik etkileşimler aşağıda Tablo 2'de listelenmiştir.
Everolimus konsantrasyonlarını yükselten CYP3A4 ve PgP inhibitörleri:
CYP3A4 ya da PgP inhibitörleri olan maddeler, everolimusun metabolizmasını ya da intestinal hücrelerden dışa atılımını azaltarak kandaki everolimus konsantrasyonlarını yükseltebilirler.
Everolimus konsantrasyonlarını düşüren CYP3A4 ve PgP indükleyicileri:
CYP3A4 ya da PgP indükleyicileri olan maddeler, everolimusun metabolizmasını ya da intestinal hücrelerden dışa atılımını artırarak kandaki everolimus konsantrasyonlarını düşürebilirler.
Tablo 2. Diğer etkin maddelerin everolimus üzerindeki etkileri
Etkileşime göre etkin madde | Etkileşim âEverolimus EAA/Cdeğerinde değişiklik | Eşzamanlı uygulama ile ilgili öneriler |
| Geometrik ortalama oranı (gözlenen aralık) |
|
| ||
Kuvvetli CYP3A4/PgP inhibitörleri | ||
Ketokonazol | EAA â15,3 kat (aralık 11,2-22,5) Câ4,1 kat | AFINITOR ve kuvvetli inhibitörlerin eşzamanlı uygulanması önerilmez. |
| (aralık 2,6-7) |
|
İtrakonazol, posakonazol, vorikonazol | İncelenmemiştir. Everolimus konsantrasyonunda büyük bir artış beklenir. |
|
Telitromisin, |
|
|
klaritromisin |
|
|
Nefazodon | ||
Ritonavir, atazanavir, sakuinavir, darunavir, indinavir, nelfinavir | ||
Orta düzey CYP3A4/PgP inhibitörleri | ||
Eritromisin | EAA â4,4 kat | Orta güçte CYP3A4 inhibitörleri veya PgP inhibitörlerinin eşzamanlı olarak uygulanmasından kaçınılamazsa dikkat gösterilmelidir. Hastalara orta şiddette bir CYP3A4 veya PgP inhibitörünün eşzamanlı olarak uygulanması gerekirse, günlük 5 mg veya günlük 2,5 mg'a doz azaltımı düşünülmelidir. Ancak bu doz ayarlamasına ilişkin klinik veri yoktur. Bireysel değişkenlikten dolayı önerilen doz ayarlaması tüm bireylerde ideal olmayabilir, bu nedenle yan etkiler açısından yakın takip önerilmektedir (bkz. Bölüm 4.2 ve 4.4). Orta güçteki inhibitörün kullanılması bırakılırsa, AFINITOR dozu eşzamanlı uygulamanın başlatılmasından önce kullanılan doza döndürülmeden önce en az 2 ila 3 günlük (en yaygın kullanılan orta güçteki inhibitörler için ortalama eliminasyon süresi) bir arınma periyodu düşünülmelidir. |
| (aralık 2-12,6) | |
| Câ2 kat | |
| (aralık 0,9-3,5) | |
İmatinib | EAA â 3,7 kat | |
| Câ 2,2 kat | |
Verapamil | EAA â3,5 kat | |
| (aralık 2,2-6,3) | |
| Câ2,3 kat | |
| (aralık1,3-3,8) | |
Siklosporin oral | EAA â2,7 kat | |
| (aralık 1,5-4,7) | |
| Câ1,8 kat | |
| (aralık 1,3-2,6) | |
Kannabidiol | EAA â2,5 kat | |
(P-gp inhibitörü) | Câ2,5 kat | |
Flukonazol | İncelenmemiştir. Maruziyette artış beklenir. | |
Diltiazem | ||
Dronedaron | İncelenmemiştir. Maruziyette artış beklenir. | |
Amprenavir, fosamprenavir | İncelenmemiştir. Maruziyette artış beklenir. | |
Greyfurt suyu ya da CYP3A4/PgP'yi etkileyen diğer besinler | İncelenmemiştir. Maruziyette artış beklenir (etki, geniş ölçüde değişkenlik gösterir). | Kombinasyondan kaçınılmalıdır. |
Kuvvetli CYP3A4 indükleyicileri | ||
Rifampisin | EAA â%63 | Potent CYP3A4 indükleyicilerinin eşzamanlı olarak kullanılmasından kaçınılmalıdır. Hastaya potent bir CYP3A4 indükleyicisinin eşzamanlı olarak uygulanması gerekirse, AFINITOR dozunun, indükleyicinin başlatılmasından itibaren 4 ve 8. günlerde uygulanan 5 mg veya daha az artırmalarla günlük 10 mg'dan günlük 20 mg'a yükseltilmesi düşünülmelidir. Bu AFINITOR dozunun EAA değerini indükleyiciler yokluğunda gözlenen aralıkta tutacağı öngörülmektedir. Ancak bu doz ayarlamasına ilişkin klinik veri yoktur. İndükleyici ile tedavi bırakılırsa, AFINITOR dozu eşzamanlı uygulamanın başlatılmasından önce kullanılan doza döndürülmeden önce en az 3 ila 5 günlük (anlamlı enzim deindüksiyonu için makul süre) bir arınma periyodu düşünülmelidir. |
| (aralık %0-80) | |
| Câ%58 | |
| (aralık %10-70) | |
Deksametazon | İncelenmemiştir. Maruziyette düşüş beklenir. | |
Karbamazepin, fenobarbital, fenitoin | İncelenmemiştir. Maruziyette düşüş beklenir. | |
Efavirenz, nevirapin | İncelenmemiştir. Maruziyette düşüş beklenir. | |
St John's Wort (Hypericum perforatum |
İncelenmemiştir. Maruziyette büyük bir düşüş beklenir. | Everolimus ile tedavi sırasında sarı kantaron içeren preparatlar kullanılmamalıdır. |
Plazma konsantrasyonları everolimus tarafından değiştirilebilecek ajanlar:
İn vitro sonuçlara dayalı olarak, 10 mg'lık günlük oral dozların alınmasından sonra elde edilen sistemik konsantrasyon PgP, CYP3A4 ve CYP2D6 inhibisyonunu olasılık dışı bırakmaktadır. Diğer yandan bağırsakta CYP3A4 ve PgP inhibisyonu ekarte edilememektedir.
Sağlıklı gönüllülerdeki bir etkileşim çalışması, duyarlı bir CYP3A substrat probu olan midazolamın oral dozunun everolimus ile eşzamanlı uygulanmasının, midazolamın Cdeğerinde %25'lik bir artışa ve midazolamın EAAdeğerinde %30'luk bir yükselmeye yol açtığını göstermiştir. Bu etki olasılıkla intestinal CYP3A4'ün everolimus tarafından inhibe edilmesinden kaynaklanmaktadır. Bu nedenle everolimus, oral yolla eşzamanlı uygulanan CYP3A4 substratlarının biyoyararlanımını etkileyebilir. Bununla birlikte sistemik uygulanan CYP3A4 substratlarının maruziyeti üzerinde klinik açıdan anlamlı bir etki beklenmez (bkz. Bölüm 4.4).
Everolimus ve depo oktreotidin eşzamanlı olarak uygulanması, oktreotid Cdeğerini 1,47'lik geometrik ortalama oranıyla (everolimus/plasebo) artırmış olup, bu durumun ilerlemiş nöroendokrin tümörleri olan hastalarda everolimusa etkililik yanıtı üzerinde klinik olarak anlamlı etkileri saptanamamıştır.
Everolimus ile eksemestanın bir arada uygulanması, eksemestanın Cve Cdeğerlerini sırasıyla %45 ve %64 yükseltmiştir. Diğer yandan, estradiolun aynı değerleri kararlı durumda (4 hafta) iki tedavi kolu arasında farklılık göstermemiştir. Kombinasyonu almakta olan, hormon reseptörü pozitif ilerlemiş meme kanserli hastalarda eksemestan ile bağlantılı olarak advers reaksiyonlarda bir artış gözlenmemiştir. Eksemestan düzeylerindeki artışın etkililik ya da güvenlilik üzerinde bir etkisi olması olası değildir.
Anjiyotensin dönüştürücü enzim (ADE) inhibitörlerinin eşzamanlı kullanımı:
Eşzamanlı olarak ADE inhibitörü (örn. ramipril) tedavisi alan hastalar anjiyoödem açısından daha yüksek risk altında olabilirler (bkz. Bölüm 4.4).
Aşılar:
Aşılara verilen immün yanıt etkilenebilir ve bu nedenle AFINITOR ile yapılan tedavi sırasında aşılamanın etkisi azalabilir. AFINITOR ile yapılan tedavi sırasında canlı aşıların kullanılmasından kaçınılmalıdır. Canlı aşılara örnekler: burun içi grip, kızamık, kabakulak, kızamıkçık, oral polio, BCG, sarı humma, su çiçeği ve TY21a tifo aşıları.
Radyasyon tedavisi:
Everolimus alan hastalarda radyasyon tedavisi kaynaklı toksisitenin kuvvetlendiği bildirilmiştir (bkz. Bölüm 4.4 ve 4.8).
Özel popülasyonlara ilişkin ek bilgiler
Özel popülasyonlara ilişkin veri bulunmamaktadır.
Pediatrik popülasyon:
Pediatrik popülasyonlara ilişkin veri bulunmamaktadır.
4.6. Gebelik ve laktasyon
Gebelik kategorisi D'dir.
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeline sahip kadınlar, everolimus kullanırken ve tedavinin sona ermesini takiben 8 haftaya kadar, yüksek etkililiğe sahip bir doğum kontrol yöntemi kullanmalıdır (örn., oral, enjekte veya implante östrojen içermeyen hormonal doğum kontrol yöntemi, progesteron bazlı doğum kontrol hapları, histerektomi, tübal ligasyon, tam kaçınma, bariyer yöntemleri, rahim içi araç [RIA] ve/veya kadının/erkeğin kısırlaştırılması). AFINITOR kullanan erkek hastalar baba olma girişiminde bulunmaktan alıkonmamalıdır.
Gebelik dönemi
Everolimusun hamile kadınlarda kullanımına ilişkin yeterli veri bulunmamaktadır. Hayvanlar üzerinde yapılan çalışmalar embriyotoksisite ve fetotoksisiteyi içeren üreme toksisite etkilerini göstermektedir (bkz. Bölüm 5.3). İnsanlar için potansiyel risk bilinmemektedir.
Everolimus kullanımı gebelik döneminde ve kontrasepsiyon kullanmayan gebe kalma potansiyeline sahip kadınlarda önerilmemektedir.
AFINITOR gerekli olmadıkça gebelik döneminde kullanılmamalıdır.
Laktasyon dönemi
Everolimusun insan sütüyle atılıp atılmadığı bilinmemektedir. Hayvanlar üzerinde yapılan çalışmalar, everolimusun ve metabolitlerinin sütle atıldığını göstermektedir (bkz. Bölüm 5.3). AFINITOR kullanan kadınlar, bu nedenle bebeklerini tedavi süresince ve son dozdan sonraki 2 hafta süresince emzirmemelidir.
Üreme yeteneği/Fertilite
Everolimusun kadın ve erkek hastalarda infertiliteye sebebiyet verme potansiyeli bilinmemektedir ancak kadın hastalarda adet düzensizlikleri, sekonder amenore ve ilişkili lüteinleyici hormon (LH)/folikül stimüle edici hormon (FSH) oran dengesizliği gözlenmiştir.
Klinik olmayan bulgulara göre, AFINITOR ile yapılan tedavi erkek ve dişi fertilitesini olumsuz yönde etkileyebilmektedir. (bkz. Bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
AFINITOR'un araç ve makine kullanımı üzerinde hafif ya da orta dereceli bir etkisi vardır. Hastalara AFINITOR ile tedavi sırasında yorgunluk hissetmeleri halinde araç ve makine kullanırken dikkatli olmaları tavsiye edilmelidir.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti
Güvenlilik profili, onaylı endikasyonlara yönelik beşi randomize, çift kör, plasebo kontrollü faz III çalışma ve altısı açık etiketli faz I ve faz II çalışmalar olan on bir klinik çalışmada AFINITOR ile tedavi edilen 2.879 hastanın birleştirilmiş verilerine dayanmaktadır.
Havuzlanmış güvenlilik verilerinden elde edilen en yaygın advers ilaç reaksiyonları (ADR) (insidansı â¥1/10 olan ve azalan sırada): stomatit, döküntü, yorgunluk, diyare, enfeksiyonlar, bulantı, iştah azalması, anemi, disguzi, pnömonit, periferik ödem, hiperglisemi, asteni, kaşıntı, ağırlıkta azalma, hiperkolesterolemi, epistaksis, öksürük ve başağrısı olmuştur.
En yaygın derece 3/4 ADR'ler (insidansı â¥1/100 ila <1/10 olan stomatit, anemi, hiperglisemi, enfeksiyonlar, yorgunluk, diyare, pnömonit, asteni, trombositopeni, nötropeni, dispne, proteinüri, lenfopeni, hemoraji, hipofosfatemi, döküntü, hipertansiyon, pnömoni, alanin aminotransferaz (ALT) artışı, aspartat aminotransferaz (AST) artışı ve diyabet olmuştur.
Klinik çalışmalardan elde edilen advers ilaç reaksiyonları:
Aşağıda, güvenlik analizinde bildirilen ADR'lerin sıklık kategorilerine göre sınıflaması verilmektedir. Advers reaksiyonlar MedDRA sistem organ sınıfına ve sıklığına göre listelenmiştir: Çok yaygın (â¥1/10); yaygın (â¥1/100 ila <1/10); yaygın olmayan (â¥1/1.000 ila
<1/100); seyrek â¥1/10.000 ila <1/1000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Her sıklık grubu ADR'ler azalan sıklık sırasına göre sunulmuştur.
Enfeksiyonlar ve enfestasyonlar Çok yaygın: Enfeksiyonlar* Kan ve lenf sistemi hastalıkları Çok yaygın: Anemi
Yaygın: Trombositopeni, nötropeni, lökopeni, lenfopeni
Yaygın olmayan: Pansitopeni Seyrek: Saf kırmızı hücre aplazisi Bağışıklık sistemi hastalıkları Yaygın olmayan: Aşırı duyarlılık
Metabolizma ve beslenme hastalıkları
Çok yaygın: İştah azalması, hiperglisemi, hiperkolesterolemi
Yaygın: Hipertrigliseridemi, hipofosfatemi, diabetes mellitus, hiperlipidemi, hipokalemi, dehidrasyon, hipokalsemi
Psikiyatrik hastalıklar Yaygın: Uykusuzluk Sinir sistemi hastalıklar
Çok yaygın: Disguzi, baş ağrısı Yaygın olmayan: Aguzi
Göz hastalıkları
Yaygın: Göz kapağı ödemi Yaygın olmayan: Konjonktivit Kardiyak hastalıklar
Yaygın olmayan: Konjestif kalp yetmezliği
Vasküler hastalıklar
Yaygın: Hemoraji, hipertansiyon, lenfödem Yaygın olmayan: Flushing, derin ven trombozu,
Solunum, göğüs bozuklukları ve mediastinal hastalıklar
Çok yaygın: Pnömoni, epistaksis, öksürük Yaygın: Dispne
Yaygın olmayan: Hemoptizi, pulmoner embolizm Seyrek: Akut solunum sıkıntısı sendromu Gastrointestinal hastalıklar
Çok yaygın: Stomatit, diyare, bulantı
Yaygın: Kusma, ağızda kuruma, karın ağrısı, mukozal inflamasyon, ağız ağrısı, dispepsi, disfaji
Hepato-biliyer hastalıklar
Yaygın: Yükselmiş aspartat aminotransferaz, yükselmiş alanin aminotransferaz
Deri ve deri altı doku hastalıkları
Çok yaygın: Döküntü, kaşıntı
Yaygın: Kuru cilt, tırnak bozukluklukları, hafif saç dökülmesi, akne, eritem, tırnak kırılması, el-ayak sendromu (palmar-plantar eritrodisestezi sendromu), deride dökülme, cilt lezyonları
Seyrek: Anjioödem*
Kas-iskelet bozukluklar, bağ doku ve kemik hastalıkları
Yaygın: Artralji
Böbrek ve idrar yolu hastalıkları
Yaygın: Proteinüri*, kanda kreatinin artışı, böbrek yetmezliği* Yaygın olmayan: Günlük idrarda artış, akut böbrek yetmezliği* Üreme sistemi ve meme hastalıkları
Yaygın: Adet düzensizliği Yaygın olmayan: Amenore *
Genel bozukluklar ve uygulama bölgesine ilişkin bozukluklar
Çok yaygın: Yorgunluk, asteni, periferik ödem Yaygın: Pireksi
Yaygın olmayan: Kalp dışı göğüs ağrısı, bozulmuş yara iyileşmesi
Araştırmalar
Çok yaygın: Ağırlık azalması
Yaralanma, zehirlenme ve prosedürlerle bağlantılı komplikasyonlar
Bilinmiyor: Radyasyon hatırlatma sendromu (Radiation recall syndrome), radyasyon reaksiyonunun kuvvetlenmesi
* âSeçilmiş istenmeyen etkiler ile ilgili açıklamalarâ kısmına da bakınız
Seçilmiş istenmeyen etkiler ile ilgili açıklamalar
Klinik çalışmalarda ve pazarlama sonrası spontan raporlarda everolimus, ölümcül sonucu da içeren ciddi hepatit B reaktivasyonu vakaları ile ilişkilendirilmiştir. Enfeksiyonların reaktivasyonu, immünsupresyon periyotları sırasında beklenen bir olaydır.
Klinik çalışmalarda ve pazarlama sonrası spontan raporlarda, everolimus böbrek yetmezliği olayları (ölümcül olanlar dahil) ve proteinüri ile ilişkilendirilmiştir. Böbrek fonksiyonunun takip edilmesi önerilmektedir (bkz. Bölüm 4.4).
Klinik çalışmalar ve pazarlama sonrası spontan raporlarda, everolimus amenore vakaları (sekonder amenore ve diğer menstrüel düzensizlikler) ile ilişkilendirilmiştir.
Klinik çalışmalarda ve pazarlama sonrası spontan bildirimlerde everolimus, bazıları ölümle sonuçlanan (PJP/ PCP) olguları ile ilişkilendirilmiştir (bkz. Bölüm 4.4).
Klinik çalışmalarda ve pazarlama sonrası spontan raporlarda, eşzamanlı ADE inhibitörü kullanımı ile birlikte ya da tek başına anjiyoödem bildirilmiştir (bkz. Bölüm 4.4).
Geriyatrik hastalar
Birleştirilmiş güvenlilik veritabanında AFINITOR ile tedavi edilen hastaların %37'inin â¥65 yaşında olduğu saptanmıştır.
AFINITOR tedavisinin bırakılmasına yol açan ADR'li onkoloji hasta sayısı â¥65 yaşındaki hastalarda daha yüksek bulunmuştur (%20'ye karşı %13). Tedavinin bırakılmasına neden olan en yaygın ADR'ler pnömoni (interstisyel akciğer hastalığı dahil), yorgunluk, dispne ve stomatit olmuştur.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99)
4.9. Doz aşımı ve tedavisi
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grubu: Antineoplastik ajanlar, protein kinaz inhibitörleri, mTOR inhibitörleri
ATC kodu: L01EG02
Etki mekanizması
Everolimus, seçici bir mTOR (rapamisinin memeli hedefi) inhibitörüdür. mTOR, aktivitesi insanlarda görülen çok sayıda kanserde arttığı bilinen önemli bir serin treonin kinazdır. Everolimus, intraselüler bir protein olan FKBP-12'ye bağlanıp, mTOR kompleksi-1 (mTORC1) aktivitesini inhibe eden bir kompleks oluşturur. mTORC1 sinyal yolağının inhibisyonu, hücre büyümesinin düzenlenmesinde görev alan S6 ribozomal protein kinazın (S6K1) aktivitesini azaltmak suretiyle ve hücre döngüsü, anjiyogenez ve glikoliz ile alakalı olan proteinleri düzenleyen ökaryotik uzatma faktörü 4E bağlayıcı proteinin (4EBP-1) aktivitesini azaltarak proteinlerin translasyonunu ve sentezini engeller. Everolimus, tümörün angiogenik süreçlerini potansiyalize eden vasküler endotelyal büyüme faktörü (VEGF) düzeylerini azaltır. Everolimus, tümör hücreleri, endotelyal hücreler, fibroblastlar ve vasküler
düz kas hücrelerinin büyümesi ve proliferasyonunun potent bir inhibitörüdür ve solid tümörlerde in vitro ve in vivo glikolizi azalttığı gösterilmiştir.
Klinik etkililik ve güvenlilik
Hormon reseptörü pozitif meme kanseri
BOLERO-2 (CRAD001Y2301), önceki letrozol veya anastrozol ile tedavi sonrası nüks veya progresyonlu östrojen reseptörü pozitif, HER 2-neu/ amplifiye olmayan ilerlemiş meme kanseri olan postmenopozal kadınlarda plasebo + eksemestan karşısında AFINITOR + eksemestana ilişkin randomize, çift kör, çok merkezli faz III çalışmadır. Hastalar, açık etiketli eksemestana (25 mg/gün) ek olarak everolimus (10 mg/gün) veya plasebo için 2:1 oranında randomize edilmiş. Önceki hormonal tedaviye hassasiyet (var/ yok) ve iç organ metastazı varlığına (var/ yok) göre katmanlama yapılmıştır. Önceki hormonal tedaviye hassasiyet (1) ilerlemiş koşullarda önceki en az bir hormonal tedaviden sonra belgelenmiş klinik fayda (tam yanıt [CR], kısmi yanıt [PR], ≥24 hafta stabil hastalık) veya (2) nüks öncesi en az 24 ay adjuvan hormonal tedavidir.
Birincil sonlanımı araştırmacı lokal radyoloji değerlendirmesine göre Solid Tümörlerde Yanıt Değerlendirme Kriterlerine (RECIST) göre progresyonsuz sağkalım (PFS) olarak belirlenmiş, Destekleyici PFS analizleri, bağımsız merkezi radyoloji değerlendirmesine dayanmıştır.
İkincil sonlanımı genel sağkalım (OS), Genel Yanıt Oranı (ORR), Klinik Fayda Oranı (CBR), Güvenlilik, Yaşam Kalitesi (QoL) değişikliği ve ECOG PS bozulmasına kadar geçen süredir. Diğerleri 6 ve 12. hafta kemik döngü değişiklikleridir.
Ek olarak 724 hasta 2:1 everolimus (10 mg/gün) + eksemestan (25 mg/gün) kombinasyonu (n= 485) veya plasebo + eksemestana (25 mg/gün) (n = 239) randomize edilmiştir. Nihai OS analizi zamanında, medyan everolimus tedavisi süresi 24 haftadır (aralık 1-199,1 hafta). Medyan eksemestan tedavisi süresi everolimus + eksemestan grubunda 29,5 hafta (1-199,1) iken, plasebo + eksemestan grubunda 14,1 haftadır (1-156).
Birincil etkililik sonlanım noktası için etkililik bulguları nihai PFS analizinden elde edilmiştir (bkz. Tablo 3 ve Şekil 1). Plasebo + eksemestan kolundaki hastalar progresyon zamanında everolimusa çapraz geçiş yapmamıştır.
Tablo 3. BOLERO-2 etkililik bulguları
Analiz | AFINITORn=485 | Plasebon=239 | Tehlike oranı | p değeri |
Medyan progresyonsuz sağkalım (ay) (%95 GA) | ||||
Araştırıcı radyolojik incelemesi | 7,8 (6,9 ila 8,5) | 3,2 (2,8 ila 4,1) | 0,45 (0,38 ila 0,54) | <0,0001 |
Bağımsız radyolojik inceleme | 11 (9,7 ila 15) | 4,1 (2,9 ila 5,6) | 0,38 (0,31 ila 0,48) | <0,0001 |
Medyan genel sağkalım (ay) (%95 GA) | ||||
Medyan genel sağkalım | 31 (28 â 34,6) | 26,6 (22,6 â 33,1) | 0,89 (0,73 â 1,1) | 0,1426 |
En iyi genel sağkalım (ay) (%95 GA) | ||||
Objektif yanıt oranı | %12,6 (9,8 ila 15,9) | %1,7 (0,5 ila 4,2) | n/a | <0,0001 |
|
|
|
|
|
Klinik fayda oranı | %51,3 (46,8 ila 55,9) | %26,4 (20,9 ila 32,4) | n/a | <0,0001 |
Şekil 1 BOLERO-2 Kaplan-Meier progresyonsuz sağkalım eğrileri (araştırıcı radyolojik incelemesi)
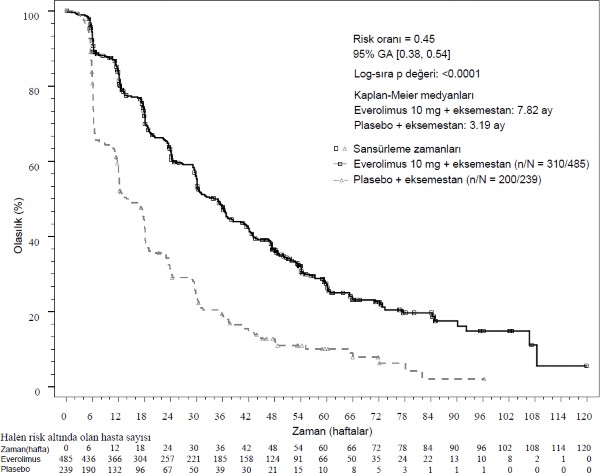
Hesaplanmış PFS tedavisi etkisi araştırıcı değerlendirmesine göre planlanmış PFS alt grup analizi ile desteklenmiştir. Analiz edilen tüm alt gruplar için (yaş, önceki hormonal tedaviye duyarlılık, tutulan organ sayısı, başlangıçta sadece kemik lezyonları durumu ve viseral metastaz varlığı ve majör demografik ve prognostik alt gruplar arasında), plasebo + eksemestana karşı 0,25 ila 0,6 arasında değişen bir hesaplanmış tehlike oranı (HR) ile everolimus + eksemestan ile pozitif bir tedavi etkisi görülmüştür.
QLQ-C30'un genel ve fonksiyonel alt birim skorlarında â¥%5 bozulmaya kadar geçen süre açısında iki kol arasında bir fark gözlenmemiştir.
BOLERO-6 (Çalışma CRAD001Y2201), östrojen reseptörü pozitif, HER2/neu negatif, lokal ilerlemiş, tekrarlayan veya önceki letrozol veya anastrozol tedavisi sırasında rekürrens veya progresyon sonrası metastatik meme kanseri olan menopoz sonrası kadınların tedavisinde
eksemestan ile kombinasyon karşısında tek başına everolimusun incelendiği üç kollu, randomize, açık etiketli bir faz II everolimus çalışmasıdır
Çalışmanın birincil amacı, yalnızca everolimusa karşı everolimus + eksemestan için PFS'nin HR'sini tahmin etmektir. Temel ikincil amaç, everolimus + eksemestan için kapesitabine karşı PFS'nin HR'sini tahmin etmektir.
Diğer ikincil amaçlar arasında OS değerlendirmesi, objektif yanıt oranı, klinik fayda oranı, güvenlilik, ECOG performansında bozulmaya kadar geçen zaman, yaşam kalitesinde bozulmaya kadar geçen zaman ve tedavi memnuniyeti (TSQM) yer almıştır. Resmi istatistiksel karşılaştırma planlanmamıştır.
Toplam 309 hasta, 1: 1: 1 oranında everolimus (günde 10 mg) + eksemestan (günde 25 mg) kombinasyonuna (n = 104), tek başına everolimus (günde 10 mg) (n = 103) veya kapesitabin (2 hafta boyunca günde iki kez 1250 mg/m2 doz, ardından bir haftalık dinlenme, 3 haftalık döngü) (n = 102) kollarına randomize edilmiştir. Verilerin kesilmesi sırasında everolimus + eksemestan kolunda ortalama tedavi süresi 27,5 hafta (aralık 2-165.7), everolimus kolunda 20 hafta (1.3-145) ve kapesitabin kolunda 26,7 hafta (1.4-177.1) olmuştur.
Yerel araştırmacı değerlendirmesine göre gözlenen 154 PFS olayı ile son PFS analizinin sonucu, everolimus koluna göre everolimus + eksemestan kolu lehine tahmini 0,74 HR (%90 GA: 0.57, 0.97) göstermiştir. Ortalama PFS sırasıyla 6,8 ay (%90 GA: 5.5, 7.2) ve 8,4 ay
(%90 GA: 6.6, 9.7) olmuştur.
Şekil 2 BOLERO-6 Kaplan-Meier progresyonsuz sağkalım eğrileri (araştırmacının radyolojik incelemesi)

Ana ikincil sonlanım noktası PFS için tahmini HR, gözlemlenen toplam 148 PFS olayına dayanarak, everolimus + eksemestan kombinasyon koluna kıyasla kapesitabin lehine 1,26 (%90 GA: 0.96, 1.66) olmuştur.
İkincil sonlanım noktası OS sonuçları, birincil sonlanım noktası PFS ile tutarlı olmamış, tek başına everolimus kolu lehine bir eğilim gözlenmiştir. Everolimus + eksemestan koluna göre
tek başına everolimus kolundaki OS'nin karşılaştırılması için tahmini HR değeri, 1,27 (%90 GA: 0.95, 1.70) bulunmuştur. Kapesitabin koluna göre everolimus + eksemestan kombinasyon kolunda OS karşılaştırması için tahmini HR 1.33'tür (%90 GA: 0.99, 1.79).
Pankreas orijinli ilerlemiş nöroendokrin tümörlerin tedavisi
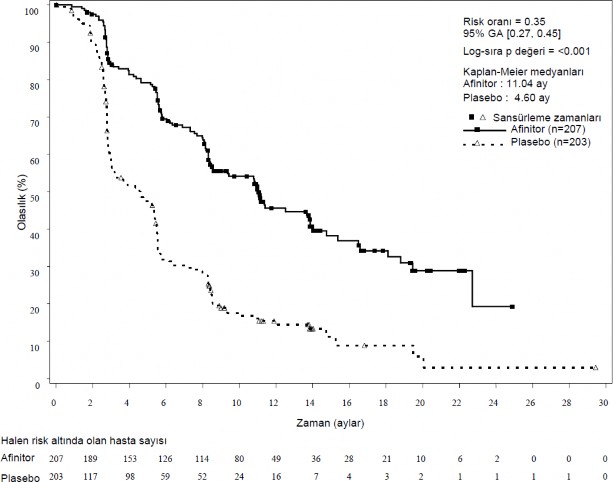
RADIANT-3 (CRAD001C2324 - ilerlemiş pankreatik nöroendokrin tümör (pNET) hastalarında plasebo artı en iyi destek tedaviye (BSC) karşı AFINITOR artı BSC ilişkin randomize, çift kör, çok merkezli faz III çalışma) , medyan PFS'de %65 risk azalması (HR 0,35; %95 GA (GA: Güven aralığı): 0,27; 0,45; p<0,0001) ve 2,4 katlık bir uzama (4,6 aya karşı 11,04 ay) ile plaseboya karşı AFINITOR'un istatistiksel olarak anlamlı klinik faydasını göstermiştir (bkz. Tablo 4 ve Şekil 3).
RADIANT-3, hastalığı önceki 12 ay içinde progrese olan, iyi ve orta derecede farklılaşmış ilerlemiş pNET'li hastaları içermektedir. BSC içinde Somatostatin analoglarına izin verilmiştir.
Birincil sonlanım araştırıcı radyolojik incelemesine göre RECIST'e göre PFS'dir. Radyolojik progresyon sonrası hastalar araştırıcı tarafından körlenmiş, plaseboya randomize olanlar daha sonra açık etiketli AFINITOR kullanabilmiştir.
İkincil sonlanım noktaları güvenlilik, ORR (CR veya PR), yanıt süresi ve OS'yi içermektedir.
Toplam 410 hasta AFINITOR 10 mg/gün (n=207) veya plaseboya (n=203) 1:1 oranda randomize edilmiş, demografikler iyi dengelenmiştir (medyan yaş 58, %55 erkek, %78,5 beyaz). Her iki koldaki hastaların %53'ü daha önce sistemik tedavi almıştır. Körlenmiş tedavinin medyan süresi, everolimus alan hastalar için 37,8 hafta (1,1 ile 129,9 hafta arasında) ve plasebo alanlar için 16,1 haftadır (0,4 ile 147 hafta arasında).
Hastalık progresyonunun ardından veya çalışmanın körlüğü kaldırıldıktan sonra, başlangıçta plaseboya randomize edilen 203 hastanın 172'si (%84,7) açık etiketli AFINITOR'a çapraz geçiş yapmıştır. Açık etiketli tedavinin medyan süresi, tüm hastalarda 47,7 hafta olarak belirlenmiştir: Everolimus'a randomize edilen ve daha sonra açık etiketli everolimusa geçiş yapan 53 hastada 67,1 hafta ve plaseboya randomize edilen ve daha sonra açık etiketli everolimusa geçiş yapan 172 hastada 44,1 haftadır.
Tablo 4. RADIANT-3 â etkililik bulguları
Popülasyon | AFINITOR n=207 | Plasebo n=203 | Tehlike oranı (%95 GA) | p-değeri |
Medyan progresyonsuz sağkalım (ay) (%95 GA) | ||||
Araştırıcı radyolojik incelemesi | 11,04 (8,41; 13,86) | 4,6 (3,06; 5,39) | 0,35 (0,27; 0,45) | <0,0001 |
Bağımsız radyolojik inceleme | 13,67 (11,17; 18,79) | 5,68 (5,39; 8,31) | 0,38 (0,28; 0,51) | <0,0001 |
Medyan genel sağkalım (ay) (%95 GA) | ||||
Medyan genel sağkalım | 44,02 (35,61; 51,75) | 37,68 (29,14; 45,77) | 0,94 (0,73; 1,2) | 0,3 |
Şekil 3 RADIANT-3 â Kaplan-Meier progresyonsuz sağkalım eğrileri (araştırıcı radyolojik incelemesi)
Gastrointestinal veya akciğer kökenli ilerlemiş nöroendokrin tümörlerinin tedavisi
Plasebo ile birlikte en iyi destek tedavisi (BSC) karşısında AFINITOR artı BSC'nin değerlendirildiği randomize, çift kör, çok merkezli bir faz III çalışma olan RADIANT-4 (çalışma CRAD001T2302) ilerlemiş, iyi diferansiye (Derece 1 ya da 2) fonksiyonel olmayan, gastrointestinal veya akciğer kökenli nöroendokrin tümörleri olan, karsinoid sendrom öyküsü ya da karsinoid sendrom ile ilişkili aktif semptomları olmayan hastalar ile yürütülmüştür.
Çalışmanın birincil sonlanma noktası, bağımsız radyoloji değerlendirmesine dayalı Solid Tümörlerde Yanıt Değerlendirme Kriterleri (RECIST) ile değerlendirilen progresyonsuz sağkalım (PFS) olmuştur. Destekleyici PFS analizi, yerel araştırmacı incelemesine dayanmıştır. İkincil sonlanma noktaları genel sağkalım (OS), genel yanıt oranı, hastalık kontrol oranı, güvenlilik, Yaşam Kalitesinde değişiklik (FACT-G) ve Dünya Sağlık Örgütü performans durumu (WHO PS) bozulmasına kadar geçen süreyi içermiştir.
Toplam 302 hasta 2:1 oranında everolimus (günlük 10 mg) (n=205) ya da plasebo (n=97) almak üzere randomize edilmiştir. İki tedavi grubu çalışma başlangıcındaki demografik özellikler, hastalık karakteristikleri ve önceli somatostatin analoğu (SSA) kullanımı öyküsü bakımından genel olarak dengeli olmuştur. Hastaların medyan yaşı 63 (aralık: 22-86) olup hastaların %76'sı beyaz ırk mensubudur. Körlenmiş tedavinin medyan süresi AFINITOR alan
hastalarda 40,4 hafta ve plasebo alan hastalarda 19,6 hafta olmuştur. Birincil PFS analizinden sonra, plasebo kolundan 6 hasta açık etiketli everolimusa geçmiştir.
Birincil sonlanım noktası PFS (bağımsız radyolojik inceleme) için etkililik sonuçları, nihai PFS analizinden elde edilmiştir (bkz. Tablo 5 ve Şekil 4). PFS (araştırmacı radyolojik incelemesi) için etkililik sonuçları, son OS analizinden elde edilmiştir (bkz. Tablo 5).
Tablo 5. RADIANT-4 â Progresyonsuz sağkalım sonuçları
Popülasyon | AFINITOR n=205 | Plasebo n=97 | Tehlike oranı (%95 GA) | p-değeri |
Medyan progresyonsuz sağkalım (ay) (%95 GA) | ||||
Bağımsız radyolojik inceleme | 11,01 (9,2; 13,3) | 3,91 (3,6; 7,4) | 0,48 (0,35; 0,67) | <0,001 |
Araştırıcı radyolojik incelemesi | 14,39 (11,24; 17,97) | 5,45 (3,71; 7,39) | 0,4 (0,29; 0,55) | <0,001 |
Şekil 4 RADIANT-4 â Kaplan-Meier progresyonsuz sağkalım eğrileri (bağımsız radyolojik inceleme)

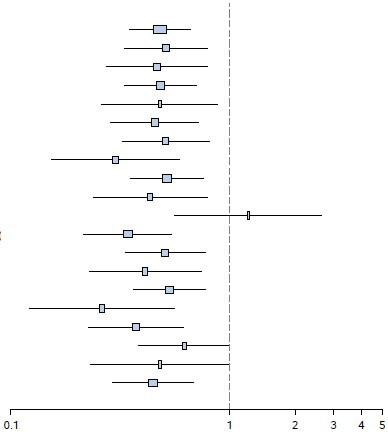
Olasılık (%)
Destekleyici analizlerde, tümör kaynaklı birincil bölge olan ileum hastalarının alt grubu hariç, tüm alt gruplarda pozitif tedavi etkisi gözlenmiştir (İleum: HR= 1,22 [%95 GA: 0,56 ila 2,65], İleum olmayan: HR= 0,34 [%95 GA: 0,22 ila 0,54] Akciğer: HR= 0,43 [%95 GA: 0,24 ila
0,79]) (bkz. Şekil 5).
Şekil 5 RADIANT-4 â Daha önceden belirlenen hasta alt grubunda pogresyonsuz sağkalım sonuçları (bağımsız radyolojik inceleme)
Yaş WHO PS
SSA öncesi
Kemoterapi öncesi
Birincil tümor yeri
Tümor derecesi
Karaciğer tümor yükü
CgA referans değeri
NSE referans değeri
Hepsi (N=302)
![]()
<65 yaş (N=159)
â¥65 yaş (N=143)
0 (N=216)
1 (N=86) Evet (N=157)
Hayır (N=145) Evet (N=77)
No (N=225)
Akciğer (N=90) İleum (N=71)
Derece 2 (N=107)
≤10% (N=228)
>10% (N=72)
>2xULN (N=139)
â¤2xULN (N=138)
>ULN (N=87)
â¤ULN (N=188)
Everolimus + BSC Plasebo + BSC
* İleum olmayan: mide, kolon, rektum, apandis, kör bağırsak, onikiparmak bağırsağı, jejunum, primer kökenli ve diğer gastrointestinal kökenli olmayan karsinom
ULN: Normal üst sınır CgA: Kromogranin A NSE: Nörona özgü enolaz
Tabakalı Cox modelinden gelen tehlike oranı (%95 GA)
Final genel sağkalım (OS) analizi, çalışmanın kör döneminde AFINITOR veya plasebo alan hastalar arasında istatistiksel olarak anlamlı bir fark göstermemiştir (HR = 0,9 [% 95 GA: 0,66-1,22]).
İki kol arasında WHO PS'de kesin bozulmaya kadar geçen süre (HR=1.02; [%95 CI: 0.65, 1.61]) ile yaşam kalitesinde kesin bozulmaya kadar geçen süre (FACT-G toplam puanı HR=0.74; [%95 CI:0.50, 1.10]) arasında fark gözlemlenmemiştir.
Renal hücreli kanser hastalarının tedavisi
Daha önce uygulanan VEGFR-TKI (vasküler endotelyal büyüme faktörü reseptörü tirozin kinaz inhibitörü) tedavisine (sunitinib, sorafenib, ya da sunitinib ve sorafenib birlikte) rağmen ilerleyen, metastatik renal hücreli karsinom hastalarında, BSC ile birlikte 10 mg/gün AFINITOR ve plasebonun karşılaştırıldığı, faz III, uluslararası, çok merkezli, randomize çift kör çalışmada, bevacizumab ve interferon-alfa ile ön tedaviye izin verilmiş, hastalar, Memorial Sloan-Kettering Kanser Merkezi (MSKCC) prognostik puanına (olumlu-, orta-,
kötü-risk grupları) ve daha önce uygulanan antikanser tedaviye göre (daha önce 1'e karşılık 2 VEGFR-TKI) sınıflandırılmıştır.
RECIST kullanılarak belgelenen ve körlenmiş, bağımsız merkezi gözden geçirmeyle değerlendirilen ilerlemenin olmadığı sağkalım birincil sonlanımdır. İkincil sonlanım, güvenlilik, objektif tümör yanıt oranı, OS, hastalıkla bağlantılı semptomlar ve yaşam kalitesini kapsar. Radyolojik ilerleme belgelendikten sonra, araştırıcı tarafından körlük kaldırılabilir: plaseboya randomize edilen hastalara açık etiketli AFINITOR 10 mg/gün uygulanabilir. Bağımsız Veri İzleme Komitesi, ikinci ara analizde, birincil sonlanıma ulaşıldığına karar vermiş ve çalışmanın sonlandırılmasını önermiştir.
416 hasta 2:1 AFINITOR (n=277) veya plasebo (n=139) alacak şekilde randomize edilmiş, demografik veriler oldukça dengelidir (Medyan yaş [61; 27 - 85], %78 erkek, %88 beyaz,
önceki VEGFR-TKI terapi sayısı [1 tedavi: %74, 2 tedavi: %26]). AFINITOR alanlarda
medyan kör tedavisüresi 141 (19 â 451) gün iken, plaseboda 60 (21 â 295) gündür. AFINITOR, birincil sonlanım noktası olan progresyonsuz sağkalımda plaseboya göre daha iyi sonuç vererek progresyon veya ölüm riskinde %67 oranında istatistiksel olarak anlamlı bir azalma sağlamıştır (bkz. Tablo 6 ve Şekil 6).
Tablo 6 RECORD-1 â Progresyonsuz sağkalım sonuçları
Popülasyon | n | AFINITOR n=277 | Plasebo n=139 | Tehlike oranı (%95 GA) | p-değeri |
|
| Medyan progresyonsuz sağkalım (ay) (%95 GA) |
|
| |
Primer analiz | |||||
Hepsi (bağımsız kör | 416 | 4,9 | 1,9 | 0,33 | <0,0001 |
merkezi |
| (4-5,5) | (1,8-1,9) | (0,25-0,43) |
|
değerlendirme) |
|
|
|
|
|
Destekleyici/hassas analizler | |||||
Hepsi (araştırmacı | 416 | 5,5 | 1,9 | 0,32 | <0,0001 |
tarafından yerel |
| (4,6-5,8) | (1,8-2,2) | (0,25-0,41) |
|
değerlendirme) |
|
|
|
|
|
MSKCC prognostik skoru (bağımsız kör merkezi değerlendirme) | |||||
İyi risk | 120 | 5,8 | 1,9 | 0,31 | <0,0001 |
|
| (4-7,4) | (1,9-2,8) | (0,19-0,5) |
|
Orta risk | 235 | 4,5 | 1,8 | 0,32 | <0,0001 |
|
| (3,8-5,5) | (1,8-1,9) | (0,22-0,44) |
|
Kötü risk | 61 | 3,6 | 1,8 | 0,44 | 0,007 |
|
| (1,9-4,6) | (1,8-3,6) | (0,22-0,85) |
|
Şekil 6 RECORD 1 â Kaplan-Meier progresyonsuz sağkalım eğrileri (bağımsız merkezi inceleme)

Altı aylık PFS plasebo ile %9'a kıyasla AFINITOR ile %36'dır.
AFINITOR hastalarının 5'inde (%2) doğrulanmış objektif tümör yanıtları gözlenmiş; plaseboda hiçbirisinde bu gözlenmemiştir. Bu nedenle ilerlemenin olmadığı sağkalım avantajı temelde, hastalık stabilizasyonu olan popülasyonu temsil etmektedir (AFINITOR ile tedavi edilenlerin %67'sine tekabül eder).
Genel sağkalım açısından tedaviyle ilişkili istatistiksel olarak anlamlı farklılık bildirilmemiştir (risk oranı 0,87; güven aralığı: 0,65 â 1,17; p = 0,177). Plaseboya randomize edilen hastaların hastalık progresyonu nedeniyle açık etiketli AFINITOR'a çapraz geçiş yapması, genel sağkalım açısından tedaviyle ilişkili farklılığın tespit edilmesi konusunda karışıklığa neden olmuştur.
Diğer çalışmalar
Stomatit, AFINITOR ile tedavi edilen hastalarda en sık bildirilen advers reaksiyondur (bkz. Bölüm Özel kullanım uyarıları ve önlemleri ve Bölüm İstenmeyen etkiler). Postmenopozal meme kanseri kadınlarda (N=92) yapılan pazarlama sonrası tek kollu bir çalışmada, stomatit insidansını ve ciddiyetini azaltmak için, deksametazon 0,5mg/5ml alkolsüz oral solüsyonü ile topikal tedavi, gargara olarak (tedavinin ilk 8 haftasında günde 4 kez) AFINITOR (everolimus, 10mg/gün) artı eksemestan (25mg/gün) ile tedavi edilen hastalara uygulanmıştır. 8. haftada derece â¥2 stomatit insidansı %2,4'tür (n=2/85 değerlendirilebilir hasta) ve bu rakam geçmişte bildirilenlerden daha düşüktür. Derece 1 stomatit insidansı %18,8'dir (n=16/85) ve derece 3 veya 4 stomatit vakası bildirilmemiştir. Bu çalışmadaki genel güvenlilik profili, hastaların %2,2'sinde (n=2/92) rapor edilen oral kandidiyazın hafifçe artan sıklığı dışında, onkoloji ve TSC düzleminde everolimus için belirlenen güvenlilik profili ile tutarlıdır.
Pediatrik popülasyon
Avrupa İlaç Ajansı, pankreas kaynaklı nöroendokrin tümörlerde, torasik nöroendokrin tümörlerde ve renal hücreli karsinomda pediatrik popülasyonun tüm alt gruplarında AFINITOR ile yapılan çalışmaların sonuçlarını sunma zorunluluğundan vazgeçmiştir (pediatrik kullanım hakkında bilgi için bkz. Bölüm 4.2)
5.2. Farmakokinetik özellikler
Genel özelliklerEverolimus, doğal ürün rapamisinden kimyasal modifikasyonla türetilen bir makrolitik laktondur. Everolimusun farmakokinetik özellikleri aşağıda ayrıntılı olarak belirtilmektedir:
Emilim:
İlerlemiş solid tümorlü hastalarda AFINITOR alımından sonra doruk everolimus konsantrasyonlarına (C) açlık durumunda ya da hafif, yağ içermeyen bir öğün ile birlikte, günlük 5 ve 10 mg everolimus uygulamasından sonra 1 saatte ulaşılır. C, 5 ve 10 mg'lık günlük dozlamada dozla orantılıdır. Everolimus bir PgP substratı ve orta derecede potent inhibitörüdür.
Besinlerin etkisi:
Sağlıklı gönüllülerde yüksek yağlı öğünler AFINITOR 10 mg'a sistemik maruziyeti (EAA ile ölçülen) %22 oranında ve doruk plazma konsantrasyonu Cdeğerini %54 oranında azaltmıştır. Düşük yağlı öğünler EAA'yi %32 ve Cdeğerini %42 azaltmıştır. Ancak besinler emilim sonrası faz konsantrasyonu-zaman profili üzerinde belirgin bir etkiye sahip olmamıştır.
Dağılım:
5 ila 5000 ng/mL aralığında konsantrasyona bağlı olan everolimusun kan-plazma oranı %17 ile %73 arasındadır. 10 mg/gün AFINITOR verilen kanser hastalarında, plazmada bulunan everolimus oranı, kan konsantrasyonunun yaklaşık %20'si olmuştur. Plazma proteinine bağlanma oranı sağlıklı gönüllülerde ve orta şiddette karaciğer yetmezliği olanlarda yaklaşık
%74'tür. İlerlemiş solid tümörleri olan hastalarda dağılım hacmi (Vd), sanal merkezi kompartıman için 191 L ve sanal periferik kompartıman için 517 L olarak saptanmıştır.
Biyotransformasyon:
Everolimus bir CYP3A4 ve PgP substratıdır. Oral uygulamayı takiben, everolimus insan dolaşımındaki temel bileşen olmaktadır. İnsanlarda altı temel metabolit belirlenmiştir; bunlar üç tane monohidroksile metabolit, iki hidrolitik açık halkalı ürün ve everolimusun fosfatidilkolin konjugatıdır. Bu metabolitler toksisite çalışmalarında kullanılan hayvan türlerinde de tanımlanmıştır ve aktiviteleri, ana bileşenden 100 kat daha düşüktür. Bu nedenle, everolimusun genel farmakolojik aktivitesine en büyük katkıyı ana ilacın yaptığı düşünülmektedir.
Eliminasyon:
Everolimusun ilerlemiş solid tümörleri olan hastalardaki 10 mg'lık günlük dozundan sonraki ortalama Kl/F (oral klerens) değeri 24,5 L/saattir. Everolimusun ortalama eliminasyon yarılanma ömrü yaklaşık olarak 30 saattir.
Kanser hastalarında spesifik atılım çalışmaları gerçekleştirilmemiştir; organ nakli ile ilgili yapılan çalışmalardan elde edilen veriler mevcuttur. Siklosporin ile birlikte tek doz radyoaktif işaretli everolimus uygulamasını takiben, radyoaktivitenin %80'i dışkı ile %5'i idrar ile atılmıştır. Ana ilaç dışkı ya da idrarda belirlenmemiştir.
Kararlı durum farmakokinetiği:
İlerlemiş solid tümörleri olan hastalarda everolimus uygulamasından sonra, kararlı durum EAAdeğeri, günlük uygulama için 5-10 mg doz aralığında olmuştur. Kararlı durum koşullarına, günlük doz rejimi ile 2 haftada ulaşılmaktadır. C5 ve 10 mg arasında dozla orantılıdır. tdeğerine doz uygulamasından 1 ila 2 saat sonra ulaşılmıştır. Kararlı durumda EAAve doz öncesi çukur konsantrasyon arasında anlamlı bir korelasyon gözlenmiştir.
Hastalardaki karakteristik özellikler
Karaciğer yetmezliği olan hastalar: Everolimusun güvenliliği, tolere edilebilirliği ve farmakokinetiği, AFINITOR tabletlerin iki ayrı tek oral doz çalışmasında, karaciğer fonksiyonu normal olan gönüllülere kıyasla karaciğer fonksiyon bozukluğu olan 8 ve 34 gönüllüde değerlendirilmiştir.
İlk çalışmada, orta derecede karaciğer yetmezliği (Child-Pugh B) olan 8 gönüllüde everolimusun ortalama EAA'sı, normal karaciğer fonksiyonuna sahip 8 gönüllüde bulunanın iki katı olmuştur.
Normal gönüllülere kıyasla farklı şiddetlerde karaciğer fonksiyon bozukluğu olan 34 gönüllüden oluşan ikinci çalışmada, hafif (Child-Pugh A), orta (Child-Pugh B) ve şiddetli (Child-Pugh C) karaciğer yetmezliği olan gönüllülerde maruziyette (yani EAA) sırasıyla 1,6 kat, 3,3 kat ve 3,6 kat artış olmuştur.
Çoklu doz farmakokinetiği simülasyonları, karaciğer yetmezliği olan hastalarda Child-Pugh durumlarına dayalı doz önerilerini desteklemektedir.
İki çalışmanın sonuçlarına dayanarak, karaciğer yetmezliği olan hastalarda doz ayarlaması önerilmektedir (bkz. Bölüm 4.2 ve 4.4).
Böbrek yetmezliği olan hastalar: İlerlemiş kanseri olan 170 hasta üzerinde gerçekleştirilen bir popülasyon farmakokinetiği çalışmasında, kreatinin klerensinin (25 - 178 mL/dak) everolimusun oral klerensi üzerinde anlamlı bir etkisi gözlenmemiştir. Nakil sonrası böbrek yetmezliği (kreatinin klerensi aralık 11 - 107 mL/dak) nakil hastalarında everolimusun farmakokinetiğini etkilememiştir.
Pediyatrik hastalar: Pediatrik kanser popülasyonunda AFINITOR kullanılması ile ilgili bir endikasyon yoktur (bkz. Bölüm 4.2).
Yaşlı hastalar: Kanser hastaları üzerinde yapılan bir popülasyon farmakokinetiği değerlendirmesinde, yaşın (27 ila 85) everolimusun oral klerensi üzerinde anlamlı bir etkisi gözlenmemiştir.
Irk: Benzer karaciğer fonksiyonlarına sahip Japon ve Batılı kanser hastalarında oral klerens değerleri benzer olmuştur. Popülasyon farmakokinetiği analizlerine dayalı olarak, siyah ırktan transplantasyon hastalarında oral klerens değerinin ortalama %20 daha yüksek olduğu görülmüştür.
5.3. Klinik öncesi güvenlilik verileri
Everolimusun klinik öncesi güvenlilik profili sıçanlarda, farelerde, mini-domuzlarda, maymunlarda ve tavşanlarda değerlendirilmiştir. Temel hedef organlar şunlardır: Birçok türde erkek ve dişi üreme sistemleri (testiküler tübüler bozulma, epididimiste sperm içeriğinin azalması ve uterus atrofisi), sıçanlarda ve farelerde akciğerler (alveolar makrofajlarda artış), maymun ve mini-domuzlarda pankreas (ekzokrin hücresinin sırasıyla degranülasyon ve vaküolasyonu ve maymunda adacık hücrelerinin dejenerasyonu), yalnızca sıçanlarda gözler (lentiküler ön sütür çizgisi opasiteleri). Sıçanların (tübüler epitelde yaşa bağlı lipofusin artışı ve hidronefrozda artışlar) ve farelerin (altta yatan lezyonların alevlenmesi) böbreklerinde küçük
değişiklikler gözlenmiştir. Maymunlarda veya mini-domuzlarda, böbrek toksisitesine rastlanmamıştır.
Arka plandaki hastalıkların (sıçanlarda kronik miyokardit, maymunların plazmasında ve kalbinde coxsackie virüs infeksiyonu, mini-domuzların gastrointestinal kanalında koksidiyozis, farelerde ve maymunlarda deri lezyonları), everolimus tedavisiyle alevlendiği gözlenmiştir. Bu bulgular genellikle terapötik maruziyet aralığının içindeki ya da üstündeki sistemik maruziyet düzeylerinde gözlenmiştir; buna tek istisna, yüksek doku dağılımının gözlendiği sıçanlardır; sıçanlarda bu durum terapötik maruziyet aralığının altında bir düzeyde meydana gelmiştir.
Erkek sıçanlarda yapılan bir fertilite çalışmasında, 0,5 mg/kg ve daha yüksek everolimus dozları testis morfolojisinde değişikliğe neden olmuş, 5 mg/kg everolimus, sperm motilitesini, sperm sayısını ve plazma testosteron düzeylerini azaltarak erkek fertilitesinde azalmaya yol açmıştır. Bu etkinin geri dönüşümlü olduğu yolunda kanıtlar bulunmuştur.
Hayvan üreme çalışmalarında dişi fertilitesi etkilenmemiştir. Ancak dişi sıçanlarda â¥0,1 mg/kg düzeyinde oral everolimus dozları (günde 10 mg'lık dozu alan hastalarda EAAdüzeyinin yaklaşık %4'ü) implantasyon öncesindeki kaybın artmasıyla sonuçlanmıştır.
Everolimus, plasentadan geçerek fötusta toksik etki göstermiştir. Everolimus sıçanlarda, terapötik düzeyin altındaki sistemik maruziyet düzeylerinde, embriyo/ fetotoksisiteye neden olmuştur. Bu mortalite olarak belirtilmektedir ve fetal ağırlığı düşürmektedir. 0,3-0,9 mg/kg arasındaki dozlarda iskelet değişikliklerinin ve malformasyonların (örneğin sternal yarık) insidansı artmıştır. Tavşanlarda geç dönem emilimin artmasına bağlı olarak embriyotoksisite kaçınılmaz olmuştur.
İlgili genotoksisite sonlanım noktalarını kapsayan genotoksisite çalışmaları, klastojenik veya mutajenik aktiviteye dair herhangi bir kanıt göstermemiştir. Everolimusun 2 yıla kadar uygulanması, farelerde ve sıçanlarda, tahmini klinik maruziyetin sırasıyla 3,9 ve 0,2 katına karşılık gelen en yüksek dozlara kadar herhangi bir onkojenik potansiyel göstermemiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Susuz laktoz (sığır kaynaklı) Laktoz monohidrat (sığır kaynaklı) KrospovidonHidroksipropil metilselüloz Magnezyum stearat Butilhidroksitoluen
6.2. Geçimsizlikler
Yeterli veri yoktur
6.3. Raf ömrü
36 ay
6.4. Saklamaya yönelik özel tedbirler
30°C'nin altındaki oda sıcaklığında saklayınız.
Işık ve nemden korumak için orijinal ambalajında saklayınız.
6.5. Ambalajın niteliği ve içeriği
PA/AL/PVC blisterler
Ambalaj büyüklüğü: 30, 60 ve 90 tablet içeren blister ambalaj
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğiâne uygun olarak imha edilmelidir.
 HIV ve Aids
HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan
Virüsdür). Bu virüs AIDS hastalığına sebep olur.
HIV ve Aids
HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan
Virüsdür). Bu virüs AIDS hastalığına sebep olur. |
 Asperger Sendromu
Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde,
gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır.
Asperger Sendromu
Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde,
gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| CERTICAN | 8699504070002 | 1,626.66TL |
| EVAXMUS | 8699638015351 | 14,644.36TL |
| VOTUBIA | 8699504011678 | 47,391.49TL |
| Diğer Eşdeğer İlaçlar |
 |
Şizofrenlik Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler hakkında bilgi verecektir. |
 |
Grip, Soğuk Algınlığı ve Öksürük Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |
 |
Parkinson Hastalığı Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
İLAÇ GENEL BİLGİLERİ
Novartis Sağlık,Gıda ve Tarım Ürünleri San. Tic. A.Ş.
| Geri Ödeme Kodu | A12543 |
| Satış Fiyatı | 24350.26 TL [ 15 Apr 2024 ] |
| Önceki Satış Fiyatı | 24350.26 TL [ 5 Apr 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699504011487 |
| Etkin Madde | Everolimus |
| ATC Kodu | L01EG02 |
| Birim Miktar | 10 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 30 |
| Antineoplastik ve İmmünomodülatör Ajanlar |
| İthal ( ref. ülke : Yunanistan ) ve Beşeri bir ilaçdır. |