LEUSENOX 2 mg/ml IV infüzyonlukçözelti hazırlamak için konsantre (10 adet) Farmakolojik Özellikler
{ Arsenik Trioksid }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Diğer antineoplastik ajanlar
ATC kodu: L01XX27
Etki mekanizması:
Arsenik trioksitin etki mekanizması tam olarak anlaşılamamıştır. Arsenik trioksit, in-vitro olarak NB4 insan promiyelositik lösemi hücrelerinde, apoptozun karakteristik özellikleri olan; morfolojik değişikliklere ve deoksiribonükleik asit (DNA) fragmantasyonuna neden olur. Arsenik trioksit aynı zamanda füzyon protein pro-miyelositik lösemi/retinoik asit reseptör-alfa (PML/RAR-alfa) degredasyonuna veya hasarına neden olur.
Klinik çalışmalar:
Yeni tanı konmuş, yüksek risk altında olmayan APL hastaları
All-trans-retinoik asit (ATRA) ile kombinasyon halinde uygulanan Arsenik trioksitin etkililiğinin ve güvenliliğinin ATRA + kemoterapi (örn. idarubisin ve mitoksantron) etkililiği ve güvenliliği ile karşılaştırıldığı kontrollü, randomize non-inferiorite bir Faz 3 klinik çalışmasında (Çalışma APL0406), Arsenik trioksit, yeni tanı konmuş düşük ila orta riskte APL'si olan 77 hastada araştırılmıştır. Lösemik hücrelerde RT-PCR veya mikro noktalarla işaretlenmiş PML nükleer dağılım ile t(15;17) veya PML-RARα varlığı konfirme edilen yeni tanı konmuş APL'si olan hastalar dahil edilmiştir. t(11;17) (PLZF/RARα) gibi varyant translokasyonları olan hastada herhangi bir veri mevcut değildir. Anlamlı aritmi, EKG anomalileri (konjenital uzun QT sendromu, anlamlı ventriküler ya da atriyal taşiaritmi, dinlenme esnasında klinik olarak anlamlı bradikardi (kalp atım hızı dakikada 50'den daha az), EKG taramasında QTc > 450 milisaniye, sağ dal bloku ve sol ön hemiblok, bifasiküler blok) veya nöropatisi olan hastalar çalışmaya dahil edilmemiştir. ATRA + Arsenik trioksit tedavi grubundaki hastalar, CR'ye kadar günlük 45 mg/m2 oral ATRA ve günlük 0,15 mg/kg iv Arsenik trioksit almıştır. Konsolidasyon sırasında, ATRA aynı dozda 2 hafta uygulamalı, 2 hafta uygulamasız periyotlarla toplam 7 siklus boyunca, LEUSENOX ise aynı dozda haftanın 5 günü, 4 hafta uygulamalı, 4 hafta uygulamasız olarak 4 siklus boyunca uygulanmıştır. ATRA
+ kemoterapi tedavi grubundaki hastalar CR'ye kadar 2, 4, 6 ve 8. günde 12mg/m2 iv idarubisin ve günlük 45 mg/m2 oral ATRA almıştır. Konsolidasyon sırasında hastalar ilk 15 gün boyunca 1 ila 4. günde günlük 5 mg/m2 idarubisin ve günlük 45 mg/m2 ATRA almış, bunun ardından 15 gün boyunca 1 ila 5. günlerde 10 mg/m2 iv mitoksantron ve günlük 45 mg/m2 ATRA almış ve son olarak, 15 gün boyunca tek doz 12 mg/m2 idarubisin ve günlük 45 mg/m2 ATRA almıştır. Konsolidasyonun her bir kürü bir önceki kürün hematolojik iyileşmesi gerçekleştiğinde (nötrofil sayısının> 1,5 Ã 109/L ve trombositlerin >100 Ã 109/L olması olarak tanımlanmaktadır)
başlatılmıştır. ATRA + kemoterapi tedavi grubundaki hastalar aynı zamanda 2 yıl boyunca, günlük oral 50mg/m2 6-merkaptopürin, haftalık intramüsküler 15mg/m2 metotreksat ve 3 ayda bir olmak üzere 15 gün boyunca günlük 45 mg/m2 ATRA içeren idame tedavisi almıştır.
Temel etkililik bulguları aşağıdaki Tablo 3'te özetlenmektedir:
Sonlanım noktası | ATRA + Arsenik trioksit (n = 77) [%] | ATRA + Kemoterapi (n = 79) [%] | Güven aralığı (CI) | P değeri |
2 yıllık olaysız sağkalım (EFS) | 97 | 86 | Farka ait % 95 CI, 2-22 yüzdelik nokta | Eşit etkililik için p<0,001 ATRA+Arsenik trioksit'in üstünlüğü için p = 0,02 |
Hematolojik tam remisyon (HCR) | 100 | 95 |
| p = 0,12 |
2 yıllık genel sağkalım (OS) | 99 | 91 |
| p = 0,02 |
2 yıllık hastalıksız sağkalım (DFS) | 97 | 90 |
| p = 0,11 |
2 yıllık kümülatif relaps insidansı (CIR) | 1 | 6 |
| p = 0,24 |
Tablo 3
APL = akut promiyelositik lösemi; ATRA = all-trans-retinoik asit Relaps/ refrakter APL
Arsenik trioksit; karşılaştırmalı olmayan, tek-kollu, açık etiketli iki çalışmada, öncesinde antrasiklin ve retinoid rejimi ile tedavi gören 52 APL'li hastada araştırılmıştır. Biri tek araştırmacı ile yapılan klinik çalışma (n=12) ve diğeri ise çok merkezli, 9-merkezli çalışmadır (n=40). İlk çalışmada hastalar, Arsenik trioksitten ortalama 0,16 mg/kg/gün dozda (0,06-0,20 mg/kg/gün aralığında) alırken; çok merkezli çalışmadaki hastalar, 0,15 mg/kg/gün'lük sabit dozda almışlardır. Arsenik trioksit; maksimum 60 gün olmak üzere, kemik iliği lösemik hücrelerden arınıncaya kadar, 1-2 saat üzerinde intravenöz olarak uygulanmıştır. Tam remisyonu olan hastalar, 5 haftalık döngü üzerinden 25 ilave doz için, Arsenik trioksit ile
konsalidasyon tedavisi almışlardır. Konsalidasyon tedavisi; tek merkezli çalışmada indüksiyondan 6 hafta (3-8 hafta aralığında) sonra, çok merkezli çalışmada ise 4 hafta (3-6 hafta aralığında) sonra başlamıştır. Tam remisyon (CR); kemik iliğinde görülebilir lösemik hücrelerin yokluğu ve platelet ile beyaz kan hücrelerinin periferal iyileşme olarak tanımlanır.
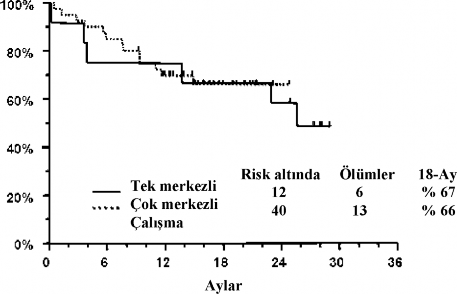
Tek merkezli çalışmadaki hastalarda 1-6 ön tedavi rejimini takiben relaps oluşurken, 2 hastada da kök hücre transplantasyonunu takiben relaps oluşmuştur. Çok merkezli çalışmadaki hastalarda; 1-4 ön tedavi rejimini takiben relapslar olmuştur ve 5 hastada ise kök hücre transplantasyonunu takiben relapslar vardır. Tek merkezli çalışmada ortalama yaş 33 yıldır (yaş aralığı: 9-75). Çok merkezli çalışmada ortalama yaş 40 yıldır (yaş aralığı: 5-73).
Tablo 4
| Tek merkezli çalışma N=12 | Çok merkezli çalışma N=40 |
Arsenik trioksit dozu, mg/kg/gün (Ortanca, aralık) | 0.16 (0,06-0,20) | 0,15 |
Tam remisyon | 11 (% 92) | 34 (% 85) |
Kemik iliği remisyonuna kadar süre (ortanca) | 32 gün | 35 gün |
Tam resmiyona kadar süre (ortanca) | 54 gün | 59 gün |
18 aylık hayatta kalma | % 67 | % 66 |
Tek merkezli çalışma 2 pediyatrik hasta (< 18 yaş) içermektedir ve her ikisinde de tam remisyon sağlanmıştır. Çok merkezli çalışma 5 pediyatrik hasta (<18 yaş) içermektedir ve 3'ünde tam remisyon sağlanmıştır. 5 yaşından küçük çocuklar tedavi edilmemiştir.
Konsalidasyon sonrası izleme (follow-up) tedavisinde; tek merkezli çalışmadan 7 hasta ve çok merkezli çalışmadan 18 hasta, arsenik trioksit ile idame tedavisi almıştır. Tek merkezli çalışmadan 3 hasta ve çok merkezli çalışmadan 15 hasta, arsenik trioksit'i tamamladıktan sonra kök hücre transplantasyonu almıştır. Kaplan-Meier ortalama tam remisyon süresi; tek merkezli çalışma için 14 aydır ve çok merkezli çalışma için buna erişilememektedir. En son izlemede; tek merkezli çalışmadaki 12 hastanın 6'sı 28 aylık (25-29 ay aralığında) ortalama izleme süresi ile yaşamıştır. Çok merkezli çalışmadaki 40 hastanın 27'si, 16 aylık (9-25 ay aralığında)
ortalama izleme süresi ile yaşamıştır. Her çalışma için 18 aylık sağkalımın Kaplan-Meier değerlendirmesi aşağıda gösterilmiştir.
Normal bir genotipe dönüşmesinin sitogenetik doğrulaması ve PML/RARα'nın normale dönüşümünün Ters Transkriptaz â Polimeraz Zincir Reaksiyonu (RT-PCR) tespiti aşağıdaki tabloda gösterilmiştir.
Arsenik trioksit tedavisi sonrası sitogenetik:
Tablo 5
| Tek Merkezli Pilot Çalışması Tam remisyon ile N=11 | Çok Merkezli Çalışma Tam remisyon ile N=34 |
Konvansiyonel sitogenetik |
|
|
[t(15;17)] |
|
|
Yok | 8 (% 73) | 31 (% 91) |
Mevcut | 1 (% 9) | % 0 |
Değerlendirilebilir değil | 2 (% 18) | 3 (% 9) |
PML/RARα için RT-PCR |
|
|
Negatif | 8 (% 73) | 27 (% 79) |
Pozitif | 3 (% 27) | 4 (% 12) |
Değerlendirilebilir değil | 0 | 3 (% 9) |
Yanıtlar; 6-75 yaş aralığındaki, test edilen tüm yaş gruplarında izlenmiştir. Yanıt oranı, her iki cinsiyet için de benzerdi. t(11; 17) ve t(5; 17) kromozamal translokasyon içeren varyant APL üzerine Arsenik trioksit'in etkileri ile ilgili deneyim elde edilmemiştir.
Pediyatrik popülasyon:
Çocuklardaki deneyim sınırlıdır. 0,15 mg/kg/gün'lük tavsiye edilen dozda Arsenik trioksit ile tedavi edilen 18 yaş altındaki (5-16 yaş aralığındaki) 7 hastanın 5'i tam bir yanıta ulaşmıştır (bkz. bölüm 4.2)
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
Arsenik trioksitin inorganik, liyofilize formu; çözelti içerisine konulduğunda, hızlıca hidrolize ürün olan arsenöz aside (AsIII) dönüşür. AsIII, arsenik trioksitin farmakolojik olarak aktif olan şeklidir.
Dağılım:
İhmal edilebilir düzeyde proteinlere bağlanmasıyla dokular içerisinde belirgin bir şekilde dağılma gösterdiği için Asün dağılım hacmi (V) büyüktür (>400 L). Vaynı zamanda ağırlığa da bağlı olup, vücut ağırlığının artmasıyla artar. Toplam arsenik başlıca karaciğerde, böbrekte, kalpte ve daha az olarak da akciğer, saç ve tırnaklarda birikmektedir.
Biyotransformasyon:
Arsenik trioksitin metabolizması; başlıca karaciğerde, hem arsenik trioksitin aktif türevi olan arsenöz asit (AsIII)'in arsenik asite (AsV) oksidasyonunu, hem de monometilarsonik asite (MMAV) ve dimetilarsinik asite (DMAV) metiltransferaz aracılığıyla oksidatif metilasyonu kapsamaktadır. Beş değerlikli (pentavalent) metabolitler olan MMAV ve DMAV'nin, plazmada ortaya çıkması yavaştır (Arsenik trioksitin ilk uygulanışından yaklaşık 10-24 saat sonra). Ancak, uzun olan yarılanma ömürleri dolayısıyla; birikme, (AsIII)'ün yaptığına kıyasla, multiple dozlamaya daha çok bağlıdır. Bu metabolitlerin birikme (akümülasyon) derecesi, dozlama rejimine bağlıdır. Tek doz uygulama ile karşılaştırıldığında, multiple dozlamadan sonraki birikme yaklaşık 1,4 ila 8 katı kadardır. AsV, plazma içerisinde nispeten düşük seviyelerde bulunur.
İnsan karaciğer mikrozomları ile yapılan in vitro enzimatik çalışmalar; 1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1, 3A4/5, 4A9/11 gibi başlıca sitokrom P450 enzimlerinin substratları üzerine, arsenik trioksitin inhibitör aktivitesinin bulunmadığını göstermiştir. P450 enzimlerinin substratları olan ilaçların arsenik trioksit ile etkileşmesi beklenmemektedir.
Eliminasyon:
Uygulanan arsenik trioksit dozunun yaklaşık olarak %15'i, değişmeyen AsIII olarak idrar ile birlikte atılmaktadır. AsIII'ün metillenmiş metabolitleri (MMAV ve DMAV), başlıca idrar ile atılmaktadır. AsIII'ün plazma konsantrasyonu, 10-14 saatlik ortalama terminal eliminasyon yarı ömrü ile bifazik şekilde pik plazma konsantrasyonunun altına düşer. 7-32 mg'lık (0,15 mg/kg olarak uygulanan) tek doz üzerinden AsIII'ün toplam klerensi 49 l/s olup, renal klerensi 9 l/s'dir. Klerens, çalışılan doz aralığında uygulanan doza veya kişinin ağırlığına bağlı değildir. MMAV ve DMAV metabolitlerinin tahmin edilen ortalama terminal eliminasyon yarı ömürleri sırayla; 32 saat ve 70 saattir.
Böbrek Yetmezliği:
Hafif derecede böbrek yetmezliği (kreatinin klerensi 50-80 ml/dk) veya orta derecede böbrek yetmezliği (kreatinin klerensi 30-49 mL/dk) olan hastalarda, AsIII'ün plazma klerensi değişmemiştir. Ciddi böbrek yetmezliği (kreatinin klerensi 30 mL/dk'dan daha az) olan hastalarda AsIII'ün plazma klerensi, normal böbrek fonksiyonu olan hastalar ile kıyaslandığında
% 40 daha azdır (bkz. bölüm 4.4).
MMAV ve DMAV'ye sistemik maruziyet, böbrek yetmezliği olan hastalarda daha fazla olma eğilimindedir. Bunun klinik açıdan önemi bilinmemektedir; ancak artmış bir toksisite görülmemiştir.
Karaciğer yetmezliği:
Hafif-orta derecede karaciğer yetmezliği olan hepatoselüler karsinomalı hastalardan elde edilen farmakokinetik veri, haftada iki kez yapılan infüzyonları takiben AsIII veya AsV'ün birikmediğini göstermiştir. AUC normalize edilmiş doz (her mg doz başına) aracılığıyla belirlenene göre karaciğer fonksiyon seviyesinin azalması ile, AsIII, AsV, MMAV veya DMAV'ye sistemik maruziyette artışa karşı belirgin bir eğilim elde edilmemiştir.
Doğrusallık / doğrusal olmayan durum:
7-32 mg aralığındaki (0,15 mg/kg olarak uygulanan) toplam tek dozda, sistemik maruziyet (AUC) doğrusal olarak görünmektedir. AsIII'ün pik plazma konsantrasyonunda bifazik şekilde azalma ev daha yavaş bir terminal eliminasyon fazını takiben hızlı bir başlangıç distribüsyon fazı ile karakterizedir. Günlük (n=6) veya haftada 2 kere olan (n=3) rejimde, 0,15 mg/kg olarak
uygulandıktan sonra; tek infüzyon ile kıyaslandığında, yaklaşık 2 kat AsIII biriktiği gözlenmiştir. Bu birikme, tek doz sonuçlarına göre beklenenden biraz daha çoktur.
5.3. Klinik öncesi güvenlilik verileri
Hayvanlardaki arsenik trioksidin limitli sayıdaki üreme toksisite çalışması, önerilen klinik dozun 1-10 katı uygulandığında (mg/m2), embriyotoksisite ve teratojenite (nöral tüp defektleri, anoftalmi ve mikroftalmi) göstermektedir. Arsenik trioksit ile fertilite çalışmaları yürütülmemiştir. Arsenik bileşikleri, in vivo ve in vitro olarak memeli hücrelerin morfolojik transformasyonlarını ve kromozomal bozuklukları indükler. Resmi bir arsenik trioksit karsinojenisite çalışması yapılmamıştır. Ancak, arsenik trioksit ve diğer inorganik arsenik bileşikleri insan karsinojenleri olarak kabul edilmektedir.
 Kolon, Rektum yada Bağırsak Kanseri
Bağırsak kanseri kolon veya rektumda
(arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir
şekilde tedavi edilir.
Kolon, Rektum yada Bağırsak Kanseri
Bağırsak kanseri kolon veya rektumda
(arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir
şekilde tedavi edilir. |
 Grip, Soğuk Algınlığı ve Öksürük
Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır.
Grip, Soğuk Algınlığı ve Öksürük
Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |
İLAÇ GENEL BİLGİLERİ
Koçak Farma İlaç ve Kimya Sanayi A.Ş.
| Satış Fiyatı | 48356.67 TL [ 17 May 2024 ] |
| Önceki Satış Fiyatı | 48356.67 TL [ 10 May 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699828770619 |
| Etkin Madde | Arsenik Trioksid |
| ATC Kodu | L01XX27 |
| Birim Miktar | 2 |
| Birim Cinsi | MG/ML |
| Ambalaj Miktarı | 10 |
| Antineoplastik ve İmmünomodülatör Ajanlar > Diğer Kanser İlaçları > Arsenic trioxide |
| Yerli ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Dış Gebelik Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur. |
 |
Doğum Sonrası Depresyonu Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından tecrübe edilen stresli bir durumdur. |
 |
En Yaygın Alerji Türleri Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir. |