LEUSENOX 2 mg/ml IV infüzyonlukçözelti hazırlamak için konsantre (10 adet) Kısa Ürün Bilgisi
{ Arsenik Trioksid }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
LEUSENOX 2 mg/ml IV İnfüzyonluk Çözelti Hazırlamak İçin Konsantre Steril
Sitotoksik
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
LEUSENOX'un 1 ml'si 2 mg arsenik trioksit içerir. Her 6 ml'lik çözelti, 12 mg arsenik trioksit içerir.
Yardımcı maddeler
Sodyum hidroksit 7,200 mg
Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
İntravenöz infüzyon için konsantre çözelti içeren flakon Steril, berrak, renksiz, sulu çözelti.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
LEUSENOX, yetişkin hastalarda, Pro-Miyelositik Lösemi/Retinoik-Asit-Reseptör-alfa (PML/RAR-alfa) geni varlığı ve/veya t (15; 17) translokasyon varlığı ile remisyon indüksiyonu ve konsolidasyon için endikedir.
Akut promiyelositik lösemi tanısı konmuş olan 18 yaş ve üzerindeki yeni tanı konmuş düşük ila orta riskli (Lökosit sayısı ≤ 10 à 103/μl) hastalarda all-trans retinoik asit ile kombine ya da monoterapi olarak kullanımda endikedir.
Önceden retinoid ve kemoterapötik ajan içeren tedaviye yanıt vermeyen veya nüks gelişen akut promiyelositik lösemi olgularının tedavisinde endikedir.
LEUSENOX'a karşı diğer akut miyelojen lösemi alt tiplerinin yanıt oranı incelenmemiştir.
4.2. Pozoloji ve uygulama şekli
Pozoloji / uygulama sıklığı ve süresi:LEUSENOX, akut lösemi tedavisinde, tecrübeli doktor denetimi altında uygulanmalıdır ve Bölüm 4.4'te anlatılan özel gözlem prosedürleri izlenmelidir. Aynı doz, yetişkinler ve yaşlılar için önerilir.
Yeni tanı konmuş düşük ila orta riskli akut promiyelositik lösemi (APL)
İndüksiyon tedavi planı
LEUSENOX, intravenöz yolla 0,15 mg/kg/gün dozda uygulanmalı ve günlük olarak, tam remisyon elde edilinceye kadar verilmelidir. 60. günde tam remisyon elde edilememişse doz uygulaması sonlandırılmalıdır.
Konsolidasyon planı
LEUSENOX, intravenöz yolla 0,15 mg/kg/gün dozda uygulanmalı, haftada 5 gün verilmelidir. Tedavi, 4 hafta uygulamalı, 4 hafta uygulamasız olarak toplam 4 siklus boyunca sürdürülmelidir.
Relaps/refrakter akut promiyelositik lösemi (APL)
İndüksiyon tedavi planı
LEUSENOX, tam remisyonu sağlanıncaya kadar (lösemik hücreler bulunmadan hücresel kemik iliğinde % 5'ten daha az blast olması), günlük 0,15 mg/kg/gün sabit dozunda intravenöz olarak uygulanır. Eğer tam remisyonu 50. günde sağlanamazsa, doz verilmesi kesilmelidir.
Konsolidasyon planı
Konsolidasyon tedavisine, indüksiyon tedavisinin tamamlanmasından 3-4 hafta sonra başlanmalıdır. LEUSENOX haftada 5 gün, 2 günlük aralar verilerek, bunun 5 hafta tekrarlanmasıyla; 25 doz boyunca 0,15 mg/kg/gün dozunda, intravenöz olarak uygulanmalıdır.
Dozun ertelenmesi, modifikasyon ve yeniden başlatılması:
Ulusal Kanser Enstitüsü Genel Toksisite Kriterleri'ne göre derecesi 3 veya daha büyük ve LEUSENOX tedavisi ile ilişkili olabileceği düşünülen toksisite gözlenmesi durumunda, planlanmış olan tedavi bitiminden önceki herhangi bir anda; LEUSENOX ile tedaviye ara verilmeli, uygun şekilde düzenlenmeli veya kesilmelidir. LEUSENOX'a bağlı gelişen bu tür reaksiyonları gösteren hastalar, sadece toksik etki geçtikten sonra veya ara verilmesine neden olan anormalliğin normale dönmesinden sonra tedaviye devam etmelidir. Bu gibi vakalarda tedaviye, önceki günlük dozun % 50'si ile devam edilir. Eğer azaltılan dozda, tedaviye
başlanılan 7 gün içerisinde toksik olaylar oluşmazsa; günlük doz, orijinal dozun % 100'üne tekrar çıkarılabilir. Yeniden toksisite gösteren hastalar tedaviden ayrılmalıdır.
Elektrokardiyogram (EKG) ve elektrolit anormallikleri için Bölüm 4.4'e bakınız.
Uygulama şekli:
LEUSENOX, intravenöz olarak 1-2 saat boyunca uygulanmalıdır. Eğer vazomotor reaksiyonlar gözlenirse, infüzyon süresi 4 saate kadar uzatılabilir. Santral venöz katater gerekli değildir. Hastalar, yeterli gözlem sağlamak amacıyla ve hastalığın semptomlarından dolayı, tedavi başlangıcında hastaneye yatırılmalıdır.
Tıbbi ürünü uygulamadan önce hazırlamaya ilişkin talimatlar için Bölüm 6.6'ya bakınız.
Özel popülasyonlara ilişkin ek bilgiler Böbrek/Karaciğer yetmezliği:
Karaciğer yetmezliği olan bütün gruplarda ve böbrek yetmezliği olan bütün gruplarda veri olmadığı için; karaciğer ve/veya böbrek yetmezliği olan hastalarda LEUSENOX kullanılırken dikkat edilmesi önerilmektedir.
Pediyatrik popülasyon:
17 yaşına kadarki çocuklarda, LEUSENOX'un etkililiği ve güvenilirliği belirlenmemiştir. 5 ile 16 yaş arasındaki çocuklar için mevcut olan veriler Bölüm 5.1'de açıklanmıştır, ancak pozoloji ile ilgili herhangi bir öneri yapılamamıştır. 5 yaşının altındaki çocuklarda herhangi bir veri bulunmamaktadır.
Geriyatrik popülasyon:
Geriyatrik popülasyonda kullanımıyla ilgili herhangi bir veri bulunmamaktadır.
4.3. Kontrendikasyonlar
Etkin madde
4.4. Özel kullanım uyarıları ve önlemleri
Klinik olarak stabil olmayan APL hastaları özellikle risk altındadır ve bu durum hem hematolojik, hepatik, renal ve koagülasyon parametre testlerinin daha sık olmasını, hem de elektrolit ile glisemi düzeylerinin gözlenmesinin daha sık olmasını gerektirir.
Lökosit Aktivasyon Sendromu (APL Farklılaşma Sendromu):
LEUSENOX ile tedavi gören, relaps/ refrakter durumda, APL hastalarının % 27'si; lökositoz ile birlikte görülen veya görülmeyen plevral veya perikardiyal efüzyonlar, pulmoner infiltratlar, kilo alma, dispne ve ateş ile karakterize olan APL farklılaşma sendromu veya retinoik-asit-akut promiyelositik lösemi (RA-APL) diye isimlendirilen sendroma benzer semptomlar geçirmiştir. Bu sendrom öldürücü olabilir. Yeni tanı konmuş ve LEUSENOX ve all-trans-retinoik asit (ATRA) ile tedavi edilen APL hastalarının % 19'unda, 5 şiddetli olgu dahil olmak üzere APL farklılaşma sendromu gözlenmiştir. Sendromu işaret eden ilk belirtilerde (açıklanamayan ateş, nefes darlığı ve/veya kilo alma, anormal göğüs oskültatuar bulguları veya radyografik anormallikler), lökosit sayısına bakılmaksızın LEUSENOX tedavisi geçici olarak durdurulmalı ve hemen yüksek dozda steroid (günde iki defa, intravenöz olarak 10 mg deksametazon) başlanmalıdır ve en az 3 gün boyunca veya daha uzun süre, belirti ile semptomlar gidinceye kadar devam edilmelidir. Klinik olarak gerekçelendirildiği/gerekli görüldüğü takdirde, eşzamanlı diüretik tedavisi de tavsiye edilir. Hastaların büyük çoğunluğunda, APL farklılaşma sendromu tedavisi sırasında LEUSENOX tedavisinin sonlandırılması gerekmemektedir. Belirti ve semptomlar hafifledikten sonra LEUSENOX tedavisi ilk 7 gün sırasında önceki dozun % 50'sinde devam ettirilebilir. Bunun ardından, önceki toksisitenin kötüleşmemesi durumunda LEUSENOX yeniden tam dozajda devam ettirilebilir. Semptomların yeniden ortaya çıkması durumunda LEUSENOX önceki dozaja düşürülmelidir. Yeni tanı konmuş APL hastalarında, indüksiyon tedavisi sırasında APL farklılaşma sendromu gelişimini önlemek için, LEUSENOX uygulamasının ilk gününden indüksiyon tedavisinin son gününe kadar prednizon (indüksiyon tedavisi boyunca günde 0,5 mg/kg vücut ağırlığı) uygulanabilir. LEUSENOX'dan dolayı oluşan lökosit aktivasyon sendromunun tedavisi sırasında, steroidlerin ve kemoterapinin birlikte uygulanması ile ilgili bir deneyim olmadığından, steroidler ile yapılan tedaviye kemoterapinin eklenmesi önerilmez. Pazarlama sonrası deneyimler, diğer tipte maligniteler görülen hastalarda benzer bir sendromun oluşabileceğini göstermektedir.
Elektrokardiyogram (EKG) Anormallikleri
Arsenik trioksit, QT aralığının uzamasına ve tam atriyoventriküler bloğa neden olabilir. QT uzaması, ölümcül olabilen torsade de pointes-tipi ventriküler aritmiye yol açabilir. Antrasiklinler ile yapılan önceki tedavi, QT uzama riskini artırabilir. Torsade de pointes riski; QT uzamasının büyüklüğü, Sınıf Ia ve III antiaritmikler (ör. kinidin, amiodaron, sotalol, dofetilid), antipsikotikler (ör. tiyoridazin), antidepressanlar (ör. amitriptilin), bazı makrolitler
(ör. eritromisin), bazı antihistaminikler (ör. terfenadin ve astemizol), bazı kinolon antibiyotikleri (ör. sparfloksasin) ve QT aralığını uzatan diğer bazı ilaçlar (ör. sisaprid) gibi QT aralığını uzatan tıbbi ilaçların birlikte uygulanması, Torsade de pointes öyküsü, QT aralık uzamasının önceden var olması, konjestif kalp yetmezliği, amfoterisin B, potasyum tüketici diüretiklerin uygulanması ve hipokalemi veya hipomagnezemiye yol açan diğer durumlar ile ilişkilidir. Klinik çalışmalarda, relaps/ refrakter durumda, LEUSENOX ile tedavi gören hastaların % 40'ı, 500 milisaniyeden büyük en az bir düzeltilmiş QT (QTc) aralık uzaması tecrübe etmişlerdir. QTc uzaması; LEUSENOX infüzyonundan sonra 1 ile 5 hafta arasında gözlemiş ve LEUSENOX infüzyonundan sonraki 8 haftanın sonunda esas değerine dönmüştür. Bir hasta (amfoterisin B de dahil olmak üzere; birlikte birçok tıbbi ürün alan), relaps APL için arsenik trioksit ile indüksiyon tedavisi sırasında, asemptomatik torsade de pointes geçirmiştir. Yeni tanı konmuş APL hastalarının % 15,6'sında, ATRA ile kombinasyon halinde arsenik trioksit kullanımında QTc uzaması gözlenmiştir (bkz. bölüm 5.1 âYeni tanı konmuş, yüksek risk altında olmayan APL hastalarıâ). Yeni tanı konmuş bir hastada indüksiyon tedavisinin 3. gününde şiddetli QTc uzaması ve elektrolit anormallikleri görüldüğü için indüksiyon tedavisi sonlandırılmıştır.
EKG ve Elektrolit Gözlem Önerileri
LEUSENOX ile tedaviye başlamadan önce, 12-lead EKG uygulanmalı ve serum elektrolitleri (potasyum, kalsiyum ve magnezyum) ile kreatinin değerlendirilmelidir; önceden bulunan elektrolit anormallikleri düzeltilmeli ve eğer mümkünse, QT aralığını uzattığı bilinen tıbbi ürünler kesilmelidir. Torsade de pointes risk faktörüne veya QTc uzaması risk faktörüne sahip hastalar, sürekli kardiyak gözlem (EKG) ile gözlenmelidir. 500 milisaniye'den daha büyük QTc'ler için düzeltici ölçümler tamamlanmış olmalı ve LEUSENOX kullanılması düşünülmeden önce seri EKG'ler ile QTc'ler yeniden değerlendirilmelidir. LEUSENOX ile tedavi sırasında potasyum konsantrasyonları 4 mEq/L'den yüksek olmalı ve magnezyum konsantrasyonları 1,8 mg/dL'nin üzerinde olmalıdır. Mutlak QT aralık değeri 500 milisaniye'den daha büyük bir değere ulaşan hastalar, yeniden değerlendirilmeli ve bir arada bulunan risk faktörlerini düzeltmek için acil önlemler alınmalı; eğer risk faktörleri varsa, LEUSENOX tedavisinin sürdürülüp sürdürülmeyeceği risk/yarar açısından değerlendirilmelidir. Eğer senkop, hızlı veya düzensiz kalp atışları gelişirse; hasta hastaneye yatırılmalı ve sürekli gözlenmelidir, serum elektrolitleri değerlendirilmeli ve LEUSENOX tedavisi; QTc aralığı 460 milisaniye altına gerileyinceye, elektrolit anormallikleri düzelinceye ve senkop, düzensiz kalp atışları düzelinceye kadar geçici olarak kesilmelidir. İyileşmenin
sağlanmasının ardından tedavi, önceki günlük dozun % 50'si ile devam ettirilmelidir. Tedaviye azaltılmış dozda yeniden başlanmasından sonraki 7 gün içinde QTc uzaması tekrarlamadığı takdirde, LEUSENOX tedavisi ikinci bir hafta boyunca 0,11 mg/kg vücut ağırlığı dozda uygulanabilir. Herhangi bir uzama olmazsa, günlük doz orijinal dozun % 100'üne kadar geri yükseltilebilir. İnfüzyon sırasında, QTc aralığı üzerine LEUSENOX'un etkisi ile ilgili veri yoktur. Elektrokardiyogramlar haftada iki defa yapılmalı ve indüksiyon ile konsolidasyon sırasında klinik olarak stabil olmayan hastalar için daha sık olarak yapılmalıdır.
Hepatoksisite (derece 3 veya daha şiddetli)
Yeni tanı konmuş düşük ila orta risk altındaki APL hastalarının % 63,2'sinde, LEUSENOX'un ATRA ile kombinasyon halinde kullanıldığı indüksiyon veya konsolidasyon tedavisi sırasında derece 3 veya 4 hepatik toksik etkiler gelişmiştir. Ancak, toksik etkiler LEUSENOX'a, ATRA'ya veya ikisine birden ara verildiğinde ortadan kalkmıştır. Ulusal Kanser Enstitüsü Ortak Toksisite Kriterlerine göre derece 3 veya daha şiddetli hepatoksisite görüldüğü takdirde, LEUSENOX tedavisi planlanan tedavi sonundan önce durdurulmalıdır. Bilirubin ve/veya SGOT ve/veya alkali fosfataz düzeyleri normal üst limitin 4 katının altına düşer düşmez, LEUSENOX tedavisi ilk 7 gün boyunca önceki dozun % 50'sinde uygulanmalıdır. Bunun ardından, önceki toksisitenin kötüleşmemesi durumunda LEUSENOX yeniden tam dozajda devam ettirilmelidir. Hepatotoksisite tekrar ortaya çıktığında, LEUSENOX kalıcı olarak kesilmelidir.
Dozun ertelenmesi ve modifikasyonu
Ulusal Kanser Enstitüsü Genel Toksisite Kriterleri'ne göre derecesi 3 veya daha büyük ve LEUSENOX tedavisi ile ilişkili olabileceği düşünülen toksisite gözlenmesi durumunda, planlanmış olan tedavi bitiminden önceki herhangi bir anda; LEUSENOX ile tedaviye kısa süreliğine ara verilmelidir (bkz. bölüm 4.2.).
Laboratuvar Testleri:
Hastanın hematolojik, hepatik, renal ve koagülasyon parametre testleri yanında elektrolit ve glisemi düzeyleri, haftada en az iki kere gözlenmelidir. Klinik olarak stabil olmayan hastalarda ise daha sık olmak üzere; indüksiyon fazı boyunca ve konsolidasyon fazı sırasında haftada en az bir kez gözlenmelidir.
Böbrek yetmezliği olan hastalar
Bütün böbrek yetmezliği olan gruplarda veri olmadığı için; böbrek yetmezliği olan hastalarda LEUSENOX kullanılırken dikkat edilmesi önerilmektedir. Eğer doz ayarlaması gerekliyse; ciddi böbrek yetmezliği olan hastalardaki deneyimler, bunu belirlemek için yeterli değildir.
Diyaliz hastalarında LEUSENOX kullanımı araştırılmamıştır. Karaciğer yetmezliği olan hastalar:
Bütün karaciğer yetmezliği olan gruplarda veri olmadığı için; karaciğer yetmezliği olan hastalarda LEUSENOX kullanılırken dikkat edilmesi önerilmektedir. Eğer doz ayarlaması gerekliyse; ciddi karaciğer yetmezliği olan hastalardaki deneyimler, bunu belirlemek için yeterli değildir.
Yaşlı hastalar
Yaşlı popülasyonda LEUSENOX kullanımı üzerine sınırlı sayıda klinik veri bulunmaktadır. Bu hastalarda dikkat edilmesi gerekir.
Hiperlökositoz
LEUSENOX ile tedavi, bazı relaps/ refrakter APL hastalarda hiperlökositoz oluşması (≥10 à 103/µL) ile ilişkilendirilebilir. Başlangıçtaki beyaz kan hücre sayısı (WBC) ile hiperlökositoz gelişimi arasında bir ilişki görülmediği gibi, esas WBC sayısı ve pik WBC sayısı arasında bir ilişki de görülmemektedir. Hiperlökositoz asla ek bir kemoterapi ile tedavi edilmez ve LEUSENOX tedavisine devam edilerek çözülür. Konsolidasyon sırasında WBC sayısı, indüksiyon tedavisi sırasındaki kadar yüksek olmayıp, < 10 à 103/µL'dir. Konsolidasyon sırasında sadece bir hastada WBC sayısı 22 à 103/µL olmuştur. Yirmi relaps/ refrakter APL hasta (% 50) lökositoz geçirmiştir; fakat tüm hastalarda WBC sayısı, kemik iliği remisyonuna kadar azalmış veya normale dönmüştür ve sitotoksik kemoterapi veya lökoferez gerekmemiştir. Yeni tanı konmuş düşük ila orta risk altındaki APL hastalarında, indüksiyon tedavisi sırasında 74 hastanın 35'inde (% 47) lökositoz gelişmiştir (bkz. bölüm 5.1 âYeni tanı konmuş, yüksek risk altında olmayan APL hastalarıâ). Ancak bütün olguların yönetimi hidroksiüre tedavisi ile başarıyla gerçekleşmiştir. Tedavinin başlatılmasından sonra sürekli lökositoz gelişen hastalara hidroksiüre verilmelidir. Hidroksiüre, lökosit sayısını <10 à 103/μl düzeyinde tutacak şekilde belirli bir dozda devam ettirilmeli ve bunun ardından azaltılarak kesilmelidir.
Tablo 1. Hidroksiüre uygulamasının başlatılması için tavsiye:
WBC (Lökosit) | Hidroksiüre |
10 â 50 à 10/μl | 500 mg, günde 4 kez |
> 50 à 10/μl | 1000 mg, günde 4 kez |
İkincil primer malignitelerin gelişimi
LEUSENOX'un etkin maddesi, arsenik trioksit, bir insan kanserojenidir. İkincil primer malignitelerin gelişimi açısından hastalar izlenmelidir.
Ensefalopati
Arsenik trioksit tedavisi ile ensefalopati vakaları bildirilmiştir. Vitamin B1 eksikliği olan hastalarda arsenik trioksit tedavisinden sonra Wernicke ensefalopatisi rapor edilmiştir. B1 eksikliği riski olan hastalar, arsenik trioksit'e başlanmasından sonra ensefalopati belirti ve semptomları açısından yakından izlenmelidir. Bazı vakalar B1 vitamini takviyesiyle düzeltilmiştir.
Bu tıbbi ürün her 10 ml'de 1 mmol (23 mg)'dan daha az sodyum ihtiva eder; yani esasında âsodyum içermezâ kabul edilmektedir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
LEUSENOX ve diğer terapötik tıbbi ürünler arasında yürütülen farmakokinetik etkileşim üzerine resmi bir değerlendirme yoktur.
QT/QTc aralığının uzaması, hipokalemi veya hipomagnezemiye neden olduğu bilinen tıbbi ürünler
Arsenik trioksit ile tedavi sırasında QT/QTc uzaması beklenmektedir; ayrıca torsade de pointes ve tam kalp bloğu bildirilmiştir. Diüretikler ve amfoterisin B gibi hipokalemi veya hipomagnezemiye neden olduğu bilinen tıbbi ürünleri almış veya almakta olan hastalar, daha fazla torsade de pointes riski altındadır. Makrolit antibiyotikleri, antipsikotik tiyoridazin veya hipokalemi ya da hipomagnezemiye neden olduğu bilinen tıbbi ürünler gibi QT/QTc aralığını uzattığı bilinen diğer tıbbi ürünler ile LEUSENOX birlikte kullanıldığında dikkat edilmesi önerilmektedir. QT uzatan tıbbi ajanlar hakkındaki ek bilgi, Bölüm 4.4.'te verilmektedir.
Hepatotoksik etkilere neden olduğu bilinen tıbbi ürünler
Hepatotoksik etkiler, arsenik trioksit tedavisi sırasında ortaya çıkabilir. Arsenik trioksitin hepatotoksik etkilere neden olduğu bilinen diğer tıbbi ürünlerle birlikte uygulanması durumunda dikkatli olunması önerilir (bkz. bölüm 4.4 ve 4.8).
Diğer antilösemik tıbbi ürünler
Diğer antilösemik tıbbi ürünlerin etkinliği üzerine, LEUSENOX'un etkisi bilinmemektedir.
Özel popülasyonlara ilişkin ek bilgiler Karaciğer yetmezliği:
LEUSENOX ile tedavi sırasında hepatotoksik etkiler oluşabildiği için, hepatotoksik etkilere neden olduğu bilinen diğer tıbbi ürünler ile LEUSENOX birlikte kullanıldığında dikkat edilmesi önerilmektedir.
Böbrek yetmezliği:
Bütün böbrek yetmezliği olan gruplarda veri olmadığı için; böbrek yetmezliği olan hastalarda LEUSENOX kullanılırken dikkat edilmesi önerilmektedir.
Pediyatrik popülasyon:
Pediyatrik popülasyonda, etkileşim çalışmaları üzerine veri bulunmamaktadır.
4.6. Gebelik ve laktasyon
Gebelik kategorisi: D'dir.
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeli bulunan hem erkekler hem de kadınlar, LEUSENOX ile tedavi boyunca etkili doğum kontrol yöntemleri kullanmalıdır.
Gebelik dönemi
LEUSENOX'un gebelik ve/veya fetus/yeni doğan üzerinde zararlı farmakolojik etkileri bulunmaktadır.
LEUSENOX, gerekli olmadıkça gebelik döneminde kullanılmamalıdır. Hayvan çalışmalarında, arsenik trioksidin embriyotoksik ve teratojenik olduğu gösterilmiştir (bkz. bölüm 5.3). Eğer bu tıbbi ürün hamilelik sırasında kullanılacaksa veya bu ürünü alırken hasta hamile kalırsa, hasta fetüsteki potansiyel zararlar konusunda bilgilendirilmelidir.
Laktasyon dönemi
Arsenik trioksit, anne sütü ile atılmaktadır (süte geçmektedir). Emen çocuklarda LEUSENOX'dan dolayı ciddi yan etki potansiyeli nedeniyle, uygulama öncesinde ve uygulama boyunca emzirme kesilmelidir.
Üreme yeteneği / Fertilite
LEUSENOX ile yürütülen, klinik veya klinik olmayan fertilite çalışmaları bulunmamaktadır.
4.7. Araç ve makine kullanımı üzerindeki etkiler
LEUSENOX'un araç ve makine kullanma yeteneği üzerinde herhangi bir etkisi bulunmamaktadır veya önemsiz düzeydedir.
4.8. İstenmeyen etkiler
Güvenlilik profili özeti
Klinik çalışmalarda relaps/ refrakter APL hastaların % 37'sinde, CTC derecesi 3 ve 4 olan ilgili advers reaksiyonlar oluşmuştur. En sık bildirilen reaksiyonlar; hiperglisemi, hipokalemi, nötropeni ve alanin amino transferaz (ALT)'da artıştır. Hematolojik değerlendirmelerde belirtildiği üzere, relaps/ refrakter APL hastalarının % 50'sinde lökositoz oluşmuştur.
Ciddi advers reaksiyonlar yaygın (% 1-10) olup, relaps/ refrakter popülasyon için beklenmedik bir durum değildir. Arsenik trioksit ile ilişkili bu advers reaksiyonlar arasında şunlar bulunmaktadır: APL farklılaşma sendromu (3), lökositoz (3), uzamış QT aralığı (4, 1 tanesi torsade de pointes'li), atriyal fibrilasyon/ atriyal flutter (1), hiperglisemi (2) ve hemoraji, enfeksiyonlar, ağrı, diyare, bulantı ile ilişkili bir çeşit ciddi advers reaksiyonlar.
Genelde, tedaviye bağlı olarak meydana gelen advers reaksiyonlar zamanla azalma eğilimindedir; bu, relaps/ refrakter APL hastalarında altta yatan hastalığın düzelmesiyle ilişkili olabilir. Hastalar konsalidasyon ve idame tedavisinde, indüksiyondakine nazaran, daha az toksisite ile tolere etme eğilimindedirler. Bu, muhtemelen, tedavi kürünün başlangıcında
kontrol edilemeyen hastalık sürecinin yan etkilerinin ve semptomlar ile ölümü kontrol etmek için gerekli çok sayıda ilacın birlikte kullanımının çelişmesine bağlıdır.
Yeni tanı konmuş düşük ila orta risk altındaki APL hastalarında all-trans retinoik asit (ATRA)
+ kemoterapi ile ATRA + arsenik trioksitin karşılaştırıldığı çok merkezli bir faz 3 non- inferiorite çalışmasında (Çalışma APL0406; bkz. bölüm 5.1), arsenik trioksit ile tedavi edilen hastalarda hepatik toksisite, trombositopeni, nötropeni ve QTc uzamasını içeren ciddi advers reaksiyonlar gözlenmiştir.
Advers reaksiyonların listelenmiş özeti
Aşağıdaki istenmeyen etkiler, yeni tanı konmuş hastaların dahil edildiği APL0406 çalışmasında veya refrakter/relaps APL'si olan hastaların dahil edildiği klinik çalışmalarda ve/veya pazarlama sonrası deneyimde bildirilmiştir. İstenmeyen etkiler, sistem organ ve sıklığı terim sitemi olan MedDRA ile ve refrakter/relaps APL'si olan 52 hastada Arsenik trioksit klinik çalışmaları boyunca elde edilen sıklıklara göre aşağıda Tablo 2'de listelenmiştir. Sıklıklar şuna göre tanımlanmaktadır: Çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila <1/100); seyrek (≥1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Her bir sıklık grubu içinde, istenmeyen etkiler azalan ciddiyet sırasına göre sunulmaktadır.
| Tüm dereceler | Derece≥3 |
Enfeksiyonlar ve enfestasyonlar |
|
|
Herpes zoster | Yaygın | Bilinmiyor |
Sepsis | Bilinmiyor | Bilinmiyor |
Pnömoni | Bilinmiyor | Bilinmiyor |
Kan ve lenf sistemi hastalıkları |
|
|
Febril nötropeni | Yaygın | Yaygın |
Lökositoz | Yaygın | Yaygın |
Nötropeni | Yaygın | Yaygın |
Pansitopeni | Yaygın | Yaygın |
Trombositopeni | Yaygın | Yaygın |
Anemi | Yaygın | Bilinmiyor |
Lökopeni | Bilinmiyor | Bilinmiyor |
Lenfopeni | Bilinmiyor | Bilinmiyor |
Metabolizma ve beslenme hastalıkları | ||
Hiperglisemi | Çok yaygın | Çok yaygın |
Hipokalemi | Çok yaygın | Çok yaygın |
Hipomagnezemi | Çok yaygın | Yaygın |
Hipernatremi | Yaygın | Yaygın |
Ketoasidozis | Yaygın | Yaygın |
Hipermagnezemi | Yaygın | Bilinmiyor |
Dehidratasyon | Bilinmiyor | Bilinmiyor |
Sıvı retansiyonu | Bilinmiyor | Bilinmiyor |
Psikiyatrik hastalıklar |
|
|
Konfüzyonel durum | Bilinmiyor | Bilinmiyor |
Sinir Sistemi hastalıkları |
|
|
Parestezi | Çok yaygın | Yaygın |
Sersemlik hissi | Çok yaygın | Bilinmiyor |
Baş ağrısı | Çok yaygın | Bilinmiyor |
Konvülsiyon Ensefalopati, Wernicke ensefalopati | Yaygın Bilinmiyor | Bilinmiyor Bilinmiyor |
Göz hastalıkları |
|
|
Bulanık görme | Yaygın | Bilinmiyor |
Kardiyak hastalıklar |
|
|
Taşikardi | Çok yaygın | Yaygın |
Perikardiyal efüzyon | Yaygın | Yaygın |
Ventriküler ekstrasistol | Yaygın | Bilinmiyor |
Kalp yetmezliği | Bilinmiyor | Bilinmiyor |
Ventriküler taşikardi | Bilinmiyor | Bilinmiyor |
Vasküler hastalıklar |
|
|
Vaskülit | Yaygın | Yaygın |
Hipotansiyon | Yaygın | Bilinmiyor |
Solunum, göğüs ve mediastinal hastalıklar | ||
Diferansiyasyon sendromu | Çok yaygın | Çok yaygın |
Dispne | Çok yaygın | Yaygın |
Hipoksi | Yaygın | Yaygın |
Plevral efüzyon | Yaygın | Yaygın |
Plöritik ağrı | Yaygın | Yaygın |
Pulmoner alveoler hemoraji | Yaygın | Yaygın |
Pnömonit | Bilinmiyor | Bilinmiyor |
Gastrointestinal hastalıklar |
|
|
Diyare | Çok yaygın | Yaygın |
Kusma | Çok yaygın | Bilinmiyor |
Bulantı | Çok yaygın | Bilinmiyor |
Abdominal ağrı | Yaygın | Yaygın |
Deri ve deri-altı doku hastalıkları |
|
|
Prürit (kaşıntı) | Çok yaygın | Bilinmiyor |
Kızarıklık | Çok yaygın | Bilinmiyor |
Eritem | Yaygın | Yaygın |
Yüzde ödem | Yaygın | Bilinmiyor |
Kas-iskelet, bağ doku ve kemik hastalıkları Miyalji |
Çok yaygın |
Yaygın |
Artralji | Yaygın | Yaygın |
Kemik ağrısı | Yaygın | Yaygın |
Böbrek ve idrar hastalıkları |
|
|
Böbrek yetmezliği | Yaygın | Bilinmiyor |
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar | ||
Pireksi (ateş) | Çok yaygın | Yaygın |
Ağrı | Çok yaygın | Yaygın |
Yorgunluk | Çok yaygın | Bilinmiyor |
Ödem | Çok yaygın | Bilinmiyor |
Göğüs ağrısı | Yaygın | Yaygın |
Titreme | Yaygın | Bilinmiyor |
Araştırmalar |
|
|
Artmış alanin aminotransferaz (ALT) | Çok yaygın | Yaygın |
Artmış aspartat aminotransferaz (AST) | Çok yaygın | Yaygın |
Elektrokardiyogram QT uzaması | Çok yaygın | Yaygın |
Hiperbilirubinemi | Yaygın | Yaygın |
Artmış kan kreatinin | Yaygın | Bilinmiyor |
Kiloda artış | Yaygın | Bilinmiyor |
Artmış gama-glutamiltransferaz (GGT)* | Bilinmiyor* | Bilinmiyor* |
*CALGB çalışması C9710'da kontrol kolunda hiç kimsede bulunmamasına karşı, Arsenik trioksit konsolidasyon döngüsü (döngü 1 ve döngü 2) alan 200 hastanın haricinde, GGT'si artmış derece ≥3 olan 2 vaka bildirilmiştir.
Seçili advers reaksiyonların açıklaması Farklılaşma sendromu
Arsenik trioksit tedavisi sırasında APL çalışmalarındaki relaps durumunda 52 hastanın 14'ünde, lökositozlu veya lökositoz olmadan; ateş, dispne, kilo alma, pulmoner infiltrat ve plevral ya da perikardiyal efüzyonlarla karakterize APL farklılaşma sendromunun bir veya daha fazla semptomu vardır (bkz. bölüm 4.4). İndüksiyon sırasında 27 hastada lökositoz (WBC ≥10
à 103/µL) vardır ve bunlardan 4'ünün değeri 100.000/µL'nin üzerindedir. Çalışmada başlangıç beyaz kan hücre sayısı (WBC), lökositoz gelişimi ile ilişkili değildir ve konsolidasyon tedavisi sırasında WBC sayısı indüksiyondaki kadar yüksek değildir. Bu çalışmalarda, lökositoz kemoterapötik tıbbi ürünler ile tedavi edilmemiştir. Beyaz kan hücre sayısını düşürmek için kullanılan tıbbi ürünler, zaman zaman lökositozla ilgili toksisiteyi alevlendirmekte olup; etkili bir standart yaklaşım kanıtlanmamıştır. WBC sayısını düşürmek için kemoterapötik tıbbi ürünler ile tedaviyi takiben; insani amaçlı ilaca erken erişim programındaki bir hasta, lökositoza
bağlı olan serebral infarkttan ölmüştür. Sadece seçilen vakalarda müdahale edilerek, yaklaşımın gözlem şeklinde olması önerilmektedir.
Yeni tanı konmuş, düşük ila orta risk altındaki APL hastalarının % 19'unda, 5 şiddetli olgu dahil olmak üzere APL farklılaşma sendromu gözlenmiştir (bkz. bölüm 5.1).
Hemoraji ile ilgili Dissemine (Yaygın) İntravasküler Koagülasyon (DIC) nedeniyle pivotal çalışmalardaki relaps durumda mortalite çok yaygın (> % 10) olup; literatürde bildirilen erken ölümle örtüşmektedir.
Pazarlama sonrası deneyimde, Arsenik trioksit ile tedavi edilen APL haricindeki malignitelerde de retinoik asit sendromu gibi bir farklılaşma sendromu rapor edilmiştir.
QT aralığı uzaması
Arsenik trioksit QT aralığı uzamasına neden olabilir (bkz. bölüm 4.4). QT uzaması, öldürücü olabilen torsade de pointes-tipi ventriküler aritmiye yol açabilir. Torsade de pointes riski; QT uzamasının derecesi, QT uzatan tıbbi ürünlerle birlikte kullanılması, torsade de pointes öyküsü olanlar, önceden QT aralığı uzaması olanlar, konjestif kalp yetmezliği, potasyum atıcı diüretiklerin kullanılması veya hipokalemi ya da hipomagnezemiye neden olan diğer koşullar ile ilişkilidir. Relaps APL'nin arsenik trioksit ile indüksiyon tedavisi sırasında, bir hastada (amfoterisin B de dahil olmak üzere; birlikte birçok tıbbi ürün kullanan) asemptomatik torsade de pointes gelişmiştir. QT uzamasına dair başka kanıt olmasa da, bu kişi konsolidasyona tabi tutulmuştur.
Yeni tanı konmuş, düşük ila orta risk altındaki APL hastalarının % 15,6'sında QTc uzaması gözlenmiştir (bkz. bölüm 5.1). Bir hastada indüksiyon tedavisinin 3. gününde şiddetli QTc uzaması ve elektrolit anormallikleri görüldüğü için indüksiyon tedavisi sonlandırılmıştır.
Periferal nöropati
Parestezi/disestezi ile karakterize olan periferal nöropati yaygındır ve ortamdaki arseniğin iyi bilinen bir etkisidir. Sadece relaps/ refrakter APL'si olan hastalardan sadece ikisi bu yan etkiden dolayı tedaviyi bırakmış ve bunlardan biri, bir sonraki protokolde, ilave Arsenik trioksit almaya devam etmiştir. Relaps/ refrakter APL hastaların % 44'ü nöropati ile ilişkilendirilebilen semptomlar geliştirmiştir; bunların çoğu, hafif-orta dereceli ve Arsenik trioksit tedavisinin kesilmesine bağlı olarak geri dönüşümlü olmuştur.
Hepatoksisite (derece 3-4)
Yeni tanı konmuş düşük ila orta risk altındaki APL hastalarının % 63,2'sinde, Arsenik trioksitin ATRA ile kombinasyon halinde kullanıldığı indüksiyon veya konsolidasyon tedavisi sırasında derece 3 veya 4 hepatik toksik etkiler gelişmiştir. Ancak, toksik etkiler Arsenik trioksite, ATRA'ya veya ikisine birden ara verildiğinde ortadan kalkmıştır (bkz. bölüm 4.4 ve 5.1).
Hematolojik ve gastrointestinal toksisite
Yeni tanı konmuş, düşük ila orta risk altındaki APL hastalarında, gastrointestinal toksisite, derece 3-4 nötropeni ve derece 3 veya 4 trombositopeni meydana gelmiş; ancak bunlar ATRA ile kombinasyon halinde Arsenik trioksit ile tedavi edilen hastalarda ATRA + kemoterapi ile tedavi edilenlere kıyasla 2,2 kat daha az sıklıkta görülmüştür (bkz. bölüm 5.1).
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirilmeleri gerekmektedir. (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
Eğer ciddi akut arsenik toksisitesini akla getiren semptomlar (ör. konvülziyonlar, kas zayıflığı ve konfüzyon) görülüyorsa; LEUSENOX hemen kesilmeli ve günde 1 g veya daha az (≤1 g) olan günlük dozdaki penisilamin ile şelat oluşturucu tedavi düşünülebilir. Penisilamin ile tedavi süresi, üriner arsenik laboratuvar değerleri göz önünde bulundurularak değerlendirilmelidir. Oral yolla ilaç kullanamayan hastalar için; hayatı tehdit edici toksisite hemen giderilene kadar, her 4 saatte bir intramüsküler olarak 3 mg/kg dozunda dimerkaprol uygulanması düşünülebilir. Daha sonra, günde ≤1 g olmak üzere, günlük dozda penisilamin verilebilir. Koagülopati varlığında, 5 gün boyunca her 8 saatte bir 350 mg/m2 veya 10 mg/kg şelat oluşturucu ajan Dimerkaptosüksinik Asit Süksimerinin (DCI) oral olarak uygulanması ve sonra 2 hafta boyunca her 12 saatte bir uygulanması önerilir.
Şiddetli akut arsenik doz aşımı olan hastalar için diyaliz dikkate alınmalıdır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Diğer antineoplastik ajanlar
ATC kodu: L01XX27
Etki mekanizması:
Arsenik trioksitin etki mekanizması tam olarak anlaşılamamıştır. Arsenik trioksit, in-vitro olarak NB4 insan promiyelositik lösemi hücrelerinde, apoptozun karakteristik özellikleri olan; morfolojik değişikliklere ve deoksiribonükleik asit (DNA) fragmantasyonuna neden olur. Arsenik trioksit aynı zamanda füzyon protein pro-miyelositik lösemi/retinoik asit reseptör-alfa (PML/RAR-alfa) degredasyonuna veya hasarına neden olur.
Klinik çalışmalar:
Yeni tanı konmuş, yüksek risk altında olmayan APL hastaları
All-trans-retinoik asit (ATRA) ile kombinasyon halinde uygulanan Arsenik trioksitin etkililiğinin ve güvenliliğinin ATRA + kemoterapi (örn. idarubisin ve mitoksantron) etkililiği ve güvenliliği ile karşılaştırıldığı kontrollü, randomize non-inferiorite bir Faz 3 klinik çalışmasında (Çalışma APL0406), Arsenik trioksit, yeni tanı konmuş düşük ila orta riskte APL'si olan 77 hastada araştırılmıştır. Lösemik hücrelerde RT-PCR veya mikro noktalarla işaretlenmiş PML nükleer dağılım ile t(15;17) veya PML-RARα varlığı konfirme edilen yeni tanı konmuş APL'si olan hastalar dahil edilmiştir. t(11;17) (PLZF/RARα) gibi varyant translokasyonları olan hastada herhangi bir veri mevcut değildir. Anlamlı aritmi, EKG anomalileri (konjenital uzun QT sendromu, anlamlı ventriküler ya da atriyal taşiaritmi, dinlenme esnasında klinik olarak anlamlı bradikardi (kalp atım hızı dakikada 50'den daha az), EKG taramasında QTc > 450 milisaniye, sağ dal bloku ve sol ön hemiblok, bifasiküler blok) veya nöropatisi olan hastalar çalışmaya dahil edilmemiştir. ATRA + Arsenik trioksit tedavi grubundaki hastalar, CR'ye kadar günlük 45 mg/m2 oral ATRA ve günlük 0,15 mg/kg iv Arsenik trioksit almıştır. Konsolidasyon sırasında, ATRA aynı dozda 2 hafta uygulamalı, 2 hafta uygulamasız periyotlarla toplam 7 siklus boyunca, LEUSENOX ise aynı dozda haftanın 5 günü, 4 hafta uygulamalı, 4 hafta uygulamasız olarak 4 siklus boyunca uygulanmıştır. ATRA
+ kemoterapi tedavi grubundaki hastalar CR'ye kadar 2, 4, 6 ve 8. günde 12mg/m2 iv idarubisin ve günlük 45 mg/m2 oral ATRA almıştır. Konsolidasyon sırasında hastalar ilk 15 gün boyunca 1 ila 4. günde günlük 5 mg/m2 idarubisin ve günlük 45 mg/m2 ATRA almış, bunun ardından 15 gün boyunca 1 ila 5. günlerde 10 mg/m2 iv mitoksantron ve günlük 45 mg/m2 ATRA almış ve son olarak, 15 gün boyunca tek doz 12 mg/m2 idarubisin ve günlük 45 mg/m2 ATRA almıştır. Konsolidasyonun her bir kürü bir önceki kürün hematolojik iyileşmesi gerçekleştiğinde (nötrofil sayısının> 1,5 Ã 109/L ve trombositlerin >100 Ã 109/L olması olarak tanımlanmaktadır)
başlatılmıştır. ATRA + kemoterapi tedavi grubundaki hastalar aynı zamanda 2 yıl boyunca, günlük oral 50mg/m2 6-merkaptopürin, haftalık intramüsküler 15mg/m2 metotreksat ve 3 ayda bir olmak üzere 15 gün boyunca günlük 45 mg/m2 ATRA içeren idame tedavisi almıştır.
Temel etkililik bulguları aşağıdaki Tablo 3'te özetlenmektedir:
Sonlanım noktası | ATRA + Arsenik trioksit (n = 77) [%] | ATRA + Kemoterapi (n = 79) [%] | Güven aralığı (CI) | P değeri |
2 yıllık olaysız sağkalım (EFS) | 97 | 86 | Farka ait % 95 CI, 2-22 yüzdelik nokta | Eşit etkililik için p<0,001 ATRA+Arsenik trioksit'in üstünlüğü için p = 0,02 |
Hematolojik tam remisyon (HCR) | 100 | 95 |
| p = 0,12 |
2 yıllık genel sağkalım (OS) | 99 | 91 |
| p = 0,02 |
2 yıllık hastalıksız sağkalım (DFS) | 97 | 90 |
| p = 0,11 |
2 yıllık kümülatif relaps insidansı (CIR) | 1 | 6 |
| p = 0,24 |
Tablo 3
APL = akut promiyelositik lösemi; ATRA = all-trans-retinoik asit Relaps/ refrakter APL
Arsenik trioksit; karşılaştırmalı olmayan, tek-kollu, açık etiketli iki çalışmada, öncesinde antrasiklin ve retinoid rejimi ile tedavi gören 52 APL'li hastada araştırılmıştır. Biri tek araştırmacı ile yapılan klinik çalışma (n=12) ve diğeri ise çok merkezli, 9-merkezli çalışmadır (n=40). İlk çalışmada hastalar, Arsenik trioksitten ortalama 0,16 mg/kg/gün dozda (0,06-0,20 mg/kg/gün aralığında) alırken; çok merkezli çalışmadaki hastalar, 0,15 mg/kg/gün'lük sabit dozda almışlardır. Arsenik trioksit; maksimum 60 gün olmak üzere, kemik iliği lösemik hücrelerden arınıncaya kadar, 1-2 saat üzerinde intravenöz olarak uygulanmıştır. Tam remisyonu olan hastalar, 5 haftalık döngü üzerinden 25 ilave doz için, Arsenik trioksit ile
konsalidasyon tedavisi almışlardır. Konsalidasyon tedavisi; tek merkezli çalışmada indüksiyondan 6 hafta (3-8 hafta aralığında) sonra, çok merkezli çalışmada ise 4 hafta (3-6 hafta aralığında) sonra başlamıştır. Tam remisyon (CR); kemik iliğinde görülebilir lösemik hücrelerin yokluğu ve platelet ile beyaz kan hücrelerinin periferal iyileşme olarak tanımlanır.
Tek merkezli çalışmadaki hastalarda 1-6 ön tedavi rejimini takiben relaps oluşurken, 2 hastada da kök hücre transplantasyonunu takiben relaps oluşmuştur. Çok merkezli çalışmadaki hastalarda; 1-4 ön tedavi rejimini takiben relapslar olmuştur ve 5 hastada ise kök hücre transplantasyonunu takiben relapslar vardır. Tek merkezli çalışmada ortalama yaş 33 yıldır (yaş aralığı: 9-75). Çok merkezli çalışmada ortalama yaş 40 yıldır (yaş aralığı: 5-73).
Tablo 4
| Tek merkezli çalışma N=12 | Çok merkezli çalışma N=40 |
Arsenik trioksit dozu, mg/kg/gün (Ortanca, aralık) | 0.16 (0,06-0,20) | 0,15 |
Tam remisyon | 11 (% 92) | 34 (% 85) |
Kemik iliği remisyonuna kadar süre (ortanca) | 32 gün | 35 gün |
Tam resmiyona kadar süre (ortanca) | 54 gün | 59 gün |
18 aylık hayatta kalma | % 67 | % 66 |
Tek merkezli çalışma 2 pediyatrik hasta (< 18 yaş) içermektedir ve her ikisinde de tam remisyon sağlanmıştır. Çok merkezli çalışma 5 pediyatrik hasta (<18 yaş) içermektedir ve 3'ünde tam remisyon sağlanmıştır. 5 yaşından küçük çocuklar tedavi edilmemiştir.
Konsalidasyon sonrası izleme (follow-up) tedavisinde; tek merkezli çalışmadan 7 hasta ve çok merkezli çalışmadan 18 hasta, arsenik trioksit ile idame tedavisi almıştır. Tek merkezli çalışmadan 3 hasta ve çok merkezli çalışmadan 15 hasta, arsenik trioksit'i tamamladıktan sonra kök hücre transplantasyonu almıştır. Kaplan-Meier ortalama tam remisyon süresi; tek merkezli çalışma için 14 aydır ve çok merkezli çalışma için buna erişilememektedir. En son izlemede; tek merkezli çalışmadaki 12 hastanın 6'sı 28 aylık (25-29 ay aralığında) ortalama izleme süresi ile yaşamıştır. Çok merkezli çalışmadaki 40 hastanın 27'si, 16 aylık (9-25 ay aralığında)
ortalama izleme süresi ile yaşamıştır. Her çalışma için 18 aylık sağkalımın Kaplan-Meier değerlendirmesi aşağıda gösterilmiştir.
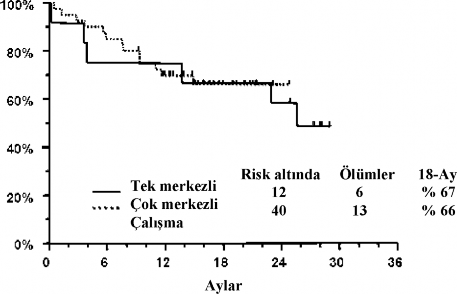
Normal bir genotipe dönüşmesinin sitogenetik doğrulaması ve PML/RARα'nın normale dönüşümünün Ters Transkriptaz â Polimeraz Zincir Reaksiyonu (RT-PCR) tespiti aşağıdaki tabloda gösterilmiştir.
Arsenik trioksit tedavisi sonrası sitogenetik:
Tablo 5
| Tek Merkezli Pilot Çalışması Tam remisyon ile N=11 | Çok Merkezli Çalışma Tam remisyon ile N=34 |
Konvansiyonel sitogenetik |
|
|
[t(15;17)] |
|
|
Yok | 8 (% 73) | 31 (% 91) |
Mevcut | 1 (% 9) | % 0 |
Değerlendirilebilir değil | 2 (% 18) | 3 (% 9) |
PML/RARα için RT-PCR |
|
|
Negatif | 8 (% 73) | 27 (% 79) |
Pozitif | 3 (% 27) | 4 (% 12) |
Değerlendirilebilir değil | 0 | 3 (% 9) |
Yanıtlar; 6-75 yaş aralığındaki, test edilen tüm yaş gruplarında izlenmiştir. Yanıt oranı, her iki cinsiyet için de benzerdi. t(11; 17) ve t(5; 17) kromozamal translokasyon içeren varyant APL üzerine Arsenik trioksit'in etkileri ile ilgili deneyim elde edilmemiştir.
Pediyatrik popülasyon:
Çocuklardaki deneyim sınırlıdır. 0,15 mg/kg/gün'lük tavsiye edilen dozda Arsenik trioksit ile tedavi edilen 18 yaş altındaki (5-16 yaş aralığındaki) 7 hastanın 5'i tam bir yanıta ulaşmıştır (bkz. bölüm 4.2)
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
Arsenik trioksitin inorganik, liyofilize formu; çözelti içerisine konulduğunda, hızlıca hidrolize ürün olan arsenöz aside (AsIII) dönüşür. AsIII, arsenik trioksitin farmakolojik olarak aktif olan şeklidir.
Dağılım:
İhmal edilebilir düzeyde proteinlere bağlanmasıyla dokular içerisinde belirgin bir şekilde dağılma gösterdiği için Asün dağılım hacmi (V) büyüktür (>400 L). Vaynı zamanda ağırlığa da bağlı olup, vücut ağırlığının artmasıyla artar. Toplam arsenik başlıca karaciğerde, böbrekte, kalpte ve daha az olarak da akciğer, saç ve tırnaklarda birikmektedir.
Biyotransformasyon:
Arsenik trioksitin metabolizması; başlıca karaciğerde, hem arsenik trioksitin aktif türevi olan arsenöz asit (AsIII)'in arsenik asite (AsV) oksidasyonunu, hem de monometilarsonik asite (MMAV) ve dimetilarsinik asite (DMAV) metiltransferaz aracılığıyla oksidatif metilasyonu kapsamaktadır. Beş değerlikli (pentavalent) metabolitler olan MMAV ve DMAV'nin, plazmada ortaya çıkması yavaştır (Arsenik trioksitin ilk uygulanışından yaklaşık 10-24 saat sonra). Ancak, uzun olan yarılanma ömürleri dolayısıyla; birikme, (AsIII)'ün yaptığına kıyasla, multiple dozlamaya daha çok bağlıdır. Bu metabolitlerin birikme (akümülasyon) derecesi, dozlama rejimine bağlıdır. Tek doz uygulama ile karşılaştırıldığında, multiple dozlamadan sonraki birikme yaklaşık 1,4 ila 8 katı kadardır. AsV, plazma içerisinde nispeten düşük seviyelerde bulunur.
İnsan karaciğer mikrozomları ile yapılan in vitro enzimatik çalışmalar; 1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1, 3A4/5, 4A9/11 gibi başlıca sitokrom P450 enzimlerinin substratları üzerine, arsenik trioksitin inhibitör aktivitesinin bulunmadığını göstermiştir. P450 enzimlerinin substratları olan ilaçların arsenik trioksit ile etkileşmesi beklenmemektedir.
Eliminasyon:
Uygulanan arsenik trioksit dozunun yaklaşık olarak %15'i, değişmeyen AsIII olarak idrar ile birlikte atılmaktadır. AsIII'ün metillenmiş metabolitleri (MMAV ve DMAV), başlıca idrar ile atılmaktadır. AsIII'ün plazma konsantrasyonu, 10-14 saatlik ortalama terminal eliminasyon yarı ömrü ile bifazik şekilde pik plazma konsantrasyonunun altına düşer. 7-32 mg'lık (0,15 mg/kg olarak uygulanan) tek doz üzerinden AsIII'ün toplam klerensi 49 l/s olup, renal klerensi 9 l/s'dir. Klerens, çalışılan doz aralığında uygulanan doza veya kişinin ağırlığına bağlı değildir. MMAV ve DMAV metabolitlerinin tahmin edilen ortalama terminal eliminasyon yarı ömürleri sırayla; 32 saat ve 70 saattir.
Böbrek Yetmezliği:
Hafif derecede böbrek yetmezliği (kreatinin klerensi 50-80 ml/dk) veya orta derecede böbrek yetmezliği (kreatinin klerensi 30-49 mL/dk) olan hastalarda, AsIII'ün plazma klerensi değişmemiştir. Ciddi böbrek yetmezliği (kreatinin klerensi 30 mL/dk'dan daha az) olan hastalarda AsIII'ün plazma klerensi, normal böbrek fonksiyonu olan hastalar ile kıyaslandığında
% 40 daha azdır (bkz. bölüm 4.4).
MMAV ve DMAV'ye sistemik maruziyet, böbrek yetmezliği olan hastalarda daha fazla olma eğilimindedir. Bunun klinik açıdan önemi bilinmemektedir; ancak artmış bir toksisite görülmemiştir.
Karaciğer yetmezliği:
Hafif-orta derecede karaciğer yetmezliği olan hepatoselüler karsinomalı hastalardan elde edilen farmakokinetik veri, haftada iki kez yapılan infüzyonları takiben AsIII veya AsV'ün birikmediğini göstermiştir. AUC normalize edilmiş doz (her mg doz başına) aracılığıyla belirlenene göre karaciğer fonksiyon seviyesinin azalması ile, AsIII, AsV, MMAV veya DMAV'ye sistemik maruziyette artışa karşı belirgin bir eğilim elde edilmemiştir.
Doğrusallık / doğrusal olmayan durum:
7-32 mg aralığındaki (0,15 mg/kg olarak uygulanan) toplam tek dozda, sistemik maruziyet (AUC) doğrusal olarak görünmektedir. AsIII'ün pik plazma konsantrasyonunda bifazik şekilde azalma ev daha yavaş bir terminal eliminasyon fazını takiben hızlı bir başlangıç distribüsyon fazı ile karakterizedir. Günlük (n=6) veya haftada 2 kere olan (n=3) rejimde, 0,15 mg/kg olarak
uygulandıktan sonra; tek infüzyon ile kıyaslandığında, yaklaşık 2 kat AsIII biriktiği gözlenmiştir. Bu birikme, tek doz sonuçlarına göre beklenenden biraz daha çoktur.
5.3. Klinik öncesi güvenlilik verileri
Hayvanlardaki arsenik trioksidin limitli sayıdaki üreme toksisite çalışması, önerilen klinik dozun 1-10 katı uygulandığında (mg/m2), embriyotoksisite ve teratojenite (nöral tüp defektleri, anoftalmi ve mikroftalmi) göstermektedir. Arsenik trioksit ile fertilite çalışmaları yürütülmemiştir. Arsenik bileşikleri, in vivo ve in vitro olarak memeli hücrelerin morfolojik transformasyonlarını ve kromozomal bozuklukları indükler. Resmi bir arsenik trioksit karsinojenisite çalışması yapılmamıştır. Ancak, arsenik trioksit ve diğer inorganik arsenik bileşikleri insan karsinojenleri olarak kabul edilmektedir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Sodyum hidroksit
Hidroklorik asit (pH ayarlayıcı olarak) Enjeksiyonluk su
6.2. Geçimsizlikler
6.2. Geçimsizlikler
6.3. Raf ömrü
24 ay.
İntravenöz çözeltiler içerisinde seyreltildikten sonra LEUSENOX, 25ºC'nin altındaki oda sıcaklığında 24 saat ve buzdolabında (2-8ºC) 48 saat süresince kimyasal ve fiziksel olarak dayanıklıdır.
Mikrobiyolojik olarak değerlendirildiğinde, ürün hemen kullanılmalıdır. Eğer hemen kullanılmayacaksa, kullanmadan önce geçerli saklama süresi ve koşulları kullanıcının sorumluluğundadır; eğer seyreltme işlemi kontrollü ve valide edilmiş aseptik koşullarda yapılmazsa, normalde 2-8ºC'de 24 saatten daha uzun olmamalıdır.
6.4. Saklamaya yönelik özel tedbirler
25ºC'nin altındaki oda sıcaklığında saklayınız.
Dondurmayınız.
Seyreltilen steril ürünün saklanmasına yönelik özel tedbirler için Bölüm 6.3'e bakınız.
6.5. Ambalajın niteliği ve içeriği
Her bir kutuda 6 ml çözelti içeren 10 adet 10 ml'lik flakon (10 R şeffaf cam flakon) bulunur.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj ve Ambalaj Atıkları Kontrolü Yönetmeliğiâne uygun olarak imha edilmelidir.
LEUSENOX'un hazırlanması:
Herhangi bir koruyucu madde bulunmadığı için, LEUSENOX'un kullanımı boyunca aseptik teknik kesinlikle uygulanmalıdır.
LEUSENOX, flakondan çekildikten hemen sonra, 50 mg/ml (% 5) glukoz enjeksiyonluk çözeltisinin veya 9 mg/ml (% 0,9) sodyum klorür enjeksiyonluk çözeltisinin 100-250 ml'si ile seyreltilmelidir. Sadece tek bir kullanım içindir. Her bir flakonun kullanılmayan kısımları uygun olarak atılmalıdır. Daha sonraki uygulamalar için, herhangi bir kullanılmayan kısım saklamayınız.
LEUSENOX diğer tıbbi ürünler ile karıştırılmamalı veya aynı intravenöz yol kullanılarak birlikte uygulanmamalıdır.
LEUSENOX, intravenöz olarak 1-2 saat boyunca uygulanmalıdır. Eğer vazomotor reaksiyonlar gözlenirse, infüzyon süresi 4 saate kadar uzatılabilir. Santral venöz bir kateter gerekmemektedir.
Seyreltilen çözelti berrak ve renksiz olmalıdır. Tüm parenteral çözeltiler, partiküler madde ve uygulamadan önce renklenme açısından görsel olarak incelenmelidir. Yabancı partikül madde bulunması halinde müstahzarı kullanmayınız.
 Diyabet Hastalığı
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır.
Diyabet Hastalığı
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |
 Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir.
Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| TRISENOX | 8699638764143 | 40,311.46TL |
| Diğer Eşdeğer İlaçlar |
 |
Deri Kanseri Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör. |
 |
Travma Sonrası Bunalımı Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir. |
 |
Yüksek Tansiyon Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon atardamarlarınızdaki kanın basıncıdır. |
İLAÇ GENEL BİLGİLERİ
Koçak Farma İlaç ve Kimya Sanayi A.Ş.
| Satış Fiyatı | 48356.67 TL [ 26 Apr 2024 ] |
| Önceki Satış Fiyatı | 48356.67 TL [ 22 Apr 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699828770619 |
| Etkin Madde | Arsenik Trioksid |
| ATC Kodu | L01XX27 |
| Birim Miktar | 2 |
| Birim Cinsi | MG/ML |
| Ambalaj Miktarı | 10 |
| Antineoplastik ve İmmünomodülatör Ajanlar > Diğer Kanser İlaçları > Arsenic trioxide |
| Yerli ve Beşeri bir ilaçdır. |