TECENTRIQ 840 mg/14 ml infüzyonluk çözelti hazırlamak için konsantre Farmakolojik Özellikler
{ Atezolizumab }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ve İmmünomodülatör ajanlar, Monoklonal Antikorlar ve Antikör İlaç Konjugatları, PD-1/PDL-1 (Programlanmış hücre ölüm proteini 1 / ölüm ligandı 1) İnhibitörleri
ATC kodu: L01FF05
Etki mekanizması:
Hümanize IgG1 anti-programlı ölüm-ligandı 1(PD-L1), tümör hücreleri ve/veya tümör infiltre eden immün hücrelerinde eksprese olabilir ve tümör mikroortamında anti-tümör immün yanıtının inhibisyonuna katkıda bulunabilir. PD-L1'in T-hücrelerinde ve antijen sunan hücrelerde bulunan PD-1 ve B7.1 reseptörlerine bağlanması, sitotoksik T-hücre aktivitesini, T-hücre çoğalmasını ve sitokin üretimini baskılar.
Atezolizumab Fc bölgesi değiştirilmiş bir hümanize immünoglobülin G1 (IgG1) monoklonal antikorudur; doğrudan PD-L1'e bağlanır ve PD-1 ve B7.1 reseptörlerinin ikili blokajını sağlayarak, antikor bağımlı hücresel sitotoksisiteyi indüklemeden antitümör immün yanıtın yeniden aktive edilmesi de dahil, immün yanıtın PD-L1/PD-1 aracılı inhibisyonunu serbest bırakır. Atezolizumab, PD-L2/PD-1 etkileşimini koruyarak PD-L2/PD-1 aracılı inhibitör
sinyallerin devam etmesine izin verir.
Klinik etkililik ve güvenlilik:
1200 mg dozda üç haftada bir uygulanan TECENTRIQ ile yapılan çalışmaların tanımı için, TECENTRIQ 1200 mg/20 mL infüzyonluk çözelti hazırlamak için konsantre'nin Kısa Ürün Bilgisi'ne bakınız.
Üçlü negatif meme kanseri
IMpassion130 (WO29522): Daha önce metastatik hastalık için tedavi edilmemiş, lokal ileri veya metastatik ÜNMK hastalarında randomize faz III çalışma
Metastatik hastalık için daha önce kemoterapi almamış, rezeke edilemeyen, lokal ileri veya metastatik ÜNMK olan hastalarda, atezolizumab ile nab-paklitakselin etkililik ve güvenliliğini değerlendirmek için Faz III, çift kör, iki kollu, çok merkezli, uluslararası, randomize, plasebo kontrollü bir çalışma olan IMpassion130 yürütülmüştür. Taksan monoterapisi için uygun olan hastalar seçilmiştir (yani hızlı klinik ilerlemenin olmaması, yaşamı tehdit eden viseral metastazların veya hızlı semptom ve/veya hastalık kontrolü ihtiyacının olmaması). Son 12 ay içerisinde neoadjuvan veya adjuvan ortamında kemoterapi alan hastalar, otoimmün hastalık öyküsü olan, randomizasyondan önceki 4 hafta içinde bir canlı atenüe aşı, randomizasyondan önceki 4 hafta içinde sistemik immünostimülatör ajan uygulanmış veya randomizasyondan önceki 2 hafta içinde sistemik immunosupresif tıbbi ürün kullanmış hastalar, tedavi edilmemiş semptomatik veya kortikosteroide bağlı beyin metastazı öyküsü olan hastalar dahil edilmemiştir. Tümör değerlendirmeleri, 1. döngünün (1. gün) ardından ilk 12 ay süreyle 8 haftada (± 1 hafta) bir ve sonrasında 12 haftada (± 1 hafta) bir olmak üzere gerçekleştirilmiştir.
Toplamda 902 hasta çalışmaya dahil edilmiş ve karaciğer metastazı varlığı, taksan tedavisi öyküsü ve tümör infiltre edici immün hücrelerde (IC) PD-L1 ekspresyonu durumuna göre tabakalandırılmıştır (PD-L1 ile boyanmış tümör infiltre edici immün hücreler [IC] < %1 VENTANA PD-L1 (SP142) testi ile değerlendirilen tümör alanına karşı tümör alanının ≥ %1'i).
Hastalar, her 28 günlük siklusta 1. ve 15. günlerde intravenöz infüzyon yoluyla atezolizumab 840 mg veya plasebo ve her 28 günlük siklusta 1., 8. ve 15. günlerde intravenöz infüzyon yoluyla nab-paklitaksel (100 mg/m) almak üzere randomize edilmiştir. Hastalar, RECIST v1.1 uyarınca radyografik hastalıkta ilerleme veya kabul edilemez bir toksisite meydana gelene kadar tedavi görmüştür. Kabul edilemez toksisite nedeniyle nab-paklitaksel durdurulduğunda atezolizumab ile tedaviye devam edilebilir. Her tedavi kolunda medyan tedavi döngüsü sayısı atezolizumab için 7 ve nab-paklitaksel için 6'dır.
Çalışma popülasyonunun demografik ve başlangıç özellikleri, tedavi kolları arasında iyi dengelenmiştir. Hastaların çoğu kadındır (%99,6), %67,5'i beyaz, %17,8'i Asyalıdır. Medyan yaş 55' dir (aralık: 20-86). Başlangıçta ECOG performans skoru 0 (%58,4) veya 1'dir (%41,3). Genel olarak, dahil edilen hastaların %41'inde başlangıçta PD-L1 ekspresyonu ≥ %1 iken, %27'sinde karaciğer metastazları ve %7'sinde beyin metastazları mevcuttur. Yaklaşık olarak hastaların yarısı, (neo)adjuvan koşullarda bir taksan (%51) veya antrasiklin (%54) almıştır. PD-L1 ekspresyonu ≥ %1 olan hastalarda demografik bilgiler ve başlangıç tümör hastalığı, genel itibariyle daha geniş çalışma popülasyonunu temsil ediyordu.
Eş birincil etkililik sonlanım noktaları, ITT popülasyonunda ve RECIST v1.1 uyarınca PD-L1 ekspresyonu ≥ %1 olan hastalarda araştırmacı tarafından değerlendirilen, progresyonsuz sağkalımın (PS) yanı sıra ITT popülasyonunda ve PD-L1 ekspresyonu ≥ %1 olan hastalarda
genel sağkalımı (GS) içermiştir. İkincil etkililik sonlanım noktaları, RECIST v1.1 uyarınca objektif yanıt oranı (OYO) ve yanıt süresini (YS) içermiştir.
Medyan sağkalım takibi 13 aylık olan progresyonsuz sağkalım (PS) için son analiz sırasında PD-L1 ekspresyonu ≥%1 olan hastalar için IMpassion130'un PS, OYO ve YS sonuçları Tablo 3'de özetlenmiştir ve PS için Kaplan-Meier eğrileri PD-L1 ekspresyonu <%1 olan hastalar Şekil 1'de gösterilmektedir. Nab-paklitaksele atezolizumab eklendiğinde PS'de iyileşme gözlenmemiştir (TO 0,94, %95 GA 0,78, 1,13).
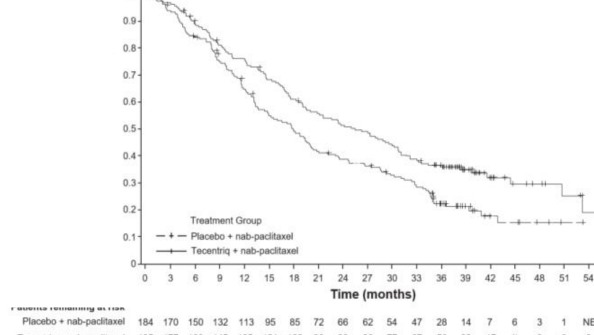
Nihai GS analizi, PD-L1 ekspresyonu ≥%1 olan ve medyan takip süresi 19,12 olan hastalarda yapılmıştır. GS sonuçları Tablo 3'de ve Kaplan-Meier eğrileri Şekil 1'de sunulmaktadır. PD-L1 ekspresyonu <%1 olan hastalar, nab-paklitaksele atezolizumab eklendiğinde gelişmiş GS gözlenmemiştir (TO 1,02, %95 GA 0,84, 1,24).
PD-L1 ekspresyonu ≥%1 olan hastalarda, önceki (neo)adjuvan tedavi, BRCA1/2 mutasyonu ve başlangıçta asemptomatik beyin metastazları araştırılarak keşif amaçlı alt grup analizleri yapılmıştır. Daha önce (neo) adjuvan tedavi almış hastalarda (n=242) birincil (nihai) PS için tehlike oranı 0,79 ve final GS için 0,77 iken, daha önce (neo)adjuvan tedavi almamış hastalarda (n=127), birincil (nihai) PS için tehlike oranı, final GS için 0,44 ve 0,54 olarak saptanmıştır.
IMpassion130 çalışmasında, test edilen 614 hastanın 89'u (%15) patojenik BRCA1/2 mutasyonları taşımaktaydı. PD-L1+/BRCA1/2 mutant alt grubundan 19 hasta atezolizumab artı nab-paklitaksel ve 26 plasebo artı nab-paklitaksel almıştır. Araştırmacı analize dayanarak ve küçük örnek boyutunun kabul edilmesiyle, BRCA1/2 mutasyonunun varlığı, atezolizumab ve nab-paklitakselin PS klinik yararını etkilemiyor gibi görünmektedir.
Tedavi edilen hasta sayısı az olmasına rağmen, başlangıçta asemptomatik beyin metastazı olan hastalarda etkililik kanıtı yoktu; medyan PS, atezolizumab artı nab-paklitaksel kolunda (n=15) 2,2 ay iken, plasebo artı nab-paklitaksel kolunda (n=11) 5,6 aydır (TO 1,40; %95 GA 0,57,
3,44).
Tablo 3: PD-L1 ekspresyonu ≥ %1 olan hastalarda etkililik özeti (IMpassion130)
Anahtar etkililik sonlanım noktaları | Atezolizumab+ nab-paklitaksel | Plasebo+ nab-paklitaksel |
Birincil etkililik sonlanım noktaları | n=185 | n=184 |
Araştırmacı tarafından değerlendirilen PS (RECIST v1.1)-Primer analiz | ||
Olay sayısı (%) | 138 (%74,6) | 157 (%85,3) |
Medyan PS süresi (ay) | 7,5 | 5 |
%95 GA | (6,7; 9,2) | (3,8; 5,6) |
Tabakalandırılmış tehlike oranıâ¡ (%95 GA) | 0,62 (0,49; 0,78) | |
p değeri | <0,0001 | |
12-aylık PS (%) | 29,1 | 16,4 |
Araştırmacı tarafından değerlendirilen PS (RECIST v1.1)- Güncellenmiş keşif analizi | ||
Olay sayısı (%) | 149 (%80,5) | 163 (%88,6) |
Medyan PS süresi (ay) | 7,5 | 5,3 |
%95 GA | (6,7; 9,2) | (3,8; 5,6) |
Tabakalandırılmış tehlike oranıâ¡ (%95 GA) | 0,63 (0,5; 0,8) | |
p değeri | <0,0001 | |
12-aylık PS (%) | 30,3 17,3 | |
GS | ||
Ölüm sayısı(%) | 120 (%64,9) | 139 (%75,5) |
Medyan olay süresi (ay) | 25,4 | 17,9 |
%95 GA | (19,6, 30,7) | (13,6, 20,3) |
Tabakalandırılmış tehlike oranıâ¡ (%95 GA) |
|
0,67 (0,53, 0,86) |
İkincil ve araştırmaya yönelik sonlanım noktaları | ||
Araştırmacı tarafından değerlendirilen OYO (RECIST 1.1) | n=185 | n=183 |
Yanıt veren hasta sayısı (%) | 109 (%58,9) | 78 (%42,6) |
%95 GA | (51,5; 66,1) | (35,4; 50,1) |
Tam yanıt sayısı (%) | 19 (%10,3) | 2 (%1,1) |
Kısmi yanıt sayısı (%) | 90 (%48,6) | 76 (%41,5) |
Stabil hastalık sayısı | 38 (%20,5) | 49 (%26,8) |
Araştırmacı tarafından değerlendirilen YS | n=109 | n=78 |
Ay olarak medyan | 8,5 | 5,5 |
%95 GA | (7,3; 9,7) | (3,7; 7,1) |
â¡ Karaciğer metastazı varlığı ve taksan tedavisi öyküsüne göre tabakalandırılmıştır.
PS= Progresyonsuz sağkalım; RECIST= Solid Tümörlerde Yanıt Değerlendirme Kriterleri v1.1.; GA= Güven aralığı; OYO= Objektif yanıt oranı; YS= Yanıt süresi; GS= Genel sağkalım
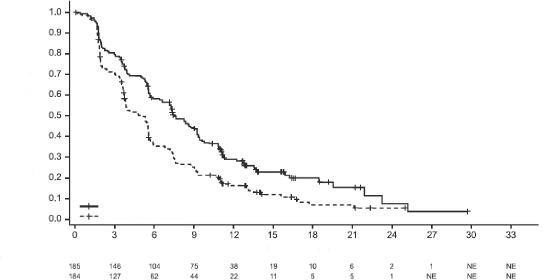
Şekil 1: PD-L1 ekspresyonu ≥ %1 olan hastalarda Progresyonsuz Sağkalım için Kaplan-Meier Eğrisi (IMpassion130)
Şekil 2: PD-L1 ekspresyonu ≥ %1 olan hastalarda Genel Sağkalım için Kaplan-Meier Eğrisi (IMpassion130)
EORTC QLQ-C30 ile ölçülen hasta tarafından bildirilen genel sağlık durumu/sağlıkla ilişkili yaşam kalitesinin (HRQoL) bozulmasına kadar geçen süre (başlangıç puanından sürekli ≥10 puanlık bir düşüş) her tedavi grubunda benzerdir ve bu tüm hastaların karşılaştırılabilir bir süre boyunca temel HRQoL'lerini koruduğunu göstermektedir.
5.2. Farmakokinetik özellikler
Genel özelliklerAtezolizumaba maruziyet 1 mg/kg - 20 mg/kg doz aralığında 3 haftada bir uygulanan sabit doz
1200 mg doz ile orantılı olarak artmıştır. 472 hastayı içeren bir popülasyon analizi, aşağıdaki doz aralığı için atezolizumab farmakokinetiğini birinci derece eliminasyonla bir doğrusal iki bölmeli düzenleme modeli ile 1 - 20 mg/kg olarak açıklamıştır. Üç haftada bir uygulanan 1200 mg atezolizumab dozu ve 2 haftada bir uygulanan 840 mg atezolizumab dozu ve 4 haftada bir uygulanan 1680 mg atezolizumab dozunun farmakokinetik özellikleri aynıdır. Bu üç doz rejimiyle karşılaştırılabilir toplam maruziyetlere ulaşılması beklenmektedir. Bir popülasyon farmakokinetik analizi, 6-9 hafta tekrarlı dozlamadan sonra kararlı durumun elde edildiğini öne sürmektedir. Eğri altındaki alanda, maksimum konsantrasyon ve en düşük konsantrasyonda sistemik birikim sırasıyla 1,91; 1,46 ve 2,75 kat olmuştur.
Emilim:
Atezolizumab intravenöz infüzyon şeklinde uygulanır. Diğer uygulama yollarıyla yapılan çalışmalar olmamıştır.
Dağılım:
Popülasyon farmakokinetik analizi, bir hastada merkezi kompartman dağılım hacminin 3,28 L ve kararlı durumunda hacmin 6,91 L olduğunu göstermektedir.
Biyotransformasyon:
Atezolizumabın metabolizması doğrudan araştırılmamıştır. Antikor klerensi esas olarak katabolizmayla gerçekleşir.
Eliminasyon:
Popülasyon farmakokinetik analizi, atezolizumabın klerensinin 0,2 L/gün ve tipik terminal eliminasyon yarı ömrünün 27 gün olduğunu göstermektedir.
Özel popülasyonlara ilişkin ek bilgiler:
Popülasyon farmakokinetiği ve maruziyet-yanıt analizlerine göre aşağıdaki faktörlerin atezolizumabın farmakokinetiği üzerinde bir etkisi yoktur: Yaş, (21-89 yaş), bölge, etnik köken, böbrek bozukluğu, hafif karaciğer bozukluğu, PD-L1 ekspresyonu düzeyi veya ECOG performans durumu. Vücut ağırlığı, cinsiyet, pozitif ADA durumu, albümin seviyeleri ve tümör yükünün atezolizumab farmakokinetiği üzerindeki etkisi istatistiki olarak anlamlı ancak klinik olarak anlamlı değildir. Doz ayarlaması önerilmemektedir.
Pediyatrik popülasyon:
Pediyatrik (<18 yaş, n=69) ve genç erişkin (18-30 yaş, n=18) hastalarda yürütülen erken faz, çok merkezli, açık etiketli bir çalışmadan elde edilen farmakokinetik sonuçlar, atezolizumab klerensi ve dağılım hacminin, normal vücut ağırlığına göre normalize edildiğinde 15 mg/kg alan pediyatrik hastalar ve her 3 haftada bir 1200 mg atezolizumab alan genç erişkin hastalar arasında karşılaştırılabilir olduğunu göstermiştir. Maruziyetin ise, vücut ağırlığı düştükçe pediyatrik hastalarda arttığı gözlenmiştir. Bu değişiklikler, atezolizumab konsantrasyonunun terapötik hedef maruziyetinin altına düşmesi ile bağlantılı değildir. 2 yaş altındaki çocuklar için veriler sınırlıdır, bu nedenle kesin sonuçlara varılamamaktadır.
Geriyatrik popülasyon:
Yaşlı hastalarda TECENTRIQ için özel bir çalışma yapılmamıştır. Yaşın atezolizumabın farmakokinetiği üzerindeki etkisi bir popülasyon farmakokinetik analizinde değerlendirilmiştir. Yaş, 21-89 yaş aralığındaki (n=472) ve medyan 62 yaşındaki hastalar temel alındığında, atezolizumabın farmakokinetiğini etkileyen önemli bir kovaryant olarak tanımlanmamıştır.
<65 yaşındaki (n=274), 65-75 yaşındaki (n=152) ve >75 yaşındaki (n=46) hastalarda atezolizumabın farmakokinetiğinde klinik açıdan anlamlı bir fark gözlenmemiştir (bkz. Bölüm 4.2).
Böbrek yetmezliği:
Böbrek yetmezliği olan hastalarda TECENTRIQ için özel bir çalışma yapılmamıştır. Popülasyon farmakokinetik analizinde, böbrek fonksiyonu normal (90 mL/dk/1,73 m veya üzeri tahmini glomerüler filtrasyon hızı [eGFR]; n=140) olan hastalarla karşılaştırıldığında, hafif (60 - 89 mL/dk/1,73 m eGFR; n=208) veya orta şiddetli (30 - 59 mL/dk/1,73 m eGFR; n=116) böbrek yetmezliği olan hastalarda atezolizumabın klerensinde klinik açıdan önemli farklar bulunmamıştır. Yalnızca birkaç hastada şiddetli böbrek yetmezliği vardır (eGFR 15 - 29 mL/dk/1,73 m; n=8) (bkz. Bölüm 4.2). Şiddetli böbrek yetmezliğinin atezolizumabın farmakokinetiği üzerindeki etkisi bilinmemektedir.
Karaciğer yetmezliği:
Karaciğer bozukluğu olan hastalarda TECENTRIQ için özel bir çalışma yapılmamıştır. Popülasyon farmakokinetik analizinde, hafif (bilirubin ≤NÜS ve AST>NÜS veya bilirubin >1 â 1,5 x NÜS ve herhangi bir AST) veya orta (bilirubin > 1,5 â 3 x NÜS ve herhangi bir AST) karaciğer yetmezliği olan ve normal karaciğer fonksiyonu (bilirubin ≤ NÜS ve AST ≤NÜS) olan hastalar arasında atezolizumabın klerensi bakımından klinik olarak önemli farklar bulunmamıştır. Şiddetli (bilirubin > 3 x NÜS ve herhangi bir AST) karaciğer yetmezliği olan hastalara ilişkin veri mevcut değildir. Karaciğer yetmezliği, Ulusal Kanser Enstitüsü (NCI) karaciğer fonksiyon bozukluğu kriterlerine göre tanımlanmıştır (bkz. Bölüm 4.2). Şiddetli karaciğer yetmezliğinin (bilirubin > 3 x NÜS ve herhangi bir AST) atezolizumabın farmakokinetiği üzerindeki etkisi bilinmemektedir.
5.3. Klinik öncesi güvenlilik verileri
Karsinojenite:
TECENTRIQ'in karsinojenik potansiyelini belirlemek için karsinojenite çalışması yapılmamıştır.
Mutajenite:
TECENTRIQ'in mutajenik potansiyelini belirlemek için mutajenite çalışması yapılmamıştır. Bununla birlikte, monoklonal antikorların DNA veya kromozomları değiştirmesi beklenmemektedir.
Fertilite:
TECENTRIQ ile herhangi bir doğurganlık çalışması yapılmamıştır. Bununla birlikte, kronik toksisite çalışmasına sinomolgus maymunlarında erkek ve dişi üreme organlarının değerlendirilmesi dahil edilmiştir. Atezolizumabın dişi maymunlara tahmini EAA'da uygulanması (önerilen dozu alan hastalardaki EAA'nın yaklaşık 6 katı), geri dönüşümlü olarak düzensiz adet döngüsüne ve yumurtalıklarda yeni oluşturulmuş korpus lutea eksikliğine neden olmuştur. Erkek üreme organları üzerinde herhangi bir etkisi olmamıştır.
Teratojenite:
TECENTRIQ ile hayvanlarda üreme ve teratojenite çalışmaları yapılmamıştır. Hayvan çalışmaları, PD-L1/PD-1 yolağının inhibisyonunun, gelişen fetüsün bağışıklıkla ilişkili reddine yol açarak fetal ölümle sonuçlanabileceğini göstermiştir. TECENTRIQ uygulaması, embriyo-fetal ölüm dahil olmak üzere fetal zarara neden olabilir.
 Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir.
Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
 İnme
İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama
ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına
yol açar.
İnme
İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama
ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına
yol açar. |
İLAÇ GENEL BİLGİLERİ
Roche Müstahzarları Sanayi A.Ş.
| Satış Fiyatı | 59800.44 TL [ 10 May 2024 ] |
| Önceki Satış Fiyatı | 59800.44 TL [ 3 May 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Kısıtlanmış Beyaz Reçeteli bir ilaçdır. |
| Barkodu | 8699505763323 |
| Etkin Madde | Atezolizumab |
| ATC Kodu | L01XC32 |
| Birim Miktar | 840/14 |
| Birim Cinsi | MG/ML |
| Ambalaj Miktarı | 1 |
| Antineoplastik ve İmmünomodülatör Ajanlar > Diğer Kanser İlaçları |
| İthal ( ref. ülke : Litvanya ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Kolon, Rektum yada Bağırsak Kanseri Bağırsak kanseri kolon veya rektumda (arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir şekilde tedavi edilir. |
 |
Deri Kanseri Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör. |
 |
Sırt Ağrısı Sırt ağrısı birden bire ortaya çıkıp şiddetli (akut) olabilir veya zamanla gelişip daha uzun süreli sorunlara (kronik) neden olabilir. |