TALZENNA 1 mg SERTKAPSUL (30 adet) Farmakolojik Özellikler
{ Talazoparib Tosilat }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Diğer antineoplastik ajanlar, Poli (ADP-riboz) polimeraz (PARP) inhibitörleri
ATC kodu: L01XK04
Etki mekanizması:
Talazoparib, PARP enzimleri PARP1 ve PARP2'nin bir inhibitörüdür. PARP enzimleri; DNA onarımı, gen transkripsiyonu ve hücre ölümü gibi, hücre DNA hasar yanıt sinyal yolaklarında rol oynar. PARP inhibitörleri (PARPi), kanser hücreleri üzerinde, bir PARPi'ye bağlanan PARP proteininin bir DNA lezyonundan kolayca ayrışmadığından, DNA onarımına, replikasyonuna ve transkripsiyonuna ve sonuç olarak da apoptoz ve/veya hücre ölümüne engel olduğu PARP katalitik aktivitesinin inhibisyonu ve PARP yakalama olmak üzere 2 mekanizma ile sitotoksik etkiler göstermektedir. DNA onarım genlerinde kusurlar barındıran kanser hücre hatlarının tek ajan olarak talazoparib ile tedavisi, çift sarmallı DNA kopmalarının bir belirteci olan γH2AX düzeyinin artışına yol açarak azalmış hücre proliferasyonuna ve artmış apoptoza neden olur. Talazoparibin anti tümör etkisi ayrıca, hastanın daha önce platin bazlı bir rejimle tedavi edilmiş olduğu hastadan türetilmiş ksenogreft (PDX) BRCA mutant meme kanseri modelinde de gözlenmiştir. PDX modelinde talazoparib tümör büyümesini azaltmış ve tümörlerde γH2AX düzeyini ve apoptozu arttırmıştır.
Kardiyak elektrofizyoloji
Talazoparibin kardiyak repolarizasyon üzerindeki etkisi, başlangıçtan itibaren kalp atış hızı (QTc) için düzeltilmiş QT aralığının değişimi ile ileri evre solid tümörlü 37 hastadaki karşılık gelen plazma talazoparib konsantrasyonları arasındaki ilişkiyi belirlemek için, zaman eşleşmeli elektrokardiyogramlar (EKG) kullanılarak değerlendirilmiştir. Talazoparib, klinik olarak önerilen günde bir kez 1 mg'lık maksimum dozda QTc uzaması üzerinde klinik olarak anlamlı bir etkide bulunmamıştır.
Klinik etkililik ve güvenlilik
Randomize Faz 3 çalışması EMBRACA
EMBRACA, germ hattı BRCA mutasyonlu HER2 negatif, lokal ileri evre veya metastatik meme kanseri olan, metastazlı ya da lokal ileri evre hastalıkları için daha önce en fazla 3
sitotoksik kemoterapi rejimi almış hastalarda TALZENNA'nın kemoterapiyle (kapesitabin, eribulin, gemsitabin, vinorelbin) karşılaştırıldığı açık etiketli, randomize, paralel, 2 kollu, çok merkezli bir çalışma olmuştur. Hastaların, neoadjuvan, adjuvan ve/veya metastatik tedavi için bir antrasiklin ve/veya taksanla (kontrendike değilse) tedavi almış olmaları şart koşulmuştur. İleri evre hastalık için daha önce platin tedavisi alan hastalarda, platin tedavisi esnasında hastalık ilerlemesi bulgusu olmaması şart kılınmıştır. Daha önce bir PARP inhibitörüyle tedavi alanlara izin verilmemiştir.
EMBRACA çalışmasında randomize edilen 431 hastanın 408'inde (%95), bir klinik çalışma tayini kullanılarak deleteriyöz veya şüpheli deleteriyöz gBRCAm olduğu merkezi olarak onaylanmıştır ve bunların 354'ü (%82) BRACAnalysis CDx kullanılarak onaylanmıştır. BRCA mutasyonu durumu (meme kanseri yatkınlık geni 1 [BRCA1] pozitif veya meme kanseri yatkınlık geni 2 [BRCA2] pozitif) her iki tedavi kolu arasında benzer olmuştur.
Toplam 431 hasta 2:1 randomize edilerek, ilerleme ya da kabul edilemez toksisite görülene kadar günde bir kez TALZENNA 1 mg kapsülleri veya standart dozlarda kemoterapi almıştır. EMBRACA çalışmasında randomize edilen 431 hastanın 287'si TALZENNA koluna, 144'ü kemoterapi koluna randomize edilmiştir. Randomizasyon, metastatik hastalık için daha önce kemoterapi kullanılmasına (0'a karşılık 1, 2 veya 3), üçlü negatif hastalık durumuna (üçlü negatif meme kanserine [TNBC] karşılık TNBC dışı) ve merkezi sinir sistemi metastazı öyküsüne (var-yok) göre sınıflandırılarak yapılmıştır.
Çalışmanın tedavi kolları arasında hastaların demografik verileri, başlangıç ve hastalık özellikleri genelde benzer olmuştur (bkz. Tablo 3).
Tablo 4. Demografik veriler, başlangıç ve hastalık özellikleriâ EMBRACA
çalışması
| Talazoparib (N=287) | Kemoterapi (N=144) |
Medyan yaş (y [aralık]) | 45,0 (27,0, 84,0) | 50,0 (24,0, 88,0) |
Yaş kategorisi (y), n (%) | ||
< 50 | 182 (%63,4) | 67 (%46,5) |
50 ila < 65 | 78 (%27,2) | 67 (%46,5) |
≥ 65 | 27 (%9,4) | 10 (%6,9) |
Cinsiyet, n (%) | ||
Kadın | 283 (%98,6) | 141 (%97,9) |
Erkek | 4 (%1,4) | 3 (%2,1) |
Irk, n (%) | ||
Asyalı | 31 (%10,8) | 16 (%11,1) |
Siyah veya Afro Amerikalı | 12 (%4,2) | 1 (%0,7) |
Beyaz | 192 (%66,9) | 108 (%75,0) |
Diğer | 5 (%1,7) | 1 (%0,7) |
Rapor edilmemiştir | 47 (%16,4) | 18 (%12,5) |
ECOG performans durumu, n (%) | ||
0 | 153 (%53,3) | 84 (%58,3) |
1 | 127 (%44,3) | 57 (%39,6) |
2 | 6 (%2,1) | 2 (%1,4) |
Eksik | 1 (%0,3) | 1 (%0,7) |
Hormon reseptörü durumu, n (%) | ||
HER2-pozitif | 0 (%0,0) | 0 (%0,0) |
Üçlü negatif | 130 (%45,3) | 60 (%41,7) |
Hormon reseptörü pozitif (ER pozitif veya PgR pozitif) | 157 (%54,7) | 84 (%58,3) |
Tablo 4. Demografik veriler, başlangıç ve hastalık özellikleriâ EMBRACA
çalışması
| Talazoparib (N=287) | Kemoterapi (N=144) |
Merkezi veya yerel laboratuvar değerlendirmesine göre BRCA durumu, n (%) | 287 (%100,0) | 144 (%100,0) |
BRCA1 mutasyonu pozitif | 133 (%46,3) | 63 (%43,8) |
BRCA2 mutasyonu pozitif | 154 (%53,7) | 81 (%56,3) |
İlk meme kanseri teşhisinden ileri evre meme kanseri teşhisine kadar olan süre (yıl) | ||
n | 286 | 144 |
Medyan | 1,9 | 2,7 |
Minimum, maksimum | 0, 22 | 0, 24 |
İlk meme kanseri teşhisinden ilerlemiş meme kanseri teşhisine kadar olan süre için kategoriler | ||
< 12 ay | 108 (%37,6) | 42 (%29,2) |
≥ 12 ay | 178 (%62,0) | 102 (%70,8) |
Lokal ileri evre veya metastatik hastalık için önceki sitotoksik rejim sayısı | ||
Ortalama (Std Spm.) | 0,9 (1,01) | 0,9 (0,89) |
Medyan | 1 | 1 |
Minimum, maksimum | 0, 4 | 0, 3 |
Lokal ileri evre veya metastatik hastalık için önceden sitotoksik rejim alan hasta sayısı, n (%) | ||
0 | 111 (%38,7) | 54 (%37,5) |
1 | 107 (%37,3) | 54 (%37,5) |
2 | 57 (%19,9) | 28 (%19,4) |
3 | 11 (%3,8) | 8 (%5,6) |
≥ 4 | 1 (%0,3) | 0 (%0,0) |
Aşağıdaki önceki tedavileri alan hasta sayısı, n (%) | ||
Taksan | 262 (%91,3) | 130 (%90,3) |
Antrasiklin | 243 (%84,7) | 115 (%79,9) |
Platin | 46 (%16,0) | 30 (20,8) |
BRCA=meme kanseri yatkınlık geni; ER=östrojen reseptörü; HER2=insan epidermal büyüme faktörü reseptörü 2;
N=hasta sayısı; n=kategorideki hasta sayısı; PgR=progesteron reseptörü.
Primer etkililik sonlanım noktası, körleştirilmiş bağımsız merkezi incelemeyle (BICR)
değerlendirildiği şekilde, Solid Tümörlerde Yanıt Değerlendirme Kriterleri (RECIST) versiyon
1.1 uyarınca değerlendirilen progresyonsuz sağkalım (PFS) olmuştur. Sekonder hedefler, objektif yanıt oranı (ORR), genel sağkalım (OS), güvenlilik ve PK olmuştur.
Çalışmada, kemoterapiye kıyasla TALZENNA için birincil etkililik sonlanım noktası olan PFS'de istatistiksel açıdan anlamlı bir iyileşme ortaya konmuştur. Son OS analizi zamanında OS üzerinde istatistiksel olarak anlamlı bir etki bulunmamaktadır. EMBRACA etkililik verileri Tablo 4'te özetlenmektedir. PFS ve OS için Kaplan-Meier eğrileri sırasıyla Şekil 1 ve Şekil 3'de sunulmaktadır.
Tablo 5. Etkililik sonuçlarının özeti â EMBRACA çalışması
| Talazoparib | Kemoterapi |
BICR ile PFS | N=287 | N=144 |
Olaylar, sayı (%) | 186 (%65) | 83 (%58) |
Medyan (%95 GA), ay | 8,6 (7,2, 9,3) | 5,6 (4,2, 6,7) |
Tehlike oranı (%95 GA) | 0,54 (0,41, 0,71) | |
2 taraflı p değeri | p<0,0001 | |
OS (son analiz) | N=287 | N=144 |
Olaylar, sayı (%) | 216 (%75,3) | 108 (%75) |
Medyan (%95 GA), ay | 19,3 (16,6, 22,5) | 19,5 (17,4, 22,4) |
Tehlike oranı (%95 GA) | 0,85 (0,67, 1,07) | |
2 taraflı p değeri | p=0,1693 | |
Araştırmacıya göre objektif yanıt | N=219 | N=114 |
ORR % (%95 GA) | 62,6 (55,8, 69,0) | 27,2 (19,3, 36,3) |
Olasılık oranı (%95 GA) | 4,99 (2,93, 8,83) | |
2 taraflı p değeri | p<0,0001 | |
Araştırmacıya göre yanıt süresi | N=137 | N=31 |
Medyan (IQR), ay | 5,4 (2,8, 11,2) | 3,1 (2,4, 6,7) |
BICR=körleştirilmiş bağımsız merkezi inceleme; GA=güven aralığı; CMH=Cochran-Mantel-Haenszel; CR=tam yanıt; IQR=çeyrekler arası aralık; ITT=tedavi amaçlı; ORR=objektif yanıt oranı; OS=genel sağkalım; PARP=poli (adenozin difosfat riboz) polimeraz; PFS= progresyonsuz sağkalım; PR=kısmi yanıt; RECIST 1.1=Solid Tümörlerde Yanıt Değerlendirme Kriterleri versiyon 1.1.
* PFS, ORR ve yanıtın süresi, 15 Eylül 2017'deki veri kesim tarihine ve talazoparib kolunda 13,0 aylık (%95 GA: 11,1, 18,4) ve kemoterapi kolunda 7,2 aylık (%95 GA: 4,6, 11,1) bir medyan takibe dayalıdır. OS 30 Eylül 2019'daki veri kesim tarihine ve talazoparib kolunda 44,9 aylık (%95 GA: 37,9, 47,0) ve kemoterapi kolunda 36,8 aylık (%95 GA: 34,3, 43,0) bir medyan takibe dayalıdır.
Şekil 1. PFS Kaplan-Meier eğrileri â EMBRACA çalışması
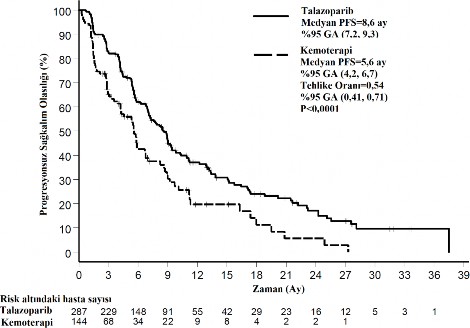
GA=güven aralığı; PFS=progresyonsuz sağkalım.
Prognostik faktörler ve başlangıç özellikleri temelinde tedavi etkisinin iç tutarlılığını araştırmak üzere önceden belirlenmiş alt grup PFS analizleri yapılmıştır. Genel sonuçlarla tutarlı şekilde her bir hasta alt grubunda, hastalık ilerlemesi veya ölüm riskinde azalmanın talazoparib kolu lehine olduğu gözlenmiştir (Şekil 2).
Şekil 2. Önemli alt gruplar için PFS analizlerinin meta-analiz diyagramı â EMBRACA
çalışması
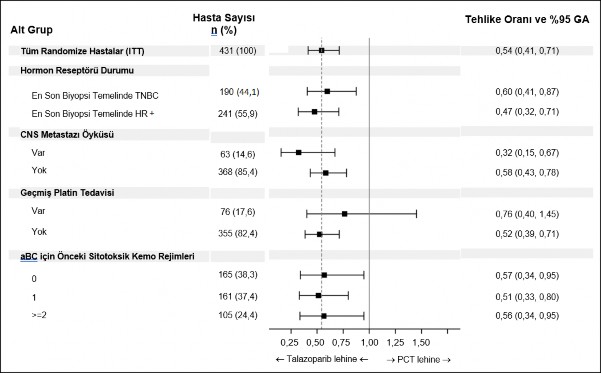
aBC=ileri evre meme kanseri; GA=güven aralığı; CNS=merkezi sinir sistemi; HR+=hormon reseptörü pozitif; ITT=tedavi amaçlı; PCT=doktorun seçtiği tedavi (kemoterapi); PFS=progresyonsuz sağkalım; TNBC=üçlü negatif meme kanseri.
Şekil 3. Toplam sağkalımın Kaplan-Meier eğrileri â EMBRACA çalışması
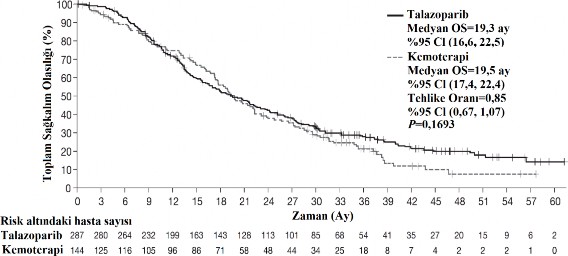
GA= güven aralığı, OS= genel sağkalım
Primer analiz p-değeri katmanlı bir log-sıra testine dayalıdır.
Pediatrik popülasyon
Avrupa İlaç Dairesi, meme kanseri için pediatrik popülasyonun tüm alt gruplarında talazoparib ile yapılmış çalışmaların sonuçlarını sunma yükümlülüğünden muaf tutmuştur (çocuklarda kullanımla ilgili bilgi için bkz. Bölüm 4.2).
5.2. Farmakokinetik özellikler
Genel özellikler
Emilim
Talazoparibin oral yoldan uygulanmasının ardından, Cdeğerine kadar olan medyan süre (T) genelde, doz uygulandıktan sonra 1 ila 2 saat arasında olmuştur. İnsanlarda mutlak biyoyararlanım çalışması yapılmamıştır. Ancak üriner boşaltım verileri esas alındığında mutlak biyoyararlanım en az %41 olup, emilen fraksiyon en az %69 olmuştur (bkz. Eliminasyon). Talazoparibin 1 ve 6,8 arasındaki tüm pH değerlerinde yeterince çözündüğü dikkate alındığında, asit azaltıcı maddelerin talazoparibe maruziyet üzerinde anlamlı etkisi olması beklenmemektedir. Pivotal çalışmadaki hastaların yüzde yirmi sekizi (%28), ağırlıklı olarak proton pompası inhibitörleri olmak üzere asit azaltıcı maddeler alıyordu.
Gıda etkisi
Gıda alımıyla emilim hızı düşmüştür ancak talazoparibin emilim derecesi azalmamıştır. Yüksek yağ, yüksek kalori içerikli gıdayla (yaklaşık 827 kalori, %57 yağ) birlikte tek bir oral talazoparib dozu alınmasının ardından, talazoparibin ortalama Cdeğeri yaklaşık %46 azalmıştır ve medyan Tdeğeri 1 ila 4 saat arasında gecikmiştir, EAAise etkilenmemiştir. Bu sonuçlara dayanılarak TALZENNA yemekle birlikte veya yemek olmadan alınabilir (bkz. bölüm 4.2).
Dağılım
Talazoparibin popülasyon ortalaması belirgin dağılım hacmi (V/F) 420 l olmuştur. İn vitro, talazoparib plazma konsantrasyonlarına yaklaşık %74 bağlanır, 0,01 µM ila 1 µM konsantrasyon aralığında konsantrasyon bağımlılığı yoktur. İnsan plazmasında in vivo olarak
bağlanmamış ilacın ortalama talazoparib oranı (fraksiyonu, f) ile böbrek fonksiyonu veya karaciğer fonksiyonunun kötüleşmesi arasında belirgin bir bağlantı olmadığından, böbrek veya karaciğer yetmezliği talazaporibin protein bağlanmasını etkilemiyor gibi gözükmektedir.
Biyotransformasyon
Talazoparib insanlarda karaciğer metabolizmasına minimum seviyede girer. İnsanlara oral yoldan tek doz 1 mg[C] talazoparib uygulandıktan sonra, plazmada dolaşımda büyük metabolitler saptanmamıştır ve dolaşımda olduğu belirlenen ilaç kaynaklı tek madde talazoparib olmuştur. Uygulanan dozun %10'undan fazlasını tek başına temsil eden hiçbir metabolit idrar veya feçeste geri kazanılmamıştır.
İn vitro, talazoparib klinik açıdan anlamlı konsantrasyonlarda, sitokrom (CYP)1A2, CYP2B6,
CYP2C8, CYP2C9, CYP2C19, CYP2D6 veya CYP3A4/5 inhibitörü ya da CYP1A2, CYP2B6
veya CYP3A4 indükleyici olmamıştır.
İn vitro, talazoparib başlıca bağırsak, karaciğer veya böbrek membran taşıyıcıların herhangi birini (P-gp, BCRP, organik anyon taşıyıcı polipeptit [OATP]1B1, OATP1B3, organik katyonik taşıyıcı [OCT]1, OCT2, organik anyon taşıyıcı [OAT]1, OAT3, safra tuzu atım pompası [BSEP], çoklu ilaç ve toksin ekstrüzyonu [MATE]1 ve MATE2-K) klinik açıdan anlamlı konsantrasyonlarda inhibe etmemiştir.
İn vitro, talazoparib majör üridin-difosfat glukuronosiltransferaz (UGT) izoformlarının herhangi birini (1A1, 1A4, 1A6, 1A9, 2B7 ve 2B15) klinik açıdan anlamlı konsantrasyonlarda inhibe etmemiştir.
Eliminasyon
İlacın değişmemiş olarak böbreklerden eliminasyonu (pasif filtreleme ve aktif salgılama), talazoparibin temel eliminasyon yolağıdır. Talazoparibin aktif böbrek salgılamasına P-gp muhtemelen dahil olur. Talazoparibin ortalama (±standart sapma) terminal plazma yarılanma ömrü 90 (±58) saat olmuştur ve kanser hastalarındaki popülasyon ortalaması (gönüllüler arası değişkenlik) belirgin oral klirens (CL/F) değeri 6,5 (%31) l/sa olmuştur. Tek bir oral [C] talazoparib dozu verilen 6 kadın hastada, uygulanan toplam radyoaktif dozun ortalama %69'u (±%8,6) ve %20'si (±%5,5) sırasıyla idrar ve feçeste geri kazanılmıştır. Değişmemiş talazoparibin idrarda atılımı, uygulanan dozun %55'ine tekabül ederek başlıca eliminasyon yolu olmuştur, feçeste geri kazanılan değişmemiş talazoparib ise %14 olarak görülmüştür.
Doğrusallık /Doğrusal Olmayan Durum:
Birden fazla doz günlük olarak uygulandıktan sonra talazoparib maruziyeti genelde dozla orantılı şekilde 0,025 mg ila 2 mg aralığında artmıştır. 1 mg talazoparibin hastalara tekrarlı olarak günlük dozda verilmesinin ardından, plazma konsantrasyonu-zaman eğrisi (EAA) altındaki geometrik ortalama (varyasyon katsayısı % [CV%]) alan ve kararlı durumdaki talazoparibin maksimum gözlenen plazma konsantrasyonu (C) sırasıyla 126 (107) ngâ¢sa/ml ila 208 (37) ngâ¢sa/ml aralığında ve 11 (90) ng/ml ila 19 (27) ng/ml aralığında olmuştur. Tekrarlı olarak günlük doz uygulandıktan sonra plazma talazoparib konsantrasyonları 2 ila 3 hafta içinde kararlı duruma ulaşmıştır. Tekrarlı olarak günde bir kez 1 mg oral yoldan uygulandıktan sonra talazoparibin medyan birikim oranı 2,3 ila 5,2 aralığında olmuştur. Talazoparib, P-gp ve BCRP taşıyıcılarının bir substratıdır.
Hastalardaki karakteristik özellikler:
Yaş, cinsiyet ve vücut ağırlığı
Kanserli 490 hastadan veriler kullanılarak, yaş (18 ila 88 yaş), cinsiyet (53 erkek ve 437 kadın) ve vücut ağırlığının (35,7 kg ila 162 kg) talazoparib PK'sı üzerindeki etkisini değerlendirmek
amacıyla bir popülasyon PK analizi yapılmıştır. Sonuçlar, yaş, cinsiyet ve vücut ağırlığının talazoparib PK'sı üzerinde klinik açıdan anlamlı etkisi olmadığını göstermiştir.
Irk
Asyalı 41 ve Asyalı olmayan 449 (361 Beyaz, 16 Siyah, 9 Diğer ve 63 Bildirilmemiş) hastadan oluşan toplam 490 hastanın yer aldığı bir popülasyon PK analizine dayanılarak, talazoparib CL/F değeri Asyalı hastalarda Asyalı olmayanlara kıyasla daha yüksek olmuş, Asyalı hastalarda %19 daha düşük maruziyet (EAA) elde edilmiştir.
Pediatrik popülasyon
Talazoparibin farmakokinetik özellikleri 18 yaş altı hastalarda değerlendirilmemiştir.
Böbrek yetmezliği
Farklı derecelerde böbrek yetmezliği olan ileri evre kanser hastalarında yapılan bir PK çalışmasının verileri, günde bir kez çoklu talazoparib dozunu takiben talazoparib toplam maruziyetinin (EAA) orta seviyede (eGFR 30 - < 60 mL/dk) ve şiddetli (eGFR < 30 mL /dk) böbrek yetmezliği olan hastalarda, böbrek fonksiyonu normal olan (eGFR ≥ 90 mL/dk) hastalara kıyasla sırasıyla %92 ve %169 arttığını göstermiştir. Talazoparib Cdeğeri, böbrek fonksiyonu normal olan hastalara kıyasla orta seviyede ve şiddetli böbrek yetmezliği olan hastalarda sırasıyla %90 ve %107 artmıştır. Talazoparib maruziyeti, hafif böbrek yetmezliği (eGFR 60 - <90 mL/dak) olan hastalar ve normal böbrek fonksiyonuna sahip olan hastalar için benzerdir. Ek olarak, hafif böbrek yetmezliği olan 132 hasta (60 ml/dk ≤ CrCL < 90 ml/dk), orta seviyede böbrek yetmezliği olan 33 hasta (30 ml/dk ≤ CrCL < 60 ml/dk) ve şiddetli böbrek yetmezliği olan 1 hastayı (CrCL < 30 ml/dk) içeren 490 hastadan oluşan bir popülasyon PK analizine dayanılarak, talazoparib CL/F değeri, hafif ve orta seviyede böbrek yetmezliği olan hastalarda, böbrek fonksiyonu normal olan hastalara (CrCL ≥ 90 ml/dk) kıyasla sırasıyla %14 ve %37 azalmıştır ve bu da EAA'da %17 ve %59 artışa karşılık gelir. Talazoparib PK'sı, hemodiyalize ihtiyacı olan hastalarda araştırılmamıştır (bkz. bölüm 4.2).
Karaciğer yetmezliği
Hafif karaciğer yetmezliği olan 118 hastayı da içeren (toplam bilirubin ≤1,0ÃULN ve AST>ULN veya toplam bilirubin >1,0 ila 1,5ÃULN ve herhangi bir AST) 490 hasta üzerinde yapılan bir PK analizine dayanılarak, hafif karaciğer yetmezliğinin talazoparib PK'sı üzerinde etkisi yoktur. Talazoparib PK'sı, karaciğer fonksiyonu normal olan hastalarda, hafif karaciğer yetmezliği, orta karaciğer yetmezliği (toplam bilirubin >1,5 ila 3,0 Ã ULN ve herhangi bir AST) veya şiddetli karaciğer yetmezliği (toplam bilirubin >3,0 Ã ULN ve herhangi bir AST) olan hastalarda bir PK deneyinde araştırılmıştır. Bu PK deneyinden elde edilen verilerin kullanıldığı popülasyon PK analizleri, hafif, orta veya şiddetli karaciğer yetmezliğinin talazoparibin PK'sı üzerinde anlamlı bir etkisi olmadığını göstermiştir (bkz. bölüm 4.2).
5.3. Klinik öncesi güvenlilik verileri
Karsinojenisite
Talazoparible karsinojenisite çalışması yapılmamıştır.
Genotoksisite
Talazoparib, bakteriyel ters mutasyon (Ames) testinde mutajenik bulunmamıştır. Talazoparib, bir in vitro kromozom sapması tayininde insan periferik kan lenfositlerinde ve bir in vivo mikronükleus tayininde sıçanlarda, klinik açıdan anlamlı dozlara benzer maruziyetlerde klastojenik olmuştur. Bu klastojenisite, talazoparibin primer farmakolojisinden kaynaklanan genomik instabiliteyle tutarlıdır ve insanlarda genotoksisite potansiyelini işaret eder.
Tekrarlı doz toksisitesi
Sıçanlar ve köpekler üzerinde yapılan tekrarlı doz toksisite çalışmalarında, subterapötik maruziyetlerdeki başlıca bulgular, hematopoietik hücrelerde doza bağlı azalmayla kemik iliği hiposelülaritesini, birden fazla organda lenfoid dokuların deplesyonunu ve atrofiyi ve/veya testislerde, epididimde ve seminifer tübüllerde dejeneratif değişiklikleri içermiştir. Daha yüksek maruziyetlerdeki ilave bulgular, gastrointestinal (GI) kanalda, karaciğerde ve yumurtalıkta apoptoz/nekrozdaki doza bağlı artışı içermiştir. Histopatolojik bulguların çoğu genelde tersine çevrilebilir olmuş, testis bulguları ise doz kesildikten 4 hafta sonra kısmen tersine çevrilebilir olmuştur. Bu toksisite bulguları, talazoparibin farmakolojisiyle ve doku dağılım paterniyle tutarlıdır.
Gelişim toksikolojisi
Sıçanlar üzerinde yapılan bir embriyo-fetal gelişimi çalışmasında talazoparib, önerilen dozda insanlardaki maruziyetin yaklaşık 0,09 katı maternal sistemik EAAmaruziyetinde, embriyo-fetal ölüme, fetüs malformasyonuna (basık göz şişliği, küçük göz, ayrık sternebra, kaynaşık servikal omurga) ve kemiklerde yapısal değişkenliklere yol açmıştır.
 Ağız Kanseri
Ağız kanserinin en yaygın türleri, dudak, dil, dişetidir. Nadiren
yanak içi veya damak bölgelerini de içine alır.
Ağız Kanseri
Ağız kanserinin en yaygın türleri, dudak, dil, dişetidir. Nadiren
yanak içi veya damak bölgelerini de içine alır. |
 HIV ve Aids
HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan
Virüsdür). Bu virüs AIDS hastalığına sebep olur.
HIV ve Aids
HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan
Virüsdür). Bu virüs AIDS hastalığına sebep olur. |
İLAÇ GENEL BİLGİLERİ
Pfizer İlaçları Ltd.Şti.
| Satış Fiyatı | 78004.47 TL [ 17 May 2024 ] |
| Önceki Satış Fiyatı | 78004.47 TL [ 10 May 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Kısıtlanmış Beyaz Reçeteli bir ilaçdır. |
| Barkodu | 8681308151100 |
| Etkin Madde | Talazoparib Tosilat |
| ATC Kodu | L01XK04 |
| Birim Miktar | 1 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 30 |
| Antineoplastik ve İmmünomodülatör Ajanlar > Diğer Kanser İlaçları |
| İthal ( ref. ülke : Fransa ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
İnme İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına yol açar. |
 |
Deri Kanseri Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör. |
 |
Dış Gebelik Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur. |