NUVARING 11.7 mg/2.7 mg vaginal ilaç tasıyıcı sistem Klinik Özellikler
{ Etinilestradiol + Etonogestrel }
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Kontrasepsiyon.
NUVARING doğurganlık çağındaki kadınlara yöneliktir. Güvenlilik ve etkililiği 18 - 40 yaş arası kadınlarda belirlenmiştir.
NUVARING reçetelenme kararında kadının mevcut risk faktörleri, özellikle venöz tromboembolizm (VTE) için risk faktörleri ve NUVARING kullanımıyla VTE riskinin diğer kombine hormonal kontraseptiflerle (KHK) karşılaştırması göz önünde bulundurulmalıdır (bkz. bölüm 4.3 ve 4.4).
4.2. Pozoloji ve uygulama şekli
Pozoloji:Başarılı bir kontraseptif etkinlik için NUVARING, tarif edildiği şekilde kullanılmalıdır (bkz.
âNUVARING nasıl kullanılır' ve âNUVARING kullanmaya nasıl başlamalı').
Uygulama sıklığı ve süresi:
NUVARING kullanmaya nasıl başlamalı
Önceki siklusta hormonal kontraseptif kullanılmadığında:
NUVARING menstrüasyonun ilk gününde yerleştirilmelidir (örn. menstrüel kanamanın ilk gününde). Etki 2-5. günlerde başlar, ancak NUVARING kullanımının ilk 7 günü sırasında ek olarak prezervatif gibi bir bariyer yöntemi kullanımı önerilmektedir.
Bir kombine hormonal kontraseptiften geçiş yapmak:
Kadın NUVARING'i en geç daha önce kullandığı kombine hormonal kontraseptifin, olağan tabletsiz, flastersiz ya da plasebo tabletli dönemi sonrasındaki gün yerleştirmelidir.
Eğer kadın önceki metodunu sürekli ve doğru olarak kullanıyorsa ve gebe olmadığı kesin ise, döngünün herhangi bir gününde önceki kombine hormonal kontraseptiften geçiş yapabilir.
Sadece progestogen yönteminden (minipil, implant veya enjeksiyon) veya bir progestogen- salgılayan intrauterin sisteminden (IUS) geçiş yapmak:
Kadın minipil'den herhangi bir günde (implanttan veya hormon içeren rahim içi araç çıkarıldığı gün, enjeksiyon yönteminde bir sonraki enjeksiyonun uygulanma tarihinde) geçiş yapabilir fakat bu olguların tamamında NUVARING kullanımının ilk 7 günü boyunca ek bir bariyer yöntemi kullanmalıdır.
İlk trimester düşüğü sonrasında:
Kadın derhal kullanmaya başlayabilir. Böylece, ek kontraseptif önlem alma gereği ortadan kalkar. Eğer hemen ardından bir uygulama istenmiyorsa, âönceki siklusta hormonal kontraseptif kullanılmadığında' başlığı altında bildirilmiş tavsiyeler dikkate alınmalıdır (ya da izlenmelidir). Bu sırada, alternatif bir kontrasepsiyon yöntemi kullanılması önerilir.
Doğum ya da ikinci trimester düşüğü sonrasında:
Emziren kadın için bölüm 4.6.'ya bakınız.
Kadınlara doğum ya da ikinci trimester düşüğünü izleyen dördüncü hafta sırasında kullanıma başlamaları önerilmelidir. Daha geç başlangıç yapan kadınlara NUVARING kullanımının ilk 7 gününde ek bir bariyer yöntemi kullanmaları önerilmelidir. Bununla birlikte, öncesinde cinsel ilişki gerçekleşmişse, NUVARING kullanmaya başlamadan önce hamilelik dışlanmalı ya da kadın ilk adet dönemine kadar beklemelidir.
Önerilen rejimden sapmalar
Kadın önerilen rejime uymaz ise, kontraseptif etkinlik ve siklus kontrolü bozulabilir. Bir sapma durumunda kontraseptif etkililik kaybını önlemek amacıyla şunlar önerilebilir:
Halkasız dönemin uzamış olması durumunda ne yapılmalı
Kadın anımsadıktan sonra derhal yeni bir halka yerleştirmelidir. Yerleştirmeyi izleyen 7 gün boyunca prezervatif gibi ek bir bariyer yöntemi kullanılmalıdır. Halkasız dönemde bir cinsel ilişki gerçekleşmiş ise, hamilelik olasılığı düşünülmelidir. Halkasız dönemin uzunluğu arttıkça hamilelik riski artacaktır.
Halka geçici olarak vajina dışına çıkmış ise ne yapılmalı
NUVARING 3 haftalık bir kesintisiz dönem boyunca vajina içinde bırakılmalıdır. Eğer halka yanlışlıkla çıkarılmış ise soğuk ya da ılık (sıcak değil) sıcaklıktaki su ile çalkalanarak derhal yeniden yerleştirilmelidir.
Eğer NUVARING vajinanın dışında 3 saatten kısa bir süre boyunca kalmış ise kontraseptif etkililikte bir azalma olmaz. Kadın mümkün olan en kısa sürede, ancak en geç 3 saat içinde halkayı yeniden yerleştirmelidir.
Eğer kullanımın 1. ya da 2. haftalarında NUVARING 3 saati aşan bir süre vajina dışında kaldıysa ya da bundan şüpheleniliyorsa kontraseptif etkililikte azalma olabilir. Kadın anımsamasını takiben halkayı derhal geri yerleştirmelidir. NUVARING vajina içinde kesintisiz 7 gün bulunma süresini tamamlayana kadar, ek olarak prezervatif gibi bir bariyer yöntemi kullanılmalıdır. NUVARING'in vajina dışında kalma süresi ne kadar uzunsa ve bu durum halkasız döneme ne kadar yakınsa, gebelik riski o kadar yüksektir.
Eğer 3 haftalık kullanım periyodunun 3. haftasında NUVARING 3 saati aşan bir süre vajina dışında kaldıysa ya da bundan şüpheleniliyorsa kontraseptif etkinlikte azalma olabilir. Kadın halkayı çıkarmalı ve aşağıdaki iki seçenekten birini seçmelidir:
Hemen yeni bir halka yerleştirilmelidir.
Not: Yerleştirilen yeni halka ile sonraki üç haftalık kullanım periyodu başlayacaktır. Kadın önceki siklusundan geri çekilme kanaması yaşamayabilir. Ancak ani kanama ve lekelenme meydana gelebilir.
Çekilme kanaması gerçekleştikten sonra ve önceki halkanın çıkarılmasından veya atılmasından sonra 7 gün geçmeden (7x24 saat) bir yeni halka yerleştirilmelidir.
4.3. Kontrendikasyonlar
KHK aşağıda belirtilen koşullarda kullanılmamalıdır. NUVARING kullanımı sırasında bu koşulların herhangi biri ilk kez ortaya çıktığında halka derhal çıkartılmalıdır.
NUVARING aktif bileşenlerine ya da 6.1 bölümünde listelenen herhangi bir yardımcı maddeye aşırı duyarlılık,
Venöz tromboembolizm (VTE) varlığı ya da riski,
Venöz tromboembolizm â mevcut VTE (antikoagülan kullanırken) veya VTE öyküsü (örn. derin ven trombozu [DVT] veya pulmoner embolizm [PE])
Aktive protein C (APC) direnci, antitrombin III eksikliği, protein C eksikliği, protein S eksikliği, gibi venöz tromboembolizm için bilinen kalıtsal veya edinilmiş predispozisyon
4.4. Özel kullanım uyarıları ve önlemleri
Aşağıda belirtilen durumlar ya da risk faktörlerinden herhangi birinin varlığında, NUVARING'in uygunluğu kadın ile tartışılmalıdır. Bu durumlar ya da risk faktörlerinin herhangi birinde ağırlaşma ya da ilk kez ortaya çıkma söz konusu olduğunda kadının NUVARING kullanımının durdurulup durdurulmayacağına karar vermek için hekimi ile temasa geçmesi tavsiye edilmelidir.
Dolaşım bozuklukları
Venöz tromboembolizm (VTE) riski
Herhangi bir kombine hormonal kontraseptifin (KHK) kullanımı hiç kullanım olmamasına kıyasla venöz tromboembolizm (derin ven trombozu ve pulmoner embolizm) riskini artırır. Levonorgestrel, norgestimat veya noretisteron en düşük VTE riskiyle ilişkilendirilmiştir. NUVARING gibi diğer ürünlerde risk seviyesi bunun iki katına kadar olabilir. En düşük VTE riski olan ürün dışında herhangi bir ürünün kullanılmasına, NUVARING'le VTE riski, mevcut risk faktörlerinin riski nasıl etkilediği ve kullanımın ilk yılında VTE riskinin en fazla olduğu kadınla konuşulduktan sonra karar verilmelidir. Buna ek olarak, 4 hafta veya daha uzun süre KHK kullanımından sonra ara verilip tekrar başlandığında, riskin arttığına dair bulgular vardır.
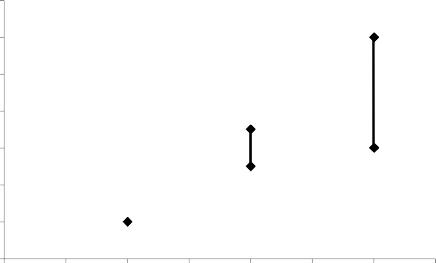
KHK kullanmayan veya hamile olmayan kadınlarda, bir yıl içinde 10.000 kadından 2'sinde VTE gerçekleşir. Ancak, bir kadındaki kişisel risk, altta yatan risk faktörlerine (bkz. aşağıdaki bölüm) bağlı olarak, çok daha yüksek olabilir.
Levonorgestrel içeren düşük doz KHK kullanan 10.000 kadından yaklaşık 6'sında bir yıl içerisinde VTE gelişeceği tahmin edilmektedir. NUVARING'le levonorgestrel içeren KHK'lerin karşılaştırılmasında VTE riskiyle ilgili tutarsız sonuçlar elde edilmiştir (görece risk tahminleri hiç artış olmamasından [risk oranı, RO=0,96], neredeyse iki katı risk artışına [RO=1,90] kadar değişkendir). Bu, bir yılda NUVARING kullanan 10.000 kadından 6 ila 12'sinde VTE'ye karşılık gelmektedir.
Her iki durumda da bir yıldaki VTE sayısı, hamile olan veya postpartum dönemdeki kadınlarda beklenen sayıdan daha düşüktür.
Vakaların %1 ila 2'sinde VTE ölümcül olabilir.
Bir yılda 10.000 kadında VTE olaylarının sayısı
14
12
10
8
6
4
2
0
KHK kullanıcılarında hepatik, mezenterik, renal ya da retinal venler ve arterler gibi diğer kan damarlarında son derece seyrek olarak tromboz bildirilmiştir.
VTE için risk faktörleri
KHK kullanan, ilave risk faktörleri olan bir kadında, özellikle birden fazla risk faktörü varsa (bkz. aşağıdaki tablo) venöz tromboembolik komplikasyon riski büyük oranda artabilir.
Birden fazla risk faktörü nedeniyle yüksek venöz tromboz riski olan kadınlarda NUVARING kontrendikedir (bkz. bölüm 4.3). Bir kadında birden fazla risk faktörü varsa, risk artışı, faktörlerin teker teker risk toplamından daha yüksek olabilir â bu durumda kadının toplam VTE riski değerlendirilmelidir. Risk yarar dengesi negatif olarak değerlendiriliyorsa, KHK reçetelenmemelidir (bkz. bölüm 4.3).
Tablo: VTE için risk faktörleri
Risk faktörü | Yorum |
Obezite (vücut kitle indeksi [VKİ] 30 kg/m'nin üzerinde) | VKİ arttıkça risk büyük oranda artar. Özellikle diğer risk faktörleri de mevcutsa özellikle göz önünde bulundurulması önemlidir. |
Uzun süreli hareketsiz kalma, majör cerrahi, bacak veya pelvise yapılan herhangi bir cerrahi müdahale, nöroşirürji veya majör travma. Not: Özellikle diğer risk faktörleri de mevcutsa, 4 saatten uzun havayolu seyahati dahil geçici hareketsiz kalma, VTE için bir risk faktörü olabilir. | Bu durumlarda bant/tablet/halkanın bırakılması (elektif cerrahi durumunda en azından 4 hafta önceden bırakılması) ve tekrar hareketlilik sağlandıktan 2 hafta sonrasına kadar başlanmaması tavsiye edilir. İstenmeyen gebeliği engellemek için başka bir doğum kontrol yöntemi kullanılmalıdır. NUVARING önceden bırakılmadıysa antitrombotik tedavi düşünülmelidir. |
Pozitif aile öyküsü (kardeş veya ebeveynlerde venöz tromboembolizm, özellikle 50 yaş öncesi gibi erken yaşlarda) | Kalıtsal predispozisyondan şüpheleniliyorsa, KHK kullanımına karar vermeden önce kadın bir uzmana yönlendirilmelidir. |
VTE ile ilişkili diğer tıbbi durumlar | Kanser, sistemik lupus eritematozus, hemolitik üremik sendrom, kronik inflamatuar barsak hastalığı (Crohn hastalığı veya ülseratif kolit) ve orak hücre anemisi |
Artan yaş | Özellikle 35 yaş üzeri |
Venöz trombozun başlangıcı veya progresyonunda varikoz venlerin veya süperfisyal tromboflebitin olası rolü hakkında fikir birliği yoktur.
Hamilelik sırasında, özellikle doğum sonrası 6 haftalık dönemde, artmış tromboembolizm riski göz önünde bulundurulmalıdır (gebelik ve laktasyon bilgileri için bkz. bölüm 4.6).
VTE'nin semptomları (derin ven trombozu ve pulmoner emboli)
Kadınlara semptomlar görüldüğü takdirde acil tıbbi yardıma başvurmaları ve ilgili sağlık çalışanına KHK kullandıklarını belirtmeleri gerektiği söylenmelidir.
Derin ven trombozunun (DVT) semptomları aşağıdakileri içerir;
her iki bacak ve/veya ayakta ya da bacakta bir vende şişme;
bacakta, yalnızca ayağa kalkarken veya yürürken hissedilebilen ağrı veya hassasiyet;
Diğer durumlar
Hipertrigliseridemisi ya da bu hastalıkla ilgili aile öyküsü bulunan kadınlar, hormonal kontraseptif kullandıklarında yüksek pankreatit riski altında olabilir.
Hormonal kontraseptif kullanan kadınların kan basınçlarında küçük artışlar bildirilmiş olmasına karşın, klinik olarak önemli artışlar seyrektir. Hormonal kontraseptif kullanımı ve klinik hipertansiyon arasında kesin bir ilişki kanıtlanmış değildir. Bununla birlikte, NUVARING kullanımı sırasında sürekli ve klinik olarak anlamlı bir hipertansiyon gelişirse, hekimin halka kullanımını bir süre durdurması ve hipertansiyonu tedavi etmesi doğru olacaktır. Antihipertansif tedavi ile normotansif değerler elde edilirse, uygun görülen durumlarda NUVARING kullanımına yeniden başlanabilir.
Gerek hamilelik gerekse hormonal kontraseptif kullanımı sırasında aşağıdaki durumlara ilişkin belirti ya da kötüleşme bildirilmiş olmakla birlikte kullanımı ile ilişkinin kanıtı kesin değildir: kolestaza bağlı sarılık ve/veya pruritus, safra taşı oluşumu, porfiri, sistemik lupus eritematozus, hemolitik üremik sendrom, Sydenham koresi, herpes gestasyonis, otosklerozla ilişkili işitme kaybı.
Eksojen östrojenler, kalıtsal ve edinilmiş anjiyoödem belirtilerini indükleyebilir ya da şiddetlendirebilir.
Akut ya da kronik karaciğer bozukluklarında karaciğer fonksiyonları belirteçleri normale dönene kadar NUVARING kullanımına ara verilmesi gerekebilir. İlk olarak hamilelik ya da daha önceki seks steroidi kullanımları sırasında ortaya çıkmış olan kolestatik sarılık ve/veya kolestaz ile ilişkili pruritin tekrarlaması halka kullanımının bırakılmasını gerektirir.
Östrojen ve progesteronların periferik insülin direnci ve glukoz toleransı üzerine bir etkisi olabilse de, hormonal kontraseptif kullanan diabetiklerde terapötik rejim değişikliği gereğine işaret eden bir kanıt bulunmamaktadır. Bununla birlikte, NUVARING kullanan diabetik kadınlar özellikle ilk kullanım aylarında dikkatle izlenmelidir.
Crohn hastalığında ve ülseratif kolitte, hormonal kontraseptif kullanımı ile ilişkili yeniden ortaya çıkma veya kötüleşme bildirilmiştir. Ancak hormonal kontraseptif kullanımı ile ilişkisine dair kanıt yetersizdir.
Özellikle kloazma gravidarum öyküsü bulunan kadınlarda nadir olarak kloazma oluşabilir. Kloazmaya eğilimli kadınlar NUVARING kullanımı sırasında güneş ya da ultraviyole ışınlarına maruz kalmaktan kaçınmalıdır.
Aşağıdaki durumlardan herhangi biri bulunan kadınlar NUVARING'i doğru olarak yerleştirmede başarılı olmayabilir ya da halkayı kaybedebilirler: uterus boynu prolapsusu, sistosel ve/veya rektosel, ciddi ya da kronik konstipasyon.
Çok nadir olarak, NUVARING'in üretraya ve mesane çıkışına yanlışlıkla yerleştirildiği bildirilmiştir. Sistit semptomları karşısında ayırıcı tanıya gidilirken, bu nedenle halkanın yanlış yere yerleştirilmiş olma olasılığı üzerinde durulmalıdır.
NUVARING kullanımı sırasında kadınlar, çok seyrek olarak vajinit yaşayabilirler. Ne NUVARING etkinliğininvajinittedavisindenetkilendiğine de NUVARING kullanımının
Çok nadir olarak halkanın vajina dokusuna yapıştığı ve sağlık görevlisi tarafından çıkarılmasının gerektiği bildirilmiştir. Dokunun halkanın üzerinde büyüdüğü bazı durumlarda, üstteki vajinal dokuyu kesmeden halkayı keserek çıkarma gerçekleştirilmiştir.
Depresif ruh hali ve depresyon, hormonal kontraseptif kullanımın iyi bilinen istenmeyen yan etkilerindendir (bkz. bölüm 4.8). Depresyon ciddi olabilir ve intihar girişimi ve intihar için iyi bilinen bir risk faktörüdür. Kadınların, tedaviye başladıktan kısa bir süre sonra da dahil olmak üzere, duygudurum değişiklikleri ve depresif belirtiler olması durumunda doktorlarına başvurmaları önerilir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Not: Potansiyel etkileşimleri tanımlamak için eş zamanlı ilaçların reçetelenme bilgisine başvurulmalıdır.
Diğer tıbbi ürünlerin NUVARING üzerindeki etkileri
Mikrozomal enzimleri uyararak seks hormonlarının klerensinde artışa ve kanama ve/veya kontraseptif başarısızlığa yol açabilen ilaçlar veya bitkisel ürünler ile etkileşimler ortaya çıkabilir.
İdame
Enzim indüksiyonu birkaç gün tedaviden sonra gözlemlenebilir. Maksimum enzim indüksiyonu genellikle birkaç hafta içinde görülür. İlaç tedavisinin kesilmesinden sonra, yaklaşık 4 hafta boyunca enzim indüksiyonu devam edebilir.
Kısa süreli tedavi
Enzim uyaran ilaçlar veya bitkisel ürünlerle tedavi gören kadınlar, NUVARING'in yanı sıra bir bariyer yöntemini veya başka bir kontrasepsiyon yöntemini geçici olarak kullanmalıdır. Not: NUVARING bir diyafram, servikal başlık veya kadın kondomu ile kullanılmamalıdır. Bariyer yöntemi, eşzamanlı ilaç tedavisi boyunca ve ilacın kesilmesinde 28 gün sonrasına kadar kullanılmalıdır. Eş zamanlı ilaç uygulamasının 3 haftalık bir halka siklusunu aşması durumunda, olağan halkasız dönem atlanarak derhal bir sonraki halka yerleştirilmelidir.
Uzun süreli tedavi
Kadınlarda karaciğer enzim indükleyici aktif maddeler ile uzun süreli tedavide, başka bir güvenilir, hormonal olmayan doğum kontrol yöntemi önerilmektedir.
Literatürde aşağıdaki etkileşimler bildirilmiştir.
Kombine hormonal kontraseptiflerin klirensini arttıran maddeler
Seks hormonlarının plazma konsantrasyonlarını azaltarak klirens artışına sebep olan mikrozomal enzimleri, özellikle sitokrom P450 enzimini (CYP), indükleyen ilaçlarla veya bitkisel ürünlerle etkileşimler ortaya çıkabilir ve NUVARING dahil olmak üzere kombine hormonal kontraseptiflerin etkinliğini azaltabilir. Bu ürünler fenitoin, fenobarbital, pirimidon, bosentan, karbamazepin, rifampisin ve muhtemelen okskarbazepin, topiramat, felbamat, griseofulvin, bazı HIV proteaz inhibitörleri (ritonavir gibi) ve non-nükleosit revers transkriptaz inhibitörleri (örn., efavirenz), ve bitkisel St. John's wort içeren ürünlerdir.
Kombine hormonal kontraseptiflerin klirensinde değişken etkileri olan maddeler
Hormonal kontraseptifler, HIV proteaz inhibitörleri (örn., Nelfinavir) ve non-nükleosit revers transkriptaz inhibitörlerinin (örn., Nevirapin) birçok kombinasyonu ve / veya Hepatit C virüsü (HCV) tıbbi ürünleri ile kombinasyonları (örn., Boceprevir, telaprevir) birlikte uygulandığında, etonogestrel veya östrojen dahil olmak üzere progestojenlerin plazma konsantrasyonlarını artırabilir veya azaltabilir. Bu değişikliklerin net etkisi, bazı vakalarda klinik olarak ilişkili olabilir.
Kombine hormonal kontraseptiflerin klirensini azaltan durumlar
Enzim inhibitörleri ile potansiyel etkileşimlerin klinik ilişkisi bilinmemektedir. Eş zamanlı olarak güçlü (ör. ketokonazol, itrakonazol, klaritromisin) veya orta (örn., flukonazol, diltiazem, eritromisin) CYP3A4 inhibitörleri, etonogestrel dahil olmak üzere, östrojenler veya progestojenlerin serum konsantrasyonlarını arttırabilir.
Antimikotik, antibiyotik ve kayganlaştırıcı ürünler de dahil olmak üzere intravajinal preparatların eş zamanlı kullanımı sırasında halka kopması bildirilmiştir (bkz. Bbölüm 4.4. âKopan Halkalar'). Farmakokinetik verileri esas aldığımızda, vajinal yoldan uygulanan antimikotikler ve spermisidlerin NUVARING'in kontraseptif etkililiği ve güvenliliği etkileme olasılığı bulunmamaktadır.
Hormonal kontraseptifler diğer ilaçların metabolizması ile etkileşebilir. Buna göre, plazma ve doku konsantrasyonları hem artabilir (örn. siklosporin) hem de azalabilir (örn. lamotrigin).
Farmakodinamik etkileşimler
Ribavirin veya glekaprevir / pibrentasvir içeren veya içermeyen ombitasvir / paritaprevir / ritonavir ve dasabuvir içeren tıbbi ürünlerle eş zamanlı kullanım, ALT yükselme riskini artırabilir (bkz. bölüm 4.3 ve 4.4). Bu nedenle, NUVARING kullanıcıları, bu kombinasyon ilaç rejimiyle tedaviye başlamadan önce alternatif bir kontrasepsiyon yöntemine (örn., sadece progestojen kontrasepsiyon veya hormonal olmayan yöntemler) geçmelidir. NUVARING, bu kombinasyon ilaç tedavisi ile tedavinin tamamlanmasından 2 hafta sonra yeniden başlatılabilir.
Laboratuvar testleri:
Kontraseptif steroidlerin kullanımı; karaciğer, tiroid, adrenal ve böbrek fonksiyonunun biyokimyasal parametreleri, taşıyıcı proteinlerin (örn. kortikosteroid bağlayan globulin ve seks hormonu bağlayan globulin) plazma düzeyleri, lipid/lipoprotein fraksiyonları, karbonhidrat metabolizması parametreleri ve koagülasyon ve fibrinoliz parametreleri dahil belirli laboratuvar sonuçlarını etkileyebilmektedir. Değişimler genellikle normal laboratuvar aralıkları içinde kalmaktadır.
Tamponlarla etkileşim:
Farmakokinetik verilere göre, tamponların kullanımının, NUVARING tarafından salınan hormonların sistemik emilimi üzerinde hiçbir etkisi yoktur. Nadir durumlarda NUVARING tampon çıkarılırken çıkarılabilir (bkz. öneri için âHalka geçici olarak vajina dışına çıkmış ise ne yapılmalı').
Özel popülasyonlara ilişkin ek bilgiler Pediyatrik popülasyon:
Pediyatrik popülasyon ve özel popülasyonlarla ilgili herhangi bir etkileşim çalışması yoktur.
Geriyatrik popülasyon:
NUVARING, fertil kadınların kullanımında endikedir. Geriyatrik popülasyonda herhangi bir güvenlilik veya etkililik çalışması yapılmamıştır.
4.6. Gebelik ve laktasyon
Gebelik kategorisi X'dir.
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Bu tıbbi ürünün endikasyonu kontrasepsiyon olduğu için, bu başlık geçerli değildir.
Gebelik dönemi
NUVARING hamilelik sırasında kontrendikedir.
Eğer hamilelik NUVARING doğal yerindeyken gerçekleşirse, halka yerinden çıkartılmalıdır. Yaygın epidemiyolojik çalışmalar, hamilelik öncesinde KOK kullanmış kadınların doğurduğu çocuklarda doğum kusuru riski artışı ve KOK'lar erken hamilelik sırasında yanlışlıkla kullanıldığında bir teratojenik etki ortaya koymamıştır.
Az sayıda kadının dahil olduğu bir klinik çalışma sonucuna göre, intravajinal uygulama dolayısıyla, NUVARING'deki kontraseptif steroidlerin intrauterin konsantrasyonları KOK kullanıcılarında gözlenen seviyeler ile benzerdir (bkz. bölüm 5.2). NUVARING'e maruz kalmış hamileliklerin klinik sonuçları bildirilmemiştir.
Doğum sonrası dönemde NUVARING kullanımına tekrar başlanırken VTE riskinin artışı göz önünde bulundurulmalıdır (bkz. bölüm 4.2 ve 4.4).
Laktasyon dönemi
Emzirme, anne sütünün miktarını azaltabilen ve bileşimini değiştirebilen östrojenlerden etkilenebilmektedir. Bu nedenle, çocuk sütten tamamen kesilene kadar geçen sürede NUVARING kullanımı genellikle önerilmemelidir. Küçük miktarlarda kontraseptif steroidler ve/veya metabolitleri süt ile atılabilmektedir ancak bunun bebeğin sağlığını olumsuz etkilediğine ilişkin bir kanıt bulunmamaktadır.
Üreme yeteneği/Fertilite
NUVARING gebelikten korunmak için endikedir. Kadın, gebe kalmak istediği için NUVARING'i kullanmayı bırakırsa, gebe kalmaya çalışmadan önce doğal adet dönemine kadar beklemesi tavsiye edilmelidir; bu durum, bebeğin ne zaman doğacağının hesaplanmasına yardımcı olacaktır.
4.7. Araç ve makine kullanımı üzerindeki etkiler
Farmakodinamik profilin temelinde, NUVARING'in araç ve makine kullanımı üzerinde beklenen herhangi bir etkisi yoktur veya etkisi göz ardı edilebilir derecede önemsizdir.
4.8. İstenmeyen etkiler
NUVARING'le yapılan klinik çalışmalarda en sık rapor edilen istenmeyen etkiler baş ağrısı, vajinal enfeksiyon ve vajinal akıntı olmuştur; bunların hepsi kadınların %5 ila 6'sında rapor edilmiştir.
Seçilmiş advers reaksyionların tanımı
KHK kullanan kadınlarda, miyokard infarktüsü, inme, geçici iskemik atak, venöz tromboz ve pulmoner emboli dahil, arteriyel ve venöz trombotik ve tromboembolik olay riskinde artış gözlenmiştir; bölüm 4.4'te daha detaylı olarak bunlardan bahsedilmektedir.
KHK kullanan kadınlarda diğer yan etkiler de rapor edilmiştir; bölüm 4.4'te daha detaylı olarak bunlardan bahsedilmektedir.
NUVARING kullanıcılarında bildirilmiş olan advers ilaç reaksiyonlarının listesi, aşağıda verilmektedir.
Sıklıklar şu şekilde tanımlanmıştır:
Çok yaygın (≥ 1/10), yaygın (≥ 1/100 ila ≤ 1/10), yaygın olmayan (≥ 1/1,000 ila ≤1/100), seyrek (≥ 1/10.000 ila ≤ 1/1.000), çok seyrek (≤ 1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Enfeksiyonlar ve enfestasyonlar
Yaygın: Vajinal enfeksiyon
Yaygın olmayan: Servisit, sistit, üriner sistem enfeksiyonu
Bağışıklık sistemi hastalıkları
Bilinmiyor: Kalıtsal ve edinilmiş anjiyoödem semptomlarının şiddetlenmesini ve
anafilaksiyi içeren hipersensitivite reaksiyonları
Metabolizma ve beslenme hastalıkları
Yaygın olmayan: Artan iştah
Psikiyatrik hastalıklar
Yaygın: Depresyon, azalan libido
Yaygın olmayan: Tepkide değişiklik, ruh hali değişimi, ruh hali dalgalanması
Sinir sistemi hastalıkları
Yaygın: Baş ağrısı, migren
Yaygın olmayan: Baş dönmesi, hipoestezi
Göz hastalıkları
Yaygın olmayan: Görme bozukluğu
Vasküler hastalıklar
Yaygın olmayan: Sıcak basması
Seyrek: Venöztromboemb olizm,arteriyeltrombo embolizm
Gastrointestinal hastalıklar
Yaygın: Karın ağrısı, bulantı
Yaygın olmayan: Abdominal distansiyon, diyare, kusma, konstipasyon
Deri ve deri altı doku hastalıkları
Yaygın: Akne
Yaygın olmayan: Saç dökülmesi, egzema, kaşıntı, döküntü, ürtiker Bilinmiyor: Kloazma
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları
Yaygın olmayan: Sırt ağrısı, kas spazmları, ekstremitelerde ağrı
Böbrek ve idrar hastalıkları
Yaygın olmayan: Disüri, acil idrara çıkma hissi, pollaküri
Üreme sistemi ve meme hastalıkları
Yaygın: Memede hassasiyet, genital kaşıntı, dismenore, pelvik ağrı, vajinal akıntı Yaygın olmayan: Amenore, meme ağrısı, meme büyümesi, memede kitle, servikal polip,
koital kanama, disparoni, serviksin ektropiyonu, fibrokistik meme hastalığı, menoraji, metroraji, pelvik ağrı, premenstrüel sendrom, uterin spazm, vajinal yanma hissi, vajinal koku, vajinal ağrı, vulvovajinal ağrı, vulvovajinal kuruluk
Seyrek: Galaktore
Bilinmiyor: Penis rahatsızlıkları
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıkları
Yaygın olmayan: Yorgunluk, irritabilite, halsizlik, ödem, yabancı cisim hissetme Bilinmiyor: Vajinal halka bölgesi dokusunda aşırı büyüme
Araştırmalar
Yaygın: Kilo artışı Yaygın olmayan: Kan basıncı artışı
Yaralanma ve zehirlenme
Yaygın: Vajinal halka rahatsızlığı, vajinal halkanın çıkması Yaygın olmayan: Vajinal halka komplikasyonu
Bilinmiyor: Halka kopmasına bağlı vajinal yara
1) Advers olayların listelenmesi spontan raporlamaya dayanır.
KHK kullanımıyla ilişkili hormon-bağımlı tümörler (örneğin karaciğer tümörleri, meme kanseri) rapor edilmiştir. Daha fazla bilgi için bkz. bölüm 4.4.
Çok seyrek olarak, NUVARING'in kullanım sırasında koptuğu rapor edilmiştir (bkz. bölüm 4.4 ve 4.5).
Etkileşimler
Hormonal kontraseptiflerle diğer ilaçların (enzim indükleyicileri) etkileşimlerinden ani kanama ve/veya kontraseptif başarısızlık ortaya çıkabilir (bakınız bölüm 4.5).
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e- posta:tufam@titck.gov.tr; Tel:0 800 314 00 08; Faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
Hormonal kontraseptiflerin doz aşımının bildirilen herhangi bir ciddi olumsuz etkisi yoktur. Bu olguda oluşabilecek semptomlar şunlardır: Bulantı, kusma ve genç kadınlarda hafif vajinal kanama. Antidotu yoktur ve tedavi semptomatiktir.
 Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir.
Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
 Ruh ve Akıl Sağlığımızı Geliştirmek
İyi akıl ve ruh sağlığı sahip olmaktan ziyade, yaptığınız şeylerdir. Akıl ve
ruhsal olarak sağlıklı olmak için kendinize değer vermeli ve kendinizi kabul
etmelisiniz.
Ruh ve Akıl Sağlığımızı Geliştirmek
İyi akıl ve ruh sağlığı sahip olmaktan ziyade, yaptığınız şeylerdir. Akıl ve
ruhsal olarak sağlıklı olmak için kendinize değer vermeli ve kendinizi kabul
etmelisiniz. |
İLAÇ GENEL BİLGİLERİ
Organon Turkey İlaçları Ltd. Şti.
| Satış Fiyatı | 335.95 TL [ 10 May 2024 ] |
| Önceki Satış Fiyatı | 335.95 TL [ 3 May 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8683280337305 |
| Etkin Madde | Etinilestradiol + Etonogestrel |
| ATC Kodu | G02BB01 |
| Birim Miktar | 2,7+11,7 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 1 |
| Ürogenital Sistem ve Cinsiyet Hormonları > Hamilelik (Gebelik) Önleyici İlaçlar > Progesteron ve Östrojen Vajinal Halka |
| İthal ( ref. ülke : Ispanya ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Omurilik zedelenmeleri Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir. |
 |
Mide Kanseri Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir. |
 |
Belsoğukluğu, Chlamydia ve Frengi Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve boğazda enfeksyona sebep olabilir. |