IMMUNINE 1200 IU/10 ml infüzyonluk çözelti için liyofilize toz içeren flakon { Eczacibasi-Baxalta } Saklanması
{ Faktor Ix }
Kan ve Kan Yapıcı Organlar > K Vitamini ve Diğer Hemostatikler > İnsan Faktör IX Konsantresi Takeda İlaçları ve Ticaret Ltd.Şti. | Güncelleme : 22 March 2016IMMUNINE'ın saklanması
Çocukların göremeyeceği ve erişemeyeceği yerlerde ve ambalajında saklayınız. 2 - 8°C arasında buzdolabında saklayınız. İlacı dondurmayınız.
Işıktan korumak için orijinal ambalajında saklayınız.
Etiket ve kutusu üzerinde yazan son kullanma tarihinden sonra kullanmayınız. Son kullanma tarihi o ayın son gününü ifade eder.
Belirtilen raf ömrü içerisinde, oda sıcaklığında (25°C'nin altında) 3 ay süreyle saklanabilir. Ancak bu durum yalnızca 3 ay ile sınırlıdır. Kutu üzerine oda sıcaklığında saklamaya başladığınız ve bitirdiğiniz tarihi kaydediniz. IMMUNINE bu 3 ay içinde kullanılmalıdır. Eğer tıbbi ürüne ihtiyaç olmazsa 3 ay sona erdiğinde ürün atılmalıdır. IMMUNINE yeniden buzdolabında saklanmaz.
Rekonsitüye edildikten sonra 25°C altında saklanmak koşuluyla 3 saat içerisinde kullanılmalıdır.
Son kullanma tarihi geçmiş veya kullanılmayan ilaçları çöpe atmayınız! Çevre, Şehircilik ve İklim Değişikliği Bakanlığınca belirlenen toplama sistemine veriniz.
Son kullanma tarihiyle uyumlu olarak kullanınız
Ambalajındaki son kullanma tarihinden sonra IMMUNINE'ı kullanmayınız.
Ruhsat Sahibi: Takeda İlaç Sağlık San. Tic. Ltd. Şti.
Levent-Şişli/İSTANBUL
Üretim Yeri: Takeda Manufacturing Austria AG Viyana, Avusturya
Bu kullanma talimatı en sonâ¦/â¦/⦠tarihinde onaylanmıştır.
AŞAĞIDAKİ BİLGİLER BU İLACI UYGULAYACAK SAĞLIK PERSONELİ İÇİNDİR
Pozoloji / Uygulama sıklığı ve süresi:
Yerine koyma tedavisinin dozu ve süresi, faktör IX eksikliğinin ciddiyetine, kanamanın yeri ve miktarına ve hastanın klinik durumuna bağlıdır.
![]()
Uygulanan faktör IX ünitelerinin sayısı, faktör IX ürünleri için güncel Dünya Sağlık Örgütü standardı ile ilişkili uluslararası ünite (IU) terimiyle ifade edilir. Plazmadaki faktör IX aktivitesi, ya yüzdesel olarak (normal insan plazmasına göre) ya da uluslararası ünite olarak (plazmadaki faktör IX konsantreleri için uluslararası standarda göre) ifade edilir.
1 Uluslararası Ünite (IU) faktör IX aktivitesi, 1 mL normal insan plazmasındaki faktör IX miktarına eşdeğerdir.
İhtiyaç olduğunda tedavi
Gereken faktör IX dozunun hesaplanması, 12 yaş ve üzerindeki hastalarda 1 IU/kg faktör IX'un plazma faktör IX düzeyini %1.1 yükselttiği şeklindeki ampirik bulguya dayandırılmıştır.
Gereken doz aşağıdaki formülle hesaplanabilir:
Gerekli IU miktarı = vücut ağırlığı (kg) x istenen F IX artışı (%) x 0.9
Uygulanacak miktar ve uygulama sıklığı, her hasta için bireysel olarak klinik yararlılık esasına göre düzenlenmelidir. Faktör IX preparatlarının nadiren günde 1 defadan fazla uygulanma gerekliliği vardır.
Aşağıda belirtilen kanama olaylarında, faktör IX aktivitesi bu süreçte karşılık gelen plazma faktör IX aktivite düzeyinin (normal düzeyin yüzdesi veya IU/dL olarak) altına düşürülmemelidir.
Aşağıdaki tablo kanama dönemleri ve cerrahide kullanılacak dozu belirlemeye yardımcı olmak için verilmektedir:
Kanama düzeyi cerrahi prosedür türü | Gereken Faktör IX düzeyi (normaline %) (IU/dl) |
Doz sıklığı (saat) / Tedavi süresi (gün) |
Kanamalar | ||
Erken hemartroz, kas içi veya ağız içi kanamaları | 20 â 40 | Her 24 saatte bir tekrarlanmalıdır.. Tedaviye ağrı ile belirlenen kanama atağı düzelene veya iyileşme görülene kadar en az 1 gün devam edilir. |
Yoğun eklem içi kanamaları, kas içi kanama ya da hematom |
30 - 60 | Ağrı ve akut hareket kısıtlılığı düzelene kadar 3-4 gün boyunca ya da daha uzun süreyle, 24 saatte bir infüzyon tekrarlanmalıdır. |
Yaşamı tehdit eden kanamalar | 60 - 100 | Hayati tehlike geçene kadar 8 â 24 saatte bir infüzyon tekrarlanmalıdır. |
Cerrahi Girişimler | ||
Minör (Diş çekimi dahil) | 30 â 60 | Düzelme görülene kadar en az 1 gün her 24 saatte bir uygulanmalıdır. |
Majör ameliyatlar |
80 â 100 (ameliyat öncesi ve sonrası) | Yeterli yara iyileşmesi görülene kadar her 8-24 saatte bir, daha sonra en az 7 gün süreyle F IX aktivitesi %30-%60 olacak şekilde infüzyon tekrarlanmalıdır. |
Profilaksi
Ciddi hemofili B hastalığı olanlarda kanamaya karşı uzun dönem profilakside, 20-40 IU/kg'lık dozlar 3-4 günlük aralarla verilmelidir.
Özellikle genç hastalar olmak üzere bazı olgularda, daha kısa dozaj aralıkları ya da daha yüksek dozlar gerekebilir.
Tedavi süresince, tekrarlanan infüzyon sıklığının ve uygulanacak dozun ayarlanmasına rehber olması için faktör IX düzeyi ölçülmesi önerilmektedir. Özellikle majör cerrahi girişimlerde, koagülasyon analizleriyle (plazma faktör IX aktivitesi) yerine koyma tedavisinin sıkı takibi gereklidir. Farklı yarılanma zamanı ve in vivo yanıt nedeniyle, faktör IX'a cevap kişiden kişiye değişebilir.
Pediyatrik popülasyon
Mevcut verilere göre, 12 yaşından büyük hastalar için pediyatrik hasta pozolojisi önerisi yapılabilir. 6 ila 12 yaş grubunda, mevcut klinik veriler bir doz önerisi yapmak için yeterli değildir.
İstenmeyen etkiler
Özel popülasyon
IMMUNINE kullanımı pediyatrik hemofili B hastalarında incelenmiştir. Güvenlilik IMMUNINE kullanan yetişkinlerdeki güvenliğe benzerdir.
Ayrıca, IMMUNINE kullanımı sırasıyla 6 yaşına kadar çocuklarda ve 0-64 yaşındaki Hemofili B hastalarında yapılan iki gözlemsel çalışmada incelenmiştir. 6 yaşına kadar çocuklardaki
güvenlilik, IMMUNINE kullanan 6 yaşından büyük çocuklarda ve yetişkinlerdeki güvenliliğe benzerdir.
Enjeksiyonluk çözelti hazırlamak için tozun sulandırılması:Aseptik teknik kullanınız !
Çözücü (steril enjeksiyonluk su) içeren kapalı flakonu oda sıcaklığına getiriniz (maksimum
+ 37°C).
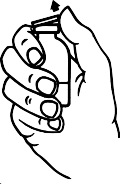
Toz flakonunun ve çözücü flakonun koruyucu kapaklarını çıkarınız (Şekil A) ve her ikisinin de lastik tıpalarını dezenfekte ediniz.
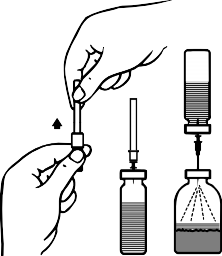
Ambalaj içeriğindeki âtransfer iğnesinin' koruyucu kapağını, bir ucundan döndürerek ve çekerek çıkarınız. Görünür hale gelen iğneyi çözücü flakonunun lastik tıpasına batırınız (Şekil B ve C).
Transfer iğnesinin diğer ucundaki koruyucu kapağını, açıkta kalan kısımlarına temas etmemeye dikkat ederek çıkarınız.
Çözücü flakonunu toz flakonunun üzerine ters çevirin ve transfer iğnesinin serbest ucunu toz flakonunun kauçuk tıpasından geçirin (Şekil D). Çözücü, vakum ile toz flakonuna çekilecektir.
İğneyi toz flakonundan çıkararak iki flakonun ayrılmasını sağlayınız (Şekil E). Çözünmeyi hızlandırmak için, toz flakonunu hafifçe çalkalayınız veya döndürünüz.
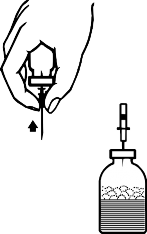
Tozun sulandırılması tamamlanınca, ambalaj içeriğindeki âhavalandırma iğnesini' takınız (Şekil F). Oluşmuş bulunan köpüklenme kaybolacaktır. Havalandırma iğnesini çıkarınız.
Enjeksiyon / infüzyon
Aseptik teknik kullanınız!
Ambalaj içeriğindeki âfiltreli iğnenin' koruyucu kapağını, döndürerek ve çekerek çıkarınız ve steril tek kullanımlık bir enjektöre takınız. Çözeltiyi enjektöre çekiniz (Şekil G).
Filtreli iğneyi enjektörden çıkarınız ve ambalajdaki kelebek infüzyon setini (ya da ambalajdaki tek kullanımlık iğneyi) kullanarak çözeltiyi yavaş olarak (enjeksiyon hızı dakikada 2 mL'yi aşmamalıdır) intravenöz enjeksiyon şeklinde uygulayınız.
İnfüzyon şeklinde uygulanacaksa, uygun bir filtreye sahip olan tek kullanımlık infüzyon seti kullanılmalıdır.
![]()
![]()
Şek. A Şek.B Şek.C Şek. D Şek. E Şek. F Şek.G