EVRENZO 100 mg film kaplı tablet (12 adet) Farmakolojik Özellikler
{ Roksadustat }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: anti-anemik preparatlar, diğer anti-anemik preparatlar ATC kodu: B03XA05
Etki mekanizması
Roksadustat hipoksiyle indüklenen faktör prolil hidroksilaz inhibitörüdür (HIF-PHI). HIF-PH enzimlerinin aktivitesi, eritropoezde rol oynayan genlerin ekspresyonunu düzenleyen bir transkripsiyon faktörü olan HIF'nin intrasellüler seviyelerini kontrol eder. HIF yolağının aktivasyonu, kırmızı kan hücresi üretimini arttırmak için hipoksiye adaptif yanıtta önemlidir.
HIF-PH'nin geri dönüşümlü inhibisyonu yoluyla, roksadustat, plazma endojen eritropoetin
(EPO) seviyelerinin artmasını, demir taşıyıcı proteinlerin düzenlenmesini ve hepsidinin
(KBH'de inflamasyon sırasında artan bir demir regülatör proteini) azaltılmasını kapsay
koordineli bir eritropoetik yanıtı uyarır. Bu uyarı, demir biyoyararlanımında iyileşmeye, Hb üretiminde artışa ve kırmızı hücre kütlesinde artışa neden olur.
Farmakodinamik etkiler
QTc ve kalp atış hızı üzerine etkileri
Sağlıklı gönüllülerde 2,75 mg/kg'lık tek terapötik dozda ve 5 mg/kg'lık (510 mg'a kadar) tek supraterapötik dozda roksadustat ile yapılan kapsamlı bir QT (TQT) çalışması, QTc aralığında bir uzama göstermemiştir. Aynı kapsamlı QT çalışması, 2,75 mg/kg doz için dozdan 8 ila 12 saat sonra, dakikada 9 ila 10 atıma kadar ve 5 mg/kg doz için dozdan 6 ila 12 saat sonra dakikada 15 ila 18 atıma kadar plasebo ile düzeltilmiş bir kalp atış hızı artışı göstermiştir.
Klinik etkililik ve güvenlilik
KBH ile anemide gelişim programı
Roksadustatın etkililiği ve güvenliliği, anemisi olan, diyalize bağımlı olmayan (NDD) ve diyalize bağımlı (DD) KBH hastalarında çok merkezli ve randomize 8 çalışmadan oluşan küresel olarak yürütülen bir faz 3 programında en az 52 hafta boyunca değerlendirilmiştir (bkz. Tablo 4).
Evre 3-5 KBH'li NDD hastalarında yapılan üç çalışma; çift kör ve plasebo kontrollü çalışmalardır (ALPS, 1517-CL-0608; ANDES, FGCL-4592-060; OLYMPUS, D5740C00001)
ve bir çalışma karşılaştırıcı olarak darbepoetin alfa kullanılarak yapılan açık etiketli ESA kontrollü çalışmadır (DOLOMITES, 1517-CL-0610). Tüm NDD çalışmaları ESA ile tedavi edilmemiş hastalarda etkililiği ve güvenliliği, Hb'yi 10 ila 12 g/dL hedef aralığında düzelterek ve daha sonra koruyarak (Hb düzeltme yaklaşımı) değerlendirmiştir.
Hemodiyaliz veya periton diyalizi alan hastalarda açık etiketli ESA kontrollü 4 DD çalışması (kontrol: epoetin alfa ve/veya darbepoetin alfa) aşağıdaki farklı durumlarda etkililiği ve güvenliliği değerlendirmiştir:
Hb düzeltmesi yaklaşımı (HIMALAYAS, FGCL-4592-063).
Hb'yi hedef aralıkta tutmak için hastaların bir ESA ile tedaviden geçiş yaptığı bir ESA'dan geçiş yaklaşımı (PYRENEES, 1517-CL-0613; SIERRAS, FGCL-4592-064).
veya Hb düzeltmesi ve ESA geçiş yaklaşımlarının kombinasyonu (ROCKIES,
D5740C00002).
NDD çalışmalarındaki hastalar evre 3 ila 5 KBH'ye sahiptir ve diyalize girmemişlerdir. Ortalama Hb seviyesinin ≤10,5 g/dL olmasına olanak sağlayan DOLOMITES çalışmasındaki (1517 CL 0610) hastalar hariç, tüm hastalarda randomizasyonda ortalama Hb seviyesi ≤10 g/dL'dir. Ferritin seviyelerinin ≥30 ng/mL (ALPS, 1517 CL 0608; ANDES, FGCL 4592 060),
≥50 ng/mL (OLYMPUS, D5740C00001) veya ≥100 ng/mL (DOLOMITES, 1517 CL 0610)
olması gerekmektedir. Randomizasyondan 6 hafta öncesine kadar ESA tedavisine olanak sağlayan çalışmadakiler (OLYMPUS, D5740C00001) hariç, hastalara randomizasyondan sonraki 12 hafta içinde herhangi bir ESA tedavisi uygulanmamıştır.
DD çalışmalarında hastaların diyalize giriyor olması gerekmektedir: 4 aydan uzun diyaliz olarak tanımlanan PYRENEES çalışmasındaki (1517 CL 0613) hastalar için stabil DD; ≥2 hafta ve ≤4 ay diyaliz olarak tanımlanan HIMALAYAS çalışmasındaki (FGCL 4592 063) hastalar için insidental (ID), DD. SIERRAS (FGCL-4592-064) ve ROCKIES çalışmalarına (D5740C00002) hem stabil (yaklaşık %80 ila %90) hem de ID (yaklaşık %10 ila %20) DD
Randomizasyondan önceki 12 hafta içinde herhangi bir ESA tedavisi almış olan hastaların
alınmadığı HIMALAYAS çalışmasındaki (FGCL 4592 063) hastalar hariç, tüm hastala
NDD hastalarda yapılan çalışmalar | ||||
| Plasebo kontrollü çalışmalar (NDD havuzu) | ESA kontrollü (Darbepoetin alfa) | ||
Yaklaşım | Hb düzeltmesi | |||
Çalışma | ALPS (1517-CL- 0608) | ANDES (FGCL- 4592-060) | OLYMPUS (D5740C 00001) | DOLOMITES (1517-CL-0610) |
Randomizasyon (Roksadustat/karşılaştırma) | 594 (391/203) | 916 (611/305) | 2760 (1384/1376) | 616 (323/293) |
DD hastalarında yapılan çalışmalar | ||||
| ESA kontrollü çalışmalar (DD havuzu) (Epoetin alfa veya Darbepoetin alfa) | |||
Yaklaşım | ESA dönüşümü | Hb düzeltmesi | ESA dönüşümü ve Hb düzeltmesi | |
Çalışma | PYRENE | SIERRAS 92-064) | HIMALAYAS | ROCKIES (D5740C00002) |
Randomizasyon | 834 | 740 | 1039 | 2101 |
randomizasyondan en az 8 hafta önce intravenöz veya subkutan ESA uygulanması
gerekmektedir.
Roksadustat ile tedavi için, bölüm 4.2'de tarif edildiği gibi dozaj talimat esasları izlenmiştir. Her bir çalışmanın demografileri ve tüm başlangıç özellikleri, roksadustat ve kontrol grupları arasında karşılaştırılabilir niteliktedir. Randomizasyondaki medyan yaş 55 â 69 yıl olup; hastaların %16,6 ila %31,1'i 65-74 yaş aralığında, %6,8 ila %35'i ise ≥75 yaşındadır. Kadın hastaların yüzdesi %40,5 ila %60,7 arasında değişmektedir. Çalışmalar arasında en yaygın olarak temsil edilen ırklar Beyaz, Siyahi veya Afrika kökenli Amerikan ve Asyalı olmuştur. En yaygın KBH etiyolojileri diyabetik ve hipertansif nefropatidir. Medyan Hb seviyeleri 8,6 ila 10,78 g/dL arasında değişmektedir. NDD hastalarının yaklaşık %50-60'ının ve DD hastalarının
%80-90'ının demir depoları başlangıçta doludur.
Yedi faz 3 çalışmadan elde edilen veriler, iki ayrı popülasyonda (üç NDD ve dört DD olmak üzere) havuzlanmıştır (bkz. Tablo 4).
Üç plasebo kontrollü NDD çalışması (roksadustatta 2.386 hasta, plaseboda 1.884 hasta) NDD havuzuna dahil edilmiştir. ESA kontrollü NDD DOLOMITES Faz 3 çalışması (1517-CL-0610; roksadustatta 323 hasta ve darbepoetin alfada 293 hasta) verileri, bu çalışma NDD popülasyonundaki tek açık etiketli, aktif kontrollü çalışma olduğundan, havuzlanmış NDD analizlerine dahil edilmemiştir.
Dört ESA kontrollü DD çalışması (roksadustatta 2.354 hasta, ESA'da [epoetin alfa ve/veya darbepoetin alfa] 2.360 hasta) DD havuzuna dahil edilmiştir. DD havuzunda, iki farklı tedavi durumunu yansıtmak için iki alt havuz kurulmuştur:
DD popülasyonunda 2 haftadan uzun ve 4 aydan kısa bir süre diyalize giren hastalara Hb düzeltmesi yaklaşımını yansıtan insidental (ID) DD hastaları (ID DD havuzu) adı verildi.
Bu dört aylık eşik değerinden sonra diyalize girmeye devam etmiş DD hastalarına, ESA geçiş yaklaşımını yansıtan stabil DD hastaları (Stabil DD havuzu) adı verildi.
Tablo 4: KBH anemisinde roksadustat faz 3 geliştirme programına genel bakış
(Roksadustat/karşılaştırma) | (414/420) | (370/370) | (522/517) | (1048/1053) |
DD: diyalize bağımlı; ESA: eritropoez uyarıcı ajan; Hb: hemoglobin; NDD: diyalize bağımlı
olmayan.
NDD KHB hastaları Etkililik sonuçları
Tedavi sırasında Hb seyri
Klinik çalışmalarda roksadustat, diyalize girmeyen KBH anemisi olan hastalarda hedef Hb
seviyelerini (10-12 g/dL) elde etmede ve sürdürmede etkili olmuştur (bkz. Şekil 1).
Şekil 1: 52. haftaya kadar geçen süre boyunca ortalama (SE) Hb (g/dL) (FAS); NDD
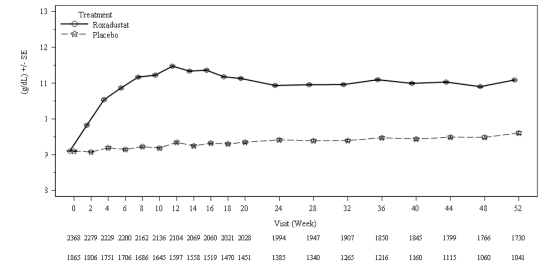
Roksadustat
Plasebo
havuzu (Hb düzeltmesi)
FAS: tam analiz seti; Hb: hemoglobin; NDD: diyalize bağımlı olmayan; SE: standart hata.
NDD KHB hastalarında başlıca Hb etkililiği sonlanım noktaları
Hb düzeltmesi için anemi tedavisine ihtiyaç duyan NDD hastalarında, ilk 24 hafta boyunca Hb yanıtı elde eden hastaların oranı, plasebo (%8,7) ile karşılaştırıldığında roksadustat grubunda (%80,2) daha yüksek olmuştur. Başlangıçtan 28 ila 36. haftaya kadar Hb seviyelerinde plaseboya (0,14 g/dL) kıyasla roksadustat grubunda (1,91 g/dL) istatistiksel olarak anlamlı bir artış olmuştur ve %95 güven aralığının alt limiti 1'in üzerindedir. NDD çalışmalarında, medyan 4,1 hafta süre ile Hb'de en az 1 g/dL artış sağlanmıştır (bkz. Tablo 5).
Açık-etiketli ESA kontrollü NDD DOLOMITES (1517-CL-0610) çalışmasında, ilk 24 hafta içinde Hb yanıtına ulaşan hastaların oranı, darbepoetin alfa (%78) ile karşılaştırıldığında roksadustat grubunda (%89,5) non-inferior olmuştur (bkz. Tablo 5).
Popülasyon | NDD KHB hastaları | |||
Yaklaşım | Hb düzeltmesi | Hb düzeltmesi | ||
Sonlanım noktası/ Parametre | NDD havuzu (FAS) | DOLOMITES (PPS) 1517-CL-0610 | ||
n= 2368 | n= 1865 | n= 286 | alfa | |
Tablo 5: Önemli Hb etkililiği sonlanım noktaları (NDD)
Hb yanıtı elde eden hastaların oranı | ||||
Yanıt verenler, n (%) [%95 GA] | 1.899 (80,2) [78,5; 81,8] | 163 (8,7) [7,5; 10,1] | 256 (89,5) [85,4; 92,8] | 213 (78) [72,6; 82,8] |
Oranların farkı [%95 GA] | 71,5 [69,4; 73,51] | 11,51 [5,66; 17,36] | ||
Olasılık oranı [%95 GA] | 40,49 [33,01; 49,67] | 2,48 [1,53; 4,04] | ||
P değeri | <0,0001 | ND | ||
Hb'de başlangıçtan itibaren değişim (g/dL) | ||||
Ortalama (SD) başlangıç | 9,1 (0,74) | 9,1 (0,73) | 9,55 (0,76) | 9,54 (0,69) |
Ortalama (SD) CFB | 1,85 (1,07) | 0,17 (1,08) | 1,85 (1,08) | 1,84 (0,97) |
LS ortalaması | 1,91 | 0,14 | 1,85 | 1,84 |
LS ortalaması farkı [%95 GA] | 1,77 [1,69; 1,84] | 0,02 [-0,13; 0,16] | ||
P değeri | <0,0001 | 0,844 | ||
CFB: başlangıçtan itibaren değişim; GA: güven aralığı; KBH: kronik böbrek hastalığı; FAS: tam analiz seti; Hb: hemoglobin; LS: en küçük kare; ND: yapılmadı; NDD: diyalize bağımlı olmayan; PPS: her bir protokol seti; SD: standart sapma.
DD KHB hastaları
Tedavi boyunca Hb seyri
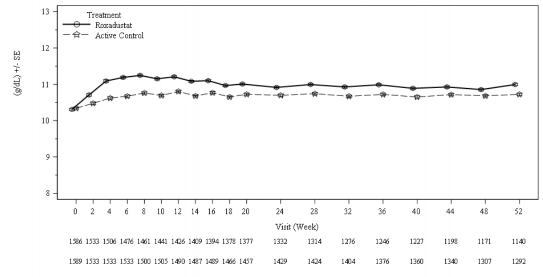
Klinik çalışmalarda, roksadustat, önceki ESA tedavisinden bağımsız olarak, diyalize giren KBH hastalarında hedef Hb seviyelerine (10-12 g/dL) ulaşılması ve sürdürülmesinde etkili olmuştur (bkz. Şekil 2 ve 3).
Şekil 2: 52. haftaya kadar ortalama (SE) Hb (FAS); ID DD alt havuzu (Hb düzeltmesi)


![]()
Roxadustat
Active Control
![]()
|
| ||||||||||||||||||
| |||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
DD: diyalize bağımlı; FAS: tam analiz seti; Hb: hemoglobin; ID: insidental diyaliz; SE: standart hata.
5
![]()
Roksadustat
Aktif kontrol
Şekil 3: 52. haftaya kadar geçen süre boyunca ortalama (SE) Hb (g/dL) (FAS); stabil DD alt havuz (ESA geçişli)
DD: diyalize bağımlı; ESA: eritropoez uyarıcı ajan; FAS: tam analiz seti; Hb: hemoglobin; SE: standart
hata
DD KHB hastalarında önemli Hb etkililik sonlanım noktaları
Hb düzeltmesi için anemi tedavisine ihtiyaç duyan ve ESA tedavisinden geçiş yapan DD hastalarında, roksadustat grubunda Hb'de başlangıçtan 28. ila 36. haftaya kadar bir artış olmuştur, bu artış ESA grubunda gözlemlenenle benzerdir ve -0,75 g/dL'lik önceden belirlenmiş non-inferiorite marjının üzerinde olmuştur. İlk 24 hafta boyunca Hb yanıtı elde eden hastaların oranı roksadustat ve ESA gruplarında benzerdir (bkz. Tablo 6).
Popülasyon | DD hastaları | |||
Yaklaşım | Hb Düzeltmesi | ESA Geçişi | ||
Sonlanım noktası/ Parametre | ID DD havuzu (FAS/PPS) | Stabil DD havuzu (PPS) | ||
Roksadustat n = 756 | ESA n = 759 | Roksadustat n = 1379 | ESA n = 1417 | |
Hb'de başlangıçtan itibaren değişim(g/dL) | ||||
Ortalama (SD) başlangıç | 8,77 (1,2) | 8,82 (1,2) | 10,32 (0,99) | 10,37 (0,99) |
Ortalama (SD) CFB | 2,37 (1,57) | 2,12 (1,46) | 0,65 (1,15) | 0,36 (1,23) |
LS ortalaması | 2,17 | 1,89 | 0,58 | 0,28 |
LS ortalaması farkı [%95 GA] | 0,28 [0,11; 0,451] | 0,3 [0,228; 0,373] | ||
P değeri | 0,0013 | <0,0001 | ||
Hb yanıtı elde eden hastaların oranı | ||||
Yanıt verenler, n (%) [%95 GA] | 453 (59,9) [56,3; 63,4] | 452 (59,6) [56; 63,1] | 978 (70,9) [68,4; 73,3] | 959 (67,7) [65,2; 70,1] |
Oranların farkı [%95 GA] | 0,3 | 2,7 [-0,7; 6] | ||
Olasılıkornı [%95GA] | ||||
P değeri | ND | ND | ||
Tablo 6: Önemli Hb etkililik sonlanım noktaları (DD)
5
![]()
CFB: başlangıçtan itibaren değişim; GA: güven aralığı; KBH: kronik böbrek hastalığı; DD: diyalize bağımlı; ESA: eritropoez uyarıcı ajan; FAS: tam analiz seti; Hb: hemoglobin; ID: insidental diyaliz; LS: en küçük kare; ND: yapılmadı; PPS: her bir protokol seti; SD: standart sapma.
almadan 28 ila 36. haftada 10 ila 12 g/dL'lik hedef aralığındadır.
Kurtarma tedavisi, RBC transfüzyonu ve intravenöz demir
Roksadustat ile tedavinin kurtarma tedavisi, RBC transfüzyonu ve intravenöz demir kullanımı üzerindeki etkileri Tablo 7 (NDD) ve Tablo 8'de (DD) sunulmaktadır. Klinik çalışmalarda, transferrrin satürasyonu sabitken, roksadustat, hepsidini (demir metabolizmasının regülatörü), ferritini azaltmış, serum demirini arttırmıştır, tüm bu değerler zaman içinde demir durumunun indikatörleri olarak değerlendirilmiştir.
Düşük dansiteli lipoprotein (LDL) kolesterol
Roksadustat tedavisinin LDL kolesterol üzerindeki etkileri Tablo 7 ve Tablo 8'de sunulmaktadır. Roksadustat ile tedavi edilen hastalarda plasebo veya ESA ile tedavi edilen hastalara kıyasla ortalama LDL ve yüksek dansite lipoprotein (HDL) kolesterol seviyelerinde azalma olmuştur. LDL kolesterol üzerindeki etki daha belirgindir, bu da LDL/HDL oranının azalmasına yol açmıştır ve statin kullanımına bakılmaksızın gözlemlenmiştir.
Tablo 7: Diğer etkililik sonlanım noktaları: kurtarma tedavisinin kullanımı, aylık intravenöz demir kullanımı ve LDL kolesterolde başlangıçtan itibaren değişim (NDD)
Popülasyon | NDD KHB hastaları | |||
Müdahale | Düzeltme | Düzeltme | ||
Sonlanım noktası/Parametre | NDD havuzu (FAS) | DOLOMITES (1517- CL-0610) | ||
Roksadustat n=2368 | Plasebo n= 1865 | Roksadustat n=322 | Darbepoetin alfa n= 292 | |
Kurtarma tedavisi alan hastaların sayısı, n (%) | 211 (8,9) | 580 (31,1) |
ND | |
RBC | 118 (5) | 240 (12,9) | ||
IV demir | 50 (2,1) | 90 (4,8) | ||
ESA | 48 (2) | 257 (13,8) | ||
IR | 10,4 | 41 | ||
Tehlike oranı | 0,19 |
ND | ||
%95 GA | 0,16; 0,23 | |||
P değeri | <0,0001 | |||
IV demir alan hastaların sayısı, n (%) |
ND | 20 (6,2) | 37 (12,7) | |
IR | 9,9 | 21,2 | ||
Tehlike oranı | 0,45 | |||
%95 GA | 0,26; 0,78 | |||
P değeri | 0,004 | |||
LDL kolesterolde başlangıçtan 12-28.haftaya kadar olan değişim (mmol/L) | ||||
ANCOVA kullanılarak analiz | ||||
Ortalama LS | -0,446 | 0,066 | -0,356 | 0,047 |
%95 GA | ||||
Ortalama LS farkı (R- karşılaştırıcı) | -0,513 | -0,403 |
%95 GA | -0,573; -0,453 | -0,51; -0,296 |
P değeri | <0,0001 | <0,001 |
NDD havuzu için sunulan P değerleri nominal p değerleridir.
ANCOVA: kovaryans analizi; ESA: eritropoez uyarıcı ajan; FAS: tam analiz seti; GA: güven aralığı; IR: insidans oranı (risk altındaki 100 hasta yılı başına); IV: intravenöz; LDL: düşük yoğunluklu lipoprotein; LS: en küçük kare; ND: yapılmadı; NDD: diyalize bağımlı olmayan; R: roksadustat; RBC: kırmızı kan hücresi.
Tablo 8: Diğer etkililik sonlanım noktaları: kurtarma tedavisinin kullanımı, aylık intravenöz demir kullanımı ve LDL kolesterolde başlangıçtan itibaren değişim (DD)
Popülasyon | DD KBH hastaları | |||
Müdahale | Düzeltme | Düzeltme | ||
Sonlanım noktası/Parametre | ID DD havuzu (FAS) | Stabil DD havuzu (FAS) | ||
Roksadustat n=756 | ESA n= 759 | Roksadustat n=1586 | ESA n= 1589 | |
28 â 52 hafta boyunca ortalama aylık IV demir (mg) | ||||
N | 606 | 621 | 1414 | 1486 |
Ortalama (SD) | 53,57 (143,097) | 70,22 (173,33) | 42,45 (229,8) | 61,99 (148,02) |
LDL kolesterolde başlangıçtan 12-28.haftaya kadar olan değişim (mmol/L) | ||||
ANCOVA kullanılarak analiz | ||||
Ortalama LS | -0,61 | -0,157 | -0,408 | -0,035 |
%95 GA | -0,7; -0,520 | -0,245; -0,069 | -0,449; -0,368 | -0,074; 0,003 |
Ortalama LS farkı (R- karşılaştırıcı) | -0,453 | -0,373 | ||
%95 GA | -0,575; -0,331 | -0,418; -0,328 | ||
P değeri | <0,0001 | <0,0001 | ||
ID DD ve stabil DD havuzları için sunulan P değerleri nominal p değerleridir.
ANCOVA: kovaryans analizi; DD: diyalize bağımlı; ESA: eritropoez uyarıcı ajan; FAS: tam analiz seti; GA: güven aralığı; ID: insidental diyaliz; IV: intravenöz; KHB: kronik böbrek hastalığı; LDL: düşük yoğunluklu lipoprotein; LS: en küçük kare
SIERRAS (FGCL-4592-064) diyaliz çalışmasında, EPO-alfa grubuna kıyasla roksadustat grubunda tedavi sırasında hastaların anlamlı derecede daha düşük bir oranına kırmızı kan hücresi transfüzyonu uygulanmıştır (%21,1'e karşı %12,5); ROCKIES (D5740C00002) çalışmasında sayısal azalma istatistiksel olarak anlamlı değildir (%13,2'ye karşı %9,8).
Diyalizde olmayan hastanın bildirdiği sonuçlar
DOLOMITES (1517-CL-0610) çalışmasında, SF-36 PF ve SF-36 VT ile ilgili olarak
roksadustatın darbepoetine non-inferior olduğu belirlenmiştir.
| MACE | MACE+ | ACM | |||
Roksadust at | Plasebo n = 1884 | Roksadusta t | Plasebo n = 1884 | Roksadusta t | Plasebo n = 1884 | |
Tedavi esnasında | ||||||
hasta sayısı (%) | 344 (14,4) | |||||
PYRENEES (1517-CL-0613) çalışmasında, başlangıçtan 12 â 28.haftaya kadar SF-36 PF ve SF-36 VT değişiklikleri ile ilgili olarak, roksadustatın ESA'lara non-inferior olduğu belirlenmiştir.
Klinik güvenlilik
Havuzlanmış, hükümlendirilmiş kardiyovasküler olayların meta-analizi
Faz 3 çalışma programından hükümlendirilmiş majör advers kardiyovasküler olayların (MACE; tüm nedenlere bağlı mortalite [ACM], miyokard infarktüsü, inmeden oluşan bileşik) ve MACE+'nin (tüm nedenlere bağlı mortalite [ACM], miyokard infarktüsü, inme ve hastaneye yatmayı gerektiren stabil olmayan anjinadan oluşan bileşik) meta analizi 8984 hastada gerçekleştirilmiştir.
MACE, MACE+ ve ACM sonuçları, havuzlanmış tehlike oranı (HR) ve bunun %95 güven aralığı (GA) kullanılarak üç veri seti için sunulmaktadır. Üç veri seti şunları içermektedir:
NDD hastalarında havuzlanmış bir plasebo kontrollü Hb düzeltmesi veri seti [OLYMPUS
(D5740C00001), ANDES (FGCL-4592-060) ve ALPS (1517-CL-0608) çalışmalarına dahil
edilen hastaları içerir; bkz. Tablo 4]
NDD ve ID-DD hastalarında havuzlanmış bir ESA kontrollü Hb düzeltmesi veri seti
[DOLOMITES (1517-CL-0610), HIMALAYAS (FGCL-4592-063) çalışmalarına dahil
edilen hastaları ve SIERRAS (FGCL-4592-064) ve ROCKIES (D5740C00002);
çalışmalarının ID-DD hastalarını içerir; bkz. Tablo 4]
Stabil DD hastalarında havuzlanmış bir ESA kontrollü ESA geçişli veri seti [PYRENEES
(1517-CL-0613) çalışmasındaki ve ROCKIES (D5740C00002) ve SIERRAS (FGCL-4592-
064) çalışmalarının Stabil DD hastalarını içerir; bkz. Tablo 4]
Diyalize bağımlı olmayan KHB hastalarında plasebo-kontrollü Hb düzeltme setinde MACE,
MACE+ ve ACM
NDD hastalarında, tedavi esnasındaki analizlerin, MACE, MACE+ ve ACM analizi, çalışma tedavisi başlangıcından tedavi takibinin bitişinin itibaren 28. güne kadar olan tüm verileri içermiştir. Tedavi sırasındaki analizlerde, sansürleme olasılığı için ters ağırlıklı bir Cox modeli kullanılmıştır (IPCW yöntemi); bu model, özellikle başlangıçta ve zamanla tahmini glomerüler filtrasyon hızı (eGFR) tayinleri ve Hb dahil olmak üzere, risk artışlarına ve tedavinin erken sonlandırılmasına katkı sağlayanlar dahil, roksadustat ve plasebo arasındaki takip süresi farklılıklarını düzeltmeyi amaçlar. Bu modelde herhangi bir çelişki kalıp kalmadığı belirsizliğini korumaktadır. Tedavi sırasındaki analizler için HR'ler 1,26; 1,17 ve 1,16'dır (bkz. Tablo 9). ITT (tedaviye niyetlenilen) analizleri, çalışma tedavisinin başlangıcından tedavi sonrası güvenlilik takibinin sonuna kadar tüm verileri içermiştir. ITT analizi, tedavi sırasındaki analizde plasebo lehine risk dağılımındaki dengesizliği göstermek için dahil edilmiştir, fakat ITT analizleri genellikle çalışma ilacı tedavisi etkisinde bir seyrelme gösterir ve bu ITT analizlerindeki bias, özellikle çalışma tedavisinin sonlandırılmasından sonra ESA kurtarma tedavisi uygulandığı için, tamamen hariç tutulamaz. HR'ler sırasıyla 1,1; 1,07 ve 1,08 %95 GA üst limitleri de sırasıyla 1,27; 1,21 ve 1,26 olmuştur.
Tablo 9: NDD havuzunda plasebo-kontrollü Hb düzeltmesinde KV güvenlilik ve mortalite
FAIR | 8,7 | 6,8 | 11,6 | 10,1 | 6,4 | 5 |
HR (%95 GA) | 1,26 (1,02; 1,55) | 1,17 (0,99; 1,4) | 1,16 (0,9; 1,5) | |||
ITT | ||||||
Olay yaşayan hasta sayısı (%) | 480 (20,1) | 350 (18,6) | 578 (24,2) | 432 (22,9) | 400 (16,8) | 301 (16) |
FAIR | 10,6 | 10,3 | 13,2 | 13,2 | 8,3 | 8,1 |
HR (%95 GA) | 1,1 (0,96; 1,27) | 1,07 (0,94; 1,21) | 1,08 (0,93; 1,26) | |||
ACM: tüm nedenlere bağlı mortalite; ACM, MACE/MACE+'nın bir bileşenidir. GA: güven aralığı; FAIR: takip ayarlı insidans oranı (olay yaşayan hasta sayısı/100 hasta yılı); HR: tehlike oranı; ITT: tedaviye niyetlenilen; MACE: majör advers kardiyovasküler olay (ölüm, fatal olmayan miyokard infarktüsü ve/veya inme); MACE+: stabil olmayan anjina ve/veya konjestif kalp yetmezliği için hastaneye yatış dahil olmak üzere majör advers kardiyovasküler olay.
Diyalize bağımlı olmayan ve diyalize bağımlı KBH hastalarından oluşan ESA kontrollü Hb düzeltme setindeki MACE, MACE+ ve ACM
NDD ve ID-DD hastalarının Hb düzeltme setinde, başlangıç özellikleri ve tedaviyi bırakma oranları, havuzlanmış roksadustat ve havuzlanmış ESA hastaları arasında karşılaştırılabilir olmuştur. Tedavide gözlemlenen MACE, MACE+ ve ACM analizi, sırasıyla 1,02; 0,98 ve 1,05'lik %95 GA üst limiti ile 0,79; 0,78 ve 0,78 HR değerleri sunmuştur (bkz. Tablo 10). Tedavi sırasındaki analizler, Hb düzeltmesi gerektiren KBH hastalarında ESA ile karşılaştırıldığında roksadustat ile kardiyovasküler güvenlilik veya mortalite riskinde artışa ilişkin hiçbir kanıtı desteklememektedir.
Tablo 10: ESA-kontrollü Hb düzeltme havuzunda KV güvenlilik ve mortalite
| MACE | MACE+ | ACM | |||
Roksadustat N = 1083 | ESA N = 1059 | Roksadustat N = 1083 | ESA N = 1059 | Roksadustat N= 1083 | ESA N= 1059 | |
Tedavi esnasında |
|
| ||||
Olay yaşayan hasta sayısı (%) |
105 (9,7) |
136 (12,8) |
134 (12,4) |
171 (16,1) |
74 (6,8) |
99 (9,3) |
IR | 6,5 | 8,2 | 8,3 | 10,3 | 4,6 | 6 |
HR (%95 GA) |
0,79 (0,61; 1,02) | 0,78 (0,62; 0,98) | 0,78 (0,57; 1,05) | |||
ACM: tüm nedenlere bağlı mortalite; ACM, MACE/MACE+'nın bir bileşenidir. ESA: eritropoez uyarıcı ajan; GA: güven aralığı; HR: tehlike oranı; IR: insidans oranı (olay yaşayan hasta sayısı/100 hasta yılı); MACE: majör advers kardiyovasküler olay (ölüm, fatal olmayan miyokard infarktüsü ve/veya inme); MACE+: stabil olmayan anjina ve/veya konjestif kalp yetmezliği nedeniyle hastaneye yatışlar dahil majör advers kardiyovasküler olay.
Stabil Diyalize bağımlı KBH hastalarında ESA kontrollü ESA geçiş setinde MACE ve MACE+ ve ACM
ESA'dan geçiş yapan stabil DD hastalarında, tedavi sırasında gözlemlenen MACE, MACE+ ve ACM için analiz sonuçları, sırasıyla 1,38; 1,19 ve 1,49 %95 GA üst sınırlarıyla 1,18; 1,03 ve 1,23 HR değerleri sunmuştur (bkz. Tablo 11). Roksadustat tedavisine randomize edilen hastaların çalışmanın başlangıcındaESA'dangeçişyapmışolmaları ve stabilize Hb değerleri
barındırması nedeniyle, gözlemlenen sonuçlar karmaşıklaşabilir; dolayısıyla tedavi etki
tahminlerinin herhangi bir karşılaştırmasının güvenilir bir şekilde ortaya konması mümkün olmayacağından, Tablo 11'deki sonuçlar dikkatli bir şekilde yorumlanmalıdır.
Tablo 11: ESA-kontrollü ESA geçişi stabil DD havuzunda KV güvenlilik ve mortalite
| MACE | MACE+ | ACM | |||
Roksadustat n= 1594 | ESA n= 1594 | Roksadustat n= 1594 | ESA n= 1594 | Roksadustat n= 1594 | ESA n= 1594 | |
Tedavi esnasında | ||||||
Olay yaşayan hastaların sayısı (%) |
297 (18,6) |
301 (18,9) |
357 (22,4) |
403 (25,3) |
212 (13,3) |
207 (13) |
IR | 10,4 | 9,2 | 12,5 | 12,3 | 7,4 | 6,3 |
HR (%95 GA) | 1,18 (1; 1,38) | 1,03 (0,9; 1,19) | 1,23 (1,02; 1,49) | |||
ACM: tüm nedenlere bağlı ölüm; ACM, MACE/MACE+ bileşenidir. GA: güven aralığı; ESA: eritropoiez uyarıcı ajan; HR: tehlike oranı; IR: insidans oranı (100 hasta yılında olay yaşayan hastaların sayısı); MACE: majör advers kardiyovasküler olay (ölüm, fatal olmayan mikoyard infarktüsü ve/veya inme); MACE+: stabil olmayan anjina ve/veya konjestif kalp yetmezliği için hastaneye yatışlar dahil, majör advers kardiyovasküler olay
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
Maksimum plazma konsantrasyonları (C) genellikle açlık durumunda dozdan 2 saat sonra elde edilir. Roksadustatın yiyecekle uygulanması, açlık durumuna kıyasla C'ı %25 düşürmüştür, ancak EAA'yı değiştirmemiştir. Bu nedenle, roksadustat yiyecekle veya yiyecek olmadan alınabilir (bkz. bölüm 4.2).
Dağılım:
Roksadustat, ağırlıklı olarak albümin olmak üzere insan plazma proteinlerine yüksek oranda (yaklaşık %99) bağlanır. Roksadustatın kan-plazma oranı 0,6'dır. Kararlı durumda görünür dağılım hacmi 24 L'dir.
Biyotransformasyon:
İn vitro verilere dayanarak, roksadustat CYP2C8 ve UGT1A9 enzimlerinin yanı sıra BCRP, OATP1B1, OAT1 ve OAT3'ün bir substratıdır. Roksadustat OATP1B3 veya P-gp'nin bir substratı değildir. Roksadustat öncelikle hidroksi-roksadustat ve roksadustat-O-glukuronide metabolize edilir.
İnsan plazmasındaki ana dolaşım bileşeni değişmemiş roksadustattır, insan plazmasında hiçbir saptanabilir metabolit, toplam ilaca bağlı materyal maruziyetinin %10'undan fazlasını oluşturmamıştır ve insana özgü metabolitler gözlemlenmemiştir.
Eliminasyon:
Roksadustatın ortalama etkili yarılanma ömrü (t), KBH hastalarında yaklaşık 15 saattir.
Roksadustatın görünür toplamvücutklirensi(CL/F)diyalizde olmayan KBH hastalarında 1,1
L/s ve diyalizdeki KBH hastalarında 1,4 L/s'dir. Roksadustat ve metabolitleri hemodiyaliz ile
önemli ölçüde uzaklaştırılmamaktadır.
Atılım:
Radyoaktif işaretli roksadustat sağlıklı gönüllülerde oral yoldan uygulandığında, radyoaktivitenin ortalama geri kazanımı %96 (dışkıda %50, idrarda %46) idi. Dışkıda, dozun
%28'i değişmemiş roksadustat olarak atılmıştır. Dozun %2'sinden azı değişmemiş roksadustat olarak idrarda geri kazanılmıştır.
Doğrusallık/doğrusal olmayan durum:
Roksadustat plazma maruziyeti (plazma ilaç konsantrasyonunun zaman eğrisi altındaki alan [EAA] ve maksimum plazma konsantrasyonları (C)) önerilen terapötik doz aralığında dozla orantılıdır. Haftada üç kez dozlama rejiminde kararlı durum roksadustat plazma konsantrasyonları, minimum birikim ile bir haftada (3 doz) elde edilir. Roksadustatın farmakokinetiği zamanla değişmemektedir.
Hastalardaki karakteristik özellikler
Yaş, cinsiyet, vücut ağırlığı ve ırk etkileri:
KBH'ye bağlı anemisi olan yetişkin hastalarda yaş (≥18), cinsiyet, ırk, vücut ağırlığı, böbrek fonksiyonu (eGFR) veya diyaliz durumuna bağlı olarak roksadustat farmakokinetiğinde klinik olarak anlamlı bir fark gözlemlenmemiştir.
Hemodiyaliz:
Diyalize bağımlı KBH'li hastalarda, roksadustat hemodiyalizden 2 saat önce veya 1 saat sonra uygulandığında farmakokinetik parametre değerlerinde belirgin bir fark gözlemlenmemiştir. Diyaliz, genel olarak önemsiz bir roksadustat klirens yoludur.
Karaciğer Yetmezliği
Tek bir 100 mg roksadustat dozunu takiben, normal karaciğer ve böbrek fonksiyonları olan gönüllülere kıyasla orta derecede karaciğer yetmezliği (Child-Pugh Sınıf B) ve normal böbrek fonksiyonu olan gönüllülerde ortalama roksadustat EAA değeri %23 daha yüksek ve ortalama C%16 daha düşüktür. Orta derecede karaciğer yetmezliği (Child-Pugh Sınıf B) ve normal böbrek fonksiyonu olan gönüllüler, sağlıklı gönüllülere kıyasla bağlanmamış roksadustat EAA'da (+%70) bir artış göstermiştir.
Şiddetli karaciğer yetmezliği (Child-Pugh Sınıf C) olan hastalarda roksadustatın farmakokinetiği araştırılmamıştır.
Farmakokinetik/farmakodinamik ilişki(ler)
İlaç etkileşimleri
İn vitro verilere dayanarak, roksadustat, CYP2C8, BCRP, OATP1B1 ve OAT3'ün bir inhibitörüdür (bkz. bölüm 4.5). Rosiglitazon (orta derecede duyarlı CYP2C8 substratı) farmakokinetiği, roksadustat ile birlikte uygulamadan etkilenmemiştir. Roksadustat, intestinal UGT1A1 inhibitörü olabilir, fakat hepatik UGT1A1 inhibitörü değildir ve klinik olarak geçerli konsantrasyonlarda diğer CYP metabolize edici enzimlerin veya taşıyıcıların inhibisyonunu veya CYP enzimlerinin indüksiyonunu göstermemiştir. Oral adsorptif kömür veya omeprazolün roksadustat farmakokinetiği üzerinde klinik olarak anlamlı bir etkisi yoktur. Klopidogrel, KBH'si olan hastalarda roksadustat maruziyeti üzerinde herhangi bir etkiye sahip değildir.
Diğer tıbbi ürünlerin roksadustatüzerindekietkileri
Sağlıklı gönüllülerde gemfibrozil (CYP2C8 ve OATP1B1 inhibitörü) veya probenesid (UGT ve OAT inhibitörü) ile birlikte uygulama, roksadustat EAA'sını 2,3 kat ve C'ı 1,4 kat artırmıştır (bkz. bölüm 4.5).
Sağlıklı deneklerde roksadustatın fosfat bağlayıcılar sevelamer karbonat veya kalsiyum asetat ile birlikte uygulanması, roksadustat EAA'sını sırasıyla %67 ve %46 ve C'ı sırasıyla %66 ve %52 oranında azaltmıştır. Roksadustat, fosfat bağlayıcılar veya kalsiyum, demir, magnezyum veya alüminyum içeren diğer ürünler gibi çok değerlikli katyonlarla bir şelat oluşturabilir. Fosfat bağlayıcıların aşamalı olarak uygulanması (en az 1 saat arayla), sağlıklı gönüllülerde ve KBH'li hastalarda bir popülasyon farmakokinetik analizine dayalı olarak, roksadustat maruziyeti üzerinde klinik olarak anlamlı bir etkiye sahip değildir.
Sağlıklı gönüllülerde yürütülen ilaç etkileşimi çalışmaları, lantanyum karbonat, oral adsorptif kömür veya omeprazolün roksadustat farmakokinetiği üzerinde klinik olarak anlamlı bir etkisi olmadığını göstermiştir. KBH'li hastalarda popülasyon farmakokinetik analizi, klopidogrelin roksadustat maruziyeti üzerinde hiçbir etkisi olmadığını göstermiştir.
Roksadustatın diğer tıbbi ürünler üzerindeki etkileri
Sağlıklı gönüllülerde roksadustatın simvastatin ile birlikte uygulanması simvastatinin EAA ve Cdeğerlerini sırasıyla 1,8 ve 1,9 kat ve simvastatin asidin (simvastatinin aktif metaboliti) EAA ve Cdeğerlerini sırasıyla 1,9 ve 2,8 kat artırmıştır. Roksadustattan 2 saat önce veya 4 veya 10 saat sonra simvastatin uygulandığında da simvastatin ve simvastatin asit konsantrasyonları artmıştır. Roksadustatın rosuvastatin ile birlikte uygulanması, rosuvastatinin EAA ve Cdeğerlerini sırasıyla 2,9 ve 4,5 kat artırmıştır. Roksadustatın atorvastatin ile birlikte uygulanması, atorvastatinin EAA ve Cdeğerlerini sırasıyla 2 ve 1,3 kat artırmıştır.
Roksadustat, diğer statinlerin maruziyetini de artırabilir (bkz. bölüm 4.5).
Bupropion, rosiglitazon ve S-varfarinin (sırasıyla CYP2B6, CYP2C8 ve CYP2C9 için prob substratları) farmakokinetiği roksadustat ile birlikte uygulamadan etkilenmemiştir.
5.3. Klinik öncesi güvenlilik verileri
Tekrarlı doz toksisite çalışmaları
Sprague-Dawley veya Fisher sıçanlarında yapılan 26 haftalık aralıklı tekrarlı doz çalışmasında, Maksimum Tavsiye Edilen İnsan Dozunda (MRHD) toplam EAA'nın yaklaşık 4-6 katı olan dozda roksadustat, aort ve atriyoventriküler kapakçık (A-V) valvülopatileri dahil olmak üzere histopatolojik bulgularla sonuçlanmıştır. Bu bulgular, sonlandırma sırasında hayatta kalan hayvanlarda ve aynı zamanda ölmek üzere olduğu için hayatı erken sonlandırılan hayvanlarda görülmüştür. Ayrıca, 30 günlük bir iyileşme döneminin sonundaki hayvanlarda da mevcut olduğu için, bulgular tamamen geri dönüşümlü olmamıştır.
Sağlıklı hayvanlarda tekrarlı doz toksisite çalışmalarında, aşırı eritropoez ile sonuçlanan aşırı farmakoloji gözlemlenmiştir.
Sıçanlarda, MRHD'deki toplam EAA'nın yaklaşık 2 katında, dolaşımdaki trombositlerde azalmaların yanı sıra, aktif haldeki kısmi tromboplastin zamanı ve protrombin zamanında artışlar gibi hematolojik değişiklikler gözlenmiştir. Kemik iliğinde (sıçanlarda MRHD'de toplam EAA'nın yaklaşık 7 katı sistemik maruziyet), böbreklerde (sıçanlarda MRHD'de toplam EAA'nın yaklaşık 5 ila 6 katı sistemik maruziyet), akciğerlerde (sıçanlarda ve Cynomolgus maymunlarda MRH'de toplam EAA'nın sırasıyla 8 ve 2 katı sistemik maruziyet) ve kalpte (sıçanlarda MRHD'de toplamEAA'n ınyaklaşık4ila6katı sistemik maruziyet) pıhtılar
gözlenmiştir.
Beyin güvenliliği
Sprague-Dawley sıçanlarında gerçekleştirilen 26-haftalık aralıklı tekrar doz çalışmasında, MRHD'de toplam EAA'nın yaklaşık 6 katında bir hayvanda beyin nekrozu ve glioz histolojik bulgusu görülmüştür. Aynı süre boyunca tedavi edilen Fisher sıçanlarında, MRHD toplam EAA'nın yaklaşık 3 â 5 katında toplam dört hayvanda beyin/hipokampal nekroz gözlenmiştir.
22 veya 52 hafta süreyle aralıklı olarak roksadustat uygulanan Cynomolgus maymunları, MRHD'de toplam EAA'nın yaklaşık 2 katına kadar sistemik maruziyetlerde benzer bulgular göstermemiştir.
Karsinojenisite ve mutajenisite
Roksadustat, insan eşdeğer dozuna dayanarak MRHD'nin 40 katında farelerde in vitro Ames mutajenisite testinde, insan periferik kan lenfositlerinde in vitro kromozom anomalisi testinde ve in vivo mikronükleus testinde negatif olmuştur.
Fare ve sıçan karsinojenisite çalışmalarında, hayvanlara haftada üç defa klinik doz rejimi ile roksadustat uygulanmıştır. Roksadustatın kemirgenlerde hızlı klirensi nedeniyle, dozlama periyodu boyunca sistemik maruziyetler kesintisiz olmamıştır. Bu nedenle, olası hedef dışı karsinojenik etkiler göz ardı edilmiş olabilir.
2 yıllık fare karsinojenisite çalışmasında, düşük ve yüksek doz gruplarında (sistemik maruziyetler MRHD'de toplam EAA'nın yaklaşık 1 katı ve yaklaşık 3 katı) akciğer bronkoalveolar karsinoma insidansında anlamlı artışlar kaydedilmiştir. Yüksek doz grubundaki dişilerde (sistemik maruziyetler MRHD'de toplam EAA'nın yaklaşık 3 katı) subkutis fibrosarkomunda anlamlı bir artış görülmüştür.
2 yıllık sıçan karsinojenisite çalışmasında, orta doz seviyesinde (sistemik maruziyet MRHD'de toplam EAA'nın 1 katından daha az) meme bezi adenomu insidansında anlamlı bir artış gözlenmiştir. Bununla birlikte, bulgu doza bağlı değildir ve bu tümör tipinin insidansı test edilen en yüksek doz seviyesinde (sistemik maruziyet MRHD'de toplam EAA'nın yaklaşık 2 katı) daha düşük olmuştur ve bu nedenle bahsi geçen test ilacı ile ilgili olarak değerlendirilmemiştir.
Fare ve sıçan karsinojenisite çalışmalarından elde edilen benzer bulgular klinik çalışmalarda gözlenmemiştir.
Üreme ve gelişimsel toksisite
Roksadustatın tedavi edilen erkek veya dişi sıçanlarda MRHD'deki insan maruziyetinin yaklaşık 4 katında çiftleşme veya fertilite üzerinde hiçbir etkisi olmamıştır. Bununla birlikte, erkek sıçanlarda NOAEL'de, erkek fertilitesi üzerinde herhangi bir etki olmaksızın epididimis ve seminal veziküllerin (sıvı dolu) ağırlıklarında azalmalar olmuştur. Erkek üreme organı ile ilgili herhangi bir bulgu için NOEL MRHD'nin 1,6 katı olmuştur. Dişi sıçanlarda bu doz seviyesinde, kontrol hayvanlarına kıyasla cansız embriyoların sayısında ve implantasyon sonrası kayıplarda artış olmuştur.
Sıçan ve tavşanlarda üreme ve gelişimsel toksisite çalışmalarından elde edilen sonuçlar, ortalama fetal veya yavru vücut ağırlığının azaldığını, plasental ağırlık artışının, kürtaj ve yavru ölümlerinin ortalama düzeyde olduğunu göstermiştir.
İmplantasyondan sert damağın kapanmasına kadar (gebeliğin 7 â 17. günleri) roksadustat
![]()
fetal vücut ağırlığında azalma ve iskelet değişikliklerinde artış göstermiştir. Roksadustatın
5
implant sonrası fetal sağkalım üzerinde herhangi bir etkisi olmamıştır.
Hamile Yeni Zelanda tavşanlarına, gebeliğin 7. gününden 19. gününe kadar günlük olarak roksadustat uygulanmıştır ve gebeliğin 29. gününde sezaryen işlemi gerçekleştirilmiştir. MRHD'deki toplam EAA'nın yaklaşık 3 katına kadar sistemik maruziyetlerde roksadustat uygulaması, hiçbir embriyo-fetal bulgu göstermemiştir. Bununla birlikte, bir tavşan MRHD'deki toplam EAA'nın yaklaşık 1 katında ve 2 dişi ise MRHD'deki toplam EAA'nın yaklaşık 3 katında düşük yapmıştır. Düşük doğum yapan tavşanlar zayıf vücut yapısında oldukları gözlenmiştir.
Sprague-Dawley sıçanlarında gerçekleştirilen perinatal/postnatal gelişim çalışmasında, gebe dişilere gebeliğin 7. gününden emzirmenin 20. gününe kadar günlük roksadustat uygulanmıştır. Laktasyon döneminde, MRHD'deki toplam C'ın yaklaşık 2 katı roksadustat uygulanan dişilerin doğurduğu yavrular, sütten kesim öncesi dönemde yüksek mortalite oranı göstermiştir ve sütten kesimde sakrifiye edilmiştir. MRHD'de insan maruziyetinin yaklaşık 3 katı ile sonuçlanan sistemik maruziyet dozlarında roksadustat uygulanan dişilerin doğurduğu yavrular, kontrol grubundaki dişilerin doğurduğu yavrularla karşılaştırıldığında, doğumdan sonraki 21- günlük hayatta kalma süresinde (laktasyon indeksi) anlamlı bir düşüş gösterilmiştir.
Çapraz-besleme çalışmasında, sıçan yavrularının canlılığı üzerindeki en belirgin etkiler, yalnızca doğum sonrası roksadustata maruz bırakılan yavrularda kaydedilmiştir ve doğuma kadar roksadustata maruz bırakılan yavruların canlılığı, maruz kalmayan yavrularınkinden daha düşük olmuştur.
Maruz bırakılmayan sıçanlardan elde edilen yavruların roksadustat (insan eşdeğer dozu yaklaşık 2 katı MRHD) ile tedavi edilen anne sıçanlarla çapraz beslendiği çapraz besleme çalışmasında, yavru plazmasında roksadustat görülmüş olup, bu durum ilacın süt yoluyla transfer edildiğini göstermektedir. Bu anne sıçanlardan elde edilen sütlerde roksadustat mevcuttur. Roksadustat içeren süte maruz bırakılan yavrular, tedavi edilmeyen anne sıçanlarla çapraz beslenen anne sıçanlardan elde edilen yavrulara kıyasla (%98,5), daha düşük bir sağkalım oranı (%85,1) göstermiştir. Laktasyon döneminde roksadustata maruz kalan ve sağkalan yavruların ortalama vücut ağırlığı da kontrol yavrularınınkinden daha düşük olmuştur (uterus içi maruziyet yok â süt maruziyeti yok).
Kardiyovasküler güvenlilik
Bir kardiyovasküler güvenlilik farmakolojisi çalışmasında, maymunlara tek bir 100 mg/kg roksadustat uygulamasının ardından kalp atım hızı artışları gösterilmiştir. hERG veya EKG üzerinde hiçbir etkisi olmamıştır. Sıçanlarda yapılan ek güvenlilik farmakolojisi çalışmaları, roksadustatın MRHD'deki maruziyetin yaklaşık altı katından itibaren, total periferik direnci azalttığını ve ardından kalp atım hızında refleks bir artış olduğunu göstermiştir.
 HIV ve Aids
HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan
Virüsdür). Bu virüs AIDS hastalığına sebep olur.
HIV ve Aids
HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan
Virüsdür). Bu virüs AIDS hastalığına sebep olur. |
 Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir.
Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir. |
İLAÇ GENEL BİLGİLERİ
Astellas Pharma İlaç Ticaret Ve Sanayi A.Ş
| Satış Fiyatı | 4266.58 TL [ 10 May 2024 ] |
| Önceki Satış Fiyatı | 4266.58 TL [ 3 May 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Kısıtlanmış Beyaz Reçeteli bir ilaçdır. |
| Barkodu | 8699043890505 |
| Etkin Madde | Roksadustat |
| ATC Kodu | B03XA05 |
| Birim Miktar | 100 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 12 |
| Kan ve Kan Yapıcı Organlar > Diğer Anemi İlaçları |
| İthal ( ref. ülke : Hollanda ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Omurilik zedelenmeleri Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir. |
 |
Aşırı Alkol Kullanımı, Alkolizm Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür. Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması gerekmez. |
 |
İnme İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına yol açar. |