COPELLOR 80 mg/1 ml enjeksiyonluk çözelti içeren kullanıma hazır kalem (3 kalem) Farmakolojik Özellikler
{ Iksekizumab }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: İmmünosüpresanlar, interlökin inhibitörleri ATC kodu: L04AC13
Etki mekanizması
Ixekizumab, interlökin 17A'ya (IL-17A ve IL-17A/F) yüksek afinite (< 3 pM) ve özgüllükle bağlanan bir IgG4 monoklonal antikorudur. IL-17A'nın yüksek konsantrasyonları, keratinosit proliferasyonu ve aktivasyonunu uyararak psöriyazis patogenezinden olduğu gibi eroziv kemik hasarına ve patolojik yeni kemik oluşumuna yol açan inflamasyonu tetikleyerek aksiyel spondiloartrit ve psöriyatik artrit patogenezinden de sorumlu tutulmuştur. Ixekizumabın IL- 17A'yı nötralize etmesi bu etkileri inhibe etmektedir. Ixekizumab IL-17B, IL-17C, IL-17D, IL- 17E ya da IL-17F ligandlarına bağlanmaz.
İn vitro bağlanma testleri ixekizumabın insan Fcγ reseptörleri I, IIa ve IIIa'ya veya kompleman bileşeni C1q'ya bağlanmadığını doğrulamıştır.
Farmakodinamik etkiler
Ixekizumab, IL-17A ile indüklenen ya da düzenlenen biyolojik yanıtları modüle eder. Yapılan bir faz I çalışmasından elde edilen psöriyatik deri biyopsisi verilerine dayanarak, başlangıçtan
43. güne kadar epidermis kalınlığındaveprolifereolankeratinosit sayısında, T hücreleri ve
dendritik hücre sayısında azalmanın yanı sıra lokal enflamatuvar belirteçlerde azalma yönünde doza bağımlı bir eğilim bulunmuştur. Doğrudan sonuç olarak ixekizumab tedavisi psöriyazis plak lezyonlarında bulunan eritem, endurasyon ve deskuamasyonu azaltmaktadır.
COPELLOR'un inflamasyon belirteçlerinden C reaktif protein düzeylerini düşürdüğü (tedavinin 1 haftası içinde) gösterilmiştir.
Klinik etkililik ve güvenlilik
Yetişkinlerde plak psöriyazis
COPELLOR'un etkililik ve güvenliliği fototerapi ya da sistemik tedavi önerilen orta ila ağır plak tipi psöriyazisli yetişkin hastaların (N=3.866) yer aldığı randomize, çift kör, plasebo kontrollü üç faz III çalışmada değerlendirilmiştir (UNCOVER-1, UNCOVER-2 ve UNCOVER-3). COPELLOR'un etkililik ve güvenliliği etanerseptle karşılaştırılarak da değerlendirilmiştir (UNCOVER-2 ve UNCOVER-3). COPELLOR almak üzere randomize edilen ve 12. haftada sPGA (static Physician Global Assessment) (0,1) yanıtı olan hastalar 48 haftalık ekstra bir süre boyunca plasebo ya da COPELLOR almak üzere tekrar randomize edilmiş (UNCOVER-1 ve UNCOVER-2); plasebo, etanersept ya da COPELLOR almak üzere randomize edilmiş olup sPGA (0,1) yanıtı görülmeyen hastalara ise 48 hafta daha COPELLOR uygulanmıştır. Ek olarak, çalışmanın tamamına katılan hastalarda toplam 5 yıla kadar, uzun dönem etkililik ve güvenlilik her üç çalışmada da değerlendirilmiştir.
Hastaların %64'ünün daha önce sistemik tedavi (biyolojik, konvansiyonel sistemik ya da psoralen ve ultaviyole A (PUVA)), %43,5'inin fototerapi, %49,3'ünün konvansiyonel sistemik tedavi ve %26,4'ünün biyolojik tedavi almış olduğu kaydedilmiştir. %14,9'unun en az bir anti- TNF alfa ajan ve %8,7'sinin bir anti-IL-12/IL-23 almış olduğu belirlenmiştir. Hastaların
%23,4'ünde başlangıçta psöriyatik artrit öyküsü kaydedilmiştir.
Üç çalışmada da bileşik primer sonlanım noktaları 12. haftada plaseboya kıyasla PASI (Psöriyazis Alan Şiddet İndeksi) 75 yanıtına ve â0â ("temiz") ya da 1 ("minimal") sPGA yanıtına ulaşan hasta oranı olarak belirlenmiştir. Medyan başlangıç PASI skoru 17,4 ile 18,3 arasında değişmiş; hastaların %48,3 ila %51,2'sinde başlangıç sPGA skorunun şiddetli ila çok şiddetli olup ortalama başlangıç kaşıntı Sayısal Derecelendirme Ölçeğinin (kaşıntı NRS) 6,3 ile 7,1 arasında olduğu kaydedilmiştir.
12. haftada Klinik Yanıt
UNCOVER-1 çalışmasında 1296 hasta, 12 hafta süresince plasebo ya da COPELLOR (160 mg başlangıç dozunun ardından iki ya da dört haftada bir 80 mg [Q2W ya da Q4W]) almak üzere randomize (1:1:1) edilmiştir.
Tablo 2. UNCOVER-1 Çalışmasında 12. Haftadaki Etkililik Sonuçları
Sonlanım noktaları | Hasta Sayısı (%) | Yanıt Oranındaki Plasebodan Farkı (%95 GA) | |||
Plasebo (N = 431) | COPELLOR 80 mg Q4W (N = 432) | COPELLOR 80 mg Q2W (N = 433) | COPELLOR 80 mg Q4W | COPELLOR 80 mg Q2W | |
sPGA "0" (temiz) ya da "1" (minimal) |
14 (3,2) |
330 (76,4) |
354 (81,8) | 73,1 (68,8 ; 77,5) | 78,5 (74,5 ; 82,5) |
sPGA "0" (temiz) | 0 | 149 (34,5) | 160 (37) | 34,5 (30 ; 39) | 37 (32,4 ; 41,5) |
PASI 75 | 17 (3,9) | 357 (82,6) | 386 (89,1) | 78,7 (74,7 ; 82,7) | 85,2 (81,7 ; 88,7) |
PASI 90 | 2 (0,5) | 279 (64,6) | 307 (70,9) | 64,1 (59,6 ; 68,7) | 70,4 (66,1 ; 74,8) |
PASI 100 | 0 | 145 (33,6) | 153 (35,3) | 33,6 (29,1 ; 38) | 35,3 (30,8 ; 39,8) |
Kaşıntı NRS azalması ≥ 4 | 58 (15,5) | 305 (80,5) | 336 (85,9) | 65 (59,5 ; 70,4) | 70,4 (65,4 ; 75,5) |
Kısaltmalar: N = Tedavi yönelimli popülasyondaki hasta sayısı
Not: Eksik veriye sahip olan hastalar cevap vermeyen olarak sayılmıştır.
= 379, COPELLOR 80 mg Q2W N = 391
UNCOVER-2 çalışmasında 1224 hasta, 12 hafta süresince plasebo, COPELLOR (160 mg başlangıç dozunun ardından iki veya dört haftada bir 80 mg [Q2W ya da Q4W]) veya haftada iki kez etanersept 50 mg almak üzere randomize (1:2:2:2) edilmiştir.
Tablo 3. UNCOVER-2 Çalışmasında 12. Haftadaki Etkililik Sonuçları
Sonlanım noktaları | Hasta Sayısı (%) | Yanıt Oranındaki Plasebodan Farkı (%95 GA) | ||||
Plasebo (N = 168) | COPELLO R 80 mg Q4W (N = 347) | COPELLO R 80 mg Q2W (N = 351) | Etanersept 50 mg, haftada iki kez (N = 358) | COPELLOR 80 mg Q4W | COPELLOR 80 mg Q2W | |
sPGA "0" (temiz) ya da "1" (minimal) |
4 (2,4) |
253 (72,9) |
292 (83,2) |
129 (36) | 70,5 (65,3 ; 75,7) | 80,8 (76,3 ; 85,4) |
sPGA "0" | 1 (0,6) | 147(41,9) | 31,7 | 41,3 | ||
PASI 75 | 4 (2,4) | 269 (77,5) | 315 (89,7) | 149 (41,6) | 75,1 (70,2 ; 80,1) | 87,4 (83,4 ; 91,3) |
PASI 90 | 1 (0,6) | 207 (59,7) | 248 (70,7) | 67 (18,7) | 59,1 (53,8 ; 64,4) | 70,1 (65,2 ; 75) |
PASI 100 | 1 (0,6) | 107 (30,8) | 142 (40,5) | 19 (5,3) | 30,2 (25,2 ; 35,2) | 39,9 (34,6 ; 45,1) |
Kaşıntı NRS azalması ≥ 4 | 19 (14,1) | 225 (76,8) | 258 (85,1) | 177 (57,8) | 62,5 (55,1 ; 70,3) | 71,1 (64 ; 78,2) |
Kısaltmalar: N = tedavi yönelimli popülasyondaki hasta sayısı
Not: Eksik veriye sahip olan hastalar cevap vermeyen olarak sayılmıştır.
= 293, COPELLOR 80 mg Q2W N = 303, Etanersept N = 306
UNCOVER-3 çalışmasında 1346 hasta , 12 hafta süresince plasebo, COPELLOR (160 mg başlangıç dozunun ardından iki veya dört haftada bir 80 mg [Q2W ya da Q4W]) veya haftada iki kez etanersept 50 mg almak üzere randomize (1:2:2:2) edilmiştir.
Tablo 4. UNCOVER-3 Çalışmasında 12. Haftadaki Etkililik Sonuçları
Sonlanım noktaları |
Hasta Sayısı (%) | Yanıt Oranındaki Plasebodan Farkı (%95 GA) | ||||
Plasebo (N = 193) |
COPELLOR 80 mg Q4W (N = 386) |
COPELLOR 80 mg Q2W (N = 385) | Etanersept 50 mg haftada iki kez (N = 382) |
COPELLOR 80 mg Q4W |
COPELLOR 80 mg Q2W | |
sPGA "0" (temiz) ya da "1" (minimal) |
13 (6,7) |
291 (75,4) |
310 (80,5) |
159 (41,6) | 68,7 (63,1 ; 74,2) | 73,8 (68,5 ; 79,1) |
sPGA "0" (temiz) | 0 | 139 (36) | 155 (40,3) | 33 (8,6) | 36 (31,2 ; 40,8) | 40,3 (35,4 ; 45,2) |
PASI 75 | 14 (7,3) | 325 (84,2) | 336 (87,3) | 204 (53,4) | 76,9 (71,8 ; 82,1) | 80 (75,1 ; 85) |
PASI 90 | 6 (3,1) | 252 (65,3) | 262 (68,1) | 98 (25,7) | 62,2 (56,8 ; 67,5) | 64,9 (59,7 ; 70,2) |
PASI 100 | 0 | 135 (35) | 145 (37,7) | 28 (7,3) | 35 (30,2 ; 39,7) | 37,7 (32,8 ; 42,5) |
Kaşıntı NRS Azalması ≥4 | 33 (20,9) | 250 (79,9) | 264 (82,5) | 200 (64,1) | 59 (51,2 ; 66,7) | 61,6 (54,0 ; 69,2) |
Kısaltmalar: N = tedavi yönelimli popülasyondaki hasta sayısı
Not: Eksik veriye sahip olanhastalarcevapvermeyenolaraksayılmıştır.
= 313, COPELLOR 80 mg Q2W N = 320, Etanersept N = 312
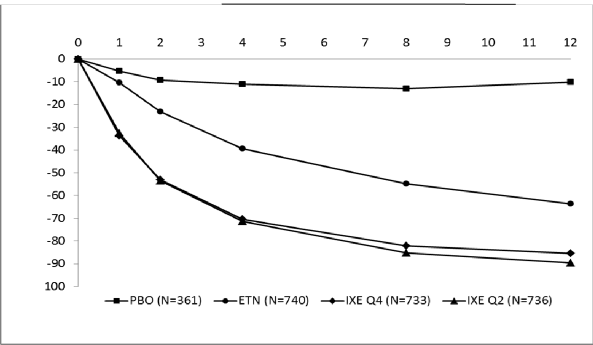
COPELLOR 2. haftada ortalama PASI'de >%50 azalmayla hızlı başlangıçlı etkililik göstermiştir (Şekil 1). COPELLOR ile PASI 75'e ulaşan hasta yüzdesi daha 1. haftada plasebo ve etanersepte kıyasla anlamlı ölçüde yüksek bulunmuştur. COPELLOR ile tedavi edilen hastaların yaklaşık %25'inde 2. haftada <5 PASI skoruna ulaşılmış, 4. haftada %55'ten fazlasında <5 PASI skoruna ulaşılmış ve 12. haftada bu oran %85'e çıkmıştır (etanersept için
%3, %14 ve %50). COPELLOR ile tedavi edilen hastalarda 1. haftada kaşıntıda anlamlı düzelmeler görülmüştür.
Tedavi Haftası
Şekil 1. İndüksiyon Dozlama Döneminde Tedavi Yönelimli Popülasyonda Başlangıç Sonrası Her Vizitte (mBOCF) PASI Skoru, Düzelme Yüzdesi - UNCOVER-2 ve UNCOVER-3
COPELLOR'un etkililik ve güvenliliği yaş, cinsiyet, ırk, vücut ağırlığı, başlangıçtaki PASI şiddet derecesi, plak bölgesi, eş zamanlı psöriyatik artrit ve önceden uygulanan biyolojik tedaviden bağımsız olarak ortaya konmuştur. COPELLOR sistemik tedavi görmemiş, biyolojik ürün kullanmamış, biyolojik/anti-TNF'ye maruz kalmış ve biyolojik/anti-TNF'yle başarısız olunmuş hastalarda etkili olmuştur.
UNCOVER-2 çalışmasında 12. haftada sPGA (0,1) etanersepte yanıtsız olduğu belirlenen (N
= 200) ve 4 haftalık arınma döneminden sonra COPELLOR 80 mg Q4W'ye geçen hastaların sırasıyla %73 ve %83,5'inde 12 haftalık COPELLOR tedavisinden sonra sPGA (0,1) ve PASI 75 elde edilmiştir.
Aktif komparatörün yer aldığı 2 klinik çalışmada (UNCOVER-2 ve UNCOVER-3), ciddi advers olayların oranı etanersept ve COPELLOR için %1,9 olup advers olaylara bağlı ilacı bırakma oranı etanersept için %1,2 ve COPELLOR için %2 bulunmuştur. Enfeksiyon oranı etanersept için %21,5 ve COPELLOR için %26 olup ciddi enfeksiyon oranı etanersept için
%0,4 ve COPELLOR için %0,5 olmuştur.
Yanıtın 60. Haftada ve 5 Yıla Kadar Korunması
UNCOVER-1 ve UNCOVER-2'de normalde COPELLOR için randomize edilen ve 12. haftada yanıt veren hastalar (sPGA skoru 0,1) 48 hafta daha plasebo ya da COPELLOR (dört ila on iki haftada bir 80 mg [Q4W ya da Q12W]) tedavi rejimlerinden birini almak üzere tekrar randomize edilmiştir.
On ikinci haftada sPGA (0,1) yanıtı veren ve tedaviden çekilmek üzere yeniden randomize edilenlerde relapsa kadar geçen medyan süre UNCOVER-1 ve UNCOVER-2 çalışmaları entegre edildiğinde (sPGA ≥ 3) 164 gün olarak belirlenmiştir. Bu hastaların %71,5'i COPELLOR 80 mg Q4W ile tekrar tedaviye başlandıktan sonra 12 hafta içinde en az sPGA (0,1) yanıtını geri kazanmıştır.
Tablo 5. 60. Haftada Yanıt ve Etkililiğin Korunması (UNCOVER-1 ve UNCOVER-2 çalışmaları)
Sonlanım noktaları |
Hasta Sayısı (%) | Yanıt Oranındaki Plasebodan Farkı (%95 GA) | ||||
80 mg Q4W (indüksiyon) / Plasebo (idame) (N=191) | 80 mg Q2W (indüksiyon) / Plasebo (idame) (N=211) | 80 mg Q4W (indüksiyon) / 80 mg Q4W (idame) (N=195) | 80 mg Q2W (indüksiyon) / 80 mg Q4W (idame) (N=221) | 80 mg Q4W (indüksiyon) / 80 mg Q4W (idame) | 80 mg Q2W (indüksiyon) / 80 mg Q4W (idame) | |
İdame Ettirilen sPGA "0" (temiz) ya da "1" (minimal) |
12 (6,3) |
16 (7,6) |
134 (68,7) |
173 (78,3) |
62,4 (55,1 ; 69,8) |
70,7 (64,2 ; 77,2) |
İdame Ettirilen ya da Ulaşılan sPGA 0 (temiz) |
3 (1,6) |
6 (2,8) |
96 (49,2) |
130 (58,8) |
47,7 (40,4 ; 54,9) |
56 (49,1 ; 62,8) |
İdame Ettirilen ya da Ulaşılan PASI 75 |
15 (7,9) |
19 (9) |
145 (74,4) |
184 (83,3) |
66,5 (59,3 ; 73,7) |
74,3 (68 ; 80,5) |
İdame Ettirilen ya da Ulaşılan PASI 90 |
9 (4,7) |
10 (4,7) |
130 (66,7) |
169 (76,5) |
62 (54,7 ; 69,2) |
71,7 (65,4 ; 78) |
İdame Ettirilen ya da Ulaşılan PASI 100 |
3 (1,6) |
6 (2,8) |
97 (49,7) |
127 (57,5) |
48,2 (40,9 ; 55,4) |
54,6 (47,7 ; 61,5) |
Kısaltmalar: N = analiz popülasyonundaki hasta sayısı
Not: Eksik veriye sahip olan hastalar cevap vermeyen olarak sayılmıştır
COPELLOR'un sistemik tedavi görmemiş, biyolojik ajan kullanmamış, biyolojik/anti-TNF'ye maruz kalmış ve biyolojik/anti-TNF'yle başarısız olunmuş hastalardaki etkililiği korunmuştur.
Tırnak psöriyazisinde (Tırnak Psöriyazis Şiddet İndeksi [NAPSI] ile değerlendirilen), kafa derisi psöriyazisinde (Psöriyazis Kafa Derisi Şiddet İndeksi [PSSI] ile değerlendirilen) ve palmoplantar psöriyaziste (Psöriyazis Palmoplantar Şiddet İndeksi [PPASI] ile değerlendirilen) plaseboya ve etanersepte kıyasla 12. haftada başlangıca göre anlamlı derecede yüksek düzelmeler olduğu ortaya konmuştur ve COPELLOR ile tedavi edilip 12. haftada sPGA (0,1) yanıtı veren hastalarda 60. haftada korunmuştur.
UNCOVER-1, UNCOVER-2 ve UNCOVER-3 çalışmasında, Başlangıç Dönemi sırasında Copellor Q2W ve sonrasında Q4W alan 591 kişiden 427'si 5 yıllık Copellor tedavisini tamamlamıştır ve bunlardan 101'inde doz artışı gerekmiştir. İki yüz altmış dördüncü hafta değerlendirmesini tamamlayan hastalardan (N=427), 295 (%69), 289 (%68) ve 205 (%48) hastada, 264. haftada sırasıyla sPGA (0,1), PASI 90 ve PASI 100 yanıtı olduğu görülmüştür. UNCOVER-1 ve UNCOVER-2'de İndüksiyon Döneminden sonra DLQI toplanmıştır, 113 hastada (%66) DLQI (0,1) yanıtı olduğu gözlenmiştir.
Yaşam Kalitesi/Hasta Tarafından Bildirilen Sonuçlar
12. haftada ve çalışmaların tamamında COPELLOR, Dermatoloji Yaşam Kalitesi İndeksinde (DLQI) başlangıca göre ortalama azalma aralıklarıyla değerlendirilen Sağlıkla İlgili Yaşam Kalitesinde istatistiksel olarak anlamlı düzelmeler ile ilişkili bulunmuştur (COPELLOR 80 mg Q2W -10,2'den -11,1'e, COPELLOR 80 mg Q4W -9,4'ten - 10,7'ye, etanersept -7,7'den -8,0'a ve plasebo -1,0'dan -2,0'a). COPELLOR ile tedavi edilen hastaların anlamlı ölçüde yüksek bir bölümünde DLQI 0 veya 1 elde edilmiştir. Çalışmalar genelinde COPELLOR ile tedavi edilen hastaların anlamlı ölçüde yüksek bir bölümünde 12. Haftada Kaşıntı NRS≥4 noktalarında azalma elde edilmiş (COPELLOR Q2W için %84,6, COPELLOR Q4W için %79,2 ve plasebo için %16,5) ve COPELLORiletedaviedilen12. haftadasPGA(0 veya 1) yanıtı olan hastalarda
değerlendirilen 60. haftaya kadar COPELLOR ile tedavide depresyonun kötüleştiğine dair bir kanıt bulunamamıştır.
Pazarlama Sonrası doğrudan karşılaştırma çalışmaları
IXORA-S: Çift kör bir çalışmada, Copellor'un primer çalışma amacı 12. haftada PASI 90 yanıtı (Tablo 6) bakımından ustekinumaba üstün olduğu gösterilmiştir. Yanıt başlangıcı PASI 75 için 2. hafta gibi erken bir süreyle (p <0,001), PASI 90 ve PASI 100 için de 4. haftaya kadar olmak üzere üstün bulunmuştur (p <0,001). Copellor'un ustekinumaba kıyasla üstünlüğü vücut ağırlığına göre gruplanan alt gruplarda da ortaya konmuştur.
Tablo 6. Ixekizumab ve Ustekinumab Karşılaştırma Çalışmasında PASI Yanıt Oranları
| 12. hafta | 24. hafta | 52. hafta | |||
| Copellor* | Ustekinumab ** | Copellor * | Ustekinumab ** | Copellor* | Ustekinumab* * |
Hastalar (n) | 136 | 166 | 136 | 166 | 136 | 166 |
PASI 75, n (%) | 120 (%88,2) | 114 (%68,7) | 124 (%91,2) | 136 (%81,9) | 120 (%88,2) | 126 (%75,9) |
PASI 90, n (%) | 99 (%72,8) | 70 (%42,2) | 113 (%83,1) | 98 (%59) | 104 (%76,5) | 98 (%59) |
PASI 100, n (%) | 49 (%36) | 24 (%14,5) | 67 (%49,3) | 39 (%23,5) | 71 (%52,2) | 59 (%35,5) |
* Ixekizumab 160 mg yükleme dozu olarak verilmiş, ardından 2, 4, 6, 8, 10 ve 12. haftalarda 80 mg, daha sonra da Q4W 80 mg verilmiştir
** Vücut ağırlığına dayalı dozlama: Ustekinumab tedavisi alan hastalara 0 ve 4. haftalarda ve daha sonra 52. haftaya kadar 12. haftada bir 45 mg veya 90 mg uygulanmıştır (onaylı pozolojiye göre vücut ağırlığına bağlı olarak)
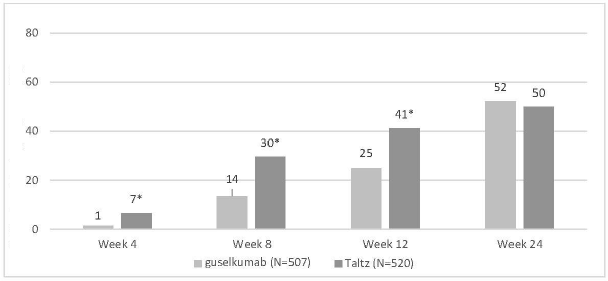
IXORA-R: Copellor'un etkililiği ve güvenliliği, Copellor'u guselkumab ile karşılaştıran 24 haftalık randomize, çift kör, paralel gruplu bir çalışmada da araştırılmıştır; Copellor, 4. haftadan itibaren tam cilt temizliği elde etmede ve birincil çalışma hedefinde (12. haftada PASI 100) üstündür ve 24. haftada PASI 100'de daha düşük değildir (Tablo 7).
Tablo 7. İxekizumab ile Guselkumab Karşılaştırmalı Çalışmasından Etkililik Yanıtları, Tedavi Amaçlı Popülasyon
Sonlanım Noktası |
Zaman | Guselkumab (N=507) yanıt, n (%) | Ixekizumab (N=520) yanıt, n (%) | Fark (IXE - GUS), % (CI) |
p-değeri | ||
Primer Hedefler | |||||||
PASI 100 | 12. hafta | 126 (24,9) | 215 | (41,3) | 16,5 | (10,8 ; 22,2) | <0,001 |
Majör Sekonder Hedefler | |||||||
PASI 75 | 2. hafta | 17,8 | (13,7 ; 21,8) | <0,001 | |||
PASI 90 | 4. hafta | 40 (7,9) | 109 | (21) | 13,1 | (8,9 ; 17,3) | <0,001 |
PASI 100 | 4. hafta | 7 (1,4) | 35 | (6,7) | 5,4 | (3 ; 7,7) | <0,001 |
PASI 90 | 8. hafta | 182 (35,9) | 304 | (58,5) | 22,6 | (16,6 ; 28,5) | <0,001 |
sPGA (0) | 12. hafta | 128 (25,2) | 218 | (41,9) | 16,7 | (11 ; 22,4) | <0,001 |
PASI 50 | 1. hafta | 47 (9,3) | 143 | (27,5) | 18,2 | (13,6 ; 22,8) | <0,001 |
PASI 100 | 8. hafta | 69 (13,6) | 154 | (29,6) | 16 | (11,1 ; 20,9) | <0,001 |
PASI 100 | 24. hafta | 265 (52,3) | 260 | (50) | -2,3 | (-8,4 ; 3,8) | 0,414 |
Kısaltmalar: CI = güven aralığı; GUS = guselkumab; IXE = ixekizumab; N = analiz popülasyonundaki hasta sayısı; n = belirtilen kategorideki hasta sayısı; PASI = Psöriyazis Alan Şiddet İndeksi; sPGA = statik Hekimin Genel Değerlendirmesi.
24. hafta
12. hafta
8. hafta
4. hafta
Şekil 2: 4, 8, 12 ve 24. Haftalarda PASI 100, NRI
*4, 8 ve 12. haftalarda guselkumab'a karşı p<0,001 NRI = Yanıt Vermeyen İmputasyonu
Genital Psöriyaziste Etkililik
Orta ila şiddetli genital psöriyazis (Genital sPGA skoru ≥3) bulunan, vücut yüzey alanının (VYA) minimum %1'i etkilenmiş (%60,4'ünde etkilenen VYA ≥%10) ve genital psöriyazis için önceden en az bir topikal tedaviyle başarısızlık ya da intolerans kaydedilmiş 149 yetişkin hastanın (%24 kadın) yer aldığı randomize, çift kör, plasebo kontrollü bir çalışma (IXORA-Q) yapılmıştır. Hastalarda en az 6 aydır ve en az orta dereceli olmak üzere plak psöriyazis (sPGA skoru ≥3 ve fototerapi ve/veya sistemik tedavi adayı olma şeklinde tanımlı) kaydedilmiştir.
COPELLOR tedavisine randomize edilen hastalar ilk doz olarak 160 mg ve ardından 12 hafta süreyle 2 haftada bir 80 mg almıştır. Primer sonlanım noktası genital organlarda sPGA için en az "0â (temiz) veya â1â (minimal) yanıt (genital sPGA 0/1) elde eden hastaların oranıdır. On ikinci haftada, COPELLOR grubunda plasebo grubuna kıyasla anlamlı derecede daha fazla sayıda hasta genital sPGA 0/1 ve başlangıç VYA değerinden bağımsız genital sPGA 0/1 elde etmiştir (sırasıyla başlangıçtaVYA%1-<%10,≥%10:genitalsPGA â0' veya â1': COPELLOR
büyük bir bölümü genital organlarda ağrı, genital organlarda kaşıntı, genital psöriyazisin cinsellik üzerine etkisi, Dermatoloji Yaşam Kalitesi İndeksi (DLQI) ve hasta tarafından bildirilen sonuçlarda (Patient Reported Outcomes - PRO) azalma elde etmiştir.
Tablo 8. IXORA-Q Çalışmasında Genital Psöriyazisli Yetişkinlerde 12. Haftada Etkililik Bulguları; NRI
Sonlanım noktaları | COPELLOR | Plasebo | Plaseboya kıyasla fark (%95 GA) |
Randomize edilen hasta sayısı (N) | N=75 | N=74 |
|
Genital organlarda sPGA â0â veya â1â | %73 | %8 | %65 (%53, %77) |
sPGA â0â veya â1â | %73 | %3 | %71 (%60, %81) |
DLQI 0,1 | %45 | %3 | %43 (%31, %55) |
Başlangıçta GPSS Kaşıntı NRS Skoru ≥3 olan N | N=62 | N=60 |
|
GPSS Genital Kaşıntı (≥3 puan iyileşme) | %60 | %8 | %51 (%37, %65) |
Başlangıçta SFQ Madde 2 Skoru ≥2 olan N | N=37 | N=42 |
|
SFQ madde 2 skoru, â0â (hiç etkilenmedi) veya â1â (nadiren etkilendi) | %78 | %21 | %57 (%39, %75) |
Psöriyatik artrit
COPELLOR aktif psöriyatik artrit (≥3 şiş eklem ve ≥3 hassas eklem) bulunan 780 hastanın yer aldığı randomize, çift kör, plasebo kontrollü iki faz III çalışmada değerlendirilmiştir. Hastalarda medyan 5,33 yıldır psöriyatik artrit tanısı (Psöriyatik Artrit Sınıflandırma Kriterleri [CASPAR]) olduğu kaydedilmiştir ve mevcut plak psöriyazis deri lezyonları (%94,0) veya belgelenmiş plak psöriyazis öyküsü olduğu, hastaların %12,1'inde başlangıçta orta ila şiddetli plak psöriyazis bulunduğu belirlenmiştir. Psöriyatik artrit hastalarının sırasıyla %58,9 ve
%22,3'ünden fazlasında başlangıçta entezit ve daktilit olduğu saptanmıştır. Her iki çalışmada da primer sonlanım noktası olarak 24. haftadaki Amerikan Romatoloji Derneği (ACR) 20 yanıtı değerlendirilmiştir değerlendirilmiştir ve bunu 24. haftadan 156. haftaya (3 yıl) kadar bir uzatma dönemi takip etmiştir.
Psöriyatik Artrit Çalışması 1'de (SPIRIT-P1), aktif psöriyatik artrit bulunan ve biyolojik tedavi almamış hastalar; plasebo, 2 haftada bir 40 mg adalimumab (aktif kontrol referans kolu), 2 haftada bir (Q2W) 80 mg COPELLOR veya 4 haftada bir (Q4W) 80 mg COPELLOR almak üzere randomize edilmiştir. Her iki COPELLOR rejimine 160 mg'lik bir başlangıç dozu dahil edilmiştir. Bu çalışmada hastaların %85,3'ü önceden ≥1 cDMARD tedavisi almıştır. Eş
zamanlı MTX, hastaların %53'ünde haftalık ortalama 15,8 mg dozda kullanılmıştır. Eş zamanlı
MTX kullanan hastaların %67'sinde dozun 15 mg ya da daha fazla olduğu görülmüştür. 16. haftada yetersiz yanıt alınan hastalar kurtarma tedavisi almıştır (arka plan tedavisinde modifikasyon). COPELLOR Q2W veya Q4W alan hastalar orijinal olarak atandıkları COPELLOR dozuna devam etmişlerdir. Adalimumab veya plasebo alan hastalar, yanıt verme durumlarına göre 16. ya da 24. haftada COPELLOR Q2W veya Q4W almak üzere 1:1 oranında yeniden randomize edilmiştir. Copellor'da 243 hasta 3 yıllık uzatma dönemini tamamlamıştır.
Psöriyatik Artrit Çalışması 2'ye (SPIRIT-P2) önceden bir anti-TNF ajanıyla tedavi alan ve etkisizlik ya da intolerans sebebiyle anti-TNF ajanı kullanımına devam etmeyen hastalar (anti- TNF-IR hastalar) alınmıştır. Hastalar plasebo, 2 haftada bir (Q2W) 80 mg COPELLOR veya 4 haftada bir (Q4W) 80 mg COPELLOR almak üzere randomize edilmiştir. Her iki COPELLOR rejimine 160 mg'lik bir başlangıç dozu dahil edilmiştir. Hastaların sırasıyla %56 ve %35'i 1 anti-TNF'ye veya 2 anti-TNF'ye yetersiz yanıt almıştır. SPIRIT-P2 çalışmasında 363 hasta değerlendirilmiş; hastaların %41'inde haftalık ortalama doz 16,1 mg olmak üzere eş zamanlı MTX kullanımı kaydedilmiştir. Eş zamanlı MTX, hastaların %73,2'sinde 15 mg ya da daha fazla dozda kullanılmıştır. 16. haftada yetersiz yanıt alınan hastalar kurtarma tedavisi almıştır (arka plan tedavisinde modifikasyon). COPELLOR Q2W ya da Q4W alan hastalar orijinal olarak atandıkları COPELLOR dozuna devam etmişlerdir. Plasebo alan hastalar, yanıt verme durumlarına göre 16. ya da 24. haftada COPELLOR Q2W veya Q4W almak üzere 1:1 oranında yeniden randomize edilmiştir. Copellor'da 168 hasta 3 yıllık uzatma dönemini tamamlamıştır.
Bulgu ve semptomlar
COPELLOR tedavisi 24. haftada hastalık aktivitesi ölçütlerinde plaseboya kıyasla anlamlı iyileşmeyle sonuçlanmıştır (bkz. Tablo 9).
Tablo 9. 24. Haftada SPIRIT-P1 ve SPIRIT-P2 Etkililik Bulguları
| SPIRIT-P1 | SPIRIT-P2 | |||||||||
Sonlanım noktaları |
|
|
|
| Yanıt Oranında Plaseboya Kıyasla Fark (%95 GA) |
|
|
| Yanıt Oranında Plaseboya Kıyasla Fark (%95 GA) | ||
| PBO (n = 106) | COPELL OR Q4W (N = 107) | COPELL OR Q2W (N = 103) | ADA (N = 101) | COPEL LOR Q4W | COPEL LOR Q2W | PBO (N = 118) | COPELL OR Q4W (N = 122) | COPELL OR Q2W (N = 123) | COPEL LOR Q4W | COPEL LOR Q2W |
ACR 20 yanıtı, n (%) | |||||||||||
24. Hafta |
32 (30,2) |
62 (57,9) |
64 (62,1) |
58 (57,4) | 27,8 (15 ; 40,6) | 31,9 (19,1 ; 44,8) |
23 (19,5) |
65 (53,3) |
59 (48) | 33,8 (22,4 ; 45,2) | 28,5 (17,1 ; 39,8) |
ACR 50 yanıtı, n (%) | |||||||||||
24. Hafta |
16 (15,1) |
43 (40,2) |
48 (46,6) |
39 (38,6) | 25,1 (13,6 ; 36,6) | 31,5 (19,7 ; 43,3) |
6 (5,1) |
43 (35,2) |
41 (33,3) | 30,2 (20,8 ; 39,5) | 28,3 (19 ; 37,5) |
ACR 70 yanıtı, n (%) | |||||||||||
24. Hafta |
6 (5,7) |
25 (23,4) |
35 (34) |
26 (25,7) | 17,7 (8,6 ; 26,8) | 28,3 (18,2 ; 38,5) |
0 |
27 (22,1) |
15 (12,2) | 22,1 (14,8 ; 29,5) | 12,2 (6,4 ; 18) |
Minimal Hastalık Aktivitesi (MHA) n (%) | |||||||||||
24. Hafta |
16 (15,1) |
32 (29,9) |
42 (40,8) |
32 (31,7) | 14,8 (3,8 ; 25,8) | 25,7 (14 ; 37,4) |
4 (3,4) |
34 (27,9) |
29 (23,6) | 24,5 (15,9 ; 33,1) | 20,2 (12 ; 28,4) |
Başlangıçta psöriyazis deri tutulumu VYA ≥%3 olan hastalarda ACR 50 ve PASI 100, n (%) | |||||||||||
24. Hafta |
1 (1,5) |
21 (28,8) |
19 (32,2) |
9 (13,2) | 27,3 (16,5 ; 38,1) | 30,7 (18,4 ; 43) |
0 (0) |
12 (17,6) |
10 (14,7) | 17,6 (8,6 ; 26,7) | 14,7 (6,3 ; 23,1) |
Kısaltmalar: ACR 20/50/70=AmerikanRomatoloji Derneği%20/%50/%70 yanıt oranı; ADA
= adalimumab; VYA = vücut yüzey alanı; GA = güven aralığı; Q4W = 4 haftada bir COPELLOR 80 mg; Q2W = 2 haftada bir COPELLOR 80 mg; N = analiz popülasyonundaki hasta sayısı; n = belirlenen kategorideki hasta sayısı; NRI = yanıt vermeyen impütasyonu; PASI 100 = psöriyazis alan şiddet indeksinde %100 iyileşme; PBO = plasebo.
Not: 16. haftada kurtarma tedavisi uygulanan, tedaviyi bırakan ya da verileri eksik olan hastalar için 24. hafta analizlerinde yanıt vermeyenler olarak impütasyon yapılmıştır.
Eş zamanlı cDMARD'lar arasında MTX, leflunomid ve sülfasalazin yer almıştır.
Önceden var olan daktilit veya entezit bulunan hastalarda, COPELLOR Q4W tedavisi plaseboya kıyasla 24. haftada daktilit ve entezitte iyileşmeyle sonuçlanmıştır (düzelme: sırasıyla %78'e %24; p<0,001 ve %39'a %21; p<0,01).
VYA ≥%3 olan hastalarda 12. hafta PASI 75 ölçümüne göre, derinin temizlenmesindeki iyileşmenin Q4W rejimi ile tedavi edilenler için %67 (94/141), plasebo ile tedavi edilenler için
%9 (12/134) olmuştur (p<0,001). 24. haftada PASI 75, PASI 90 ve PASI 100 yanıtı elde eden hastaların oranı, COPELLOR Q4W ile plaseboya kıyasla daha yüksek olmuştur (p<0,001). Eş zamanlı orta ila şiddetli psöriyazis ve psöriyatik artrit bulunan hastalarda COPELLOR Q2W, plaseboya kıyasla PASI 75, PASI 90 ve PASI 100 için anlamlı derecede daha yüksek yanıt oranı sergilemiş (p<0,001) ve Q4W rejimine kıyasla klinik açıdan anlamlı yarar sağlamıştır.
COPELLOR tedavisi sırasındaki tedavi yanıtları plaseboya kıyasla, ACR 20 için 1. hafta gibi erken bir zamanda, ACR 50 için 4. haftada ve ACR 70 için 8. haftada anlamlı derecede yüksek olmuş ve 24 hafta süresince korunmuştur; çalışmada kalan hastalar için etkiler 3 yıl boyunca devam etmiştir.
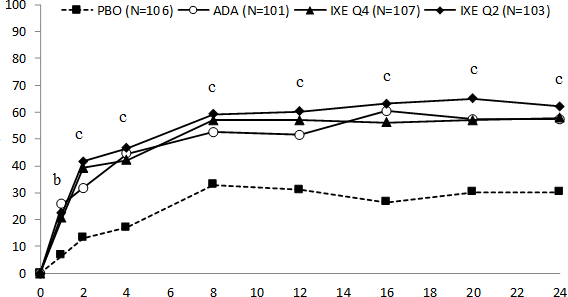
Şekil 3. SPIRIT-P1 Çalışmasında 24. Haftaya Kadar Zaman İçindeki ACR 20 Yanıtları
% ACR20 Yanıt verenler |
|
| Tedavi haftası |
COPELLOR Q2W ve Q4W için: plaseboya kıyasla p<0,01 ve c p<0,001.
SPIRIT-P1 ve SPIRIT-P2 çalışmalarında psöriyatik artrit hastalarında MTX tedavisi dahil eş zamanlı cDMARD kullanımı olup olmamasından bağımsız şekilde ACR 20/50/70 yanıtları benzerdir.
SPIRIT-P1 ve SPIRIT-P2 çalışmalarında hastanın ağrı değerlendirmesi dahil ACR yanıtlarının tüm bileşenlerinde iyileşmeler gösterilmiştir. 24. haftada modifiye Psöriyatik Artrit Yanıt Kriterleri (PsARC) yanıtı elde eden hastaların oranı, COPELLOR tedavisi alan hastalarda plasebo alanlara kıyasla daha yüksek olmuştur.
SPIRIT-P1 çalışmasında ACR 20/50/70, MDA, entezitin giderilmesi, daktillitin giderilmesi ve PASI 75/90/100 yanıt oranlarıyla değerlendirilen etkililik 52. haftaya kadar korunmuştur.
COPELLOR'un etkililik ve güvenliliği yaş, cinsiyet, ırk, hastalık süresi, başlangıçtaki vücut ağırlığı, başlangıçtaki psöriyazis tutulumu, başlangıçtaki CRP, başlangıçtaki DAS28-CRP; eş zamanlı kortikosteroid kullanımı ve önceden uygulanan biyolojik tedaviden bağımsız olarak ortaya konmuştur. COPELLOR; biyolojik kullanmamış, biyolojik maruziyeti bulunan ve biyolojik tedavinin başarısız olduğu hastalarda etkili bulunmuştur.
SPIRIT-P1'de 63 hasta 3 yıllık Q4W ixekizumab tedavisini tamamlamıştır. İxekizumab Q4W'ye (ITT popülasyonunda NRI analizi) randomize edilen 107 hastanın 54'ünde (%50), 41'inde (%38), 29'unda (%27) ve 36'sında (%34) 156. haftada sırasıyla ACR20, ACR50, ACR70 ve MDA yanıtı gözlenmiştir.
SPIRIT-P2'de 70 hasta 3 yıllık Q4W ixekizumab tedavisini tamamlamıştır. İxekizumab Q4W'ye (ITT popülasyonunda NRI analizi) randomize edilen 122 hastanın 56'sında (%46), 39'unda (%32), 24'ünde (%20) ve 33'ünde (%27) 156. haftada sırasıyla ACR20, ACR50, ACR70 ve MDA yanıtı gözlenmiştir.
Radyografik yanıt
SPIRIT-P1 çalışmasında, yapısal hasar progresyonunun inhibisyonu radyografik olarak değerlendirilmiş ve modifiye toplam Sharp Skorunda (mTSS) ve skorun bileşenleri, Erozyon Skoru (ES) ve Eklem Boşluğu Daralması (JSN) skoru bakımından 24. ve 52. haftada başlangıca göre görülen değişiklik olarak ifade edilmiştir. 24. hafta verileri Tablo 10'da sunulmuştur.
Tablo 10. SPIRIT-P1'de modifiye Toplam Sharp Skorundaki Değişiklik
|
| Plaseboya kıyasla fark (%95 GA) | ||||
PBO (n = 106) | COPELLOR Q4W (N = 107) | COPELLOR Q2W (N = 103) | ADA (N = 101) | COPELLOR Q4W | COPELLOR Q2W | |
Başlangıç skoru, ortalama (SS) |
17,6 (28,62) |
19,2 (32,68) |
15,2 (28,86) |
15,9 (27,37) |
NA |
NA |
24. Haftada başlangıca göre değişiklik, LSM (SH) |
0,51 (0,092) |
0,18 (0,090) |
0,09 (0,091) |
0,13 (0,093) |
-0,33 (-0,57,-0,09) |
-0,42 (-0,66,-0,19) |
Kısaltmalar: ADA = adalimumab; GA = güven aralığı; Q4W = 4 haftada bir COPELLOR 80 mg; Q2W = 2 haftada bir COPELLOR 80 mg; LSM = en küçük kareler ortalaması; N = analiz popülasyonundaki hasta sayısı; PBO = plasebo; SH = standart hata; SS = standart sapma.
b plaseboya kıyasla p<0,01; c p<0,001.
COPELLOR, radyografik eklem hasarı progresyonunu 24.haftada inhibe etmiş (Tablo 10) ve
randomizasyondan 24.haftaya kadar radyografik eklem hasarı progresyonu (başlangıca göre
≤0,5 mTSS değişikliği olarak tanımlanmıştır) bulunmayan hastaların oranı, COPELLOR Q2W için %94,8 (p<0,001), COPELLOR Q4W için %89 (p=0.026), adalimumab için %95,8 (p<0,001) olurken, bunlara kıyasla plasebo için %77,4'tür. Elli ikinci haftada mTSS'de başlangıca göre ortalama değişiklik plasebo/COPELLOR için 0,27, COPELLOR Q2W/COPELLOR Q4W için 0,54, adalimumab/COPELLOR Q4W için 0,32 olmuştur. Randomizasyondan 52. haftaya kadar radyografik eklem hasarı progresyonu olmayan hastaların oranı, plasebo/COPELLOR Q4W için %90,9, COPELLOR Q2W/COPELLOR Q4W için %85,6, adalimumab/COPELLOR Q4W için %89,4'tür. Hastalarda başlangıca göre (mTSS≤0,5 olarak tanımlanan) aşağıdaki tedavi kollarında yapısal ilerleme olmamıştır: Plasebo/Copellor Q4W %81,5 (N=22/27), Copellor Q4W/Copellor Q4W %73,6 (N=53/72), ve adalimumab/Copellor Q4W %88,2 (N=30/34).
Fiziksel fonksiyon ve sağlıkla ilgili yaşam kalitesi
SPIRIT-P1 ve SPIRIT-P2 çalışmalarında COPELLOR Q2W (p<0,001) ve Q4W (p<0,001)
tedavisi alan ve Sağlık Değerlendirme Anketi-Engellilik İndeksi (HAQ-DI) ile fiziksel fonksiyon bakımından değerlendirilen hastalar 24. haftada, plasebo tedavisi alanlara kıyasla anlamlı iyileşme göstermiş ve bu iyileşmeler SPIRIT-P1 çalışmasında 52. haftaya kadar korunmuştur.
COPELLOR tedavisi alan hastalarda Kısa Form-36 Sağlık Anketi'nin (SF-36 PCS) Fiziksel Bileşenler Özeti skoruyla ölçülen sağlıkla ilgili yaşam kalitesinde iyileşmeler bildirilmiştir (p<0,001). Ayrıca Yorgunluk şiddeti NRS skorlarıyla değerlendirilen yorgunluk bakımından da iyileşmeler olduğu görülmüştür (p<0,001).
Pazarlama sonrası Faz 4, doğrudan karşılaştırmalı çalışma
COPELLOR'un etkililik ve güvenliliği daha önce biyolojik hastalık modifiye edici antiromatizmal ilaç (bDMARD) almamış PsA'lı 566 hastada adalimumaba (ADA) kıyasla yürütülen çok merkezli, randomize, açık etiketli, kör değerlendiricili, paralel grup çalışmasında (SPIRIT-H2H) araştırılmıştır. Hastalar başlangıçta eşzamanlı cDMARD kullanımı ve orta dereceli ile şiddetli psöriyazis varlığına (PASI≥12, BSA≥10 ve sPGA≥3) göre gruplandırılmıştır.
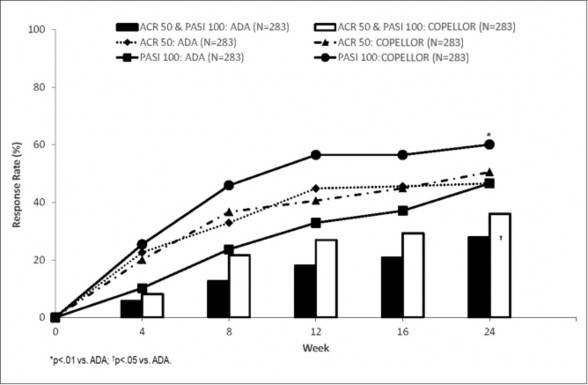
COPELLOR, çalışmanın primer sonlanım noktasında ADA'ya üstünlük göstermiştir: 24. haftada aynı anda ACR 50 ve PASI 100 yanıtının elde edilmesi (COPELLOR %36 ve ADA
%27,9; p=0,036; %95 güven aralığı [%0,5, %15,8]). COPELLOR aynı zamanda ADA'ya kıyasla 24. haftada çalışmadaki temel sekonder sonlanım noktaları olan ACR 50'de benzer etkililik (önceden belirlenmiş sınır -%12) (ITT analiz: COPELLOR %50,5 ve ADA %46,6; ADA'ya göre %3,9 fark; %95 güven aralığı [-%4,3; %12,1]; PPS analiz COPELLOR: %52,3,
ADA: %53,1, fark: -%0,8 [GA: -%10,3; %8,7]) ve PASI 100'de üstünlük (COPELLOR: %60,1
ve ADA: %46,6, p=0,001) göstermiştir. Elli ikinci haftada, ADA'ya kıyasla Copellor ile tedavi edilen hastaların daha yüksek bir oranı aynı anda ACR50 ve PASI 100'e [%39 (111/283) kıyasla %26 (74/283)] ve PASI 100'e [%64 (182/283) kıyasla %41 (117/283)] ulaşmıştır. Copellor ve ADA tedavisi, ACR50 için benzer yanıtlarla sonuçlanmıştır [%49,8 (141/283) kıyasla %49,8 (141/283)]. Copellor'a verilen yanıtlar, monoterapi olarak veya metotreksat ile birlikte kullanıldığında tutarlı olmuştur.
Şekil 4: 0-24. Hafta Primer Sonlanım Noktası (Aynı anda ACR 50 ve PASI 100) ve Başlıca Sekonder Sonlanım Noktaları (ACR 50; PASI 100) Yanıt Oranları [ITT popülasyon, NRI]**
** COPELLOR: Orta ila şiddetli plak psöriyazisli hastalarda 0. haftada 160 mg ve sonrasında
12. haftaya kadar 2 haftada bir, daha sonra 4 haftada bir 80 mg ya da diğer hastalarda 0. haftada 160 mg, sonra 4 haftada bir 80 mg; ADA: orta ila şiddetli plak psöriyazisli hastalarda
0. haftada 80 mg, sonra 1. haftadan itibaren 2 haftada bir 40 mg ya da diğer hastalarda 0.
haftada 40 mg, sonra 2 haftada bir 40 mg.
Yalnızca önceden tanımlanmış ve çoklu aralığa göre test edilmiş sonlanım noktası için anlamlılık düzeyi verilmiştir.
Aksiyel spondiloartrit
COPELLOR aksiyel spondiloartritli toplam 960 yetişkin hastanın yer aldığı randomize, plasebo kontrollü üç çalışmada (ikisi radyografik ve biri non-radyografik aksiyel spondiloartrit) değerlendirilmiştir.
Radyografik aksiyel spondiloartrit
COPELLOR aksiyel spondiloartritli toplam 657 yetişkin hastanın yer aldığı randomize, çift kör, plasebo kontrollü iki çalışmada (COAST-V ve COAST-W) değerlendirilmiştir. Hastalar, NSAİİ tedavisine rağmen, Bath Ankilozan Spondilit Hastalık Aktivite İndeksi (Bath Ankylosing Spondylitis Disease Activity Index - BASDAI) ≥4 ve sayısal derecelendirme ölçeğinde toplam bel ağrısı ≥4 ile tanımlanmış aktif hastalığa sahiptir. Başlangıçta her iki çalışmada da, hastalar ortalama 17 yıl boyunca (medyan 16 yıl) semptomlara sahiptir. Başlangıçta, hastaların yaklaşık %32'si eşzamanlı cDMARD kullanmaktadır. COAST-V'de 0. haftada COPELLOR 80 mg veya 160 mg ardından 2 haftada bir (Q2W) veya 4 haftada bir (Q4W) 80 mg, 2 haftada bir adalimumab 40 mg veya plasebo ile tedavi edilen 341 biyolojik
ürün kullanmamış hasta değerlendirilmiştir. Plasebo alan hastalar 16. haftada COPELLOR
(160 mg başlangıç dozu ardından 80 mg Q2W veya Q4W) almak üzere yeniden randomize edilmiştir. Adalimumab alan hastalar 16. haftada COPELLOR (80 mg Q2W veya Q4W) almak üzere yeniden randomize edilmiştir. COAST-W'da 1 veya 2 TNF inhibitörü ile daha önce deneyimi olan 316 hasta değerlendirilmiştir (%90'ı yetersiz yanıt verenlerdir ve %10'u TNF inhibitörlerine intolerans gösterenlerdir). Tüm hastalar 0. haftada COPELLOR 80 mg veya 160 mg ve ardından 80 mg Q2W veya Q4W ile veya plasebo ile tedavi edilmiştir. Plasebo alan hastalar 16. haftada COPELLOR (160 mg başlangıç dozu ardından 80 mg Q2W veya Q4W) almak üzere yeniden randomize edilmiştir. Her iki çalışmada da birincil sonlanım noktası, 16. haftada Spondiloartrit Değerlendirme Uluslararası Çalışma Grubu 40 (Assessment of Spondyloarthritis International Society 40 - ASAS40) yanıtı elde eden hastaların yüzdesidir.
Klinik yanıt
Her iki çalışmada da COPELLOR 80 mg Q2W veya 80 mg Q4W ile tedavi edilen hastalar, 16. haftada plaseboya kıyasla ASAS40 ve ASAS20 yanıtlarında daha fazla iyileşme göstermiştir (Tablo 11). Eşzamanlı tedavilerden bağımsız olarak hastalarda yanıtlar benzerdir. COAST- W'da, önceki TNF inhibitörlerinin sayısına bakılmaksızın yanıtlar görülmüştür.
Tablo 11. 16. Haftada COAST-V ve COAST-W'da Etkililik Sonuçları
| COAST-V, biyolojik ürün kullanmamış | COAST-W, TNF-inhibitorü kullanmış | |||||
COPELLOR 80 mg Q4W (N=81) |
Plasebo (N=87) | Plasebodan farkı g | Adalimumab 40 mg Q2W (N=90) | COPELLOR 80 mg Q4W (N=114) |
Plasebo (N=104) |
Plasebodan fark g | |
ASAS20 | 52 (%64,2) | 35 | 24 (9,3 ; | 53 (%58,9) | 55 (%48,2) | 31 | 18,4 (5,7 ; |
yanıt, n (%), |
| (%40,2) | 38,6) |
|
| (%29,8) | 31,1) |
NRI |
|
|
|
|
|
|
|
ASAS40 | 39 (%48,1) | 16 | 29,8 (16,2 ; | 32 (%35,6) | 29 (%25,4) | 13 | 12,9 (2,7 ; |
yanıt, n (%), |
| (%18,4) | 43,3) |
|
| (%12,5) | 23,2) |
NRI |
|
|
|
|
|
|
|
ASDAS | |||||||
Başlangıca | -1,4 | -0,5 | -1 (-1,3 ; - | -1,3*** | -1,2 | -0,1 | -1,1 (-1,3 ; - |
göre değişiklik | 3,7 | 3,9 | 0,7) *** | 3,7 | 4,2 | 4,1 | 0,8) *** |
Başlangıç |
|
|
|
|
|
|
|
BASDAI Skoru | |||||||
Başlangıca | -2,9 | -1,4 | -1,5 (-2,1 ; - | -2,5*** | -2,2 | -0,9 | -1,2 (-1,8 ; - |
göre değişiklik | 6,8 | 6,8 | 0,9) *** | 6,7 | 7,5 | 7,3 | 0,7) *** |
Başlangıç |
|
|
|
|
|
|
|
MRI Spine SPARCC | |||||||
Başlangıca | -11 | -1,5 | -9,5 (-12,6 ; | -11,6*** | -3 | 3,3 | -6,3 (-10 ; - |
göre değişiklik | 14,5 | 15,8 | -6,4) *** | 20 | 8,3 | 6,4 | 2,5) ** |
Başlangıç |
|
|
|
|
|
|
|
BASDAI50 n | 34 (%42) | 15 | 24,7 (11,4 ; | 29 (%32,2)* | 25 (%21,9)i | 10 | 12,3 (2,8 ; |
(%), NRI |
| (%17,2) | 38,1) *** |
|
| (%9,6)i | 21,8)* |
ASDAS <2,1, | 35 (%43,2) | 11 | 30,6 (17,7 ; | 34 (%37,8)*** | 20 (%17,5) | 5 (%4,8) | 12,7 ( 4,6 ; |
n (%) (Düşük |
| (%12,6) | 43,4) *** |
|
| 20,8) ** | |
hastalık |
|
|
|
|
|
|
|
aktivitesi), |
|
|
|
|
|
|
|
NRI |
|
|
|
|
|
|
|
ASDAS <1,3, n (%) (İnaktif hastalık), NRI | 13 (%16) | 2 (%2,3) | 13,8 (5,2 ; 22,3) ** | 14 (%15,6)** | 4 (%3,5)i | 1 (%1)i | 2,5 (-1,3 ; 6,4) |
ASAS HI |
|
|
|
|
|
|
|
Başlangıca | -2,4 | -1,3 | -1,1 (-2 ; - | -2,3* | -1,9 | -0,9 | -1 (-1,9 ; - |
göre değişiklik | 7,5 | 8,1 | 0,3) * | 8,2 | 10 | 9 | 0,1) * |
Başlangıç |
|
|
|
|
|
|
|
SF-36 PCS |
|
|
|
|
|
|
|
Başlangıca | 7,7 | 3,6 | 4,1 (1,9 ; | 6,9** | 6,6 | 1,4 | 5,2 (3 ; 7,4) |
göre değişiklik | 34 | 32 | 6,2) *** | 33,5 | 27,5 | 30,6 | *** |
Başlangıç |
|
|
|
|
|
|
|
Kısaltmalar: N = Tedavi yönelimli popülasyondaki hasta sayısı; NRI = yanıt vermeyen impütasyonu; Eksik veriye sahip olan hastalar yanıt vermeyen olarak sayılmıştır. ASAS HI = Spondiloartrit Değerlendirme Uluslararası Çalışma Grubu Sağlık İndeksi (Assessment of SpondyloArthritis International Society Health Index); ASDAS = Ankilozan Spondilit Hastalık Aktivite Skoru (Ankylosing Spondylitis Disease Activity Score); BASDAI = Bath Ankilozan Spondilit Hastalık Aktivite İndeksi (Bath Ankylosing Spondylitis Disease Activity Index); CFB = 16. haftada başlangıca göre en küçük kareler ortalaması değişimi; MRI Spine SPARCC = Kanada MRI Omurga Spondiloartrit Skorlama Konsorsiyumu (Spondyloarthritis Research Consortium of Canada Magnetic Resonance Imaging Scoring of the Spine) (23 discovertebral birim ölçeği)
ASAS40 yanıtı, ≥%40 iyileşme ve geri kalan alanlarda herhangi bir kötüleşme olmaksızın 4 alanın
≥3'ünde başlangıca göre ≥2 birimlik mutlak iyileşme olarak tanımlanır.
* p<0,05; ** p <0,01; *** Plasebo ile karşılaştırıldığında p<0,001.
16. haftada ASAS40 yanıt kriterlerinin ana bileşenlerinde (spinal ağrı, BASFI, hasta global değerlendirmesi, sertlik) ve CRP dahil olmak üzere diğer hastalık aktivitesi ölçümlerinde düzelmeler olmuştur.
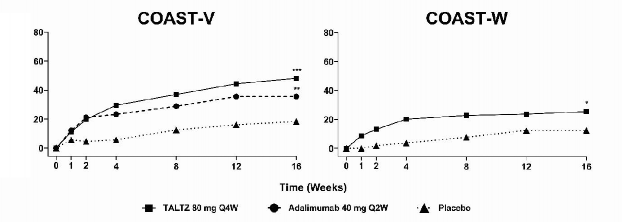
Zaman (Hafta)
Yanıt verenlerin yüzdesi
Şekil 5. COAST-V ve COAST-W'da 16. Haftaya Kadar ASAS40 Yanıtına Ulaşan Hastaların Yüzdeleri, NRI
* p<0,05; ** p<0,01; *** Plasebo ile karşılaştırıldığında p<0,001.
Hastalarda, başlangıçtaki CRP seviyeleri, başlangıç ASDAS skorları ve MRI Spine SPARCC skorlarından bağımsız olarak benzer ASAS40 yanıtı görülmüştür. ASAS40 yanıtı yaş, cinsiyet, ırk, hastalık süresi, başlangıç vücut ağırlığı, başlangıç BASDAI skoru ve önceki biyolojik tedavilerden bağımsız olarak gösterilmiştir.
COAST-V ve COAST-W'da etkililik, ASAS20, ASAS40, ASDAS, BASDAI ve ASAS HI
yanıt oranları dahil olmak üzere Tablo 11'de sunulan sonlanım noktaları ile değerlendirildiği üzere 52. haftaya kadar korunmuştur.
Sağlıkla ilişkili sonuçlar
Spinal ağrı, 1. hafta kadar erken bir sürede plaseboya göre iyileşme göstermiştir ve 16. haftaya kadar sürmüştür (COPELLOR vs plasebo: COAST-V -3,2 vs -1,7; COAST-W -2,4 vs -1,0); yorgunluk ve omurga mobilitesi plaseboya göre 16. haftada iyileşme göstermiştir. Spinal ağrı,
yorgunluk ve omurga mobilitesindeki iyileşmeler 52 hafta boyunca sürdürülmüştür.
Non-radyografik aksiyel spondiloartrit
COPELLOR en az 3 ay boyunca aktif aksiyel spondiloartritli 303 yetişkin hastanın yer aldığı randomize, 52 haftalık periyotta plasebo kontrollü çift kör bir çalışmada (COAST-X) değerlendirilmiştir. Hastalar, yüksek CRP ve/veya MRI'de sakroiliit ile gösterilen objektif inflamasyon belirtilerine sahip olmalı ve sakroiliak eklemlerde yapısal hasara ilişkin kesin radyografik kanıt olmamalıdır. Hastalar, NSAİİ tedavisine rağmen BASDAI ≥4 ve 0 ila 10 arasında NRS ≥4 olan spinal ağrı ile tanımlanan aktif hastalığa sahiptir. Hastalar, 0. haftada COPELLOR 80 mg veya 160 mg, ardından 2 haftada bir (Q2W) 80 mg veya 4 haftada bir (Q4W) 80 mg, veya plasebo ile tedavi edilmiştir. Doz ayarlaması ve/veya eşzamanlı ilaçların (NSAİİ'ler, cDMARD'lar, kortikosteroidler, analjezikler) başlatılmasına 16. haftadan itibaren izin verilmiştir.
Başlangıçta, hastalar ortalama 11 yıldır non-radyografik aksiyel spondiloartrit semptomlarına sahiptir. Hastaların yaklaşık %39'u eşzamanlı bir cDMARD kullanmaktaydı.
Birincil sonlanım noktası, 16. haftada ASAS40 yanıtı elde eden hastaların yüzdesidir.
Klinik yanıt
16. haftada plaseboya kıyasla COPELLOR 80 mg Q4W ile tedavi edilen hastalarda daha yüksek oranda, ASAS40 yanıtı elde edilmiştir. (Tablo 12). Yanıtlar, eşlik eden tedavilerden bağımsız olarak benzerdir.
Tablo 12. COAST-X'de 16. Haftada Etkililik Sonuçları, NRI
| COPELLOR 80 mg Q4W (N=96) | Plasebo (N=105) |
Plasebodan fark |
ASAS20 yanıt, n (%), NRI | 52 (%54,2) | 41 (%39) | 15,1 (1,5 ; 28,8)* |
ASAS40 yanıt, n (%), NRI | 34 (%35,4) | 20 (%19) | 16,4 (4,2 ; 28,5)** |
ASDAS | |||
Başlangıca göre değişiklik Başlangıç | -1,1 3,8 | -0,6 3,8 | -0,5 (-0,8 ; -0,3) *** |
BASDAI Skoru | |||
Başlangıca göre değişiklik Başlangıç | -2,2 7 | -1,5 7,2 | -0,7 (-1,3 ; -0,1) * |
MRI SIJ SPARCC | |||
Başlangıca göre değişiklik Başlangıç | -3,4 5,1 | -0,3 6,3 | -3,1 (-4,6 ; -1,6) *** |
ASDAS <2,1, n (%) (Düşük hastalık aktivitesi), NRI | 26 (%27,7) | 13 (%12,4) | 15,3 (4,3 ; 26,3) ** |
SF-36 PCS | |||
Başlangıca göre değişiklik Başlangıç | 8,1 33,5 | 5,2 32,6 | 2,9 (0,6 ; 5,1) * |
Kısaltmalar: N = Tedavi yönelimli popülasyondaki hasta sayısı; NRI = yanıt vermeyen impütasyonu. ASDAS = Ankilozan Spondilit Hastalık Aktivite Skoru (Ankylosing Spondylitis Disease Activity Score); BASDAI = Bath Ankilozan Spondilit Hastalık Aktivite İndeksi (Bath Ankylosing Spondylitis Disease Activity Index); Başlangıca göre değişiklik = 16. haftada başlangıca göre en küçük kareler ortalaması değişimi; MRI SIJ SPARCC = Sakroiliak eklemin Kanada MRI Omurga Spondiloartrit Skorlama Konsorsiyumu (Spondyloarthritis Research Consortium of CanadaMagneticResonanceImaging Scoring).
* p<0,05; ** p <0,01; *** Plasebo ile karşılaştırıldığında p<0,001.
16. haftada ASAS40 yanıt kriterlerinin ana bileşenlerinde (spinal ağrı, BASFI, hasta genel değerlendirmesi, sertlik) ve diğer hastalık aktivitesi ölçümlerinde önemli klinik düzelmeler olmuştur.
Şekil 6. COAST-X'de 16. Haftaya Kadar ASAS40 Yanıtına Ulaşan Hastaların Yüzdeleri,
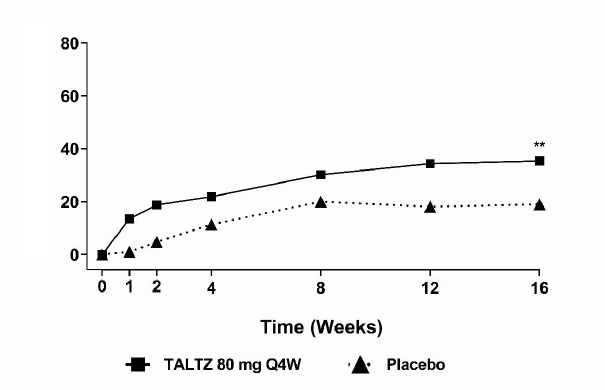
COPELLOR 80 mg Q4W
Zaman (Hafta)
Plasebo
Yanıt verenlerin yüzdesi
NRI
** Plasebo ile karşılaştırıldığında p<0,01
Etkililik Tablo 12'de sunulan sonlanım noktaları ile değerlendirildiği üzere 52. haftaya kadar
sürdürülmüştür.
Sağlıkla ilişkili sonuçlar
Spinal ağrı, 1. hafta kadar erken bir sürede plaseboya kıyasla iyileşme göstermiştir ve bu iyileşme 16. haftaya kadar sürmüştür (COPELLOR vs plasebo: COAST-X: -2,4 vs -1,5). Ek olarak, plaseboya kıyasla COPELLOR kullanan daha fazla hasta, 16. ve 52. haftalarda ASAS Sağlık İndeksi'ne göre iyi sağlık durumuna (ASAS HI ≤5) ulaşmıştır.
Uzun vadeli sonuçlar aksiyal spondiloartrit
Üç önemli COAST-V/W/X çalışmasından (52 hafta) birini tamamlayan hastalara, uzun vadeli bir uzatma ve randomize geri çekme çalışmasına katılması teklif edilmiştir (COAST-Y, Copellor Q4W ve Q2W'ye kayıtlı sırasıyla 350 ve 423 hasta ile). Remisyon 157/773 (%20,3) elde edenler arasında (16. ve 20. haftalarda Ankilozan Spondilit Hastalığı Aktivite Skoru [ASDAS] en az bir kez <1,3 ve ≥2,1 ASDAS skoru mevcut değildir), 76 haftaya kadar Copellor'a maruz kalan 155 hasta COAST-Y çalışmasının 24. haftasında randomize edilmiştir (Plasebo, N=53; Copellor Q4W, N=48; ve Copellor Q2W, N=54); bunlardan 148'i (%95,5) 64. hafta ziyaretini tamamlamıştır (Plasebo, N=50; Copellor Q4W, N=47; Copellor Q2W, N=51). Primer sonlanım noktası, randomize yoksunluk popülasyonunda 24-64. haftalarda alevlenme yaşamayan hastaların oranıdır (plaseboya karşı kombine Copellor Q2W ve Copellor Q4W grupları). Kombine Copellor gruplarında (%83,3 (85/102), p<0,001) ve Copellor Q4W'de (%83,3 (40/48), p=0,003) hastaların anlamlı ölçüde daha yüksek bir oranında (NRI), Copellor'dan plaseboya geçenlerle (%54,7 (29/53)) karşılaştırıldığında 24-64. haftalarda alevlenme olmamıştır. Copellor (hem kombine Copellor gruplarında hem de Copellor Q4W grubunda), plasebo ile karşılaştırıldığında alevlenme süresini önemli ölçüde geciktirmiştir (sırasıyla Log-Rank Testi p<0,001 ve p<0,01).
Sürekli olarak Copellor Q4W alan hastalarda (N=157), ASAS40, ASDAS <2,1 ve BASDAI50 yanıtları 116. haftaya kadar korunmuştur.
İmmünizasyon
Sağlıklı gönüllülerde yapılan bir çalışmada, iki doz ixekizumab sonrasında alınan (160 mg'ı takiben ikinci doz olarak 2 hafta sonra 80 mg) iki inaktif aşıda (tetanoz ve pnömokok) herhangi bir güvenlilik endişesi belirlenmemiştir. Ancak, COPELLOR uygulandıktan sonra bu aşılara karşı yeterli immün yanıt hakkında karar vermek için immünizasyon ile ilgili veriler yeterli değildir.
5.2. Farmakokinetik özellikler
Genel özellikler:Emilim:
Psöriyazis hastalarında tek subkütan ixekizumab dozunun ardından ortalama en yüksek konsantrasyonlara 5 ila 160 mg doz aralığında 4 ila 7. günlerde ulaşılmıştır. 160 mg başlangıç dozundan sonra ixekizumabın ortalama (SS) maksimum plazma konsantrasyonu (C) 19,9 (8,15) mcg/ml olarak bulunmuştur.
160 mg başlama dozundan sonra 80 mg Q2W doz rejimiyle kararlı durum (kd) 8. haftada elde edilmiştir. Ortalama (SS) Cve C tahminleri, 21,5 (9,16) mcg/ml ve 5,23 (3,19) µg/ml'dir.
On ikinci haftada 80 mg Q2W doz rejiminden 80 mg Q4W doz rejimine geçildikten sonra kararlı duruma yaklaşık 10 haftadan sonra ulaşılacaktır. Ortalama (SS) Cve Ctahminleri 14,6 (6,04) mcg/ml ve 1,87 (1,30) µg/ml'dir.
Subkütan uygulama sonrası ixekizumabın ortalama biyoyararlanım analizlerde %54 ile %90 arasında hesaplanmıştır.
Dağılım:
Popülasyon farmakokinetiği analizlerine göre, kararlı durumdaki ortalama total dağılım hacmi 7,11 L'dir.
Biyotransformasyon:
Ixekizumab bir monoklonal antikordur ve aynı endojen immünoglobulinler gibi katabolik yolaklarla küçük peptitlere ve aminoasitlere degrade olması beklenir.
Eliminasyon:
Popülasyon farmakokinetik analizinde, ortalama serum klirensi 0,0161 L/sa olmuştur. Klirens dozdan bağımsızdır. Popülasyon farmakokinetiği analizlerinden hesaplanan ortalama eliminasyon yarılanma ömrü, plak tipi psöriyazisi olanlarda 13 gündür.
Doğrusallık/doğrusal olmayan durum:
Subkütan enjeksiyonla uygulanan 5 ila 160 mg doz aralığında maruziyet (EAA) orantılı olarak artmıştır.
Endikasyonlardaki farmakokinetik özellikler
COPELLOR'un farmakokinetik özellikleri, plak psöriyazis, psöriyatik artrit, radyografik aksiyel spondiloartrit ve non-radyografik aksiyel spondilartrit endikasyonlarında benzerdir.
Hastalardaki karakteristik özellikler
Geriyatrik popülasyon:
Klinik geliştirme çalışmalarında COPELLOR'a maruz kalmış 4204 plak tipi psöriyazis hastasından toplam 301'inin 65 yaş veya üstü ve 36'sının 75 yaş veya üzerinde olduğu kaydedilmiştir. Yaşlı hasta sayısının sınırlı olduğu (≥65 yaş için n = 94 ve ≥75 yaş için n = 12) popülasyon farmakokinetiği analizlerine dayanılarak, ileri yaştaki hastalar ile 65 yaşın altındakilerde klirens aynı bulunmuştur.
Sınırlı sayıda yaşlı hastanın yer aldığı bir popülasyon farmakokinetiği analizine göre (≥65 yaş
için n = 94, ≥75 yaş için n = 12), yaşlı hastalardaki ve 65 yaş altındakilerdeki klirens benzer bulunmuştur.
Böbrek yetmezliği:
Böbrek yetmezliğinin ixekizumabın farmakokinetiği üzerindeki etkilerini değerlendirmeye yönelik spesifik klinik farmakoloji çalışması yapılmamıştır. Bir IgG MAb olan bozulmamış ixekizumabın renal eliminasyonunun düşük ve önemsiz olması beklenir.
Karaciğer yetmezliği:
Karaciğer yetmezliğinin ixekizumabın farmakokinetiği üzerindeki etkilerini değerlendirmeye yönelik spesifik klinik farmakoloji çalışması yapılmamıştır. IgG MAb'ler başlıca intraselüler katabolizmayla elimine olur ve karaciğer yetmezliğinin ixekizumab klirensini etkilemesi beklenmez.
5.3. Klinik öncesi güvenlilik verileri
Tekrarlanan doz çalışmaları, güvenlilik farmakoloji değerlendirmeleri ve üremeyle ilgili ve gelişimsel toksisite çalışmalarına göre sinomolgus maymunlarından elde edilen klinik dışı veriler insanlar için spesifik bir risk göstermemiştir.
Otuz dokuz hafta süresince subkütan dozlarda 50 mg/kg'a kadar ixekizumab uygulaması organ toksisitesi ya da immün fonksiyon üzerinde istenmeyen etki (örn. T hücresine bağlı antikor yanıtı ve NK hücre aktivitesi) oluşturmamıştır. Maymunlara uygulanan haftalık 50 mg/kg subkütan doz 160 mg olan COPELLOR başlangıç dozunun yaklaşık 19 katıdır ve maymunlarda, önerilen doz rejimiyle insanlar için öngörülen kararlı durum maruziyetinin yaklaşık 61 katı maruziyet (EAA) oluşturmuştur.
Ixekizumabın karsinojenik veya mutajenik potansiyeline yönelik klinik dışı çalışma yapılmamıştır.
On üç hafta boyunca haftada 50 mg/kg subkütan dozda ixekizumab verilen cinsel olgunluğa sahip sinomolgus maymunlarında üreme organları, menstrüel döngüler ya da sperm üzerinde herhangi bir etki görülmemiştir.
Gelişimsel toksisite çalışmalarında, ixekizumabın plasentayı geçtiği ve yavrunun kanında 6 aya kadar bulunduğu gösterilmiştir. Yüksek postnatal mortalite insidansı eş zamanlı kontrollere kıyasla ixekizumab verilen yavru maymunlarda görülmüştür. Bu öncelikle erken doğum veya yavruların anne tarafından ihmali, insan olmayan primat çalışmalarındaki yaygın bulgular ile ilişkilidir ve klinik olarak konu dışı olarak değerlendirilmiştir.
 Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir.
Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
 Omurilik zedelenmeleri
Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir.
Omurilik zedelenmeleri
Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir. |
İLAÇ GENEL BİLGİLERİ
Lilly İlaç Ticaret Ltd.Şti.
| Geri Ödeme Kodu | A17439 |
| Satış Fiyatı | 58907.08 TL [ 10 May 2024 ] |
| Önceki Satış Fiyatı | 58907.08 TL [ 3 May 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699673954677 |
| Etkin Madde | Iksekizumab |
| ATC Kodu | L04AC13 |
| Birim Miktar | 80 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 3 |
| Antineoplastik ve İmmünomodülatör Ajanlar > İmmünsupresif Ajanlar |
| İthal ( ref. ülke : Abd ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Belsoğukluğu, Chlamydia ve Frengi Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve boğazda enfeksyona sebep olabilir. |
 |
Kolon, Rektum yada Bağırsak Kanseri Bağırsak kanseri kolon veya rektumda (arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir şekilde tedavi edilir. |
 |
Dış Gebelik Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur. |