AUGMENTIN BID 200/28 oral süspansiyon haz. için kuru toz 100 ml Klinik Özellikler
{ Amoksisilin + Klavulanik Asit }
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
AUGMENTİN, lokal resmi antibiyotik reçeteleme kılavuzları ve duyarlılık verilerine uygun olarak kullanılmalıdır.
AUGMENTİN, aşağıdaki sistemlerde amoksisiline dirençli beta laktamaz üreten suşların neden olduğundan şüphelenilen bakteriyel enfeksiyonların kısa süreli tedavisinde endikedir. Diğer durumlarda sadece amoksisilin düşünülmelidir.
Üst Solunum Yolu Enfeksiyonları (KBB dahil): Tekrarlayan tonsillit, akut bakteriyel sinüzit, akut otitis media.
4.2. Pozoloji ve uygulama şekli
Dozlar, her bir bileşen olarak belirtilen dozlar dışında, amoksisilin/klavulanik asit içeriğine göre tanımlanır.
Bir enfeksiyonu tedavi etmek için seçilen AUGMENTİN dozu için aşağıdaki maddeler dikkate alınmalıdır:
Beklenen patojenler ve bu patojenlerin antibakteriyel ajanlara karşı olası duyarlılıkları (bkz. Bölüm 4.4)
4.3. Kontrendikasyonlar
AUGMENTİN, diğer beta-laktam ajanlara karşı (örn. sefalosporin, karbapenem veya monobaktam) aşırı duyarlılık hikayesi (örn. anafilaksi) olanlarda kontrendikedir.
Geçmişinde AUGMENTİN'e bağlı sarılık/karaciğer fonksiyon bozukluğu hikayesi olan hastalarda kontrendikedir (bkz. Bölüm 4.8).
4.4. Özel kullanım uyarıları ve önlemleri
AUGMENTİN ile tedaviye başlanmadan önce geçmişinde penisilin, sefalosporin veya diğer beta laktam ajanlara karşı aşırı duyarlılık hikayesi varlığı dikkatlice sorgulanmalıdır (bkz. Bölüm 4.3 ve 4.8).
Penisilin tedavisi alan hastalarda ciddi ve bazen öldürücü aşırı duyarlılık reaksiyonları (anafilaktoid ve şiddetli kutanöz advers reaksiyonlar dahil) bildirilmiştir. Bu reaksiyonların, geçmişinde penisiline karşı aşırı duyarlılık hikayesi olan ve atopik bireylerde görülmesi daha olasıdır. Bir alerjik reaksiyon meydana gelirse AUGMENTİN tedavisi sonlandırılmalı ve uygun alternatif bir tedaviye başlanmalıdır.
Bir enfeksiyonun amoksisiline duyarlı organizma/organizmalara bağlı olduğu kanıtlanırsa, resmi kılavuzlara göre amoksisilin/klavulanik asitten amoksisiline geçiş göz önünde bulundurulmalıdır.
AUGMENTİN'in bu formu, klavulanik asit inhibisyonuna duyarlı beta laktamazların aracılık etmediği beta laktam ajanlara dirençli, olası patojenlerin yüksek riski söz konusu ise kullanıma uygun değildir. Bu form, penisiline dirençli S. pneumoniae tedavisinde kullanılmamalıdır.
Böbrek fonksiyonunda bozukluk olan veya yüksek dozlar alan hastalarda konvülsiyonlar görülebilir (bkz. Bölüm 4.8).
Amoksisilin kullanımını takiben görülen kızamık benzeri döküntü enfeksiyöz mononükleoz ile ilişkili olabileceğinden, eğer enfeksiyöz mononükleoza ilişkin bir şüphe var ise AUGMENTİN tedavisinden kaçınılmalıdır.
Amoksisilin ile eş zamanlı olarak allopurinol kullanılması alerjik cilt reaksiyonu olasılığını arttırabilir.
Uzun süreli kullanım zamanla duyarlı olmayan organizmaların aşırı çoğalmasına neden olabilir.
Tedavinin başında püstüllerle birlikte ateşli bir genel eritemin oluşması akut jeneralize eksantematöz püstülozun (AGEP) bir semptomu olabilir (bkz. Bölüm 4.8). Bu reaksiyon AUGMENTİN tedavisinin sonlandırılmasını gerektirir ve daha sonraki amoksisilin kullanımını kontrendike hale getirir.
Amoksisilin/klavulanik asit karaciğer fonksiyon bozukluğu bulgusu olan hastalarda dikkatle kullanılmalıdır (bkz. Bölüm 4.2, 4.3 ve 4.8).
Karaciğer olayları daha çok erkeklerde ve yaşlı hastalarda bildirilmiştir ve uzun süreli tedaviyle ilişkili olabilir. Bu olaylar çocuklarda nadiren bildirilmiştir. Tüm popülasyonlarda belirti ve semptomlar, genellikle tedavi sırasında ya da tedaviden kısa süre sonra ortaya çıkar ancak bazı vakalarda tedavinin kesilmesinin ardından birkaç haftaya kadar belirgin hale gelmeyebilir. Bunlar genellikle geri dönüşlüdür. Hepatik olaylar ciddi olabilir ve son derece nadir koşullarda ölümler bildirilmiştir. Bunlar hemen her zaman altta yatan ciddi hastalığı olanlarda ya da eş zamanlı olarak karaciğer üzerinde etkili olma potansiyeli bilinen ilaçları kullananlarda meydana gelmiştir (bkz. Bölüm 4.8).
Amoksisilin dahil neredeyse tüm antibakteriyel ajanlarla, antibiyotiğe bağlı kolit bildirilmiştir ve şiddeti hafiften yaşamı tehdit edici boyuta kadar değişebilir (bkz. Bölüm 4.8). Bu nedenle, herhangi bir antibiyotik tedavisi sırasında veya sonrasında ishal olan hastalarda bu teşhisin değerlendirilmesi önemlidir. Antibiyotiğe bağlı kolit gözlendiğinde, amoksisilin/klavulanik asit tedavisi derhal kesilmeli, bir doktor tarafından değerlendirilmeli ve uygun tedavi başlatılmalıdır. Bu durumda anti-peristaltik ilaçlar kontrendikedir.
Uzun süreli tedavi sırasında renal, hepatik ve hematopoetik fonksiyon dahil, organ sistem fonksiyonlarında periyodik değerlendirme tavsiye edilir.
AUGMENTİN ve oral antikoagülan kullanan bazı hastalarda seyrek olarak protrombin zamanında uzama (INR değerinde yükselme) bildirilmiştir. Antikoagülanlar ile birlikte reçete edildiğinde uygun şekilde izlenmesi gereklidir. İstenilen antikoagülasyon düzeyini sürdürebilmek için oral antikoagülasyon dozunda ayarlama yapılması gerekebilir (bkz. Bölüm 4.5 ve 4.8).
Böbrek bozukluğu olan hastalarda doz, böbrek bozukluğunun derecesine uygun şekilde ayarlanmalıdır (bkz. Bölüm 4.2).
Azalmış idrar çıkışı olan hastalarda, özellikle parenteral tedavide, çok seyrek olarak kristalüri görülmüştür. Yüksek doz amoksisilin tedavisi sırasında, amoksisilin kristalüri olasılığını azaltmak için, uygun miktarda sıvı alınması ve idrar miktarının düzenlenmesi tavsiye edilebilir. Mesane kateterleri olan hastalarda düzenli olarak açıklık kontrolü yapılmalıdır (bkz. Bölüm 4.9).
Amoksisilinle tedavi sırasında idrarda glukozun arandığı testler yapıldığında, enzimatik glukoz oksidaz yöntemleri kullanılmalıdır çünkü enzimatik olmayan yöntemlerde yalancı pozitif sonuçlar görülebilir.
Amoksisilin/klavulanik asit alan ve daha sonra Aspergillus enfeksiyonunun bulunmadığı saptanan hastalarda Bio-Rad Laboratuarları Platelia Aspergillus EIA testi kullanıldığında pozitif test sonuçları bildirilmiştir. Bio-Rad Laboratuarları Platelia Aspergillus EIA testi ile Aspergillus-
dışı polisakkaridler ve polifuranozlar arasında çapraz reaksiyonlar bildirilmiştir. Bu nedenle amoksisilin/klavulanik asit alan hastalardaki pozitif test sonuçları dikkatli yorumlanmalı ve başka tanı yöntemleriyle doğrulanmalıdır.
Bu tıbbi ürün, 5 mL'de 12,5 mg aspartam içerir ve bu fenilalanin için bir kaynaktır. Bu nedenle, fenilketonürili hastalarda dikkatli kullanılmalıdır. 12 haftadan küçük bebeklerde aspartam kullanımını değerlendirme için klinik veriler ve klinik olmayan veriler mevcut değildir.
Bu tıbbi ürünün formülasyonunda yer alan tatlandırıcılar maltodekstrin (glukoz) ve benzil alkol (0,00124 mg/ml) içerir. Nadir glukoz-galaktoz malabsorpsiyon hastalığı olan hastaların bu ilacı kullanmamaları gerekir. Benzil alkol, alerjik reaksiyonlara neden olabilir. Benzil alkolün intravenöz uygulaması, yeni doğanlarda ciddi yan etkiler ve ölümle ilişkilendirilmiştir (nefes darlığı sendromu). Toksisitenin oluşabileceği minimum benzil alkol miktarı bilinmemektedir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Oral antikoagülanlar:
Oral antikoagülanlar ve penisilin antibiyotikleri aralarında herhangi bir etkileşim raporlanmadan pratikte yaygın olarak kullanılmıştır. Buna karşın, literatürde, asenokumarol veya varfarin kullanan ve bir kür amoksisilin tedavisi verilen hastalarda uluslararası normalleştirilmiş oran (INR) değerinde yükselme görülen vakalar bildirilmiştir. Eğer birlikte kullanılması gerekli ise, amoksisilin kullanımının başlatılması veya bırakılması sürecinde protrombin zamanı veya INR değeri dikkatle takip edilmelidir. Ayrıca, oral antikoagülanların dozunda ayarlamalar gerekebilir (bkz. Bölüm 4.4 ve 4.8).
Metotreksat:
Penisilinler metotreksatın atılımını azaltabilir ve bu durum toksisitede potansiyel bir artışa neden olur.
Probenesid:
Probenesid ile birlikte kullanımı önerilmemektedir. Probenesid, amoksisilinin renal tübüler sekresyonunu azaltır. Probenesidin AUGMENTİN ile birlikte kullanımı amoksisilinin kan seviyelerinin artışına ve kanda bulunma süresinin uzamasına neden olabilirken, bu durum klavulanik asit için görülmez.
Mikofenolat mofetil:
Mikofenolat mofetil alan hastalarda, oral amoksisilin ve klavulanik asit başlatılmasını takiben aktif metabolit mikofenolik asidin doz öncesi konsantrasyonunda yaklaşık %50'lik bir azalma bildirilmiştir. Doz öncesi düzeydeki değişim, genel metabolit mikofenolik asit maruziyetindeki değişimleri doğru şekilde temsil etmeyebilir. Bu nedenle, mikofenolat mofetil dozunda bir değişiklik, graft fonksiyon bozukluğuna ilişkin klinik kanıt yokluğunda normalde gerekli olmamalıdır. Bununla birlikte, kombinasyon sırasında ve antibiyotik tedavisinden kısa süre sonra yakın klinik takip yürütülmelidir.
Allopurinol:
Amoksisilin tedavisi sırasında allopurinol kullanımı alerjik cilt reaksiyonları olasılığını artırabilir. Allopurinol ve AUGMENTİN'in birlikte kullanımına ait veri bulunmamaktadır.
Oral kontraseptifler:
Diğer antibiyotiklerde de olduğu gibi AUGMENTİN, bağırsak florasını etkileyebilir. Bu durum östrojen reabsorpsiyonunun azalmasına yol açar ve kombine oral kontraseptiflerin etkililiğini azaltır.
Özel popülasyonlara ilişkin ek bilgiler:
Veri bulunmamaktadır.
Pediyatrik popülasyon:
Yukarıda verilen bilgiler pediyatrik popülasyon için geçerlidir.
4.6. Gebelik ve laktasyon
Gebelik Kategorisi: B
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Diğer antibiyotiklerde de olduğu gibi AUGMENTİN, bağırsak florasını etkileyebilir. Bu durum östrojen reabsorpsiyonunun azalmasına yol açar ve kombine oral kontraseptiflerin etkililiğini azaltır. Bu nedenle tedavi süresince alternatif, etkili ve güvenilir bir doğum kontrol yöntemi uygulanmalıdır.
Gebelik dönemi
Hayvanlar üzerinde yapılan çalışmalar, gebelik/embriyonal/fetal gelişim/doğum ya da doğum sonrası gelişim ile ilgili olarak doğrudan ya da dolaylı zararlı etkiler olduğunu göstermemektedir (bkz. Bölüm 5.3).
Gebe kadınlara verilirken tedbirli olunmalıdır.
İnsanlarda gebelik sırasında amoksisilin/klavulanik asit kullanımına ilişkin kısıtlı veriler, artmış konjenital malformasyonlar riskine işaret etmemektedir.
Preterm, prematüre fetal membran yırtılması (pPROM) olan kadınlarda yapılan bir çalışmada, AUGMENTİN'in profilaktik kullanımının yeni doğanlarda nekroze enterokolit riskinin artması ile ilişkili olabileceği bildirilmiştir. Doktor tarafından gerekli görülmedikçe gebelik esnasında kullanılmamalıdır.
Laktasyon dönemi
AUGMENTİN'in iki etkin maddesi de anne sütüne geçer (klavulanik asitin anne sütü alan süt çocukları üzerindeki etkisi ile ilgili herhangi bir bilgi yoktur). Dolayısıyla, anne sütüyle beslenen süt çocuklarında ishal ve mukoz mebranlarda mantar enfeksiyonu olasılığı vardır. Bu nedenle emzirmenin kesilmesi gerekebilir. Sensitizasyon olasılığı göz önüne alınmalıdır. Emzirme döneminde amoksisilin/klavulanik asit, sadece tedaviyi uygulayan hekimin fayda/risk değerlendirmesinden sonra kullanılmalıdır.
Üreme yeteneği/Fertilite
Oral ve parenteral yolla verildiği hayvanlar (fare ve sıçanlar) üzerinde yapılan reprodüktif çalışmalarda AUGMENTİN teratojenik etki göstermemiştir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
AUGMENTİN'in araç ve makine kullanımı üzerindeki etkileriyle ilgili bir çalışma yapılmamıştır. Buna karşın, araç ve makine kullanımını etkileyebilecek istenmeyen etkiler (örneğin; alerjik reaksiyonlar, sersemlik hali, konvülsiyonlar) oluşabilir (bkz. Bölüm 4.8).
4.8. İstenmeyen etkiler
En çok bildirilen advers ilaç reaksiyonları ishal, bulantı ve kusmadır.
AUGMENTİN ile yapılan klinik çalışmalardan ve pazarlama sonrası gözetimden elde edilen ve MedDRA sistem organ sınıfına göre ayrılan advers ilaç reaksiyonları aşağıda listelenmektedir.
İstenmeyen etkilerin meydana gelme sıklıklarına göre sınıflandırılması için aşağıdaki terminolojiler kullanılmıştır:
Çok yaygın (≥1/10); yaygın (â¥1/100 ila <1/10); yaygın olmayan (â¥1/1.000 ila <1/100); seyrek (â¥1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Enfeksiyonlar ve enfestasyonlar
Yaygın: Mukokutanöz kandidiyazis
Bilinmiyor: Duyarlı olmayan organizmaların aşırı çoğalması
Kan ve lenf sistemi hastalıkları
Seyrek: Geri dönüşümlü lökopeni (nötropeni dahil), trombositopeni
Bilinmiyor: Geri dönüşümlü agranülositoz, hemolitik anemi, kanama ve protrombin zamanında uzama
Bağışıklık sistemi hastalıkları
Bilinmiyor: Anjiyonörotik ödem, anafilaksi, serum hastalığı benzeri sendrom, aşırı duyarlılık vasküliti
Sinir sistemi hastalıkları
Yaygın olmayan: Baş ağrısı ve baş dönmesi
Bilinmiyor: Geri dönüşümlü hiperaktivite, konvülsiyonlar aseptik menenjit
Gastrointestinal hastalıkları
Yaygın: Diyare, bulantı, kusma
Yaygın olmayan: Sindirim güçlüğü Bilinmiyor: Antibiyotiğe bağlı kolit
Siyah tüylü dil (dildeki papillaların belirginleşip siyah renk alması) Diş rengi değişikliği
Hepato-bilier hastalıkları
Yaygın olmayan: AST ve/veya ALT değerlerinde yükselme Bilinmiyor: Hepatit ve kolestatik sarılık
Deri ve derialtı doku hastalıkları
Yaygın olmayan: Deride döküntü, kaşıntı, ürtiker Seyrek: Eritema multiforme
Bilinmiyor: Stevens-Johnson sendromu, toksik epidermal nekrolizis, bülloz döküntülü dermatit, akut generalize ekzantemöz püstüller (AGEP),
eozinofili ve sistemik semptomların eşlik ettiği ilaç reaksiyonu (DRESS)
Böbrek ve idrar hastalıkları
Bilinmiyor: İnterstisyel nefrit, kristalüri
Şüpheli advers reaksiyonların raporlanması:
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
Aşağıda gösterildiği şekilde su ekleyiniz.
AUGMENTİN süspansiyonlarda sulandırma çizgisi, şişenin etrafını çevreleyen şeffaf bir girinti şeklinde gösterilmiştir. Sulandırma çizgisi (şeffaf girinti) 70 mL ve 100 mL şişelerde farklı seviyelerde bulunmaktadır.
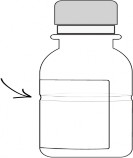
Sulandırma Çizgisi
Sulandırma Çizgisi
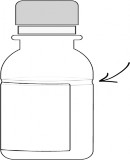
70 mL 100 mL
 Gıda Alerjisi
Her yıl milyonlarca insan yiyeceklere alerji gösteriyor.
Gıda Alerjisi
Her yıl milyonlarca insan yiyeceklere alerji gösteriyor. |
 En Yaygın Alerji Türleri
Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir.
En Yaygın Alerji Türleri
Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir. |
İLAÇ GENEL BİLGİLERİ
Glaxo Smith Kline İlaçları San.Ve Tic.A.Ş
| Geri Ödeme Kodu | A01030 |
| Satış Fiyatı | 92.01 TL [ 22 Apr 2024 ] |
| Önceki Satış Fiyatı | 92.01 TL [ 15 Apr 2024 ] |
| Original / Jenerik | Jenerik İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699522285822 |
| Etkin Madde | Amoksisilin + Klavulanik Asit |
| ATC Kodu | J01CR02 |
| Birim Miktar | 200+28,5 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 100 |
| Enfeksiyona Karşı Kullanılan (Antienfektif) İlaçlar > Penisilinler > Amoksisilin ve Klavulanik Asit |
| Yerli ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Tiroid Kanseri En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur. |
 |
Mide Kanseri Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir. |
 |
Deri Kanseri Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör. |