MYRALON 150 mcg/20 mcg tablet Kısa Ürün Bilgisi
{ Desogestrel + Etinilestradiol }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
MYRALON 150 mcg/20 mcg Tablet
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her bir tablet 150 mikrogram desogestrel ve 20 mikrogram etinilestradiol içermektedir.
Yardımcı maddeler
Laktoz (ineklerden elde edilir), tablet ağırlığı 80 mg olana kadar Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
Tablet
Tabletler, beyaz renkte, yuvarlak, bikonveks ve 6 mm çapındadır. Her tabletin bir tarafı 4'ün üzerinde âTR', diğer tarafı ise Organon* ile işaretlenmiştir.
âALT yükselmeleri
Hepatit C virüsü enfeksiyonları (HCV) için ribavirin içeren veya içermeyen ombitasvir / paritaprevir / ritonavir ve dasabuvir içeren tıbbi ürünlerle tedavi edilen hastalarda yapılan klinik çalışmalar sırasında, normal üst sınırının (ULN) 5 katından daha fazla transaminaz (ALT) yükselmeleri, kombine hormonal kontraseptifler (KHK'ler) gibi etinilestradiol içeren ilaçlar kullanmakta olan kadınlarda anlamlı olarak daha sıklıkla oluşmuştur. Ayrıca glekaprevir / pibrentasvir ile tedavi edilen hastalarda da, KHK gibi etinilestradiol içeren ilaçlar kullanan kadınlarda ALT yükselmeleri gözlenmiştir (Bkz. Bölüm 4.3 ve 4.5).
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Oral kontrasepsiyon (Doğum Kontrolü)
MYRALON reçetelenme kararında kadının mevcut risk faktörleri, özellikle venöz tromboembolizm (VTE) için risk faktörleri ve MYRALON kullanımıyla VTE riskinin diğer kombine hormonal kontraseptiflerle (KOK) karşılaştırması göz önünde bulundurulmalıdır (Bkz. Bölüm 4.3 ve 4.4).
4.2. Pozoloji ve uygulama şekli
MYRALON nasıl kullanılmalıdır
Tabletler paketin üzerinde belirtilen sırayla, her gün yaklaşık aynı saatlerde, yeterli miktarda su ile alınmalıdır. 21 ardışık gün boyunca günde bir tablet alınacaktır. Bir sonraki pakete, genellikle çekilme kanamasının gerçekleştiği 7 günlük tablet alınmayan aradan sonra başlanacaktır. Kanama genellikle son tablet alındıktan 2-3 gün sonra başlar ve bir sonraki pakete başlandığında bitmemiş olabilir.
MYRALON kullanmaya nasıl başlanacaktır
Daha önce hormon ile doğum kontrolü uygulanmamışsa (geçen ay içerisinde)
Tercihen ilk paketten tablet alımına adet döneminin birinci gününde (adet kanamasının ilk günü) başlanması önerilir; bu durumda ilave doğum kontrol önlemlerine gerek yoktur.
Eğer adet kanaması başlamışsa (2, 3 veya 4 gün önce), tablet alımına menstrüal periyodun 5. günü başlanmalıdır. Bu durumda tablet kullanılan ilk 7 gün süresince ilave doğum kontrol önlemlerinin alınması önerilmektedir.
Eğer adet kanaması başlayalı 5 günden fazla olmuşsa, hastaya MYRALON tableti almadan önce bir sonraki adet dönemine kadar beklemesi söylenmelidir.
21 günlük tablet veya başka bir 22 günlük tabletten haptan MYRALON'a geçiş:
Eski paketteki tüm tabletler bitirilmelidir. İlk MYRALON tableti ertesi gün alınmalıdır; yani
tabletlerin alımı arasında hiç boşluk bırakılmaz ve hastanın adet döneminin başlamasını
beklemesine gerek yoktur. Tabletler âMYRALON nasıl kullanılmalıdırâ başlığı altında verilen talimatlara göre alınmalıdır. İlave doğum kontrol önlemlerinin alınması gerekmez. Hasta ilk
MYRALON paketinin sonuna kadar adet kanaması yaşamayacaktır; ancak bunun zararı yoktur ve tablet alınan günlerde bir miktar kanama olursa bunun da zararı yoktur.
Başka bir kombine her gün alınan tabletten (28 günlük tabletler) MYRALON'a geçiş MYRALON'a her gün alınan tablet paketindeki son aktif tablet alındıktan sonra (yani 21 veya 22 tablet alındıktan sonra) başlanmalıdır. İlk MYRALON tableti ertesi gün alınır; yani tabletlerin alımı arasında hiç boşluk bırakılmaz ve hastanın adet döneminin başlamasını beklemesine gerek yoktur. Kesintisiz olarak 21 gün boyunca her gün aynı saatte bir tablet alınır ve onu 7 günlük tabletsiz dönem izler. Sonraki her pakete 7 günlük tabletsiz dönem bitince başlanır. İlave doğum kontrol önlemlerinin alınması gerekmez. 28 günlük pakette kalan fazla tabletler atılmalıdır. Hasta ilk MYRALON paketinin sonuna kadar adet kanaması yaşamayacaktır; ancak bunun zararı yoktur ve tablet alınan günlerde bir miktar kanama olursa bunun da zararı yoktur.
Sadece progestojen içeren bir tabletten (Mini Hap) MYRALON'a geçiş:
İlk MYRALON tablet, adet kanamasının ilk gününde (o gün kadın bir mini hap almış olsa bile) alınmalıdır. Kesintisiz olarak 21 gün boyunca her gün aynı saatte bir tablet alınır ve onu 7 günlük tabletsiz dönem izler. Sonraki her pakete 7 günlük tabletsiz dönem dolduktan sonra başlanır. Daha sonra ilave doğum kontrol önlemlerinin alınması gerekmez. Mini tablet paketinde kalan tüm sadece progestojen içeren haplar atılmalıdır.
Eğer kadın bir mini hap almaktaysa, her zaman adet kanaması yaşamayabilir (özellikle emzirme döneminde). İlk MYRALON tableti, mini hapın bırakıldığı günün ertesi günü alınmalıdır. Mini hap paketinde kalan tüm haplar atılmalıdır. İlk 7 gün boyunca ilave doğum kontrol önlemleri alınmalıdır.
Sadece progestojen içeren enjeksiyon, implant veya progestojen salan bir rahim içi sistemden geçiş
Kadın implanttan herhangi bir günde, rahim içi sistemden bu sistemin bırakıldığı gün ve enjektabl bir üründen sonraki enjeksiyon zamanı geldiğinde geçiş yapabilir. İlk 7 gün boyunca ilave doğum kontrol önlemleri alınmalıdır.
Doğumdan Sonra Uygulama
Bebek doğduktan sonra, emzirmeyen annelere hormonal kontraseptif uygulamasına doğumdan 21 gün sonra başlanmalıdır; bu durumda hiçbir ilave doğum kontrol önlemine gerek yoktur. Eğer doğumdan sonra cinsel ilişki gerçekleşmişse, hormonal kontraseptif kullanımı adet kanamasının ilk gününe kadar ertelenmelidir.
Doğumun ardından 21 günden fazla süre geçmişse, MYRALON'un doğum sonrası uygulamasında ilk 7 gün ilave kontraseptif önlemler gereklidir.
Not: Emziren annelere kombine hap kullanmamaları söylenmelidir; çünkü kombine hap anne sütünün miktarını azaltabilir; onun yerine sadece progestojen içeren bir hap kullanmaları önerilmelidir.
Düşük veya kürtajdan sonra uygulamaya derhal başlanmalıdır; bu durumda hiçbir ilave doğum kontrol önlemine gerek yoktur.
İlave doğum kontrol önlemleri
İlave doğum kontrol önlemleri gerekirse, hastaya ya hiç cinsel ilişkiye girmemesi ya da
diyafram ile birlikte spermisit kullanması ya da eşinin prezervatif kullanması tavsiye
edilmelidir.
Takvim yöntemleri önerilmemelidir; çünkü hap doğal menstrüasyon döngüsüyle ilişkili olağan
siklus değişikliklerini (örn., servikal mukusta ve vücut sıcaklığında değişiklikler) etkiler.
Bir adet dönemi nasıl atlanır?
Bir adet dönemini atlamak için, yeni MYRALON paketine mevcut paket bitirildikten sonraki gün başlanmalıdır (hasta tabletsiz günleri atlar). Tablet alımına olağan şekilde devam edilmelidir. İkinci paketin kullanımı sırasında kadın hafif lekelenme veya ara kanama yaşayabilir; ancak hiçbir tablet atlanmadığı sürece ilave doğum kontrol yöntemine ihtiyaç yoktur. Sonraki MYRALON paketine, adet kanaması tamamen bitmiş olsun veya olmasın, olağan 7 günlük tabletsiz dönemden sonra başlanır.
Tablet kullanımı unutulduğunda yapılması gerekenler:
Tablet alımının unutulması durumunda öneriler
Tabletlerin alımı unutulursa MYRALON'un güvenilirliği azalabilir:
Unutulan tablet 12 saat içerisinde alınırsa, ilave hiçbir önleme gerek yoktur; sonraki tabletler normal zamanında alınmalıdır.
Kullanıcının tablet almayı unutmasından itibaren 12 saatten fazla bir süre geçmişse, gebeliğe karşı koruyucu etki azalmış olabilir. Kadın, almayı unuttuğu son tableti almalı (aynı gün iki tablet alınması anlamına gelse bile) ve ardından tabletleri normal zamanında almaya devam etmelidir. Sonraki 7 gün boyunca ilave doğum kontrol önlemleri alınmalı ve hasta â7 gün kuralınıâ uygulamalıdır.
7 Gün Kuralı
Herhangi bir tabletin alımı 12 saatten uzun süre unutulursa, Kadın 12 saatten daha uzun süren kusma veya diyare yaşarsa,
Kadın âDiğer tıbbi ürünler ile etkileşimlerâ bölümünde listelenen ilaçlardan herhangi birini alıyorsa:
Kadın tabletleri olağan şekilde almaya devam etmeli ve sonraki 7 gün boyunca ilave doğum kontrol önlemleri alınmalıdır.
Ancak, bu 7 günlük süre mevcut paketin bitiminden sonrasına uzarsa, sonraki pakete mevcut paket bittiği anda başlanmalıdır; yani paketler arasında hiç boşluk bırakılmamalıdır (Bu, tablet alımında oluşacak uzun süreli bir arayı önler; uzun süreli ara ovülasyon riskini arttırabilir ve dolayısıyla kontraseptif korumayı azaltabilir). Kadın 2 paket bitene kadar adet kanaması yaşamayabilir; ancak bunun zararı yoktur ve tablet alınan günlerde bir miktar kanama olursa bunun da zararı yoktur.
Kusma veya şiddetli diyare durumunda öneriler
Şiddetli gastrointestinal bozukluklarda, emilim tam olarak gerçekleşmeyebilir ve ilave doğum kontrol hapı almak gerekebilir. Diyare aşırı derecede şiddetli olmadıkça, steroid emilimini etkilemez.
Tablet alındıktan sonra 3-4 saat içerisinde kusma meydana gelirse veya şiddetli veya uzun süreli diyare durumlarında, unutulan tabletlerle ilgili önerilere uyulması gerekmektedir. Normal tablet alım takviminin değiştirilmesi arzu edilmiyorsa başka bir paketten ekstra tablet(ler)in alınması gerekmektedir.
Uygulama şekli:
Ağızdan yeterli miktarda su ile alınmalıdır.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek/Karaciğer yetmezliği:
Herhangi bir etkililik ve güvenlilik çalışması yapılmamıştır.
Karaciğer fonksiyon testlerinin sonuçları anormal olursa, tedavi bırakılmalıdır. İlave bilgi için Bkz. Bölüm 4.3. ve Bkz. Bölüm 4.4.
Pediyatrik popülasyon:
18 yaşın altındaki adolesanlarda desogestrelin güvenliliği ve etkililiği bilinmemektedir. Herhangi bir veri mevcut değildir.
Geriyatrik popülasyon:
Herhangi bir etkililik ve güvenlilik çalışması yapılmamıştır.
4.3. Kontrendikasyonlar
Etkin madde
KHK'ler aşağıda listelenen durumların herhangi birinin varlığında kullanılmamalıdır. Aşağıda belirtilen durumlardan herhangi biri KHK kullanımı sırasında ilk defa ortaya çıkarsa, ürün kullanımı hemen durdurulmalıdır:
Mevcut venöz tromboembolizm (VTE) veya VTE riski
VTE â mevcut VTE (antikoagülan kullanırken) veya VTE öyküsü (örn. derin ven
trombozu [DVT] veya pulmoner emboli [PE])
APC direnci (Faktör V Leiden dahil), antitrombin III eksikliği, protein C eksikliği, protein S eksikliği gibi venöz tromboembolizm için bilinen kalıtsal veya edinilmiş predispozisyon
4.4. Özel kullanım uyarıları ve önlemleri
Uyarılar
Aşağıda belirtilen durum ya da risk faktörlerinden herhangi birinin varlığında, MYRALON'un uygunluğu kadın ile tartışılmalıdır.
Bu durumlardan veya risk faktörlerinden herhangi birinin şiddetlenmesi veya ilk kez görülmesi durumunda, MYRALON kullanımının durdurulup durdurulmayacağına karar vermek için derhal doktoru ile temasa geçmesi kadına tavsiye edilmelidir.
âDolaşım Bozuklukları
VTE riski
Herhangi bir KHK kullanımı hiç kullanım olmamasına kıyasla VTE riskini artırır. Levonorgestrel, norgestimat veya noretisteron en düşük VTE riskiyle ilişkilendirilmiştir. MYRALON gibi diğer ürünlerde risk seviyesi bunun iki katına kadar olabilir. En düşük VTE riski olan ürün dışında herhangi bir ürünün kullanılmasına, MYRALON'la VTE riski, mevcut risk faktörlerinin riski nasıl etkilediği ve kullanımın ilk yılında VTE riskinin en fazla olduğu kadınla konuşulduktan ve anladığına kanaat getirildikten sonra karar verilmelidir. Buna ek olarak, 4 hafta veya daha uzun süre KHK kullanımından sonra ara verilip tekrar başlandığından, riskin arttığına dair bulgular vardır.
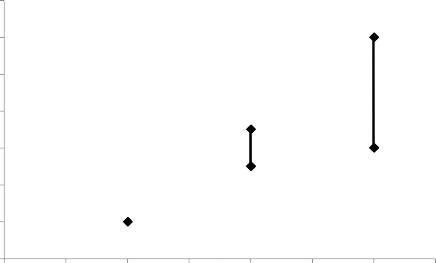
KHK kullanmayan veya hamile olmayan kadınlarda, bir yıl içinde 10.000 kadından 2'sinde VTE gerçekleşir. Ancak, altta yatan risk faktörlerine (Bkz. aşağıdaki bölüm) bağlı olarak, bir kadındaki kişisel risk çok daha yüksek olabilir.
Desogestrel içeren KHK kullanan 10.000 kadından yaklaşık 9 ila 12'sinde bir yıl içerisinde VTE gelişeceği tahmin edilmektedir; bu, bir yılda levonorgestrel içeren KHK kullanan
10.000 kadından 6'sına karşılık gelmektedir.
Her iki durumda da bir yıldaki VTE sayısı, hamile olan veya postpartum dönemdeki kadınlarda beklenen sayıdan daha düşüktür.
Vakaların %1 ila 2'sinde VTE ölümcül olabilir.
Bir yılda 10.000 kadında VTE olaylarının sayısı
12
10
8
6
4
2
0
KHK kullanıcılarında hepatik, mezenterik, renal ya da retinal venler ve arterler gibi diğer kan damarlarında son derece seyrek olarak tromboz bildirilmiştir.
VTE için risk faktörleri
KHK kullanan, ilave risk faktörleri olan bir kadında, özellikle birden fazla risk faktörü varsa (bkz. aşağıdaki tablo) venöz tromboembolik komplikasyon riski büyük oranda artabilir.
Birden fazla risk faktörü nedeniyle yüksek VTE riski olan kadınlarda MYRALON kontrendikedir (Bkz. Bölüm 4.3). Bir kadında birden fazla risk faktörü varsa, risk artışı, faktörlerin teker teker risk toplamından daha yüksek olabilir â bu durumda kadının toplam VTE riski değerlendirilmelidir. Risk yarar dengesi negatif olarak değerlendiriliyorsa, KHK reçetelenmemelidir (Bkz. Bölüm 4.3).
Tablo: VTE için risk faktörleri
Risk faktörü | Yorum |
Obezite (vücut kitle indeksi [VKİ] 30 kg/m'nin üzerinde) | VKİ arttıkça risk büyük oranda artar. Diğer risk faktörleri de mevcutsa özellikle göz önünde bulundurulması önemlidir |
Uzun süreli hareketsiz kalma, majör cerrahi, bacak veya pelvise yapılan herhangi bir cerrahi müdahale, nöroşirürji veya majör travma.
Not: Özellikle diğer risk faktörleri de mevcutsa, 4 saatten uzun havayolu seyahati dahil geçici hareketsiz kalma, VTE için bir risk faktörü olabilir. | Bu durumlarda bant/tablet/halkanın bırakılması (elektif cerrahi durumunda en azından 4 hafta önceden bırakılması) ve tekrar hareketlilik sağlandıktan 2 hafta sonrasına kadar başlanmaması tavsiye edilir. İstenmeyen gebeliği engellemek için başka bir doğum kontrol yöntemi kullanılmalıdır.
MYRALON önceden bırakılmadıysa antitrombotik tedavi düşünülmelidir. |
Pozitif aile öyküsü (kardeş veya ebeveynlerde VTE, özellikle 50 yaş öncesi gibi erken yaşlarda) | Kalıtsal predispozisyondan şüpheleniliyorsa, KOK kullanımına karar vermeden önce kadın bir uzmana yönlendirilmelidir. |
VTE ile ilişkili diğer tıbbi durumlar | Kanser, sistemik lupus eritematozus, hemolitik üremik sendrom, kronik inflamatuar bağırsak hastalığı (Crohn hastalığı veya ülseratif kolit) ve orak hücre anemisi |
Artan yaş | Özellikle 35 yaş üzeri |
Venöz trombozun başlangıcı veya progresyonunda varikoz venlerin veya süperfisyal tromboflebitin olası rolü hakkında fikir birliği yoktur.
Hamilelik sırasında, özellikle doğum sonrası 6 haftalık dönemde, artmış tromboembolizm riski göz önünde bulundurulmalıdır (gebelik ve laktasyon bilgileri için Bkz. Bölüm 4.6).
VTE'nin semptomları (derin ven trombozu ve pulmoner emboli)
Kadınlara semptomlar görüldüğü takdirde acil tıbbi yardıma başvurmaları ve ilgili sağlık çalışanına KOK kullandıklarını belirtmeleri gerektiği söylenmelidir.
Derin ven trombozunun (DVT)semptomlarıaşağıdakileriiçerir:
bacakta, yalnızca ayağa kalkarken veya yürürken hissedilebilen ağrı veya hassasiyet;
bacakta sıcaklık artışı; bacak derisinin kızarması veya soluklaşması
âDiğer durumlar
Hipertrigliseridemisi veya bu rahatsızlığa ilişkin bir aile öyküsü olan kadınlarda, KOK kullanıldığında pankreatit riskinde artış olabilmektedir.
Eksojen östrojenler, kalıtsal ve edinilmiş anjiyoödem semptomlarını indükleyebilir veya şiddetlendirebilir.
KOK kullanan birçok kadının kan basıncında küçük artışlar görülmekle birlikte, klinik açıdan anlamlı artışlar nadirdir. KOK kullanımı ile klinik hipertansiyon arasında herhangi bir ilişki saptanmamıştır. Fakat KOK kullanımı sırasında klinik açıdan anlamlı, kalıcı hipertansiyon gelişirse, doktorun KOK kullanımını kesmesi ve hipertansiyona yönelik tedavi uygulaması tedbirli bir davranış olacaktır. Uygun olduğu düşünüldüğünde, antihipertansif tedavi ile normal kan basıncı değerlerine ulaşıldıktan sonra KOK kullanımına tekrar başlanabilir.
Aşağıda sıralanan durumların hem gebelik hem de KOK kullanımı ile birlikte oluştuğu veya kötüleştiği bildirilmiştir, ancak KOK kullanımı ile bağlantısı kanıtlanmamıştır: Kolestaza bağlı sarılık ve/veya kaşıntı; safra taşı oluşumu; porfiri; sistemik lupus eritematozus; hemolitik-üremik sendromu; Sydenham's kore; herpes gestationis;
otoskleroza bağlı işitme kaybı.
KOK'lerin periferik insülin direnci ve glukoz toleransı üzerinde bir etkisi olmakla
birlikte, KOK kullanan diyabetik hastaların tedavi rejiminin değiştirilmesi gerektiğine
dair hiçbir kanıt mevcut değildir. Fakat diyabetik kadınlar KOK kullanırken dikkatli bir şekilde gözlem altında tutulmalıdırlar.
Karaciğer fonksiyonunun akut veya kronik rahatsızlıkları, kararaciğer fonksiyonu normale dönene kadar KOK kullanımının kesilmesini gerekterebilir. Daha önceden gebelik sırasında ya da seks hormonlarının kullanımı sırasında meydana gelen kolestatik sarılığın tekrarlanması KOK kullanımının durdurulmasını gerektirir.
Ülseratif kolit ve Crohn hastalığı, KOK kullanımı ile ilişkilendirilmiştir.
Özellikle kloazma gravidarum (gebelik maskesi) öyküsü olan kadınlarda nadiren kloazma oluşabilir. Kloazmaya eğilimi olan kadınlar, bu ilacı kullanırken güneş veya ultraviyole ışınlarına maruz kalmamaya özen göstermelidirler.
MYRALON her tablette < 80 mg laktoz içermektedir. Nadir kalıtımsal galaktoz intoleransı, Lapp-laktoz yetmezliği ya da glukoz-galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Etkileşimler:
Oral kontraseptifler ve diğer medikal ürünler arasında etkileşimler, ara kanamalara ve/veya oral kontasepsiyonun başarısız olmasına yol açabilirler. Aşağıdaki etkileşimler bildirilmiştir:
Karaciğer metabolizması:
Seks hormonlarının plazma konsantrasyonlarını düşüren artmış klerense sebep olabilen ve MYRALON de dahil, kombine oral kontraseptiflerin etkililiğini azaltabilen, özellikle sitokrom P450 enzimleri (CYP) olmak üzere, mikrozomal enzimleri indükleyen tıbbi veya bitkisel ürünler ile etkileşimler ortaya çıkabilir. Bu ürünler, (fenitoin, fenobarbital, primidon, bosentan, karbamazepin, rifampisin, rifabutin ve muhtemelen de okskarbazepin, topiramat, felbamat, griseofulvin bazı HIV proteaz inhibitörleri (örn., ritonavir) ve nonnükleozid revers transkriptaz inhibitörleri (örn. efavirenz) ve bitkisel bir ilaç olan St. John's Wort (Sarı Kantaron Otu) içeren ürünleri içerir. Enzim indüksiyonu tedaviden birkaç gün sonra ortaya çıkabilir. Maksimum enzim indüksiyonu genellikle birkaç hafta içinde gözlenir. İlaç tedavisi kesildikten sonra, enzim indüksiyonu 28 güne kadar sürebilir.
Hormonal kontraseptiflerle birlikte uygulandığında, HIV proteaz inhibitörlerinin (örneğin nelfinavir) ve nükleosid olmayan ters transkriptaz inhibitörlerinin (örneğin nevirapin) birçok kombinasyonu ve/veya Hepatit C virüsü (HCV) tıbbi ürünlerinin (örneğin, boceprevir, telaprevir) kombinasyonları, desogestrelin aktif metaboliti olan etonogestrel de dahil olmak üzere progestinlerin veya östrojenlerin plazma konsantrasyonlarını artırabilir veya azaltabilir. Bu değişikliklerin net etkisi bazı durumlarda klinik açıdan önemli olabilir.
Yukarıda bahsedilen herhangi bir hepatik enzim-indükleyici tıbbi veya bitkisel ürünlerden herhangi birini kullanan kadınlara MYRALON'un etkililiğin azalabileceği konusunda bilgi verilmelidir. Hepatik enzim-indükleyici tıbbi ürünün kullanılması sırasında ve hepatik enzim- indükleyici tıbbi ürün ile tedavinin sonlandırılmasından sonraki 28 gün için, MYRALON'a ek olarak bir bariyer doğum kontrol yöntemi kullanılmalıdır.
Eğer eş zamanlı ilaç kullanılan dönem, KOK paketindeki tabletler bittikten sonrasına uzuyorsa,
bir sonraki KOK paketine normal tabletsiz ara dönem bırakılmadan başlanmalıdır.
Enzim indükleyici tıbbi ürünlerle uzun süreli tedavi alan kadınlar için, enzim indükleyici tıbbi ürünlerden etkilenmeyen alternatif bir kontrasepsiyon yöntemi düşünülmelidir.
Güçlü (örneğin ketokonazol, itrakonazol, klaritromisin) veya orta dereceli (örneğin flukonazol, diltiazem, eritromisin) CYP3A4 inhibitörlerinin birlikte verilmesi, desogestrelin aktif metaboliti olan etonogestrel de dahil olmak üzere progestinlerin veya östrojenlerin serum konsantrasyonlarını artırabilir.
Oral kontraseptifler diğer ilaçların metabolizması ile etkileşebilir. Buna göre, plazma ve doku konsantrasyonları hem artabilir (örn. siklosporin) hem de azalabilir (örn. lamotrigin).
Not: Potansiyel etkileşimlerin tanımlanması amacıyla eş zamanlı uygulanan ilaçların reçetesindeki bilgilerine başvurulmalıdır.
Farmakodinamik etkileşimler
Ribavirin veya glekaprevir / pibrentasvir içeren veya içermeyen ombitasvir / paritaprevir /
ritonavir ve dasabuvir içeren tıbbi ürünlerle eş zamanlı kullanım, ALT yükselme riskini
artırabilir (Bkz. Bölüm 4.3 ve 4.4). Bu nedenle, MYRALON kullanıcıları, bu kombinasyon ilaç rejimiyle tedaviye başlamadan önce alternatif bir kontrasepsiyon yöntemine (örn., sadece progestojen içeren kontrasepsiyon veya hormonal olmayan yöntemler) geçmelidir. MYRALON, bu kombinasyon ilaç rejimi ile tedavinin tamamlanmasından 2 hafta sonra yeniden başlatılabilir.
Özel popülasyonlara ilişkin ek bilgiler:
Pediyatrik popülasyon:
18 yaşından küçük adolesanlarda etkililik ve güvenliliğe ilişkin hiçbir klinik veri mevcut değildir.
Laboratuvar Testleri:
Kontraseptif steroidlerin kullanılması, karaciğer, tiroid, adrenal ve renal fonksiyonlara ilişkin biyokimyasal parametreleri, kortikosteroit bağlayıcı globülin ve lipit/lipoprotein fransiyonları gibi taşıyıcı proteinlerin plazma düzeyleri, karbohidrat metabolizması parametreleri ile koagülasyon ve fibrinoliz parametreleri de dahil olmak üzere bazı laboratuvar tetkiklerinin sonuçlarını etkileyebilmektedir. Değişiklikler genellikle normal laboratuvar aralığında kalır.
4.6. Gebelik ve laktasyon
Gebelik kategorisi X'dir.
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
MYRALON, doğum kontrolü amacıyla kullanılmaktadır.
Gebelik dönemi
KHK'lerin gebelik süresince kullanımı endike değildir. MYRALON kullanımı sırasında gebelik gerçekleşirse kullanım sonlandırılmalıdır.
Ancak çoğu epidemiyolojik çalışmalarda, ne gebelik öncesinde KOK kullanan kadınların çocuklarında doğum kusurlarında bir yükselme, ne de KOK'lerin erken gebelik döneminde yanlışlıkla alınması neticesinde herhangi bir teratojenik etki görülmemiştir.
Doğum sonrası dönemde MYRALON kullanımına tekrar başlanırken VTE riskinin artışı göz önünde bulundurulmalıdır (Bkz. Bölüm 4.2 ve 4.4).
Laktasyon dönemi
KOK'ler anne sütünün kalitesini azalttıkları ve bileşimini değiştirdikleri için emzirme etkilenebilir. Dolayısıyla KOK kullanımı genel olarak bebeğin tamamen sütten kesilmesine kadar önerilmemektedir. Süt ile birlikte küçük miktarlarda kontraseptif steroidlerin ve/veya bunların metabolitlerinin salgılanması mümkün olmakla birlikte, bu durumun bebeğin sağlığı üzerinde olumsuz bir etkiye sahip olduğuna ilişkin herhangi bir kanıt mevcut değildir.
Üreme yeteneği/Fertilite
Bu tıbbi ürünün endikasyonu kontrasepsiyon olduğu için bu başlık geçerli değildir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
Araç ve makine kullanımı üzerine herhangi bir etkisi gözlenmemiştir.
4.8. İstenmeyen etkiler
Seçilmiş advers reaksiyonların tanımı
Tüm KHK'lardaki gibi, özellikle kullanımın ilk aylarında, vajinal kanama düzeninde değişiklik
görülebilir. Bu değişiklikler kanama sıklığında (hiç, az, daha sık veya devamlı), yoğunluğunda (azalan veya artan) ve süresindeki değişiklikleri içerebilir.
KHK kullanan kadınlarda, miyokard infarktüsü, inme, geçici iskemik atak, venöz tromboz ve pulmoner emboli dahil, arteriyel ve venöz trombotik ve tromboembolik olay riskinde artış gözlenmiştir; bölüm 4.4'te daha detaylı olarak bunlardan bahsedilmektedir.
MYRALON veya KHK kullanıcılarının genel olarak raporlaranmış muhtemelen bağlantılı istenmeyen etkiler aşağıda listelenmiştir. İstenmeyen olaylar aşağıda sistem organ sınıfına göre listelenmiştir. Sıklıklar şu şekilde tanımlanmıştır: Çok yaygın (≥1/10); yaygın (≥1/100 ila
≤1/10); yaygın olmayan (≥1/1000 ila ≤1/100); seyrek (≥1/10.000 ila ≤1/1.000); çok seyrek (≤1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Bağışıklık sistemi hastalıkları:
Seyrek: Hipersensitivite
Bilinmiyor: Kalıtsal ve edinilmiş anjiyoödem semptomlarının şiddetlenmesi
Metabolizma ve beslenme hastalıkları:
Yaygın olmayan: Sıvı tutulumu
Psikiyatrik hastalıkları:
Yaygın: Depresif ruh hali, değişken ruh hali Yaygın olmayan: Libido azalması
Seyrek: Libido artışı
Sinir sistemi hastalıkları:
Yaygın: Baş ağrısı Yaygın olmayan: Migren
Göz hastalıkları:
Seyrek: Kontakt lens intoleransı
Vasküler hastalıkları:
Seyrek: Venöz tromboembolizm hastalıkları, arteriyel tromboembolizm hastalıkları
Gastrointestinal hastalıkları:
Yaygın: Bulantı, karında ağrı Yaygın olmayan: Kusma, ishal
Deri ve deri altı doku hastalıkları:
Yaygın: Döküntü, ürtiker
Seyrek: Eritema nodosum, eritoma multiforme
Üreme sistemi ve meme hastalıkları:
Yaygın: Memede acı, meme hassasiyeti Yaygın olmayan: Memede büyüme Seyrek: Vajinal akıntı, memede akıntı
Araştırmalar:
Yaygın: Kiloda artış Seyrek: Kiloda azalma
Belirli bir istenmeyen etki reaksiyonunu tanımlama için en uygun MedDRA terimi
(versiyon11) listelenmiştir. Eş anlamlıları veya benzer koşulları listelenmemiştir ancak, göz
önünde bulundurulmalıdır.
4.9. Doz aşımı ve tedavisi
Doz aşımına bağlı ciddi zararlı etkilere ilişkin herhangi bir rapor mevcut değildir. Bu duruma bağlı olarak oluşabilen semptomlar şunlardır: Bulantı, kusma ve hafif vajinal kanama. Antidot mevcut değildir ve semptomatik tedavi uygulanmalıdır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapotik grup: Progestojen ve östrojen kombinasyonları (Sabit kombinasyonlar) ATC kodu: G03AA09
MYRALON 150 mikrogram desogestrel ile 20 mikrogram etinilestradiol içeren bir oral
kontraseptif kombinasyonudur.
Etinilestradiol iyi bilinen bir sentetik östrojendir.
Desogestrel sentetik bir progestojendir. Oral uygulamadan sonra, ovülasyonu güçlü biçimde baskılayıcı aktivite ve güçlü bir progestasyonel ve anti-östrojenik aktivite gösterir. Östrojenik aktiviteye sahip değildir. Androjenik/anabolizan aktivitesi zayıftır.
Pediyatrik popülasyon:
18 yaş altı adolesanlarda etkililik ve güvenlilikle ilgili klinik veri yoktur.
5.2. Farmakokinetik özellikler
Genel özelliklerDesogestrel
Emilim:
Oral olarak uygulanan desogestrel hızlı ve tam olarak emilmekte ve etonogestrele dönüştürülmektedir. Tek bir oral dozu takiben 2 nanogram/mL civarı olan doruk serum konsantrasyonlarına 1-2 saat içerisinde ulaşılır. Kararlı durumda, 5 nanogram/mL ortalama doruk serum konsantrasyonları gözlenmiştir. Biyoyararlanım % 62-81 arasındadır.
Dağılım:
Etonogestrel serum albüminine ve seks hormon bağlayıcı globüline (SHBG) bağlanır. Toplam serum ilaç konsantrasyonunun yalnızca %2-4'ü serbest steroid olarak bulunmaktadır ve
% 40-70'i spesifik olarak SHBG'ye bağlanmaktadır. SHBG düzeyinde etinilestradiol nedenli artış, öteki serum proteinlerinin dağılımını değiştirebilir, SHBG'ye bağlı fraksiyonu artırıp albumine bağlı fraksiyonu azaltır. Desogestrelin sanal dağılım hacmi 1,5 L/kg düzeyindedir.
Biyotransformasyon:
Etonogestrel, sitokrom P450 3A4 dahil olmak üzere steroid metabolizmasının bilinen yolları üzerinden tamamen metabolize olmaktadır. Serumdan metabolik klerens hızı yaklaşık 2 mL/dak/kg düzeyindedir. Birlikte uygulanan etinilestradiol ile herhangi bir etkileşim saptanmamıştır.
Eliminasyon:
Etonogestrel serum seviyesi iki fazda azalmaktadır. Terminal dispozisyon fazı, yaklaşık 30 saatlik bir yarılanma ömrü ile karakterizedir. Desogestrel ve bunun metabolitleri, yaklaşık 6:4'lük bir idrar / safra oranı ile atılmaktadır.
Doğrusallık/doğrusal olmayan durum:
Etonogestrel farmakokinetiği, etinilestradiol tarafından üç katına çıkarılan SHBG düzeyinin etkisi altındadır. Günlük oral alımı takiben, ilaç serum düzeyleri iki ile üç kat arasında artış göstermekte ve uygulama siklusunun ikinci yarısı içerisinde durağan durum koşullarına ulaşmaktadır.
Etinilestradiol
Emilim:
Oral yoldan uygulanan etinilestradiol hızlı ve tam olarak emilmektedir. Tek bir oral dozu takiben 30 pikogram/mL civarı olan doruk serum konsantrasyonlarına 1-2 saat içerisinde ulaşılmaktadır. Kararlı durumda doruk 65 pikogram/mL ortalama doruk konsantrasyonları gözlenmiştir. Presistemik konjügasyon ve ilk geçiş metabolizması sonucunda mutlak biyoyararlanım yaklaşık % 60 düzeyindedir.
Dağılım:
Etinilestradiol serum albüminine yüksek düzeyde, fakat spesifik olmayan biçimde bağlanmaktadır (yaklaşık % 98.5) ve serumdaki SHBG konsantrasyonlarında artışa yol açmaktadır. Yaklaşık 5 L/kg düzeyinde bir görünür dağılım hacmi saptanmıştır.
Biyotransformasyon:
Etinilestradiol, ince bağırsak mukozasında ve karaciğerde presistemik konjügasyona uğramaktadır. Etinilestradiol birincil olarak aromatik hidroksilasyon ile metabolize olmakla birlikte birçok hidroksillenmiş ve metillenmiş metabolitler oluşmakta ve bunlar serbest metabolit veya glukuronidler ve sülfatlarla konjügatlar şeklinde bulunmaktadır. Metabolik klerens hızı yaklaşık 5 mL/dak/kg düzeyindedir.
Eliminasyon:
Etinilestradiol serum düzeyleri iki fazda azalmaktadır, terminal dispozisyon fazı yaklaşık 24 saatlik bir yarılanma ömrü ile karakterizedir. Değiştirilmemiş ilaç atılmamakta, etinilestradiol metabolitleri 4:6 oranında idrar ve safra ile atılmaktadır. Metabolit atılımının yarılanma ömrü yaklaşık 1 gündür.
Doğrusallık/Doğrusal olmayan durum:
Kararlı durum konsantrasyonlarına, tek doza kıyasla serum ilaç düzeylerinin % 30-40 oranında
daha yüksek olması halinde 3-4 gün sonra ulaşılmaktadır.
5.3. Klinik öncesi güvenlilik verileri
5.3. Klinik öncesi güvenlilik verileri
Ancak, seks steroidlerinin belli hormonal doku ve tümörlerin büyümesini arttırdığı unutulmamalıdır.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Susuz koloidal silika
Laktoz monohidrat (ineklerden elde edilir)
Patates nişastası
Povidon
Stearik asit
all-rac-αtokoferol
6.2. Geçimsizlikler
Yoktur.
6.3. Raf ömrü
36 ay.
6.4. Saklamaya yönelik özel tedbirler
30°C'nin altında, ışık ve nemden korunarak saklanmalıdır.
6.5. Ambalajın niteliği ve içeriği
Aluminyum ile kaplı saşe içinde PVC/alüminyum blister.
21 beyaz tablet içeren blister.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Özel bir gereklilik yoktur.
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve
âAmbalaj Atıkları Kontrolü Yönetmeliğiâne uygun olarak imha edilmelidir.
 Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir.
Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir. |
 Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir.
Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| MYRALON | 8683280337282 | 241.92TL |
| Diğer Eşdeğer İlaçlar |
 |
HIV ve Aids HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan Virüsdür). Bu virüs AIDS hastalığına sebep olur. |
 |
Tiroid Kanseri En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur. |
 |
Travma Sonrası Bunalımı Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir. |
İLAÇ GENEL BİLGİLERİ
Organon Turkey İlaçları Ltd. Şti.
| Satış Fiyatı | 241.92 TL [ 26 Apr 2024 ] |
| Önceki Satış Fiyatı | 241.92 TL [ 22 Apr 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8683280337282 |
| Etkin Madde | Desogestrel + Etinilestradiol |
| ATC Kodu | G03AA09 |
| Birim Miktar | 0,15+0,02 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 21 |
| Ürogenital Sistem ve Cinsiyet Hormonları > Sistemik Hormonal Gebeliği Önleyici İlaçlar > Desogestrel + etinilestradiol |
| İthal ( ref. ülke : Italya ) ve Beşeri bir ilaçdır. |