KARDOES PREMIX 2500 mg/250 ml INFUXYONLUK çözelti Kısa Ürün Bilgisi
{ Esmolol Hcl }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
KARDOES PREMIX 2500 mg/250 ml İnfüzyonluk Çözelti Steril
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Esmolol hidroklorür: 10 mg/ml (Her bir 250 ml'lik torba 2500 mg esmolol hidroklorür içerir).
Yardımcı maddeler
Bu tıbbi ürün her bir torbasında yaklaşık 30,45 mmol (ya da 700 mg) sodyum içerir. Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
İnfüzyon için çözelti.
Berrak, renksiz ila açık sarı renkte çözelti.
Çözeltinin pH'sı 4,5 - 5,5 arası ve ozmolaritesi yaklaşık 300 mOsm/l'dir.
Beta blokörler sınıf reaksiyonu olarak bazı durumlarda psöriyazise ya da psöriyaziste kötüleşmeye neden olabilir.
Uygulama seti takılır; setle birlikte verilen talimata uyularak uygulamaya başlanır.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Supraventriküler taşikardi (preeksitasyon sendromları hariç) veya düzeltilebilir nedenlere bağlı olmayan sinüs taşikardisi
KARDOES perioperatif, postoperatif dönemdeki atriyal fibrillasyon ve atriyal flutter'li hastalarda ventrikül hızının süratli kontrolünde ya da ventrikül hızının kısa etkili bir ajanla kısa süreli kontrolünün istendiği diğer durumlarda endikedir.
KARDOES ayrıca hekim tarafından hızlanmış kalp hızının özel bir girişimle düzeltilmesi kararı verilmişse, kompanse olmamış sinüs taşikardisi durumunda da endikedir.
Perioperatif dönemde oluşan taşikardi ve hipertansiyon
KARDOES, trakeal entübasyon ve anestezi indüksiyonu sırasında, cerrahi prosedür devam ederken, anesteziden çıkarken ve postoperatif dönemde görülen taşikardi ve hipertansiyonda hekim tarafından böyle özel bir girişimle düzeltilmesi kararı verilmişse endikedir.
KARDOES 18 yaşına kadar olan çocuklarda kullanım için endike değildir (Bkz. Bölüm 4.2). KARDOES kronik ayarlamalarda kullanılmak için tasarlanmamıştır.
4.2. Pozoloji ve uygulama şekli
Pozoloji / uygulama sıklığı ve süresi
KARDOES PREMIX 2500 mg/250 mL infüzyon çözeltisi, intravenöz uygulama için önerilen, kullanıma hazır 10 mg/mL izo-ozmotik bir çözeltidir.
Supraventriküler taşikardi (preeksitasyon sendromları hariç) veya kompanse olmamış sinüs taşikardisinin tedavisinde dozlama
KARDOES'in supraventriküler taşiaritmilerdeki dozu aşağıdaki akış şemasında gösterildiği gibi ayrı ayrı titre edilmelidir:
Tedavi Başlama ve İdame için Akış Şeması
![]()
1 dakika boyunca 500 mikrogram/kg/dakika yükleme dozu infüzyonunun ardından 4 dakika boyunca 50 mikrogram/kg/dk idame infüzyonu
![]() Yanıt
Yanıt
İnfüzyonun 50 mikrogram/kg/dakika olarak devamı
5 dakika içinde yetersiz cevap
1 dakika boyunca 500 mikrogram/kg/dakika dozunun tekrarlanması
İdame infüzyonunun 4 dakika boyunca 100 mikrogram/kg/dakikaya çıkarılması
![]()
![]() Yanıt
Yanıt
İnfüzyonun 100 mikrogram/kg/dakika
olarak devamı
5 dakika içinde yetersiz cevap
1 dakika boyunca 500 mikrogram/kg/dakika dozunun tekrarlanması
İdame infüzyonunun 4 dakika boyunca 150 mikrogram/kg/dakikaya çıkarılması
![]()
![]() Yanıt
Yanıt
İnfüzyonun 150 mikrogram/kg/dakika
olarak devamı
Yetersiz cevap
1 dakika boyunca 500 mikrogram/kg/dakika dozunun tekrarlanması
İdame infüzyonunun 4 dakika boyunca 200 mikrogram/kg/dakikaya çıkarılması ve bu dozla devamı
Yükleme dozu
Hemodinamik cevaba (kalp atım hızı, kan basıncı) bağlı olarak yükleme dozu ayarı gerekebilir.
İdame dozu
Devamlı ve basamaklı dozlama için etkili idame dozu 50 ila 200 mikrogram/kg/dk'dır. 25 mikrogram/kg/dakika doz kullanılabilir. İstenen hemodinamik cevaba bağlı olarak idame dozu ayarlaması gerekli olabilir. 200 mikrogram/kg/dk'dan yüksek dozların uygulanması, kalp atış hızının düşürülmesinde küçük bir ek etki sağlamakta ve advers reaksiyonların oranını arttırmaktadır.
KARDOES'in farklı hasta ağırlıkları için uygulanacak olan yükleme dozu ve idame dozları, Tablo 1 ve Tablo 2'de sırasıyla gösterilmiştir:
Tablo 1
500 mcg/kg/dakikalık bir BAŞLANGIÇ YÜKLEME DOZU için gerekli olan 10 mg/mL KARDOES hacmi
Hacim (mL) | Hasta ağırlığı (kg) | ||||||||
40 | 50 | 60 | 70 | 80 | 90 | 100 | 110 | 120 | |
2 | 2,5 | 3 | 3,5 | 4 | 4,5 | 5 | 5,5 | 6 | |
Tablo 2
12,5 ve 300 mcg/kg/dakika arasındaki infüzyon hızlarında İDAME DOZLARI sağlamak için gerekli olan 10 mg/mL KARDOES hacmi
Hasta ağırlığı (kg) | İnfüzyon Doz Hızı | ||||||
12,5 mcg/kg/ dk | 25 mcg/kg/ dk | 50 mcg/kg/ dk | 100 mcg/kg/ dk | 150 mcg/kg/ dk | 200 mcg/kg/ dk | 300 mcg/kg/ dk | |
Doz hızına ulaşmak için saatte uygulanacak miktar (mL/saat) | |||||||
40 | 3 mL/saat | 6 mL/saat | 12 mL/saat | 24 mL/saat | 36 mL/saat | 48 mL/saat | 72 mL/saat |
50 | 3,75 mL/saat | 7,5 mL/saat | 15 mL/saat | 30 mL/saat | 45 mL/saat | 60 mL/saat | 90 mL/saat |
60 | 4,5 mL/saat | 9 mL/saat | 18 mL/saat | 36 mL/saat | 54 mL/saat | 72 mL/saat | 108 mL/saat |
70 | 5,25 mL/saat | 10,5 mL/saat | 21 mL/saat | 42 mL/saat | 63 mL/saat | 84 mL/saat | 126 mL/saat |
80 | 6 mL/saat | 12 mL/saat | 24 mL/saat | 48 mL/saat | 72 mL/saat | 96 mL/saat | 144 mL/saat |
90 | 6,75 mL/saat | 13,5 mL/saat | 27 mL/saat | 54 mL/saat | 81 mL/saat | 108 mL/saat | 162 mL/saat |
100 | 7,5 mL/saat | 15 mL/saat | 30 mL/saat | 60 mL/saat | 90 mL/saat | 120 mL/saat | 180 mL/saat |
110 | 8,25 mL/saat | 16,5 mL/saat | 33 mL/saat | 66 mL/saat | 99 mL/saat | 132 mL/saat | 198 mL/saat |
120 | 9 mL/saat | 18 mL/saat | 36 mL/saat | 72 mL/saat | 108 mL/saat | 144 mL/saat | 216 mL/saat |
1 mL KARDOES, 10 mg esmolol'e eşittir.
İstenen kalp atış hızı veya güvenlilik son noktasına (örneğin düşük kan basıncı) yaklaşıldığında, yükleme dozu atlanmalı (uygulanmamalı) ve idame infüzyonundaki artan doz 50 mikrogram/kg/dakika'dan 25 mikrogram/kg/dakika'ya veya daha düşük bir seviyeye düşürülmelidir. Gerekirse, titrasyon adımları arasındaki aralık 5 dakikadan 10 dakikaya arttırılabilir.
Perioperatif taşikardi ve hipertansiyon
Perioperatif taşikardi ve hipertansiyon için dozaj rejimi aşağıdaki gibi değişebilir:
İntraoperatif tedavi için â anestezi sırasında acil kontrol gerektiğinde:
15 ila 30 saniyede verilen 80 mg'lık bir bolus enjeksiyonu takiben 150 mikrogram/kg/dakikalık infüzyon verilir. İnfüzyon hızı 300 mikrogram/kg/dakika'ya kadar gereken şekilde titre edilir. Farklı hasta ağırlıkları için gereken infüzyon hacmi Tablo 2'de verilmiştir.
Anesteziden uyanma üzerine
4 dakika boyunca 500 mikrogram/kg/dakikalık bir infüzyonu takiben 300 mikrogram/kg/dakikalık bir infüzyon verilir. Farklı hasta ağırlıkları için gereken infüzyon hacmi Tablo 2'de verilmiştir.
Titrasyon uygun olduğu zaman ameliyat sonrası durumlar için
Hızlı bir etki başlangıcı oluşturmak için her titrasyon adımından 1 dakika önce 500 mikrogram/kg/dakikalık bir yükleme dozu verilir. 4 dakikada verilen ve istenen terapötik etki oluşunca durulan 50, 100, 150, 200, 250 ve 300 mikrogram/kg/dakikalık titrasyon adımları kullanılır. Farklı hasta ağırlıkları için gereken infüzyon hacmi Tablo 2'de verilmiştir.
Önerilen maksimum doz
Kan basıncının yeterli kontrolü için daha yüksek dozlar (250-300 mcg/kg/dak) gerekebilir. 300 mcg/kg/dak'ın üzerindeki dozajların güvenliliği yeterince çalışılmamıştır.
KARDOES ile dozajlama sırasında dikkat edilecek potansiyel etkiler
Advers reaksiyon durumunda, KARDOES dozu azaltılabilir veya kesilebilir. Farmakolojik advers reaksiyonlar 30 dakika içinde çözülmelidir.
Lokal infüzyon bölgesi reaksiyonu oluşursa, alternatif bir infüzyon bölgesi kullanılmalı ve ekstravazasyonu önlemek için dikkatli olunmalıdır.
KARDOES'in 24 saatten daha uzun bir süre boyunca uygulanması tam olarak değerlendirilmemiştir. 24 saatten daha uzun infüzyon sürelerinde dikkatli kullanılmalıdır.
Ribaund taşikardisi ve ribaund hipertansiyonu riski nedeniyle infüzyonun kademeli olarak sonlandırılması önerilir. Tüm beta blokerlerde olduğu gibi, geri çekilme etkileri göz ardı edilemediğinden, koroner arter hastalığı (KAH) hastalarında KARDOES uygulamasının aniden kesilmesinde dikkatli olunmalıdır.
KARDOES tedavisinden alternatif ilaçlara geçiş
Hastalarda kalp hızında yeterli kontrol ve stabil bir klinik tablo sağlandıktan sonra alternatif antiaritmik ilaçlara geçiş yapılabilir.
Doz azaltma:
KARDOES tedavisinden alternatif ilaçlara geçileceği zaman hekim seçilen alternatif ilacın kullanma talimatlarını dikkatli şekilde incelemeli ve KARDOES dozunu aşağıdaki şekilde azaltmalıdır:
Alternatif ilacın ilk dozundan sonraki 1 saat içerisinde KARDOES infüzyon hızı yarıya (%50) düşürülür.
Alternatif ilacın ikinci dozunun uygulanmasından sonra hastanın yanıtı izlenir ve ilk saatte yeterli kontrol sağlanırsa KARDOES infüzyonu kesilir.
Ek dozaj bilgisi
İstenen terapötik etkiye veya bir güvenlilik uç noktasına (örneğin düşürülmüş kan basıncına) yaklaşıldığında, yükleme dozu atlanmalı ve artımlı infüzyon 12,5 ila 25 mikrogram/kg/dakika'ya düşürülmelidir. Gerekirse, titrasyon adımları arasındaki aralık, 5 dakikadan 10 dakikaya arttırılabilir.
KARDOES, kalp atış hızı veya kan basıncı hızla bir güvenlilik sınırına yaklaştığında veya bu sınırı aştığında kesilmeli ve kalp atış hızı veya kan basıncı kabul edilebilir bir seviyeye döndükten sonra daha düşük bir dozda yükleme infüzyonu olmadan yeniden başlatılmalıdır.
Uygulama şekli:
KARDOES kullanıma hazır bir çözelti olduğundan, seyreltilmeden intravenöz yoldan kullanılır.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek yetmezliği:
Böbrek yetmezliği olan hastalarda KARDOES asit metaboliti böbrekler tarafından değişmemiş formda atıldığından infüzyonla KARDOES uygulandığında dikkatli olunması gerekir. Asit metabolitin atılımı son evre böbrek hastalığı olan kişilerde anlamlı şekilde azalmakta olup eliminasyon yarı ömrü normalin yaklaşık on katına artmış ve plazma düzeyleri ciddi şekilde yükselmiştir.
Karaciğer yetmezliği:
Kırmızı kan hücrelerindeki esterazlar KARDOES metabolizmasında temel bir rol oynadığından karaciğer yetmezliği durumunda özel önlemler gerekli değildir.
Pediyatrik popülasyon:
KARDOES'in 18 yaş altı çocuklarda kullanımdaki etkililiği ya da güvenliliği henüz kanıtlanmamıştır. Bu nedenle, KARDOES pediyatrik popülasyonda kullanım için endike değildir (Bkz. Bölüm 4.1). Mevcut veriler bölüm 5.1 ve 5.2'de tanımlanmaktadır ancak bu verilerden pozoloji hakkında bir öneri sunulamaz.
Geriyatrik popülasyon:
Yaşlılarda tedaviye düşük dozdan başlanarak, uygulama dikkatle yapılmalıdır.
Yaşlılarda özel çalışmalar yürütülmemiştir. Ancak 65 yaş üzeri 252 hastadan elde edilmiş verilerin analizi, oluşan farmakodinamik etkiler açısından 65 yaş altındakilerle herhangi bir farklılık olmadığını göstermektedir.
4.3. Kontrendikasyonlar
Etkin madde
Ağır sinüs bradikardisi (dakikada 50 vurumdan az),
Hasta sinüs sendromu; ağır AV düğümü ileti bozuklukları (pacemaker olmayan); ikinci veya üçüncü derece kalp blokları,
Kardiyojenik şok,
Ciddi hipotansiyon,
Dekompanse kalp yetmezliği,
Eşzamanlı ya da yakın zamanda intravenöz yoldan verapamil kullanımı. KARDOES, verapamil kesilmesinden sonraki 48 saat içinde uygulanmamalıdır (Bkz.Bölüm 4.4),
Tedavi edilmemiş feokromositoma,
Pulmoner hipertansiyon,
Akut astım atağı,
Metabolik asidoz.
4.4. Özel kullanım uyarıları ve önlemleri
KARDOES tedavisi gören tüm hastalarda kan basıncı ve EKG'nin sürekli olarak izlenmesi önerilmektedir.
Hastada hemodinamik bozukluk bulunduğunda veya hasta aşağıdaki parametrelerin birini veya tümünü azaltan diğer ilaçları kullanıyorsa, supraventriküler aritmili hastalarda ventrikül yanıtının kontrolü için esmolol hidroklorür kullanımı sırasında dikkatli olunmalıdır: Periferik direnç, miyokardiyal dolum, miyokardiyal kontraktilite veya miyokardiyumda elektriksel impuls propagasyonu.Esmolol hidroklorür etkilerinin hızlı başlaması ve sonlanmasına karşın bilinç kaybı, kardiyojenik şok, kardiyak arrest gibi şiddetli reaksiyonlar gelişebilir. Esmolol hidroklorürün ventrikül hızını kontrol etmek için kullanıldığının varsayıldığı kompleks klinik koşullarda birkaç ölüm vakası bildirilmiştir.
En sık görülen yan etki dozla ilişkili olan, ancak her dozda da görülebilen hipotansiyondur. Hipotansiyon şiddetli olabilmektedir. Bir hipotansif epizod yaşanması durumunda infüzyon hızı düşürülmeli veya gerekirse infüzyon kesilmelidir. Hipotansiyon genellikle geriye dönüşebilir niteliktedir (KARDOES uygulamasına son verildikten sonraki 30 dakika içinde). Bazı vakalarda kan basıncını normal değerlerine yükseltebilmek için ek girişimlere gerek duyulabilir. Sistolik kan basıncı düşük hastalarda dozun ayarlanması ve idame infüzyonu sırasında özel dikkat gerekir.
Esmolol hidroklorür kullanımı sırasında ağır bradikardi dahil bradikardi ve kardiyak arrest meydana gelmiştir. KARDOES, tedavi öncesinde kalp hızı düşük olanlarda özel bir dikkatle ve ancak olası yararları, riskine ağır basıyorsa kullanılmalıdır.
Önceden ağır sinüs bradikardisi olan hastalarda KARDOES kullanımı kontrendikedir (Bkz.Bölüm 4.3). Nabzın istirahatteyken dakikada 50-55 vurunun altına düştüğü ve hastada bradikardiye ilişkin semptomlar görülürse dozaj azaltılmalı ya da uygulamaya son verilmelidir.
Konjestif kalp yetmezliğinde dolaşım fonksiyonunun desteklenmesi için sempatik aktivite gereklidir. Beta blokajının miyokard depresyonunu arttırarak yetmezliği daha da ağırlaştırma riski bulunmaktadır. Belirli bir süreden uzun sürelerle beta blokörlerle miyokard depresyonunun devam ettirilmesi, bazı vakalarda kalp yetmezliğine yol açabilir.
Kardiyak fonksiyonları bozulmuş hastalarda KARDOES kullanılırken dikkatli olunması gerekir. Kalp yetmezliğinin ilk belirti ve semptomları görülür görülmez KARDOES tedavisine son
verilmelidir. Her ne kadar eliminasyon yarı ömrünün kısa olması nedeniyle, KARDOES'in kesilmesi yeterli olsa da ayrıca spesifik tedavi uygulanması da düşünülebilir (Bkz.Bölüm 4.9). KARDOES dekompanse kalp yetmezliği olan hastalarda kontrendikedir (Bkz.Bölüm 4.3).
Kalpteki ileti süresi üzerindeki negatif etkileri nedeniyle beta blokör ilaçlar birinci derece kalp bloğu veya diğer kalp ileti bozukluğu olan hastalarda ancak dikkatle verilmelidir (Bkz.Bölüm 4.3).
KARDOES feokromositomalı hastalarda ancak alfa-reseptör blokörleriyle ön tedavi görmüş olmak kaydıyla ve dikkatle kullanılmalıdır (Bkz.Bölüm 4.3).
Hipotermiyle uyarılmış hipertansiyonun tedavisinde KARDOES kullanımında dikkatli olunması gerekir.
Genel olarak bronkospastik hastalıkları olanlar beta blokör kullanmamalıdır. Beta-1 reseptörlere nispeten selektif olması ve kullanım sırasında titre edilebilir olması nedeniyle KARDOES bu hastalarda dikkatle kullanılabilir. Ancak beta-1 selektifliği mutlak olmadığından KARDOES, olası etkili en düşük dozu elde etmek için dikkatle titre edilmelidir. Bronkospazm durumunda infüzyon derhal durdurulmalı ve gerektiğinde beta-2 agonist bir preparat uygulanmalıdır.
Hasta zaten bir beta-2-reseptör stimülan ajan kullanıyorsa, bu ajanın dozunun yeniden değerlendirilmesi gerekebilir.
KARDOES hırıltılı solunum ya da astım hikayesi olan hastalarda dikkatli kullanılmalıdır.
KARDOES diyabetik hastalarda ya da şüpheli ya da gerçek hipoglisemisi olanlarda dikkatli uygulanmalıdır. Beta blokörler hipogliseminin taşikardi gibi prodromal semptomlarını maskeleyebilir. Ancak sersemlik hali ve terleme etkilenmeyebilir. Beta blokörlerle antidiyabetik ajanların eşzamanlı kullanımı antidiyabetik ajanların hipoglisemik (kan şekeri düşürücü) etkisinde artışa yol açabilir (Bkz.Bölüm 4.5).
Esmolol hidroklorür kullanımına bağlı olarak infüzyon bölgesinde reaksiyonlar meydana gelmiştir. Bu reaksiyonlar arasında iritasyon ve enflamasyon bulunabildiği gibi özellikle ekstravazasyon ile ilişkili trombofilebit, nekroz ve deride blisterlenme gibi daha ciddi reaksiyonlar da bulunur (Bkz.Bölüm 4.8). Küçük venlerden veya kelebek kateterle yapılacak uygulamalardan kaçınılmalıdır. Lokal bir infüzyon yeri reaksiyonu oluştuğunda, alternatif bir infüzyon bölgesi kullanılmalıdır.
Beta blokörler, karşılanmamış alfa-reseptör kökenli koroner arter vazokonstrüksiyonuna bağlı olarak Prinzmetal anjinası olan hastalarda anjina ataklarının sıklık ve süresini arttırabilir. Bu tür hastalarda selektif olmayan beta blokörler kullanılmamalı; beta-1 selektif olan blokörler ise yalnızca son derece dikkatli şekilde kullanılmalıdır.
KARDOES hipovolemik hastalarda refleks taşikardiyi zayıflatabilir ve dolaşım kollapsı riskini arttırabilir. Bu nedenle bu tür hastalarda KARDOES dikkatli kullanılmalıdır.
Beta blokörler periferik dolaşım bozukluklarının (Raynaud hastalığı veya sendromu, intermittan kladikasyon) bulunduğu hastalarda bozuklukları şiddetlendirebileceği için son derece dikkatli uygulanmalıdır.
KARDOES dahil, özellikle intravenöz olarak uygulanan bazı beta blokörler, serum potasyum düzeylerinde yükselme ve hiperkalemi ile ilişkilendirilmiştir. Bu risk böbrek yetmezliği ve hemodiyaliz tedavisi görme gibi risk faktörlerinin bulunduğu hastalarda artar.
Beta blokörler hem alerjenlere duyarlılığı hem de anafilaktik reaksiyonların şiddetini arttırır. Beta blokör kullanan hastalar anafilaktik ya da anafilaktoid reaksiyonların tedavisinde kullanılan olağan dozlarda epinefrine yanıt vermeyebilir (Bkz.Bölüm 4.5).
Beta blokörlerin psöriyazis ya da psöriyazis benzeri döküntülere yol açabileceği ve mevcut bir psöriyazis hastalığını ağırlaştırabileceği bildirilmiştir. Özgeçmiş ya da soygeçmişinde psöriyazis bulunanlarda beta blokörler ancak tedaviden beklenen fayda ile olası riskleri dikkatle değerlendirildikten sonra kullanılmalıdır.
Propranolol ve metoprolol gibi beta blokörler hipertiroidinin belirli klinik işaretlerini (taşikardi gibi) maskeleyebilir. Tirotoksikoz gelişim riski ya da kuşkusu olan hastalarda beta blokörlerle devam etmekte olan tedavinin aniden kesilmesi tiroid krizini hızlandırabilir ve bu tür hastalar yakından izlenmelidir.
Bu ürün 250 ml'lik bir torbasında 30,45 mmol (700 mg) sodyum içerir. Bu durum kontrollü sodyum diyetinde olan hastalar için göz önünde bulundurulmalıdır.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
KARDOES diğer antihipertansif ajanlar veya bradikardiye neden olabilen diğer ilaçlarla birlikte kullanıldığında daima dikkatli olunmalıdır: KARDOES'in etkileri veya hipotansiyon veya bradikardi yan etkileri şiddetlenebilir.
Verapamil gibi kalsiyum antagonistleri ve daha düşük düzeyde diltiazem kontraktilitede ve AV iletiminde negatif bir etkiye sahiptir. Bu kombinasyon iletim anomalileri olan hastalara uygulanmamalı ve KARDOES verapamil kesildikten sonraki 48 saatte verilmemelidir (Bkz Bölüm 4.3).
Dihidropiridin türevi (örn. nifedipin) kalsiyum antagonistleri hipotansiyon riskini arttırabilir. Kalp yetmezliği için kalsiyum antagonisti ile tedavi gören hastalara beta blokör uygulanması kalp yetmezliğine neden olabilir. KARDOES'in dikkatle titre edilerek uygun hemodinamik monitorizasyonu önerilir.
KARDOES ve Sınıf I anti-aritmik ilaçların (örn; dizopiramid, kinidin) ve amiodaronun eşzamanlı kullanımı atriyal-iletim süresinde güçlendirici etkiye sahip olabilir ve negatif inotropik etkiye neden olabilir.
KARDOES ve insülin veya oral antidiyabetik ilaçların eşzamanlı kullanımı kan şekeri düşürücü etkiyi artırabilir (özellikle selektif olmayan beta-blokörler). Beta- adrenerjik blokajı hipoglisemi belirtilerinin (taşikardi) gözlenmesini engelleyebilir ancak baş dönmesi/sersemlik ve terleme gibi diğer belirtiler maskelenmeyebilir.
Anestezi ilaçları: Hastaların hacim durumunun belirsiz olduğu veya eşzamanlı antihipertansif ilaçların kullanıldığı durumlarda refleks taşikardide azalma veya hipotansiyon riskinde artış görülebilir. Beta-blokaja devam edilmesi indüksiyon ve entübasyon sırasında aritmi riskini
azaltır. Hastaya KARDOES'e ek olarak bir beta-blokör ajan verilirken anestezist bilgilendirilmelidir. İnhalasyon anestezi ajanlarının hipotansif etkileri KARDOES varlığında artabilir. Her bir ajanın dozu istenen hemodinamik parametrelerin korunması için değiştirilebilir. KARDOES ile gangliyon bloke edici ilaçların kombinasyonu hipotansif etkiyi arttırabilir.
Steroid olmayan anti-enflamatuvar ilaçlar (NSAİİ) ile birlikte kullanıldıklarında beta blokörlerin hipotansif etkileri azalır.
Beta-blokörlerle eşzamanlı olarak floktafenin veya amisulprid kullanılırken özellikle dikkatli olunmalıdır.
Trisiklik antidepresanların (imipramin ve amitriptilin gibi), barbitüratların ya da fenotiyazinler (klorpromazin gibi) yanında diğer antipsikotik ajanların (klozapin gibi) birlikte uygulanışı kan basıncını azaltıcı etkiyi arttırabilir. Beklenmeyen bir hipotansif durumdan kaçınmak için birlikte kullanımda KARDOES dozu azaltılmalıdır.
Beta-blokörler kullanılırken anafilaktik reaksiyon riski olan hastalarda alerjen maruziyetine (kazara, diagnostik veya terapötik) reaksiyon gözlenebilir. Beta blokör kullanan hastalar, anafilaktik reaksiyonların tedavisinde kullanılan mutad epinefrin dozlarına yanıt vermeyebilir (Bkz. Bölüm 4.4).
KARDOES'in etkileri eşzamanlı uygulandığında beta-adrenerjik agonist aktiviteye sahip sempatomimetik ilaçlara bağlı olarak azalabilir. Her bir ajanın dozunun hasta yanıtına göre ayarlanması veya alternatif terapötik ajanların kullanımının düşünülmesi gerekebilir.
Katekolamin boşalmasına yol açan ilaçlar (örn; rezerpin) beta-blokör ilaçlarla birlikte verildiğinde aditif bir etki gösterebilirler. KARDOES ile eşzamanlı olarak katekolamin boşalmasına yol açan ilaç tedavisi alan hastalar vertigo, senkop veya postrual hipotansiyon ile sonuçlanabilen hipotansiyon ve önemli bradikardi belirtileri açısından yakından izlenmelidir.
Beta blokörlerin, moksonidin veya alfa-2-agonistleriyle (klonidin gibi) birarada kullanımı çekilmeye bağlı rebound hipertansiyon riskini arttırır. Klonidin veya moksonidin bir beta blokörle birlikte kullanılacaksa ve daha sonra her iki ilaç da kesilecekse, ilk olarak beta blokör, klonidin veya moksonidin birkaç gün sonra kesilmelidir.
Beta blokörlerin ergot türevleriyle bir arada kullanımı ciddi periferik vazokonstrüksiyon ve hipertansiyonla sonuçlanabilir.
Esmolol hidroklorür ile varfarin arasında bir etkileşim olup olmadığını belirlemek için yapılan bir çalışmadaki veriler, esmolol hidroklorür ve varfarinin birlikte uygulanmasının, varfarinin plazma düzeylerini değiştirmediğini göstermiştir. Buna rağmen varfarin ile birlikte uygulanan esmolol hidroklorürür konsantrasyonları daha yüksek olarak bulunmuştur.
Esmolol hidroklorür ve digoksin sağlıklı gönüllülerde intravenöz yoldan birlikte uygulandığında, bazı zaman noktalarında digoksinin kandaki düzeylerinde %10-20'lik bir yükselme olduğu bildirilmiştir. Dijital glikozitleriyle esmolol hidroklorür kombinasyonu AV ileti süresini uzatabilir. Digoksin, esmolol hidroklorürün farmakokinetik özelliklerini etkilememiştir.
İntravenöz morfin ve esmolol hidroklorür sağlıklı gönüllülere eşzamanlı olarak uygulandığında morfinin kan düzeylerinde herhangi bir değişiklik olmadığı görülmüştür. Morfin varlığında
esmolol hidroklorürün kararlı durum kan düzeylerinin %46 oranında arttığı ancak diğer farmakokinetik parametrelerden hiçbirinin değişmediği saptanmıştır.
Esmolol hidroklorürün suksametonyum klorür ve mivakuryum ile uyarılan nöromüsküler blokajın süresi üzerine etkisi cerrahi girişimde bulunulan hastalarda incelenmiştir. Esmolol hidroklorür, suksametonyum klorür ile indüklenen nöromüsküler blokajın başlamasını etkilememektedir, ancak nöromüsküler blokajın süresi 5 dakikadan 8 dakikaya çıkmıştır. Esmolol hidroklorür, mivakuryumun klinik süresini (%18,6) ve geri kazanım indeksini (%6,7) kısmen uzatmıştır.
Varfarin, digoksin, morfin, suksametonyum klorür veya mivakuryum ile yapılan çalışmalarda gözlenen etkileşimler klinik açıdan çok önemli olmamakla birlikte KARDOES ile eşzamanlı olarak varfarin, digoksin, morfin, suksametonyum klorür veya mivakuryum uygulanan hastalarda titrasyon dikkatli yapılmalıdır.
Özel popülasyonlara ilişkin ek bilgiler:
Bilgi bulunmamaktadır.
Pediyatrik popülasyon:
Bilgi bulunmamaktadır.
4.6. Gebelik ve laktasyon
:Gebelik Kategorisi: C / D (2. ve 3. trimester)
Çocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeli olan kadınlar tedavi süresince etkili doğum kontrolü uygulamak zorundadırlar.
Gebelik dönemi
Hayvanlar üzerinde yapılan çalışmalar, gebelik /ve-veya/ embriyonal/fetal gelişim /ve-veya/ doğum /ve-veya/ doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir. Hayvanlar üzerinde esmolol hidroklorürle yapılan çalışmalarda üreme toksisitesi görülmüştür (Bkz. Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.
Esmolol hidroklorür gebelik döneminde kullanılmamalıdır.
Farmakolojik etkileri nedeniyle gebeliğin geç döneminde fetus ve yenidoğan üzerindeki yan etkileri (özellikle hipoglisemi, hipotansiyon ve bradikardi) dikkate alınmalıdır.
Gebelikte KARDOES tedavisi gerekli olursa, uteroplasental kan akımı ve fötal büyüme izlenmelidir. Yenidoğan bebeğin yakından izlenmesi gerekir.
Laktasyon dönemi
Esmolol hidroklorür emzirme döneminde kullanılmamalıdır.
Emziren kadınlarda esmolol hidroklorürün anne sütüne geçip geçmediği bilinmemektedir. Yenidoğan bebeklere potansiyel bir riski gözardı edilemez.
Üreme yeteneği / Fertilite
Esmololün insanlarda üreme yeteneği/fertilite üzerindeki etkisini araştıran bir çalışma bulunmamaktadır.
4.7. Araç ve makine kullanımı üzerindeki etkiler
Araç ve makine kullanımı sırasında KARDOES'in kullanımı mümkün olmadığından bu konudaki etkisi bilinmemektedir.
4.8. İstenmeyen etkiler
İstenmeyen etkilerin görülmesi durumunda KARDOES'in dozu azaltılabilir ya da uygulamaya son verilebilir.
Görülen advers etkilerin çoğu hafif ve geçici nitelikte olarak bildirilmiştir. En önemlisi hipotansiyondur.
Advers etkilerin görülme sıklığı, aşağıdaki kriterler kullanılarak değerlendirilmiştir:
Çok yaygın (≥1/10)
Yaygın (≥1/100 ila <1/10)
Yaygın olmayan (≥1/1.000 ila <1/100) Seyrek (≥1/10.000 ila <1/1 .000)
Çok seyrek <1/10.000)
Bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Metabolizma ve beslenme hastalıkları
Yaygın: Anoreksi.
Bilinmiyor: Hiperkalemi, metabolik asidoz.
Psikiyatrik hastalıklar
Yaygın: Depresyon, anksiyete. Yaygın olmayan: Anormal düşünce.
Sinir sistemi hastalıkları
Yaygın: | Baş dönmesi/sersemlik hali, uykuya meyil, başağrısı, parestezi, dikka bozukluğu, konfüzyonel durum, ajitasyon. |
Yaygın olmayan:
Göz hastalıkları | Senkop, konvülsiyon, konuşma bozukluğu. |
Yaygın olmayan: | Görmede bozulma. |
Kardiyak hastalıklar
Yaygın olmayan: Bradikardi, atriyoventriküler blok, pulmoner arteriyel basınçta yükselme, kalp yetmezliği, ventriküler ekstrasistoller, nodal ritim, anjina pektoris.
Çok seyrek: | Sinüs durması, asistol. |
Bilinmiyor: | Akselere idiyoventriküler ritim, koroner arteriyospazm, kardiyak arrest. |
Vasküler hastalıklar
Çok yaygın: Hipotansiyon.
Yaygın olmayan: Periferik iskemi, solukluk, yüz ve boyun bölgesinde kızarma. Çok seyrek: Trombofilebit
Solunum, göğüs bozuklukları ve mediastinal hastalıklar
Yaygın olmayan: Dispne, pulmoner ödem, bronkospazm, hırıltılı solunum, nazal konjesyon, akciğer seslerinde ronkus ve raller.
Gastrointestinal hastalıklar
Yaygın: Bulantı, kusma.
Yaygın olmayan: Disguzi, dispepsi, kabızlık, ağızda kuruma, karında ağrı.
Deri ve deri altı doku hastalıkları
Çok yaygın: | Diaforez. |
Yaygın olmayan: | Ciltte renk kaybı, eritem. |
Çok seyrek: | Deri nekrozu (ekstravazasyona bağlı). |
Bilinmiyor: | Psoriyazis, anjiyoödem, ürtiker. |
Kas-iskelet bozuklukları, bağ doku ve iskelet hastalıkları
Yaygın olmayan: Kas-iskelet ağrısı.
Böbrek ve idrar yolu hastalıkları
Yaygın olmayan: Üriner retansiyon.
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar:
Yaygın: | Asteni, halsizlik, enjeksiyon yeri reaksiyonu, infüzyon bölgesi reaksiyonu, infüzyon bölgesi inflamasyonu, infüzyon bölgesi endürasyonu. |
Yaygın olmayan: | Titremeler, ateş yükselmesi, ödem, ağrı, infüzyon bölgesinde yanma, infüzyon bölgesinde ekimoz. |
Bilinmiyor: | İnfüzyon bölgesinde filebit, infüzyon bölgesinde veziküller, infüzyon bölgesinde blisterlenme. |
Baş dönmesi/sersemlik hali ve diyaforez semptomatik hipotansiyonla birlikte görülmüştür.
Midskapular ağrı ve kostokondrit dahil.
4.9. Doz aşımı ve tedavisi
Konsantre esmolol hidroklorür solüsyonları ile kazara büyük doz aşımı vakaları meydana gelmiştir. Bu doz aşımlarının bazıları ölüme yol açarken, diğerleri kalıcı işlev kaybına neden olmuştur. Preparatın 6,25 mg â 2,5 g arasındaki yükleme dozları (12,5 - 50 mg/kg) ölümle sonuçlanmıştır.
Doz aşımının semptomları
Doz aşımı durumunda aşağıdaki belirtiler oluşabilir:
Şiddetli hipotansiyon, sinüs bradikardisi, atriyoventriküler blok, kalp yetmezliği, kardiyojenik şok, kardiyak arrest, bronkospazm, solunum yetmezliği, komaya kadar ilerleyebilen bilinç kaybı, konvülsiyonlar, bulantı, kusma, hipoglisemi ve hiperkalemi.
Doz aşımında tedavi
Kısa eliminasyon yarı ömrü nedeniyle (yaklaşık 9 dakika) toksisite tedavisinde ilk basamak KARDOES infüzyonunun durdurulmasıdır. Doz aşımı sonrasında semptomların kaybolması için gereken süre uygulanan KARDOES miktarına bağlı olacaktır. Bu süre KARDOES'in terapötik doz düzeyinde ilaç kesildikten sonra 30 dakikadan uzun sürebilir. Suni solunum gerekebilir.
Daha sonra gözlenen klinik etkilere göre aşağıdaki önlemler düşünülebilir:
Bradikardi: Atropin ya da diğer bir antikolinerjik ilaç intravenöz yoldan uygulanır. Bradikardinin yeterince tedavi edilemediği durumlarda pacemaker gerekli olabilir.
Bronkospazm: Nebülize beta-2-sempatomimetikler uygulanmalıdır. Bu yeterli olmazsa beta- 2-sempatomimetikler ya da aminofilinin intravenöz yoldan uygulanması düşünülmelidir.
Semptomatik hipotansiyon: İntravenöz yoldan sıvılar ve/veya pressör ajanlar verilmelidir.
Kardiyovasküler depresyon veya kardiyak şok: Diüretik veya sempatomimetikler uygulanabilir. Uygulanacak sempatomimetiklerin (semptoma göre dobutamin, dopamin, noradrenalin, isoprenalin) dozu terapötik etkiye bağlıdır.
Daha ileri tedavi gerektiğinde, klinik duruma ve tedaviyi yürüten hekimin kararına göre aşağıdaki ilaçlar intravenöz yoldan verilebilir.
Atropin,
İnotropik ajanlar,
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik Grubu: Selektif beta blokör ilaçlar ATC kodu: C07AB09
KARDOES bir beta selektif (kardiyoselektif) adrenerjik reseptör blokaj ajanıdır. Terapötik dozlarda anlamlı bir intrensek sempatomimetik aktivite (ISA) ya da membran stabilizan etkinliği yoktur.
KARDOES'in etkin maddesi olan esmolol hidroklorür kimyasal olarak beta blokörlerin fenoksi propanolamin sınıfındandır.
5. FARMAKOLOJİK ÖZELLİKLER
Uygun yükleme dozu kullanıldığında, kandaki kararlı durum düzeylerine 5 dakikada ulaşılır. Ancak terapötik etkiye stabil plazma konsantrasyonundan daha kısa sürede erişilir. Daha sonra istenen farmakolojik etkinin elde edilmesi için infüzyon oranı ayarlanabilir.
KARDOES beta blokörlerin bilinen hemodinamik ve elektrofizyolojik etkilerine sahiptir:
İstirahat halinde ve egzersiz sırasında kalp hızında azalma,
Izoprenalin azalması sonucunda kalp hızında artış,
Sinoatriyal (SA) düğümün recovery süresinde uzama,
Atriyoventriküler (AV) iletide gecikme,
Atriyoventriküler (AV) aralığının normal sinüs ritmi ile ve His-Purkinje dokusunda gecikme olmadan atrium stimülasyonu sırasında uzama,
PQ süresinde uzama, evre II atriyoventriküler blok indüksiyonu,
Atriyum ve ventriküllerin fonksiyonel refraktör periyodunda uzama,
Azalmış ejeksiyon fraksiyonu ile negatif inotropik etki,
Kan basıncında azalma.
Pediyatrik popülasyon
Supraventriküler taşikardisi olan yaşları 2 ile 16 arasındaki 26 pediyatrik hastada kontrollü bir farmakokinetik/etkinlik çalışması yürütülmüştür. 1000 mikrogram/kg'lık bir esmolol hidroklorür yükleme dozu uygulandıktan sonra devamlı infüzyonla dakikada 300 mikrogram/kg'lık dozla idame tedavisine geçilmiştir. Esmolol başlandıktan sonraki 5 dakikada hastaların %65'inde supraventriküler taşikardi sonlanmıştır.
Randomize olan ancak kontrolsüz bir doz karşılaştırması çalışmasında, yaşları 1 haftalık ile 7 yaş arasındaki 116 pediyatrik hastanın aort koarktasyonu düzeltildikten sonra gelişen hipertansiyonda etkinlik araştırılmıştır. 125 mikrogram/kg'lık, 250 mikrogram/kg'lık veya 500 mikrogram/kg'lık esmolol hidroklorür başlangıç dozu uygulanan hastalarda daha sonra devamlı infüzyonla sırasıyla dakikada 125 mikrogram/kg, 250 mikrogram/kg veya 500 mikrogram/kg'lık dozlarla idame tedavisine geçilmiştir. Her üç dozaj grubunda hipotansif etki açısından anlamlı bir fark görülmemiştir. Hastaların toplamda %54'ünde yeterli kan basıncı kontrolü sağlanması için esmolol hidroklorür dışında başka bir ilaç kullanılması gerekmiştir. Değişik doz gruplarında bu açıdan bir farklılık görülmemiştir.
5.2. Farmakokinetik özellikler
Emilim:
Esmolol kinetiği sağlıklı yetişkinlerde doğrusaldır, plazma konsantrasyonu doza orantılıdır. Eğer bir yükleme dozu kullanılmazsa, sabit durumdaki kan konsantrasyonlarına, dakikada 50 ila 300 mikrogram/kg dozlarıyla 30 dakika içinde ulaşılır.
Dağılım:
Esmolol hidroklorürün dağılım yarılanma süresi yaklaşık 2 dakika gibi çok kısadır. Dağılım hacmi 3,4 L/kg'dır.
Esmolol hidroklorürün insan plazma proteinlerine %55 oranında bağlandığı, asit metabolitinin ise sadece %10 oranında bağlandığı gösterilmiştir.
Biyotransformasyon:
Esmolol hidroklorürün metabolizması dozu 50 ile 300 mikrogram/kg/dakika olduğunda dozdan bağımsızdır.
Esmolol hidroklorür esterazlar tarafından bir asit metaboliti (ASL-8123) ve metanole metabolize olur. Bu metabolizasyon, ester bağlarının eritrositlerin sitozollerindeki esterazlar tarafından hidrolizi yoluyla gerçekleşir.
Eliminasyon:
İntravenöz uygulama sonucu eliminasyon yarı ömrü yaklaşık 9 dakikadır.
Toplam klerensi 285 ml/kg/dakikadır; toplam klerens karaciğer veya diğer organların dolaşımından bağımsızdır. Esmolol hidroklorür böbreklerden kısmen değişmeden (uygulanan miktarın %2'sinden azı) kısmen de zayıf bir beta blokör etkinliğe sahip asit metaboliti olarak (uygulanan miktarın %0,1'inden azı) atılır. Asit metabolit idrarla atılır ve eliminasyon yarı ömrü yaklaşık 3,7 saattir.
Hastalardaki karekteristik özellikler
Pediyatrik popülasyon:
Yaşları 3 ile 16 arasında olan 22 pediyatrik hastada bir farmakokinetik çalışma gerçekleştirilmiştir. 1000 mikrogram/kg'lık bir KARDOES yükleme dozu uygulandıktan sonra devamlı infüzyonla dakikada 300 mikrogram/kg'lık dozla idame tedavisi uygulanmıştır. Çalışmada çocuklardaki KARDOES kinetiğinin erişkinlerdekinden farklı olmadığına işaret edecek şekilde ortalama toplam vücut klerensi 119 ml/kg/dakika, ortalama dağılım hacmi 283 ml/kg ve ortalama terminal eliminasyon yarılanma ömrü 6,9 dakika olarak gözlenmiştir. Ancak, çocuklarda bireysel değişkenliğin fazla olduğu gözlenmiştir.
5.3. Klinik öncesi güvenlilik verileri
Hayvan çalışmalarında teratojenik etki görülmemiştir. Tavşanlarda olasılıkla esmolol hidroklorürün neden olduğu embriyotoksik bir etki (fötal rezorpsiyonda artma) gözlenmiştir. Bu etki terapötik dozların en az 10 katı yüksek dozlarda gözlenmiştir.
KARDOES'in fertilite üzerindeki etkileri ile perinatal ve postnatal etkilerini araştıran bir çalışma gerçekleştirilmemiştir. Esmolol hidroklorürün birkaç in vitro ve in vivo test sistemlerinde mutajenik olmadığı bulunmuştur. Esmolol hidroklorürün güvenilirliği uzun süreli çalışmalarla incelenmemiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Sodyum asetat trihidrat Glasiyel asetik asit
Sodyum klorür
Sodyum hidroksit ve/veya hidroklorik asit (pH ayarlanması için) Enjeksiyonluk su
6.2. Geçimsizlikler
Geçimlilik çalışmaları bulunmadığından bu ilaç diğer ilaçlarla veya sodyum bikarbonat çözeltisi ile karıştırılmamalıdır.
Alkali maddelerle temasından kaçınınız.
6.3. Raf ömrü
24 ay.
Açılan ürün 2-8 C arasında saklandığında 24 saat süreyle fizikokimyasal olarak stabildir.
Mikrobiyolojik açıdan ürün torbası açıldıktan sonra hemen kullanılmalıdır. Hemen kullanılamadığı durumlarda, kullanılmaya başlamadan önceki saklama süre ve koşulları kullanıcının sorumluluğundadır. Bu süre 2-8C arasında torbanın kontrollü ve valide edilmiş aseptik koşullarda açılmadığı durumlarda normalde 24 saatten uzun olamaz.
6.4. Saklamaya yönelik özel tedbirler
25 C'nin altındaki oda sıcaklığında ambalajında saklanmalıdır. Buzdolabında saklanmamalı ya da dondurulmamalıdır.
Çözeltinin saklama koşulları için bölüm 6.3'e bakınız.
6.5. Ambalajın niteliği ve içeriği
PE dış torba içinde çift çıkışlı 250 ml'lik bir adet PVC-free torba.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâne ve âAmbalaj Atıklarının Kontrolü Yönetmeliğiâne uygun olarak imha edilmelidir.
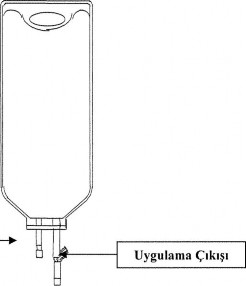
TORBA KULLANIM TALİMATI
KARDOES PREMIX 2500 mg/250 ml infüzyon için kullanıma hazır çözelti, 250 ml'lik PVC- free torbalarda (biri torbaya ilaç uygulama için, diğeri torbadaki ilacın hastaya verilmesi için olan çift çıkışlı torba) sunulmaktadır.
KARDOES PREMIX 2500 mg/250 ml infüzyon için kullanıma hazır çözeltinin torbasındaki ilaç uygulama ucu yalnızca torbadan ilk bolus uygulanacak ilacın çekilmesi için kullanılmalıdır; tekrarlanan bolus uygulaması için değildir. Bolus dozunu çekerken aseptik teknik kullanılmalıdır. KARDOES PREMIX 2500 mg/250 ml infüzyon için kullanıma hazır çözeltiye hiçbir ilave ilaç eklenmemelidir.
Her torba tek hastada kullanım içindir. İlaç uygulama çıkışının mühürü kırıldıktan ve torbadan ilacın çekilmesinden sonra torbanın 24 saat içinde kullanılması gerekir. Çözeltinin kullanılmayan bölümü ve torbası yerel uygulamalar doğrultusunda imha edilmelidir. Kısmen kullanılmış torbaları yeniden kullanmayınız.
Şekil I. Çift-çıkışlı torba
İlaç Çıkışı (Sadece başlangıçtaki bolus uygulama için ) |
|
DİKKAT
Plastik torbaları seri bağlamalar için kullanmayınız. Bu tip kullanım ikinci kaptaki sıvının uygulanması tamamlanmadan önce birinci kaptan rezidüel havanın çekilmesine bağlı emboliye neden olabilir.
AÇMAK İÇİN
Kullanımdan hemen öncesine kadar dış ambalajından (dış torba) çıkarılmamalıdır. Dış torba daha önceden açılmışsa ya da hasar görmüşse kullanılmamalıdır. Dış torba nemi önleme amacını taşır. İç torba çözeltinin sterilitesini korur.
Dış torba çentikli yerinden açılarak premix torba çıkarılır. Bu aşamada plastik torba üzerinde görülebilen opasiteler, sterilizasyon prosesi sırasındaki nem absorbsiyonuna bağlıdır. Bu normaldir ve çözeltinin kalitesini veya güvenilirliğini etkilemez. Opaklık giderek azalacaktır.
İç torba sıkıştırılarak küçük sızıntılar olup olmadığı 1 dakika boyunca kontrol edilir. Sızıntı varsa sterilizasyon etkilenmiş olacağından çözelti atılmalıdır. Uygulamadan önce partiküler madde ve renk değişikliği için solüsyon görsel olarak incelenir. Yalnızca berrak ve renksiz veya açık sarı renkli çözeltiler kullanılmalıdır.
KARDOES PREMIX 2500 mg/250 ml'e ekstra hiçbir madde eklenmemelidir.
İNTRAVENÖZ UYGULAMA İÇİN HAZIRLIKLAR (aseptik teknik kullanılmalıdır)
Premix torba, asma yerinden bir askıya asılır.
 Dış Gebelik
Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep
olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan
bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur.
Dış Gebelik
Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep
olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan
bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur. |
 Diyabet Hastalığı
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır.
Diyabet Hastalığı
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| ESMOBLOC | 8699606524861 | 2,617.43TL |
| KARDOES | 8699614690099 | |
| MULTIFLEX | 8680400770288 | |
| TURKTIPSAN | 8697637692023 | 1,876.52TL |
| Diğer Eşdeğer İlaçlar |
 |
Mesane Kanseri Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve hücre içindeki karsinom olarak nitelendirilir. |
 |
Omurilik zedelenmeleri Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir. |
 |
Yüksek Tansiyon Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon atardamarlarınızdaki kanın basıncıdır. |
İLAÇ GENEL BİLGİLERİ
Tüm-Ekip İlaç A.Ş.
| Geri Ödeme Kodu | A17364 |
| Satış Fiyatı | TL |
| Önceki Satış Fiyatı | |
| Original / Jenerik | Jenerik İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699614690099 |
| Etkin Madde | Esmolol Hcl |
| ATC Kodu | C07AB09 |
| Birim Miktar | 10 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 250 |
| Kalp Damar Sistemi > Beta Bloke Edici Ajanlar > Esmolol |
| Yerli ve Beşeri bir ilaçdır. |